Dokument_1
Werbung

Synthese neuer P,N-Binaphthylliganden
für die asymmetrische Katalyse
Dissertation zur Erlangung
des Doktorgrades der Naturwissenschaften (Dr. rer. nat.)
genehmigt vom Fachbereich Chemie
der Technischen Universität Kaiserslautern
(D 386)
vorgelegt von
Claudia May
Betreuer der Arbeit: Prof. Dr. W. R. Thiel
Tag der wissenschaftlichen Aussprache: 05.02.2009
Kaiserslautern 2009
Vom
Fachbereich
Chemie
der
Technischen
Universität
Kaiserslautern
05.02.2009 als Dissertation angenommen.
Dekan:
Prof. Dr. W. E. Trommer
Vorsitzender der Prüfungskommission:
Prof. Dr. S. Kubik
1. Berichterstatter:
Prof. Dr. W. R. Thiel
2. Berichterstatter:
Prof. Dr. H. Sitzmann
am
Die vorliegende Arbeit wurde im Fachbereich Chemie der Technischen Universität
Kaiserslautern im Arbeitskreis von Prof. Dr. W. R. Thiel in der Zeit von Oktober 2004
bis Mai 2008 angefertigt.
Für Mario
Abkürzungsverzeichnis
[α]
spezifischer Drehwert
Ac
Acetyl (-C(O)CH3)
AcOH
Essigsäure
BINAM
2,2’-Diamino-1,1’-binaphthyl
BINAP
2,2’-Bis(diphenylphosphanyl)-1,1’-binaphthyl
BINOL
1,1’-Binaphth-2,2’-ol
Bn
Benzyl
t
Bu
tert-Butyl
t
BuOH
tert-Butanol
COD
1,5-Cyclooctadien
dba
Dibenzylidenaceton
dppf
1,1’-Bis(diphenylphosphanyl)ferrocen
dppp
1,3-Bisdiphenylphosphinopropan
DMFDMA
N,N-Dimethylformamiddimethylacetal
ee
Enantiomerenüberschuss (enantiomeric excess)
Et
Ethyl
Et2O
Diethylether
EtOH
Ethanol
EtOAc
Ethylacetat
h
Stunden
IR
Infrarot
MALDI
Matrix-Assisted Laser Desorption / Ionisation
MAP
N,N-Dimethylaminophosphanligand
Me
Methyl
MeCN
Acetonitril
min
Minuten
MOP
Monodentater Phosphanligand
m/z
Masse/Ladungs-Verhältnis
NBCC
(8S, 9R)-(-)-N-Benzylcinchonidiniumchlorid
NMR
Nuclear Magnetic Resonance
ÖPV
Ölpumpenvakuum (10-3 mbar)
PPFNMe
N,N-Dimethyl-1-[2-(diphenylphosphino)ferrocenyl]
ethylamin
PPFOMe
1-[2-(Diphenylphosphino)ferrocenyl]ethylmethylether
Ph
Phenyl
i
Pr
iso-Propyl
Pz
Pyrazol
RT
Raumtemperatur
Tf
Triflatgruppe (CF3SO2-)
THF
Tetrahydrofuran
TOF
Flugzeit (time of flight)
Tz
Triazol
IR-Spektroskopie
ν~
Wellenzahl in cm-1
br
breit
m
mittel
s
stark
w
schwach
T
Transmission in %
NMR-Spektroskopie
δ
chemische Verschiebung in ppm
br, s
breites Singulett
d
Dublett
dd
Dublett von Dubletts
dt
Dublett von Tripletts
Hz
Hertz
J
Koppungskonstante in Hz
m
Multiplett
ppm
parts per million
t
Triplett
Inhaltsverzeichnis
Inhaltsverzeichnis
1
Einleitung .......................................................................................1
1.1
Asymmetrische Katalyse................................................................................ 1
1.2
1,1’-Binaphthylsysteme als Liganden in der asymmetrischen Katalyse ......... 2
1.3
Phosphinooxazolinbinaphthylliganden ........................................................... 5
2
Motivation und Zielsetzung...........................................................8
3
Ergebnisse und Diskussion ........................................................ 11
3.1
Aufbau von Biarylen..................................................................................... 11
3.1.1 Versuche zur Synthese des Binaphthylgerüsts mittels Suzuki-Kupplung 13
3.1.2 Synthese des Binaphthylgerüsts mittels oxidativer Kupplung.................. 16
3.2
3.1.2.1
Synthese von 1,1’-Binaphth-2,2’-ol (BINOL, 6) als Grundbaustein ... 16
3.1.2.2
Synthese von 1,1’-Binaphthyl-2,2’-bistrifluormethansulfonat (8)........ 19
Synthese eines Pyrazolylbinaphthylliganden 20 .......................................... 21
3.2.1 Synthese der Ligandvorstufe 12 durch Umsetzung des Binaphthylnitrils
11 mit Methyllithium ................................................................................. 21
3.2.2 Synthese der Ligandvorstufe 12 durch Umsetzung des Binaphthylnitrils
11 mit Grignard-Reagenzien.................................................................... 29
3.2.3 Synthese der Ligandvorstufe 12 durch Umsetzung des Binaphthylsäurechlorids 17 mit Lithiumdimethylcuprat...................................................... 33
3.2.4 Weitere Versuche zur Synthese des Acetylbinaphthyls 12 bzw. analoger
Strukturen für den Aufbau des Pyrazolringes .......................................... 46
3.2.5 Synthese des chiralen Pyrazolylphosphanylbinaphthylliganden S-20 ..... 49
3.3
Synthese eines Triazolylbinaphthylliganden 27 ........................................... 56
3.3.1 Synthese von 3-Naphth-2-yl-1H(1,2,4)triazol (23) ................................... 56
3.3.2 Synthese von 2-Carbamoyl-2’-diphenylphosphanoyl-1,1’-binaphthyl (24)
als zentrale Ligandvorstufe...................................................................... 61
3.3.3 Synthese des Triazolylphosphanylbinaphthylliganden 27........................ 66
3.4
Palladium(II)-Komplexe................................................................................ 75
3.4.1 Komplexierungsversuch von S-20 mit PdCl2(PhCN)2 .............................. 76
3.4.2 Komplexierung von 27 mit PdCl2(PhCN)2 ................................................ 77
3.5
Versuche zur Synthese weiterer P,N-Binaphthyle ....................................... 85
Inhaltsverzeichnis
3.5.1 Palladiumkatalysierte Aminierungsversuche von Monotriflat 10 .............. 85
3.5.2 Umsetzungen des Amids 24 mit 1,2-Phenylendiamin.............................. 87
4
Zusammenfassung und Ausblick ............................................... 91
4.1
Zusammenfassung ...................................................................................... 91
4.2
Ausblick ....................................................................................................... 95
5
Experimenteller Teil..................................................................... 96
5.1
Allgemeines zur Durchführung..................................................................... 96
5.2
Verwendete Geräte...................................................................................... 96
5.3
Synthesevorschriften ................................................................................... 98
5.3.1 Synthese wichtiger Edukte ...................................................................... 98
5.3.1.1
Synthese von Diphenylphosphanoxid (9) .......................................... 98
5.3.1.2
Synthese und Rückgewinnung von N-Benzylcinchonidiniumchlorid
(NBCC, 7).......................................................................................... 99
5.3.1.3
Synthese und Racematspaltung von 1,1’-Binaphth-2,2’-ol (6)......... 100
5.3.1.4
Synthese von 1,1’-Binaphthyl-2,2’-bistrifluormethansulfonat (8)...... 102
5.3.2 Synthese des Pyrazolliganden S-20 ...................................................... 104
5.3.2.1
Synthese von 2-Carbomethoxy-2’-trifluormethansulfonoyl-1,1’binaphthyl (14)................................................................................. 104
5.3.2.2
Synthese von 2-Carbomethoxy-2’-diphenylphosphanoyl-1,1’binaphthyl (15)................................................................................. 105
5.3.2.3
Synthese von 2’-Diphenylphosphanoyl-1,1’-binaphthyl-2-carbonsäure (16) ........................................................................................ 106
5.3.2.4
Synthese von (S)-2’-Diphenylphosphanoyl-1,1’-binaphthyl-2carbonsäurechlorid (S-17)............................................................... 108
5.3.2.5
Synthese von (S)-2-Acetyl-2’-diphenylphosphanoyl-1,1’-binaphthyl (S-12)........................................................................................ 109
5.3.2.6
Synthese von (S)-2-(N,N-Dimethylaminoprop-2-enon-1-yl)-2’diphenylphosphanoyl-1,1’-binaphthyl (S-18) ................................... 110
5.3.2.7
Synthese von (S)-2’-Diphenylphosphanoyl-2-(pyrazol-3-yl)-1,1’binaphthyl (S-19) ............................................................................. 111
5.3.2.8
Synthese von (S)-2’-Diphenylphosphanyl-2-(pyrazol-3-yl)-1,1’binaphthyl (S-20) ............................................................................. 112
Inhaltsverzeichnis
5.3.3 Synthese der Triazolliganden 23 und 27 ............................................... 114
5.3.3.1
Synthese von 2-Naphthoamid (21).................................................. 114
5.3.3.2
Synthese von N’-Naphthoyl-N,N-dimethylformamidin (22) .............. 114
5.3.3.3
Synthese von 3-Naphth-2-yl-1H(1,2,4)triazol (23) ........................... 115
5.3.3.4
Synthese von 2’-Diphenylphosphanoyl-2-trifluormethansulfonoyl1,1’-binaphthyl (10).......................................................................... 117
5.3.3.5
Synthese von 2-Cyano-2’-diphenylphosphanoyl-1,1’binaphthyl (11)................................................................................. 118
5.3.3.6
Synthese von 2-Carbamoyl-2’-diphenylphosphanoyl-1,1’-binaphthyl (24) ........................................................................................... 120
5.3.3.7
Synthese von 2-N,N-Dimethylaminomethylenacylamido-2’diphenylphosphanoyl-1,1’-binaphthyl (25)....................................... 122
5.3.3.8
Synthese von 2’-Diphenylphosphanoyl-2-[1H(1,2,4)triazol-3-yl]1,1’-binaphthyl (26).......................................................................... 123
5.3.3.9
Synthese von 2’-Diphenylphosphanyl-2-[1H(1,2,4)triazol-3-yl]1,1’-binaphthyl (27).......................................................................... 124
5.3.3.10 Komplexierung von 27 mit PdCl2(PhCN)2........................................ 126
6
Literaturverzeichnis................................................................... 128
7
Anhang ....................................................................................... 132
7.1
NMR-Spektren ........................................................................................... 132
7.2
Röntgenkristallstrukturdaten ...................................................................... 178
7.3
IR-Spektren................................................................................................ 189
7.4
Selbständigkeitserklärung.......................................................................... 207
7.5
Danksagung............................................................................................... 208
7.6
Lebenslauf ................................................................................................. 210
Einleitung
1
1 Einleitung
1.1 Asymmetrische Katalyse
Aufgrund des stetig wachsenden Bedarfs an enantiomerenreinen Verbindungen für
die Herstellung von Pharmazeutika, Agrarchemikalien sowie Geschmacks- und Duftstoffen wurde deren Synthese in den letzten Jahrzehnten zu einem Schwerpunkt der
chemischen Forschung. Die Aufgabe bzw. das Ziel besteht dabei darin, prochirale
Verbindungen stereoselektiv in enantiomerenangereicherte bzw. -reine Produkte zu
überführen.
Klassische Methoden wie die Racematspaltung oder die Verwendung chiraler
Reagenzien haben den Nachteil, dass stöchiometrische Mengen eingesetzt werden
müssen. Die Entwicklung chiraler in der Regel metallhaltiger Katalysatoren ist daher
eine wesentlich effizientere Variante, die gegenüber den eben genannten Methoden
beträchtliche Vorteile hat. Aus einem chiralen Liganden und einer Metallvorstufe
werden sogenannte Präkatalysatoren entweder vorgebildet und isoliert oder in situ
generiert. Zu Beginn der Katalyse entstehen freie Koordinationsstellen am eigentlichen Katalysator, welche von den Substraten bzw. Reaktanden eingenommen
werden. Die Reaktion verläuft dann in einer durch den Liganden geprägten chiralen
Umgebung. Mit der Abspaltung des enantiomerenreinen Produktes ist der Zyklus
geschlossen und der Katalysator steht für weitere Umsetzungen wieder zur Verfügung (Abb. 1).[1]
Auf diesem Weg kann mit wenig chiralem Katalysator eine große Menge an
enantiomerenreinem Produkt gebildet werden, wodurch der Einsatz stöchiometrischer Mengen entfällt. Außerdem wird eine Trennung von Enantiomerengemischen
durch eine hohe Enantioselektivität des Katalysators vermieden. Im Idealfall kann
dieser sogar zurückgewonnen und erneut verwendet werden.
Einleitung
2
chiraler Ligand
X
M = Metall
M
X
Präkatalysator
enantiomerenreines
Produkt
Substrat / Reaktand
A
A
B
M
Eliminierung
Katalysator
M
B
Koordination
A
A
B
M
B
Reaktion
[1]
Abb. 1: Allgemeines Prinzip der asymmetrischen Katalyse.
Während sich die katalytisch aktiven Metallzentren hauptsächlich auf Übergangsmetalle der Gruppen III bis XI beschränken, sind der strukturellen Variation der
Liganden kaum Grenzen gesetzt. Bereits Anfang der 90iger Jahre waren mehr als
2000 chirale Liganden bekannt und ihre Zahl steigt seitdem stetig an.[2]
1.2 1,1’-Binaphthylsysteme als Liganden in der asymmetrischen
Katalyse
Funktionalisierte Binaphthyle erlangten in den letzten Jahren immer größere
Bedeutung für die asymmetrische Katalyse. Durch Koordination an eine Vielzahl von
unterschiedlich großen Metallzentren, begünstigt durch den flexiblen Winkel
zwischen den Naphthyleinheiten, vermögen sie Reaktionen zu katalysieren und Chiralität zu induzieren.
Erste Untersuchungen auf diesem Gebiet erfolgten mit C2-symmetrischen Binaphthylen (Abb. 2), die aufgrund der gleichen Substituenten in 2- und 2’-Position einfach
zu synthetisieren sind. Die Dihydroxy- und Diaminoverbindung (BINOL und BINAM)
sind durch oxidative Kupplung entsprechender Naphthalinvorstufen schnell und in
Einleitung
3
hohen Ausbeuten zugänglich.[3] Ausgehend vom BINOL-Grundgerüst lässt sich auch
das Diphosphan (BINAP) in wenigen Reaktionsschritten realisieren.[4]
BINOL
OH
PPh2
NH2
OH
PPh2
NH2
BINAP
BINAM
[3, 4]
Abb. 2: Wichtige Vertreter C2-symmetrischer Binaphthylsysteme.
Während BINOL Komplexe mit oxophilen Hauptgruppenelementen (B, Al), frühen
Übergangsmetallen (Ti, Zr) sowie den Lanthanoiden (La, Yb) bildet, werden von
BINAM und BINAP eher späte Übergangsmetalle (Ru, Rh, Ir, Pd) als Metallzentren
bevorzugt.[2, 5] Damit ist BINOL eine der vielseitigsten Binaphthylverbindungen, da es
sowohl als Ligand für katalytische asymmetrische Reaktionen fungieren als auch
zum Aufbau zahlreicher weiterer C2- sowie C1-symmetrischer Binaphthyle verwendet
werden kann.[3b] Aus der obigen Reihe an symmetrischen Liganden ist aber vor allem
BINAP wegen seiner hervorragenden katalytischen Aktivität und der erfolgreichen
Anwendung in der chemischen Industrie hervorzuheben. Noyori und seine Mitarbeiter
begannen 1974 mit der Synthese dieses Diphosphans, welche sechs Jahre später
erstmals veröffentlicht wurde.[4a] Sehr gute Ergebnisse erzielte dieser Ligand in der
Ru-katalysierten Hydrierung α,β-ungesättigter Substrate. Eine wichtige Anwendung
besteht dabei in der Synthese des entzündungshemmenden Wirkstoffs Naproxen.
Bei der asymmetrischen Isomerisierung von Allylaminen, insbesondere im Schlüsselschritt der industriellen Synthese von (-)-Menthol (Takasago-Verfahren), konnte ein
kationischer Rh-BINAP-Komplex ebenso erfolgreich eingesetzt werden (Abb. 3).[4d, e]
Einleitung
4
H3C
COOH (S)-BINAP-Ru(OAc)2 / H2
H
COOH
MeO
MeO
(S)-Naproxen
97% ee
NEt2
[(S)-BINAP-Rh(COD)]+
NEt2
Diethylgeranylamin
(R)-Citronellal-Enamin
96-99% ee
OH
(-)-Menthol
[4d, e]
Abb. 3: Beispiele für die erfolgreiche Anwendung von BINAP in der asymmetrischen Katalyse.
Dieser überragende Erfolg von BINAP führte zur Synthese zahlreicher BINAPAnaloga bzw. weiterer chiraler Binaphthylliganden, deren Potential in verschiedenen
katalytischen Reaktionen getestet wurde.[4c, 6] Trotz der Vorteile C2-symmetrischer
Liganden (einfache Synthese, geringe Anzahl an Diastereomeren im katalytisch
aktiven Übergangszustand) können in der Literatur zunehmend Beispiele für
C1-symmetrische Binaphthyle gefunden werden. Die unterschiedlichen Substituenten
in 2- und 2‘-Position erniedrigen die Symmetrie, wobei neben den sterischen
Aspekten für die räumliche Anordnung des Liganden auch asymmetrische
elektronische Effekte eine immer größere Rolle spielen. Durch die unterschiedlichen
Donoratome erfolgt eine verstärkte elektronische Differenzierung der restlichen
Koordinationsstellen am Metall, was Einfluss auf die Anlagerung des Substrates und
somit auf die gesamte Katalyse hat.
Monophosphanliganden (Abb. 4), wie das von Hayashi et al. bereits 1991 synthetisierte Methoxyphosphin (MOP), wurden außerdem mit dem Ziel entwickelt,
asymmetrische Reaktionen zu katalysieren, bei denen Diphosphanliganden wie
BINAP bisher erfolglos waren. Hohe katalytische Aktivität und Enantioselektivität
zeigten MOP-Liganden in verschiedenen Pd-katalysierten Reaktionen, wobei sie vor
allem in der Hydrosilylierung von Olefinen anderen Liganden weit überlegen waren.[7]
Einleitung
5
OMe
NMe2
PPh2
PPh2
MOP
MAP
(1991)
(1998)
Abb. 4: Monophosphanliganden von Hayashi et al. (MOP) und Kočovský et al. (MAP)
[7a, 8]
als Beispiele für C1-symmetrische Binaphthylsysteme.
Bei der Synthese des Dimethylaminophosphins (MAP) und weiterer MAP-Derivate
orientierten sich Kočovský et al.[3a, 8] 1998 dagegen an den Erfolgen von P,N-Liganden wie den Phosphinooxazolinen[9] von Helmchen und Pfaltz. Katalytische Aktivität
zeigten diese neuen Binaphthylliganden zunächst in Pd-katalysierten allylischen
Substitutionen.[3a, 8] Wenig später setzten Buchwald et al. neben den Biphenylanaloga[10] auch entsprechende MAP-Liganden erfolgreich bei C-C-Kupplungsreaktionen[3a, 11] ein.
1.3 Phosphinooxazolinbinaphthylliganden
Die Arbeitskreise von Ikeda, Hayashi und Pregosin berichteten ebenfalls Ende der
90iger Jahre unabhängig voneinander über eine Möglichkeit zur Kombination der
heterobidentaten Phosphinooxazoline mit dem chiralen Binaphthylgerüst. Auf
unterschiedlichen Synthesewegen gelangten sie zu einem neuen P,N-Binaphthylliganden (Abb. 5).[12]
Einleitung
6
O
N
R
P
R = iPropyl
Ar
Ar
Ar = Ph
(I / H / P)
3,5-Di-Me-Ph
(P)
3,5-Di-tBu-Ph
(P)
[12]
Abb. 5: Phosphinooxazolinliganden der Arbeitsgruppen Ikeda (I), Hayashi (H) und Pregosin (P).
Die Eignung dieses Binaphthyls als chiraler Ligand für die asymmetrische Katalyse
wurde von allen drei Gruppen anhand der allylischen Alkylierung von 1,3-Diphenylpropenylacetat mit Dimethylmalonat getestet (Abb. 6).[12]
MeOOC
OAc
Ph
Ph
COOMe
Pd / Ligand
Dimethylmalonat
Ph
* Ph
R-Enantiomer
91% ee
Abb. 6: Einsatz des neuen P,N-Liganden in der Pd-katalysierten allylischen Alkylierung.
Der Arbeitskreis von Pregosin berichtete zusätzlich von hervorragenden Enantiomerenüberschüssen bis 99%, die bei der allylischen Aminierung von 1,3-Diphenylpropenylacetat mit 2-Methoxybenzylamin realisiert wurden.[12c]
Außerdem erzielten sowohl Hayashi et al.[13] als auch Pregosin et al.[12c] sehr gute
Ergebnisse bei der Heck-Arylierung von 2,3-Dihydrofuranen mit Aryltriflaten (Abb. 7).
Einleitung
7
O
Pd / Ligand
O
*
Ph
Phenyltriflat
S-Enantiomer
74-80% ee
[12c, 13]
Abb. 7: Verwendung des neuen P,N-Liganden in der Pd-katalysierten Heck-Arylierung.
Als Produkte wurden dabei ausschließlich 2,5-Dihydrofuranderivate mit Enantiomerenüberschüssen von maximal 80% isoliert. Die Bildung regioisomerer 2,3-Dihydrofurane, die als Hauptprodukt bei der Verwendung von BINAP als Ligand
entstehen, wurde dagegen nicht beobachtet. Durch Einführung von Alkylgruppen in
3- und 5-Position der Phenylringe am Liganden (3,5-Dialkyl Meta Effekt)[14] gelang es
Pregosin und seinen Mitarbeitern (siehe Abb. 5) bei der Heck-Reaktion das phenylsubstituierte Produkt mit ee-Werten von 86% (3,5-Me2)[14a] bzw. 98% (3,5-tBu2)[14b] zu
erhalten.
Die hier vorgestellten Beispiele sind jedoch nur eine kleine Auswahl an asymmetrischen Reaktionen, die durch diesen Phosphinooxazolinbinaphthylliganden sowie
seinen Derivaten mit Übergangsmetallen wie Palladium oder auch Rhodium katalysiert werden können.[15]
Motivation und Zielsetzung
8
2 Motivation und Zielsetzung
Mit C1-symmetrischen Binaphthylen wie den Phosphinooxazolinliganden von
Pregosin et al., Hayashi et al. und Ikeda et al. konnten, wie bereits erwähnt, sehr
gute Ergebnisse in einer Vielzahl enantioselektiv katalysierter Reaktionen erzielt
werden.[12, 13] Inspiriert von diesen Erfolgen war das Ziel dieser Arbeit die Synthese
neuer enantiomerenreiner P,N-Binaphthylliganden mit weiteren Heterozyklen als
N-Donoreinheit sowie deren Charakterisierung. Ausgehend von bekannten bzw.
neuen Binaphthylvorstufen (Abb.8) sollte in wenigen Reaktionsschritten der Aufbau
eines Pyrazol- bzw. Triazolringes erfolgen.
C(O)NH2
C(O)Me
P(O)Ph2
P(O)Ph2
[16]
Abb. 8: Amid
- bzw. acetylsubstituiertes Phosphanoylbinaphthyl als zentrale Ligandvorstufen.
Die Synthese verschieden substituierter Arylpyrazole durch Umsetzung entsprechender Arylketone mit Dimethylformamiddimethylacetal (DMFDMA) und anschließende
Zyklisierung mit Hydrazin-Monohydrat wurde im Arbeitskreis Thiel für die Synthese
achiraler Liganden bereits eingesetzt.[17] Ausgehend von 2-Acetonaphthon konnte
auf diese Weise 3-Naphthyl-1H-pyrazol dargestellt werden (Abb. 9).
Motivation und Zielsetzung
9
O
O
i
CH3
CH3
N
CH3
ii
i) DMFDMA
ii) Hydrazin-Monohydrat
NH
N
Abb. 9: Synthese von 3-Naphthyl-1H-pyrazol.
Aryltriazole können in einer ähnlichen Reaktionsabfolge ausgehend von den
entsprechenden Arylamiden synthetisiert werden (Abb. 10).[18] Dieser Weg zu
Triazolverbindungen sollte sich im Prinzip auch auf Naphthylsysteme und
anschließend auf unsymmetrisch substituierte Binaphthylsysteme übertragen lassen.
N
O
O
NH2
N
i
MeO
OMe
i) DMFDMA
HN
NMe2
N
ii
MeO
OMe
MeO
OMe
ii) Hydrazin-Monohydrat
Abb. 10: Synthese von 3-(3,5-Dimethoxyphenyl)-1H(1,2,4)-triazol.
Durch die Pyrazol- bzw. Triazoleinheiten besitzen diese neuen Binaphthylliganden
(Abb. 11) neben der chiralen Information und den unterschiedlichen Donoratomen
als Koordinationsstellen für Metalle zusätzlich Möglichkeiten zur Modifikation in
Hinsicht auf sterische und vor allem elektronische Effekte. Dies sollte Einfluss auf die
katalytischen Eigenschaften der entsprechenden Metallkomplexe haben.
Motivation und Zielsetzung
10
X = CH oder N
X
chirale Information
N
N
P
Ph
H
Möglichkeiten zur Modifikation
des Heterozyklus
Ph
unterschiedliche Donoratome zur Koordination
katalytisch aktiver Metallzentren
Abb. 11: P,N-Binaphthylligand mit Pyrazol bzw. Triazol als N-Donoreinheit.
Ein weiteres Ziel dieser Arbeit war die Synthese und Charakterisierung von Koordinationsverbindungen der bidentaten Binaphthylliganden mit Metallen wie Palladium.
Analog zu entsprechenden Phosphinooxazolinkomplexen[12] könnten sie als potentielle Katalysatoren für die allylische Alkylierung bzw. Aminierung sowie die HeckReaktion fungieren.
Ergebnisse und Diskussion
11
3 Ergebnisse und Diskussion
3.1 Aufbau von Biarylen
Durch das stetig wachsende Interesse an axial-chiralen Biarylsystemen als Liganden
für die asymmetrische Katalyse gibt es hierfür zahlreiche, zum Teil auch enantioselektive Synthesemethoden.
Bei den klassischen Kupplungsreaktionen (z. B. Kumada-, Suzuki- bzw. oxidative
Kupplung) werden die Biaryle direkt aus den entsprechend substituierten Aryleinheiten aufgebaut.[3, 19] Oft verlaufen diese metallkatalysierten bzw. oxidativen
Kupplungen nicht enantioselektiv, so dass anschließend eine Racemattrennung
durch Bildung von Einschlusskomplexen (z. B. mit N-Benzylcinchonidiniumchlorid)
oder durch fraktionierte Kristallisation von Diastereomeren mittels chiraler Hilfsreagenzien (z. B. Camphersulfonsäure) erfolgen muss. Des Weiteren spielen sowohl
die Art des Substituenten als auch dessen Position für den erfolgreichen Verlauf der
Reaktion eine entscheidende Rolle.
In den letzten Jahren konnten einige Fortschritte bei der Entwicklung neuer bzw. eine
Verbesserung bestehender Methoden erzielt werden.[19] Durch den Einsatz von
chiralen Kupfer(II)-(S)-amphetaminkomplexen können bei oxidativen Verfahren
Binaphthyle in enantiomerenangereicherter Form (z. B. BINOL, 96% ee) erhalten
werden (Abb. 12).[19a, 20]
i) 4 eq CuCl2,
16 eq (S)-(+)-MeCH(NH2)CH2Ph
OH
ii) 4 N HCl
OH
2
OH
MeOH, 25 °C, 20 h
98% (96% ee)
Abb. 12: Cu-vermittelte enantioselektive oxidative Homokupplung von 2-Naphthol.
Ergebnisse und Diskussion
12
Auch bei der Ni-katalysierten Reaktion von Arylhalogeniden mit Arylgrignardverbindungen (Kumada-Kupplung) kann durch Verwendung eines chiralen Ferrocenylphosphanliganden ein entsprechendes C2-symmetrisches Binaphthyl mit hohen
Enantiomerenüberschüssen isoliert werden (Abb. 13).[19b, 21]
CH3
MgBr
Ni / (S)-(R)-PPFOMe
CH3
+
Br
CH3
PPh2
CH3
CH3
Fe H
OMe
69% (95% ee)
Abb. 13: Enantioselektive Kumada-Kupplung in Gegenwart eines chiralen Ferrocenylphosphans.
Zu einem der bedeutendsten und meist verwendeten Verfahren zur C-C-Bindungsknüpfung zählt die vielfach untersuchte Pd-katalysierte Kupplung von Arylboronsäuren bzw. deren Estern mit Arylhalogeniden bzw. -triflaten (Suzuki-Kupplung[22]).
Mit chiralen P,N-Ferrocenylphosphanliganden können auch bei dieser Reaktion
Binaphthylverbindungen mit ee-Werten bis zu 85% erhalten werden (Abb. 14).[19b, 23]
CH3
I
Pd / (S)-(R)-PPFNMe
CH3
+
CH3
O
PPh2
O
NMe2
B
CH3
Fe
H
CH3
50% (85% ee)
Abb. 14: Enantioselektive Suzuki-Kupplung mit einem bidentaten chiralen Ferrocenylliganden.
Ergebnisse und Diskussion
13
Enantioselektiv katalysierte Aryl-Aryl-Kupplungen sind meist auf spezielle Substitutionsmuster bzw. funktionelle Gruppen beschränkt oder versagen bei zu großer
sterischer Hinderung. Durch den ökonomischen Einsatz und die stetige Verbesserung chiraler Katalysatoren könnten sie sich jedoch in Zukunft zur Methode der Wahl
entwickeln.
Trotz ständiger Neuerungen auf dem Gebiet der Biarylsynthese existiert bisher noch
kein allgemeingültiges Verfahren, das allen Anforderungen, wie hohen chemischen
Ausbeuten und optischen Reinheiten, günstigen Edukten und chiralen Katalysatoren,
milden Reaktionsbedingungen sowie der Toleranz jeder Art und Lage von
Substituenten, gerecht wird.[19b] Daher wurde auch in dieser Arbeit auf klassische
Methoden der Biarylsynthese zurückgegriffen, um ein geeignetes Binaphthylgerüst
als Grundstruktur für die neuen P,N-Liganden zu erhalten.
3.1.1 Versuche zur Synthese des Binaphthylgerüsts mittels Suzuki-Kupplung
Mit dem 2-Acetylnaphthyltriflat 1 und der 1-Naphthylboronsäure 3 sollten geeignete
Reagenzien für eine Suzuki-Kupplung geschaffen werden. Die elektronenziehende
Acetylgruppe der Komponente 1 wirkt bei dieser Pd-katalysierten Reaktion stark
aktivierend und der Triflatsubstituent ist eine gute Abgangsgruppe.
Beide Naphthalinvorstufen für den Aufbau des Biarylrückgrats sind über wenige
literaturbekannte Reaktionsschritte zugänglich. Die Triflatkomponente 1 konnte aus
kommerziell erhältlichem 2-Acetyl-1-naphthol durch Veresterung der Hydroxyfunktion
mit Trifluormethansulfonsäureanhydrid dargestellt werden (Abb. 15).[24]
OH
OTf
O
(CF3SO2)2O
1
90 %
Abb. 15: Synthese von 2-Acetyl-1-naphthyltriflat (1).
O
Ergebnisse und Diskussion
14
Die Synthese der Boronsäurekomponente 3 erfolgte ausgehend von ebenfalls
kommerziell erhältlichem 1-Brom-2-naphthol. Dabei wurde zunächst die Hydroxygruppe in 2-Position bis zur späteren Einführung der P-Donoreinheit durch Veretherung mit einer Benzylgruppe geschützt.[25] Die Umsetzung mit Magnesium lieferte ein
entsprechendes Grignardreagenz, welches mit Triisopropylborat und anschließender
Hydrolyse zur Naphthylboronsäure 3 weiterreagierte (Abb. 16).[26]
Br
i) NaOEt
OH
Br
OBn
ii) BnBr
i) Mg
ii) B(OiPr)3 / H3O+
2
70%
HO
OH
B
OBn
3
50%
Abb. 16: Synthese von 2-Benzyloxy-1-naphthylboronsäure (3).
Bereits zu Beginn der 90iger Jahre wurde über erfolgreiche Pd(0)-katalysierte
Kreuzkupplungen von Arylboronsäuren mit Aryltriflaten u. a. auch zur Synthese
sterisch anspruchsvoller bzw. funktionalisierter Biarylsysteme berichtet.[27]
Die Durchführung der folgenden Kupplungsversuche geschah in Anlehnung an die in
der Literatur beschriebenen Methoden. Zunächst wurden Standardbedingungen wie
Tetrakis(triphenylphosphan)palladium als Pd(0)-Katalysator in Gegenwart von LiCl
und 2 M Na2CO3-Lösung als Base gewählt. Die Entstehung des Binaphthylsystems 4
wurde jedoch nicht beobachtet. Anhand der Signallage in den NMR-Spektren und
dem Integralverhältnis von Methylengruppe (Benzylsubstituent) zu Methylgruppe
(Acetylsubstituent) konnten lediglich die Verbindungen 2-Acetyl-1-naphthol und
2-Benzyloxynaphthalin identifiziert werden (Abb. 17).
Ergebnisse und Diskussion
15
1
Ac
Pd-Kat.
OTf
Ac
+
HO
OBn
OH
B
OBn
4
3
mittels NMR identifizierte Verbindungen:
2-Benzyloxynaphthalin
2-Acetyl-1-naphthol
OH
O
OBn
und
Signal für OH-Gruppe bei 14 ppm
B(OH)2-Signale fehlen
Integralverhältnis von CH2-Gruppe (Benzylsubstituent) zu
CH3-Gruppe (Acetylsubstituent) nicht 2:3 !
Abb. 17: Versuch der Synthese von Binaphthylsystem 4 via Suzuki-Kupplung.
Der Aufbau eines entsprechenden Binaphthyls konnte auch durch Variation von
Base und Lösungsmittel sowie durch Kupplungsversuche mit Phenyltriflat bzw.
Phenylboronsäure nicht realisiert werden (Tab. 1).
Tab. 1: Kupplungsversuche und deren Reaktionsbedingungen.
Nr.
ArB(OH)2
ArOTf
Kat.
Zusatz
Base
LM
T [°C]
t [h]
1
3
1
Pd(PPh3)4
LiCl
Na2CO3
Toluol/EtOH
90
7
2
PhB(OH)2
1
Pd(PPh3)4
LiCl
Na2CO3
Toluol/EtOH
90
7
3
3
1
Pd(PPh3)4
–
Ba(OH)2×8H2O
DME
80
6
4
3
PhOTf
Pd(PPh3)4
–
K3PO4
DMF
100
6
a) abgebrochen wegen zunehmender Zersetzung des Katalysators
a)
Ergebnisse und Diskussion
16
Der Einsatz von wässrigem Na2CO3 als Base erscheint unpassend für die Kupplung
von Triflaten, doch auch die Verwendung stärkerer oder wasserfreier Basen brachte
keine besseren Ergebnisse. Die Zugabe von LiCl ist für die Stabilisierung des
Katalysators wichtig, da Triflate mit dem als Liganden fungierenden Triphenylphosphan zu entsprechenden Phosphoniumsalzen reagieren können und somit den
Katalysator zerstören.[22] Dieser Effekt wurde auch beim 2. Kupplungsversuch der
Naphthylkomponenten 1 und 3 (siehe Tab. 1, Nr. 3) beobachtet, was eine weitere
Erklärung für den schlechten Reaktionsverlauf darstellt. Außerdem hat der
Substituent der Boronsäure einen Einfluss auf die Reaktion. Sowohl elektronenziehende als auch elektronenschiebende Substituenten können zur Abspaltung der
Boronsäuregruppe führen. Allein durch die Stellung in ortho-Position wird dieser
Vorgang noch extrem beschleunigt.[27c] Die Entstehung von 2-Benzyloxynaphthalin,
welches nicht mehr gekuppelt werden kann, ist somit ein weiterer Grund für die
schlechten Ergebnisse. Die Reaktionsbedingungen hätten durch die Verwendung
eines effizienteren Katalysators (z. B. PdCl2 / dppf)[27b] nochmals optimiert werden
können. Allerdings hätte dies auf die sterischen Aspekte bzw. den Substituenteneffekt der Boronsäurekomponente einen geringeren Einfluss gehabt, so dass die
erfolgreiche Synthese des Binaphthyls 4 via Suzuki-Kupplung weiterhin ungeklärt
bleibt.
Aufgrund dieser wenig zufrieden stellenden Ergebnisse wurde ein neuer Weg für die
Synthese eines in 2- und 2’-Position substituierten Binaphthyls gesucht. Als
Alternative wurde die oxidative Kupplung von Naphthalinvorstufen durch Umsetzung
mit Eisen(III)- oder Kupfer(II)-salzen gewählt.[3] Auf diese Weise lassen sich verschiedene Binaphthyle u. a. das 1,1’-Binaphth-2,2’-ol (BINOL) als Grundgerüst für die
neuen Liganden darstellen.
3.1.2 Synthese des Binaphthylgerüsts mittels oxidativer Kupplung
3.1.2.1
Synthese von 1,1’-Binaphth-2,2’-ol (BINOL, 6) als Grundbaustein
Die Synthese von BINOL 6 erfolgt nach der Methode von Ding et al.[28] durch
oxidative Homokupplung von 2-Naphthol suspendiert in wässriger Fe3+-Lösung. Bei
dieser Reaktion können die homogen im Wasser verteilten Fe3+-Ionen schnell mit der
Oberfläche des festen 2-Naphthols 5 in Kontakt treten und somit durch Einelek-
Ergebnisse und Diskussion
17
tronenoxidation das Radikal 5• bilden. Die anschließende Kupplung mit einem
weiteren neutralen Molekül 5 führt zur ebenfalls radikalischen Verbindung 6•. Die
Aromatizität des Kupplungsproduktes wird durch Oxidation mit Luftsauerstoff und
unter Abspaltung von H+ wiederhergestellt (Abb. 18).
OH
Fe3+
5
O
H+
Fe2+
5
5
OH
OH
6
O2
H
H+
O
H
OH
6
Abb. 18: Mechanismus der oxidativen Homokupplung von 2-Naphthol.
Diese Reaktion besitzt neben den kostengünstigen Edukten 2-Naphthol und
FeCl3×6H2O sowie Wasser als „Lösungsmittel“ den Vorteil, dass das ebenfalls
wasserunlösliche Produkt 6 einfach abfiltriert werden kann. Nach Umkristallisation
aus Toluol liegt 6 als beigefarbener feinkristalliner Feststoff vor. Außerdem verläuft
die Reaktion in Suspension schneller als in Lösung und liefert selbst bei größeren
Ansätzen (0.2 mol) noch gute Ausbeuten an BINOL 6 (Abb. 19).[28]
Ergebnisse und Diskussion
18
OH
FeCl3x6H2O
OH
H2O, 50 °C, 3 h
OH
5
6
70%
Abb. 19: Synthese von 1,1’-Binaphth-2,2’-ol (6).
Für eine spätere enantiomerenreine Synthese der P,N-Liganden musste nun eine
Trennung des racemischen BINOLs 6 in seine beiden Enantiomere erfolgen. Die von
Cai et al.[29a] beschriebene Methode unter Verwendung von (8S, 9R)-(-)-N-Benzylcinchonidiniumchlorid (NBCC, 7) als chiralem Reagenz liefert dabei beide
Enantiomere in hohen chemischen Ausbeuten und optischen Reinheiten. Weitere
Vorteile dieses Verfahrens sind der Einsatz von nur 0.55–0.60 Äquivalenten des
chiralen Salzes 7 für die Racematspaltung sowie die Möglichkeit zur Rückgewinnung
von NBCC (bis zu 85%) durch Aufarbeitung der anfallenden wässrigen Phasen.
Einen kleinen Nachteil stellt der relativ hohe Preis des chiralen Hilfsmittels 7 dar.
Daher wurden zunächst durch die Umsetzung des günstigeren Cinchonidins mit
Benzylchlorid in Ethanol größere Mengen an NBCC synthetisiert (Abb. 20).[30]
H
H
Cl
H
HO
H
N+
H
N
BnCl
-
HO
H
EtOH, 80 °C, 3-4 h
N
N
7
75 %
Abb. 20: Synthese des chiralen Hilfsreagenz (8S, 9R)-(-)-N-Benzylcinchonidiniumchlorid (NBCC, 7).
Ergebnisse und Diskussion
19
Bei der anschließenden Racematspaltung von BINOL 6 konnten beide Enantiomere
in guten Ausbeuten (> 80%) und ee-Werten von ≥ 99% erhalten werden (Abb. 21).
Die optische Reinheit wurde durch die Bestimmung des spezifischen Drehwertes [α]
bei einer Temperatur von 21 °C und einer Wellenläng e von 589 nm ermittelt. Die
erhaltenen Werte für R-(+)-BINOL (+ 34.5, c = 1, THF) und S-(-)-BINOL (- 34.5,
c = 1, THF) stimmten dabei mit den in der Literatur[29a] aufgeführten Daten (+ 34.3 für
R-6 und - 34.0 für S-6) sehr gut überein.
OH
NBCC
OH
MeCN
OH
NBCC
OH
OH
+
OH
∆T, 4 h
6
in Lösung
Komplex (Feststoff)
i) MeOH, ∆T, 24 h
Aufarbeitung
ii) Aufarbeitung
S-BINOL (S-6)
R-BINOL (R-6)
83% (> 99% ee)
85% (> 99% ee)
Abb. 21: Racematspaltung von 1,1’-Binaphth-2,2’-ol.
Mit Verbindung 6 wurde somit ein Binaphthylgrundgerüst geschaffen, welches sich
durch unterschiedliche Substitution der beiden OH-Gruppen in entsprechende C1symmetrische Binaphthyle überführen lassen sollte. Um die folgenden Substitutionsreaktionen zu erleichtern, wurden zunächst die Hydroxygruppen in die besseren
Triflatabgangsgruppen umgewandelt.
3.1.2.2
Synthese von 1,1’-Binaphthyl-2,2’-bistrifluormethansulfonat (8)
In Anlehnung an die Literatur[31a] erfolgte die Umsetzung von 6 mit Trifluormethansulfonsäureanhydrid in Gegenwart von Pyridin als Base und absolutiertem
Dichlormethan als Lösungsmittel. Nach der Aufarbeitung konnte das entsprechende
Bistriflat 8 in guten Ausbeuten isoliert werden (Abb. 22).
Ergebnisse und Diskussion
20
OH
(CF3SO2)2O, C5H5N
OTf
OH
N2, CH2Cl2, RT, 2 h
OTf
8
83%
Abb. 22: Synthese von 1,1’-Binaphthyl-2,2’-bistrifluormethansulfonat (8).
Bei Verwendung von enantiomerenreinem BINOL R-6 bzw. S-6 gelang auch die
Synthese der Bistriflate R-8 bzw. S-8 in hohen chemischen Ausbeuten (83–86%) und
optischen Reinheiten. Die Enantiomerenreinheit für beide Bistriflate konnte durch die
ermittelten spezifischen Drehwerte für R-8 (- 150.0) bzw. S-8 (+ 144.0) bei c = 1 in
CHCl3 und deren Vergleich mit den Literaturdaten (R-8: - 147.7 bzw. S-8: + 146.3 bei
c = 1.01 in CHCl3)[31b, c] bestätigt werden.
Die verschiedenen Reaktionswege ausgehend vom Bistriflat 8, die zu unsymmetrisch
substituierten Binaphthylvorstufen bis hin zu den jeweiligen P,N-Liganden führen,
werden nun in den folgenden Kapiteln 3.2 bis 3.4 diskutiert. Die Synthese erfolgte
zunächst zur Prüfung der Durchführbarkeit aller bzw. der Optimierung einzelner
Reaktionsschritte ausgehend vom Racemat 8.
Ergebnisse und Diskussion
21
3.2 Synthese eines Pyrazolylbinaphthylliganden 20
Die Synthese dieses P,N-Binaphthyls 20 sollte ausgehend von literaturbekannten
Binaphthylen[14b] durchgeführt werden. Schlüsselschritt ist hierbei die Darstellung der
bislang literaturunbekannten zentralen Ligandvorstufe 2-Acetyl-2’-diphenylphosphanoyl-1,1’-binaphthyl (12) (Abb. 23).
C(O)Me
P(O)Ph2
12
Abb. 23: 2-Acetyl-2’-diphenylphosphanoyl-1,1’-binaphthyl (12) als zentrale Ligandvorstufe.
3.2.1 Synthese der Ligandvorstufe 12 durch Umsetzung des Binaphthylnitrils 11 mit Methyllithium
Analog zur von Dotta et al.[14b] beschriebenen Synthese eines Phosphinooxazolinliganden wurden zunächst ausgehend von Bistriflat 8 die unsymmetrisch substituierten Binaphthylvorstufen 10 und 11 synthetisiert (Abb. 24). Anschließend sollte
anstelle der Kondensation mit S-Valinol zum Aufbau des Oxazolinringes eine
Umsetzung mit Methyllithium zur Einführung des Acetylsubstituenten erfolgen.
Das im ersten Reaktionsschritt benötigte Diphenylphosphanoxid (9) wurde über eine
zweistufige Synthese aus Triphenylphosphan synthetisiert (s. Kapitel 5.3.1).[32] Mittels
Pd-katalysierter Kupplung wurde selektiv nur eine der beiden Triflatgruppen von 8
durch eine sterisch anspruchsvolle Phosphanoxideinheit ersetzt.[33] Das Binaphthyl
10 konnte durch Säulenchromatographie als gelbes Öl bzw. schaumartiger Feststoff
in Ausbeuten von 56% in reiner Form erhalten werden. Die weiteren Fraktionen
bestanden aus nicht umgesetztem Edukt 8, hydrolysierten Verbindungen sowie
Diphenylphosphinigsäure.
Ergebnisse und Diskussion
22
Pd(OAc)2 / dppp
NiBr2 / PPh3
PH(O)Ph2 9, iPr2EtN
Zn, KCN
OTf
8
P(O)Ph 2
DMSO
CN
MeCN
P(O)Ph 2
90 °C, 6 h
100 °C, 24 h
10
11
56%
68%
Abb. 24: Synthese der Binaphthyle 10 und 11.
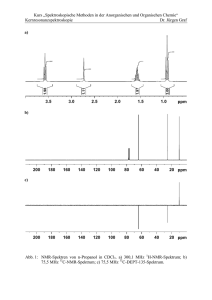
Die Charakterisierung von 10 erfolgte vorwiegend mit NMR-spektroskopischen
Methoden. Ein Quartett im
13
C-NMR-Spektrum (δ = 118.2 ppm, JC,F = 320 Hz) zeigt
den Erhalt eines Triflatrestes. Das Signal für das Phosphoratom der Phosphanoyleinheit wurde im
31
P-NMR-Spektrum bei 29.2 ppm beobachtet. Es unterscheidet sich
von seiner chemischen Verschiebung deutlich vom Phosphanoxid 9 (δ = 22.2 ppm)
29.2
22.2
(Abb. 25).
10
50
40
30
9
20
10
0
δ [ppm]
Abb. 25: Vergleich der
Eine Verschiebung der
31
P-NMR-Spektren von Binaphthyl 10 und Diphenylphosphanoxid 9.
31
P-NMR-Resonanz zu tieferem Feld ist sowohl für 10 als
auch für alle weiteren Phosphanoylbinaphthyle signifikant und ermöglicht neben
charakteristischen
1
H- und
13
C-NMR-Signalen des zweiten Substituenten eine
schnelle Identifikation der Verbindungen. Die eindeutige Zuordnung der Resonanzen
Ergebnisse und Diskussion
23
des Binaphthylgerüsts in den 1H-NMR- und 13C-NMR-Spektren war durch die geringe
Symmetrie der Verbindungen und die damit verbundenen Änderungen von
Signallagen bzw. -anzahl sowie den zusätzlichen Phenylsignalen der P(O)Ph2Einheit und die Kopplung zum Phosphoratom schwierig.
Durch eine anschließende Ni-katalysierte Substitution der verbliebenen Triflateinheit
mit Cyanid wurde das Binaphthylnitril 11 als farbloser Feststoff in Ausbeuten von
68% erhalten.[34] Die Einführung dieses sehr kleinen Substituenten konnte mit
verschiedenen spektroskopischen Methoden nachgewiesen werden. Für das Nitrilkohlenstoffatom wurde im
13
C-NMR-Spektrum ein Signal bei 118.6 ppm beobachtet.
Des Weiteren konnte im IR-Spektrum eine intensive Bande bei 2224 cm-1 der CNStreckschwingung zugeordnet werden. Der Einfluss der Nitrilgruppe auf das
Phosphoratom ist im Vergleich zur Triflateinheit etwas schwächer und wird durch
eine minimale Verschiebung des Signals im
31
P-NMR-Spektrum zu höherem Feld
(28.6 ppm) sichtbar. Die racemische Verbindung 11 zeichnet sich außerdem durch
eine schlechte Löslichkeit in vielen organischen Lösungsmitteln aus. Nur in
chlorierten Lösungsmitteln wie CHCl3 und CH2Cl2 lag 11 komplett gelöst vor und
konnte so in Form farbloser Kristalle erhalten und röntgenstrukturanalytisch
untersucht werden (Abb. 26).
Abb. 26: Kristallstruktur von Binaphthylnitril 11.
Ergebnisse und Diskussion
24
Die Verbindung 11 kristallisiert in der monoklinen Raumgruppe P21/n. Die beiden
Naphthyleinheiten sind um einen Winkel von 98.5 ° g egeneinander verdreht und
stehen dadurch fast senkrecht in einer transoiden Anordnung zueinander. Durch die
freien Elektronenpaare am Sauerstoff- und Stickstoffatom kommt es im Kristall zur
Ausbildung von intermolekularen nichtklassischen Wasserstoffbrückenbindungen
(Abb. 27). Die Untereinheiten aus jeweils einem R- und einem S-Enantiomer sind
über H-Brücken (2.519 Å) zwischen den Sauerstoffatomen der Phosphanoxidreste
und den Protonen in 4-Position der jeweils benachbarten nitrilsubstituierten Naphthyleinheit miteinander verbunden. Die dreidimensionale Struktur resultiert aus der
Aneinanderlagerung
dieser
Untereinheiten
über Wasserstoffbrückenbindungen
(2.563 Å) zwischen dem Nitrilstickstoffatom und dem Proton in 3-Position der
benachbarten phosphanoxidsubstituierten Naphthyleinheit. H-Brücken können, auch
wenn sie eher schwache Wechselwirkungen zwischen Molekülen darstellen,
aufgrund ihrer Anzahl zur Stabilität der Gesamtstruktur beitragen. Das könnte u. a.
ein Grund für den hohen Schmelzpunkt von 287 °C sow ie die schlechte Löslichkeit
des racemischen Binaphthyls 11 sein.
Abb. 27: Angedeutete dreidimensionale Struktur von 11 durch Ausbildung von H-Brücken.
Ergebnisse und Diskussion
25
Im Anschluss wurde versucht eine Suspension von Verbindung 11 in THF mit
Methyllithium bei 0 °C umzusetzen (Abb. 28). [35] Das nach der Aufarbeitung erhaltene
rötliche Öl wurde mittels NMR-Spektroskopie untersucht. Das
31
P-NMR-Spektrum
zeigte im Bereich von 28–31 ppm Signale mehrerer Phosphorspezies, was zunächst
auf eine unvollständige Umsetzung bzw. die Bildung von Nebenprodukten schließen
ließ. Allerdings war im 1H-NMR-Spektrum kein eindeutiges Signal für die Methylgruppe der Acetyl-Funktion vorhanden.
i) MeLi
ii) NH4Cl
CN
C(O)Me
P(O)Ph2
P(O)Ph2
11
12
Abb. 28: 1. Versuch zur Synthese der Acetylverbindung 12.
Mittels säulenchromatographischer Aufreinigung (EtOAc / n-Hexan 1:1) des Öls
sollten die entstandenen Verbindungen isoliert und charakterisiert werden. Aus den
zwei abtrennbaren Fraktionen konnten zum einen weinrote Kristalle sowie ein
beigefarbener Feststoff isoliert werden. Die Signallagen in den NMR-Spektren des
Feststoffs deuteten überwiegend auf das Edukt 11 hin, zumal hier ebenfalls das
erwartete Signal für die Methylgruppe fehlte. Ebenso widerlegten die NMR-Daten der
roten Kristalle die Entstehung der Acetylverbindung 12: es fehlte ein Signal im
31
P-NMR-Spektrum und die Anzahl der Signale aus den 1H- und
13
C-NMR-Spektren
deuteten auf ein symmetrisches Binaphthylsystem ohne Phosphoratom hin. Im
1
H-NMR-Spektrum (Abb. 29) gab es keinen Hinweis auf den Acetylsubstituenten, da
die Protonensignale sich ausschließlich im Aromatenbereich bei chemischen
Verschiebungen von 7.5–8.4 ppm befanden. Auch im
13
C-NMR-Spektrum (Abb. 30)
deutete keines der zehn Aromatensignale auf das 2,2’-substituierte Binaphthyl 12
hin. Allerdings lieferte ein Signal bei ~ 194 ppm (Carbonylkohlenstoffatom) einen
entscheidenden Anhaltspunkt für die Struktur der Verbindung.
Ergebnisse und Diskussion
26
H-NMR (CDCl3, 400.1 MHz): δ = 7.55–7.60 (m, 4H, Harom.), 7.78 (d,
1
J = 8.0 Hz, 2H, Harom.), 7.84 (d, J = 8.0 Hz, 2H, Harom.), 7.89–7.91 (m, 2H,
Harom.), 8.34–8.36 (m, 2H, Harom.).
C D C l3
8 ,4
8 ,2
8 ,0
7 ,8
7 ,6
7 ,4
7 ,2
7 ,0
δ [p p m ]
1
Abb. 29: H-NMR-Spektrum der weinroten Kristalle.
C-NMR (CDCl3, 50.3 MHz): δ = 119.8, 126.4, 127.7, 127.9, 128.1, 129.3,
13
130.1, 133.0, 138.8, 146.0 (Carom.), 194.3 (C=O).
C D C l3
134
132
130
128
126
160
140
120
100
C=O
200
180
80
60
40
20
0
δ [p p m ]
Abb. 30:
13
C-NMR-Spektrum der weinroten Kristalle.
Aufgrund der Spektren wurde angenommen, dass bei dieser Umsetzung ein
nucleophiler Angriff von Methyllithium auf das Phosphoratom der Phosphan-
Ergebnisse und Diskussion
27
oxideinheit und nicht auf das Nitrilkohlenstoffatom stattgefunden haben muss. Die
Abspaltung von Diphenylmethylphosphanoxid konnte durch ein Signal bei ~ 31 ppm
im
31
P-NMR-Spektrum des vor der Aufreinigung vorliegenden rötlichen Öls belegt
werden. Das dadurch intermediär gebildete Carbanion addierte im Folgeschritt
intramolekular an das Nitrilkohlenstoffatom unter Ausbildung eines Fünfrings mit exoständiger Imingruppe. Die anschließende Hydrolyse des Iminsalzes mit wässriger
NH4Cl-Lösung führt zu Dibenzo[c,g]fluorenon (13) (Abb. 31).
CN
CN
-
O Li+
O
P
Ph
MeLi
Ph
P
Ph
Ph Me
P(O)MePh2
11
N
- Li+
NH4Cl-Lsg.
O
-
+
N Li
13
Abb. 31: Postulierter Mechanismus für die Bildung des Ketons 13.
Diese Vermutung konnte durch die Röntgenstrukturanalyse der weinroten Kristalle
bestätigt werden (Abb. 32). Das Keton 13 kristallisiert aus einem EtOAc / n-HexanGemisch (1:1) in der monoklinen Raumgruppe P21/n. Der Diederwinkel zwischen den
Naphthyleinheiten, der die Verdrillung des Systems beschreibt, beträgt 22.7 °.
Ergebnisse und Diskussion
28
Dadurch ergibt sich ein Abstand von 2.109 Å für die Protonen in 8- und 8’-Position
(IUPAC-Nomenklatur). Anhand der Struktur ist außerdem ersichtlich, dass das Keton
13 wie alle anderen 1,1’-Binaphthyle axiale Chiralität aufweist.
Abb. 32: Verschiedene Ansichten der Röntgenstruktur von Dibenzo[c,g]fluorenon 13.
Die dreidimensionale Struktur von Verbindung 13 zeigt, dass sich die Moleküle
aufgrund von π-π-Wechselwirkungen in zickzackartigen Schichten anordnen
(Abb. 33).
Abb. 33: Anordnung von 13 im Molekülverband.
Ergebnisse und Diskussion
29
Ein interessanter Aspekt des Dibenzo[c,g]fluorenon (13) ist die Möglichkeit, dass
durch Reduktion zu Dibenzo[c,g]fluoren ein Ligand erhalten wird, der eine Kombination aus Cyclopentadien und 1,1’-Binaphthyl darstellt. Aus diesen Resultaten entstand ein mittlerweile eigenständiges Arbeitsgebiet des Arbeitskreises Thiel. Weitere
Ergebnisse zu diesem Thema sind in den Arbeiten von F. Pammer zu finden.[35]
Da die Synthese der Acetylverbindung 12 über das Nitril 11 mit MeLi nicht möglich
war, wurde nach weiteren Darstellungsmethoden gesucht.
3.2.2 Synthese der Ligandvorstufe 12 durch Umsetzung des Binaphthylnitrils 11 mit Grignard-Reagenzien
Grignard-Reagenzien sind ähnlich reaktive wenn auch weichere Nucleophile als die
bereits erwähnten Lithiumorganyle. Sie gehen leicht Reaktionen mit einer Vielzahl
von Elektrophilen ein. Dabei liefert die Addition an ein Nitril nach der Hydrolyse des
Reaktionsgemisches das entsprechende Keton (Abb. 34).[37a] Diese Methode ist eine
weitere Möglichkeit zur Synthese des Acetylbinaphthyls 12 ausgehend vom Nitril 11.
O
NMgX
R
N + MeMgX
R = Alkyl-, Aryl-
Hydrolyse
R
Me
R
Me
X = I, Br, Cl
Abb. 34: Addition von Grignard-Reagenzien an Nitrile zur Synthese von Ketonen.
Im Folgenden wurde versucht, das in Ether suspendierte Nitril 11 mit MeMgI bei
34 °C umzusetzen. [37b] Nach der Aufarbeitung zeigten die 1H- und 13C-NMR-Spektren
Signale für eine Methylgruppe bei 2.39 ppm und für ein Carbonylkohlenstoffatom bei
200 ppm, die dem Produkt 12 zugeordnet wurden. Allerdings war die Umsetzung
unvollständig, da der Signalsatz von 11 ebenfalls noch vorhanden war (Tab. 2, Nr.1).
Durch Variation der Reaktionsbedingungen wurde versucht, eine Optimierung der
Synthese von Acetylbinaphthyl 12 zu erzielen. Dabei zeigte sich, dass die Temperatur bei diesen Umsetzungen einen geringen Einfluss hatte. Mit der Verwendung
von Dioxan konnten zwar höhere Reaktionstemperaturen realisiert werden, jedoch
Ergebnisse und Diskussion
30
wurde in den NMR-Spektren keine Produktbildung beobachtet (Tab. 2, Nr. 2). Die
Reaktionsdauer und insbesondere die Konzentration an MeMgI waren dafür von
entscheidender Bedeutung. Die längere Umsetzung in Et2O bei Raumtemperatur
(Tab. 2, Nr. 3) brachte ein ähnliches Ergebnis wie die Reaktion unter Rückfluss.
Allerdings konnte durch die Steigerung der Menge an Grignard-Reagenz von drei auf
7.5 Äquivalente über die Reaktionszeit von vier Tagen die Acetylverbindung 12 in
den NMR-Spektren zu 83% identifiziert werden (Tab. 2, Nr. 4). Der Versuch, das
Edukt 11 mit einem nur fünffachen Überschuss an MeMgI bei längerer Reaktionszeit
umzusetzen, zeigte eine geringere Produktbildung (Tab. 2, Nr. 5). Die fehlende
Menge MeMgI konnte also nicht durch längeres Rühren bei RT kompensiert werden.
Tab. 2: Reaktionsbedingungen der Umsetzungen von 11 mit MeMgX.
11
MeMgX
Nr.
[mmol]
[mmol]
1
2.5
2
a)
T
t
Verhältnis
LM
[°C]
[h]
11:12 [%]
3.0 MeMgI
Et2O
34
2
45 : 55
4.7
6.0 MeMgI
Dioxan
101
2
100 : 0
3
2.5
3.0 MeMgI
Et2O
RT
24
40 : 60
4
1.0
7.5 MeMgI
Et2O
RT
96
17 : 83
5
2.0
10.5 MeMgI
Et2O
RT
168
75 : 25
6
1.0
3.0 MeMgCl
THF
RT
2
95 : 5
b)
c)
1
a) Verhältnis der Signalsätze beider Verbindungen im H-NMR-Spektrum
b) zeitlich versetzte Zugabe der 3.0 M Grignard-Lösung: 1 ml + 3 x 0.5 ml
c) zeitlich versetzte Zugabe der 3.0 M Grignard-Lösung: 2 ml + 3 x 0.5 ml
Die schlechte Löslichkeit von 11 in Et2O sollte der Grund für die geringe Bildung der
Acetylverbindung 12 sein. Vermutlich bildete sich auf den Kristallen von 11 ein passivierender Überzug aus dem bei der Reaktion entstandenen Mg-Imid, der das weitere
Auflösen des Edukts verhindert. Zusätzlich könnte neben dem sterischen auch ein
elektronischer Aspekt einen Einfluss auf den Reaktionsverlauf haben, da bei der
Verwendung von MeMgCl in THF trotz Auflösung des Nitrils 11 bei Zugabe des
Grignard-Reagenzes NMR-spektroskopisch eine sehr geringe Umsetzung zu
Produkt 12 beobachtet wurde (Tab. 2, Nr. 6). Das Nitrilkohlenstoffatom ist evtl. nicht
elektrophil genug für die Reaktion mit der nucleophilen Grignardverbindung.
Ergebnisse und Diskussion
31
Vermutlich hatte auch die Struktur des Grignard-Reagenzes, die abhängig von
Konzentration und Lösungsmittel (Schlenk-Gleichgewicht) ist, eine Auswirkung auf
den Reaktionsablauf (Abb. 35). In Et2O wird die Form I bevorzugt, in der das
Lösungsmittel an die Magnesiumatome komplexiert. In THF scheint die dimere Form
II zu überwiegen und in Dioxan existiert durch Ausfällen des unlöslichen Magnesiumhalogenids nur noch das Dimethylmagnesium (Form III).[37c]
X
2 MeMgX
Me
Mg
Mg Me
Me2Mg + MgX2
X
I
II
X = I, Cl
III
Abb. 35: Mögliche Struktur der Grignard-Reagenzien in Lösung (Schlenk-Gleichgewicht).
Die anschließende Isolierung der Acetylverbindung 12 aus einigen Versuchsansätzen gelang, aufgrund der besseren Löslichkeit gegenüber dem Nitril 11 in
organischen Lösungsmitteln, mittels Kristallisation aus EtOAc in Ausbeuten von
maximal 15%. Neben der NMR-spektroskopischen Charakterisierung wurde die
Existenz des neuen Binaphthyls 12 durch Röntgenstrukturanalyse der gelblichen
Kristalle bestätigt (Abb. 36). Der von 2-Acetyl-2’-diphenylphosphanoyl-1,1’-binaphthyl
(12) erhaltene monokline Kristall besitzt die Raumgruppe P21/n. Der Torsionswinkel
zwischen den Naphthyleinheiten beträgt hier 81.1 ° und ist damit ~ 17 ° kleiner als in
der Nitrilverbindung 11. Des Weiteren wird anhand der Struktur eine nahezu parallele
Anordnung einer der Phenylgruppen des Phosphanoxids zum Naphthylring der
Acetyleinheit ersichtlich. Diese wird durch einen Winkel zwischen den Ebenen von
12.4 ° und einen Abstand von d C29-C11 = 3.175 Å zwischen Phenyl- und Naphthylsystem definiert. Durch die Ausbildung von intermolekularen Wasserstoffbrückenbindungen zwischen den Sauerstoffatomen der Phosphanoxidgruppen und den
Protonen in 4-Position der jeweils benachbarten Acetylnaphthyleinheiten mit einer
Länge von 2.483 Å ergibt sich die räumliche Anordnung der Moleküle. Weitere
nichtklassische H-Brücken z. B. zwischen dem Carbonylkohlenstoffatom und dem
Proton einer Phosphanoxidnaphthyleinheit des Nachbarmoleküls können dagegen
nicht beobachtet werden. Diese weniger starr ausgeprägte dreidimensionale
Ergebnisse und Diskussion
32
Gesamtstruktur im Vergleich zu Nitril 11 führt u. a. zu der bereits erwähnten verbesserten Löslichkeit von 12 in organischen Lösungsmitteln.
Abb. 36: Ausbildung von intermolekularen H-Brücken bei Acetylbinaphthyl 12.
Aufgrund der benötigten hohen Konzentration an Grignard-Reagenz sowie der
langen
Reaktionszeiten
und
der
trotzdem
geringen
Ausbeute
an
reinem
Acetylbinaphthyl 12 wurde nach einer alternativen Synthesemöglichkeit gesucht. Der
elektrophile Charakter der polaren CN-Dreifachbindung von 11 ist für eine
nucleophile Addition von Grignard-Verbindungen anscheinend nicht ausreichend.
Durch den Einsatz von Carbonsäurehalogeniden als Elektrophile, deren Carbonylgruppe stärker polarisiert ist, sollte ein besserer Reaktionsverlauf erzielt werden.
Unter bestimmten Bedingungen können Säurechloride auch mit Grignard-Reagenzien zu Ketonen umgesetzt werden. Allerdings besteht die Möglichkeit zu einer
erneuten Addition des Nucleophils an das bereits entstandene Keton, wobei tertiäre
Alkohole als Nebenprodukte entstehen können. Bei Verwendung von Cupraten
erfolgt selbst mit einem Überschuss an Reagenz keine Weiterreaktion. Aus diesem
Grund wird im folgenden Kapitel auf die Reaktion von Säurechloriden mit Kupferorganylen wie z. B. Lithiumdimethylcuprat eingegangen.
Ergebnisse und Diskussion
33
3.2.3 Synthese der Ligandvorstufe 12 durch Umsetzung des Binaphthylsäurechlorids 17 mit Lithiumdimethylcuprat
Kupferorganische Verbindungen der Zusammensetzung R2CuLi entstehen durch
Transmetallierung von Lithiumorganylen mit Kupfer(I)salzen. Auf diese Weise bildet
sich durch Umsetzung von einem Äquivalent Kupfer(I)iodid mit zwei Äquivalenten
Methyllithium das hochreaktive Lithiumdimethylcuprat (Abb. 37), welches aufgrund
der beiden gleichen organischen Reste als Homo- bzw. nach seinem Entdecker auch
als Gilman-Cuprat bezeichnet wird.[38a, b]
CuI
MeLi
MeCu
MeLi
+ LiI
Me2CuLi LiI
Abb. 37: Synthese von Lithiumdimethylcuprat.
Wegen ihrer Reaktivität und der Empfindlichkeit gegenüber Sauerstoff und Wasser
werden
Organocuprate
erst
direkt
vor
Reaktionsbeginn
in
absolutierten
Lösungsmitteln wie Et2O bzw. THF und unter Schutzgasatmosphäre synthetisiert.
Ebenso wie Grignardverbindungen gehen diese nucleophilen kupferorganischen
Reagenzien
Reaktionen
Übertragung
eines
mit
verschiedenen
organischen
Restes
Elektrophilen
vom
Cuprat
auf
ein,
wobei
ein
durch
elektrophiles
Kohlenstoffatom eine C-C-Bindungsknüpfung erfolgt. Auf diese Weise lassen sich
auch Carbonsäurechloride in Ketone überführen (Abb. 38).[38a]
O
O
+ MeCu + LiCl
+ Me2CuLi
R
Cl
R
Me
R = Alkyl-, Aryl-
Abb. 38: Nucleophile Substitution mit Lithiumdimethylcuprat zur Synthese von Ketonen.
Die für die Reaktion benötigte Binaphthylcarbonsäure konnte allerdings nicht wie
zunächst angenommen durch Hydrolyse des Nitrils 11 gewonnen werden (Abb. 39).
In der Literatur[34] wurde bereits darauf hingewiesen, dass diese Reaktion bei 11
Ergebnisse und Diskussion
34
weder unter sauren noch basischen Bedingungen zur Ausbildung einer Säuregruppe
führt.
Hydrolyse mit
KOH-Lösung
CN
COOH
P(O)Ph2
P(O)Ph2
11
16
Abb. 39: Versuch zur Synthese der Binaphthylcarbonsäure 16.
In eigenen Untersuchungen, bei denen 11 mit verschiedenen KOH-Lösungen
umgesetzt wurde, konnte in den
31
P-NMR-Spektren ebenfalls nur ein Signal für das
entsprechende Amid bei 31.5 ppm beobachtet werden. Auf diese Verbindung und die
daraus resultierende Synthese eines weiteren P,N-Liganden wird in Kapitel 3.3
ausführlicher eingegangen. Aufgrund dieser Tatsache musste die Synthese der
Carbonsäure 16 über den Binaphthylester 15 erfolgen (Abb. 40).
Pd(OAc)2 / dppp
Pd(OAc)2 / dppp
S-8
i
COOMe PH(O)Ph2 9, Pr2EtN
CO (1 atm), iPr2EtN
OTf
DMSO / MeOH
P(O)Ph2
DMSO
100 °C, 48 h
70 °C, 24 h
R-8
COOMe
S-14
S-15
68%
75%
R-14
R-15
45%
78%
Abb. 40: Synthese der enantiomerenreinen Binaphthyle 14 und 15.
Durch eine Pd-katalysierte Carbonylierung der Monotriflatverbindung 10 wäre 15
einfach zu realisieren. Jedoch berichteten Hayashi et al., dass aufgrund der
sterischen Hinderung durch die Phosphanoylgruppe das Binaphthyl 15 bei dieser
Ergebnisse und Diskussion
35
Reaktion nicht entsteht.[34] Daher musste die Esterfunktion vor der Phosphanoxideinheit ins Binaphthylgerüst eingeführt werden. Im Hinblick auf die zukünftige
enantiomerenreine Darstellung des Pyrazolyl-Phosphan-Liganden erfolgten die
anschließenden Synthesen der Vorstufen 14 und 15 nicht nur racemisch sondern
auch ausgehend vom S- bzw. R-Bistriflat 8.
Im ersten Reaktionsschritt wurde mittels Pd-katalysierter Carbonylierung eine
Triflatgruppe von 8 durch eine Methylestereinheit ersetzt.[34] Aufgrund des geringen
sterischen Anspruchs dieser Estergruppe erfolgte die Durchführung in großer
Verdünnung mit einer niedrigen CO-Konzentration, so dass eine Substitution der
zweiten Triflateinheit verhindert
werden sollte. Trotzdem konnte bei allen
Reaktionsansätzen
Monoester
neben
dem
14
auch
die
Entstehung
des
entsprechenden Diesters u. a. anhand der Methylgruppensignale NMR-spektroskopisch nachgewiesen werden (Tab. 3).
1
13
Tab. 3: Vergleich der H- und C-NMR-Daten von Mono- und Diester.
1
a)
H-NMR-Signal
Verbindung
COOMe
OTf
[ppm]
3.57 (s, CH3)
7.16–8.27 (12 Harom.)
13
b)
C-NMR-Signal
[ppm]
52.1 (CH3)
118.0 (q, CF3)
119.2–145.3 (20 Carom.)
166.6 (C=O)
COOMe
3.51 (s, CH3)
COOMe
7.08–8.21 (6 Harom.)
51.9 (CH3)
125.9–140.3 (10 Carom.)
167.1 (C=O)
a) Messfrequenz 600.1 MHz, Lösungsmittel CDCl3
b) Messfrequenz 150.9 MHz, Lösungsmittel CDCl3
Die beiden Verbindungen konnten säulenchromatographisch (EtOAc / n-Hexan 1:5)
sowohl voneinander als auch von weiteren Nebenprodukten, die aus nicht
umgesetztem Bistriflat 8 und hydrolysierten Verbindungen bestanden, getrennt
werden. Dadurch ergaben sich für den racemischen sowie für die enantiomerenreinen Monoester 14 meist nur durchschnittliche Ausbeuten[34] von 50%. Neben den
Ergebnisse und Diskussion
36
NMR-Daten (Tab. 3) lieferte auch das IR-Spektrum, aufgrund der intensiven Carbonylschwingungsbande bei 1732 cm-1, einen eindeutigen Beweis für die eingeführte
Estergruppe.
Im Anschluss wurde in einer weiteren Pd-katalysierten Reaktion die verbliebene
Triflateinheit durch eine Diphenylphosphanoylgruppe substituiert.[34] Nach säulenchromatographischer Aufarbeitung konnten das racemische sowie enantiomerenreine Binaphthyl 15 in Ausbeuten von bis zu 78% isoliert werden. In den NMRSpektren wurden sowohl das Methylgruppensignal der Esterfunktion bei 3.52 ppm im
1
H-NMR als auch das Signal für das Phosphoratom bei 28.6 ppm im
31
P-NMR-
Spektrum den Substituenten des Produktes zugeordnet. Des Weiteren gelang es,
aus MeOH gelbliche Kristalle der racemischen Verbindung 15 für die Röntgenstrukturanalyse zu erhalten (Abb. 41).
Abb. 41: Kristallstruktur des racemischen Binaphthylesters 15 als MeOH-Addukt.
Die triklinen Kristalle von Binaphthyl 15 besitzen die Raumgruppe P 1. Anhand der
Struktur ist ersichtlich, dass ein Lösungsmittelmolekül über eine klassische
Wasserstoffbrückenbindung (1.830 Å) an das Sauerstoffatom des Phosphanoxidsubstituenten gebunden ist. Die beiden Naphthyleinheiten sind, ähnlich wie bei der
Acetylverbindung 12, um einen Winkel von 79.9 ° gegeneinander verdreht . Ebenso
wird hier die fast parallele Ausrichtung eines Phenylrings der Phosphanoylgruppe
zum Naphthylring mit Estereinheit durch einen Winkel von 17.4 ° zwischen den
Ergebnisse und Diskussion
37
Ebenen und einem Abstand von dC29-C11 = 3.180 Å bestimmt. Die räumliche
Anordnung der einzelnen Moleküle erfolgt durch Ausbildung von intermolekularen
nichtklassischen H-Brücken (Abb. 42).
Abb. 42: H-Brückenbildung zwischen den Molekülen sowie dem Lösungsmittel MeOH.
Dabei wechselwirkt das Carbonylsauerstoffatom der Estergruppe sowohl mit einem
Methylproton einer benachbarten Esterfunktion (2.502 Å) als auch mit einem
Phenylproton des Phosphanoylsubstituenten eines weiteren Nachbarmoleküls
(2.521 Å). Auch das Lösungsmittel MeOH bildet eine weitere nichtklassische
Wasserstoffbrückenbindung (2.361 Å) zwischen dem Sauerstoffatom und einem
Proton in 6-Position eines benachbarten methylesterfunktionalisierten Naphthylsystems aus.
Ergebnisse und Diskussion
Die
weiteren
Umsetzungen
38
des
Binaphthylesters
15
zur
entsprechenden
Carbonsäure 16 bzw. der Acetylverbindung 12 wurden anschließend sowohl mit der
racemischen Verbindung als auch mit dem S-Enantiomer durchgeführt.
Durch basenkatalysierte Hydrolyse (Verseifung) des Esters S-15 konnte die
enantiomerenreine Binaphthylcarbonsäure S-16 als weißer Feststoff in Ausbeuten
von über 90% isoliert werden (Abb. 43).
40%ige
COOMe
KOH-Lösung
P(O)Ph2
MeOH
COOH
P(O)Ph2
65 °C, 12 h
S-15
S-16
94%
Abb. 43: Synthese der enantiomerenreinen Binaphthylcarbonsäure S-16.
Im IR-Spektrum ließ sich die neu entstandene Säurefunktion aufgrund der Valenzschwingungsbanden für die OH-Gruppe bei 3427 cm-1 und für die Carbonylgruppe
bei 1722 cm-1 nachweisen. Außerdem wurde ein Signal für das Carbonylkohlenstoffatom im
13
C-NMR-Spektrum bei 171.5 ppm beobachtet. Aus EtOAc konnten durch
langsames Verdunsten des Lösungsmittels farblose Kristalle der Verbindung S-16
isoliert und anschließend röntgenstrukturanalytisch untersucht werden (Abb. 44). Die
enantiomerenreine Carbonsäure S-16 kristallisiert in der monoklinen Raumgruppe I2.
Aufgrund der nahezu senkrechten Anordnung (Torsionswinkel 93.4 °) beider Naphthyleinheiten zueinander, kann es zur Ausbildung einer klassischen Wasserstoffbrückenbindung mit einer Länge von 1.514 Å zwischen dem Sauerstoffatom des
Phosphanoylsubstituenten und dem Proton der Säuregruppe kommen. Diese
intramolekulare H-Brücke könnte ein Grund für die deutliche Verschiebung des
Phosphoratomsignals zu tieferem Feld (35.6 ppm) im
31
P-NMR-Spektrum sein. Eine
fast parallele Ausrichtung der Carbonsäurenaphthyleinheit zu einem Phenylring der
Phosphanoxidgruppe wird auch bei S-16 durch den kleinen Winkel von 9.2 °
zwischen den Ebenen deutlich.
Ergebnisse und Diskussion
39
Abb 44: Kristallstruktur von Binaphthyl S-16 mit H-Brückenbindungen.
Die Aneinanderlagerung der einzelnen Moleküle zum Aufbau einer dreidimensionalen Struktur erfolgt über intermolekulare nichtklassische Wasserstoffbrücken.
Diese werden sowohl zwischen dem Carbonylsauerstoffatom und einem p-Phenylproton (2.457 Å) als auch zwischen dem Sauerstoffatom der Phosphanoxideinheit
und einem o-Phenylproton (2.484 Å) eines benachbarten Moleküls ausgebildet. Eine
Dimerisierung, wie beim Binaphthylester 15, konnte in diesem Fall vermutlich
aufgrund der Chiralität der Verbindung und der damit verbundenen Ausrichtung der
einzelnen Moleküle nicht beobachtet werden. Die optische Reinheit des Binaphthyls
S-16 wurde durch die Bestimmung des spezifischen Drehwertes [α ]21
D = - 204 mit
einer Konzentration von 0.54 g / 100 ml in CHCl3 überprüft.
Die anschließende Synthese des Carbonsäurechlorids S-17 erfolgte durch Umsetzung des Binaphthyls S-16 mit Thionylchlorid (Abb. 45).[39a] Nach Entfernen des
im Überschuss eingesetzten anorganischen Säurechlorids konnte die Verbindung
S-17 als gelber schaumartiger Feststoff isoliert werden. Aufgrund der hohen Empfindlichkeit dieses Produktes gegenüber H2O und protischen Lösungsmitteln
erfolgte keine weitere Aufreinigung, weshalb bei dieser Reaktion ein quantitativer
Umsatz angenommen wurde.
Ergebnisse und Diskussion
40
SOCl2
COOH
P(O)Ph2
COCl
P(O)Ph2
80 °C, 2-3 h
S-17
S-16
quantitativ
Abb. 45: Synthese des enantiomerenreinen Binaphthylcarbonsäurechlorids S-17.
Daher erfolgte auch die Charakterisierung hauptsächlich durch wenige spektroskopische Messungen. Im 1H-NMR-Spektrum (Abb. 46) lagen die Signale für die
aromatischen Protonen von S-17 im Bereich von 6.9–9.5 ppm. Nach der Integration
der einzelnen Signale wurde allerdings ein etwas mehr als doppelt so hoher Wert wie
erwartet erhalten (46 statt 22 Harom.).
CDCl3
10
8
6
4
2
1
2
10
0
9
2 2 3 2 6 1 20
8
3
22
7
δ [ppm]
1
Abb. 46: H-NMR-Spektrum des Säurechlorids S-17.
6
Ergebnisse und Diskussion
41
Eine unvollständige Umsetzung der Säure S-16 oder die Entstehung anderer
Binaphthylsysteme durch Abspaltung der einzelnen Substituenten konnte durch das
31
P-NMR-Spektrum von S-17 ausgeschlossen werden. Das Spektrum (Abb. 47)
zeigte nur ein Signal bei 66.2 ppm, wobei eine Verschiebung von ~ 30 ppm zu
66.2
35.6
tieferem Feld ungewöhnlich groß war.
S-16
S-17
100
80
60
40
20
0
δ [ppm]
100
80
60
40
20
0
δ [ppm]
Abb. 47: Vergleich der
31
P-NMR-Spektren von Säurechlorid S-17 und Säure S-16.
Solche hohen Werte für die chemische Verschiebung werden auch bei Phosphoniumverbindungen wie z. B. [Ph3P+-OMe][CF3SO3-] beobachtet.[39b] Daher wurde
angenommen, dass bei der Umsetzung der Säure S-16 mit Thionylchlorid ein
ähnliches System (Abb. 48) entstanden ist. Aufgrund der doppelten Protonenanzahl
im
1
H-NMR-Spektrum wurde außerdem angenommen, dass zwei verschiedene
Formen vorliegen müssen. Des Weiteren könnte das breite Singulett bei 9.5 ppm
einer OH-Gruppe am Phosphoratom zugeordnet werden. Durch eine mögliche
elektronische Ähnlichkeit der Säurechlorideinheit am Binaphthylgerüst wäre es
denkbar, dass im
31
P-NMR-Spektrum, anstelle von zwei Signalen bei minimal unter-
schiedlichen δ-Werten, nur ein Signal beobachtet werden kann.
Ergebnisse und Diskussion
42
O
Cl
O
HO
P
Cl
+
Cl
S
O
HO
-
P
O
Cl
+
-
Ph
Ph
Ph
Ph
I
II
- HCl
- HCl
O
O
O
O
P
Cl
+
Ph
S
-
P
Ph
+
O
O
Cl
-
Ph Ph
Abb. 48: Postulierte Strukturen für das Säurechlorid S-17.
Bei den vorgeschlagenen Formen I und II wäre es auch möglich, dass sich durch
eine intramolekulare Abspaltung von HCl Binaphthylsysteme mit entsprechender
Sieben- oder Neunringstruktur ausbilden. Eine genauere Strukturaufklärung des
Säurechlorids S-17 wurde wegen der zu großen Hydrolyseempfindlichkeit bisher
nicht durchgeführt. Schon in Spuren vorhandenes H2O im Lösungsmittel CDCl3 war
ausreichend, um einen Hydrolysepeak im
31
P-NMR-Spektrum bei ~ 35 ppm nach-
zuweisen. Aus diesem Grund wird die Verbindung S-17 auch weiterhin vereinfacht
als Binaphthylsystem mit Säurechloridfunktion in 2-Position und Phosphanoylgruppe
in 2’-Position abgebildet.
Ergebnisse und Diskussion
43
Im Anschluss erfolgte die Umsetzung des Säurechlorids S-17 zur Acetylverbindung
S-12 mit einem zweifachen Überschuss an Lithiumdimethylcuprat (Abb. 49).[38c]
COCl
2 eq. Me2CuLi
C(O)Me
P(O)Ph2
N2, THF / Et2O
P(O)Ph2
-20 °C, 4 h
S-17
S-12
56%
Abb. 49: Synthese der enantiomerenreinen Ligandvorstufe S-12.
Obwohl
diese
Reaktion
unter
Schutzgasatmosphäre
und
mit
absolutierten
Lösungsmitteln durchgeführt wurde, trat eine leichte Grünfärbung des Reaktionsgemisches auf, was auf die Entstehung von Kupfer(II)salzen und somit auf eine
oxidative Zersetzung des Cuprats hindeutete. Daher erfolgte nach nur zweistündiger
Reaktionsdauer die Aufarbeitung durch Zugabe von gesättigter NH4Cl-Lösung und
anschließender Extraktion mit Et2O. Weiterhin wurde festgestellt, dass sich die
Kupfersalze selbst durch mehrmaliges Waschen mit NH4Cl-Lösung und dest. H2O
nicht vollständig entfernen ließen. Erst durch Zugabe von wässriger Ammoniaklösung
konnten sie in Form des tiefblauen [Cu(NH3)4]2+ stärker gebunden und damit leichter
entfernt werden. Die NMR-spektroskopische Untersuchung des gelben öligen
Rückstandes ergab, dass trotz der kurzen Reaktionszeit von 2 h eine Umsetzung
zum Acetylbinaphthyl S-12 stattgefunden hat. Im
31
P-NMR-Spektrum konnte neben
dem Signal für das durch Hydrolyse entstandene Amid S-24 bei 31.6 ppm ein
weiteres für S-12 bei 28.4 ppm beobachtet werden (Abb. 50). Auch im 1H-NMRSpektrum deutete das Methylgruppensignal bei 2.37 ppm auf die Entstehung des
Produktes S-12 hin. Die Integration der Signale ergab ein Verhältnis der beiden
Hauptverbindungen von etwa 40% (S-12) zu 60% (S-24), weshalb angenommen
wurde, dass eine Verdopplung der Reaktionszeit für einen vollständigen Umsatz des
Säurechlorids S-17 ausreichen würde.
44
31.6
Ergebnisse und Diskussion
28.4
C(O)NH2
P(O)Ph2
C(O)Me
P(O)Ph2
80
60
40
20
0
-20
δ [ppm]
Abb. 50:
31
P-NMR-Spektrum des gelben öligen Rückstandes aus dem ersten Ansatz.
Daher wurde bei weiteren Ansätzen das Reaktionsgemisch vier Stunden bei maximal
- 20 °C gerührt und mittels Dünnschichtchromatograp hie auf vollständigen Umsatz
getestet bevor eine Hydrolyse mit wässriger Ammoniaklösung erfolgte. Das bei der
Aufarbeitung entstandene Amid S-24 konnte zunächst durch eine säulenchromatographische Aufreinigung vom Produkt S-12 abgetrennt und als gelbes Öl isoliert
werden. Die NMR-spektroskopischen Untersuchungen ergaben ein Signal bei
28.8 ppm im 31P-NMR-Spektrum und einen deutlichen Signalsatz (~ 75%) für S-12 im
1
H-NMR-Spektrum. Jedoch konnte zusätzlich ein kleinerer Signalsatz (~ 25%) für
eine weitere Binaphthylverbindung identifiziert werden (Abb. 51). Der Vergleich mit
anderen Spektren ergab, dass es sich bei diesem Binaphthylsystem um den Ester
S-15 handeln musste. Die Lage und das Verhältnis der Integrale des Methylgruppensignals bei 3.53 ppm und einem Aromatensignal bei 8.02 ppm stimmte
eindeutig mit den Spektrendaten von S-15 überein. Bei genauerer Betrachtung
konnte auch im
31
P-NMR-Spektrum eine kleine Schulter am Signal bei 28.8 ppm
festgestellt werden, die auf den Ester S-15 hindeutete (Abb. 52).
Ergebnisse und Diskussion
45
CD Cl 3
S-12
2.38
S-15
0.34
8,0
7,8
7,6
7,4
7,2
7,0
S-12
6,8
3.53
8,2
1.00
CD Cl3
S-15
0.98
8
6
2.97
4
2
0
δ [ppm ]
1
28.8
Abb. 51: H-NMR-Spektrum des nach der Säulenchromatographie isolierten gelben Öls.
S -1 2
80
70
60
50
40
30
20
10
0
-1 0 -2 0
S -1 5
34
32
30
28
26
δ [p p m ]
Abb. 52:
31
P-NMR-Spektrum des nach der Säulenchromatographie isolierten gelben Öls.
Ergebnisse und Diskussion
46
Bei sämtlichen Umsetzungen von Verbindung 17 mit Lithiumdimethylcuprat wurde
die Bildung des Esters 15 in Mengen von 3% bis 70% beobachtet. Ein plausibler
Reaktionsmechanismus zur Erklärung dieses Befundes konnte bislang nicht
gefunden werden. Es kann nur vermutet werden, dass die ungeklärte Struktur von 17
dabei eine entscheidende Rolle spielt.
Am Ende ließ sich die Acetylverbindung S-12 vom Nebenprodukt aufgrund ähnlicher
Rf-Werte erst durch eine mehrmalige säulenchromatographische Aufreinigung in
Ausbeuten von bis zu 56% als farbloser Feststoff abtrennen. Neben den NMRspektroskopischen Daten für die chemische Reinheit lieferte der Wert von [α ]D = - 29
23
(c = 0.5, MeOH) einen Anhaltspunkt für die Enantiomerenreinheit von S-12.
Auf diesem Reaktionsweg unter Verwendung des Cuprates ist die Acetylverbindung
S-12 zwar im Vergleich zur Umsetzung mit Grignard-Reagenz schnell zugänglich,
jedoch bedürfen die ungeklärte Struktur des Säurechlorids 17 und die unerwartete
Entstehung des Esters 15 weiterer Untersuchungen. Daher wird im folgenden Kapitel
kurz auf weitere Synthesemöglichkeiten eines Acetylbinaphthyls 12 bzw. einer
analogen Verbindung mit 1,3-Diketonstruktur eingegangen, bevor die Fertigstellung
des chiralen P,N-Liganden durch den Aufbau des Pyrazolrings und die anschließende Reduktion des Phosphanoxids beschrieben wird.
3.2.4 Weitere Versuche zur Synthese des Acetylbinaphthyls 12 bzw. analoger
Strukturen für den Aufbau des Pyrazolringes
Eine weitere Möglichkeit zur Synthese von Methylketonen ohne die Verwendung von
metallorganischen Verbindungen ist die Umsetzung von Carbonsäureestern mit
sulfinylstabilisierten Carbanionen. Auf diese Weise reagierte in einer literaturbekannten
Testreaktion
Methylbenzoat
mit
dem
Natriumsalz
von
DMSO
(Dimsylnatrium) zu einer entsprechenden β-Ketosulfoxidzwischenstufe, welche
anschließend bei RT mit Zinkpulver und Eisessig zu Acetophenon reduziert werden
konnte (Abb. 53).[40]
Ergebnisse und Diskussion
O
i) NaH / DMSO
OMe
47
O
ii) verd. HCl
O
i) Zn / Eisessig
S
ii) NaHCO3
O
Abb. 53: Synthese von Acetophenon über eine β-Ketosulfoxidzwischenstufe.
Die Übertragung dieser Reaktion auf das asymmetrische Binaphthylsystem R-15
zeigte jedoch, dass im ersten Schritt keine β-Ketosulfoxidstruktur gebildet wurde
(Abb. 54). Nach der Aufarbeitung konnten die Signale im
31
P-NMR-Spektrum haupt-
sächlich dem Edukt R-15 und der Säure R-16 zugeordnet werden (Abb. 55).
i) NaH / DMSO
ii) verd. HCl
COOMe
P(O)Ph2
S
O
THF, RT, 4 h
O
P(O)Ph2
R-15
Abb. 54: Versuch zur Synthese eines β-ketosulfoxylsubstituierten chiralen Binaphthyls.
Auch im
1
H-NMR-Spektrum gab es keinen Hinweis auf die Entstehung der
Zwischenstufe, da sowohl ein entsprechendes Methylgruppensignal bei ~ 2.8 ppm
als auch die Signale für die diastereotopen Methylenprotonen zwischen 4 ppm und
5 ppm fehlten. Die sterische Abschirmung durch die Phosphanoyleinheit und die
stark basischen Bedingungen führten vermutlich eher zur Verseifung des Esters als
zu einer Acylierung des Carbanions. Der sterische Aspekt scheint auch den
entscheidenden Einfluss auf den Reaktionsverlauf zu haben, da in anschließenden
von T. Jozak durchgeführten Umsetzungen des entsprechenden symmetrischen
Binaphthyldiesters mit Dimsylnatrium eine di-β-ketosulfoxylsubstituierte Verbindung
nahezu quantitativ (98%) isoliert werden konnte.
48
35.5
28.6
Ergebnisse und Diskussion
R-15
R-16
100
50
0
-50
δ [ppm]
Abb. 55:
31
P-NMR-Spektrum des bei der Umsetzung von R-15 mit Dimsylnatrium entstandenen
orangefarbenen Öls.
Des Weiteren wurde auch versucht durch eine Kondensation von 2-Butanon mit dem
Ester R-15 in Gegenwart von NaOMe als Base eine 1,3-Diketoneinheit als
strukturelle Alternative zur Acetylgruppe ins Binapthylgerüst einzubauen (Abb. 56).[41]
Die anschließende Zyklisierungsreaktion mit Hydrazin würde zu einem Phosphanoylbinaphthyl mit ethylsubstituierten Pyrazolring führen.
i) NaOMe / 2-Butanon
ii) CH3COOH
COOMe
P(O)Ph2
O
N2, THF, 70 °C, 6 h
O
P(O)Ph2
R-15
Abb. 56: Versuch zur Synthese eines chiralen Binaphthyls mit 1,3-Diketoneinheit.
Ergebnisse und Diskussion
49
Allerdings konnte NMR-spektroskopisch auch bei dieser Reaktion nach der
Aufarbeitung neben dem Edukt R-15 nur die Entstehung der Binaphthylcarbonsäure
R-16 zu ~ 75% nachgewiesen werden. Vermutlich waren hier ebenfalls der sterische
Einfluss der Phosphanoylgruppe und die basischen Reaktionsbedingungen der
Grund für die bevorzugte Verseifung der Esterfunktion. Durch die Isolierung der
Verbindung R-16 in Form eines farblosen Feststoffes war es möglich, die optische
Reinheit durch den Drehwert [α ]D = + 191 (c = 0.54, CHCl3) zu bestimmen.
21
Mit diesen Reaktionen konnte zwar lediglich gezeigt werden, dass bisher noch keine
Alternative zu den bereits vorgestellten Umsetzungen mit Metallorganylen zur
Synthese des Acetylbinapthyls 12 gefunden wurde. Jedoch ließ sich zumindest die
Umsetzung mit Dimsylnatrium erfolgreich auf symmetrisch substituierte Binaphthyle
zur Darstellung von Bispyrazolylverbindungen übertragen. Da auch analoge 1,3-Diketonstrukturen für den Aufbau der N-heterozyklischen Einheit über das Phosphanoylbinaphthyl 15 nicht zugänglich sind, gilt es zukünftig, die Methoden mit Grignardreagenzien wie MeMgI bzw. dem Gilman-Cuprat zu optimieren.
3.2.5 Synthese des chiralen Pyrazolylphosphanylbinaphthylliganden S-20
Die Umsetzungen aromatischer Acetylverbindungen mit DMFDMA sind auch für die
Durchführung in der Mikrowelle im Arbeitskreis Thiel bereits etabliert. Die dabei
entstehenden Aryldimethylaminopropenone zyklisieren in Gegenwart von Hydrazin
zu den entsprechenden Arylpyrazolen.[17a]
Ausgehend vom bereits isolierten Acetylbinaphthyl S-12 konnte somit die Synthese
des neuen chiralen P,N-Binaphthylliganden durch folgende Reaktionsschritte
komplettiert werden (Abb. 57).
Ergebnisse und Diskussion
50
N
C(O)Me
DMFDMA
P(O)Ph2 140-160 °C, 15 h
O
Ph2(O)P
S-18
S-12
70%
N2H4xH2O
EtOH, 80 °C, 15 h
N
NH
PPh2
SiHCl3 , Et3N
N
NH
P(O)Ph2
Toluol, 120 °C, 40 h
S-20
S-19
54%
75%
Abb. 57: Abschließende Reaktionsschritte zur Synthese des chiralen P,N-Liganden S-20.
Der Versuch die racemische Verbindung 12 in der Mikrowelle bei 360 W und kurzen
Reaktionszeiten von 2 min umzusetzen, war auch bei mehrmaliger Durchführung und
einem deutlichen Überschuss an DMFDMA nicht erfolgreich. Daher wurde im ersten
Reaktionsschritt die Kondensation von Binaphthyl S-12 mit dem Acetal als
Lösungsmittel in 15 h bei maximal 160 °C durchgefüh rt. Nach der Aufarbeitung
konnte die neue Verbindung (S)-2-(N,N-Dimethylaminoprop-2-enon-1-yl)-2’-diphenylphosphanoyl-1,1’-binaphthyl als gelber Feststoff in Ausbeuten von 70% isoliert
werden. Anschließend wurde S-18 mit verschiedenen NMR-spektroskopischen
Messmethoden eindeutig charakterisiert. Eine Zuordnung der Signale für die entstandene Aminopropenoneinheit war sowohl im 1H-NMR-Spektrum mit Hilfe einer
H,H-COSY-NMR-Messung als auch im 13C-NMR-Spektrum möglich (Abb. 58).
Ergebnisse und Diskussion
13
51
C-NMR (CDCl3, 150.9 MHz): δ = 36.8, 44.6 (a), 97.8 (b),
125.4-143.6 (29 C arom. + c), 192.5 (d).
a
d
c
a
b
O
CDCl3
N
Ph2(O)P
c
a
a
b
9
8
7
6
5
4
3
2
1
0
δ [ppm]
1
13
Abb. 58: H-NMR-Spektrum und C-NMR-Daten von S-18.
Im
31
P-NMR-Spektrum wurde das Signal für den Phosphanoylsubstituenten bei
30.5 ppm beobachtet. Den Anhaltspunkt für die Enantiomerenreinheit von S-18
konnte der bei einer Konzentration von 0.1 g pro 100 ml CHCl3 ermittelte Drehwert
[α ]26D
= - 250 geben.
Die anschließende Umsetzung von S-18 mit Hydrazin-Monohydrat führte in
Ausbeuten von 75% zu dem pyrazolsubstituierten Phosphanoylbinaphthyl S-19. Die
für den Pyrazolring charakteristischen CH-Signale wurden im 1H-NMR-Spektrum
(Abb. 59) bei 5.79 ppm (H4-Pz) und im Aromatenbereich zwischen 7.16 ppm und
7.24 ppm (H5-Pz) beobachtet, wobei das zweite Signal ebenfalls nur durch die
Aufnahme eines H,H-COSY-NMR-Spektrums zugeordnet werden konnte. Allerdings
war in diesem Spektrum ein NH-Protonensignal auch im Bereich von 10–19 ppm
nicht zu beobachten. Der Nachweis dafür erfolgte aber durch eine im IR-Spektrum
vorhandene NH-Valenzschwingungsbande bei 3145 cm-1. Das Signal für die
Phosphanoxidgruppe wurde im 31P-NMR-Spektrum bei 31.7 ppm erhalten.
Ergebnisse und Diskussion
52
C D C l3
4
5
NH
P(O)Ph2
N
H 5-Pz
H 4-Pz
C DC l 3
8
7
6
5
M eO H
18
16
14
12
10
8
6
4
2
0
δ [ppm ]
1
Abb. 59: H-NMR-Spektrum des pyrazolsubstituierten Binaphthyls S-19.
Zusätzlich gelang es aus MeOH beigefarbene Kristalle von S-19 zu isolieren, welche
anschließend röntgenstrukturanalytisch untersucht wurden. Die orthorhombischen
Kristalle der chiralen Ligandvorstufe S-19 besitzen die Raumgruppe P212121. Anhand
der Struktur (Abb. 60) wird ersichtlich, dass die Naphthyleinheiten um einen Winkel
von 92.4 ° gegeneinander verdreht sind und somit na hezu senkrecht zueinander
stehen. Dadurch ist die Ausbildung von intermolekularen klassischen Wasserstoffbrückenbindungen (1.857 Å) zwischen den NH-Protonen und den Phosphanoylsauerstoffatomen benachbarter Moleküle möglich. Die räumliche Anordnung wird
zusätzlich durch weitere nichtklassische H-Brücken (2.615 Å) zwischen einem Proton
einer phosphanoxidsubstituierten Naphthyleinheit und dem zweiten Stickstoffatom
am Pyrazolring eines Nachbarmoleküls definiert.
Neben der Überprüfung der chemischen Reinheit durch die erwähnten Methoden
wurde die Enantiomerenreinheit mit Hilfe des Drehwertes [α ]23
D = - 160 mit c = 0.1 in
MeOH bestimmt.
Ergebnisse und Diskussion
53
Abb. 60: Kristallstruktur von S-19 mit intermolekularen H-Brücken.
Als letzter Reaktionsschritt der P,N-Ligandsynthese erfolgte die Reduktion des
Phosphanoxids S-19 zum entsprechenden Phosphan.[14b, 34] Nach der Umsetzung mit
Trichlorsilan konnte der Phosphanligand S-20 vor allem im
31
P-NMR-Spektrum
eindeutig identifiziert werden, da das Signal für das Phosphoratom um ~ 45 ppm zu
- 13.7
höherem Feld verschoben wurde und somit bei - 13.7 ppm zu finden war (Abb. 61).
N
NH
PPh2
S-20
80
60
40
20
0
-2 0
-4 0
-6 0
δ [p p m ]
Abb. 61:
31
P-NMR-Spektrum des neuen chiralen Phosphanliganden S-20.
-8 0
Ergebnisse und Diskussion
54
CDCl3
Toluol
Et3N×HCl
Toluol
8,0
12
11
7,5
10
7,0
9
6,5
8
6,0
7
5,5
6
5
4
3
2
1
0
δ [ppm ]
1
Abb. 62: H-NMR-Spektrum des neuen chiralen Phosphanliganden S-20.
Im 1H-NMR-Spektrum waren neben den Signalen für S-20 noch zusätzliche Signale
für das bei der Reaktion entstandene Triethylammoniumhydrochlorid sowie Reste
des Lösungsmittels Toluol vorhanden (Abb. 62). Bei der Aufarbeitung konnte das
Salz auch durch eine Schutzgasfiltration über Celite nicht vollständig abgetrennt
werden. Die geringe Ausbeute von 54% für das Produkt könnte ebenfalls darauf
zurückzuführen sein, dass das Phosphan S-20 nach der Filtration nur sehr schwer
von der Celiteschicht gewaschen werden konnte. Des Weiteren wurde in Lösung
eine rasche Rückoxidation des Phosphanliganden S-20 beobachtet. Das erneute
Vermessen der NMR-Probe nach 24 h ergab trotz entgastem CDCl3 neben dem
Signal für den Liganden bei - 13.7 ppm ein zusätzliches Signal bei 31.7 ppm für die
Phosphanoxidverbindung S-19. Die protonierten Massen beider Spezies waren auch
im MALDI-TOF-Massenspektrum nachweisbar (Abb. 63).
Ergebnisse und Diskussion
55
Rückoxidation von S-20 nach 24 h
70000
60000
Intensität [a.u.]
50000
[S-19H]
[S-20H]
40000
+
+
521.32
505.10
30000
20000
10000
0
490
500
510
520
530
m/z
Abb. 63: Im MALDI-TOF-Massenspektrum nachweisbare Rückoxidation von S-20.
Nach nur drei Tagen konnte im
31
P-NMR-Spektrum ausschließlich das Phosphanoyl-
binaphthyl S-19 identifiziert werden. Aufgrund dieser Beobachtung wurden sowohl
eine Aufreinigung des Liganden S-20 sowie dessen weitere Umsetzung zu
Übergangsmetallkomplexen (siehe Kapitel 3.4) erheblich erschwert.
In einer achtstufigen Synthese ist es gelungen einen neuen chiralen Phosphanliganden S-20 ausgehend vom Bistriflat S-8 mit einer Gesamtausbeute von ~ 8% zu
isolieren. Seine in Lösung beobachtete schnelle Rückoxidation zu S-19 war jedoch
der Grund, weshalb weder die Synthese des entsprechenden R-Enantiomers
durchgeführt wurde noch abgesehen von einem einzelnen Komplexierungsversuch
mit PdCl2(PhCN)2 (siehe Kapitel 3.4) weitere Untersuchungen erfolgten. Durch den
Einbau anderer Heterozyklen als N-Donoreinheit sollte im Anschluss versucht
werden oxidationsstabilere Phosphanliganden zu erhalten.
Ergebnisse und Diskussion
56
3.3 Synthese eines Triazolylbinaphthylliganden 27
Für die analoge Synthese eines Phosphanylbinaphthyls mit Triazolring als
N-Donoreinheit wird das literaturbekannte[16] 2-Carbamoyl-2’-diphenylphosphanoyl1,1’-binaphthyl (24) als zentrale Ligandvorstufe benötigt (Abb. 64). Da das Amid 24
bereits bei der Verseifung des Nitrils 11 zur Darstellung der Säure 16 als
Hauptprodukt nachgewiesen werden konnte (siehe Kapitel 3.2.3), wurde dieser
Befund aufgegriffen und nach Optimierung der Reaktionsbedingungen zur gezielten
Darstellung von 24 genutzt.
C(O)NH2
P(O)Ph2
24
Abb. 64: 2-Carbamoyl-2’-diphenylphosphanoyl-1,1’-binaphthyl (24) als zentrale Ligandvorstufe.
Die anschließenden Umsetzungen mit DMFDMA und Hydrazin-Monohydrat zum
Aufbau eines Triazols sind zwar in der Literatur[18] für verschieden substituierte
Phenylverbindungen beschrieben, jedoch fehlen Angaben zu analogen Reaktionen
mit größeren aromatischen Systemen. Daher wurde die Durchführbarkeit zunächst
anhand der Synthese des 3-Naphth-2-yl-1H(1,2,4)triazols (23) getestet, bevor eine
Übertragung der Reaktionen auf das unsymmetrische Binaphthyl 24 erfolgte.
3.3.1 Synthese von 3-Naphth-2-yl-1H(1,2,4)triazol (23)
Das Naphthyltriazol 23 ist zwar schon seit 1969 literaturbekannt, jedoch erfolgte die
Darstellung damals in einer so genannten „Relais-Synthese“ ausgehend von
4-Amino-(1,2,4)triazol über eine N-Triazolylamidinzwischenstufe. Die abschließende
Umsetzung mit Chlorameisensäureethylester führte in Ausbeuten von 97% zu
Verbindung 23 (Abb. 65).[42]
Ergebnisse und Diskussion
N
N
57
N
RCN / NaOEt
N
H
N
EtOOCCl
N
N
N
H2N
N
R
NH2
R
R = 2-Naphthyl-
N
23
97%
88%
Abb. 65: Relais-Synthese von Naphthyltriazol 23.
Ausgehend von käuflich erworbenen 2-Naphthonitril sollte das Triazol 23 über den in
Abschnitt 3.3 beschriebenen Reaktionsweg in drei Stufen ebenso schnell und in
ähnlich guten Ausbeuten zu realisieren sein (Abb. 66).
O
CN
KOH
t
NH2
BuOH, 82 °C, 3 h
21
81%
DMFDMA
N
120 °C, 5 h
H
N
N
O
N2H4xH2O
N
N
AcOH, 80 °C, 4 h
23
22
87%
99%
Abb. 66: Alternative Synthese von 3-Naphth-2-yl-1H(1,2,4)triazol (23).
Durch die Verseifung des 2-Naphtonitrils mit KOH in tert.-Butanol war das Amid 21
als farbloser Feststoff in Ausbeuten von 81% problemlos zugänglich.[43a] Mit Hilfe der
NMR-Spektroskopie konnte die Verbindung 21 nach dem Vergleich mit den Literaturdaten[43b] eindeutig charakterisiert werden. Die anschließende Umsetzung von 21 mit
DMFDMA führte zur bisher unbekannten Amidinzwischenstufe 22, die nahezu
Ergebnisse und Diskussion
58
quantitativ (99%) als hellgelber Feststoff isoliert wurde. Die Signale im 1H-NMRSpektrum (Abb. 67) konnten durch verschiedene Messmethoden wie H,H- und C,HCOSY- sowie NOESY-Experimente eindeutig dem N’-Naphthoyl-N,N-dimethylformamidin (22) zugeordnet werden.
H
O
8
8a
1
2
7
6
5'
N
3'
3
4a
5
H 3'
22
(Z )-C H 3
H3
H8
H6 H7
(E )-C H 3
C D C l3
9,0
8,5
10
8,0
8
7,5
7,0
6
4
2
δ [p pm ]
1
Abb: 67: H-NMR-Spektrum von N’-Naphthoyl-N,N-dimethylformamidin (22).
CH3
CH3
4
H4 H5
H1
N
0
Ergebnisse und Diskussion
Neben den
59
13
C-NMR-Daten lieferte auch die Elementaranalyse einen Beweis für die
Entstehung und die chemische Reinheit von 22 (Tab. 4).
Tab. 4:
13
C-NMR-Daten und Elementaranalyse von 22.
13
C-NMR-Daten
Verbindung
22
H
8a
2
6
5'
N
3'
4a
5
N
CH3 (C7), 126.2 (C3), 127.5, 127.6, 127.7
CH3
3
4
ber. (gef.) [%]
35.3 ((E)-CH3), 41.4 ((Z)-CH3), 126.1
1
7
C, H, N-Gehalt
[ppm]
O
8
a)
C 74.31 (74.22)
(C4,5,6), 129.5 (C8), 130.9 (C1), 132.8,
H 6.24 (6.26)
134.2, 135.3 (C2,4a,8a), 160.8 (C3‘),
N 12.38 (12.34)
177.8 (C5‘)
a) Messfrequenz 150.9 MHz, Lösungsmittel CDCl3
Im letzten Reaktionsschritt erfolgte durch Umsetzung des Amidins 22 mit HydrazinMonohydrat der Aufbau des Heterozyklus. Das naphthylsubstituierte Triazol 23
wurde als farbloser feinkristalliner Feststoff in Ausbeuten von 87% isoliert. In der
Literatur[42] von 1969 waren zur Charakterisierung von 23 hauptsächlich Angaben
zum Schmelzpunkt und zur elementaren Zusammensetzung zu finden. Ein Vergleich
mit diesen Daten ergab ein ähnlich gutes Ergebnis für die Elementaranalyse aber
einen fast doppelt so hohen Wert für den Schmelzpunkt (Tab. 5).
Tab. 5: Vergleich der erhaltenen Werte von 23 mit Literaturdaten.
C, H, N-Gehalt [%]
ber.
[42]
Lit.
Schmelzpunkt [°C]
gef.
C 73.83
C 73.55
C 73.61
H 4.65
H 4.92
H 4.48
N 21.53
N 21.42
N 21.64
[42]
Lit.
71 (H2O)
ermittelt
135–138
Das Triazol 23 konnte aber auch mit modernen spektroskopischen Methoden
eindeutig nachgewiesen werden. Im IR-Spektrum deutete eine NH-Valenzschwingungsbande bei 3149 cm-1 auf den entstandenen Heterozyklus hin. Des
Weiteren konnte ein Singulett im 1H-NMR-Spektrum bei 8.30 ppm dem Proton am
Triazolring und ein sehr breites Signal bei ~ 14 ppm der NH-Gruppe der Verbindung
23 zugeordnet werden (Abb. 68). Auch die Signale für die im Heterozyklus
Ergebnisse und Diskussion
60
13
vorhandenen Kohlenstoffatome wurden im
C-NMR-Spektrum bei 147.7 ppm und
159.4 ppm beobachtet (Abb. 69).
Damit konnte bewiesen werden, dass sich die Umsetzungen mit DMFDMA und
Hydrazin-Monohydrat problemlos auf größere aromatische Systeme wie dem des
2-Naphthoamids (21) übertragen lassen und in diesem Fall in guten Ausbeuten zu
einem naphthylsubstituierten Triazol 23 führen. Daher sollten diese Reaktionen im
Folgenden auch beim Binaphthylamid 24 angewendet werden.
5'
N
H5'
8
7
NH
1
8a
2
6
3'
N
3
5
4a
4
23
H1
H8 H4
H5
H3
H6 H7
CDCl3
9,0
8,5
8,0
7,5
7,0
CDCl3
NH
16
14
12
10
8
δ [ppm]
1
Abb. 68: H-NMR-Spektrum von 3-Naphth-2-yl-1H(1,2,4)triazol (23).
6
Ergebnisse und Diskussion
61
C4 C
6 ,7
5'
N
8
7
NH
1
8a
2
6
C 5 ,8
3'
C1
N
C3
3
5
4a
4
23
C 2 ,4 a ,8
C 2 ,4 a ,8
C 5'
C 3'
170
160
150
140
130
120
110
δ [p p m ]
Abb 69:
13
C-NMR-Spektrum von 3-Naphth-2-yl-1H(1,2,4)triazol (23).
3.3.2 Synthese von 2-Carbamoyl-2’-diphenylphosphanoyl-1,1’-binaphthyl (24)
als zentrale Ligandvorstufe
Ausgehend vom racemischen Binaphthylnitril 11 gelang es, unter analogen
Bedingungen[43a] wie bei der Reaktion mit 2-Naphthonitril, ein amidsubstituiertes
Phosphanoylbinaphthyl 24 zu synthetisieren (Abb. 70).
CN
P(O)Ph2
11
t
KOH
C(O)NH2
BuOH, 82 °C, 20 h
P(O)Ph2
24
85%
Abb. 70: Synthese des racemischen Binaphthylamids 24.
Ergebnisse und Diskussion
62
Das in EtOAc gelöste Amid 24 konnte durch Zugabe von wenig n-Hexan in Form
gelblicher Kristalle mit Ausbeuten von bis zu 85% isoliert werden. In den 1H- bzw.
13
C-NMR-Spektren deuteten sowohl die breiten Singuletts für die NH2-Protonen bei
5.95 ppm und 9.39 ppm als auch ein Signal für das Carbonylkohlenstoffatom bei
172.9 ppm auf den neuen Amidsubstituenten hin. Ein Signal für den Phosphanoylsubstituenten wurde im
31
P-NMR-Spektrum bei 31.6 ppm beobachtet. Neben den
spektroskopischen Daten lieferte auch die von den Kristallen angefertigte Röntgenstrukturanalyse einen Beweis für das entstandene Binaphthyl 24 (Abb. 71). Die
monoklinen Kristalle von 24 besitzen die Raumgruppe P21/c. Anhand der Struktur
wird ersichtlich, dass die Naphthyleinheiten, ähnlich wie bei den anderen Binaphthylen, um einen Winkel von 76.5 ° gegeneinander ve rdreht sind. Ebenso wird bei 24
eine nahezu parallele Ausrichtung eines Phenylrings der Phosphanoylgruppe zum
Naphthylring mit Amidgruppe beobachtet und durch einen Winkel von 9.1 ° zwischen
den Ebenen sowie einem Abstand von dC27-C11 = 3.200 Å bestimmt.
Abb. 71: Kristallstruktur des racemischen Binaphthylamids 24.
Durch die freien Elektronenpaare an den Sauerstoffatomen der Phosphanoyl- bzw.
Carbonylgruppe kommt es aufgrund der Wechselwirkung mit benachbarten Protonen
zur Ausbildung von Wasserstoffbrückenbindungen (Abb. 72).
Ergebnisse und Diskussion
63
Abb. 72: Angedeutete dreidimensionale Struktur von 24 durch Ausbildung von H-Brücken.
Dabei entstehen Untereinheiten aus jeweils einem R- und einem S-Enantiomer, die
über intermolekulare klassische H-Brücken (2.068 Å) zwischen den Sauerstoffatomen der Phosphanoxidreste und einem Proton der jeweils benachbarten Amideinheit miteinander verbunden sind. Die dreidimensionale Struktur resultiert aus der
Aneinanderlagerung dieser Untereinheiten über intermolekulare nichtklassische
H-Brücken mit einer Länge von 2.429 Å zwischen dem Carbonylsauerstoffatom des
Amidsubstituenten und dem Proton in 6-Position einer benachbarten phosphanoxidsubstituierten Naphthyleinheit.
Für die im Anschluss durchgeführte Synthese des enantiomerenreinen P,NBinaphthylliganden 27 wurden zur Darstellung der Amidvorstufe 24 auch die Binaphthyle 10 und 11 in enantiomerenreiner Form benötigt. Analog zu den bereits in
Kapitel 3.2.1 beschriebenen literaturbekannnten[33, 34] Reaktionen waren diese beiden
Binaphthylsysteme ausgehend von Bistriflat S-8 bzw. R-8 in guten Ausbeuten
ebenso leicht zugänglich (Abb. 73).
Ergebnisse und Diskussion
64
Pd(OAc)2 / dppp
S-8
NiBr2 / PPh3
PH(O)Ph2 9, iPr2EtN
OTf
DMSO
P(O)Ph2
CN
MeCN
P(O)Ph2
90 °C, 6 h
100 °C, 24 h
R-8
Zn, KCN
S-10
S-11
67%
81%
R-10
R-11
56%
76%
Abb. 73: Synthese der enantiomerenreinen Binaphthyle 10 und 11.
Neben den spektroskopischen Daten, die denen der jeweiligen racemischen
Verbindungen entsprachen (siehe 3.2.1), diente der Drehwert [α] als Anhaltspunkt für
die optische Reinheit der enantiomerenreinen Binaphthyle 10 und 11. Der für das
Monotriflat S-10 ermittelte Wert [α ]21
D = - 40 bei c = 0.5 in CHCl3 stimmte dabei mit
den Literaturdaten[33b] ( [α ]20
D = - 44.45, c = 0.5, CHCl3) gut überein. Einen annähernd
so hohen aber positiven Wert lieferte das entsprechende R-Enantiomer R-10 mit
[α ]21D
= + 30 bei gleicher Konzentration und Lösungsmittel, wobei ein direkter Ver-
gleich mit den Literaturdaten[33a] ( [α ]20
D = + 6.29, c = 1) aufgrund der dort verwendeten höheren Konzentration und CH2Cl2 als Lösungsmittel zunächst nicht möglich
war. Eine weitere Messung unter den Literaturbedingungen ergab für R-10 einen
Drehwert [α] von + 8.5. Für das Binaphthylnitril 11 konnten in der Literatur[34] bisher
nur Daten für das R-Enantiomer R-11 gefunden und zum Vergleich herangezogen
werden. Dabei wurde festgestellt, dass zwar ähnlich gute Ergebnisse für die
Elementaranalyse erzielt, jedoch deutlich höhere Werte sowohl für den Schmelzpunkt als auch für den Drehwert [α] ermittelt wurden (Tab. 6).
Ergebnisse und Diskussion
65
Tab. 6: Vergleich der erhaltenen Werte von R-11 mit Literaturdaten.
C, H, N-Gehalt [%]
ber.
[34]
Lit.
Drehwert [°×ml/dm×g]
[34]
gef.
Lit.
ermittelt
C 82.66
C 82.50
C 82.43
+ 132.1
+ 141.8
H 4.63
H 4.72
H 4.66
c = 0.49
c = 0.49
N 2.92
N 2.84
N 2.84
CHCl3
CHCl3
Schmelzpunk t [°C]
[34]
Lit.
212–214
ermittelt
223–224
Die für das enantiomerenreine Nitril R-11 ermittelten Werte konnten durch die
entsprechenden Daten für das S-Enantiomer S-11 zusätzlich bestätigt werden
(Tab. 7).
Tab. 7: Daten des enantiomerenreinen Nitrils S-11.
C, H, N-Gehalt [%]
Drehwert
Smp.
[°×ml/dm×g]
[°C]
ber.
gef.
C 82.66
C 82.65
- 141.8
H 4.63
H 4.70
c=0.49
N 2.92
N 2.80
CHCl3
223–224
Auch im Vergleich zum racemischen Binaphthyl 11 zeigten die isolierten Enantiomere wesentliche Unterschiede. Der ermittelte Schmelzpunkt war mit 287–288 °C
um 64 °C höher als der für
S-11 bzw. R-11 und wurde auf die vielen
Wechselwirkungen zwischen den Molekülen zurückgeführt (siehe 3.2.1). Aufgrund
der Chiralität von S-11 bzw. R-11 und der damit verbundenen Ausrichtung der
einzelnen Moleküle werden wahrscheinlich weniger intermolekulare H-Brücken
gebildet. Die daraus resultierende verbesserte Löslichkeit der isolierten Enantiomere
in einer Vielzahl von organischen Lösungsmitteln erleichtert die weitere Umsetzung
erheblich. Daher wurden auch mildere Bedingungen für die Verseifung von S-11
bzw. R-11 zu den entsprechenden Amiden S-24 bzw. R-24 gewählt (Abb. 74).[16b, 44]
Ergebnisse und Diskussion
66
CN
6N NaOH / H2O2
C(O)NH2
P(O)Ph 2
EtOH, 50 °C, 20 h
P(O)Ph2
S-11
S-24
96%
R-11
R-24
93%
Abb. 74: Synthese der enantiomerenreinen Binaphthylamide S-24 und R-24.
Auf diese Weise ließen sich die enantiomerenreinen amidsubstituierten Binaphthyle
S-24 und R-24 ebenfalls als gelbliche Feststoffe in Ausbeuten von über 90%
isolieren. Die Charakterisierung erfolgte zunächst mit spektroskopischen Methoden,
wobei die NMR-Daten identisch zu denen des racemischen Amids 24 waren und im
IR-Spektrum ebenfalls ein Carbonylschwingungsbande (Amidbande I) bei 1669 cm-1
und eine weitere Bande für die NH2-Deformationsschwingung (Amidbande II) bei
1614 cm-1 beobachtet werden konnten. Die optische Reinheit von S-24 und R-24
wurde außerdem durch die Bestimmung des spezifischen Drehwertes bei c = 1 in
CHCl3 überprüft. In der Literatur[16a] waren entsprechende Daten ( [α ]24
D = + 157) nur
für das R-Enantiomer zu finden, wobei der für R-24 ermittelte Wert [α ]23
D = + 140
etwas davon abweicht. Das S-Enantiomer lieferte einen ähnlich hohen negativen
Wert mit [α ]26
D = - 150.
3.3.3 Synthese des Triazolylphosphanylbinaphthylliganden 27
Die anschließenden Umsetzungen von Amid 24 mit DMFDMA und HydrazinMonohydrat zum Aufbau des Triazolrings sowie die Reduktion des Oxids 26 zum
Phosphanliganden 27 wurden zunächst auf racemischen und anschließend auf
enantiomerenreinen Weg durchgeführt. Dadurch gelang es ausgehend von S-24
über die eben beschriebenen drei Reaktionsstufen den triazolsubstituierten Phosphanliganden S-27 zu synthetisieren (Abb. 75).[18, 34]
Ergebnisse und Diskussion
67
N
N
DMFDMA
C(O)NH2
P(O)Ph2
120-140 °C, 6 h
O
Ph2(O)P
S-25
S-24
92%
N2H4xH2O
AcOH, 100 °C, 6 h
N
N
N
SiHCl3 , Et3N
NH
N
NH
P(O)Ph2
Toluol, 120 °C, 40 h
PPh2
S-27
S-26
66%
86%
Abb. 75: Abschließende Reaktionsschritte zur Synthese des chiralen P,N-Liganden S-27.
Zunächst entstand bei einer Kondensationsreaktion der Amidgruppe von S-24 mit
DMFDMA eine N’-Acyl-N,N-dimethylamidineinheit und das neue Binaphthyl S-25
konnte in Ausbeuten von 92% als hellgelber Feststoff isoliert werden. Sowohl im
1
H-NMR-Spektrum als auch im
13
C-NMR-Spektrum war eine eindeutige Zuordnung
der Signale für den Amidinsubstituenten möglich (Abb. 76). Ein Signal für die
Phosphanoylgruppe wurde im
31
P-NMR-Spektrum bei 29.2 ppm beobachtet. Die
Entstehung von S-25 konnte zusätzlich im MALDI-TOF-Massenspektrum anhand
eines Signals für die protonierte Masse bei m/z = 553.29 nachgewiesen werden
(Abb. 77).
Ergebnisse und Diskussion
13
68
C-NMR (CDCl3, 100.6 MHz): δ = 34.8, 41.0 (a), 159.8 (b), 178.3 (c).
a
c N
CDCl3
a
8,4
8,2
10
8,0
7,8
8
7,6
7,4
7,2
7,0
6
a
b
O
Ph2(O)P
b
N
a
6,8
4
2
0
δ [ppm]
1
13
Abb. 76: H-NMR-Spektrum und C-NMR-Daten der Amidineinheit von S-25.
50000
45000
N
[S-25H]
553.29
40000
N
+
O
Ph2(O)P
Intensität [a.u.]
35000
30000
S-25
25000
20000
15000
10000
5000
0
500
520
540
560
580
m /z
Abb. 77: MALDI-TOF-Massenspektrum von S-25.
600
Ergebnisse und Diskussion
69
Die anschließende Zyklisierung mit Hydrazin-Monohydrat in Essigsäure führte zum
triazolsubstituierten Phosphanoylbinaphthyl S-26, das zunächst als gelbes Öl isoliert
wurde. Durch Umkristallisation aus Methanol gelang es, gelbliche Kristalle von
S-26 in Ausbeuten von 86% zu erhalten. Im 1H-NMR-Spektrum (Abb. 78) deuteten
sowohl ein Singulett im Aromatenbereich bei ~ 7.8 ppm als auch ein sehr breites NHSignal zwischen 14 und 15 ppm auf die im Triazolring vorhandenen Protonen hin.
Der Phosphanoylsubstituent wurde durch ein Signal im
31
P-NMR-Spektrum bei
31.7 ppm nachgewiesen.
C D C l3
H Tz
N
N
C D C l3
NH
P(O)Ph 2
8,0
7,5
7,0
6,5
NH
16
15
16
14
14
13
12
12
10
8
6
4
2
0
δ [p pm ]
1
Abb. 78: H-NMR-Spektrum von S-26.
Des Weiteren konnte die von den Kristallen angefertigte Röntgenstrukturanalyse die
Entstehung des Triazolylphosphanoylbinaphthyls S-26 bestätigen (Abb. 79). Die
chirale Ligandvorstufe S-26 kristallisiert in der azentrischen orthorhombischen
Raumgruppe P212121. Aufgrund des Torsionswinkels von 97.1 ° erfolgt e ine nahezu
senkrechte Anordnung der Naphthyleinheiten zueinander, die wiederum Wechselwirkungen zwischen den einzelnen Molekülen begünstigt. Daher erfolgt die
Ausbildung von klassischen Wasserstoffbrückenbindungen mit einer Länge von
1.713 Å zwischen den NH-Protonen und den Phosphanoylsauerstoffatomen benach-
Ergebnisse und Diskussion
70
barter Moleküle. Außerdem werden zusätzlich nichtklassische H-Brücken (2.615 Å)
zwischen dem Stickstoffatom in 2-Positon des Triazolrings und einem o-Phenylproton
der Phosphanoxideinheit im Nachbarmolekül beobachtet. Für das verbliebene Stickstoffatom in 4-Position können vermutlich aufgrund seiner abgeschirmten Lage keine
derartigen Wechselwirkungen mit benachbarten Protonen festgestellt werden.
Abb. 79: Kristallstruktur von S-26 mit intermolekularen H-Brücken.
Neben den NMR-spektroskopischen Daten für die chemische Reinheit konnte der bei
c = 0.5 in CHCl3 ermittelte Drehwert [α ]D = + 46 Aufschluss über die Enantiomeren21
reinheit von S-26 geben.
Im letzten Reaktionsschritt wurde diese P,N-Ligandsynthese ebenfalls durch eine
Reduktion des Phosphanoxids S-26 mit Trichlorsilan zum entsprechenden Phosphan
S-27 komplettiert. Der neue chirale Ligand S-27 konnte aufgrund des stark
hochfeldverschobenen Signals für das Phosphoratom im
31
P-NMR-Spektrum
eindeutig identifiziert werden (Abb. 80). Das charakteristische Singulett für das CHSignal (HTz) im Triazolring war im 1H-NMR-Spektrum bei ~ 7.7 ppm zu finden, wobei
ein NH-Signal auch im Bereich von 10–20 ppm diesmal nicht beobachtet wurde
(Abb. 81). Außerdem waren in diesem Spektrum zusätzliche Signale für das bei der
Reaktion entstandene und bei der Filtration nicht vollständig abgetrennte
Triethylammoniumhydrochlorid sowie Reste des Lösungsmittels Toluol vorhanden.
71
31.7
- 13.7
Ergebnisse und Diskussion
N
N
N
N
NH
P(O)Ph2
NH
PPh2
S-26
200
150
S-27
100
50
0
-5 0
-1 0 0
-1 5 0
-2 0 0
δ [p p m ]
Abb. 80: Vergleich der
31
P-NMR-Spektren von Phosphanoxid S-26 und Phosphan S-27.
C D C l3
H Tz
C D C l3
E t 3 N ×H C l
Toluol
8,5
20
8,0
18
7,5
16
7,0
14
12
6,5
10
8
6
4
2
δ [ppm ]
1
Abb. 81: H-NMR-Spektrum des neuen chiralen Phosphanliganden S-27.
0
Ergebnisse und Diskussion
72
Die beim Pyrazolliganden S-20 in Lösung beobachtete rasche Rückoxidation des
Phosphans war im Fall des Triazolliganden S-27 vernachlässigbar gering. Nach 24 h
konnte bei der erneuten Vermessung der NMR-Probe nur ein kleines Signal (~ 3%)
bei etwa 31.7 ppm für das Oxid S-26 im
31
P-NMR-Spektrum beobachtet werden.
Eine Veränderung der Signalintensitäten wurde auch nach über 40 h nicht festgestellt (Abb. 82).
Rückoxidation nach 24 h
Rückoxidation nach 43 h
S-27
S-27
S-26
200 150 100
50
S-26
0
-50 -100 -150 -200 200 150 100
50
0
-50 -100 -150 -200
δ [ppm]
Abb. 82: Im
31
P-NMR-Spektrum beobachtete minimale Rückoxidation von S-27.
Aufgrund dieser Tatsache war eine Aufreinigung des Liganden S-27 sowie dessen
Isolierung als hellgelber Feststoff in Ausbeuten von 66% möglich.
Das entsprechende R-Enantiomer dieses P,N-Liganden R-27 war ausgehend vom
Binaphthylamid R-24 über die analogen Reaktionsschritte in ebenso guten
Ausbeuten zugänglich (Abb. 83). Die Charakterisierung der einzelnen Zwischenstufen erfolgte hauptsächlich durch NMR-spektroskopische Messungen, wobei die
erhaltenen Daten natürlich identisch zu denen der bereits interpretierten S-Binaphthyle waren. Das triazolsubstituierte Phosphanoxid R-26 konnte ebenfalls in
kristalliner Form isoliert und anschließend röntgenstrukturanalytisch untersucht
werden.
Ergebnisse und Diskussion
i
R-24
R-25
73
ii
87%
iii
R-26
N
88%
N
NH
PPh2
i
DMFDMA, 120-140 °C, 6 h
ii
N2H4xH2O, AcOH, 100 °C, 6 h
iii
SiHCl3, Et3N, Toluol, 120 °C, 40 h
R-27
78%
Abb. 83: Abschließende Reaktionsschritte zur Synthese des chiralen P,N-Liganden R-27.
Anhand der Kristallstrukturen von S-26 (Abb. 79) und R-26 (Abb. 84) wird die BildSpiegelbild-Isomerie ersichtlich, die sich auch in den nahezu identischen strukturellen
Merkmalen der orthorhombischen Kristalle widerspiegelt.
Abb. 84: Kristallstruktur von R-26 mit intermolekularen H-Brücken.
Der Torsionswinkel zwischen den Naphthyleinheiten von R-26 ist im Vergleich zu
S-26 mit 98.1 ° nur ein Grad größer und auch die jeweil igen klassischen bzw.
nichtklassischen intermolekularen Wasserstoffbrückenbindungen sind mit 1.778 Å
und 2.624 Å nur etwas länger. Da Enantiomere sich neben der Kristallstruktur
ausschließlich in ihren optischen Eigenschaften unterscheiden, sollte mit der
Ergebnisse und Diskussion
74
Bestimmung des Drehwertes [α] die Enantiomerenreinheit der kristallinen Verbindung R-26 überprüft werden. Der für R-26 ermittelte Wert [α ]21
D = - 49 bei c = 0.5 in
CHCl3 stimmte dabei mit dem für S-26 bereits erhaltenen Wert [α ]D = + 46 bei
21
gleicher Konzentration und Lösungsmittel gut überein.
Damit war die Synthese der neuen triazolsubstituierten Phosphanliganden S-27 und
R-27 ausgehend vom Bistriflat S-8 bzw. R-8 in sechs Reaktionsschritten mit einer
Gesamtausbeute von 27% (S-27) und 24% (R-27) möglich. Im Gegensatz zum
entsprechenden Pyrazolliganden S-20 wurde für diese P,N-Liganden eine vergleichsweise geringe Rückoxidation in Lösung beobachtet, was weitere Untersuchungen
und Umsetzungen wie z. B. die Komplexierung mit Übergangsmetallen erleichtert.
Ergebnisse und Diskussion
75
3.4 Palladium(II)-Komplexe
Im Hinblick auf ihren möglichen Einsatz in enantioselektiven Katalysen wurden
sowohl der pyrazolsubstituierte Phosphanligand S-20 als auch die triazolsubstituierten Phosphanliganden 27 auf ihre Fähigkeit zur Komplexierung von Übergangsmetallen wie Palladium untersucht. Die Darstellung der Pd-Komplexe von 20 und 27
erfolgte analog zu den bereits in der Literatur[12c, 13, 14b] von Pregosin et al. und
Hayashi et al. beschriebenen PdCl2-Komplexen der Phosphinooxazolinliganden
(Abb. 85). Das katalytische Potential dieser Oxazolinliganden testeten beide
Gruppen erfolgreich anhand der palladiumkatalysierten allylischen Alkylierung von
1,3-Diphenyl-Propenylacetat[12b, c] und der enantioselektiven Heck-Arylierung von
2,3-Dihydrofuranen[12b, 13].
N
Cl
=
Pd
P
O
N
Cl
P
N
R
P
R = iPropyl
Ar
Ar
Ar = Ph
(H / P)
3,5-Di-Me-Ph
(P)
3,5-Di-tBu-Ph
(P)
Abb. 85: PdCl2-Komplexe von R-Phosphinooxazolinliganden der Arbeitsgruppen
Pregosin (P) und Hayashi (H).
Im Gegensatz zu den oxazolinsubstituierten Phosphanliganden besteht bei den
P,N-Ligandsystemen 20 und 27 noch die Möglichkeit, dass durch den schnellen
NH-Protonenaustausch am jeweiligen Heterozyklus die Koordination des Metallatoms sowohl an N(1) als auch N(2) erfolgen kann und sich somit verschiedene
Komplexe (Konstitutionsisomere) ausbilden. Bei Koordination an N(2) würden
P,N-Chelatkomplexe entstehen, während die Koordination an N(1) auch zu dimeren
oder polymeren Strukturen führen könnte. Außerdem besitzt der triazolsubstituierte
Ligand 27 durch das Stickstoffatom in 4-Position eine weitere mögliche Koordinationsstelle (Abb. 86).
Ergebnisse und Diskussion
76
4
3
X
X
5
N
2
N
H
NH
1
PPh2
N
PPh2
20
X = CH
27
X=N
Abb. 86: Tautomere Formen der P,N-Liganden 20 und 27.
3.4.1 Komplexierungsversuch von S-20 mit PdCl2(PhCN)2
Die Komplexierung des Pyrazolylphosphanylliganden S-20 wurde analog zur
literaturbekannten Methode[14b] mit einem Äquivalent PdCl2(PhCN)2 in entgastem
CH2Cl2 und unter N2-Atmosphäre durchgeführt. Nach dreistündigem Rühren der
gelben Lösung bei RT (~ 20 °C) wurde das Lösungsmit tel entfernt und der gelbe
Rückstand NMR-spektroskopisch untersucht. Das im
31
P-NMR-Spektrum (Abb. 87)
vorhandene Signal bei - 13.7 ppm deutete allerdings nur auf den freien Liganden
S-20 hin, da eine Komplexierung mit Palladium eine Tieffeldverschiebung des
31
P-NMR-Signals in den Bereich von 20 ppm bis 30 ppm zur Folge haben müsste.
Daher wurde der Rückstand erneut in entgastem CH2Cl2 gelöst und für weitere 3 h
bei 30° C gerührt. Anhand des
leichte
Temperaturerhöhung
31
P-NMR-Spektrum wurde ersichtlich, dass diese
vermutlich
einen
positiven
Einfluss
auf
die
Komplexbildung hatte, da sowohl ein Signal bei 20 ppm als auch bei 24 ppm auf die
Entstehung von möglichen Pd-Komplexen des Liganden S-20 hindeuteten. Allerdings
zeigten die weiteren Phosphorresonanzen, dass auch die erneute Umsetzung
unvollständig war und zusätzliche phosphorhaltige Nebenprodukte entstanden sind,
wobei das Signal bei 31 ppm der oxidierten Form S-19 zugeordnet wurde (Abb. 87).
Von weiteren Komplexierungen des P,N-Liganden S-20 wurde aufgrund der
Nebenproduktbildung in dieser Arbeit abgesehen.
Ergebnisse und Diskussion
77
3 h bei RT
weitere 3 h bei 30 °C
S-20
S-20
Pd-Komplexe
S-19
100 80 60 40 20 0 -20 -40 -60 -80-100 100 80 60 40 20 0 -20 -40 -60 -80-100
δ [ppm]
Abb. 87:
31
P-NMR-Spektren der Komplexierungsversuche von S-20 mit PdCl2(PhCN)2.
Im Gegensatz zu den oxazolinsubstituierten Phosphanliganden konnte bei RT keine
Komplexbildung von S-20 beobachtet werden. Dichlormethan ist aufgrund seines zu
niedrigen Siedepunktes für diese Umsetzungen als Lösungsmittel ungeeignet.
Zukünftige Komplexierungsversuche sollten daher in höhersiedenden Lösungsmitteln
wie z. B. CHCl3 durchgeführt werden.
3.4.2 Komplexierung von 27 mit PdCl2(PhCN)2
Die Überprüfung der Durchführbarkeit der Komplexierung der triazolsubstituierten
Phosphanliganden 27 mit PdCl2(PhCN)2 erfolgte zuerst mit der racemischen
Verbindung.
Racemischer Pd-Komplex
Nach der Umsetzung von 27 mit einem Äquivalent PdCl2(PhCN)2 in entgastem
siedendem CHCl3 konnte ein intensiv gelber aber schwerlöslicher Feststoff mit einer
Ausbeute von 82% isoliert werden. Die NMR-spektroskopischen Untersuchungen in
Ergebnisse und Diskussion
78
den Lösungsmitteln CDCl3 und d4-MeOH ergaben, dass es sich dabei um den
entsprechenden Pd-Komplex 28 des racemischen Liganden 27 handelte. In den
jeweiligen
31
P-NMR-Spektren (Abb. 88) konnte nur ein einziges und im Vergleich zu
27 tieffeldverschobenes Signal beobachtet werden. Der erhaltene Wert von 24.9 ppm
für die chemische Verschiebung des Phosphorsignals in CDCl3 stimmte dabei sehr
gut mit dem von Hayashi et al. ermittelten Wert von 24.8 ppm[13] für den Dichlorophosphinooxazolinpalladiumkomplex (siehe Abb. 85) überein.
C D C l3
24.9
25.7
d 4-M e O H
40
20
0
-2 0
-4 0
40
20
0
-2 0
-4 0
δ [p p m ]
Abb. 88:
31
P-NMR-Spektren des racemischen Pd-Komplexes 28 in CDCl3 und d4-MeOH.
Die Entstehung des Pd-Komplexes 28 ließ sich auch in den 1H-NMR-Spektren trotz
der schlechten Löslichkeit aufgrund der veränderten Lage einiger Signale nachweisen. Des Weiteren waren in CDCl3-Lösung aufgenommenen Spektrum neben
dem Hauptsignalsatz (75%) im Aromatenbereich weitere kleine Signale (25%)
vorhanden (Abb. 89), die zunächst dem entsprechenden Konstitutionsisomer
(Koordination an N4) des Komplexes zugeordnet wurden. Ein Phosphorsignal für
dieses Isomer konnte aber, vermutlich wegen der geringen Konzentration von 28 in
der Probe, nicht beobachtet werden.
Ergebnisse und Diskussion
79
C D C l3
6.16
H Tz
*
NH
10
10
8
9
*
8
6
5.89
C D C l3
*
*
7
4
6
2
0
δ [p p m ]
1
Abb. 89: H-NMR-Signale des racemischen Pd-Komplexes 28
sowie eines möglichen Isomers (∗) in CDCl3.
H Tz
d 4-M e O H
10 9
8
7
6
5
4
3
2
1
0
NH
9 ,0
8 ,5
8 ,0
7 ,5
7 ,0
6 ,5
6 ,0
δ [p p m ]
1
Abb. 90: H-NMR-Spektrum von Pd-Komplex 28 in d4-MeOH.
5 ,5
Ergebnisse und Diskussion
80
In d4-MeOH konnte dieser zusätzliche Signalsatz nicht beobachtet werden (Abb. 90).
Allerdings war das charakteristische CH-Signal für den Triazolring deutlich bei
7.93 ppm erkennbar. Außerdem deutete in beiden Spektren ein breites Singulett bei
9.08 ppm (CDCl3) bzw. bei 8.65 ppm (d4-MeOH) auf das NH-Proton des Triazolrings
hin.
Aufgrund der schlechten Löslichkeit von 28 ist es bisher noch nicht gelungen,
Kristalle zur Strukturaufklärung zu erhalten. Aus zahlreichen Kristallisationsansätzen
konnte der Pd-Komplex 28 stets nur als Pulver isoliert werden. Da die enantiomerenreinen Verbindungen bislang eine wesentlich bessere Löslichkeit im Vergleich
zum Racemat zeigten, erfolgte die Komplexierung der Enantiomere S-27 und R-27
ebenfalls mit PdCl2(PhCN)2.
Enantiomerenreine Pd-Komplexe
Die Pd-Komplexe von S-27 und R-27 wurden analog zur bereits beschriebenen
Darstellung des racemischen Pd-Komplexes 28 synthetisiert und als ebenso intensiv
gelbe Feststoffe in Ausbeuten von 80% und 78% isoliert. Beim Vergleich der
NMR-spektroskopischen Daten von 28 mit denen der enantiomerenreinen Pd-Komplexe S-28 und R-28 konnten allerdings signifikante Unterschiede in den Signallagen
festgestellt werden (Tab. 8). Ein Dublett bei ~ 5.9 ppm in den 1H-NMR-Spektren von
S-28 und R-28 (Abb. 91) wurde zwar auch beim racemischen Komplex 28
beobachtet, allerdings in dem vom „Isomer“ stammenden kleineren Signalsatz. Die
Intensität des Hauptsignalsatzes (75%) von 28 betrug in den Spektren der
enantiomerenreinen Verbindungen dagegen nur 6%.
Tab. 8: Vergleich der NMR-Daten von Pd-Komplex 28 mit S-28 bzw. R-28.
1
a)
H-NMR-Signal
31
b)
P-NMR-Signal
Verbindung
[ppm]
[ppm]
28
6.16 (75) : 5.89 (25)
24.9
S-28 / R-28
5.86 (94) : 6.22 (6)
22.5
a) Aromatensignal (prozentualer Anteil): Messfrequenz 400.1 MHz, Lösungsmittel CDCl3
b) Angabe des Hauptsignals: Messfrequenz 162.0 MHz, Lösungsmittel CDCl3
Ergebnisse und Diskussion
81
C D C l3
C D C l3
10 9
8
7
6
5
4
3
2
1
0
*
9 ,0
8 ,5
6.22
5.86
H Tz
*
*
8 ,0
*
7 ,5
7 ,0
*
6 ,5
6 ,0
5 ,5
δ [p p m ]
1
Abb. 91: H-NMR-Signale des chiralen Pd-Komplexes R-28
sowie eines möglichen Isomers (∗) in CDCl3.
Das in den
31
P-NMR-Spektren erwartete Signal bei ~ 25 ppm war ebenfalls kaum zu
erkennen, wohingegen sowohl S-28 als auch R-28 ein deutliches Signal bei
22.5 ppm lieferten (Abb. 92).
P d - K o m p le x R - 2 8
22.5
22.5
P d - K o m p le x S - 2 8
2 5 .1
2 5 .1
100
50
0
-5 0
100
50
0
δ [p p m ]
Abb. 92:
31
P-NMR-Spektren der Pd-Komplexe S-28 und R-28 in CDCl3.
-5 0
Ergebnisse und Diskussion
82
Die Röntgenstrukturanalyse der von R-28 aus CH2Cl2 und EtOH (1:1) erhaltenen
Kristalle zeigte neben der Struktur des enantiomerenreinen Komplexes auch den
Grund für diese abweichenden NMR-Daten. Der Pd-Komplex R-28 liegt nicht wie
erwartet in der monomeren Dichloro-Form vor, sondern bildet, vermutlich durch
intermolekulare Abspaltung von HCl, ein Dimer aus (Abb. 93).
Abb. 93: Kristallstruktur des dimeren Pd-Komplexes R-28.
Der dimere Pd-Komplex R-28 kristallisiert in der orthorhombischen Raumgruppe
P212121. Anhand der Struktur wird ersichtlich, dass beide Metallzentren eine
quadratisch planare Koordinationsumgebung besitzen, was durch die geringen
Abweichungen der Bindungswinkel von 90 ° bzw. 180 ° zusätzlich bestätigt werden
kann (Tab. 9). Die Summe der Winkel zwischen den einzelnen an das Palladiumzentrum koordinierten Atomen beträgt für Pd(1) 359.93 ° und für Pd(2) 359.85 °. Die
beiden Metallzentren sind durch die zusätzliche Koordination an das weitere
Stickstoffatom im benachbarten Triazolring miteinander verbunden und bilden somit
neben den achtgliedrigen Chelatringen mit den Liganden R-27 einen verbrückenden
6-Ring aus. Der Abstand der Metallatome in diesem Palladazyklus beträgt 3.464 Å.
Außerdem ist bei beiden Pd-Einheiten der Bindungsabstand zwischen Metallzentrum
und den Stickstoffatomen wesentlich kürzer als zwischen Palladiumatom und Chlorbzw. Phosphoratom.
Ergebnisse und Diskussion
83
Tab. 9: Charakteristische Bindungsabstände und -winkel im Pd-Komplex R-28.
Bindungsabstände [Å]
Pd(1)-Cl(1)
2.293(9)
Pd(1)-P(1)
2.259(8)
Pd(1)-N(1)
2.001(3)
Pd(1)-N(5)
2.074(2)
Pd(2)-Cl(2)
2.286(6)
Pd(2)-P(2)
2.263(1)
Pd(2)-N(4)
2.015(3)
Pd(2)-N(2)
2.090(3)
Bindungswinkel [°]
Cl(1)-Pd(1)-N(1)
177.36(8)
N(5)-Pd(1)-P(1)
177.27(7)
Cl(1)-Pd(1)-P(1)
88.96(3)
P(1)-Pd(1)-N(1)
92.61(8)
N(1)-Pd(1)-N(5)
85.75(1)
N(5)-Pd(1)-Cl(1)
92.59(7)
Cl(2)-Pd(2)-N(4)
176.97(7)
N(2)-Pd(2)-P(2)
174.48(8)
Cl(2)-Pd(2)-P(2)
89.62(3)
P(2)-Pd(2)-N(4)
92.76(8)
N(4)-Pd(2)-N(2)
86.21(1)
N(2)-Pd(2)-Cl(2)
91.24(8)
Ein Vergleich mit den von Hayashi et al. erhaltenen Röntgenstrukturdaten
(Tab. 10)[13] für den monomeren Dichloropalladiumkomplex des R-Phosphinooxazolinliganden zeigt ebenfalls nur geringe Unterschiede bei entsprechenden Abständen und Winkeln.
Tab. 10: Im PdCl2-Phosphinooxazolinkomplex von Hayashi et al. ermittelte Abstände und Winkel.
Bindungsabstände [Å]
Pd(1)-Cl(1)
2.348(3)
Pd(1)-P(1)
2.259(3)
Pd(1)-N(1)
2.016(8)
Pd(1)-Cl(2)
2.293(3)
Bindungswinkel [°]
Cl(2)-Pd(1)-N(1)
174.9(7)
Cl(1)-Pd(1)-P(1)
172.1(1)
Cl(2)-Pd(1)-P(1)
86.4(9)
P(1)-Pd(1)-N(1)
92.7(2)
N(1)-Pd(1)-Cl(1)
90.7(2)
Cl(1)-Pd(1)-Cl(2)
90.8(1)
Bisher konnte nicht eindeutig geklärt werden, wieso unter analogen Reaktionsbedingungen bei der Umsetzung mit PdCl2(PhCN)2 die enantiomerenreinen Liganden
S-27
und
R-27
bevorzugt
dimere
Pd-Strukturen
bilden, wohingegen
vom
racemischen Triazolliganden 27 hauptsächlich der monomere PdCl2-Komplex 28
NMR-spektroskopisch nachgewiesen wurde. Die zunächst angenommene Ent-
Ergebnisse und Diskussion
84
stehung weiterer isomerer Komplexe aufgrund der Tautomerie von 27 bzw. des
zusätzlichen Donoratoms am Triazol wurde dagegen nicht beobachtet.
Einen Anhaltspunkt für die Enantiomerenreinheit der Pd-Komplexe S-28 und R-28
lieferten die bei c = 0.1 in CHCl3 ermittelten Drehwerte von [α ]D = - 1260 (S-28) und
23
[α ]23D
= + 1180 (R-28). Im Vergleich zu den von Hayashi et al. erhaltenen Daten[13] für
die PdCl2-Komplexe der Phosphinooxazolinliganden (S-Enantiomer: [α ]20
D = - 416;
R-Enantiomer: [α ]20
D = + 656) bei gleicher Konzentration und Lösungsmittel sind die
Werte für S-28 und R-28 nahezu doppelt so hoch. Vermutlich zeigt auch hier die
dimere Struktur einen deutlichen Einfluss.
Ergebnisse und Diskussion
85
3.5 Versuche zur Synthese weiterer P,N-Binaphthyle
Das letzte Kapitel des Abschnitts 3 befasst sich mit den Versuchen zur Darstellung
zwei weiterer P,N-Liganden. Unsymmetrische Binaphthyle mit Triflat-, Ester-, Säureoder Amidgruppe stellten schon bei den Synthesen der Liganden 20 und 27 wichtige
Zwischenstufen dar. Im Folgenden wurden daher ausgehend von Monotriflat 10 bzw.
Amid 24 Reaktionen zur Darstellung eines N-Pyrazolyl- bzw. benzimidazolsubstituierten Phosphanoylbinaphthyls getestet.
3.5.1 Palladiumkatalysierte Aminierungsversuche von Monotriflat 10
Die Pd-katalysierten Reaktionen von Arylhalogeniden mit primären und sekundären
Aminen ist eine oft verwendete und gut untersuchte Methode zur Synthese von
Arylaminen durch C-N-Bindungsknüpfung. Mit der Verwendung von phosphanhaltigen Chelatliganden wie dppf und BINAP konnten bestehende Katalysatorsysteme verbessert und die Aminierungen auch mit Aryltriflaten erfolgreich
durchgeführt werden.[45a] Ausgehend vom racemischen Monotriflat 10 sollte mit
1H-Pyrazol auf diese Weise ebenfalls ein C-N-verknüpftes Pyrazolylbinaphthylsystem entstehen (Abb. 94).
Pd2(dba)3 / dppf
Base, 1H-Pyrazol
1N
OTf
P(O)Ph2
4
2N
N2, Toluol, 100 °C, 5 h
P(O)Ph2
10
(520.56)
Abb. 94: Versuche zur Synthese eines N-Pyrazolylphosphanoylbinaphthyls.
Die Umsetzungen von 10 mit 1H-Pyrazol erfolgten unter Verwendung des
Katalysatorsystems Pd2(dba)3 / dppf sowie KOtBu bzw. Cs2CO3 als Base in
absolutiertem Toluol. Nach der Aufarbeitung dieser Ansätze war in den
31
P-NMR-
Spektren neben dem Eduktsignal bei 29.0 ppm zwar ein weiteres Signal bei
Ergebnisse und Diskussion
86
1
32.0 ppm vorhanden, jedoch gab es in den entsprechenden
H-NMR-Spektren
32.0
keinen Hinweis auf den Pyrazolsubstituenten (Abb. 95).
OTf
CDCl3
29.0
P(O)Ph2
10
60
40
20
0
-20
10
10
8
7
6
5
δ [ppm]
1
Abb. 95: H-NMR- und
31
P-NMR-Spektrum der Aminierungsversuche von Monotriflat 10.
Das Fehlen eines Signals für das Pyrazolproton in 4-Position bei etwa 6 ppm und die
im Spektrum vorhandenen zusätzlichen Binaphthylsignale deuteten eher auf ein
durch Hydrolyse bzw. Abspaltung der Triflateinheit entstandenes Zersetzungsprodukt
hin. Die Entstehung dieser Phosphanoylbinaphthyle konnte auch durch das MALDITOF-Massenspektrum bestätigt werden, wohingegen bei ~ 521 kein Massepeak für
das erwartete N-Pyrazolylbinaphthyl vorhanden war (Abb. 96).
Ergebnisse und Diskussion
87
30000
P(O)Ph2
25000
Intensität [a.u.]
20000
OTf
15000
P(O)Ph2
OH
10000
P(O)Ph 2
5000
0
400
450
500
550
600
650
m/z
Abb. 96: MALDI-TOF-Massenspektrum eines Aminierungsversuches.
Bei Pd-katalysierten Aminierungsreaktionen von Aryltriflaten werden bevorzugt
elektronenreiche Alkyl- oder Arylamine verwendet.[45a] Daher war der Einsatz eines
elektronenarmen Amins wie 1H-Pyrazol zusammen mit dem sterisch anspruchsvollen
Binaphthyltriflat 10 für diese Umsetzungen vermutlich ungünstig. Die zeitgleichen
Arbeiten von J. Thiel belegten ebenfalls, dass bei der Übertragung dieser Pd-katalysierten Reaktion auf das Binaphthylbistriflat 8 aufgrund der geringen Reaktivität des
Pyrazols keine Aminierung stattfand.[45b]
3.5.2 Umsetzungen des Amids 24 mit 1,2-Phenylendiamin
Die direkte Umsetzung von Arylcarbonsäuren, -estern, -nitrilen oder -amiden mit
o-Phenylendiamin zu arylsubstituierten Benzimidazolen in Polyphosphorsäure oder
Lösungsmitteln wie Ethylenglykol erfolgt meist erst bei Temperaturen über
200 °C. [46a-c] Diese Reaktionsbedingung ist für die Synthese enantiomerenreiner
benzimidazolsubstituierter Binaphthylliganden unvorteilhaft, so dass eine mildere
Methode ausgehend von Arylamiden über eine Iminoetherzwischenstufe getestet
wurde. Amide (I) stehen mit ihrer Iminolform (II) in einem tautomeren Gleichgewicht
(Abb. 97), was auch bei Binaphthylamid 24 anhand der breiten Singulettsignale bei
Ergebnisse und Diskussion
88
5.95 ppm und 9.39 ppm im 1H-NMR-Spektrum beobachtet werden konnte. Bei den
von S. Dettmann durchgeführten Umsetzungen verschieden substituierter Benzamide mit Triethyloxoniumtetrafluoroborat (Meerwein-Salz) stabilisiert sich Form II
unter O-Ethylierung und Bildung eines Imidsäureethylesters (III). Die anschließende
Reaktion von III mit 1,2-Phenylendiamin in absolutiertem EtOH führt bereits bei 80 °C
zu entsprechenden Benzimidazolen.[46d]
O
OH
OEt
Et3OBF4
NH2
I
NH x HBF4
NH
II
III
[46d]
Abb. 97: Tautomerie und Reaktion mit Et3OBF4 am Beispiel von Benzamid.
In dieser Arbeit wurde das racemische Amid 24 zunächst in absolutiertem CH2Cl2
suspendiert, mit etherischer Et3OBF4-Lösung versetzt und die entstandene gelbe
Lösung für 24 h bei RT gerührt. Die Iminoetherzwischenstufe konnte jedoch weder
durch Zugabe von Et2O noch durch starkes Abkühlen ausgefällt werden. Daher
wurden die Lösungsmittel entfernt und der erhaltene Feststoff direkt mit dem Diamin
in EtOH für 5 h unter Rückfluss erhitzt (Abb. 98).
H
N
i) 1M Et3OBF4 -Lsg. / CH2Cl2
C(O)NH2
P(O)Ph2
24
ii) 1,2-Phenylendiamin / EtOH
N
P(O)Ph2
29
(< 10%)
Abb. 98: Versuche zur Synthese eines benzimidazolsubstituierten Phosphanoylbinaphthyls 29.
Die NMR-spektroskopischen Untersuchungen des nach der Aufarbeitung isolierten
orangefarbenen Öls ergaben jedoch, dass es sich dabei hauptsächlich um das Edukt
Ergebnisse und Diskussion
24 handelte. Im
89
31
P-NMR-Spektrum deutete zwar ein kleines Signal bei 33.3 ppm auf
eine geringe Umsetzung hin, aber die zugehörigen Protonensignale waren im
1
H-NMR-Spektrum zu stark von denen des Amids 24 überlagert (Abb. 99). Daher
konnte anhand dieser Daten keine genaue Aussage bezüglich der Entstehung des
31.6
neuen benzimidazolsubstituierten Binaphthyls 29 getroffen werden.
33.3
24
CDCl3
50
40
30
10
20
9
10
0
8
7
6
5
δ [ppm]
1
Abb. 99: H-NMR- und
31
P-NMR-Spektrum des orangefarbenen Öls zeigen hauptsächlich Edukt 24.
Einen Anhaltspunkt dafür lieferte aber ein Signal bei ~ 571 im MALDI-TOF-Massenspektrum (Abb. 100). Auf diese Weise erfolgte der Nachweis für das in geringen
Mengen (< 10%) entstandene P,N-Binaphthyl 29. Die erneute Durchführung der
Reaktionen mit deutlich längerer Reaktionszeit (70 h) bei der Umsetzung mit
o-Phenylendiamin zeigte jedoch keine Auswirkung auf die Bildung von 29. Die NMRDaten entsprachen denen des ersten Ansatzes. Vermutlich war bereits die
Ethylierung bei RT trotz Reaktionszeit von 24 h nur in sehr geringem Maße erfolgt.
Ergebnisse und Diskussion
90
40000
H
N
C(O)NH2
35000
P(O)Ph2
N
Intensität [a.u.]
30000
P(O)Ph2
25000
20000
15000
10000
5000
0
450
500
550
600
650
m/z
Abb. 100: MALDI-TOF-Massenspektrum des öligen Rückstandes.
Neben der geringen Reaktivität der freien Amidfunktion könnte auch der sterisch
anspruchsvolle Phosphanoylsubstituent diese Zyklisierung verhindert haben. Eine
Isolierung des reinen Binaphthyls 29 war auch nach einigen Aufreinigungsversuchen
nicht möglich. Das Signal im Massenspektrum blieb somit der einzige Nachweis für
dessen Existenz.
Aufgrund dieser Ergebnisse bzw. der Verwendung des Amids 24 bei der Synthese
des Triazolliganden 27 wurden bisher keine weiteren Versuche zur Darstellung eines
benzimidazolsubstituierten Binaphthyls 29 durchgeführt.
Zusammenfassung und Ausblick
91
4 Zusammenfassung und Ausblick
4.1 Zusammenfassung
Das Ziel dieser Arbeit war die Synthese neuer chiraler P,N-Binaphthylliganden mit
verschiedenen Heterozyklen wie Pyrazol oder Triazol als N-Donoreinheit für die
enantioselektive Katalyse. Schon der Aufbau eines geeigneten unsymmetrisch
substituierten Binaphthylgerüstes stellte eine erste Herausforderung dar. Die
zunächst durchgeführten Suzukikupplungsreaktionen von 2-Acetylnaphthyltriflat 1 mit
1-Naphthylboronsäure 3 verliefen ohne Bildung des entsprechenden Binaphthyls 4
(Abb. 101).
HO
OTf
OH
B
Ac
OBn
Pd-Kat.
Ac
+
OBn
1
3
4
Abb. 101: Versuche zur Synthese des unsymmetrischen Binaphthylsystems 4 via Suzuki-Kupplung.
Mit der Synthese des symmetrischen Grundgerüstes 1,1’-Binaphth-2,2’-ol (6) durch
oxidative Kupplung von 2-Naphthol wurde eine erfolgversprechendere Alternative
gefunden. Der Vorteil dieser Methode war, dass die Racematspaltung von 6 mit
N-Benzylcinchonidiniumchlorid (7) beide Enantiomere S-6 und R-6 in guten Ausbeuten (> 80%) und ee-Werten von ≥ 99% lieferte. Die entsprechenden Bistriflate S-8
und R-8 ermöglichten schließlich den Zugang zur Darstellung enantiomerenreiner
C1-symmetrischer Binaphthyle (Abb. 102).
Zusammenfassung und Ausblick
92
X
X
P(O)Ph2
P(O)Ph2
S-10
X=OTf
R-10
S-11
X=CN
R-11
S-15
X=COOMe
R-15
Abb. 102: Ausgehend von Bistriflat S-8 bzw. R-8 erhaltene C1-symmetrische Binaphthyle.
Die weiteren Umsetzungen dieser Binaphthylsysteme führten zur neuen Acetylverbindung S-12 bzw. zu den bereits bekannten Amiden S-24 und R-24 als zentrale
Ligandvorstufen. Während die amidsubstituierten Binaphthyle 24 durch Verseifung
der enantiomerenreinen Nitrile 11 in guten Ausbeuten zugänglich waren, mussten für
die Synthese des neuartigen Acetylbinaphthyls 12 verschiedene Reaktionen
ausgehend von Nitril 11 bzw. Ester 15 getestet werden. Durch die Kondensation der
Vorstufen S-12 und S-24 mit N,N-Dimethylformamiddimethylacetal sowie der
anschließenden Zyklisierung mit Hydrazin-Monohydrat gelang es den Pyrazol- bzw.
Triazolring in das Binaphthylgerüst einzuführen. Die Reduktion der Phosphanoyleinheit mit Trichlorsilan komplettierte die Ligandsynthesen von S-20 und S-27
(Abb. 103). Während vom Triazolliganden 27 die Synthese beider Enantiomere
durchgeführt wurde, konnte vom Pyrazolliganden 20 im Rahmen dieser Arbeit nur
das S-Enantiomer erhalten werden.
Alle in dieser Arbeit synthetisierten Verbindungen wurden durch NMR-spektroskopische Messungen eindeutig nachgewiesen und mit weiteren Analysemethoden
vollständig charakterisiert. Zusätzlich konnte anhand der Röntgenstrukturanalyse die
Festkörperstruktur einiger Ligandvorstufen ermittelt werden. Eine Racemisierung der
enantiomerenreinen Binaphthyle wurde aufgrund der meist milden Reaktionsbedingungen ausgeschlossen. Dennoch erfolgte mit der Bestimmung des Drehwertes [α] eine Überprüfung der optischen Reinheit sowohl von den bekannten als
auch von den erstmalig synthetisierten Binaphthylsystemen.
Zusammenfassung und Ausblick
93
OTf
5 Stufen
3 Stufen
OTf
C(O)Me
C(O)NH2
S-8
P(O)Ph 2
P(O)Ph2
S-12
S-24
N
N
N
O
O
Ph2(O)P
Ph2(O)P
S-25
S-18
2 Stufen
2 Stufen
X
N
NH
PPh2
S-20 X=CH (8%)
S-27 X=N
(27%)
Abb. 103: Übersicht der wichtigsten Zwischenstufen zur Synthese der chiralen
P,N-Binaphthylliganden S-20 und S-27.
Die neuen P,N-Liganden 20 und 27 wurden im weiteren Verlauf der Arbeit auf ihre
Fähigkeit zur Koordination an Übergangsmetallen wie Palladium untersucht. Die
Komplexierung mit PdCl2(PhCN)2 konnte bislang jedoch nur mit dem Triazolliganden
27 erfolgreich durchgeführt werden. Spektroskopische und kristallographische Untersuchungen zeigten dabei einen interessanten Aspekt im Koordinationsverhalten
dieses neuen P,N-Binaphthyls. Anhand der NMR-Daten wurde beim racemischen
Liganden 27, analog zu dem von Hayashi et al.[13] erhaltenen Pd-Komplex mit
Zusammenfassung und Ausblick
94
enantiomerenreinem Phosphinooxazolinligand, hauptsächlich die monomere PdCl2Struktur festgestellt. Bei den jeweiligen Enantiomeren S-27 und R-27 konnte
dagegen die Bildung eines dimeren Pd2Cl2-Komplexes beobachtet und durch eine
Röntgenstrukturanalyse von R-28 bestätigt werden (Abb. 104).
Abb. 104: Kristallstruktur des dimeren Pd-Komplexes R-28.
Zusammenfassung und Ausblick
95
4.2 Ausblick
In zukünftigen Arbeiten sollten zunächst Untersuchungen zur katalytischen Aktivität
der dimeren Palladazyklen S-28 und R-28 bzw. der Liganden S-27 und R-27 in
Pd-katalysierten Reaktionen[12, 13] wie der Heck-Arylierung oder der allylischen
Alkylierung durchgeführt werden. Erst nach ausbleibender oder zu geringer Aktivität
wären auch Modifikationen der Liganden durch Einführung verschiedener Substituenten anstelle der CH-Gruppe im Triazolring denkbar. Des Weiteren gilt es die
bestehende Synthese des Pyrazolliganden S-20 zu optimieren. Vor allem bei der
zentralen Acetylvorstufe S-12 könnte durch die Umsetzung des Nitrils S-11 mit dem
Grignardreagenz MeMgI, aufgrund der besseren Löslichkeit dieses Enantiomers,
eine höhere Produktbildung erzielt werden. Ausgehend vom Acetylbinaphthyl S-12
ließe sich auch ein weiterer P,N-Ligand mit Pyrimidineinheit synthetisieren
(Abb. 105).[47]
NH
OMe
O
N
OMe
R
H
O
R
N
NH2
N
N
R
R = 2-Naphthyl
Abb. 105: Synthese von 4-(2’-Naphthyl)pyrimidin.
Ein Vorteil bei diesem Liganden wäre, dass keine NH-Funktion vorhanden ist, die
anschließende Komplexierungen oder Katalyseexperimente beeinflussen würde.
Experimenteller Teil
96
5 Experimenteller Teil
5.1 Allgemeines zur Durchführung
Käuflich erworbene Chemikalien wurden ohne weitere Aufreinigung eingesetzt. Die
Synthese wichtiger Edukte nach literaturbekannten[28-32] Methoden wird in Kapitel
5.3.1 beschrieben. Bei der Säulenchromatographie diente Kieselgel (Merck 60,
Korngröße 0.063–0.200 mm) als stationäre Phase.
5.2 Verwendete Geräte
NMR-Spektroskopie:
-
Bruker DPX 200 (1H: 200.1 MHz, 13C: 50.3 MHz, 31P: 81.0 MHz)
-
Bruker DPX 400 (1H: 400.1 MHz, 13C: 100.6 MHz, 31P: 162.0 MHz)
-
Bruker AVANCE 600 (1H: 600.1 MHz, 13C: 150.9 MHz)
Die Angabe der chemischen Verschiebung erfolgt in δ-Werten [ppm] mit TMS bzw.
dem jeweiligen Lösungsmittel (1H- und
13
C-NMR) und 85%iger Phosphorsäure (31P-
NMR) als internen Standard. Abkürzungen: s = Singulett, d = Dublett, t = Triplett,
m = Multiplett
Elementaranalyse:
Perkin-Elmer Analyzer EA 2400 CHN
Röntgenstrukturanalyse:
-
Stoe-IPDS Röntgendiffraktometer
-
Oxford Diffraction Gemini S Ultra
Weitere Angaben zu den einzelnen Röntgenstrukturen befinden sich im Anhang.
Massenspektroskopie:
Bruker MALDI-TOF-Massenspektrometer (Typ Bruker ultraflex TOF/TOF)
Die Proben wurden zum Messen in einer Matrix aus 2-(4-Hydroxybenzolazo)benzoesäure suspendiert.
Experimenteller Teil
97
Polarimetrie:
Krüss P 3001 RS Polarimeter
Die Messung erfolgte in einer 10-cm-Quarzglasküvette bei den angegebenen
Temperaturen.
Drehwert [α ]D =
T
α ∗ 100
d ∗c
° ∗ ml
in
.
dm ∗ g
IR-Spektroskopie:
Jasco FT-IR-6100typeA-Spektrometer
Messung als KBr-Pressling; es wurden nur charakteristische sowie intensive Banden
berücksichtigt und mittels folgender Intensitäten angegeben: s = strong, m = middle,
w = weak, br = broad.
Schmelzpunktbestimmung:
Bibby Sterlin Stuart SMP3
Trocknung von Lösungsmitteln:
Mbraun MB-SPS Lösungsmitteltrocknungsanlage
Die Trocknung erfolgte für Tetrahydrofuran, Diethylether, Dichlormethan und Toluol.
Experimenteller Teil
98
5.3 Synthesevorschriften
5.3.1 Synthese wichtiger Edukte
5.3.1.1
Synthese von Diphenylphosphanoxid (9)[32]
Triphenylphosphan (40.0 g, 0.15 mol) wird in THF (400 ml, abs.) unter N2-Atmosphäre vorgelegt. Anschließend erfolgt die Zugabe von Lithiumdrahtstücken (2.20 g,
0.32 mol). Die Reaktionsmischung wird bei RT gerührt bis sich das Lithium fast
vollständig gelöst hat (mind. 12 h). Danach wird die entstandene dunkelrote Lösung
auf 0 °C gekühlt und über einen Tropftrichter erfol gt die langsame Zugabe von dest.
H2O (200 ml). Die nun fast farblose Lösung wird mehrmals mit Et2O (240 ml)
extrahiert. Die vereinten etherischen Phasen werden zunächst mit verd. HCl (1:15,
2 x 80 ml) und im Anschluss mit dest. H2O gewaschen bis die Lösung neutral ist. Die
Trocknung der organischen Phase erfolgt mittels Na2CO3. Nach dem Entfernen des
Lösungsmittels wird ein gelbliches bis farbloses Öl isoliert, welches sowohl Diphenylphosphan als auch das entsprechende Oxid 9 enthält. Die vollständige Oxidation
wird durch Rühren an Luft erreicht und wird meist durch eine Trübung des Öls bzw.
Feststoffbildung ersichtlich. Das Phosphanoxid 9 (24.3 g, 0.12 mol, 79% d. Th.) kann
als gelbliches bis farbloses Öl bzw. wachsartiger Feststoff isoliert werden.
H
O
P
Charakterisierung:
Diphenylphosphanoxid (9)
9
C12H11OP (202.19):
H-NMR (CDCl3, 400.1 MHz): δ = 7.42–7.47 (m, 4H, Harom.), 7.50–7.52 (m, 2H,
1
Harom.), 7.62–7.68 (m, 4H, Harom.), 8.02 (d, JP,H = 484 Hz, 1H, P-H).
C-NMR (CDCl3, 100.6 MHz): δ = 128.9, 129.0, 130.6, 130.8, 132.5, 132.6.
13
P-NMR (CDCl3, 162.0 MHz): δ = 22.3 (s).
31
Experimenteller Teil
5.3.1.2
99
Synthese und Rückgewinnung von N-Benzylcinchonidiniumchlorid
(NBCC, 7)
Synthese[30]
Eine Mischung aus Cinchonidin (20.0 g, 67.9 mmol) und Benzylchlorid (8.60 g,
67.9 mmol, 7.82 ml) wird in Ethanol (200 ml) gelöst und für 3–4 h unter Rückfluss
erhitzt. Nach Abkühlen auf RT und dem Entfernen des Lösungsmittels wird das
entstandene dunkelrote Öl mit Diethylether (mind. 3 x 50 ml) gewaschen bis sich ein
dunkelroter zäher Feststoff bildet, welcher anschließend aus dest. H2O umkristallisiert wird. NBCC 7 (21.4 g, 50.8 mmol, 75% d. Th.) bildet hellbraune bis gelbliche
Kristalle.
Rückgewinnung[29b]
Sämtliche wässrige Phasen der Racematspaltung von BINOL 6 werden vereinigt,
eingeengt und mit NaHCO3 neutralisiert. Der entstehende Niederschlag wird
abfiltriert, mit kaltem H2O gewaschen und anschließend im ÖPV getrocknet. Die
Rückgewinnung von Verbindung 7 als beigefarbenes bis weißes Pulver ist mit
Ausbeuten von bis zu 85% möglich.
H
Cl
N+
H
HO
H
N
7
-
Experimenteller Teil
100
Charakterisierung:
(8S,9R)-(-)-N-Benzylcinchonidiniumchlorid (7)
C26H29ClN2O × 1.25 H2O (443.47): ber. (gef.) C 70.41 (70.18), H 7.16 (7.31), N 6.32
(6.40).
Smp.: 199–201 °C (209–211 °C)
[30]
.
H-NMR (CDCl3, 600.1 MHz): δ = 1.24–1.28 (m, 1H), 1.78–1.81 (m, 1H), 1.96 (br, s,
1
1H), 2.04–2.10 (m, 2H), 2.66 (br, s, 1H), 3.14–3.18 (m, 1H), 3.28–3.32 (m, 1H),
3.82–3.84 (m, 1H), 3.95–3.98 (m, 1H), 4.43–4.46 (m, 1H), 4.90–4.92 (m, 1H),
5.10–5.12 (m, 1H), 5.15–5.18 (m, 1H), 5.46–5.48 (m, 1H), 5.62–5.67 (m, 1H),
6.54–6.55 (m, 1H), 7.38–7.39 (m, 1H), 7.53–7.54 (m, 3H), 7.70–7.73 (m, 1H),
7.79–7.82 (m, 4H), 8.07–8.09 (m, 1H), 8.31–8.32 (m, 1H), 8.95–8.96 (m, 1H). [30]
C-NMR (d6-DMSO, 150.9 MHz): δ = 21.0, 24.2, 25.9, 36.7, 50.3, 59.1, 62.2, 63.6,
13
67.6, 116.3, 120.2, 123.8, 124.3, 127.2, 128.1, 128.8, 129.3, 129.7, 130.0, 133.8,
138.0, 145.4, 147.5, 150.1.[30]
[α ]20D = -176 (c = 1, H2O); ( [α ]20D = -179.4, c = 1, H2O)[30].
5.3.1.3
Synthese und Racematspaltung von 1,1’-Binaphth-2,2’-ol (6)
Synthese[28]
2-Naphthol (30.0 g, 0.21 mol) wird in einer Lösung aus FeCl3×6H2O (114 g,
0.42 mol) in dest. H2O (430 ml) suspendiert und für 3 h bei 50 °C gerühr t. Das
Reaktionsgemisch wird anschließend filtriert, der feste Rückstand mehrmals mit dest.
H2O gewaschen, getrocknet und aus Toluol umkristallisiert. BINOL 6 (21.2 g,
0.074 mol, 70%) wird als beigefarbener feinkristalliner Feststoff isoliert.
Racematspaltung[29a]
BINOL (R,S)-6 (30.0 g, 0.11 mol) und NBCC 7 (24.3 g, 0.06 mol) werden in MeCN
(400 ml) suspendiert und für 4 h unter Rückfluss erhitzt. Danach wird das Gemisch
abgekühlt und über Nacht bei RT gerührt. Vor der Filtration erfolgt für 2 h eine
weitere Abkühlung der Mischung auf 0 °C. Das Filtra t wird anschließend bis zur
Trockene eingeengt, erneut in EtOAc gelöst sowie mit 1 N HCl (2 x 100 ml) und ges.
NaCl-Lösung (100 ml) gewaschen. Nach der Trocknung der organischen Phase mit
Experimenteller Teil
101
Na2SO4, dem Entfernen des Lösungsmittels und der Umkristallisation aus EtOAc
kann die Verbindung S-6 (12.5 g, 0.043 mol, 83% d. Th.) als beigefarbene Kristalle
isoliert werden.
Der bei der Filtration erhaltene Feststoff wird mit MeCN (50 ml) gewaschen, danach
in MeOH (100 ml) suspendiert und für 24 h unter Rückfluss erhitzt. Nach Abkühlen
auf RT erfolgt erneut eine Filtration und der feste Filterrückstand wird mit wenig
MeOH (20 ml) gewaschen. In einer Mischung aus EtOAc (300 ml) und 1 N HCl
(150 ml) wird der Feststoff anschließend 30 min (bis zur Auflösung) gerührt. Danach
erfolgt die Phasentrennung und die organische Phase wird nochmals mit 1 N HCl
(150 ml) und NaCl-Lösung (150 ml) extrahiert sowie mit Na2SO4 getrocknet. Die
Verbindung R-6 kann nach Entfernen des Lösungsmittels und Umkristallisation aus
EtOAc in Form gelblicher Kristalle (12.7 g, 0.044 mol, 85% d. Th.) erhalten werden.
8
8a
1
7
OH
OH
OH
OH
2
6
5
4a
3
4
S-6
R-6
Charakterisierung:
1,1’-Binaphth-2,2’-ol (6)
C20H14O2 (286.32)
Smp.: (R,S)-11 216–218 °C (216–218 °C)
S-11 / R-11 206–208 °C (207–210 °C)
[29a]
[28]
;
.
H-NMR (d6-DMSO, 600.1 MHz): δ = 6.96 (d, J = 8.4 Hz, 2H, H8), 7.15–7.17 (m, 2H,
1
H6), 7.22–7.24 (m, 2H, H7), 7.34 (d, J = 8.9 Hz, 2H, H3), 7.84–7.87 (m, 4H, H5,4),
9.26 (s, 2H, OH).
C-NMR (d6-DMSO, 150.9 MHz): δ = 115.2 (C1), 118.4 (C3), 122.1 (C6), 124.2 (C8),
13
125.7 (C7), 127.7 (C5), 128.0 (C4a), 128.5 (C4), 134.0 (C8a), 152.8 (C2).
IR (KBr, cm-1): ν~ = 3486 (s), 3403 (s), 1618 (s), 1597 (s), 1509 (m), 1470 (m), 1461
(m), 1381 (s), 1322 (m), 1273 (m), 1253 (m), 1217 (s), 1175 (s), 1146 (s), 1125 (s),
826 (s), 816 (s), 751 (s), 574 (m).
Experimenteller Teil
102
[α ]21D
[29a]
= - 34.5 (S-6, c = 1, THF); ( [α ]21
.
D = - 34.0, c = 1, THF)
[α ]21D
= + 34.5 (R-6, c = 1, THF); ( [α ]D = + 34.3, c = 1, THF)[29a].
5.3.1.4
21
Synthese von 1,1’-Binaphthyl-2,2’-bistrifluormethansulfonat (8)[31a]
S-6 (10.1 g, 35.3 mmol) wird in CH2Cl2 (150 ml, abs.) unter N2-Atmosphäre gelöst
und mit Pyridin (7.91 g, 100 mmol, 8.09 ml, ultratrocken) versetzt. Anschließend wird
das Reaktionsgemisch auf 0 °C gekühlt. Die Zugabe v on Trifluormethansulfonsäureanhydrid (28.2 g, 100 mmol, 16.6 ml) erfolgt langsam über ein Septum mittels
Spritze. Nach Beendigung der Zugabe wird das Reaktionsgemisch 2 h bei RT
gerührt. Der bei der Reaktion entstehende Niederschlag wird abfiltriert und die
Lösung am Rotationsverdampfer eingeengt. Der Rückstand wird mit Et2O (100 ml,
abs.) versetzt, erneut filtriert und der Ether entfernt. Anschließend erfolgt eine
Aufreinigung durch Filtration über Kieselgel (CH2Cl2 / n-Hexan, 1:1). Das Bistriflat
S-8 (16.6 g, 30.2 mmol, 86% d. Th.) kann nach Entfernen der Lösungsmittel als
weißer, wachsartiger Feststoff isoliert werden.
Die Verbindung R-8 wird bei gleicher Ansatzgröße von 10.1 g (35.3 mmol) R-6 und
analoger Durchführung ebenfalls als weißer, wachsartiger Feststoff (16.1 g,
29.2 mmol, 83% d. Th.) erhalten.
8
1
8a
7
OTf
OTf
OTf
OTf
2
6
5
4a
3
4
S-8
Charakterisierung:
1,1’-Binaphthyl-2,2’-bistrifluormethansulfonat (8)
C22H12F6O6S2 (550.45)
R-8
Experimenteller Teil
103
Smp.: S-12 80–82 °C (82–84 °C)
R-12 82–84 °C (67–71 °C)
[31c]
[31b]
;
.
H-NMR (CDCl3, 400.1 MHz): δ = 7.27 (d, J = 9.2 Hz, 2H, H8), 7.40–7.44 (m, 2H, H6),
1
7.58–7.61 (m, 2H, H7), 7.63 (d, J = 9.2 Hz, 2H, H3), 8.01 (d, J = 8.4 Hz, 2H, H5),
8.15 (d, J = 9.2 Hz, 2H, H4).
C-NMR (CDCl3, 100.6 MHz): δ = 118.3 (q, J = 320 Hz, CF3), 119.5 (C3), 123.6 (C1),
13
126.9 (C6), 127.5 (C8), 128.1 (C7), 128.5 (C5), 132.1 (C4), 132.5 (C4a), 133.3 (C8a),
145.6 (C2).
IR (KBr, cm-1): ν~ = 3070 (w), 1510 (m), 1419 (s), 1404 (s), 1250 (s), 1220 (s), 1176
(s), 1139 (s), 1065 (m), 959 (s), 935 (s), 871 (m), 856 (m), 835 (s), 809 (s), 753 (m),
704 (m), 637 (s), 616 (s), 589 (m), 497 (s).
[α ]23D
[31b]
= + 144.0 (S-8, c = 1, CHCl3); ( [α ]23
.
D = + 146.3, c = 1.01, CHCl3)
[α ]23D
[31c]
= - 150.0 (R-8, c = 1, CHCl3); ( [α ]20
.
D = - 147.7, c = 1.01, CHCl3)
Experimenteller Teil
104
5.3.2 Synthese des Pyrazolliganden S-20
5.3.2.1
Synthese von 2-Carbomethoxy-2’-trifluormethansulfonoyl-1,1’binaphthyl (14)[34]
Zu einer Lösung von Bistriflat S-8 (9.70 g, 17.6 mmol) in DMSO (480 ml) werden
Pd(OAc)2 (359 mg, 1.61 mmol), dppp (664 mg, 1.61 mmol), iPr2EtN (24.3 g,
0.19 mol, 32.0 ml) und MeOH (320 ml) gegeben. Dieses Reaktionsgemisch wird
anschließend unter CO-Atmosphäre bei 70 °C für 24 h gerührt. Danach werden die
Lösungsmittel im ÖPV entfernt und der rotbraune, ölige Rückstand erneut in EtOAc
(150 ml) gelöst. Die rotbraune Lösung wird mit dest. H2O (2 x 100 ml) und ges. NaClLösung (100 ml) gewaschen sowie mit Na2SO4 getrocknet. Der nach Entfernen des
Lösungsmittels erhaltene Rückstand wird säulenchromatographisch (EtOAc / nHexan, 1:5, Rf = 0.40) gereinigt, so dass der Monoester S-14 (5.50 g, 11.9 mmol,
68% d. Th.) als gelblicher Feststoff isoliert werden kann.
Bei einer Ansatzgröße von 7.40 g (13.4 mmol) R-8 und analoger Durchführung wird
die Verbindung R-14 (2.78 g, 6.04 mmol, 45% d. Th.) ebenfalls als gelblicher
Feststoff erhalten.
S-14
COOMe
COOMe
OTf
OTf
R-14
Charakterisierung:
2-Carbomethoxy-2’-trifluormethansulfonoyl-1,1’-binaphthyl (14)
C23H15F3O5S (460.42).
Smp.: S-13 / R-13 113–115 °C.
Experimenteller Teil
105
H-NMR (CDCl3, 600.1 MHz): δ = 3.60 (s, 3H, CH3), 7.22–7.25 (m, 2H, Harom.),
1
7.33–7.37 (m, 2H, Harom.), 7.54–7.60 (m, 2H, Harom.), 7.64 (d, J = 8.8 Hz, 1H, Harom.),
7.99–8.02 (m, 2H, Harom.), 8.07–8.11 (m, 2H, Harom.), 8.30 (d, J = 8.8 Hz, 1H, Harom.).
C-NMR (CDCl3, 100.6 MHz): δ = 52.2 (CH3), 118.2 (q, J = 320 Hz, CF3), 119.3,
13
126.2, 126.5, 126.9, 127.2, 127.4, 127.6, 128.1, 128.2, 128.3, 128.7, 129.4, 129.7,
130.3, 132.1, 132.6, 133.5, 133.8, 135.2, 144.4 (20 Carom.), 166.7 (C=O).
IR (KBr, cm-1): ν~ = 3059 (m), 2952 (m), 1732 (s, C=O), 1508 (m), 1458 (m), 1416
(s), 1323 (m), 1281 (s), 1247 (s), 1204 (s), 1139(s), 1065 (m), 1000 (m), 955 (s), 941
(s), 841 (s), 810 (m), 764 (s), 703 (m), 677 (m), 622 (s), 602 (s), 500 (m), 492 (m).
5.3.2.2
Synthese von 2-Carbomethoxy-2’-diphenylphosphanoyl-1,1’binaphthyl (15)[34]
Der Monoester S-14 (2.50 g, 4.88 mmol), Pd(OAc)2 (110 mg, 0.49 mmol), dppp
(201 mg, 0.49 mmol), das Phosphanoxid 9 (1.97 g, 9.76 mmol) und iPr2EtN (5.09 g,
39.4 mmol, 6.70 ml) werden in DMSO (50 ml) gelöst und auf 100 °C erhitzt. Nach
48 h werden alle flüchtigen Bestandteile im ÖPV entfernt und der ölige rotbraune
Rückstand erneut in EtOAc (50 ml) aufgenommen. Diese Lösung wird anschließend
mit dest. H2O (3 x 30 ml) und ges. NaCl-Lösung (30 ml) gewaschen sowie mit
Na2SO4 getrocknet. Nach Entfernen des Lösungsmittels erfolgt eine säulenchromatographische Aufreinigung (EtOAc / n-Hexan 2:1, Rf = 0.30) des Rückstandes und
Verbindung S-15 kann als gelblicher Feststoff (2.10 g, 4.10 mmol, 75% d. Th.) isoliert
werden.
Die Verbindung R-15 wird bei einer Ansatzgröße von 2.78 g (6.04 mmol) R-14 und
analoger Durchführung ebenfalls als gelblicher Feststoff (2.40 g, 4.68 mmol, 78%
d. Th.) erhalten.
Experimenteller Teil
106
COOMe
COOMe
P(O)Ph2
P(O)Ph2
S-15
R-15
Charakterisierung:
2-Carbomethoxy-2’-diphenylphosphanoyl-1,1’-binaphthyl (15)
C34H25O3P (512.53)
Smp.: (R,S)-15 164–166 °C; ( R-15 174–176 °C) [34].
H-NMR (CDCl3, 400.1 MHz): δ = 3.52 (s, 3H, CH3), 6.98 (d, J = 8.4 Hz, 1H, Harom.),
1
7.05–7.10 (m, 4H, Harom.), 7.18–7.25 (m, 4H, Harom.), 7.32–7.38 (m, 4H, Harom.),
7.48–7.53 (m, 3H, Harom.), 7.60–7.65 (m, 1H, Harom.), 7.72 (d, J = 8.0 Hz, 1H, Harom.),
7.78 (d, J = 8.8 Hz, 1H, Harom.), 7.90–7.95 (m, 2H, Harom.), 8.03 (d, J = 8.8 Hz, 1H,
Harom.).
C-NMR (CDCl3, 100.6 MHz): δ = 51.9 (CH3), 126.0, 126.3, 127.0, 127.3, 127.4,
13
127.7, 127.8, 127.8(4), 127.8(9), 127.9, 128.0, 128.1, 128.2, 128.5, 128.6, 128.8,
129.0, 130.9, 131.2, 131.4, 131.5, 131.9, 132.0, 132.2, 132.3, 132.7, 133.4, 133.7,
134.4, 134.7, 138.3, 144.4 (32 Carom.), 166.8 (C=O).
P-NMR (CDCl3, 162.0 MHz): δ = 28.6 (s).
IR (KBr, cm-1): ν~ = 3058 (m), 2980 (w), 2946 (w), 1725 (s, C=O), 1437 (s, P-Aryl),
31
1237 (m), 1279 (s), 1245 (s), 1195 (s, P=O), 1136 (s), 1113 (s), 875 (m), 813 (m),
764 (s), 753 (s), 721 (s), 539 (s), 526 (s).
5.3.2.3
Synthese von 2’-Diphenylphosphanoyl-1,1’-binaphthyl-2carbonsäure (16)[34]
S-15 (3.00 g, 5.85 mmol) wird in MeOH (70 ml) gelöst, mit 40%iger KOH-Lösung
(15 ml) versetzt und für 12 h unter Rückfluss erhitzt. Nach Abkühlen der Reaktionslösung auf 0 °C erfolgt die Zugabe von konz. HCl bi s pH ~ 2. Anschließend wird mit
EtOAc (3 x 50 ml) extrahiert und die organische Phase mit Na2SO4 getrocknet. Nach
Experimenteller Teil
107
Entfernen des Lösungsmittels kann die Säure S-16 als weißer Feststoff bzw. in Form
farbloser Kristalle (2.73 g, 5.48 mmol, 94% d. Th.) isoliert werden.
Die Verbindung R-16 konnte bei anderen Reaktionsdurchführungen (siehe Kapitel
3.2.4) als Nebenprodukt identifiziert und als weißer Feststoff isoliert werden.
COOH
COOH
P(O)Ph2
P(O)Ph2
S-16
R-16
Charakterisierung:
2’-Diphenylphosphanoyl-1,1’-binaphthyl-2-carbonsäure (16)
C33H23O3P (498.48): ber. (gef.) C 79.51 (79.63), H 4.65 (4.60).
Smp.: S-15 220–221 °C.
H-NMR (CDCl3, 400.1 MHz): δ = 6.22 (d, J = 8.8 Hz, 1H, Harom.), 6.65–6.68 (m, 1H,
1
Harom.), 6.95–7.00 (m, 2H, Harom.), 7.11–7.19 (m, 5H, Harom.), 7.26–7.35 (m, 2H,
Harom.), 7.51–7.55 (m, 3H, Harom.), 7.60–7.66 (m, 2H, Harom.), 7.73–7.78 (m, 3H,
Harom.), 7.88–7.95 (m, 3H, Harom.).
C-NMR (CDCl3, 100.6 MHz): δ = 123.8, 126.0, 126.3, 126.5, 126.9, 127.1, 127.3,
13
127.5, 127.6, 127.9, 128.0, 128.1, 128.3, 128.7, 128.9, 129.0, 129.5, 129.8, 130.0,
130.9, 131.0, 131.1, 131.5, 131.8, 132.2, 132.3, 132.7, 132.9, 133.7, 134.9, 135.5,
142.4 (32 Carom.), 171.5 (C=O).
P-NMR (CDCl3, 162.0 MHz): δ = 35.6 (s).
IR (KBr, cm-1): ν~ = 3427 (br, w), 3054 (w), 1722 (s, C=O), 1437 (m), 1405 (m), 1157
31
(m), 1137 (m), 1119 (m), 745 (m), 703 (m), 692 (m), 539 (m), 525 (m).
[α ]21D
= - 204 (S-16, c = 0.54, CHCl3).
[α ]21D
= + 191 (R-16, c = 0.54, CHCl3).
Experimenteller Teil
5.3.2.4
108
Synthese von (S)-2’-Diphenylphosphanoyl-1,1’-binaphthyl-2-carbonsäurechlorid (S-17)
Die Säure S-16 (550 mg, 1.10 mmol) wird mit SOCl2 (15 ml) versetzt und für 2–3 h
unter Rückfluss erhitzt. Danach wird das überschüssige SOCl2 abdestilliert und der
ölige gelbe Rückstand im ÖPV getrocknet. Das Säurechlorid S-17 (570 mg,
1.10 mmol) wird quantitativ als gelber schaumartiger Feststoff isoliert.
COCl
P(O)Ph 2
S-17
Charakterisierung:
2’-Diphenylphosphanoyl-1,1’-binaphthyl-2-carbonsäurechlorid (S-17)
C33H22ClO2P (516.95).
Smp.: Zers. > 170 °C.
H-NMR (CDCl3, 400.1 MHz): δ = 6.89–6.95 (m, 2H, Harom.), 6.99–7.03 (m, 2H,
1
Harom.), 7.17–7.21 (m, 3H, Harom.), 7.27–7.53 (m, 20H, Harom.), 7.57–7.61 (m, 1H,
Harom.), 7.63–7.81 (m, 6H, Harom.), 7.87–7.89 (m, 2H, Harom.), 7.94–8.00 (m, 3H,
Harom.), 8.04–8.08 (m, 2H, Harom.), 8.12–8.16 (m, 2H, Harom.), 8.39–8.42 (m, 1H,
Harom.), 9.47 (br s, 2H, Harom.).
P-NMR (CDCl3, 162.0 MHz): δ = 66.2 (s).
IR (KBr, cm-1): ν~ = 3057 (w), 1769 (s), 1740 (m), 1437 (m), 1197 (m), 1119 (s), 979
31
(m), 936 (m), 820 (m), 766 (s), 750 (s), 726 (s), 704 (s), 601 (m), 540 (s).
Experimenteller Teil
5.3.2.5
109
Synthese von (S)-2-Acetyl-2’-diphenylphosphanoyl-1,1’-binaphthyl
(S-12)
Für die Synthese des Lithiumdimethylcuprats wird CuI (381 mg, 2.0 mmol) in THF
(15 ml, abs.) vorgelegt und die Suspension unter N2-Atmosphäre auf -78 °C gekühlt.
Danach erfolgt die Zugabe von 1.6 M MeLi-Lsg. (2 x 1.3 ml) und das Reaktionsgemisch wird langsam auf -20 °C gebracht, wobei ein e gelbe Lösung entsteht.
Anschließend erfolgt eine erneute Abkühlung auf -78 °C und die langsame Zugabe
des in THF (10 ml) gelösten Säurechlorids S-17 (500 mg, 0.97 mmol). Die
Reaktionslösung wird für 4 h bei -20 °C gerührt und danach mit wässriger NH3-Lsg.
(25%ig, 10 ml) und Et2O (10 ml) versetzt. Nach der Phasentrennung wir die
organische Phase mit wässriger NH3-Lsg. und NaCl-Lsg. gewaschen bis keine
Blaufärbung der wässrigen Phase mehr auftritt. Anschließend erfolgt die Trocknung
der etherischen Phase mit Na2SO4. Das nach der Entfernung des Lösungsmittels
entstehende
gelbe
Öl
wird
säulenchromatographisch
(EtOAc / n-Hexan 2:1,
Rf = 0.34) gereinigt und die Acetylverbindung S-12 (270 mg, 0.54 mmol, 56 % d. Th.)
kann als farbloser Feststoff isoliert werden.
C(O)Me
P(O)Ph 2
S-12
Charakterisierung:
(S)-2-Acetyl-2’-diphenylphosphanoyl-1,1’-binaphthyl (S-12)
C34H25O2P (496.51): ber. (gef.) C 82.24 (82.20), H 5.08 (5.14).
Smp.: 120–122 °C.
H-NMR (CDCl3, 400.1 MHz): δ = 2.39 (s, 3H, CH3), 6.85 (d, J = 8.5 Hz, 1H, Harom.),
1
6.94–7.03 (m, 3H, Harom.), 7.08–7.13 (m, 2H, Harom.), 7.22–7.28 (m, 3H, Harom.),
7.30–7.34 (m, 3H, Harom.), 7.40–7.44
(m, 1H, Harom.), 7.48–7.53 (m, 2H, Harom.),
7.57–7.62 (m, 2H, Harom.), 7.68 (d, J = 8.2 Hz, 1H, Harom.), 7.80 (d, J = 8.6 Hz, 1H,
Harom.), 7.87–7.92 (m, 3H, Harom.).
Experimenteller Teil
110
C-NMR (CDCl3, 100.6 MHz): δ = 29.6 (CH3), 125.0, 126.4, 127.1(2), 127.1(5),
13
127.2, 127.5, 127.6, 127.7, 127.8, 128.0, 128.2(1), 128.2(6), 128.3, 128.8, 129.0,
130.7, 130.9, 131.0, 131.5, 131.6, 132.0, 132.1, 132.2, 132.8, 133.2, 133.5, 134.1,
134.2, 134.4, 135.5, 137.0, 144.6 (32 Carom.), 200.0 (C=O).
P-NMR (CDCl3, 162.0 MHz): δ = 28.2 (s).
IR (KBr, cm-1): ν~ = 3430 (br, w), 3055 (w), 1691 (s, C=O), 1441 (m, P-Aryl), 1237
31
(m), 1190 (s, P=O), 1114 (s), 812 (m), 744 (s), 697 (s), 535 (s), 525 (s).
[α ]23D
= - 29 (c=0.5, MeOH).
MS (MALDI): m/z = 497.12 [MH+].
5.3.2.6
Synthese von (S)-2-(N,N-Dimethylaminoprop-2-enon-1-yl)-2’diphenylphosphanoyl-1,1’-binaphthyl (S-18)
Die Acetylverbindung S-12 (150 mg, 0.30 mmol) wird in einem Überschuss DMFDMA
(5 ml) gelöst und für 15 h auf 140–160 °C (Ölbad) e rhitzt. Nach Abkühlen auf RT wird
die gelbe Lösung auf dest. H2O (40 ml) gegeben, der entstehende gelbe Feststoff
abfiltriert, mit n-Pentan gewaschen und anschließend im ÖPV getrocknet. Das
Produkt S-18 (115 mg, 0.21 mmol, 70% d. Th.) kann als gelber Feststoff isoliert
werden.
CH3
N
CH3
O
Ph2(O)P
S-18
Experimenteller Teil
111
Charakterisierung:
(S)-2-(N,N-Dimethylaminoprop-2-enon-1-yl)-2’-diphenylphosphanoyl-1,1’-binaphthyl
(S-18)
C37H30NO2P (551.61): ber. (gef.) C 80.56 (78.19), H 5.48 (5.81), N 2.54 (2.07).
Smp.: Zers. > 140 °C.
H-NMR (CDCl3, 600.1 MHz): δ = 2.44 (s, 3H, CH3), 2.72 (s, 3H, CH3), 5.08 (d,
1
J = 12.0 Hz, 1H, CH=CHNMe2), 6.96 (d, J = 7.2 Hz, 1H, Harom.), 7.05–7.07 (m, 1H,
Harom.), 7.15–7.19 (m, 4H, Harom.), 7.27–7.50 (m, 11H, 10 Harom.; -CH=CH-NMe2), 7.59
(d, J = 8.4 Hz, 1H, Harom.), 7.64–7.66 (m, 1H, Harom.), 7.74–7.76 (m, 2H, Harom.), 7.85
(d, J = 7.8 Hz, 1H, Harom.), 7.89 (d, J = 8.4 Hz, 1H, Harom.).
C-NMR (CDCl3, 150.9 MHz): δ = 36.8 (CH3), 44.6 (CH3), 97.8 (CH=CHNMe2),
13
125.4, 126.0, 126.1, 126.8, 127.3, 127.4, 127.5, 127.6, 127.7(1), 127.7(9), 127.8,
127.9, 127.9(5), 128.0, 128.3, 128.4, 128.5, 128.6, 131.0, 131.1, 131.9, 132.0, 132.1,
132.2, 133.3, 133.5, 134.1, 134.3, 139.9, 143.6 (29 Carom.; CH=CHNMe2), 192.5
(C=O).
P-NMR (CDCl3, 162.0 MHz): δ = 30.5 (s).
IR (KBr, cm-1): ν~ = 3413 (br, m), 3052 (m), 2923 (m), 2853 (m), 1635 (s, C=O), 1570
31
(s), 1556 (s), 1436 (s, P-Aryl), 1418 (m), 1357 (m), 1275 (m), 1196 (m, P=O), 1114
(s), 1090 (m), 816 (m), 750 (m), 722 (s), 701 (s), 638 (m), 540 (s), 525 (m), 514 (m).
[α ]26D
= - 250 (c=0.1, CHCl3).
MS (MALDI): m/z = 552.57 [MH+].
5.3.2.7
Synthese von (S)-2’-Diphenylphosphanoyl-2-(pyrazol-3-yl)-1,1’binaphthyl (S-19)
S-18 (200 mg, 0.36 mmol) und Hydrazin-Monohydrat (70 mg, 1.40 mmol, 0.70 ml)
werden in EtOH (10 ml) gelöst und für 15 h unter Rückfluss erhitzt. Anschließend
wird das Lösungsmittel entfernt und das Pyrazolylphosphanoylbinaphthyl S-19 kann
zunächst als beigefarbener Feststoff isoliert werden. Bei der Umkristallisation aus
Methanol oder Ethanol entstehen beigefarbene Kristalle von S-19 (140 mg,
0.27 mmol, 75% d. Th.).
Experimenteller Teil
112
N
NH
P(O)Ph2
S-19
Charakterisierung:
(S)-2’-Diphenylphosphanoyl-2-(pyrazol-3-yl)-1,1’-binaphthyl (S-19)
C35H25N2OP (520.56): ber. (gef.) C 80.75 (79.81), H 4.84 (5.01) N 5.38 (4.95).
Smp.: Zers. > 290 °C.
H-NMR (CDCl3, 400.1 MHz): δ = 5.79 (d, J = 1.6 Hz, 1H, H4-Pz), 6.53 (d, J = 8.4 Hz,
1
1H, Harom.), 6.81–6.85 (m, 1H, Harom.), 6.92–6.96 (m, 2H, Harom.), 7.05 (d, J = 8.4 Hz,
1H, Harom.), 7.10–7.14 (m, 1H, Harom.), 7.16–7.24 (m, 5H, 4 Harom.; H5-Pz), 7.39–7.52
(m, 5H, Harom.), 7.59–7.68 (m, 4H, Harom.), 7.79–7.86 (m, 3H, Harom.).
C-NMR (CDCl3, 100.6 MHz): δ = 105.4 (C4-Pz), 125.7, 126.1, 126.7, 127.3(7),
13
127.3(9), 127.7, 127.7(6), 127.8(1), 128.1, 128.2, 128.4, 128.5, 128.7, 128.9, 129.7
130.0, 130.7, 131.0, 131.1, 131.2, 131.9(7), 132.0, 132.1, 132.7, 133.0, 133.3, 133.4,
133.5, 134.6, 138.5, 143.2, 143.4 (30 Carom.; C3-Pz; C5-Pz).
P-NMR (CDCl3, 162.0 MHz): δ = 31.7 (s).
IR (KBr, cm-1): ν~ = 3145 (m), 3037 (m), 2948 (m), 1438 (s, P-Aryl), 1199 (s, P=O),
31
1116 (s), 875 (m), 822 (s), 753 (s), 722 (s), 699 (s), 541 (s), 524 (s).
[α ]23D
= - 160 (c=0.1, MeOH).
MS (MALDI): m/z = 521.32 [MH+].
5.3.2.8
Synthese von (S)-2’-Diphenylphosphanyl-2-(pyrazol-3-yl)-1,1’binaphthyl (S-20)
S-19 (170 mg, 0.33 mmol) wird in Toluol (5 ml, abs.) und Et3N (1.46 g, 14.4 mmol,
2 ml, entgast) suspendiert und bei 0 °C unter N 2-Atmosphäre mit Trichlorsilan
(550 mg, 4.06 mmol, 0.41 ml) versetzt. Das Reaktionsgemisch wird für 40 h bei
120 °C gerührt. Nach dem Abkühlen auf RT wird die M ischung mit Et2O (5 ml,
Experimenteller Teil
113
entgast) verdünnt und vorsichtig mit NaHCO3-Lösung (5 ml, entgast) versetzt.
Anschließend erfolgt unter Schutzgas eine Filtration der Suspension über Celite. Der
Filterrückstand wird mit Et2O (5 ml, entgast) gewaschen, die organische Phase
separiert und mittels Na2SO4 getrocknet. Durch Entfernen des Lösungsmittels kann
der Phosphanligand S-29 (90.0 mg, 0.18 mmol, 54%) als gelber Feststoff isoliert
werden.
N
NH
PPh2
S-20
Charakterisierung:
(S)-2’-Diphenylphosphanyl-2-(pyrazol-3-yl)-1,1’-binaphthyl (S-20)
C35H25N2P (504.56).
H-NMR (CDCl3, 200.1 MHz): δ = 5.59 (br s, 1H, H4-Pz), 6.79–7.55 (m, 19H, 18 Harom.;
1
H5-Pz), 7.86–8.04 (m, 4H, Harom.).
31
P-NMR (CDCl3, 81.0 MHz): δ = - 13.7(s).
MS (MALDI): m/z = 505.10 [MH+].
Experimenteller Teil
114
5.3.3 Synthese der Triazolliganden 23 und 27
5.3.3.1
Synthese von 2-Naphthoamid (21)[43a]
2-Naphthonitril (2.00 g, 13.1 mmol) und KOH (2.93 g, 52.2 mmol) werden in tert.Butanol vorgelegt und 3 h unter Rückfluss erhitzt. Das als Feststoff ausfallende Amid
21 kann nach Abkühlen auf RT abfiltriert, mit dest. H2O gewaschen und
anschließend im Vakuum getrocknet werden. Das Produkt 21 (1.80 g, 10.5 mmol,
81% d. Th.) wird als weißes Pulver isoliert.
O
NH2
21
Charakterisierung:
2-Naphthoamid (21)
C11H9NO (171.19): ber. (gef.) C 77.17 (76.66), H 5.30 (5.19), N 8.18 (8.16).
Smp.: 194–195 °C (191–192 °C)
[43b]
.
H-NMR (d6-DMSO, 400.1 MHz): δ = 7.49 (s, 1H, NH2), 7.58–7.62 (m, 2H, Harom.),
1
7.97–8.02 (m, 4H, Harom.), 8.16 (s, 1H, NH2), 8.50 (s, 1H, Harom.).
C-NMR (d6-DMSO, 100.6 MHz): δ = 124.9, 127.1, 127.9, 128.0, 128.2, 128.3,
13
129.3, 132.2, 132.66, 134.66, 168.5 (C=O).
IR (KBr, cm-1): ν~ = 3378 (s), 3195 (m), 1656 (s, C=O), 1611 (s), 1475 (w), 1415 (m),
1117 (m), 840 (m), 788 (m).
5.3.3.2
Synthese von N’-Naphthoyl-N,N-dimethylformamidin (22)[18]
Die Suspension aus 2-Naphthoamid 21 (2.00 g, 11.7 mmol) und DMFDMA (25 ml)
wird auf 120 °C erhitzt. Nach 5 h Reaktionsdauer wi rd das überschüssige DMFDMA
im ÖPV entfernt, so dass das Amidin 22 (2.61 g, 11.5 mmol, 99% d. Th.) als
hellgelber Feststoff fast quantitativ erhalten werden kann.
Experimenteller Teil
115
H
O
8
8a
1
2
7
6
5'
N
3'
3
4a
5
N
CH3
CH3
4
22
Charakterisierung:
N’-Naphthoyl-N,N-dimethylformamidin (22)
C14H14N2O (226.26): ber. (gef.) C 74.31 (74.22), H 6.24 (6.26), N 12.38 (12.34).
Smp.: 81–82 °C.
H-NMR (CDCl3, 600.1 MHz): δ = 3.10 (s, 3H, (E)-CH3), 3.19 (s, 3H, (Z)-CH3), 7.48
1
(dt, 3JH7,
H8
= 7.8 Hz, 3JH7,
H6
= 6.9 Hz, 4JH7,
H5
= 1.1 Hz, 1H, H7), 7.52 (dt,
3
JH6, H5 = 8.0 Hz, 3JH6, H7 = 6.8 Hz, 4JH6, H8 = 1.1 Hz, 1H, H6), 7.84 (d, J = 7.1 Hz, 1H,
H5), 7.85 (d, J = 8.2 Hz 1H, H4), 7.96 (d, J = 8.0 Hz, 1H, H8), 8.32 (dd, J = 8.5, 1.6
Hz, 1H, H3), 8.66 (s, 1H, H3’), 8.85 (s, 1H, H1.).
C-NMR (CDCl3, 150.9 MHz): δ = 35.3 ((E)-CH3), 41.4 ((Z)-CH3), 126.1 (C7), 126.2
13
(C3), 127.5, 127.6, 127.7 (C4,5,6), 129.5 (C8), 130.9 (C1), 132.8, 134.2, 135.3 (C2,4a,8a),
160.8 (C3‘), 177.8 (C5‘).
IR (KBr, cm-1): ν~ = 3060 (w), 2926 (w), 1632 (s, C=O), 1580 (s), 1564 (s), 1427 (s),
1348 (s), 1285 (s), 1116 (s), 783 (m), 768 (m).
5.3.3.3
Synthese von 3-Naphth-2-yl-1H(1,2,4)triazol (23)[18]
N’-Naphthoyl-N,N-dimethylformamidin 22 (1.00 g, 4.42 mmol) und Hydrazin-Monohydrat (240 mg, 4.86 mmol, 0.23 ml) werden in Essigsäure (30 ml) gelöst und für 4 h
auf 80 °C erhitzt. Anschließend wird die Essigsäure im ÖPV entfernt, der gelbe, ölige
Rückstand in CH2Cl2 (30 ml) aufgenommen und mit dest. H2O (2 x 10 ml) und
NaHCO3-Lösung (10 ml) gewaschen. Nach dem Trocknen der organischen Phase
mit Na2CO3 und dem Entfernen des Lösungsmittels kann das Triazol 23 (0.75 g,
3.84 mmol, 87% d. Th.) als weißer feinkristalliner Feststoff isoliert werden.
Experimenteller Teil
116
5'
N
8
7
8a
NH
1
2
6
3'
N
3
5
4a
4
23
Charakterisierung:
3-Naphth-2-yl-1H(1,2,4)triazol (23)
C12H9N3 (195.21): ber. (gef.) C 73.83 (73.61), H 4.65 (4.48), N 21.53 (21.64).
Smp.: 135–138 °C (71°C)
[42]
.
H-NMR (CDCl3, 400.1 MHz): δ = 7.40 (dt, 3JH7,
1
H8
= 7.9 Hz, 3JH7,
H6
= 6.9 Hz,
4
JH7, H5 = 1.2 Hz, 1H, H7), 7.45 (dt, 3JH6, H5 = 7.9 Hz, 3JH6, H7 = 6.9 Hz, 4JH6, H8 = 1.2 Hz,
1H, H6), 7.71 (d, J = 8.5 Hz, 1H, H5), 7.75 (d, J = 8.5 Hz, 1H, H4), 7.79 (d, J = 8.5 Hz,
1H, H8), 8.07 (dd, J = 8.5, 1.4 Hz, 1H, H3), 8.31 (s, 1H, H5’), 8.51 (s, 1H, H1), 14.12
(br, s, 1H, NH).
C-NMR (CDCl3, 100.6 MHz): δ = 123.7 (C3), 126.2 (C2,4a,8a), 126.5 (C1), 126.8,
13
127.2 (C6,7), 127.9 (C4), 128.7, 128.9 (C5,8), 133.3, 134.2 (C2,4a,8a), 147.7 (C5’), 159.6
(C3’).
IR (KBr, cm-1): ν~ = 3149 (m), 3094 (m), 3055 (m), 2953 (m), 2906 (m), 1605 (w),
1562 (m), 1509 (m), 1411 (m), 1280 (m), 1094 (s), 1004 (m), 900 (m), 821 (m),
752 (s).
Experimenteller Teil
5.3.3.4
117
Synthese von 2’-Diphenylphosphanoyl-2-trifluormethansulfonoyl1,1’-binaphthyl (10)[33]
Ein Gemisch aus Bistriflat S-8 (10.0 g, 18.2 mmol), Diphenylphosphanoxid (4.45 g,
22.0 mmol), Pd(OAc)2 (202 mg, 0.90 mmol), dppp (382 mg, 0.92 mmol) und iPr2EtN
(12.5 ml) in DMSO (100 ml) wird 24 h bei 100 °C ger ührt. Anschließend werden alle
flüchtigen Bestandteile im ÖPV entfernt. Der dunkelrote, ölige Rückstand wird in
EtOAc (100 ml) aufgenommen und mit dest. H2O (3 x 40 ml) und ges. NaCl-Lösung
(40 ml) gewaschen. Die Trocknung der organischen Phase erfolgt mittels Na2SO4.
Nach dem Entfernen des Lösungsmittels erfolgt eine säulenchromatographische
Aufreinigung (EtOAc / n-Hexan 1:1, Rf = 0.2) des Rückstandes und das Produkt S-10
(7.34 g, 12.2 mmol, 67% d. Th.) kann als gelbes Öl bzw. schaumartiger Feststoff
isoliert werden.
Bei gleicher Ansatzgröße von 10.0 g (18.2 mmol) R-8 und analoger Durchführung
wird die Verbindung R-10 (6.13 g, 10.2 mmol, 56% d. Th.) ebenfalls als gelbes Öl
bzw. schaumartiger Feststoff erhalten.
S-10
OTf
OTf
P(O)Ph2
P(O)Ph2
R-10
Charakterisierung:
2’-Diphenylphosphanoyl-2-trifluormethansulfonoyl-1,1’-binaphthyl (10)
C33H22F3O4PS (602.53)
H-NMR (CDCl3, 400.1 MHz): δ = 7.00 (d, J = 8.5 Hz, 1H, Harom.), 7.14–7.18 (m, 2H,
1
Harom.), 7.24–7.28 (m, 3H, Harom.), 7.30–7.51 (m, 10H, Harom.), 7.56–7.59 (m, 1H,
Harom.), 7.63–7.68 (m, 1H, Harom.), 7.84 (d, J = 8.2 Hz, 1H, Harom.), 7.91 (d, J = 9.1 Hz,
1H, Harom.), 7.94 (d, J = 8.2 Hz, 1H, Harom.), 8.01 (dd, J = 8.6, 2.0 Hz, 1H, Harom.).
Experimenteller Teil
118
C-NMR (CDCl3, 100.6 MHz): δ = 118.2 (q, J = 320 Hz, CF3), 119.0, 126.6, 127.1,
13
127.2, 127.3, 127.4, 128.1, 128.2, 128.3, 128.4, 128.5, 128.6, 128.7, 128.8, 129.8,
130.8, 131.1, 131.3, 131.4, 131.5, 131.6, 131.7, 131.9, 132.0, 132.3, 132.6, 133.3,
133.7, 134.1, 134.7, 137.4, 145.8 (32 Carom.).
P-NMR (CDCl3, 162.0 MHz): δ = 29.2 (s).
IR (KBr, cm-1): ν~ = 3056 (m), 2956 (w), 2926 (w), 2856 (w), 1508 (m), 1437
31
(s, P-Aryl), 1417 (s), 1210 (s, P=O), 1174 (s), 1140 (s), 1116 (s), 1062 (s), 957 (s),
941 (s), 834 (s), 748 (s), 722 (s), 699 (s), 632 (s), 539 (s), 524 (s).
[α ]21D
= - 40 (S-10, c = 0.5, CHCl3); ( [α ]D = - 44.45, c = 0.5, CHCl3)[33b].
[α ]21D
= + 30 (R-10, c = 0.5, CHCl3); [α ]20
D = + 8.5 (R-10, c = 1, CH2Cl2);
20
[33a]
( [α ]20
.
D = + 6.29, c = 1, CH2Cl2)
5.3.3.5
Synthese von 2-Cyano-2’-diphenylphosphanoyl-1,1’-binaphthyl
(11)[34]
S-10 (4.00 g, 6.64 mmol), KCN (1.30 g, 19.9 mmol), wasserfreies NiBr2 (660 mg,
3.03 mmol), PPh3 (3.57 g, 13.6 mmol) und frisch aktiviertes Zink (630 mg, 9.55
mmol) werden in MeCN (55 ml) auf 90 °C erhitzt. Nac h 6 h wird das Reaktionsgemisch auf RT abgekühlt und das Lösungsmittel entfernt. Anschließend wird der
Rückstand in CH2Cl2 (50 ml) aufgenommen, filtriert und die gelb- bis orangefarbene
Lösung mit dest. H2O (3 x 20 ml) und NaCl-Lösung (20 ml) gewaschen. Die
organische Phase wird mit Na2SO4 getrocknet. Nach dem Entfernen des
Lösungsmittels wird der orangefarbene, ölige Rückstand∗ säulenchromatographisch
(EtOAc / n-Hexan 3:1, Rf = 0.44) gereinigt. Die Verbindung S-11 (2.59 g, 5.40 mmol,
81% d. Th.) kann als weißer Feststoff bzw. nach Umkristallisation aus EtOAc als
farblose Kristalle isoliert werden.
Die Verbindung R-11 wird bei gleicher Ansatzgröße von 4.00 g (6.64 mmol) R-10 und
analoger Durchführung ebenfalls als weißer Feststoff (2.43 g, 5.07 mmol, 76% d.
Th.) erhalten.
∗
Die racemische Verbindung 11 kann aufgrund der schlechten Löslichkeit direkt nach
der Aufarbeitung ohne säulenchromatographische Reinigung als weißer Feststoff in
Ausbeuten von bis zu 70% isoliert werden.
Experimenteller Teil
119
CN
CN
P(O)Ph2
P(O)Ph2
R-11
S-11
Charakterisierung:
2-Cyano-2’-diphenylphosphanoyl-1,1’-binaphthyl (11)
C33H22NOP (479.48): S-11 ber. (gef.) C 82.66 (82.65), H 4.63 (4.70), N 2.92 (2.80)
R-11 ber. (gef.) C 82.66 (82.43), H 4.63 (4.66), N 2.92 (2.84).
Smp.: (R,S)-11 287–288 °C;
S-11 / R-11 223–224 °C (212–214 °C)
[34]
.
H-NMR (CDCl3, 600.1 MHz): δ = 7.02 (d, J = 8.6 Hz, 1H, Harom.), 7.06 (d, J = 8.4 Hz,
1
1H, Harom.), 7.16–7.19 (m, 1H, Harom.), 7.24–7.27 (m, 2H, Harom.), 7.29–7.33 (m, 3H,
Harom.), 7.36–7.39 (m, 1H, Harom.), 7.40–7.43 (m, 1H, Harom.), 7.47–7.58 (m, 7H,
Harom.), 7.64 –7.67 (m, 1H, Harom.), 7.84–7.87 (m, 2H, Harom.), 7.96 (d, J = 8.2 Hz, 1H,
Harom.), 8.02 (dd, J = 8.6, 1.7 Hz, 1H, Harom.).
C-NMR (CDCl3, 150.9 MHz): δ = 112.3 (C-CN), 118.7 (CN), 126.3(4), 126.3(7),
13
127.3, 127.6, 127.8, 128.1, 128.2(0), 128.2(6), 128.3, 128.4(0), 128.4(6), 128.5,
128.6, 128.7, 129.0, 129.3, 129.8, 130.5, 131.6, 131.8, 131.9, 132.0, 132.1, 132.5,
132.8, 133.1, 133.2, 134.3, 134.7, 140.5, 142.4 (31 Carom.).
P-NMR (CDCl3, 162.0 MHz): δ = 28.6 (s).
IR (KBr, cm-1): ν~ = 3054 (w), 2224 (m, C≡N), 1435 (m, P-Aryl), 1309 (w), 1198
31
(s, P=O), 1117 (s), 829 (m), 823 (m), 754 (s), 722 (m), 695 (s), 539 (s), 516 (s).
[α ]21D
= - 141.8 (S-11, c = 0.49, CHCl3).
[α ]21D
[34]
= + 141.8 (R-11, c = 0.49, CHCl3); ( [α ]20
.
D = + 132.1, c = 0.49, CHCl3)
Experimenteller Teil
5.3.3.6
120
Synthese von 2-Carbamoyl-2’-diphenylphosphanoyl-1,1’-binaphthyl
(24)
Methode A (Racemat)[43a]
2-Cyano-2’-diphenylphosphanoyl-1,1’-binaphthyl 11 (1.00 g, 2.08 mmol) und KOH
(940 mg, 16.7 mmol) werden in tert.-Butanol (30 ml) vorgelegt und 18–20 h unter
Rückfluss erhitzt. Nach dem Abkühlen auf RT wird das Lösungsmittel im Vakuum
entfernt und der Rückstand in CH2Cl2 (50 ml) aufgenommen, mit dest. H2O
gewaschen und mit Na2SO4 getrocknet. Anschließend wird das Lösungsmittel
entfernt, das Produkt 24 aus EtOAc umkristallisiert und als gelbliche Kristalle isoliert
(810 mg, 1.63 mmol, 85% d. Th.).
Methode B (Enantiomere)[16b, 44]
S-11 (300 mg, 0.63 mmol) werden in EtOH (15 ml) gelöst. Danach erfolgt die Zugabe
von 6N NaOH (3 ml) und 35%igem H2O2 (6 ml). Anschließend wird das Reaktionsgemisch für 30 min bei RT gerührt und weitere 20 h bei 50 °C. Zur vollständigen
Umsetzung des Eduktes erfolgen nach etwa 5 und 15 h weitere H2O2-Zugaben
(jeweils 3 ml). Die entstandene gelbe Lösung wird nach dem Abkühlen auf RT mit
2N H2SO4 neutralisiert, anschließend filtriert und das EtOH entfernt. Die wässrige
Phase wird mit CH2Cl2 (2 x 20 ml) extrahiert. Dann wird die organische Phase mit
Na2SO4 getrocknet, filtriert und das Lösungsmittel entfernt. Das Amid S-24 (289 mg,
0.60 mmol, 96% d. Th.) kann als gelblicher Feststoff isoliert werden.
Die Verbindung R-24 wird bei gleicher Ansatzgröße von 300 mg (0.63 mmol) R-11
und analoger Durchführung ebenfalls als gelblicher Feststoff (280 mg, 0.58 mmol,
93% d. Th.) erhalten.
Experimenteller Teil
121
C(O)NH2
C(O)NH2
P(O)Ph2
P(O)Ph2
R-24
S-24
Charakterisierung:
2-Carbamoyl-2’-diphenylphosphanoyl-1,1’-binaphthyl (24)
C33H24NO2P × 0.5 EtOAc (541.57): ber. (gef.) C 77.62 (77.62), H 5.21 (5.13), N 2.59
(2.54).
Smp.: R-24 / S-24 Zers. > 160 °C (120–122 °C)
[16a]
.
H-NMR (CDCl3, 400.1 MHz): δ = 5.51 (s, 1H, NH2), 6.34 (d, J = 8.5 Hz, 1H, Harom.),
1
6.63–6.67 (m, 1H, Harom.), 6.93–6.98 (m, 2H, Harom.), 7.12–7.19 (m, 5H, Harom.),
7.28–7.31 (m, 1H, Harom.), 7.41–7.46 (m, 1H, Harom.), 7.47–7.60 (m, 4H, Harom.), 7.64
(d, J = 8.2 Hz, 1H, Harom.), 7.68–7.71 (m, 2H, Harom.), 7.74 (d, J = 8.4 Hz, 1H, Harom.),
7.87 (d, J = 8.4 Hz, 2H, Harom.), 7.91–7.93 (m, 1H, Harom.), 9.45 (s, 1H, NH2).
C-NMR (CDCl3, 150.9 MHz): δ = 124.6, 125.9, 126.7, 127.5, 127.7, 127.8, 127.9,
13
128.0, 128.2, 128.3, 128.5, 128.8, 128.9, 129.0, 129.1, 129.4, 129.7, 130.7, 131.0,
131.2, 131.7, 132.1, 132.2, 132.3, 133.0, 133.1, 133.7, 134.8, 136.6, 143.1
(30 Carom.), 172.9 (C=O).
P-NMR (CDCl3, 162.0 MHz): δ = 31.5 (s).
IR (KBr, cm-1): ν~ = 3447 (br, m), 3051 (m), 1669 (s), 1614 (m), 1437 (m, P-Aryl),
31
1389 (w), 1178 (m, P=O), 1117 (m), 1097 (w), 822 (w), 749 (m), 724 (s), 700 (s),
636 (m), 539 (s), 524 (s).
[α ]26D
= - 150 (S-24, c = 1, CHCl3).
[α ]23D
[16a]
= + 140 (R-24, c = 1, CHCl3); ( [α ]24
.
D = + 157, c = 1, CHCl3)
Experimenteller Teil
5.3.3.7
122
Synthese von 2-N,N-Dimethylaminomethylenacylamido-2’-diphenylphosphanoyl-1,1’-binaphthyl (25)
Die Suspension aus 2-Carbamoyl-2’-diphenylphosphanoyl-1,1’-binaphthyl S-24
(400 mg, 0.80 mmol) und DMFDMA (10 ml) wird auf 120–140 °C (Ölbad) erhitzt.
Nach 6 h Reaktionsdauer wird das überschüssige DMFDMA im ÖPV entfernt und der
feste Rückstand mit wenig n-Pentan gewaschen. Die Verbindung S-25 (410 mg,
0.74 mmol, 92% d. Th.) kann als hellgelber Feststoff erhalten werden.
Bei einer Ansatzgröße von 200 mg (0.40 mmol) R-24 und analoger Durchführung
wird die Verbindung R-25 (192 mg, 0.35 mmol, 87% d. Th.) ebenfalls als hellgelber
Feststoff isoliert.
CH3
N
CH3
N
N
CH3
CH3
O
Ph2(O)P
N
O
Ph2(O)P
S-25
R-25
Charakterisierung:
2-N,N-Dimethylaminomethylenacylamido-2’-diphenylphosphanoyl-1,1’-binaphthyl
(25)
C39H29N2O2P (552.60).
Smp.: S-25 / R-25 235–236 °C.
H-NMR (CDCl3, 400.1 MHz): δ = 2.48 (s, 3H, (E)-CH3), 2.90 (s, 3H, (Z)-CH3), 7.00–
1
7.14 (m, 7H, Harom.), 7.17–7.22 (m, 3H, Harom.), 7.32–7.40 (m, 5H, Harom.), 7.44–7.48
(m, 1H, Harom.), 7.64–7.66 (m, 2H, Harom.), 7.74–7.79 (m, 1H, Harom.), 7.85–7.92 (m,
2H, Harom.), 8.12 (s, 1H, -N=CHNMe2), 8.21 (d, J = 8.7 Hz, 1H, Harom.).
C-NMR (CDCl3, 100.6 MHz): δ = 34.8 ((E)-CH3), 41.0 ((Z)-CH3), 126.0, 126.6,
13
126.7, 127.5, 127.6, 127.7, 127.8, 127.9, 128.1, 128.4, 128.8, 129.0, 129.1, 130.7,
Experimenteller Teil
123
131.6, 131.7, 131.9, 132.0, 132.9, 133.2, 133.7, 133.9, 134.0, 134.1, 134.2, 134.4,
134.5, 135.5, 136.3, 145.5 (30 Carom.), 159.8 (-N=CHNMe2), 178.3 (C=O).
P-NMR (CDCl3, 162.0 MHz): δ = 29.2 (s).
IR (KBr, cm-1): ν~ = 3047 (w), 2923 (w), 1650 (s), 1594 (s), 1436 (m, P-Aryl), 1422
31
(m), 1324 (s), 1232 (s), 1197 (s, P=O), 1116 (m), 1099 (s), 766 (m), 750 (m), 705
(m), 694 (m), 540 (m), 519 (m).
MS (MALDI): m/z = 553.29 [MH+].
5.3.3.8
Synthese von 2’-Diphenylphosphanoyl-2-[1H(1,2,4)triazol-3-yl]-1,1’binaphthyl (26)
S-25 (300 mg, 0.54 mmol) und Hydrazin-Monohydrat (30 mg, 0.60 mmol, 0.03 ml)
werden in Essigsäure (10 ml) gelöst und für 6 h auf 100 °C erhitzt. Anschließend wird
die Essigsäure im ÖPV entfernt, der gelbe, ölige Rückstand in CH2Cl2 (30 ml)
aufgenommen und mit dest. H2O (2 x 10 ml) und NaHCO3-Lösung (1 x 10 ml)
gewaschen. Nach dem Trocknen der organischen Phase mit Na2CO3 und dem
Entfernen des Lösungsmittels kann das Triazolylphosphanoylbinaphthyl S-26
zunächst als gelbes Öl bzw. schaumartiger Feststoff isoliert werden. Bei der
Umkristallisation aus Methanol entstehen gelbliche Kristalle von S-26 (240 mg,
3.84 mmol, 86% d. Th.).
Bei einer Ansatzgröße von 240 mg (0.43 mmol) R-25 und analoger Durchführung
wird Verbindung R-26 (200 mg, 0.38 mmol, 88% d. Th.) ebenfalls in Form gelblicher
Kristalle isoliert.
N
N
N
N
NH
P(O)Ph2
S-26
NH
P(O)Ph2
R-26
Experimenteller Teil
124
Charakterisierung:
2’-Diphenylphosphanoyl-2-[1H(1,2,4)triazol-3-yl]-1,1’-binaphthyl (26)
C34H24N3OP (521.52): S-26 ber. (gef.) C 78.30 (77.67), H 4.64 (4.63), N 8.06 (7.81);
R-26 ber. (gef.) C 78.30 (77.79), H 4.64 (4.58), N 8.06 (7.93).
Smp.: S-26 / R-26 Zers. > 295 °C.
H-NMR (CDCl3, 400.1 MHz): δ = 6.55–6.58 (m, 1H, Harom.), 6.74–6.79 (m, 2H,
1
Harom.), 6.89–6.97 (m, 3H, Harom.), 7.14–7.24 (m, 4H, Harom.), 7.40–7.44 (m, 1H,
Harom.), 7.49–7.54 (m, 3H, Harom.), 7.56–7.58 (m, 1H, Harom.), 7.60–7.62 (m, 1H,
Harom.), 7.74–7.75 (m, 1H, Harom.), 7.77 (s, 1H, HTz), 7.79–7.82 (m, 2H, Harom.), 7.84–
7.92 (m, 3H, Harom.), 14.59 (br, s, 1H, NH).
C-NMR (CDCl3, 150.9 MHz): δ = 126.4, 126.8, 126.9, 127.0, 127.4, 127.5, 127.7,
13
127.8, 127.9, 128.0, 128.6, 128.7, 128.8(2), 128.8(5), 128.9, 129.3, 129.4, 129.9,
130.4, 130.5, 130.9, 131.8, 132.1, 132.2, 132.3, 132.5, 132.9, 133.2, 134.0, 134.8
(30 Carom.), 142.2 (N=CH), 154.9 (N=C).
P-NMR (CDCl3, 162.0 MHz): δ = 31.7 (s).
IR (KBr, cm-1): ν~ = 3430 (br, w), 3141 (w), 3051 (m), 2992 (w), 2942 (m), 2849 (w),
31
1501 (m), 1435 (m, P-Aryl), 1192 (s, P=O), 1120 (m), 750 (s), 698 (s).
[α ]21D
= + 46 (S-26, c = 0.5, CHCl3).
[α ]21D
= - 49 (R-26, c = 0.5, CHCl3).
MS (MALDI): m/z = 522.53 [MH+].
5.3.3.9
Synthese von 2’-Diphenylphosphanyl-2-[1H(1,2,4)triazol-3-yl]-1,1’binaphthyl (27)
S-26 (250 mg, 0.48 mmol) wird in Toluol (10 ml, abs.) und Et3N (2.18 g, 21.5 mmol,
3.0 ml, entgast) suspendiert und bei 0 °C unter N 2-Atmosphäre mit Trichlorsilan
(0.81 g, 5.94 mmol, 0.60 ml) versetzt. Das Reaktionsgemisch wird für 40 h bei
120 °C gerührt. Nach dem Abkühlen auf RT wird die M ischung mit Et2O (5 ml,
entgast) verdünnt und vorsichtig mit NaHCO3-Lösung (5 ml, entgast) versetzt.
Anschließend erfolgt unter Schutzgas eine Filtration der Suspension über Celite. Der
Filterrückstand wird mit Et2O (5 ml, entgast) und CHCl3 (5 ml, entgast) gewaschen,
die organische Phase separiert und mittels Na2SO4 getrocknet. Durch Entfernen des
Lösungsmittels und Waschen des festen Rückstandes mit n-Pentan (entgast) kann
Experimenteller Teil
125
der Phosphanligand S-27 (160 mg, 0.32 mmol, 66% d. Th.) als hellgelber Feststoff
isoliert werden.
Bei gleicher Ansatzgröße von 250 mg (0.48 mmol) R-26 und analoger Durchführung
wird die Verbindung R-27 (190 mg, 0.38 mmol, 78% d. Th.) ebenfalls als hellgelber
Feststoff erhalten.
N
N
N
N
NH
PPh2
S-27
NH
PPh2
R-27
Charakterisierung:
2’-Diphenylphosphanyl-2-[1H(1,2,4)triazol-3-yl]-1,1’-binaphthyl (27)
C34H24N3P (505.52).
H-NMR (CDCl3, 400.1 MHz): δ = 6.94–7.01 (m, 5H, Harom.), 7.11–7.31 (m, 9H,
1
Harom.), 7.44–7.56 (m, 3H, Harom.), 7.67 (s, 1H, HTz), 7.95 (t, J = 9.1 Hz, 2H, Harom.),
8.01 (d, J = 8.5 Hz, 1H, Harom.), 8.12 (d, J = 8.7 Hz, 1H, Harom.), 8.46 (d, J = 8.7 Hz,
1H, Harom.).
C-NMR (CDCl3, 150.9 MHz): δ = 125.5, 126.0, 126.1, 126.8, 127.0, 127.1, 127.8,
13
128.1, 128.2, 128.3, 128.4, 128.5, 128.5(5), 128.5(7), 128.5(9), 129.2, 129.3, 130.8,
132.5, 133.1, 133.3, 133.4, 133.6, 133.8, 133.9, 135.4, 135.7, 136.8, (28 Carom.),
142.7 (N=CH), 155.1 (N=C).
P-NMR (CDCl3, 162.0 MHz): δ = -13.7 (s).
IR (KBr, cm-1): ν~ = 3422 (br, w), 3054 (m), 2939 (m), 2603 (m), 2495 (m), 1498 (m),
31
1478 (m), 1434 (m, P-Aryl), 822 (m), 814 (m), 743 (s), 697 (s).
Experimenteller Teil
5.3.3.10
126
Komplexierung von 27 mit PdCl2(PhCN)2
Racemischer Pd-Komplex
Der Ligand 27 (100.0 mg, 0.20 mmol) und PdCl2(PhCN)2 (75.5 mg, 0.20 mmol)
werden in CHCl3 (10 ml, entgast) für 4 h unter Rückfluss erhitzt. Anschließend wird
das Lösungsmittel entfernt und der gelbe Rückstand mit Et2O (5 ml) und n-Pentan
gewaschen. Der Komplex 28 (111.3 mg, 0.16 mmol, 82% d. Th.) kann als intensiv
gelber Feststoff isoliert werden.
Charakterisierung:
(R,S)-2’-Diphenylphosphanyl-2-[1H(1,2,4)triazol-3-yl]-1,1’-binaphthyldichloropalladium (28)
C34H24Cl2N3PPd × 0.5 CHCl3 (742.53): ber. (gef.) C 55.80 (55.44), H 3.33 (3.44),
N 5.66 (5.67).
H-NMR (CDCl3, 400.1 MHz): δ = 6.16 (d, J = 8.4 Hz, 1H, Harom.), 6.73–7.90 (m, 21H,
1
20 Harom.; HTz), 8.11 (d, J = 8.4 Hz, 1H, Harom.), 9.08 (br, s, 1H, NH).
P-NMR (CDCl3, 162.0 MHz): δ = 24.9 (s).
31
H-NMR (CD3OD, 400.1 MHz): δ = 6.24 (d, J = 8.4 Hz, 1H, Harom.), 6.80–6.93 (m, 5H,
1
Harom.), 7.23–7.27 (m, 2H, Harom.), 7.37–7.61 (m, 8H, Harom.), 7.87–7.91 (m, 4H,
3 Harom.; 1HTz), 8.01 (br s, 2H, Harom.), 8.25 (d, J = 8.4 Hz, 1H, Harom.), 8.63 (br, s, 1H,
NH).
P-NMR (CD3OD, 162.0 MHz): δ = 25.7 (s).
IR (KBr, cm-1): ν~ = 3437 (m), 3056 (m), 1621 (w), 1497 (m), 1481 (m), 1459 (w),
31
1437 (s, P-Aryl), 1313 (w), 1099 (m), 869 (w), 818 (s), 746 (s), 693 (s), 639 (w),
530 (s), 500 (s).
MS (MALDI): m/z = 647.23 [M+-Cl], 611.24 [M+-2Cl].
Enantiomerenreine Pd-Komplexe
Der Ligand S-27 (60.0 g, 0.12 mmol) und PdCl2(PhCN)2 (45.5 mg, 0.12 mmol)
werden in CHCl3 (10 ml, entgast) für 4 h unter Rückfluss erhitzt. Anschließend wird
das Lösungsmittel entfernt und der gelbe Rückstand mit Et2O (5 ml), MeOH (5 ml)
Experimenteller Teil
127
und n-Pentan gewaschen. Der Komplex S-28 (65.0 mg, 0.095 mmol, 80% d. Th.)
kann als intensiv gelber Feststoff erhalten werden.
Der Komplex R-28 wird bei gleicher Ansatzgröße von 60.0 mg (0.12 mmol) R-27 und
analoger Durchführung ebenfalls als hellgelber Feststoff (63.0 mg, 0.092 mmol, 78%
d. Th.) isoliert. Aus einer Lösung von R-28 in CH2Cl2 / EtOH (1:1) konnten durch
langsames Verdunsten der Lösungsmittel gelbe Kristalle erhalten werden.
Charakterisierung:
Bis{(S)-2’-Diphenylphosphanyl-2-[µ2-(1,2,4)triazol-3-yl]-1,1’-binaphthylchloropalladium} (S-28); Bis{(R)-2’-Diphenylphosphanyl-2-[µ2-(1,2,4)triazol-3-yl]-1,1’-binaphthylchloropalladium} (R-28)
C68H46Cl2N6P2Pd2 (1292.75): S-28 ber. (gef.) C 63.17 (60.56), H 3.59 (3.84), N 6.50
(6.21); R-28 ber. (gef.) C 63.17 (60.31), H 3.59 (3.38), N 6.50 (6.05).
H-NMR (CDCl3, 400.1 MHz): δ = 5.86 (d, J = 8.4 Hz, 1H, Harom.), 6.60–6.64 (m, 1H,
1
Harom.), 6.81–6.94 (m, 4H, Harom.), 6.99–7.03 (m, 1H, Harom.), 7.14–7.18 (m, 3H,
Harom.), 7.28–7.43 (m, 5H, Harom.), 7.55 (d, J = 8.4 Hz, 1H, Harom.), 7.60 (d, J = 8.4 Hz,
1H, Harom.), 7.71 (d, J = 8.4 Hz, 1H, Harom.), 7.83 (s, 1H, HTz), 7.83–7.91 (m, 3H,
Harom.), 8.11 (d, J = 8.4 Hz, 1H, Harom.).
C-NMR (CDCl3, 100.6 MHz): δ = 124.3, 124.9, 126.0, 126.3, 126.7, 126.8, 127.0,
13
127.1, 127.2, 127.6, 127.7, 127.8, 127.9, 128.1, 128.2, 128.8, 129.1, 129.2, 129.4,
129.8, 131.3, 131.4, 132.1, 133.2, 133.3, 133.5, 133.6, 134.9, 136.2, 142.0, 152.6,
161.8 (30 Carom. + 2 CTz).
P-NMR (CDCl3, 162.0 MHz): δ = 22.5 (s).
IR (KBr, cm-1): ν~ = 3430 (m), 3054 (m), 1620 (w), 1498 (m), 1480 (w), 1459 (s),
31
1437 (s, P-Aryl), 1316 (w), 1099 (m), 869 (w), 819 (s), 744 (s), 696 (s), 640 (w), 530
(s), 499 (s).
[α ]23D
= - 1260 (S-28, c = 0.1, CHCl3).
[α ]23D
= + 1180 (R-28, c = 0.1, CHCl3).
Literatur
128
6 Literaturverzeichnis
[1]
K. Muñiz, Chem. unserer Zeit 2006, 40, 112–124.
[2]
T. Wabnitz, O. Reiser, Organic Synthesis Highlights, Vol. IV (Ed.: H.-G.
Schmalz), WILEY-VCH Verlag GmbH, Weinheim, 2000, S. 155–165.
[3]
a) P. Kočovský, Š. Vyskočil, M. Smrčina, Chem. Rev. 2003, 103, 3213–3245. –
b) J. M. Brunel, Chem. Rev. 2005, 105, 857–897.
[4]
a) A. Miyashita, A. Yasuda, H. Takaya, K. Toriumi, T. Ito, T. Souchi, R. Noyori,
J. Am. Chem. Soc. 1980, 102, 7932–7934. – b) A. Miyashita, H. Takaya, T.
Souchi, R. Noyori, Tetrahedron 1984, 40 (8), 1245–1253. – c) H. Kumobayashi,
T. Miura, N. Sayo, T. Saito, X. Zhang, Synlett 2001, SI, 1050–1054. – d) R.
Noyori, Angew. Chem. 2002, 114, 2108–2123; Angew. Chem. Int. Ed. 2002, 41,
2008–2022. – e) R. Noyori, Adv. Synth. Catal. 2003, 345, 15–32.
[5]
P. Pertici, F. D’Arata, C. Rosini, J. Org. Chem. 1996, 515, 163–171.
[6]
C. Rosini, L. Franzini, A. Raffaelli, P. Salvadori, Synthesis 1992, 503–517.
[7]
a) Y. Uozumi, T. Hayashi, J. Am. Chem. Soc. 1991, 113, 9887–9888. – b) T.
Hayashi, Acc. Chem. Res. 2000, 33, 354–362.
[8]
Š. Vyskočil, M. Smrčina, V. Hanuš, M. Polášek, P. Kočovský, J. Org. Chem.
1998, 63, 7738–7748.
[9]
a) A. Pfaltz, Acta Chem. Scand. B 1996, 50, 189–194. – b) G. Helmchen, S.
Kudis, P. Sennhenn, H. Steinhagen, Pure Appl. Chem. 1997, 69, 513–518. – c)
G. Helmchen, A. Pfaltz, Acc. Chem. Res. 2000, 33, 336–345.
[10] a) J. P. Wolfe, R. A. Singer, B. H. Yang, S. L. Buchwald, J. Am. Chem. Soc.
1999, 113, 9550–9661. – b) J. P. Wolfe, S. L. Buchwald, Angew. Chem. 1999,
111, 2570–2573; Angew. Chem. Int. Ed. 1999, 38, 2413–2416.
[11] J. Yin, S. L. Buchwald, J. Am. Chem. Soc. 2000, 122, 12051–12052.
[12] a) Y. Imai, W. Zhang, T. Kida, Y. Nakatsuji, I. Ikeda, Tetrahedron Lett. 1998, 39,
4343–4346. – b) M. Ogasawara, K. Yoshida, H. Kamei, K. Kato, Y. Uozumi, T.
Hayashi, Tetrahedron: Asymm. 1998, 9, 1779–1787. – c) K. Selvakumar, M.
Valentini, M. Wörle, P. S. Pregosin, Organometallics 1999, 18, 1207–1215.
[13] M. Ogasawara, K. Yoshida, T. Hayashi, Heterocycles 2000, 52 (1), 195–201.
Literatur
129
[14] a) K. Selvakumar, M. Valentini, M. Wörle, P. S. Pregosin, Organometallics
2000, 19, 1299–1307. – b) P. Dotta, A. Magistrato, U. Rothlisberger, P. S.
Pregosin, Organometallics 2002, 21, 3033–3041. – c) P. Dotta, P. G. A. Kumar,
P. S. Pregosin, Organometallics 2004, 23, 2295–2304.
[15] a) K. Selvakumar, M. Valentini, P. S. Pregosin, Organometallics 1999, 18,
4591–4597. – b) T. Hayashi. A. Okada, T. Suzuka, M. Kawatsura, Org. Lett.
2003, 5 (10), 1713–1715. – c) M. Hatano, K. J. Mikami, J. Mol. Cat. A 2003,
196, 165–169. – d) M. Hatano, K. J. Mikami, Org. Biomol. Chem. 2003, 1,
3871–3873.
[16] a) K. Sumi, T. Ikariya, R. Noyori, Can. J. Chem. 2000, 78 (6), 697–703. - b) T.
Morimoto, N. Mochizuki, M. Suzuki, Tetrahedron Lett. 2004, 45, 5717–5722.
[17] a) A.-K. Pleier, H. Glas, M. Grosche, P. Sirsch, W. R. Thiel, Synthesis 2001, 1,
55–62. – b) Y. Sun, A. Hienzsch, J. Grasser, E. Herdtweck, W. R. Thiel, J.
Organometal. Chem. 2006, 691, 291–298. – c) Y. Sun, W. R. Thiel, Inorg.
Chim. Acta 2006, 359, 4807–4810.
[18] Y. Lin, S. A. Lang Jr., M. F. Lovell, N. A. Perkinson, J. Org. Chem. 1979, 44
(23), 4160–4164.
[19] a) G. Bringmann, R. Walter, R. Weirich, Angew. Chem. 1990, 102,
1006–1019; Angew. Chem. Int. Ed. 1990, 29, 977–991. – b) G. Bringmann, A.
J. Price Mortimer, P. A. Keller, M. J. Gresser, J. Garner, M. Breuning, Angew.
Chem. 2005, 117, 5518–5563; Angew. Chem. Int. Ed. 2005, 44, 5384–5427.
[20] J. Brussee, J. L. G. Groenendijk, J. M. te Koppele, A. C. A. Jansen,
Tetrahedron 1985, 41 (16), 3313–3319.
[21] T. Hayashi, K. Hayashizaki, T. Kiyoi, Y. Ito, J. Am. Chem. Soc. 1988, 110,
8153–8156.
[22] a) N. Miyaura, A. Suzuki, Chem. Rev. 1995, 95, 2457–2483. – b) A. Suzuki,
J. Org. Chem. 1999, 576, 147–168.
[23] A. N. Cammidge, K. V. L. Crépy, Chem. Commun. 2000, 1723–1724.
[24] M. Penhoat, V. Levacher, G. Dupas, J. Org. Chem. 2003, 68 (24), 9517–9520.
[25] Autorenkollektiv,
Organikum,
21.
Auflage,
WILEY-VCH
Verlag
GmbH,
Weinheim, 2001, S. 239–240.
[26] a) M. F. Hawthorne, J. Am. Chem. Soc. 1958, 80, 4291–4293. – b) M. K.
Manthey, S. G. Pyne, R. J. W. Truscott, J. Org. Chem. 1990, 55 (15),
4581–4585.
Literatur
130
[27] J.-m. Fu, V. Snieckus, Tetrahedron Lett. 1990, 31 (12), 1665–1668. – b) T. Ohe, N. Miyaura, A. Suzuki, Synlett 1990, 221–223. – c) T. Wakanabe, N. Miyaura,
A. Suzuki, Synlett 1992, 207–210. – d) V. Percec, J.-Y. Bae, D. H. Hill, J. Org.
Chem. 1995, 60 (4), 1060–1065.
[28] K. Ding, Y. Wang, L. Zhang, Y. Wu, Tetrahedron 1996, 52 (3), 1005–1010.
[29] a) D. Cai, D. L. Hughes, T. R. Verhoeven, P. J. Reider, Tetrahedron Lett. 1995,
36 (44), 7991–7994. – b) Q.-S. Hu, D. Vitharana, L. Pu, Tetrahedron: Asymm.
1995, 6 (9), 2123–2126.
[30] X. Dai, H. Z. Tan, A. M. Wang, Huaxue Shiji 2001, 23 (2), 109–114.
[31] a) D. Cai, J. F. Payack, D. R. Bender, D. L. Hughes, T. R. Verhoeven, P. J.
Reider, Org. Syn. 1999, 76, 6–11. – b) P. Kasak, M. Putala, Tetrahedron Lett.
2004, 45 (27), 5279–5282. – c) P. C. Bulman Page, M. M. Farah, B. R. Buckley,
A. J. Blacker, J. Org. Chem. 2007, 72, 4424–4430.
[32] V. D. Bianco, S. Doronzo, Inorganic. Synthesis. 1976, 16, 161–163.
[33] L. Kurz, G. Lee, D. Morgans Jr., M. J. Waldyke, T. Ward, Tetrahedron Lett.
1990, 31 (44), 6321–6324. – b) Y. Uozumi, A. Tanahashi, S.-Y. Lee, T.
Hayashi, J. Org. Chem. 1993, 58 (7), 1945–1948.
[34] Y. Uozumi, N. Suzuki, A. Ogiwara, T. Hayashi, Tetrahedron 1994, 50 (15),
4293–4302.
[35] A. Padwa, M. Akiba, C. S. Chou, L. Cohen, J. Org. Chem. 1982, 47 (2), 183–
191.
[36] a) F. Pammer, Y. Sun, C. May, G. Wolmershäuser, H. Kelm, H.-J. Krüger, W. R.
Thiel, Angew. Chem. 2007, 119, 1293–1296; Angew. Chem. Int. Ed. 2007, 46,
1270-1273. – b) F. Pammer, Y. Sun, W. R. Thiel, Organometallics 2008, 27,
1015–1018. – c) F. Pammer, Y. Sun, M. Pagels, D. Weismann, H. Sitzmann, W.
R. Thiel, Angew. Chemie 2008, 120, 3315–3318; Angew. Chem. Int. Ed. 2008,
47, 3271–3274.
[37] a) N. Krause, Metallorganische Chemie, 1. Auflage, Spektrum Akademischer
Verlag GmbH, 1996, S. 55 ff. – b) E. A. Braude, P. H. Gore, J. Chem. Soc.
1959, 41–49. – c) Autorenkollektiv, Organikum, 21. Auflage, WILEY-VCH
Verlag GmbH, Weinheim, 2001, S. 558.
Literatur
131
[38] a) N. Krause, Metallorganische Chemie, 1. Auflage, Spektrum Akademischer
Verlag GmbH, 1996, S. 175 ff. – b) N. Krause, A. Gerold, Angew. Chem. 1997,
109, 194–213; Angew. Chem. Int. Ed. 1997, 36, 186–204. – c) Durchführung
analog zur Synthese von 2,6-Diacetylpyridin siehe Patentschrift: X. Zhang, PCT
Int. Appl. 9713763, 17. April 1997.
[39] a) Autorenkollektiv, Organikum, 21. Auflage, WILEY-VCH Verlag GmbH,
Weinheim, 2001, S. 496–499. – b) J.-L. Lecat, M. Devaud, Tetrahedron Lett.
1987, 28 (47), 5821–5822.
[40] a) E. J. Corey, M. Chaykovsky, J. Am. Chem. Soc. 1965, 87 (6), 1345–1353. –
b) G. A. Russell, G. J. Mikol, J. Am. Chem. Soc. 1966, 88 (23), 5498–5504.
[41] W. R. Thiel, J. Eppinger, Chem. Eur. J. 1997, 3 (5), 696–705.
[42] H. G. O. Becker, L. Krahnert, G. Rasch, W. Riediger, J. Witthauer, J. prakt.
Chem. 1969, Bd. 311, 41–49.
[43] a) J. H. Hall, M. Gisler, J. Org. Chem. 1976, 41 (23), 3769–3770.– b) P.
Gaspari, T. Banerjee, W. P. Malachowski, A. J. Muller, G. C. Prendergast, J.
DuHadaway, S. Bennett, A. M. Donovan, J. Med. Chem. 2006, 49, 684–692.
[44] C. R. Noller, Org. Syn. Coll. Vol. 2 1943, 13, 94–95.
[45] a) J. Louie, M. S. Driver, B. C. Hamann, J. F. Hartwig, J. Org. Chem. 1997, 62
(5), 1268–1273. – b) J. Thiel, Diplomarbeit, Technische Universität Kaiserslautern, 2007.
[46] a) E. S. Lane, J. Chem. Soc. 1953, 2238–2240. - b) D. W. Hein, R. J. Alheim, J.
J. Leavitt, J. Am. Chem. Soc. 1956, 79, 427–429. – c) A. W. Addison, P. J.
Burke, J. Heterocycl. Chem. 1981, 18, 803–805. – d) S. Dettmann, Dissertation,
Freie Universität Berlin, 2006.
[47] a) E. Bejan, H. Aït Haddou, J. C. Daran, G. G. A. Balavoine, Synthesis 1996,
1012–1018. – b) E. Ioachim, E. A. Medlycott, M. I. J. Polson, G. S. Hanan, Eur.
J. Org. Chem. 2005, 3775–3780.
Anhang
132
7 Anhang
7.1 NMR-Spektren
31
29.2
P-NMR-Spektrum (CDCl3, 162.0 MHz) von Phosphanoylbinaphthyl 10
300
ppm (t1)
200
100
0
-100
-200
-300
7.63
7.59
7.58
1.0
2.2
7.00
5.0
6.99
7.01
7.14
7.16
7.18
7.24
7.27
7.26
7.24
7.28
7.30
7.34
7.33
7.32
7.37
7.35
7.39
7.40
7.43
7.44
7.43
7.46
10.0
4.7
7.50
7.48
7.56
7.51
7.49
7.49
7.65
7.66
7.68
7.83
7.85
7.89
7.92
7.93
1.2
10.1
1.2
1.1
8.00
2.2
1.0
ppm (t1)
7.96
1.0
2.2
4.7
10.1
1.2
1.2
1.1
2.2
1.0
8.02
8.02
8.00
8.00
7.18
7.16
7.14
7.01
6.99
7.68
7.66
7.65
7.63
7.59
7.58
7.56
7.51
7.49
7.49
7.48
7.46
7.44
7.43
7.43
7.40
7.39
7.37
7.35
7.34
7.33
7.32
7.30
7.28
7.27
7.26
7.24
7.24
8.02
8.00
8.00
7.96
7.93
7.92
7.89
7.85
7.83
Anhang
133
1
H-NMR-Spektrum (CDCl3, 400.1 MHz) von Phosphanoylbinaphthyl 10
ppm (t1)
0.0
ppm (t1)
135.0
130.0
125.0
120.0
113.5
116.6
100
119.0
119.8
123.0
127.1
126.6
150
128.5
128.4
128.3
128.2
128.2
128.1
127.4
127.3
127.3
128.7
128.6
128.8
129.8
130.8
200
131.4
131.1
131.5
132.3
132.0
131.9
131.7
132.7
133.4
133.3
133.3
133.7
134.7
134.1
137.4
137.4
113.5
119.8
119.0
116.6
123.0
145.8
137.4
137.4
134.7
134.1
133.7
133.4
133.3
133.3
132.7
132.3
132.0
131.9
131.7
131.5
131.4
131.1
130.8
129.8
128.8
128.7
128.6
128.5
128.4
128.3
128.2
128.2
128.1
127.4
127.3
127.3
127.1
126.6
Anhang
134
13
C-NMR-Spektrum (CDCl3, 100.6 MHz) von Phosphanoylbinaphthyl 10
ppm (t1)
50
0
115.0
1.0
1.0
1.0
2.4
3.1
1.1
1.1
7.0
1.0
2.0
1.0
1.0
10.0
ppm (t1)
200
100
0
-100
5.0
-200
7.19
7.18
7.16
7.07
7.06
7.03
7.01
300
7.58
7.57
7.56
7.55
7.54
7.52
7.52
7.52
7.51
7.50
7.50
7.50
7.49
7.48
7.47
7.43
7.41
7.40
7.40
7.39
7.38
7.37
7.37
7.36
7.36
7.33
7.32
7.31
7.31
7.30
7.29
7.29
7.27
7.26
7.25
7.25
7.24
7.23
7.67
7.66
7.65
7.64
7.96
8.03
8.02
7.95
7.87
7.85
7.83
28.6
Anhang
135
31
P-NMR-Spektrum (CDCl3, 162.0 MHz) von Binaphthylnitril 11
ppm (t1)
-300
1
H-NMR-Spektrum (CDCl3, 600.1 MHz) von Binaphthylnitril 11
0.0
1.0
7.30
7.33
7.32
7.31
7.41
7.40
7.40
7.39
7.38
7.37
7.37
7.36
7.36
7.00
2.4
7.40
7.47
7.43
7.48
7.49
7.50
7.50
7.50
7.52
7.51
7.52
7.52
7.10
3.1
7.50
1.1
1.1
7.60
7.54
7.55
7.56
7.57
7.64
7.58
7.65
7.66
7.67
7.85
7.83
7.87
7.95
8.01
8.01
7.96
7.20
1.0
7.30
1.0
7.70
7.0
7.80
1.0
7.40
2.4
1.0
7.90
3.1
8.00
7.50
1.1
7.60
1.1
7.70
ppm (t1)
2.0
1.0
1.0
ppm (t1)
7.0
1.0
8.03
8.02
7.01
7.06
7.03
7.16
7.07
7.18
7.23
7.19
7.25
7.24
7.26
7.25
7.29
7.27
7.30
7.29
7.31
7.31
7.32
7.33
7.41
7.40
7.40
7.39
7.38
7.37
7.37
7.36
7.36
7.47
7.43
7.48
7.49
7.50
7.50
7.50
7.52
7.51
7.52
7.52
7.54
7.55
7.56
7.57
7.64
7.58
7.65
7.66
7.67
Anhang
136
6.90
7.20
135.0
ppm (t1)
130.0
50
126.4
126.3
127.3
127.8
127.6
128.1
128.2
128.3
128.4
100
128.4
128.5
128.5
129.0
128.9
128.7
128.6
129.8
129.3
150
130.5
131.9
131.6
132.0
131.9
132.5
132.0
200
132.8
132.5
133.0
133.2
133.1
133.2
134.3
134.7
134.7
118.7
112.3
130.5
129.8
129.3
129.0
128.9
128.7
128.6
128.5
128.5
128.4
128.4
128.3
128.2
128.1
127.8
127.6
127.3
126.4
126.3
133.2
133.2
133.1
133.0
132.8
132.5
132.5
132.0
132.0
131.9
131.9
131.6
134.7
134.7
134.3
140.5
140.5
142.4
142.4
Anhang
137
13
C-NMR-Spektrum (CDCl3, 150.9 MHz) von Binaphthylnitril 11
ppm (t1)
0
10.0
0
-100
5.0
6.86
6.84
2.38
100
7.12
7.11
7.10
7.08
7.03
7.01
6.99
6.98
6.97
6.96
6.95
6.94
200
7.35
7.33
7.32
7.31
7.27
7.26
7.24
7.22
300
3.0
1.0
3.1
2.1
4.2
3.0
1.1
2.2
2.1
1.0
1.0
3.1
ppm (t1)
7.81
7.79
7.69
7.67
7.62
7.60
7.59
7.57
7.54
7.53
7.52
7.50
7.50
7.48
7.44
7.42
7.40
7.93
7.92
7.91
7.89
7.87
28.2
Anhang
138
31
P-NMR-Spektrum (CDCl3, 162.0 MHz) von Acetylbinaphthyl 12
ppm (t1)
-200
-300
1
H-NMR-Spektrum (CDCl3, 400.1 MHz) von Acetylbinaphthyl 12
0.0
100
50
29.6
125.0
129.0
128.8
128.8
128.3
128.2
128.0
127.8
127.7
127.6
127.5
127.4
127.2
127.2
127.1
126.4
135.5
135.4
134.4
134.2
134.1
134.0
133.5
133.2
132.8
132.2
132.1
132.1
131.5
131.5
131.0
131.0
130.7
200.1
144.7
144.6
137.0
1.0
7.50
3.1
2.1
4.2
150
3.0
1.1
200
2.2
8.00
2.1
1.0
250
1.0
3.1
ppm (t1)
ppm (t1)
7.00
13
C-NMR-Spektrum (CDCl3, 150.9 MHz) von Acetylbinaphthyl 12
0
6.84
6.86
6.95
6.94
6.97
6.96
6.98
6.99
7.08
7.03
7.01
7.10
7.12
7.11
7.26
7.24
7.22
7.27
7.31
7.32
7.44
7.42
7.40
7.35
7.33
7.48
7.53
7.52
7.50
7.50
7.59
7.57
7.54
7.79
7.69
7.67
7.62
7.60
7.81
7.87
7.91
7.89
7.92
7.93
Anhang
139
6.50
3.0
10.0
2.1
2.0
2.0
1.0
2.1
2.0
1.0
ppm (t1)
135.0
5.0
3.60
7.25
7.24
7.23
7.22
7.37
7.37
7.36
7.36
7.35
7.34
7.33
7.33
7.65
7.63
7.60
7.58
7.57
7.56
7.56
7.55
7.54
7.54
8.02
8.00
7.99
8.13
8.11
8.10
8.09
8.31
8.30
130.0
125.0
127.4
127.2
127.2
127.1
126.4
127.5
127.6
127.7
128.0
127.8
128.2
128.3
128.8
129.0
128.8
131.0
130.7
131.0
131.5
132.1
131.5
132.1
132.2
133.2
132.8
133.5
134.0
134.1
134.4
134.2
135.5
135.4
137.0
Anhang
140
ppm (t1)
125.0
1
H-NMR-Spektrum (CDCl3, 600.1 MHz) von Monotriflat 14
0.0
52.2
128.7
128.3
128.2
128.2
127.7
127.4
127.3
127.0
126.5
126.2
123.0
119.8
119.4
116.6
113.4
132.6
132.2
130.4
129.8
129.5
135.2
133.9
133.5
144.4
2.1
8.00
2.0
100
2.0
1.0
150
2.1
ppm (t1)
2.0
1.0
166.7
ppm (t1)
7.50
13
C-NMR-Spektrum (CDCl3, 100.6 MHz) von Monotriflat 14
50
7.23
7.22
7.25
7.24
7.33
7.33
7.35
7.34
7.36
7.36
7.37
7.37
7.54
7.54
7.55
7.56
7.56
7.57
7.58
7.65
7.63
7.60
8.10
8.09
8.02
8.00
7.99
8.13
8.11
8.31
8.30
Anhang
141
7.00
135.0
134.0
133.0
132.0
131.0
130.0
129.0
128.0
126.2
126.5
127.0
127.4
127.3
127.7
128.2
128.3
128.2
128.7
129.5
129.8
130.4
132.2
132.6
133.5
142
133.9
135.2
Anhang
127.0
ppm (t1)
31
28.6
P-NMR-Spektrum (CDCl3, 162.0 MHz) von Binaphthylester 15
300
ppm (t1)
200
100
0
-100
-200
-300
7.46
7.45
7.00
6.50
6.00
5.50
6.97
5.0
6.99
7.22
7.20
7.20
7.19
7.18
7.10
7.10
7.09
7.08
7.07
7.05
7.04
7.26
7.25
7.24
7.24
7.38
7.37
7.36
7.36
7.35
7.34
7.32
7.32
7.40
7.48
1.0
4.1
7.50
4.5
4.2
7.51
7.50
7.54
7.53
7.52
7.60
7.63
7.62
7.65
7.68
7.68
7.67
7.71
7.77
7.73
7.90
7.79
7.92
8.02
7.95
7.95
10.0
4.3
8.00
2.9
8.50
1.1
9.00
2.1
1.0
ppm (t1)
3.0
1.0
4.1
4.5
4.2
4.3
2.9
1.1
2.1
1.0
8.04
6.99
6.97
3.52
7.10
7.10
7.09
7.08
7.07
7.05
7.04
7.26
7.25
7.24
7.24
7.22
7.20
7.20
7.19
7.18
7.54
7.53
7.52
7.51
7.50
7.48
7.46
7.45
7.40
7.38
7.37
7.36
7.36
7.35
7.34
7.32
7.32
7.95
8.04
7.92
8.02
7.90
7.79
7.77
7.73
7.71
7.68
7.68
7.67
7.65
7.63
7.62
7.60
Anhang
143
1
H-NMR-Spektrum (CDCl3+TMS, 400.1 MHz) von Binaphthylester 15
ppm (t1)
0.0
ppm (t1)
140.0
135.0
130.0
125.0
50
126.2
125.9
126.9
127.2
127.3
127.8
127.6
128.0
128.0
128.1
128.5
128.6
100
128.9
128.7
130.8
131.2
131.3
131.8
131.4
131.9
132.1
150
133.4
132.6
132.2
133.5
133.6
134.3
200
134.6
138.3
138.2
144.3
144.3
51.8
166.7
144.3
144.3
138.3
138.2
134.6
134.3
133.6
133.5
133.4
132.6
132.2
132.1
131.9
131.8
131.4
131.3
131.2
130.8
128.9
128.7
128.6
128.5
128.1
128.0
128.0
127.8
127.6
127.3
127.2
126.9
126.2
125.9
Anhang
144
13
C-NMR-Spektrum (CDCl3+TMS, 100.6 MHz) von Binaphthylester 15
ppm (t1)
0
1.0
10.0
0
-50
5.0
6.68
6.67
6.64
6.23
6.21
50
7.19
7.17
7.16
7.15
7.13
7.11
7.00
6.99
6.98
6.97
6.96
6.95
7.35
7.33
7.32
7.30
7.29
100
7.66
7.64
7.63
7.62
7.61
7.60
7.55
7.55
7.53
7.51
150
1.0
2.1
5.1
1.9
3.1
2.1
3.1
3.1
ppm (t1)
7.78
7.76
7.76
7.75
7.75
7.73
7.73
7.72
7.95
7.94
7.93
7.92
7.90
7.88
35.6
Anhang
145
31
P-NMR-Spektrum (CDCl3, 162.0 MHz) von Binaphthylsäure 16
ppm (t1)
-100
-150
1
H-NMR-Spektrum (CDCl3+TMS, 400.1 MHz) von Binaphthylsäure 16
0.0
133.8
133.7
132.9
132.7
132.3
132.2
131.8
131.5
131.1
131.0
130.9
130.1
129.8
129.8
129.5
129.0
128.9
128.7
128.3
128.1
128.1
128.0
127.9
127.6
127.5
127.3
127.1
126.9
126.5
126.3
126.0
123.8
142.5
142.4
135.6
135.0
7.00
100
1.0
1.0
2.1
150
5.1
200
7.50
1.9
8.00
3.1
ppm (t1)
8.50
2.1
9.00
ppm (t1)
3.1
3.1
171.5
6.50
6.00
50
6.21
6.23
6.64
6.67
7.11
7.00
6.99
6.98
6.97
6.96
6.95
6.68
7.13
7.17
7.16
7.15
7.19
7.30
7.29
7.33
7.32
7.51
7.35
7.55
7.55
7.53
7.64
7.63
7.62
7.61
7.60
7.76
7.76
7.75
7.75
7.73
7.73
7.72
7.66
7.88
7.78
7.90
7.95
7.94
7.93
7.92
Anhang
146
5.50
13
C-NMR-Spektrum (CDCl3+TMS, 100.6 MHz) von Binaphthylsäure 16
0
300
ppm (t1)
200
66.3
100
135.0
0
-100
130.0
-200
123.8
126.0
126.3
126.5
127.6
127.5
127.3
127.1
126.9
127.9
128.0
128.7
128.3
128.1
128.1
130.1
129.8
129.8
129.5
129.0
128.9
130.9
131.1
131.0
132.2
131.8
131.5
132.3
132.9
132.7
133.8
133.7
135.0
135.6
Anhang
147
ppm (t1)
125.0
31
P-NMR-Spektrum (CDCl3, 162.0 MHz) von Binaphthylsäurechlorid 17
-300
2.0
1.9
7.00
6.89
5.0
6.93
6.91
7.01
6.95
7.17
7.03
7.19
7.19
7.20
7.29
7.26
7.21
7.30
7.34
7.32
7.38
7.36
7.39
7.40
7.41
7.43
7.44
7.50
7.47
7.46
7.52
7.57
7.53
10.0
2.8
20.2
1.1
7.50
7.59
7.63
7.61
7.65
7.67
7.70
7.68
7.70
7.73
7.74
7.79
7.76
7.87
7.81
7.89
7.94
7.96
7.95
2.0
1.9
2.8
20.2
1.1
6.2
2.0
3.0
1.9
1.8
6.2
2.0
3.0
ppm (t1)
1.0
1.8
7.98
7.97
6.95
6.93
6.91
6.89
7.03
7.01
7.81
7.79
7.76
7.74
7.73
7.70
7.70
7.68
7.67
7.65
7.63
7.61
7.59
7.57
7.53
7.52
7.50
7.47
7.46
7.44
7.43
7.41
7.40
7.39
7.38
7.36
7.34
7.32
7.30
7.29
7.26
7.21
7.20
7.19
7.19
7.17
7.89
7.87
8.16
9.47
8.14
8.42
8.41
8.39
8.38
8.13
8.12
8.08
8.07
8.06
8.05
8.04
8.00
7.98
7.97
7.96
7.95
7.94
Anhang
148
1
H-NMR-Spektrum (CDCl3, 400.1 MHz) von Binaphthylsäurechlorid 17
ppm (t1)
0.0
31
30.5
P-NMR-Spektrum (CDCl3, 162.0 MHz) von Binaphthylaminopropenon 18
200
100
0
-100
7.89
7.87
7.81
7.79
7.76
7.95
7.94
8.07
8.12
8.08
8.14
8.13
8.06
8.05
8.04
8.00
7.98
7.97
7.96
7.50
ppm (t1)
ppm (t1)
20.2
8.00
1.1
6.2
2.0
8.50
3.0
1.9
9.00
1.8
1.0
1.8
9.50
8.16
8.39
8.38
8.42
8.41
149
9.47
Anhang
-200
6.00
5.50
5.07
5.09
6.96
6.95
7.07
7.06
7.05
7.28
7.27
7.26
7.19
7.15
7.32
7.31
7.41
7.40
7.36
7.35
7.34
7.45
7.59
7.50
7.50
7.49
7.47
7.65
7.75
7.43
1.0
6.50
2.72
2.44
6.96
6.95
5.09
5.07
7.07
7.06
7.05
7.19
7.15
7.50
7.50
7.49
7.47
7.45
7.43
7.41
7.40
7.36
7.35
7.34
7.32
7.31
7.28
7.27
7.26
7.75
7.65
7.59
7.90
7.88
7.85
7.84
3.0
10.0
3.0
7.00
1.0
1.0
1.2
4.2
7.50
11.5
1.1
1.0
8.00
2.1
1.1
1.1
ppm (t1)
1.0
1.2
4.2
11.5
1.1
1.0
2.1
1.1
1.1
7.90
7.88
7.85
7.84
Anhang
150
1
H-NMR-Spektrum (CDCl3, 400.1 MHz) von Binaphthylaminopropenon 18
ppm (t1)
5.0
0.0
5.00
135.0
ppm (t1)
130.0
125.3
125.9
100
126.8
126.0
127.4
127.3
127.5
127.5
127.6
127.7
127.8
127.9
127.9
150
128.3
128.2
128.4
128.5
131.0
131.0
131.8
200
131.9
132.1
132.1
133.4
133.2
134.2
134.1
134.3
36.7
44.5
132.1
132.1
131.9
131.8
131.0
131.0
128.5
128.4
128.3
128.2
127.9
127.9
127.8
127.7
127.6
127.5
127.5
127.4
127.3
126.8
126.0
125.9
125.3
97.7
143.6
139.8
134.3
134.2
134.1
133.4
133.2
192.5
Anhang
151
13
C-NMR-Spektrum (CDCl3, 100.6 MHz) von Binaphthylaminopropenon 18
ppm (t1)
50
0
125.0
15.0
100
50
10.0
0.9
0.9
1.0
2.0
1.1
1.2
5.2
5.1
4.2
3.1
ppm (t1)
150
7.24
7.24
7.22
7.21
7.21
7.20
7.20
7.19
7.19
7.19
7.18
7.16
7.16
7.14
7.13
7.12
7.11
7.10
7.10
7.06
7.04
6.96
6.95
6.94
6.94
6.92
6.92
6.85
6.85
6.83
6.83
6.83
6.81
6.55
6.52
6.81
5.80
5.79
200
ppm (t1)
7.68
7.67
7.66
7.65
7.65
7.63
7.62
7.62
7.59
7.52
7.52
7.50
7.50
7.50
7.49
7.48
7.48
7.47
7.46
7.44
7.43
7.42
7.41
7.40
7.39
7.86
7.84
7.84
7.82
7.81
7.79
31.7
Anhang
152
31
P-NMR-Spektrum (CDCl3, 162.0 MHz) von Pyrazolylphosphanoylbinaphthyl 19
0
-50
5.0
-100
1
H-NMR-Spektrum (CDCl3, 400.1 MHz) von Pyrazolylphosphanoylbinaphthyl 19
0.0
0.9
7.00
6.50
7.10
7.10
7.06
7.04
6.00
7.12
7.11
7.16
7.16
7.14
7.13
7.18
7.24
7.24
7.22
7.21
7.21
7.20
7.20
7.19
7.19
7.19
7.40
7.39
7.26
7.42
7.41
6.50
1.0
2.0
1.1
1.2
5.2
5.1
7.50
7.47
7.46
7.44
7.43
7.50
7.50
7.50
7.49
7.48
7.48
7.66
7.65
7.65
7.63
7.62
7.62
7.59
7.52
7.81
7.79
7.68
7.67
7.82
7.84
7.84
7.00
0.9
0.9
4.2
3.1
8.00
1.0
7.50
ppm (t1)
2.0
1.1
ppm (t1)
1.2
5.2
5.1
7.86
7.86
5.80
5.79
6.81
6.81
6.55
6.52
6.83
6.83
6.85
6.85
6.92
6.92
6.94
6.94
7.10
7.10
7.06
7.04
6.96
6.95
7.12
7.11
7.16
7.16
7.14
7.13
7.18
7.40
7.39
7.24
7.24
7.22
7.21
7.21
7.20
7.20
7.19
7.19
7.19
7.47
7.46
7.44
7.43
7.42
7.41
7.50
7.49
7.50
7.52
7.48
7.48
Anhang
153
5.50
ppm (t1)
135.0
130.0
127.1
126.7
126.1
125.7
100
127.4
127.4
127.7
127.8
127.8
128.5
128.4
128.2
128.1
128.7
128.6
150
128.9
130.0
129.9
129.7
130.7
131.1
131.1
131.2
131.9
132.0
132.0
200
133.0
132.7
132.1
133.4
133.3
133.5
133.5
134.6
134.6
105.4
133.5
133.5
133.4
133.3
133.0
132.7
132.1
132.0
132.0
131.9
131.2
131.1
131.1
130.7
130.1
130.0
129.9
129.9
129.7
128.9
128.7
128.6
128.5
128.4
128.2
128.1
127.8
127.8
127.7
127.4
127.4
127.1
126.7
126.1
125.7
138.5
134.6
134.6
143.4
143.3
143.2
Anhang
154
13
C-NMR-Spektrum (CDCl3, 100.6 MHz) von Pyrazolylphosphanoylbinaphthyl 19
ppm (t1)
50
0
125.0
50
1.0
10.0
31.2
6.5
ppm (t1)
7.55
7.54
7.52
7.51
7.50
7.48
7.47
7.46
7.43
7.41
7.38
7.37
7.34
7.33
7.31
7.28
7.26
7.24
7.23
7.19
7.17
7.16
7.13
7.10
7.07
7.05
7.04
7.03
7.03
7.02
7.01
7.00
6.98
6.97
6.94
6.93
6.90
6.88
6.87
6.84
6.83
6.80
6.79
5.59
8.04
7.99
7.95
7.93
7.90
7.88
7.86
-13.7
Anhang
155
31
P-NMR-Spektrum (CDCl3, 81.0 MHz) von Pyrazolylphosphanylbinaphthyl 20
ppm (t1)
0
-50
1
H-NMR-Spektrum (CDCl3, 200.1 MHz) von Pyrazolylphosphanylbinaphthyl 20
5.0
0.0
7.49
8.49
8.15
8.02
8.00
7.99
7.97
7.63
7.61
7.61
7.60
7.59
7.59
7.58
7.58
7.56
8.0
1.0
9.0
31.2
6.5
0.9
2.1
10.0
4.1
1.0
1.0
ppm (t1)
7.0
5.0
6.0
ppm (t1)
5.0
1
H-NMR-Spektrum (d4-DMSO, 400.1 MHz) von Naphthylamid 21
0.0
5.59
6.80
6.79
6.84
6.83
6.88
6.87
6.90
6.94
6.93
6.98
6.97
7.05
7.04
7.03
7.03
7.02
7.01
7.00
7.07
7.10
7.13
7.17
7.16
7.19
7.26
7.24
7.23
7.28
7.34
7.33
7.31
7.38
7.37
7.43
7.41
7.55
7.54
7.52
7.51
7.50
7.48
7.47
7.46
7.86
7.90
7.88
7.93
8.04
7.99
7.95
Anhang
156
127.5
127.5
127.3
127.3
126.4
124.2
134.0
132.0
131.5
128.6
167.8
8.00
100
50
7.49
7.58
7.58
7.56
7.60
7.59
7.59
7.63
7.61
7.61
7.97
8.02
8.00
7.99
8.15
0.9
150
2.1
8.50
4.1
1.0
200
1.0
ppm (t1)
8.49
Anhang
157
ppm (t1)
7.50
13
C-NMR-Spektrum (d4-DMSO, 100.6 MHz) von Naphthylamid 21
0
3.19
3.10
7.97
7.95
7.86
7.85
7.84
7.53
7.53
7.52
7.50
7.50
7.49
7.49
7.48
7.47
7.47
135.0
3.0
3.0
2.0
2.0
1.0
10.0
1.0
1.0
1.0
ppm (t1)
8.33
8.33
8.32
8.32
8.85
8.66
5.0
124.2
126.4
127.5
127.5
127.3
127.3
128.6
131.5
132.0
134.0
Anhang
158
ppm (t1)
130.0
125.0
1
H-NMR-Spektrum (CDCl3, 600.1 MHz) von Naphthylamidin 22
0.0
100
50
35.3
41.4
126.1
126.1
127.7
127.6
127.5
129.5
130.9
132.8
134.2
135.3
2.0
8.50
2.0
150
1.0
200
160.8
8.00
7.47
7.47
7.48
7.49
7.49
7.50
7.50
7.52
7.53
7.53
7.84
7.86
7.85
7.95
7.97
8.32
8.32
8.33
8.33
1.0
177.8
8.66
1.0
ppm (t1)
1.0
8.85
Anhang
159
ppm (t1)
7.50
13
C-NMR-Spektrum (CDCl3, 150.9 MHz) von Naphthylamidin 22
0
15.0
2.0
3.1
1.0
1.0
1.0
0.8
ppm (t1)
10.0
7.47
7.47
7.45
7.44
7.43
7.42
7.42
7.40
7.39
7.38
135.0
7.80
7.78
7.76
7.74
7.72
7.70
8.08
8.08
8.06
8.06
8.51
8.31
14.12
5.0
126.1
126.1
127.5
127.7
127.6
129.5
130.9
132.8
134.2
135.3
Anhang
160
ppm (t1)
130.0
1
H-NMR-Spektrum (CDCl3, 400.1 MHz) von Naphthyltriazol 23
0.0
147.7
134.2
133.3
128.9
128.7
127.9
127.2
126.8
126.6
126.2
123.7
8.00
150
100
2.0
8.50
3.1
159.6
50
7.42
7.42
7.40
7.39
7.38
7.47
7.47
7.45
7.44
7.43
7.78
7.76
7.74
7.72
7.70
7.80
8.08
8.08
8.06
8.06
8.31
1.0
200
1.0
1.0
250
ppm (t1)
8.51
Anhang
161
ppm (t1)
7.50
13
C-NMR-Spektrum (CDCl3, 100.6 MHz) von Naphthyltriazol 23
0
160.0
ppm (t1)
155.0
150.0
145.0
140.0
135.0
130.0
31
31.5
P-NMR-Spektrum (CDCl3, 162.0 MHz) von Binaphthylamid 24
100
ppm (t1)
50
0
-50
126.6
126.2
123.7
128.7
127.9
127.2
126.8
128.9
133.3
134.2
147.7
162
159.6
Anhang
125.0
6.50
1.0
1.0
7.00
1.0
2.1
5.2
7.50
6.00
5.50
5.0
5.51
6.33
6.95
6.93
6.65
6.63
6.35
7.10
7.14
7.12
7.18
7.16
7.28
7.26
7.20
7.42
7.30
7.45
7.44
7.47
7.53
7.51
7.49
7.62
7.57
7.55
7.69
7.64
7.75
7.75
7.74
7.73
7.72
7.72
7.71
7.86
7.88
7.91
7.93
10.0
1.3
8.00
1.0
8.50
4.3
1.0
1.1
3.1
9.00
1.0
2.0
1.0
9.50
1.0
0.9
ppm (t1)
2.1
5.2
1.3
4.3
1.0
1.1
3.1
2.0
1.0
0.9
9.45
5.51
6.95
6.93
6.65
6.63
6.35
6.33
7.20
7.18
7.16
7.14
7.12
7.10
7.64
7.62
7.57
7.55
7.53
7.51
7.49
7.47
7.45
7.44
7.42
7.30
7.28
7.26
9.45
7.93
7.91
7.88
7.86
7.75
7.75
7.74
7.73
7.72
7.72
7.71
7.69
Anhang
163
1
H-NMR-Spektrum (CDCl3, 400.1 MHz) von Binaphthylamid 24
ppm (t1)
0.0
ppm (t1)
135.0
130.0
125.0
125.9
124.6
125.9
127.7
127.5
126.7
127.8
127.9
100
128.3
128.0
128.8
128.8
128.5
128.3
129.4
129.1
129.0
128.9
129.7
130.9
130.8
150
131.7
131.3
131.0
132.1
132.0
132.2
132.3
133.7
133.1
133.0
200
133.7
134.8
136.6
124.6
129.7
129.4
129.1
129.0
128.9
128.8
128.8
128.5
128.3
128.3
128.0
127.9
127.8
127.7
127.5
126.7
125.9
125.9
133.7
133.7
133.1
133.0
132.3
132.2
132.1
132.0
131.7
131.3
131.0
130.9
130.8
134.8
136.6
143.1
143.0
172.9
Anhang
164
13
C-NMR-Spektrum (CDCl3, 150.9 MHz) von Binaphthylamid 24
ppm (t1)
50
0
Anhang
165
31
29.2
P-NMR-Spektrum (CDCl3, 162.0 MHz) von Binaphthylamidin 25
300
ppm (t1)
200
100
0
-100
-200
1
10.0
ppm (t1)
5.0
2.48
2.90
7.22
7.20
7.18
7.17
7.14
7.12
7.10
7.08
7.07
7.06
7.04
7.03
7.01
7.48
7.46
7.44
7.40
7.38
7.36
7.34
7.32
7.66
7.66
7.64
7.79
7.77
7.77
7.74
8.12
7.92
7.90
7.87
7.85
8.22
8.20
H-NMR-Spektrum (CDCl3, 400.1 MHz) von Binaphthylamidin 25
0.0
7.50
50
34.8
41.0
129.1
129.0
128.8
128.4
128.1
127.9
127.7
127.7
127.6
127.5
126.7
126.6
126.0
134.4
134.3
134.1
134.0
133.7
133.2
132.9
132.0
131.9
131.7
131.6
130.7
135.5
136.6
136.6
159.7
145.6
145.5
8.12
7.03
7.01
7.07
7.06
7.04
7.14
7.12
7.10
7.08
7.38
7.36
7.34
7.32
7.22
7.20
7.18
7.17
7.48
7.46
7.44
7.40
7.64
7.79
7.77
7.77
7.74
7.66
7.66
7.87
7.85
7.92
7.90
8.22
8.20
6.9
3.1
100
5.0
8.00
1.2
150
2.0
1.0
200
2.1
1.0
ppm (t1)
0.9
178.3
Anhang
166
ppm (t1)
7.00
13
C-NMR-Spektrum (CDCl3, 100.6 MHz) von Binaphthylamidin 25
0
ppm (t1)
200
100
31.7
135.0
0
-100
31
-200
ppm (t1)
130.0
P-NMR-Spektrum (CDCl3, 162.0 MHz) von Triazolylphosphanoylbinaphthyl 26
126.0
126.6
126.7
127.7
127.6
127.5
127.9
127.7
128.1
128.4
128.8
129.1
129.0
130.7
132.0
131.9
131.7
131.6
132.9
133.2
134.4
134.3
134.1
134.0
133.7
135.5
136.6
136.6
Anhang
167
1.0
7.00
6.50
6.75
6.74
6.57
6.55
6.77
6.76
6.91
6.79
6.78
7.19
7.17
6.97
6.95
6.92
7.22
7.21
7.20
7.27
7.26
7.25
7.23
7.45
7.43
10.0
2.0
3.2
5.1
7.50
7.56
7.55
7.54
7.52
7.51
7.49
7.47
7.78
7.76
7.62
7.60
7.58
7.57
7.87
7.86
7.84
7.82
7.81
7.79
7.92
7.89
7.89
7.93
15.0
1.1
3.3
8.00
2.0
7.3
ppm (t1)
7.94
1.00
2.04
3.15
5.06
1.08
3.33
2.00
7.28
7.96
6.79
6.78
6.77
6.76
6.75
6.74
6.57
6.55
7.62
7.60
7.58
7.57
7.56
7.55
7.54
7.52
7.51
7.49
7.47
7.45
7.43
7.27
7.26
7.25
7.23
7.22
7.21
7.20
7.19
7.17
6.97
6.95
6.92
6.91
7.96
7.94
7.93
7.92
7.89
7.89
7.87
7.86
7.84
7.82
7.81
7.79
7.78
7.76
14.59
Anhang
168
1
H-NMR-Spektrum (CDCl3, 400.1 MHz) von Triazolylphosphanoylbinaphthyl 26
ppm (t1)
5.0
0.0
155.0
ppm (t1)
150.0
145.0
140.0
135.0
130.0
125.0
50
120.0
126.8
126.4
127.5
127.5
127.1
100
129.5
129.3
128.9
128.9
128.7
128.6
128.0
127.9
127.9
127.8
129.9
130.9
130.5
130.4
131.9
131.2
132.2
132.1
150
133.0
132.9
132.5
132.4
133.2
200
ppm (t1)
134.8
134.0
142.3
142.2
154.9
154.9
142.3
142.2
134.8
134.0
133.2
133.0
132.9
132.5
132.4
132.2
132.1
131.9
131.2
130.9
130.5
130.4
129.9
129.5
129.3
128.9
128.9
128.7
128.6
128.0
127.9
127.9
127.8
127.5
127.5
127.1
126.8
126.4
Anhang
169
13
C-NMR-Spektrum (CDCl3, 150.9 MHz) von Triazolylphosphanoylbinaphthyl 26
0
Anhang
170
31
-13.7
P-NMR-Spektrum (CDCl3, 162.0 MHz) von Triazolylphosphanylbinaphthyl 27
300
ppm (t1)
200
100
0
-100
-200
-300
1
7.67
7.56
7.54
7.52
7.51
7.50
7.49
7.48
7.46
7.44
7.31
7.29
7.28
7.26
7.24
7.22
7.22
7.20
7.20
7.19
7.18
7.18
7.17
7.17
7.16
7.15
7.15
7.14
7.13
7.11
7.00
6.98
6.96
6.94
8.02
8.00
7.98
7.95
7.93
8.47
8.44
8.13
8.11
H-NMR-Spektrum (CDCl3, 400.1 MHz) von Triazolylphosphanylbinaphthyl 27
5.2
11.4
3.2
1.0
3.1
1.0
1.0
10.0
ppm (t1)
5.0
0.0
129.3
129.2
128.6
128.5
128.4
128.3
128.3
128.1
127.8
127.1
127.1
126.8
126.1
126.0
130.8
133.9
133.8
133.6
133.4
133.3
133.1
132.5
132.5
135.8
135.7
135.5
135.4
7.50
100
5.2
11.4
8.00
3.2
150
1.0
8.50
ppm (t1)
3.1
200
ppm (t1)
1.0
1.0
155.1
142.8
142.6
136.9
136.8
7.00
50
6.98
6.96
6.94
7.11
7.00
7.13
7.19
7.18
7.18
7.17
7.17
7.16
7.15
7.15
7.14
7.20
7.20
7.22
7.22
7.26
7.24
7.28
7.46
7.44
7.31
7.29
7.48
7.50
7.49
7.54
7.52
7.51
8.02
8.00
7.98
7.95
7.93
7.67
7.56
8.13
8.11
8.47
8.44
Anhang
171
6.50
13
C-NMR-Spektrum (CDCl3, 150.9 MHz) von Triazolylphosphanoylbinaphthyl 26
0
ppm (t1)
24.9
140.0
200
100
135.0
0
-100
130.0
126.8
126.1
126.0
128.1
127.8
127.1
127.1
128.3
128.3
128.4
129.2
128.6
128.5
129.3
130.8
132.5
132.5
133.1
133.3
133.4
133.8
133.6
135.8
135.7
135.5
135.4
133.9
136.8
136.9
142.8
142.6
Anhang
172
ppm (t1)
125.0
31
P-NMR-Spektrum (CDCl3, 162.0 MHz) vom racemischen Pd-Komplex 28
-200
7.21
7.19
6.50
6.00
6.15
6.17
6.73
6.86
6.78
6.78
6.77
6.76
6.75
6.88
7.14
7.16
7.17
7.23
1.0
2.9
7.00
2.4
7.29
7.31
7.33
7.39
10.0
3.0
1.5
6.3
7.50
7.42
7.41
7.44
7.45
7.48
7.73
7.76
7.75
7.78
7.85
7.80
8.10
7.90
7.87
8.12
1.0
3.4
3.4
8.00
2.9
2.4
1.1
8.50
3.0
1.5
6.3
9.00
3.4
3.4
0.9
ppm (t1)
1.1
0.9
9.07
6.78
6.78
6.77
6.76
6.75
6.73
6.17
6.15
6.88
6.86
7.23
7.21
7.19
7.17
7.16
7.14
7.33
7.31
7.29
7.48
7.45
7.44
7.42
7.41
7.39
9.07
8.12
8.10
7.90
7.87
7.85
7.80
7.78
7.76
7.75
7.73
Anhang
173
1
H-NMR-Spektrum (CDCl3, 400.1 MHz) vom racemischen Pd-Komplex 28
ppm (t1)
5.0
0.0
5.50
Anhang
174
31
25.7
P-NMR-Spektrum (CD3OD, 162.0 MHz) vom racemischen Pd-Komplex 28
200
100
0
-100
-200
ppm (t1)
1
6.25
6.23
6.93
6.92
6.90
6.88
6.87
6.85
6.84
6.83
6.82
6.81
6.80
1.0
5.3
2.2
8.2
4.4
2.2
1.1
0.7
10.0
ppm (t1)
7.27
7.25
7.23
7.23
7.91
7.90
7.88
7.88
7.61
7.60
7.55
7.53
7.51
7.48
7.46
7.45
7.43
7.41
7.39
7.37
8.63
8.26
8.24
8.01
H-NMR-Spektrum (CD3OD, 400.1 MHz) vom racemischen Pd-Komplex 28
5.0
0.0
7.00
6.23
6.85
6.84
6.83
6.82
6.81
6.80
6.25
6.88
6.87
6.90
7.23
7.23
6.93
6.92
7.25
7.37
7.27
7.39
7.41
7.43
7.46
7.45
7.51
7.48
7.53
7.50
1.0
5.3
8.00
2.2
8.2
4.4
8.50
2.2
1.1
0.7
9.00
ppm (t1)
7.55
8.24
8.01
7.91
7.90
7.88
7.88
7.61
7.60
8.26
175
8.63
Anhang
6.50
6.00
5.50
31
22.5
P-NMR-Spektrum (CDCl3, 162.0 MHz) vom enantiomerenreinen Pd-Komplex S-28
300
ppm (t1)
200
100
0
-100
-200
-300
0.9
1.0
4.2
1.1
3.0
7.00
6.50
6.00
5.0
5.85
5.87
6.60
6.62
6.81
6.64
6.83
6.83
6.85
6.84
6.87
6.92
6.89
6.99
6.94
7.01
7.03
7.14
7.16
10.0
7.18
7.17
7.26
7.28
7.32
7.30
7.36
7.35
7.38
7.39
7.41
7.43
7.54
7.59
7.56
7.69
7.62
7.71
7.86
7.83
7.89
7.88
7.91
8.10
0.9
5.0
7.50
1.0
1.1
1.1
8.00
1.1
3.9
1.0
8.50
ppm (t1)
4.2
1.1
3.0
5.0
1.1
1.1
1.1
3.9
1.0
8.12
5.87
5.85
6.64
6.62
6.60
7.18
7.17
7.16
7.14
7.03
7.01
6.99
6.94
6.92
6.89
6.87
6.85
6.84
6.83
6.83
6.81
7.62
7.59
7.56
7.54
7.43
7.41
7.39
7.38
7.36
7.35
7.32
7.30
7.28
7.26
8.12
8.10
7.91
7.89
7.88
7.86
7.83
7.71
7.69
Anhang
176
1
H-NMR-Spektrum (CDCl3, 400.1 MHz) vom enantiomerenreinen Pd-Komplex S-28
ppm (t1)
0.0
ppm (t1)
160
150
140
130
120
124.9
124.3
126.0
126.3
100
127.2
127.2
127.0
126.8
126.7
131.4
131.3
129.8
129.2
129.1
128.9
128.8
128.2
128.1
127.9
127.8
127.7
127.5
150
133.6
133.5
133.3
133.2
132.1
134.9
136.2
136.1
200
ppm (t1)
142.1
141.9
152.6
161.8
124.9
124.3
129.8
129.2
129.1
128.9
128.8
128.2
128.1
127.9
127.8
127.7
127.5
127.2
127.2
127.0
126.8
126.7
126.3
126.0
132.1
131.4
131.3
133.6
133.5
133.3
133.2
134.9
161.8
152.6
142.1
141.9
136.2
136.1
Anhang
177
13
C-NMR-Spektrum (CDCl3, 100.6 MHz) vom enantiomerenreinen Pd-Komplex S-28
50
0
110
Anhang
178
7.2 Röntgenkristallstrukturdaten
Kristalldaten und Strukturverfeinerung für 11
Summenformel
Molmasse
Temperatur
Strahlung
Wellenlänge
Scanmodus
Kristallsystem
Raumgruppe
Zelldimensionen
C33H22NOP
479.49
293(2) K
MoKα
0.71073 Å
Φ-Oszillation
Monoklin
P21/n
a = 11.9257(8) Å
α = 90o
b = 13.4298(7) Å
β = 90.109(8)o
c = 15.5358(11) Å
γ = 90o
Zellvolumen
2488.2(3) Å3
Formeleinheiten pro Zelle Z
4
Berechnete Dichte
1.280 Mg/m3
Absorptionskoeffizient
0.138 mm-1
Kristallgröße
0.46 x 0.41 x 0.32 mm
Gemessener θ-Bereich
2.62 bis 26.73o
Anzahl der gemessenen Reflexe 22915
Unabhängige Reflexe
5233 (Rint = 0.0728)
Absorptionskorrektur
Keine
Max. und min. Transmission
0.9573 und 0.9395
Diffraktometer
Stoe IPDS
Strukturlösung
Direkte Methoden
Strukturlösungsprogramm
SIR97 (Giacovazzo et al., 1997)
Strukturverfeinerung
Vollmatrix Least-Squares gegen F2
Strukturverfeinerungsprogramm SHELXL-97 (Sheldrick, 1997)
Daten / Restraints / Parameter
5233 / 0 / 325
Endgültige R-Werte [I>2σ(I)]
R1 = 0.0374, wR2 = 0.1010
R-Werte (alle Daten)
R1 = 0.0449, wR2 = 0.1047
Wichtungsschema
w=1/[σ2(Fo2)+(0.0613P)2+0.2518P] mit P=(Fo2+2Fc2)/3
GooF (alle Daten)
1.046
Größtes Maximum und Minimum 0.289 und -0.307 eÅ-3
Verfeinerung nach F2 mit ALLEN Reflexen. Die gewichteten R-Werte wR2 und alle GooF's
basieren auf F2. Die konventionellen R-Werte R1 basieren auf F, wobei F für negative F2
gleich Null gesetzt wird. Das Ablehnungskriterium F2 > 2σ(F2) wird nur zum Berechnen von
R(obs) etc. verwendet. Zur Verfeinerung wurden alle Reflexe herangezogen. Grundsätzlich
gilt: Auf F2 bezogene R-Werte sind statistisch etwa doppelt so groß wie die auf F basierenden.
Auf ALLE Reflexe bezogene R-Werte sind noch größer.
Die Wasserstoffatome wurden geometrisch lokalisiert. Für die Verfeinerung wurde ein
Reitermodell angenommen. Als Temperaturfaktor wurde der 1.2-fache Wert des äquivalenten
isotropen Temperaturfaktors desjenigen C-Atoms eingesetzt, an welches das jeweilige HAtom gebunden ist.
Anhang
179
Einzelheiten können dem Handbuch für das Verfeinerungsprogramm SHELXL entnommen
werden.
wR2 =
GooF =
∑ [ w( F − F )
∑ [ w( F ) ]
2 2
c
2
o
]
R1 =
2 2
o
∑ [ w( F
2
o
− Fc2 )
( n − p)
∑F −F
∑F
o
c
o
]
n = Zahl der Reflexe; p = Zahl der verfeinerten Parameter
Kristalldaten und Strukturverfeinerung für 12
Summenformel
Molmasse
Temperatur
Strahlung
Wellenlänge
Scanmodus
Kristallsystem
Raumgruppe
Zelldimensionen
Zellvolumen
Formeleinheiten pro Zelle Z
Berechnete Dichte
Absorptionskoeffizient
Kristallgröße
Gemessener θ-Bereich
Anzahl der gemessenen Reflexe
Unabhängige Reflexe
Absorptionskorrektur
Max. und min. Transmission
Diffraktometer
Strukturlösung
Strukturlösungsprogramm
Strukturverfeinerung
Strukturverfeinerungsprogramm
Daten / Restraints / Parameter
Endgültige R-Werte [I>2σ(I)]
R-Werte (alle Daten)
Wichtungsschema
GooF (alle Daten)
Größtes Maximum und Minimum
C34H25O2P
496.51
293(2) K
MoKα
0.71073 Å
Φ-Oszillation
Monoklin
P21/n
a = 9.0356(6) Å
α = 90o
b = 24.7381(13) Å
β = 96.395(8)o
c = 11.4951(9) Å
γ = 90o
3
2553.4(3) Å
4
1.292 Mg/m3
0.138 mm-1
0.50 x 0.29 x 0.21 mm
2.72 bis 26.73o
29102
5428 (Rint = 0.0683)
keine
0.9716 und 0.9342
Stoe IPDS
Direkte Methoden
SIR97 (Giacovazzo et al., 1997)
Vollmatrix Least-Squares gegen F2
SHELXL-97 (Sheldrick, 1997)
5428 / 0 / 335
R1 = 0.0356, wR2 = 0.0898
R1 = 0.0561, wR2 = 0.0949
w=1/[σ2(Fo2)+(0.056P)2] mit P=(Fo2+2Fc2)/3
0.953
0.185 und -0.217 eÅ-3
Anhang
180
Verfeinerung nach F2 mit ALLEN Reflexen. Die gewichteten R-Werte wR2 und alle GooF's
basieren auf F2. Die konventionellen R-Werte R1 basieren auf F, wobei F für negative F2
gleich Null gesetzt wird. Das Ablehnungskriterium F2 > 2σ(F2) wird nur zum Berechnen von
R(obs) etc. verwendet. Zur Verfeinerung wurden alle Reflexe herangezogen. Grundsätzlich
gilt: Auf F2 bezogene R-Werte sind statistisch etwa doppelt so groß wie die auf F basierenden.
Auf ALLE Reflexe bezogene R-Werte sind noch größer.
Die Wasserstoffatome wurden geometrisch lokalisiert. Für die Verfeinerung wurde ein
Reitermodell angenommen. Als Temperaturfaktor wurde der 1.5-fache Wert (CH3-Gruppen)
bzw. der 1.2-fache Wert (Ar-H) des äquivalenten isotropen Temperaturfaktors desjenigen CAtoms eingesetzt, an welches das jeweilige H-Atom gebunden ist.
Einzelheiten können dem Handbuch für das Verfeinerungsprogramm SHELXL entnommen
werden.
wR2 =
GooF =
∑ [ w( F − F )
∑ [ w( F ) ]
2 2
c
2
o
]
R1 =
2 2
o
∑ [ w( F
2
o
− Fc2 )
( n − p)
∑F −F
∑F
o
c
o
]
n = Zahl der Reflexe; p = Zahl der verfeinerten Parameter
Kristalldaten und Strukturverfeinerung für 13
Summenformel
Molmasse
Temperatur
Strahlung
Wellenlänge
Scanmodus
Kristallsystem
Raumgruppe
Zelldimensionen
C21H12O
280.31
293(2) K
MoKα
0.71073 Å
Φ -Oszillation
Monoklin
P21/n
a = 5.7939(5) Å
α = 90o
b = 14.4034(10) Å
β = 91.156(10)o
c = 16.7610(15) Å
γ = 90o
3
Zellvolumen
1398.5(2) Å
Formeleinheiten pro Zelle Z
4
Berechnete Dichte
1.331 Mg/m3
Absorptionskoeffizient
0.081 mm-1
Kristallgröße
0.42 x 0.40 x 0.38 mm
Gemessener θ-Bereich
2.81 bis 26.73o
Anzahl der gemessenen Reflexe
12440
Unabhängige Reflexe
2958 (Rint = 0.0410)
Absorptionskorrektur
Semi-empirisch aus Äquivalenten
Max. und min. Transmission
0.99820 und 0.91441
Anhang
181
Diffraktometer
Strukturlösung
Strukturlösungsprogramm
Strukturverfeinerung
Strukturverfeinerungsprogramm
Daten / Restraints / Parameter
Endgültige R-Werte [I>2σ(I)]
R-Werte (alle Daten)
Wichtungsschema
GooF (alle Daten)
Größtes Maximum und Minimum
Stoe IPDS
Direkte Methoden
SHELXS-97 (Sheldrick, 1990)
Vollmatrix Least-Squares gegen F2
SHELXL-97 (Sheldrick, 1997)
2958 / 0 / 199
R1 = 0.0346, wR2 = 0.0733
R1 = 0.0641, wR2 = 0.0786
w=1/[σ2(Fo2)+(0.0380P)2] mit P=(Fo2+2Fc2)/3
0.924
0.101 und -0.112 eÅ-3
Verfeinerung nach F2 mit ALLEN Reflexen. Die gewichteten R-Werte wR2 und alle GooF's
basieren auf F2. Die konventionellen R-Werte R1 basieren auf F, wobei F für negative F2
gleich Null gesetzt wird. Das Ablehnungskriterium F2 > 2σ(F2) wird nur zum Berechnen von
R(obs) etc. verwendet. Zur Verfeinerung wurden alle Reflexe herangezogen. Grundsätzlich
gilt: Auf F2 bezogene R-Werte sind statistisch etwa doppelt so groß wie die auf F basierenden.
Auf ALLE Reflexe bezogene R-Werte sind noch größer.
Die Wasserstoffatome wurden geometrisch lokalisiert. Für die Verfeinerung wurde ein
Reitermodell angenommen. Als Temperaturfaktor wurde der 1.2-fache Wert des äquivalenten
isotropen Temperaturfaktors desjenigen C-Atoms eingesetzt, an welches das jeweilige HAtom gebunden ist.
Einzelheiten können dem Handbuch für das Verfeinerungsprogramm SHELXL entnommen
werden.
wR2 =
GooF =
∑ [ w( F − F )
∑ [ w( F ) ]
2 2
c
2
o
]
R1 =
2 2
o
∑ [ w( F
2
o
− Fc2 )
( n − p)
o
c
o
]
n = Zahl der Reflexe; p = Zahl der verfeinerten Parameter
Kristalldaten und Strukturverfeinerung für 15
Empirical formula
Formula weight
Crystal colour and habit
Crystal size (mm)
Temperature (K)
Wavelength (Å)
Crystal system
Space group
∑F −F
∑F
C35H29O4P
544.55
yellow prism
0.29 x 0.25 x 0.18
150(2)
1.54184
Triclinic
P-1
Anhang
182
Unit cell dimensions
Volume (Å3)
Z
Calculated density (Mg/m3)
Absorption coefficient (mm-1)
F(000)
θ-range for data collection (o)
Index ranges
Reflections collected
Independent reflections
Completeness to θ = 62.76o
Absorption correction
Max. and min. transmission
Refinement method
Data/restraints/parameters
Goodness-of-fit on F2
Final R indices [I>2σ(I)]
R indices (all data)
Largest diff. Peak and hole (e·Å-3)
a = 11.3481(12) Å
α = 108.256(11)o
b = 11.3870(13) Å
β = 100.343(10)o
c = 11.4780(15) Å
γ = 95.887(9)o
1365.5(3)
2
1.324
1.210
572
4.15/62.76
-13 ≤ h ≤ 13, -11 ≤ k ≤ 13, -12 ≤ l ≤ 13
11337
4274 (Rint = 0.0359)
97.3 %
Semi-empirical from equivalents (Multiscan)
1.00000 and 0.85937
Full-matrix least-squares on F2
4274/1/366
1.100
R1 = 0.0376, wR2 = 0.1062
R1 = 0.0424, wR2 = 0.1091
0.241/-0.382
Definitions:
R1 =
∑
Fo − Fc
wR2 =
∑F
o
GooF =
∑ [ w( F
2
o
− Fc2 )
( n − p)
]
∑ [ w( F − F )
∑ [ w( F ) ]
2
o
2 2
c
]
2 2
o
n = number of reflections; p = number of parameters
Notes on the refinement of 15.
The hydrogen atom H4O, which is bound to the oxygen atom O4 in the molecule of MeOH,
was located in the difference Fourier synthesis, and was refined semi-freely with the help of a
distance restraint, while constraining its U-value to 1.2 times the U(eq) value of O4. All the
other hydrogen atom positions were calculated in deal positions (riding model).
Anhang
183
Kristalldaten und Strukturverfeinerung für S-16
Empirical formula
Formula weight
Crystal colour and habit
Crystal size (mm)
Temperature (K)
Wavelength (Å)
crystal system
Space group
Unit cell dimensions
Volume (Å3)
Z
Caculated density (Mg/m3)
Absorption coefficient (mm-1)
θ-range (o)
Reflections collected
Independent reflections
Absorption correction
Data/restraints/parameters
Final R indices [I>2σ(I)]
R indices (all data)
GooF
Flack x parameter
∆ρmax/min (e Å-3)
C66H46O6P2
996.97
colourless prism
0.26 x 0.18 x 0.08
150(2)
1.54184
Monoclinic
I2 (no.5)
a = 22.756(5) Å
b = 9.516(5) Å
c = 24.068(5) Å
5048(3)
4
1.312
1.232
3.79/62.35
16111
7021 (Rint = 0.0282)
None
7021/1/851
R1 = 0.0264, wR2 = 0.0502
R1 = 0.0339, wR2 = 0.0514
0.888
0.012(12)
0.130/-0.198
α = 90o
β = 104.388(5)o
γ = 90o
Definitions:
R1 =
∑
Fo − Fc
wR2 =
∑F
o
GooF =
∑ [ w( F
2
o
− Fc2 )
( n − p)
]
∑ [ w( F − F )
∑ [ w( F ) ]
2
o
2 2
c
]
2 2
o
n = number of reflections; p = number of parameters
Comments:
No absorption correction has been performed.
All hydrogen atom positions were found in the difference map calculated from the model
containing all non-hydrogen atoms. The hydrogen positions were refined with individual
isotropic displacement parameters.
Anhang
184
Kristalldaten und Strukturverfeinerung für S-19
Empirical formula
Formula weight
Crystal colour and habit
Crystal size (mm)
Temperature (K)
Wavelength (Å)
Crystal system
Space group
Unit cell dimensions
Volume (Å3)
Z
Calculated density (Mg/m3)
Absorption coefficient (mm-1)
F(000)
θ-range for data collection (o)
Index ranges
Reflections collected
Independent reflections
Completeness to θ = 62.72o
Absorption correction
Max. and min. transmission
Refinement method
Data/restraints/parameters
Goodness-of-fit on F2
Final R indices [I>2σ(I)]
R indices (all data)
Absolute structure parameter
Extinction coefficient
Largest diff. Peak and hole (e·Å-3)
C35H25N2OP
520.54
yellow prism
0.17 x 0.22 x 0.43
150(2)
1.54184
Orthorhombic
P212121
a = 9.7400(5) Å
α = 90o
b = 14.5820(7) Å
β = 90o
γ = 90o
c = 18.7662(9) Å
2665.3(2)
4
1.297
1.155
1088
3.84/62.72
-10 ≤ h ≤ 11, -16 ≤ k ≤ 15, -21 ≤ l ≤ 21
21084
4225 (Rint = 0.0938)
99.5 %
Semi-empirical from equivalents (Multiscan)
1.00000 and 0.77914
Full-matrix least-squares on F2
4225/0/353
1.081
R1 = 0.0385, wR2 = 0.0951
R1 = 0.0519, wR2 = 0.1104
0.00(2)
0.0022(3)
0.260/-0.289
Definitions:
R1 =
∑
Fo − Fc
wR2 =
∑F
o
GooF =
∑ [ w( F
2
o
− Fc2 )
( n − p)
]
∑ [ w( F − F )
∑ [ w( F ) ]
2
o
2 2
c
]
2 2
o
n = number of reflections; p = number of parameters
Notes on the refinement of S-19.
All hydrogen atom positions were calculated in deal positions (riding model).
Anhang
185
Kristalldaten und Strukturverfeinerung für 24
Empirical formula
Formula weight
Crystal colour and habit
Crystal size (mm)
Temperature (K)
Wavelength (Å)
Crystal system
Space group
Unit cell dimensions
Volume (Å3)
Z
Calculated density (Mg/m3)
Absorption coefficient (mm-1)
θ-range (o)
Reflections collected
Independent reflections
Completeness to θ = 62.66o
Absorption correction
Data/restraints/parameters
Final R indices [I>2σ(I)]
R indices (all data)
GooF
∆ρmax/min (e·Å-3)
C33H24NO2P
497.50
colorless block
0.17 x 0.08 x 0.07
150(2)
1.54184
Monoclinic
P21/c
a = 13.4340(2) Å
α = 90o
b = 15.26440(10) Å β = 102.9070(10)o
c = 12.19040(10) Å γ = 90o
2436.63(5)
4
1.356
1.255
4.72/62.66
11853
3817 (Rint = 0.0206)
97.7 %
Semi-empirical from equivalents (Multiscan)
3817/1/342
R1 = 0.0301, wR2 = 0.0815
R1 = 0.0369, wR2 = 0.0843
1.047
0.262/-0.322
Definitions:
R1
∑F −F
=
∑F
o
c
wR2 =
o
GooF =
∑ [ w( F
2
o
− Fc2 )
( n − p)
]
∑ [ w( F − F )
∑ [ w( F ) ]
2
o
2 2
c
]
2 2
o
n = number of reflections; p = number of parameters
Comments:
Except the two hydrogens of the amide group, all other hydrogen atom positions were
calculated in deal positions (riding model).
Anhang
186
Kristalldaten und Strukturverfeinerung für S-26
Empirical formula
Formula weight
Crystal colour and habit
Crystal size (mm)
Temperature (K)
Wavelength (Å)
Crystal system
Space group
Unit cell dimensions
Volume (Å3)
Z
Calculated density (Mg/m3)
Absorption coefficient (mm-1)
F(000)
θ-range for data collection (o)
Index ranges
Reflections collected
Independent reflections
Completeness to θ = 62.65o
Absorption correction
Max. and min. transmission
Refinement method
Data/restraints/parameters
Goodness-of-fit on F2
Final R indices [I>2σ(I)]
R indices (all data)
Absolute structure parameter
Largest diff. Peak and hole (e·Å-3)
C34H24N3OP
521.53
colorless block
0.13 x 0.10 x 0.10
150(2)
1.54184
Orthorhombic
P212121
a = 9.58240(10) Å
α = 90o
β = 90o
b = 14.97890(10) Å
c = 18.3523(2) Å
γ = 90o
2634.18(4)
4
1.315
1.181
1088
3.81/62.65
-8 ≤ h ≤ 10, -17 ≤ k ≤ 17, -21 ≤ l ≤ 17
8968
3842 (Rint = 0.0187)
99.0 %
Semi-empirical from equivalents (Multiscan)
1.00000 and 0.93738
Full-matrix least-squares on F2
3842/1/355
0.989
R1 = 0.0263, wR2 = 0.0648
R1 = 0.0300, wR2 = 0.0661
0.005(16)
0.119/-0.199
Definitions:
R1
∑F −F
=
∑F
o
c
wR2 =
o
GooF =
∑ [ w( F
2
o
− Fc2 )
( n − p)
]
∑ [ w( F − F )
∑ [ w( F ) ]
2
o
2 2
c
]
2 2
o
n = number of reflections; p = number of parameters
Notes on the refinement of S-26.
The hydrogen atom H2N, which is bound to the nitrogen atom N2, was located in the
difference Fourier synthesis, and was refined semi-freely with the help of a distance restraint,
while constraining its U-value to 1.2 times the U(eq) value of N2. All the other hydrogen
atom positions were calculated in deal positions (riding model).
Anhang
187
Kristalldaten und Strukturverfeinerung für R-26
Empirical formula
Formula weight
Crystal colour and habit
Crystal size (mm)
Temperature (K)
Wavelength (Å)
Crystal system
Space group
Unit cell dimensions
Volume (Å3)
Z
Calculated density (Mg/m3)
Absorption coefficient (mm-1)
F(000)
θ-range for data collection (o)
Index ranges
Reflections collected
Independent reflections
Completeness to θ = 62.51o
Absorption correction
Max. and min. transmission
Refinement method
Data/restraints/parameters
Goodness-of-fit on F2
Final R indices [I>2σ(I)]
R indices (all data)
Absolute structure parameter
Largest diff. Peak and hole (e·Å-3)
Definitions:
R1 =
∑
Fo − Fc
wR2 =
∑F
o
GooF =
C34H24N3OP
521.53
colorless prism
0.51 x 0.49 x 0.38
150(2)
1.54184
Orthorhombic
P212121
a = 9.5843(3) Å
α = 90o
β = 90o
b = 14.9566(4) Å
c = 18.3330(5) Å
γ = 90o
2628.01(13)
4
1.318
1.183
1088
3.81/62.51
-10 ≤ h ≤ 10, -15 ≤ k ≤ 17, -20 ≤ l ≤ 20
7958
3819 (Rint = 0.0606)
98.9 %
Semi-empirical from equivalents (Multiscan)
1.00000 and 0.25068
Full-matrix least-squares on F2
3819/0/352
1.037
R1 = 0.0534, wR2 = 0.1374
R1 = 0.0615, wR2 = 0.1411
0.07(3)
0.309/-0.452
∑ [ w( F
2
o
− Fc2 )
( n − p)
]
∑ [ w( F − F )
∑ [ w( F ) ]
2
o
2 2
c
]
2 2
o
n = number of reflections; p = number of parameters
Notes on the refinement of R-26.
All hydrogen atom positions were calculated in deal positions (riding model).
Anhang
188
Kristalldaten und Strukturverfeinerung für R-28
Empirical formula
Formula weight
Crystal colour and habit
Crystal size (mm)
Temperature (K)
Wavelength (Å)
Crystal system
Space group
Unit cell dimensions
Volume (Å3)
Z
Calculated density (Mg/m3)
Absorption coefficient (mm-1)
F(000)
θ-range for data collection (o)
Index ranges
Reflections collected
Independent reflections
Completeness to θ = 32.51o
Absorption correction
Max. and min. transmission
Refinement method
Data/restraints/parameters
Goodness-of-fit on F2
Final R indices [I>2σ(I)]
R indices (all data)
Absolute structure parameter
Largest diff. Peak and hole (e·Å-3)
C68H46Cl2N6P2Pd2
1292.75
yellow prism
0.27 x 0.26 x 0.15
150(2)
0.71073
Orthorhombic
P212121
a = 16.33520(10) Å α = 90o
β = 90o
b = 18.2290(2) Å
c = 24.6564(2) Å
γ = 90o
7342.04(11)
4
1.170
0.644
2608
3.99/32.51
-24 ≤ h ≤ 24, -26 ≤ k ≤ 26, -37 ≤ l ≤ 37
24530
24530 (Rint = 0.0000)
94.4 %
Semi-empirical from equivalents (Multiscan)
1.00000 and 0.90812
Full-matrix least-squares on F2
24530/0/721
1.126
R1 = 0.0367, wR2 = 0.1009
R1 = 0.0500, wR2 = 0.1142
-0.052(17)
0.676/-0.472
Definitions:
R1
∑F −F
=
∑F
o
c
wR2 =
o
GooF =
∑ [ w( F
2
o
− Fc2 )
( n − p)
]
∑ [ w( F − F )
∑ [ w( F ) ]
2
o
2 2
c
]
2 2
o
n = number of reflections; p = number of parameters
Notes on the refinement of R-28.
All hydrogen atom positions were calculated in deal positions (riding model). Because of the
existence of severely disordered solvents (at least 6 solvent molecules to one target molecule,
which could be ethanol, CH2Cl2 and CHCl3), SQUEEZE process integrated in PLATON has
been used. And the detailed information has also been posted in the final CIF file.
Anhang
7.3 IR-Spektren
189
Anhang
190
Anhang
191
Anhang
192
Anhang
193
Anhang
194
Anhang
195
Anhang
196
Anhang
197
Anhang
198
Anhang
199
Anhang
200
Anhang
201
Anhang
202
Anhang
203
Anhang
204
Anhang
205
Anhang
206
Selbständigkeitserklärung
207
7.4 Selbständigkeitserklärung
Hiermit erkläre ich, dass ich die vorliegende Arbeit selbständig und nur unter
Verwendung der angegebenen Literatur und Hilfsmittel angefertigt habe.
Kaiserslautern, den 18.12.2008
………………………………
Claudia May
Danksagung
208
7.5 Danksagung
Mein besonderer Dank gilt Herrn Prof. Dr. Werner R. Thiel für die Bereitstellung des
interessanten Themas und den bei dessen Bearbeitung gewährten Freiheiten sowie
für die gute Betreuung.
Für die Anfertigung der Röntgenstrukturanalysen danke ich Dr. Yu Sun und Dr.
Gotthelf Wolmershäuser.
Frau Christiane Müller und ihren „Stellvertretern“ vor allem Dr. Christian Rauber und
Dr. Harald Kelm danke ich für die Messung unzähliger NMR-Spektren.
Weiterer Dank geht an Frau Birgit Dusch und Frau Elke Biehl für die Durchführung
der Elementaranalysen, an die drei Herrren aus der Chemikalienausgabe Frank
Schröer, Jürgen Rahm und Ludvik Napast für die Versorgung mit „Alltagschemikalien“ und natürlich an die Mitarbeiter der Glasbläserei Frau Carmen Eggert und
Herrn Csaba Tömör, die neben Reparaturen und Neuanfertigungen von Glasgeräten
auch Zeit für Gespräche aller Art fanden. ☺
Den Mitarbeitern des AK Hartung danke ich nicht nur für die Bereitstellung des
Polarimeters sondern auch für die Duldung des „Bisschen AC“ in ihren Reihen und
das nicht nur für die Messungen. ☺
Für die Unterstützung bei den Arbeiten im Labor möchte ich mich bei den
Forschungspraktikanten Nicole Raquet, Filipe Manjolinho Costa, Marcus Fischer,
Janina Bachmann, Diana Hach und Michael Zengerle sowie bei meinem HiWi Jens
Seltmann, der für mich einiges zum Thema Racematspaltungen ausgetestet hat,
bedanken.
Sowohl den derzeitigen als auch den ehemaligen Arbeitskreismitgliedern und Frau
Anke Kaiser danke ich für das freundschaftliche Arbeitsklima, die stete Hilfs- und
Diskussionsbereitschaft sowie für viele gemeinsame Unternehmungen.
Danksagung
209
Besonderer Dank gilt dabei:
Susi und der wechselnden Besatzung unseres „Großraumlabors“ vor allem Zhou,
Kevin und Saskia für die gute Zusammenarbeit. ☺
Frank und Andreas P. von gegenüber nicht nur für Chaos und übermäßig gute Laune
sondern auch für die Messung der MALDI-Spektren. ☺
Christian Lothschütz, meinem betreuenden Diplomanden, für den hilfreichen Tipp mit
dem Cuprat.
Thomas für einige Telefonkonferenzen, die zur erfolgreichen Installation von
Programmen und zur Entstehung des Spektrenanhangs geführt haben. ☺
Andreas R., der es erst möglich gemacht hat (Windows XP sei dank), dass diese
Arbeit auf meinem Rechner überhaupt geschrieben werden konnte.
Anett, Saskia und Anke für die zahlreichen nichtchemischen Gespräche und die
vielen aufmunternden Worte vor allem in der Endphase der Promotion.
Allen, die ich grad vergessen habe und die mir trotzdem nicht böse sind. ☺
Außerdem möchte ich mich noch bei allen Mitarbeitern der Arbeitskreise Sitzmann
und Krüger für die Unterstützung und das gute Arbeitsklima im 6. Stock bedanken.
Ein Riesendankeschön geht natürlich auch an meinen Schatz und Ruhepol Mario,
der nicht nur ein sehr genauer (meticulously ☺) Korrekturleser war, sondern auch
unendlich viel Geduld mit mir hatte. Danke für dein Verständnis!
Meinen Eltern danke ich für ihre Unterstützung aus der Ferne und der Zusendung
zahlreicher OST-Päckl. ☺
Ich danke allen für die schöne Zeit in Kaiserslautern.
Lebenslauf
210
7.6 Lebenslauf
Name:
Claudia Heidrun May
Geburtsdatum:
22.01.1980
Geburtsort:
Görlitz
Familienstand:
ledig
Schulausbildung:
09/86 – 07/92
Allgemeinbildende
Polytechnische
Oberschule
in
Jänkendorf
08/92 – 07/98
Gymnasium in Niesky
07/98
Abitur
Hochschulstudium:
10/98 – 03/00
Studium der Chemie an der TU Dresden
04/00 – 09/04
Studium der Chemie an der TU Chemnitz
09/01
Vordiplom
02/04 – 08/04
Diplomarbeit im Arbeitskreis von Prof.
Dr. S. Spange
09/04
10/04 – 02/09
Diplom
Promotion an der TU Kaiserslautern im Arbeitskreis
von Prof. Dr. W. R. Thiel