lodsubstituierte Eisen-Schwefel-Cluster: Neue
Werbung

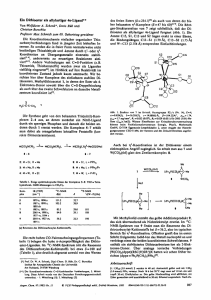
lodsubstituierte Eisen-Schwefel-Cluster: Neue Synthesen sowie zur Bildung und Stabilität von Fe2S2I42-, Fe4S4I42_ und Fe6S6I62-. Die Kristallstruktur von (Et4N)6(Fe4S4 l 4 )2Fe2S2l 4 Iodine Substituted Iron-Sulfur-Clusters: Novel Syntheses, Form ation and Stability of Fe 2S2I42_, Fe 4S4l 42_, and Fe 6S6 I62~. The Crystal Structure of (E t 4N) 6(Fe 4S4l 4 ) 2Fe 2S2l 4 Wolfgang Saak und Siegfried Pohl* Fakultät für Chemie, U niversität Bielefeld, U niversitätsstraße, D-4800 Bielefeld Z. Naturforsch. 40b, 1105 —1112 (1985); eingegangen am 9. A pril/29. Mai 1985 Iodine Substituted Iron-Sulfur Clusters, Novel Syntheses, Stability, Crystal Structure Fe 4S4I42~ has been prepared in tetrahydrofuran (TH F) solution by the reaction of Fe, S8, I2, and Me 3N CH 2PhTI~, and isolated as black, fairly air-stable crystals of (M e 3N CH 2Ph) 2Fe 4S4I 4 (1) in nearly quantitative yield. 1 reacts with iron and iodine or with elem ental sulfur and F e l 2 in C H 2C12 solution to form Fe 6S6I62~ which was isolated as black crystals of (M e 3N C H 2Ph) 2Fe 6S6I6 (5). In T H F solution Fe 6S6I62- is converted to Fe 4S4I42~ which was isolated as Fe(T H F) 6Fe 4S4I4-4 TH F (3). Evidence is presented for an equilibrium betw een Fe 2S2I42~ and Fe 4S4I42_, F el42~ and sulfur when iron, sulfur, iodine and E t 4N +I~ react (with the required stoichiom etry) to form Fe 2S2I42_ in C H 2C12 solution. From this solution (E t 4N ) 6(Fe 4S4I 4) 2Fe 2S 2I 4 (6 ) crystallizes as black needles (tetragonal, P4 2bc, a — 2467.9, b = 1653.8 pm , Z = 4). Crystals of 6 consist of the discrete anions Fe 4S4I 42 and Fe 2S2I42~ and E t 4N + cations. The [Fe 4S4]2+ core does not exhibit the usually ob­ served core distortion. This clearly dem onstrates that additional ligands (T H F, C H 3CN, iodide ions etc.) strongly reduce the stability of iodine substituted Fe/S clusters (except [Fe 4S4]2+ cores!). The biological relevance of the observed rearrangem ents is discussed. Das Interesse, das den in den letzten Jahren darge­ stellten thiolatsubstituierten Eisen-Schwefel-Clustern (s. z.B . [1—4] sowie dort zit. Lit.) entgegenge­ bracht wird, ist nicht zuletzt dadurch begründet, daß diese als Modellsubstanzen für die aktiven Z entren in Nicht-Häm -Eisenproteinen von Bedeutung sein können. In der Protein-Umgebung werden jedoch w ahr­ scheinlich auch Cluster stabilisiert, die thiolatsubstituiert synthetisch bisher nicht zugänglich sind (s. [Fe 3 S4] in [5 -8 ]). Damit sollten auch Fe —S-Cluster mit anderen Substituenten als zumindest strukturelle M odelle für proteinstabilisierte Cluster diskutiert werden. Unsere in diesem Zusam m enhang durchgeführten U ntersuchungen über das Fe/S/I-Redoxsystem erga­ ben bisher die neuen Komplexe Fe 6S6I62- [9] und Fe 8S6I83- [10]. Etwa zur gleichen Zeit w urden auf anderem Wege Fe 6S6Cl62- [11] und Fe 6S6Cl63~ [12] erhalten. * Sonderdruckanforderungen an Prof. Dr. S. Pohl. Neue Anschrift: Fachbereich C hem ie, U niversität O lden­ burg, Carl-von-Ossietzky-Straße, D-2900 O ldenburg. Verlag der Zeitschrift für Naturforschung, D -7400 Tübingen 0340 - 5087/85/0900 -1 1 0 5 /$ 01.00/0 A uf die im Arbeitskreis von Holm bereits vor eini­ gen Jahren dargestellten Fe 2S2X42~ und Fe 4S4X42~ (X = Cl, Br, I) [13, 14] sei hier ebenfalls verwiesen (s. auch [15]). Ergebnisse Darstellung und Reaktionen von Fe4S4I42~ Fe 4 S4 I42~ läßt sich nach 4 Fe + 4 S + I2 + 2 I TH F -------- > Fe 4S4l 4~ (1) in T etrahydrofuran (THF) quantitativ darstellen und als Benzyltrimethylammonium-(BTM A)-salz (1) iso­ lieren. Die schwarzen, kom pakten Kristalle von 1 sind an der Luft m ehrere Tage stabil. Die Reaktion verläuft schneller, wenn nicht pulverförmiges Eisen, sondern F e(C O ) 5 eingesetzt wird. Die Synthese von Fe 4 S4I42- nach Reaktion (1) ist sehr viel einfacher und erbringt höhere A usbeuten als der Weg über die thiolat- und chlorsubstituierten Vierkerne [13]. Eine Stöchiom etrie, die zur Bildung des Sechskerns Fe 6S6I62~ führen sollte, ergibt in TH F Fe 4 S4I42-: x THF 3 x ( 6 Fe + 6 S + 2 I 2 + 2 I") -------- > 4 Fe 4 S4l 42- + Fe(TH F)62+ + [FeL] + 2 S (2) Unauthenticated Download Date | 8/20/17 2:25 PM 1106 W. Saak —S. Pohl • lodsubstituierte Eisen-Schw efel-Cluster F el, kristallisiert nach unseren U ntersuchungen [16] aus TH F als 2: Darstellung und Reaktionen von Fe6S6I62 3 F el 2 TH F -------- * Fe(TH F) 62 +[FeI3 (THF)~], (3) Für die Lösung läßt sich jedoch ein Gleichgewicht etwa der folgenden A rt nicht ausschließen: F e(T H F) 62 +[FeI 3 (T H F ) ' ] 2 ^ 3 FeI 2(T H F ) 4 (4) Aus TH F wird nach Reaktion (2) Fe(T H F) 62 "F e 4S4 I42-. 4 TH F (3) als erste, am gering­ sten lösliche Kristallfraktion in Form schwarzer, hexagonaler Säulen in ca. 50-proz. A usbeute rein isoliert. Die A usbeute kann um 25—30% erhöht w er­ den, wenn [Fe + 12] im Überschuß eingesetzt w erden, wodurch die Fe(T H F)62+-Konzentration vergrößert wird (s. R eaktionen (2) und (3)). Fe 4 S4 I42- bildet sich auch bei der Umsetzung von feingem örsertem FeS (aus Zusammenschmelzen von Fe und S), I 2 und I- (als Tetraethylam m oniumsalz) in C H 2C12. Die Ausbeute ist allerdings sehr gering, die Reaktion außerdem sehr langsam (häufiges E r­ wärmen w ährend m ehrerer Wochen) und damit für präparative Zwecke nicht geeignet. Bem erkenswert scheint diese Umsetzung jedoch deswegen zu sein, weil die Bildung eines solchen Clusters (Identifizierung als (E t 4N ) 2Fe 4 S4I 4 • *CH,C1, (4) durch Röntgenstrukturanalyse) auf diesem Wege in Übereinstim m ung mit der Beobachtung ist, daß bei allen Zersetzungsreaktionen von Fe —S —I-Clustern bisher nie FeS als E ndprodukt beobachtet wurde. Von F el4~ wird Fe 4S4I42- nicht quantitativ oxidiert: CH,CI, l,5 F e 4 S4I 42 + Fel4' Fe 6S6I62- + F el42~ (5) Obwohl diese Reaktion noch intensiver untersucht werden muß, ist bisher bereits deutlich geworden, daß die Lage des Gleichgewichtes offenbar em pfind­ lich von Verunreinigungen beeinflußt wird. So kann über H 20 die Bildung von Formaldehyd erfolgen. Die dann entstehenden Verbindungen mit Ionen wie FeI 3 L - (L = CH 20 ) sind in C H 2C12 leichter löslich als F el42--Salze und verursachen so eine V erschie­ bung des Gleichgewichtes. In ähnlicher Weise können unterschiedliche K at­ ionen die Reaktion beeinflussen. Fe 6S6I62~ kann in einer einfachen Umsetzung nach 1,5 Fe 4 S4 I42_ + Fe + 2 I, — Fe 6S6I62~ + F el4" > (6 ) dargestellt und als (BTM A ) 2Fe 6S6I 6 (5) isoliert wer­ den. 5 bildet schwarze, leicht metallisch glänzende Plättchen, die an der Luft m ehrere Tage ohne sicht­ bare Zersetzung haltbar sind. Auf Grund der ge­ ringeren Löslichkeit kristallisiert 5 in etwa 75-proz. A usbeute rein aus, bevor das entsprechende F el4_Salz fällt. Die Reaktion , CH,CI, 1,5 Fe 4 S4 I 4 + 3 F el, + 2 S ---- — 1 + 2 Fe 6S6I62- + F e i r (7) ist zwar von den Molverhältnissen der Produkte her ein günstigerer Weg zu Fe 6S6I62-, die Umsetzung ver­ läuft jedoch — bedingt durch die Reaktionsträgheit von F el, — sehr viel langsamer. Die Synthesen nach ( 6 ) und auch (7) sind der D ar­ stellung aus den Elem enten [9] gemäß 6 Fe + 6 S + 2 I, + 2 L 1. THF 2. CH,C1, Fe 6S6I62_ (8 ) vorzuziehen, da nach ( 8 ) die Umsetzung zunächst in TH F durchgeführt wird und nach Abziehen dieses Lösungsmittels das Lösen des Rückstandes und die Kristallisation in bzw. aus CH,C1, erfolgen. Dieses V erfahren ist bei niedrigerer Ausbeute insgesamt aufwendiger. A ußerdem ergibt eine nicht exakte A usführung der Synthese nach ( 8 ) eine zusätzliche Verringerung der A usbeute, wenn nämlich das an das Eisen koordinierte TH F (s. Gleichung (2)!) nicht vollständig abgezogen wird [17], In Lösungsmitteln, die wie TH F oder CH 3CN als koordinierende Teilchen gegenüber Eisen-Kationen fungieren können, zersetzt sich der Sechskern ent­ sprechend der Gleichung (2). Vergleichbar reagiert wahrscheinlich Fe 6S6Cl62- [11], obwohl hier auf G rund spektroskopischer D aten lediglich der V ier­ kern und „unidentified by-products“ erwähnt werden. Dieses V erhalten macht es nicht sehr wahrschein­ lich, daß eine reduzierte Spezies F e ^ L 3- [12] aus C H 3CN isolierbar ist. In Ü bereinstim m ung mit der Beobachtung, daß Fe 6S6I62- gegenüber potentiellen Liganden (THF, Unauthenticated Download Date | 8/20/17 2:25 PM W. Saak —S. Pohl • lodsubstituierte Eisen-Schw efel-C luster 1107 CH3CN s.o .) instabil ist, zersetzen auch I -Ionen den Cluster: beitung Bedingungen herrschen (Thiolat-Überschuß, koordinierende Lösungsmittel), die die Bil­ dung der stabilsten Spezies, des Vierkerns, begünsti­ gen (s. auch [ 1 2 ]). Die beobachtete leichte Umwandlung von Clu­ stern ineinander in Abhängigkeit von der V erfügbar­ keit zusätzlicher Liganden (s. etwa Zersetzung des Sechskerns nach Reaktion (2) sowie (9)) ist mögli­ cherweise von Bedeutung für das Verständnis von R edoxreaktionen entsprechender Cluster in Pro­ teinen. So muß die Stabilisierung und Destabilisierung be­ stim m ter Oxidationsstufen nicht - wie bisher stets angenom m en — auf die Verzerrung eines Clusters beschränkt sein, sondern ist vielleicht verbunden mit der A usbildung einer ganz neuen G eom etrie, d.h . der Umwandlung in andere Cluster. Fe 6S6I62- + 21- Fe 4S4I 42 + Fe 2S2I 42 (9) Die analoge Umsetzung wurde in [11] für die chlor- und bromsubstituierten Sechskerne form u­ liert. Reaktion (9) ist insofern nicht vollständig, als Fe 2S2I42~ noch mit anderen Spezies im Gleichgewicht steht (s. u.). Z ur Bildung von Fe2S2l / Die Reaktion 2 Fe + 2 S + I2 + 2 F Fe 2S2I42- C H 2C12 (1 0 ) liefert nicht in eindeutiger Weise den erw arteten Zweikern. Wir isolierten bei dieser Umsetzung ne­ ben Schwefel und (E t 4N ) 2FeI 4 mit (E t 4N ) 2Fe 4S4I 4 *CH 2Cl2 (4) und (E t 4N ) 6(Fe 4S4I4) 2Fe 2S2I4 (6 ; s. auch K ristallstruktur von 6 ) zwei Verbindungen, die den V ierkern bzw. Zwei- und Vierkern enthalten. Die Elektronenspektren der entsprechenden CH 2C12-Lösung ließen sich bisher nicht eindeutig in­ terpretieren, die Zusammensetzung des „Produktge­ misches“ macht jedoch das folgende Gleichgewicht wahrscheinlich: 3 Fe 2S2I42~ ^ Fe 4S4I42_ + 2 F el42“ + 2 S (11) Bemerkenswerterweise wird ein analoges V erhal­ ten bei dem chlorsubstituierten Zweikern Fe 2S2Cl42_ nicht beobachtet [13], U nsere Ergebnisse stimmen hier nicht überein mit der in [13] berichteten Syn­ these von (E t 4N ) 2Fe 2S2I4. Strukturbestimmung von (Et4N )6(Fe4S4l4)2Fe2S2l4 (6) Experimentelles zur Strukturbestimmung Für die Strukturuntersuchungen wurde ein säulen­ förmiger Einkristall von 6 mit den Dimensionen 0,2 x 0,2 x 0,4 mm in ein M arkröhrchen eingeschlos­ sen. Verfeinerung der G itterkonstanten und M es­ sung der Reflexintensitäten erfolgten auf einem Syntex P 2 r V ierkreisdiffraktom eter (a>-scan-Methode, M o—Ka-Strahlung, X = 71,069 pm, Graphit-M onochrom ator, Szintillationszähler). Tab. I. K ristalldaten, M eßdaten und abschließende RW erte für 6 . schwarze, säulenförmige Kristalle tetragonal, P 4 2bc Kristallsystem, Raum gruppe a = 2467,9(6) G itterkonstanten [pm] c = 1653,8(4) V = 10072,49 X106 V olumen der Zelle [pm3] 4 Zahl der Form eleinheiten/Zelle 2,10 röntgenograph. Dichte [g-cirT 3] linearer A bsorptionskoeffizient 53,8 [cm "1] empirisch ( x p - s c a n ) A bsorptionskorrektur 0,595 sin 6»max/A [Ä _l] Zahl der unabhängigen Reflexe 4594 Zahl der beobachteten Reflexe 2 2853 253 Zahl der V ariablen /?, = 0,071, R , = 0,073 für beobachtete Reflexeb F arbe, Form Schlußfolgerungen Die Untersuchungen zeigen, daß in der Reihe der bisher dargestellten iodsubstituierten Fe —S-Cluster (einschließlich Fe 8S6I83_; s. [10]) lediglich der V ier­ kern gegenüber zusätzlichen D onoren wie T H F oder Iodidionen thermodynamisch stabil ist. In Ü berein­ stimmung mit dieser Beobachtung lagert sich auch das als metastabil bezeichnete Fe 6S6Cl63_-Ion beim Erwärm en in Acetonitril in den V ierkern um [12]. Obwohl thiolatsubstituierte Fe —S-Cluster teilwei­ se anders reagieren (Stabilität von R 2S2!), verdeutli­ chen die hier erhaltenen Ergebnisse jedoch, daß Vorsicht geboten ist bei Aussagen über die Struktur eines Clusters in einem Protein, wenn bei der A ufar­ Beobachtete Reflexe: I> 1 ,9 6 cr(I); R u R2: ungew ichteter bzw. gewichteter R-W ert; Definitionen von Ru R2 und a s. [18]. Unauthenticated Download Date | 8/20/17 2:25 PM 1108 W. Saak —S. Pohl • lodsubstituierte Eisen-Schw efel-Cluster K ristalldaten, M eßdaten und abschließende RW erte sind in Tab. I zusammengestellt. Die gemessenen Intensitäten wurden nach einer empirischen A bsorptionskorrektur sowie Lorentzund Polarisationsfaktorkorrekturen zu S trukturfak­ toren reduziert. Die Struktur wurde nach direkten M ethoden ge­ löst [19]. Die Verfeinerung nach dem V erfahren der Kleinsten Fehlerquadrate wurde zunächst mit iso­ tropen, dann unter Berücksichtigung der anomalen Dispersion für die schwereren Atome (Fe, S, I) mit anisotropen Tem peraturfaktoren der Form exp[ —2 j r ( \ J u h2a*2 + ••• + 2 U i2hka* b*)] vorge­ nommen. Das Gewichtsschema basierte im wesent­ lichen auf der statistischen Varianz der Meßwerte. Im letzten Zyklus der Verfeinerung waren alle Para­ Tab. II. A tom koordinaten (x lO 4) und isotrope bzw. anisotrope T em peraturparam eter (p rrrx lO ') mit Standardabwei­ chungen in Einheiten der letzten angegebenen Dezimalstelle. (1 ) (2 ) 1(3) 1(4) 1(5) 1 (6 ) F e(l) Fe(2) Fe(3) Fe(4) Fe(5) S(l) S(2) S(3) S(4) S(5) S(6 ) N (l) C (l) C(2) C(3) C(4) C(5) C(6 ) C(7) C( 8 ) N(2) C(9) C(10) C (ll) C(12) C(13) C(14) C(15) C(16) N(3) C(17) C(18) C(19) C(20) C(21) C(22) C(23) C(24) 1 1 X y 1003(1) 2160(1) 255(1) 2822(1) 433(1) 1431(1) 1804(2) 1347(2) 1047(2) 2063(2) 439(2) 1851(3) 917(3) 2238(3) 1255(3) (1 ) 63(1) 2095(1) 2535(1) 3627(1) 5045(1) 859(2) 1193(2) 1684(2) 1853(2) 4684(2) 1670(3) 799(3) 1026(3) 2106(3) 5000 5000 3354(9) 2850(11) 2357(15) 3503(13) 3621(14) 3352(13) 3105(16) 3765(11) 4354(14) 3951(10) 4379(16) 4302(17) 4061(12) 3718(13) 3359(11) 3143(15) 4000(11) 4561(14) 1245(8) 1758(16) 1645(16) 853(15) 1083(14) 1403(13) 1040(15) 890(14) 1231(14) 0 0 1550(8) 1341(11) 1738(15) 2038(12) 1972(14) 1679(12) 1268(16) 1040(12) 1251(15) 4078(10) 4427(16) 4408(17) 4235(12) 3885(13) 4175(11) 4764(13) 3472(11) 3301(15) 3653(8) 3688(18) 3806(17) 4165(14) 4686(13) 3588(14) 3525(16) 3189(14) 2627(13) 8 8 8 2 u„ u22 U33 2400 6011(2) 5953(2) 4307(2) 3871(2) 3826(2) 5190(3) 3772(3) 5194(3) 4545(3) 3856(3) 5887(5) 4849(5) 4022(5) 4020(5) 2846(7) 4930(8) 1560(14) 1910(19) 1754(26) 2016(20) 2918(22) 647(19) 167(28) 1710(22) 1463(24) 3573(17) 3128(25) 2175(26) 4463(20) 5045(23) 3382(20) 5343(24) 3392(19) 3560(27) 1482(14) 1962(27) 2841(26) 1650(23) 1394(21) 644(21) 68(26) 1813(23) 1754(24) 74(2) 97(2) 54(1) 57(1) 75(2) 61(1) 46(3) 50(3) 47(3) 36(2) 50(3) 54(5) 44(5) 47(5) 53(5) 51(8) 78(10) 40(6) 46(8) 101(14) 62(10) 80(11) 57(9) 107(15) 59(9) 90(13) 57(7) 95(14) 110(16) 57(9) 70(10) 51(9) 87(13) 44(8) 110(16) 35(6) 104(14) 96(14) 82(12) 6 8 (1 0 ) 6 6 (1 0 ) 98(14) 76(11) 81(12) 81(2) 58(1) 75(2) 67(2) 61(1) 70(1) 43(3) 51(3) 40(3) 38(2) 61(3) 57(5) 52(5) 56(5) 45(4) 81(10) 85(10) 50(1) 73(2) 79(2) 1 0 1 (2 ) 63(2) 74(2) 51(3) 42(3) 51(3) 55(3) 34(2) 41(5) 63(6) 56(7) 43(6) 38(7) 37(7) u23 UI3 -7 (1 ) 17(2) -1 7 (2 ) 1 0 (2 ) 0 (2 ) 8 (2 ) 0(3) 0(3) -3 (2 ) 0 (2 ) 5(3) -1 2 (5 ) 11(5) -4 (4 ) 8(4) - 2 (1 ) -1 3 (2 ) 1 2 (2 ) 6 (2 ) 1 1 (2 ) 0 (2 ) - 8 (2 ) 3(3) -3 (3 ) 0 (2 ) 1(3) -1 2 (5 ) 4(5) 1(4) 4(4) 0 0 0 0 Unauthenticated Download Date | 8/20/17 2:25 PM U12 - 8 (1 ) 17(1) 1 0 (1 ) -9 ( 1 ) - 2 (1) -7 ( 1 ) 7(2) - 1 (2 ) 2 (2 ) 2 (2 ) 2 (2 ) 1(4) -2 ( 4 ) 6(4) 8(4) 4(7) 2 (8 ) 1109 W. S a a k -S . Pohl • lodsubstituierte E isen-Schw efel-C luster meterverschiebungen kleiner als 0 ,1 a. Die Atomform faktoren wurden den International Tables en t­ nommen [2 0 ], Die A tom param eter sind in Tab. II angeführt. Tab. III enthält die wichtigsten interatom aren A b­ stände und Winkel*. * W eitere Einzelheiten zur K ristallstruktur können beim Fachinform ationszentrum Energie, Physik, M athem atik, D-7514 Eggenstein-Leopoldshafen 2, un ter Angabe der Hinterlegungsnum mer CSD 51532, der A utoren und des Zeitschriftenzitates angefordert werden. Tab. III. Wichtigste interatom are A bstände und W inkel in den A nionen von 6 mit Standardabweichungen in E inhei­ ten der letzten angegebenen Dezimalstelle. Fe 4 S4 I42~: 1 1 - Fe 2 1 3 - Fe 3 Fe 1—F e 2 F e l —Fe4 F e l —S2 ' Fe 2 —Fe3 Fe 2 —S2 Fe 2—S4 Fe 3- S I Fe 3 —S4 Fe 4 - S 3 253,7(5) pm 253,5(5) 272,9(7) 274,9(6) 226,6(9) 274,6(7) 229,0(10) 230,1(8) 229,3(9) 226,2(9) 225,8(9) - Fel 1 4 - Fe 4 Fe 1- F e 3 Fel - S I Fel -S 3 Fe 2 —F e4 Fe 2- S 3 Fe 3 —Fe4 Fe 3 —S2 Fe 4 - S I Fe 4 —S4 254,5(5) 255,0(5) 276,2(6) 231,1(9) 224,8(10) 272,0(6) 227,5(9) 275,9(6) 227,8(9) 232,4(10) 226,1(9) - Fe 1—S1 - Fe 1—S2 1 2 - Fe 1—S3 S l - Fe l - -S2 S 2 - F e l - -S3 S l - F e l - -S3 1 1 —F e 2 —S4 1 1 - F e 2 —S2 1 1 - F e 2 —S3 S 2 --F e2 --S3 S 2 --F e2 --S4 S 3 --F e2 --S4 112,6(3)° 114,5(3) 115,8(3) 103,3(3) 105,0(4) 104,2(3) 114,6(3) 114,5(3) 115,6(3) 103,3(4) 103,4(3) 103,9(3) 1 3 - Fe3 —S1 1 3 - Fe3 —S2 1 3 - Fe3 —S4 S l - F e 3 --S2 S l - F e 3 --S4 S 2 - F e 3 --S4 1 4 - F e 4 —S I 1 4 - F e 4 —S3 1 4 - F e 4 —S4 S l - F e 4 --S3 S l - F e 4 --S4 S 3 - F e 4 --S4 115,2(3) 113,5(3) 114,6(3) 103,4(3) 103,8(3) 105,0(4) 116,1(3) 113,3(3) 114,0(3) 103,5(3) 102,9(3) 105,8(3) 73,7(3) 72,8(3) 73,4(3) 73,6(3) 74,9(3) 73,9(3) F e l —S 3 --Fe2 F e l —S 3 --Fe4 Fe 2 —S 3 --Fe4 Fe 2 —S 4 --Fe3 Fe 2 —S 4 --Fe4 Fe 3—S 4 --Fe4 74,2(3) 75,2(3) 73,8(3) 74,0(3) 73,2(3) 75,2(3) 1 2 1 2 F e l —S l - -Fe3 F e l - S l - -Fe 4 Fe 3- S l - -Fe 4 F e l —S 2 - -Fe 2 F e l —S 2 --Fe3 Fe 2 —S 2 --Fe3 1 2 Fe 2 S 2 I42_: Fe 5—S5 Fe 5 —F e5a 1 6 - Fe 5 213,9(10) pm 267,2(8) 260,5(5) 110,4(2)° 1 5 - Fe5 —16 109,7(2) 1 6 - Fe5 —S5 110,7(2) 1 6 - Fe5 —S 6 Fe5 —S5 —Fe5a 77,3(5) Fe5 —S 6 15 —Fe 5 ,2 ( 1 1 ) 260,8(5) 2 2 2 15 —Fe5 —S5 111,7(2) 15—Fe5 —S 6 109,9(2) S 5 —F e 5 —S 6 104,4(3) Fe5 —S 6 —F e5 a 73,9(5) a Bezieht sich auf die Transform ation —x, 1 —y, z. Ergebnisse der Strukturbestimmung Die K ristallstruktur von 6 enthält neben den E t 4N +-Ionen Fe 4S4 I42~- und Fe 2 S2I42~-Clusteranionen im Verhältnis 2:1. Abb. 1 zeigt eine stereoskopische Darstellung der Elem entarzelle, Abb. 2 die A nionen mit m ittleren Bindungslängen. Die Struktur bestätigt die Annahm e, daß bei der o .a . Synthese in der Lösung Zwei- und Vierkerne nebeneinander vorliegen. Bei Fe 2S2I42_ sind die Bin­ dungen im Fe 2S2-Kern geringfügig kürzer als bei en t­ sprechenden chlor- und thiolatsubstituierten Spezies (s. z.B . [14, 21]). Die Differenzen liegen jedoch für die M ittelwerte (für 6 : s. Abb. 2; Fe 2S2Cl42~ : Fe —Fe: 271,6, F e - S : 220,1 pm [14]; Fe 2S2(S-p-tol)42“ : F e - F e : 269,1, Fe —SKern: 220,1 pm [21]) an der Grenze der Signifikanz und sollen hier nicht diskutiert werden. Auffällig ist der U nterschied der beiden F e —SBindungslängen im Zweikern von 6 (213,9 und 222,2 pm, s. Tab. III). Eine Erklärung dafür haben wir bisher nicht gefunden. Die Bindungsverhältnisse im Fe 4S4-Kern in 6 (s. Tab. III) weichen etwas von denen ab, die bisher bei CI- oder RS-substituierten Clustern beobachtet wurden, da diese stets eine tetragonale Verzerrung in der Fe 4 S4-Einheit aufweisen [14, 22—24], In Fe 4S4 I42~ ließe sich allenfalls eine Dehnung en t­ lang einer dreizähligen Achse, die etwa durch S 1 und F e 2 führt, erkennen. Die Standardfehler der Bin­ dungslängen sind jedoch zu groß, um diesen Effekt diskutieren zu können. Auch bei einem Fe 4 S4Br42_ wurde keine signifi­ kante tetragonale Verzerrung des Clusters beobach­ tet [15]. Wie bei den vergleichbaren chlorsubstituierten Komplexen [14] sind auch in 6 die Eisen-HalogenA bstände im Zweikern bei formal höherer Oxida­ tionsstufe von Fe größer als im Vierkern (M ittel­ werte: 260,7 bzw. 254,2). Das zeigt, daß die Elektronendichte am Eisen — und damit dessen „effektive“ Oxidationsstufe — we­ sentlich beeinflußt wird von der A rt, wie der Schwe­ fel gebunden ist (ju2 in Fe 2S2I42~ und /u3 in Fe 4S4I42_). Diese Tendenz setzt sich — wenn auch stark abge­ schwächt - fort bei Fe 8S6I83_, wo bei einer formalen m ittleren Oxidationsstufe von Eisen von +2,125 der Schwefel ^ 4-gebunden ist und der mittlere Fe —I-Abstand 253,4 pm beträgt [10], A nders dargestellt läßt sich in der Reihe Fe 2S2I42_, Fe 4S4I42~ und Fe 8S6I83~ die Bindungsart des Schwe- Unauthenticated Download Date | 8/20/17 2:25 PM Abb. 1. Stereoskopische Darstellung der Elem entarzelle von c-Achse. Fe - I : 2 6 0 .7 Fe - S : 218.1 Fe-Fe: 267.2 6 (ohne H -A tom e); Projektion nahezu parallel zur 2 5 4 .2 Fe - S : 2 2 8 .1 F e -F e : 2 7 4 .4 Abb. 2. A nionen von 6 im Kristall mit N um erierung der A tom e und mittleren Bindungslängen (pm ); Schwingungsellipsoide mit 50% W ahrscheinlichkeit. Unauthenticated Download Date | 8/20/17 2:25 PM W. Saak —S. Pohl • lodsubstituierte Eisen-Schw efel-C luster 1111 fels in Beziehung setzen zur m ittleren formalen Oxi­ dationsstufe von Eisen in diesen Clustern. Als „Endglied“ wäre hier FeS einzuordnen, wo bei zweiwertigem Fe der Schwefel quasi ^ 6-gebunden ist. und 1,28 g (5 mmol) S8 in 200 ml THF werden inner­ halb 5 min 9,4 ml (70 mmol) Fe(C O ) 5 getropft. Die Lösung wird 24 h unter Rückfluß erhitzt. Man läßt auf R aum tem peratur erkalten und frittet nach 24 h die in Form schwarzer, hexagonaler Säulen kristalli­ sierte Substanz ab. Man erhält so 13,5 g (82,5% ) von 3. (Z ur Begründung für den Überschuß an F el 2 s. Text!) W egen des schnellen Verlustes an T H F in der Trockne wurde keine vollständige Analyse durchge­ führt. Das Verhältnis F e : S : I ergab sich im Rahm en der Fehlergrenzen zu 1,25:1:1. (C 10H 16N ) 2Fe 6S6I 6 (5): 0,04 g (0,66 mmol) Fe und 0,34 g (1,33 mmol) I2 werden in 60 ml C H 2C12 bis zum vollständigen Auflösen des Eisens gerührt (je nach K orngröße 24—48 h). Die schwarzviolette Lö­ sung wird mit einer Lösung bzw. Suspension von 1 ,16g (Im m o l) (BTM A) 2Fe 4S4I4 (1) in 150m l C H 2C12 vereinigt und 3—4 d stehengelassen. Die aus­ gefallenen schwarzen, metallisch glänzenden Kristalle werden abgefrittet. Man erhält so 0,80 g (75% ) von 5. Experim enteller Teil Sämtliche A rbeiten wurden unter Ausschluß von Luft und Feuchtigkeit unter N2-A tm osphäre in ge­ trockneten und sauerstofffreien Lösungsmitteln aus­ geführt. (C 10H 16N ) 2Fe 4S4l 4 (1): Zu einer Mischung von 1,28g (5 mmol) S8, 5,54 g (20 mmol) Benzyltrimethylammoniumiodid und 2,54 g (10 mmol) I 2 in 200 ml TH F werden unter starkem Rühren innerhalb 5 min 5,37 ml (40 mmol) F e(C O ) 5 getropft. Die Lösung wird 12 h unter Rückfluß erhitzt und das Lösungs­ mittel anschließend abdestilliert. D er Rückstand wird 20 min im Vakuum (ca. 0,1 Torr) bei 50 °C ge­ trocknet, mit 200 ml CH 2C12 versetzt und mehrmals unter eigenem Druck auf 60 °C erhitzt. Nach 1 d wird abgefrittet und durch Einengen der M utter­ lauge bis auf ca. 15 ml eine weitere Kristallfraktion isoliert. Man erhält so 11,0 g (95%) von 1. C20H32N 2Fe4S4I4 (1159,7) Ber. C20,71 H2,78 N2,41 Fe 19,26 S 11,06 143,77, Gef. C21.08 H2,81 N2,49 Fe 18,97 S 10,84 143,53. C20H 32N 2Fe6S6I6 (1589,3) Ber. C 1 5 .ll H2,03 N I ,76 Fe21,08 S12,10 147,91, Gef. C 15,22 H2,08 N l,8 0 F e 20,87 S 12,14 148,04. Fe(TH F) 6Fe 4S4 I4-4 TH F (3): Zu einer Lösung von 10,16 g (40 mmol) I2, 5,15 g (20 mmol) (C 2H 5)4NI D er D eutschen Forschungsgemeinschaft und dem Fonds der Chemischen Industrie gilt der D ank für finanzielle Unterstützung. [1] R. H. H olm, Acc. Chem. Res. 10, 427 (1977). [2] K. S. H agen, A. D. W atson und R. H. H olm , J. Am. Chem. Soc. 105, 3905 (1983). [3] D. Coucouvanis, D. Swenson, N. C. Baenziger, C. M urphy, G. D. H olah, N. Sfarnas, A. Simopoulos und A. Kostikas, J. Am. Chem. Soc. 103, 3350 (1981). [4] H. Strasdeit, B. Krebs und G. H enkel, Inorg. Chem. 23, 1816 (1984). [5] D. G hosh, S. O ’D onnel, W. Furey (Jr.), A. Robbins und D. C. Stout, J. Mol. Biol. 158, 73 (1982). [6 ] H. B einert und A. J. Thom son, A rch. Biochem. Biophys. 222, 333 (1981). [7] M. R. A ntonio, B. A. Averill, I. M oura, J. J. G. M oura, W. H. O rm e-Johnson, B. K. Teo und A. V. Xavier, J. Biol. Chem. 257, 6646 (1982). [8 ] H. B einert, M. H. Em ptage, J. L. D reyer, R. A. Scott, J. E. H ahn, K. O. H odgson, A. J. Thom son, Proc. Natl. Acad. Sei. U .S.A . 80, 383 (1983). [9] W. Saak, G. H enkel und S. Pohl, Angew. Chem. 96, 153 (1984); Angew. Chem. Int. Ed.^ Engl. 23, 150 (1984). [10] S. Pohl und W. Saak, Angew. Chem. 96, 8 8 6 (1984); Angew. Chem. Int. Ed. Engl. 23, 907 (1984). [11] D. Coucouvanis, M. G. Kanatzidis, R. Lester, W. R. H agen und W. R. D unham , J. Am. Chem. Soc. 106, 7998 (1984). [12] M. G. Kanatzidis, W. R. H agen, W. R. D unham , R. K. Lester und D. Coucouvanis, J. Am. Chem. Soc. 107, 953 (1985); M. G. Kanatzidis, W. R. D unham , W. R. Hagen und D. Coucouvanis, J. Chem . Soc., Chem. Comm un. 1984, 356. [13] G. B. W ong, M. A. Bobrik und R. H. H olm , Inorg. Chem. 17, 578 (1978). [14] M. A. Bobrik, K. O. Hodgson und R. H. Holm, Inorg. Chem. 16, 1851 (1977). [15] A. M üller, N. Schladerbeck und H. Bögge, Chim ia39, 24 (1985). [16] S. Pohl und W. Saak, Z. Naturforsch. 39b, 1236 (1984). [17] In [11] werden die in [9] angegebenen A usbeuten für (E t 4 N ) 2 Fe 6 S6 I6 angezweifelt, was sicher auf ein nicht genaues Befolgen der Vorschrift bei den Synthesever­ suchen zurückzuführen ist. D a nur ein F el4~-Salz „in excellent yields“ isoliert wurde (s. Fußnote 12 in [11]), ist außerdem nach dem Verbleib des eingesetzten Schwefels zu fragen. Unauthenticated Download Date | 8/20/17 2:25 PM 1112 W. Saak —S. Pohl • lodsubstituierte Eisen-Schw efel-Cluster [18] S. Pohl und B. Krebs, Chem. Ber. 108, 2934 (1975). [19] Die Rechnungen wurden auf einem CMS-140-Rechner mit dem SHELXTL-Programm system durchgeführt. [20] International Tables for X-Ray Crystallography, Vol. IV, Kynoch Press 1974. [21] J. J. M ayerle, S. E. D enm ark. B. V. D ePam philis, J. A. Ibers und R. H. Holm, J. Am. Chem. Soc. 97, 1032 (1975). [22] L. Q ue (Jr.), M. A. Bobrik. J. A. Ibers und R. H. H olm , J. Am. Chem. Soc. 96, 4168 (1974). [23] B. A. Averill, T. Herskovitz. R. H. Holm und J. A. Ibers, J. Am. Chem. Soc. 95, 3523 (1973). [24] K. S. H agen. A. D. W atson und R. H. Holm, Inorg. Chem. 23, 2984 (1984) sowie dort zit. Lit. Unauthenticated Download Date | 8/20/17 2:25 PM