MHC & T-Zellen
Werbung

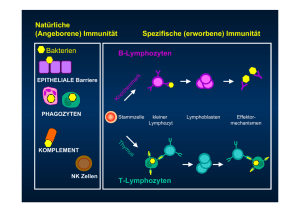
T-Lymphozyten • T-Lymphozyten erkennen spezifisch nur zellständige Antigene (Proteine!) und greifen sie direkt an. • Sie sind für die zellvermittelte Immunität verantwortlich. Antigenerkennung • B Zellen erkennen Antigene mit ihrem sIg • T Zellen können Antigene nur im Kontext mit einem MHC-Molekül auf der Oberfläche einer Antigenpräsentierenden Zelle erkennen. Die Antigenerkennung erfolgt mit dem T-Zell-Rezeptor MHC & T-Zellen • T- Zellen müssen beides erkennen: ANTIGEN und das MHC Molekül: Die Struktur des MHC-Antigen-Komplexes ist so, dass einige der polymorphen Aminosäuren des MHC in direktem Kontakt mit dem TZellrezeptor stehen. – Deshalb ist die Antigenerkennung der T-Zellen “MHC-restringiert”. Struktur des T-Zellrezeptors (TZR) β-Kette α-Kette V V C C Gelenk + + ~ 30.000 Ag-Rezeptoren/ T -Zelle + Transmembranregion cytoplasmatischer Schwanz TCR Gen Segmente & Proteine V Region V CDR1 CDR2 V V CDR1 V CDR2 C Region α Kette TCRα DJ β Kette TCRβ J γ Kette TCRγ δ Kette TCRδ J CDR3 CDR3 DDJ TZR/CD3-Komplex und Corezeptoren CD4 D1 TZR/CD3- Komplex Vα Vβ ε γ Cα Cβ δ ε D2 CD8 D3 α β extrazellulär D4 Membran ζ ζ p59 fyn p56 lck p56 lck intrazellulär Thymozyten Reifung T C Rαβ-, CD3- T C Rαβ+, CD3+ T C Rαβ+, CD3+ , C D 4+ , CD8+ , αTCR Genrearrangement T C Rαβ+, CD3+ , C D 4+ , CD8- , oder C D 4- , CD8+ , T C Rαβ+, CD3h i, C D 4+ , CD8- , oder C D 4- , CD8+ , βTCR Genrearrangement Proliferation +++ Proliferation +++ Proliferation + T-Zellreifung im Thymus Positive Selektion: Nur T-Zellen, die Selbst-MHC erkennen (ohne oder mit Peptid, auch Selbst-Peptide) überleben Negative Selektion: T-Zellen, die Selbst-Peptide (präsentiert auf Selbst-MHC) erkennen, werden durch Apoptose (programmierten Zelltod) eliminiert Beispiele für T-Zell-vermittelte Autoimmunerkrankungen • Insulin-abhängiger Diabetes mellitus (Typ I) • Rheumatoide Arthritis ? • Multiple Sklerose ? MHC = Major Histocompatibility Complex • MHC Klasse I – Auf allen kernhaltigen Zellen – Sehr polymorph – Präsentiert Peptide von etwa 9 Aminosäuren – Besteht aus einer Kette von 3 Domänen und ist mit ß-2-Mikroglobulin assoziiert • MHC Klasse II – Konstitutiv nur auf wenigen Zelltypen (B-Zellen, Makrophagen, dendritischen Zellen) – Auf anderen induzierbar (TZellen) – Weniger polymorph – Präsentiert Peptide bis 15 Aminosäuren – Besteht aus einer polymorphen ß Kette und einer α Kette MHC Klasse I Struktur Schwere Kette: α1-, α2-, α3-Domäne sehr polymorph α1-, α2-Domäne: Peptid-Bindung α3-Domäne: Transmembrandomäne ß2-Mikroglobulin (ß2m) Akzessorisches Molekül nicht polymorph In nicht-kovalenter Bindung zur schweren Kette MHC Klasse II Struktur Zwei Polypeptidketten: α-Kette & ß-Kette sehr polymorph Peptid-Bindungsdomäne Transmembrandomäne MHC beim Mensch = HLA Klasse I A B Klasse II C DP DQ D R Antigen-präsentierende Zellen: Klasse II („Professionell“) Dendritische Zellen Makrophagen B-Zellen Dendritische Zellen (Haut =Langerhans Zellen: - „Wächter“ des spezifischen Immunsystems - Primäre Immunantwort (humoral + zellulär) - Hohe (konstitutive) Expression von MHC - Hohe (konstitutive) Expression von Ko-Stimulatoren B-Zellen: - Primäre humorale Immunantwort zusammen mit dendritischen Zellen - Antigenpräsentation in der sekundären humoralen Immunantwort - MHC II und Kostimulatoren konstitutiv durch Entzündung Aufreguliert Monozyten / Makrophagen: - Antigenpräsentation nach Phagozytose / Aktivierung - Konstitutiv wenig MHC II + Kostimulatoren - Aufregulierung durch Aktivierung nortwendig - Wichtigste Funktion: - Aktivierung von Effektor-Helfer Zellen in der Peripherie - Zytokine – Aktivierung myeloider Effektorzellen (z. B. Makrophagen durch γ-Interferon) Dendritische Zellen: Trafficking und T-Zellaktivierung 2. - Einwandern in Lymphknoten - Chemotaxis durch konstitutive Exprimierte Chemokine in die T-Zell Zone - Interaktion mit antigen-spezifischen T-Helfer Zellen - Aktivierung und Proliferation der T-Helfer Zellen - T-Helfer Zellen wandern in B-Zell Zone (Follikel) - Interaktion der T-Helfer Zellen mit B-Zellen 1. - Pathogen / Gewebeschädigung - Entzündung / Zytokine / „Gefahr* - Aufnahme der Proteine Aktivierung gewebeständigen Dendritischen Zellen - Aktivierung und Export des - MHC-Peptid-Komplexes auf Membran - Aufregulierung von Chemokin-Rezeptoren - Emigration in die Lymphgefässe Klinische Relevanz des HLA •Immunabwehr: Antigenpräsentation •Transplantation: Allo-Antigene •Autoimmunität: Assoziation mit HLA Stadien der T-Zell Aktivierung, zellulären Expansion und Effektor-Funktion: Antigen-Erkennung und Aktivierung: TZR-vermittelt, „spezifisch“ • Proliferation und Expansion: Antigen-unabhängig („unspezifisch“), vermittelt über Wachstumsfaktoren (IL-2) und ihre Rezeptoren • Effektor-Funktion (z.B. Zytotoxizität): TZR-vermittelt, „spezifisch“ • T Zellen • Teilpopulationen werden durch Oberflächen-marker und ihre Zytokinmuster unterschieden • CD8+ Zellen sind zytotoxische T Zellen; sie erkennen das Antigen im Kontext mit MHC Klasse I. Sie töten z.B. virus-infizierte Zellen. • CD4+ Zellen bezeichnet man Helferzellen; sie erkennen das Antigen im Kontext mit MHC Klasse II. Sie produzieren Zytokine, die andere Zellen aktivieren. Effektor T-Zellen CD8 Killer T-Zelle CD4 Effektor Helfer TH1 CD4Effektor Helfer TH0 / TH2 Auslösung von programmiertem Zelltod (Apoptose) in Zielzellen durch CTL (Chromatin-Kondensierung, apoptotische Körperchen) Mechanismen der Zytotoxizität: Perforin und FasL Perforin: Homologie mit Komplement C9 Formen Poren in Plasmamembran Ähnlicher Mechanismus Fas-Ligand: Todesligand, der nach Bindung an seinen Rezeptor (Fas/CD95) Apoptose = Programmierten Zelltod auslöst Zellvermittelte Immunität CTL Infizierte Zelle Helfer T Zellen • Th1 – Produzieren Zytokine, die vor allem Makrophagen aktivieren zu phagozytieren und extrazelluläre Pathogene zu töten • Th2 – Produzieren Zytokine, die Plasmazellen stimulieren Antikörper zu sezernieren. Makrophagen-Aktivierung durch T-Helfer 1 (TH1) Zellen Wichtig für die Abwehr Von intrazellulärer Pathogene (z.B Tuberkulose) Wichtigstes Zytokin: Interferon-gamma Andere: TNF / LT / IL-1 Aktivierter Makrophage Aufgaben der T-Lymphozyten