Vorlesung 1: Einführung Einführung Vakzinierung, Gloucestershire
Werbung

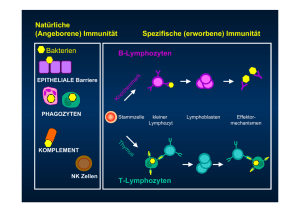
Vorlesung 1: Einführung Einführung Vakzinierung, Gloucestershire 1796 -Edwad Jenner schabte infiziertes Material aus der Hautläsion einer an Kuhpocken erkrankten Frauabgetragenes Material wurde in eine zuvor zugefügte Hautwunde eines Jungen übertragen erste „Impfung“ bzw. Äquivalent einer Impfung CAVE: Kuhpocken (Vaccinia Virus) sind etwas anderes als die Pocken (Variola Virus) und haben einen viel benigneren Verlauf Haut und Schleimhäute sind die erste Barriere gegen Infektionen -Haarfollikel, Schweißdrüsen unterbrechen die dichte, mehrlagige Epithelschicht -Schleimhäute machen den größten Teil der Grenzschichten aus (z.B. Darm) -Pathogene können nur eindringen, wenn ihnen eine Adhärenz auf der Oberfläche gelingt und sie danach die Epithelzellschicht durchdringen -Schleimhäute sind von Mukus unterschiedlicher Zusammensetzung überzogen, zusammen mit Flüssigkeitsbewegungen und Zilienschlag kann Besiedlung der SH verhindert werden -Defensine, wirken antimykotisch/bakteriostatisch -Schutz durch kommensale Flora Entzündung Unmittelbar wirksame Abwehrmechanismen: -Gewebsständige Zellen - z.B. dendritische Zellen, Gewebsmakrophagen, Langerhanszellen o.a. erkennen mit ihren PRRs (Pattern Recognition Rezeptor) die PAMPs (konservierte molekulare Muster der Infektionserreger) der Erreger -Erreger werden dann phagozytiert und abgetötet -außerdem werden Zytokine/Chemokine freigesetzt Entzündungsreaktion: -weiterhin reagieren-die Makrophagen, Mastzellen und dendritischen Zellen mit einem „Hilferuf“ massive Zytokinproduktion (v.a. IL1, IL6, TNF-a) -es kommt zur Rekrutierung weiterer Effektorzellen, Vasodilatation und lokaler Schwellung -Endothelzellen werden aktiviert exprimieren vermehrt Adhäsionsmoleküle auf ihrer Oberfläche mehr Immunzellen gelangen aus den Gefäßen zum Ort der Inflammation =Diapedese -dies wird auch durch die Vasodilatation (verlangsamter Blutfluss) unterstützt -ein Gradient von Chemokinen und Komplementproteinen (C3a,C5a) leitet die Zellen dann chemotaktisch an den Ort der Entzündung Vollbild einer Entzündung mit den entsprechenden Entzündungszeichen Aktivierung des adaptiven Immunsystems / Zusammenhang zw. Angeb. Und Adaptiven IS -parallel zu diesen Vorgängen induzieren die DC die adaptive Immunantwort -wenn unreife DC ein Antigen aufnehmen bzw. es durch ihre PRRs detektieren, verändern sie ihren Phänotyp und stellen die Mikropinozytose ein -Ag wird so zum Zeitpunkt der Gefahr im Zellinneren „konserviert“ -sie runden sich ab und migrieren durch die Lymphgefäße in die LK -auf dem Weg zum LK prozessieren sie das AG und exprimieren es in Form von MHC II / Peptid-Komplexen in sehr hoher Dichte auf ihrer Oberfläche und auch kostimulierende CD80/86 Moleküle -auf dem Weg zum LK differenzieren sich die DC also zu hoch effizienten APCs -in der T-Zell Zone der LK kommen sie in Kontakt mit nativen CD4+ T-Lymphozyten und präsentieren ihnen das Ag -T-Lymphozyten suchen aktiv nach einem passenden Peptid/MHC II -erkennen sie mit ihrem TZR ein passendes Ag werden die aktiviert d.h sie proliferieren es entstehen entsprechende Klone, diese differenzieren sich zu Effektorzellen (Th- Zellen) und einige später auch zu Memoryzellen -mit Hilfe der Th- Zellen differenzieren sich die B-Lymphozyten zu Plasmazellen und bilden schließlich entsprechende Antikörper -aktivierte T Zellen binden mit CD154 an CD40 der B-Lymphozyten, außerdem bilden sie Zytokine welche den B-Lymphozyt zur Differenzierung, Proliferation, Antikörperbildung stimulieren Die adaptive Immunantwort entsteht in den sekundär lymphatische Organen -dafür müssen die Erreger zunächst zu diesen transportiert werden -das übernehmen die Zellen des angeborenen IS -ohne entsprechende Interaktionen ist keine immunantwort möglich -DC bilden die Schnittstelle zwischen beiden Systemen Wie kommen Lymphozyten ins Zielorgan -Lymphozyten und Lymphe gelangen über die Duc. thoracicus ins Blut -Naive Lymphozyten wandern aus dem Blut in die sekundär lymphatischen Organe (Lymphknoten, Milz, und das mukosaassoziierte lymphatische Gewebe MALT) -Ag kommen mit DC und Lymphflüssigkeit über die afferenten Lymphgefäße in die LK Wenn das Immunsystem krank macht 1.keine Reaktion auf gefährliche AG bei Fehl- oder Dysfunktionen des IS -SCID (severe combined immuno deficiency),HIV 2.Allergien auf harmlose AG, meist IgE vermittelte Überreaktion mit Mastzelldegranulation 3.Reaktionen auf SelbstantigeneAutoimmunität Merke: -das IS schützt vor Infektionskrankheiten -für eine erfolgreiche Immunantwort müssen viele verschiedene Zellen kooperieren -die adaptive Immunantwort beginnen in den sekundär lymphatische Organen -wesentliches Merkmal des adaptiven IS ist des immunologische Gedächtnis Vorlesung 2: Gefahrenabwehr Angeborene/natürliche Immunität -dazu zählen: Barrieren, Zellen, lösliche Molekülen Barrieren gegen Infektionserreger -Resprationstrakt: Nasenhaare,Mukus,Zilien -Haut: RNAsen,DNAsen,mikrozidale Moleküle,pH 4-5, Fettsäuren u.a -Gastrointestinaltrakt: pH 1-2,Mukus, Enzyme, kommensale Mikroorganismen -Urogenitaltrakt: pH, Mukus, hydrostatischer Druck Mikrobiome -normalerweise Gleichgewicht zwischen Symbionten, Kommensalen, pathogen Erregern -ist das Gleichgewicht zu Gunsten der pathogenen Erreger gestört, kommt es zur Inflammation Beispiel: Pseudomembranöe Colitis durch Störung der Kommensalen 1. Normale Besiedlung mit kommensalen Bakterien 2. Antibiotika schwächen diese Population 3. C. difficile siedelt sich an und bildet ToxineZellschädigung 4. Neutrophile G. und Erythrozyten wandern in die Läsion ein 5. Erreger vermehren sich und die Entzündung breitet sich aus Antimikrobielle Peptide Defensine sind kleine 33-47 Aminosäuren lange Peptide, die drei intramolekulare Disulfidbrücken besitzen. Sie kommen in allen tierischen Organismen und höheren Pflanzen vor und dienen der Abwehr von mikrobiellen Erregern, vor allem Bakterien, aber auch Pilzen und Toxinen. In Säugetieren findet man sie zahlreich auf Haut- und Schleimhautoberflächen und sie bilden einen großen Anteil der Proteine (etwa 30 %) in den Granula der neutrophilen Granulozyten. Während einer Entzündungsreaktion steigt die körpereigene Produktion der Defensine an. -werden von Phagozyten, Epithelzellen produziert -wirken/ bewirken: mikrobizid, chemotaktisch, aktivieren Immunzellen, Neovaskularsierung, Wundheilung -vermehrte Produktion bei Psoriasis -verminderte Produktion bei M. Crohn Zellen des Immunsystems -stammen alle aus pluripotenten Stammzellen ab 1.pluripotente Stammzelle 2.myelopoetische Vorläuferzelle -Erythrozyten -Eosinophile -Thrombozyten -Neutrophile -Basophile -Monozyten 3.lymphopoetische Vorläuferzelle -T-Lymphozyten sind Zellen des -B-Lymphozyten adaptiven IS -Natürliche Killerzellen Normale Verteilung/Anzahl Neutrophile 30-80% Stabkernig 0-5% Eosinophile 0-6% Basophile 0-2% Monozyten 1-12% Lymphozyten 15-50% Zellen des angeborenen Immunsystems/angeborene Immunität -NK, Basophile,Neutrophile,Eosinophile,Monozyten,Mastzellen -handeln immer stereotyp -Neutrophile: Phagozytose -Eosinophile: Parasitenabwehr -Basophile: noch nicht bekannt (wahrscheinlich auch Parasitenabwehr) -Monozyten: Vorläufer der Makrophagen -Makrophagen:Phagozytose, Sekretion, Stimulation -Dendritische Zellen: Antigenpräsentation, Initiation der adaptiven Immunantwort -Mastzellen: woher genau sie kommen ist unklar, wichtig bei Allergien, Histamingranula -Natürliche Killerzellen:Untergruppe von Lymphozyten ohne spezielle Antigenrezeptoren -invariante, nicht klonale Rezeptoren -evolutionär altes System -schnelle Antwort, Chemokine, Komplement -KEIN Gedächtnis Zellen des adaptiven Immunsystems/Adaptive Immunität -entwickeln spezielle Funktionen, bilden das immunologische Gedächtnis -T/B-Lymphozyten -Plasmazellen sind die Träger des serologischen Gedächtnisses -während der Entwicklung entstehen viele verschiedene Varianten von T-Lymphozyten bzw. jede Zelle hat ihren eigenen Rezeptor (ca. 106 Möglichkeiten) -diverse klonale Rezeptoren -evolutionär neues System -späte Antwort, Antikörper, Zytokine -Gedächtisbildung Angeborene vs. Adaptive Immunität -Die Stärke und Geschwindigkeit der angeborenen Immunantwort ist immer gleich egal ob erster, zweiter usw. Kontakt -Geschwindigkeit und Stärke der adaptiven Immunantwort ist zunächst langsam und wenig umfangreich, bei jedem weiteren Kontakt mit dem Antigen verstärkt sich die Antwort jedoch Spezialisierte Zellen erkennen Infektionen und Gewebeschäden -Mastzellen, dendritische Zellen und Makrophagen erkennen die PAMP´s -sind evolutionär konservierte Merkmale/Strukturen(LPS, Zymosan, Flagellin) auf der Oberfläche der Erreger, die Expression ist spezifisch für bestimmte Erregergruppen -für die Detektion der PAMP´s stehen den Zellen des angeborenen IS die PRR´s zu Verfügung Pattern recognition Receptors (PRR´s) -Einteilung in vier Klassen: 1.Toll like receptors (TLR) -sind evolutionär extreme konserviert -es gibt membranständige TLR und intrazelluläre TLR (3,8,9)zeigen ins Innere der Zelle und detektieren z.B. DANN,RNA usw. von intrazellulären Erregern -immer gleiche stereotype Signaltransduktion an dessen Ende die Bildung von proinflammatorischen Cytokinen bzw. Typ I Interferon steht 2.C-type lectin receptors (CLR) -Mannanrezeptoren um z.B. Pilze zu erkennen 3.Nucleotide-binding oligomerization domain (NOD) Leucine-rich-repeat containing receptors (NLR) -Bestandteil des Inflammasoms Merke: Das Inflammasom ist ein cytosolischer Proteinkomplex in Makrophagen und neutrophilen Granulozyten, der durch Bestandteile von Bakterien oder durch Harnsäurekristalle stimuliert wird. Dadurch wird eine Serie von Reaktionen angestoßen, die zur Aktivierung von Caspase-1 führt. Caspase-1 aktiviert das proinflammatorische Zytokin Interleukin-1 durch Spaltung der inaktiven Vorstufe Pro-Interleukin-1. Aktives Interleukin-1 wird von den Makrophagen sezerniert und löst die Entzündungsreaktion aus. Wurde das Inflammasom durch Bakterienbestandteile aktiviert, spielt die Entzündungsreaktion eine wichtige Rolle bei der Abwehr der Infektion. Wurde die Entzündung dagegen durch Harnsäure-Kristalle ausgelöst, kommt es zum Gichtanfall.Das Inflammasom ist ein wichtiger Bestandteil des unspezifischen Immunsystems. 4.Retinoic-acid-inducible gene I protein (RIG-I) helicase receptors -führt auch wieder über NFB zu Bildung von Cytokinen Zytokine und Chemokine -Zellen habe mehrere Typen von Chemokin / Zytokinrezeptoren, somit können mehrere Zellen durch ein Zytokin stimuliert werden bzw. ein Zytokin kann mehrere Zellen stimulieren -Zytokine können autokrin (LI2), parakrin (IL2, IFN) und endokrin (IL1,IL6,TNF⟨) wirken -IL6:induziert die hepatische Synthese von Akut Phase Proteinen -Aktivierung der PRR bewirkt die Produktion proinflammatorischer Zytokine Damage Associated Molecular Patterns (DAMP´s) -PRR erkennen PAMP´s die mikrobielle Infektionen signalisieren -DAMP´s die Nekrose signalisieren -bei GewebeschädenFreisetzung von DAMP´s (Harnsäure, ATP,HSP) PRR übernehmen also die Unterscheidung gefährlich und ungefährlich Unterschiedliche PRR´s induzieren stereotype biologische Reaktionen -egal welcher Rezeptor angesteuert wird, es kommt zur Expression von proinflammatorischer Moleküle und damit zur Elimination der infizierten Zellen, Pathogene oder es kommt zum Immundefizid, septischen Schock oder zu chronischen Entzündungen -wesentliche Funktion der PRR´s ist also die Induktion der Zytokinexpression PRR´s und Immundefekte -Humaner Immundefekt durch Mutation von MyD88 oder IRAK-4 erhöhte Suszeptibilität für pyogene Infektionenkumulative Morbidität im frühen Kindesalter ca. 30-40%, im Erwachsenenalter keine erhöhte Morbidität, keine vermehrten Infektionen -Mutation im TLR3 Signalweg erhöhtes Risiko für Herpes-Enzephalitis -Mutation im TLR4 Hyperreaktivität, Infektionen mit A. fumigatus -Mutation im TLR5erhöhte Suszeptibilität für L.pneumophilia, rezidivierende Zystitis, aber keine erhöhte Morbidität für S.typhi, Polymorphismen sind häufig-10% ABER: protektiv gegen SLE, M.Crohn -Mutation im NOD2 verminderte Produktion von DefensinenM.Crohn Zusammenfassung: PRR´s Immundefekte -insgesamt sehr selten -teils letale Immundefekte, aber insgesamt doch weniger drastisch als es zu vermuten wäre -wahrscheinlich Kompensation durch adaptives Gedächtnis PRR´s Autoinflammatorische Syndrome -bei Überaktivität des Inflammasoms Merke: -mechanische, chemische und ökologische Barrieren schützen für Infektionskrankheiten -das angeborene IS trägt wesentlich zu selbst/ nichtselbst Unterscheidung bei -PRR´s erkennen PAMP´s bestimmter Pathogenklassen und endogene Gefahrensignale -PRR´s sind wesentlich für die Aktivierung von Zellen des angeborenen IS, Defekte können tödlich sein, Polymorphismen und Dysregulationen sind mit infektiösen oder inflammatorischen Erkrankungen verbunden Vorlesung 3: Mikrobenjäger Makrophagen -membranständige Rezeptoren unterstützen die Phagozytose (Scavenger R, Mannose R, TLR´s, Glucan R, Lipid R.) -sind nicht klonale Rezeptoren -es gibt Gewebsspezifische Makrophagen:Alveolarmakro, Kupfer Zellen usw. Neutrophile Granulozyten -Expression vieler verschiedener Rezeptoren für bakterielle/fungale Strukturen 1-Bakterium bindet an entsprechenden Rezeptor auf der Oberfläche der Neutros 2-Phagosom entsteht 3-Phagosom verschmilzt mit Granula der Neutros 4-pH änderung, antimicrobielle Wirkung 5-Verschmelzung mit LysosomPhagolysosom 6-Neutro geht in Apoptose und wird von Makrophage phagozytiert Respiratorischer Burst -das Phagolysosom enthält Enzyme die zur Produktion freier Radikale wichtig sind -der NADPH Oxidase Komplex besteht aus mehreren Untereinheiten. Sein Aufbau wird durch Phagozytose stimuliert Primäre (azurophile) Granula -Myeloperoxidase -BPI -alpha Defensine -Lysozym -Proteinase 3 -Kathepsin G M.Wegener: Autoantikörper gegen Proteinase 3Immunkomplexe lagern sich in Geweben ab und verändern z.B den Knorpel Sekundäre Granula -Lysozm -Gelatinase -Complement rezeptor 3 -Plasminogenaktivator -Kollagenase bei Fehlen der sekundären Granularezidivierende Infektionen mit S.aureus, S.epidemidis Neutrophile killen auch extrazellulär -Neutrophil extracellular Traps -Neutros entlassen Chromatin nach extrazellulärNetze entstehenBakterien bleiben am klebrigen Chromatin hängenSerinproteasen beginnen die Membran zu zerstören Extravasation 1-Wunde im Gewebe 2-Zytokinbildung durch Zellen des angeborenen IS 3-Vasodilatation mit verlangsamung des Blutstromes 4-Vermehrte Expression von Adhäsionsmolekülen durch das Endothel 5-Neutros binden mit ihrem s-Lex an das E-Selectin des Endothels 6-Zelle rollt am Endothel entlang 7-Interaktion zwischen dem LFA1 der Neutros und dem ICAM1 des Endothelsfestere Bindung 8-Öffnung der interzellulären Verbindungen und Durchtritt der NeutrosDiapedese 9-wandern entlang des Chemokingradienten zum Entzündungsherd Immundefekte chronische Granulomatose -es gibt zu viele Erreger, es können nicht alle abgetötet werden -auch durch Defekt der NADPH Oxidase -erreger werden eingekapseltum die Makrophagen mit den Erregern lagern sich TLymphozyten an und bilden viel Interferon gamma -Erreger im inneren bleiben vital Congenitale Neutropenien G6PD-Mangeldefekt respir. Burst Leukozytenadhäsionsdefekte Zusammenfassung Neutros -motile Phagozyten, die ins Gewebe wandern -baktericide Funktionen, bessere Killer als Makrophagen -killen auch extrazellulär NET´s -angeborene Defekte tödlich wenn unbehandelt -Primäre Granula(Lysosomen)enthalten:Lysoym, Peroxidase, hydrolytische Enzyme -Sekundäre Granula enthalten: Lysozym, Lactoferrin, Collagenase -stärkste Granulozytenfraktion im Blut (3-6000/µl) schwere Neutropenie <500µl !!! Eosinophile Granulozyten -motile Phagozyten, die ins Gewebe wandern -deutlich geringerre Phagozytose als Neutrophile -Inhalt der Granula schädigt die Membran der Parasiten -IL5 ist der wichtigste Wachstumsfaktor für Eosinophile -pathogenetisch bedeutsam bei Allergien -normalerweise<5% der Leukozyten -vermehrtes Auftreten bei Allergien, Helmithen-Infektionen, Colon Ca, iatrogen Basophile Granulozyten -motile Phagozyten, die ins Gewebe wandern -KEINE Phagozytose -bedeutsam bei Allergien -genaue Funktion nicht klar Mastzellen -Gewebeständig,v.a.nahe kleiner Gefäße -Regulation der Gefäßpermeabilität -Hämatopoetische Vorläuferzelle nicht bekannt -KEINE Phagozytose -bedeutsam bei Allergien, Asthma und wahrscheinlich bei Arthritis -sezernieren u.a. Histamin, TNF⟨, Prostaglandin D2, Leukotriene,IL1,IL6,Chemokinen -wesentlich für Abwehr von parasitären und bakteriellen Infektionen -Rekrutierung von weiteren Effektorzellen (T/B Lymphozyten, Eosinophile) -Wundheilung und Fibrosierung durch die Mediatoren Dendritische Zellen -bedeutsam bei Infektionsabwehr, Tumoren, Trasplantation, Autoimmunität, Allergien, Impfung -Antigenaufnahme und Präsentation -haben drei Mechanismen zur AG Aufnahme: 1.Phagozytose 2. Makropinozytose 3.über spezifische Rezeptoren (CD205,206) -Reifung durch mikrobielle Stimuli oder homöostatisch -Lokalisation an Körperoberflächen und T-Zellarealen in lymphatischen Organen -es gibt Subpopulationen mit unterschiedlichen Rezeptoren und Funktionen -können ihre „Arme“ durch die Zellen stecken und Proben z.B. aus dem Darmlumen nehmen -gelangen über afferente lymphatische Gefäße in die LK -zirkulierende DC kommen auch über den Blutstrom in die LK -unreife DC könne das 100fache ihres Volumens an AG aufnehmen aber nicht gut präsentieren -reife DC könne schlecht aufnehmen, aber sehr gut präsentieren -Reifung ist besonders wichtig, so dass keine körpereigenen Strukturen präsentiert werden -Auslöser der Reifung sind 1.mikrobielle Produkte (TLR,NOD..) 2.Lymphozyten, andere Zellen des angeborenen IS 3.Endogene Liganden (Harnsäure, Defensine) 4.Homöostatisch Pathogenetische Bedeutung -wesentlich bei der Entstehung von Allergien, Asthma, Transplantatabstoßung -manche Pathogen (HIV) blockieren die DC-Reifung -therapeutische Ansätze durch invitro Beladung der DC Zusammenfassung: Dendritische Zellen: Makrophagen: Neutrophile: B-Lymphozyten: -phagozytieren im Gewebe -AG-Präsentation im LK -DIE APZ für naive T Zellen -modulieren die T Zell Differenzierung -Antigenpräsentation -Phagozytose -bakterizide Effektormechanismen -INF -Phagozytose -Keine antigenpräsentation -bakterizide Effektormechanismen -Keine Phagozytose -Antigenaufnahme über Ag Rezeptor(Ig) -antigenpräsentation Vorlesung 4 : Antigenpräsentation und T-Lymphozyten T-Lymphozyten -expremieren auf ihrer Oberfläche einen klonalen T-Zell-Rezeptor und das CD3 Molekül!! -alle TZR´s einer T-Zelle sind gleich. Jede T-Zelle hat ihren eigenen klonalen TZR -CD-Moleküle sind spezifisch für bestimmte Zellpopulationen: -CD3,CD4 Th-Lymphozyten -CD20 B-Lymphozyten -CD11c DC -CD14 Monozyten Manche sind spezifisch für bestimmt Funktionen -CD80/86 Kostimulation -CD95 Apoptose -CD16 Fc-Rezeptoren TZR ist immer mit CD3 assoziiert -CD3 dient der Signaltransduktion, der TZR selbst hat keine eigene intrazelluläre Domäne -95% der T-Zellen exprimieren TZR erkennen grundsätzlich nur Peptid Antigene, die von APC auf MHC Molelülen präsentiert werden, die meisten haben zusätzlich auch entweder CD4 oder CD8 -CD4+ T-Zellen dirigieren das Immunsystem durch; -CD154,ZytokineB-ZellenPlamazellenAntikörperproduktion -IFNγ aktiviert auf Makrophagen -IL2wirkt auf CD8+ T-Zellen und hilft ihnen andere Zellen zu lysieren -5% exprimieren TZR -T-Zellen erkennen Peptid und MHC im Komplex zusammen!! MHC-Moleküle -MHC bzw. HLA sind Glykoproteine, die zur Ig Superfamilie gehören. Sie bestehen auf zwei Ketten und formen Peptid-bidungs-Gruben -MHC I auf allen kernhaltigen Zellen (CAVE: Ery´s habe keine Kerne) -MHC II auf speziellen APC -MHC Komplex ist polygen (viele Gene)und sehr polymorph(viele Gestalten)enorme genetische Vielfalt Struktur: MHC Ieine membranverankerte αKette + freie β Kette MHC IIeine membranverankerte α/β Kette -Größe der Peptidbindungsgrube: MHC I 8-9 Aminosäuren binden also meist Peptide die aus 9 AS bestehen (Nonamere), manchmal wird an einer bestimmten Stelle nur eine einzige bestimmt AS akzeptiert. Beim HLA-B27 ist das Arginin an Position 2 MHC II 12-20 Aminosäuren -hohe Variabilität besonders im Bereich der Bindungsgrube -beide MHC I/II präsentieren auch Selbstantigene Assoziation mit Autoimmunkrankheiten: -manche HLA-Moleküle sind mit erhöhtem Risiko für bestimmte Krankheiten assoziiert Bsp. M.Bechterew B27 Multiple Sklerose DR2 IDDM DR4 -Genetik: HLA Gene werden ko-dominant vererbt -Linkage disequilibrum: manche Kombinationen von HLA Genen werden überzufällig häufig beobachtet (A1 B7,DR2) -Haplotyp:verschiedene Allele unterschiedlicher Loci, die gemeinsam auf einem elterlichen Chromosom vererbt werden -Wahrscheinlichkeit, dass Geschwister gleiche MHC Moleküle haben ist hoher als bei Kind und Eltern Antigenprozessierung: MHC I -endogene Antigene werden von MHC I präsentiert und von CD8 T-Zellen erkannt Bsp. Virusinfektion 1.cytosolische Antigene werden im Proteasom zerlegt 2.die Bruchstücke gelangen über TAP (ATP anhängig) in das ER (HSV bindet und inhibiert TAP) 3.hier entsteht auch der MHC I, der dann gleich mit den Bruchstücken beladen wird 4.Vesikel gelangt an die Oberfläche der Zelle 5.Komplex aus MHC I und Peptid ist frei und kann von CD8 T-Tellen erkannt werden Antigenprozessierung: MHC II -Antigene werden von MHC II Molekülen präsentiert und von CD4 T-Zellen erkannt Bsp. Extrazelluläre Bakterien, Impfstoffe 1. Endozytose extrazellulärer Erreger 2.Proteolyse im Inneren des Endosoms (Endolysosom) 3.MHC II entstehen im ER 4.fertiges MHC II Molekül ist durch eine invariante Kette vor vorzeitiger Beladung geschützt, die MHC II werden in ein spezialisiertes endosomales Kompartiment transportiert 5.hiertreffen die MHC II und das Endosom mit den Peptiden zusammen, Clip auf MHC II wird entfernt und MHC II kann beladen werden 6.beladener Komplex gelangt an die Oberfläche und wird von CD4 T-Zellen erkannt Kreuzpräsentation -geht nur bei CD8 + dendritischen Zellen -hier kann ein exogenes Antigen auch auf einem MHC I präsentiert werden Störungen -TAP-Defizienzendogene Antigene kommen nicht mehr in das ER und MHC I kann nicht beladen werdenkeine Präsentation -CD1 Familie ist strukturell verwandt mit MHC I, hat aber ganz andere Bindungsgrube und deshalb ganz andere Liganden Vorlesung 5-T-Lymphozyten TZR- Struktur -sind heterodimere Moleküle und gehören zur Ig Superfamilie -der intrazytoplasmatische Anteil ist nicht zur Signaltransduktion fähig -ist immer mit CD 3 assoziiert -CD3 übernimmt die Signaltransduktion -ITAM:Immunreceptor Tyrosine-based-Activation Motif (10xITAM für Signaltransduktion nötig) -Lck=Kinase die mit CD3 interagiert (aktivierte Lck phosphoryliert CD3 ITAM´s) Signaltransduktion 1.AG wird erkannt 2.Strukturänderung 3.Lck phosphoryliert ITAM´s 4.ITAM´s aktiviert ZAP-70 5.1 das phosphoryliert wieder LAT über MAP Kinase Weg zur Aktivierung von TranskriptionfaktorenZytokinbildung 5.2 ZAP-70 aktiviert auch PLC, diese spaltet PIP2 in IP3 und DAGPKGNFBAktivierung der TranskriptionsfaktorenZytokinbildung Somatische Rekombination -TZR wird nach dem Baukastenprinzip aus unterschiedlichen Elementen zufällig zusammengesetztzusätzliche Diversität durch zufälliges Hinzufügen von Nukleotiden (ca. 1015 Möglichkeiten) Positive und negative Selektion im Thymus -T-Zellen entwickeln sich im Thymus aus Vorläuferzellen die aus dem Knochenmark stammen -wenn sie den Thymus erreichen haben sie noch keinen TZR, können also keine Ag erkennen -im Thymus wird nun der TZR rekombiniert und exprimiert -es entstehen Milliarden von Thymozyten (unreife T-Zellen) -von denen überleben aber nur 1-2%, die anderen sterben durch Selektion ab Anforderungen an reife T-Zellen: -dürfen keine Komplexe aus körpereigenen MHC Allelen mit körpereigenen Peptiden so stark binden, dass sie aktiviert werden -müssen eine minimale Bindungsstärke zu MHC Molekülen aufweisen, so dass sie ihre Überlebenssignale erhalten können und auch Komplexe mit körperfremden Peptiden mit hoher Affinität binden können -die Bindungsstärke wird bei der Wanderung durch den Thymus getestet Positive Selektion Thymozyten suchen mit ihrem TZR passende Komplexe, bleibt die Bindung aus oder unter einer bestimmten Schwelle, sterben die Thymozyten durch „Vernachlässigung“ -sie brauchen also ein Aktivierungssignal zum überlebenso wird eine minimale Affinität garantiert Negative Selektion -wenn die Affinität jedoch so stark ist, dass die reifen T- Zellen gleich aktiviert werden, sterben sie ebenfalls ab durch aktivierungsinduzierte Apoptose Rezeptor für Todessignal TRAIL nur Thymozyten mit mittlerer Affinität überleben und verlassen den Thymus als native T-Zellen Weg durch den Thymus 1.unreife, doppelt negative Zellen (kein CD4/8) gelangen über das Blut in den Thymus 2.entwickeln sich zu doppelt positiven Zellen (haben CD4 und 8) 3.wenn sie nun auf Zellen mit MHC I treffen, wird Expression von CD4 herunter reguliert, es entsteht eine CD8+ Zelle..usw. Ektope (promiske) Antigenexpression -eigentlich gewebespezifische AG werden in anderen Organen (Thymus) exprimiert -durch den Transkriptionsfaktor AIRE ermöglicht Wie werden T-Zellen aktiviert? Signal1=Peptid + MHC Signal2=Ko-stimulatorischer Rezeptor (CD28 auf T-Lymphozyt) und (CD80, 86 / B7 auf APC) die reine AG Erkennung reicht also nicht zur Aktivierung aus! -es gibt ko-stimulierende Rezeptoren aber auch ko-inhibierende wie z.B. CD 152 , CTLA-4 d.h. Selbst wenn der TZR den MHC/Peptid Komplex erkennt kommt es nicht zu Aktivierung bzw. es kommt zur Anergie/Zelltod T-Lymphozyten/APCAktivierung und Insturktion -Zytokine die von den APC gebildet werden sagen dem T-Lymphozyt auch nach seiner Aktivierung was er machen soll.. Merke: -T-Zellen erkennen MHC/Peptid Komplexe, sie unterscheiden dabei nicht zwischen Selbst und Fremd -AG-Erkennung ist nicht ausreichend für die initiale T-Zellaktivierung -T-Zellaktivierung erfordert Antigenerkennung und Kostimulation -IS unterscheidet zwischen harmlos und gefährlich Vorlesung 6: Effektorfunktionen von T-Lymphozyten T-Zell Effektorfunktionen Übersicht 1-Proliferation 2-Zytokinproduktion 3-B-Zell Aktivierung / Hilfe 4-Zytotoxizität 1.Proliferation -nach Infektion bis zu 15 Teilungen (3x1015Tochterzellen) in 7 Tagen CTL Effektorfunktion: Klonale Expansion -bei der durch das EBV hervorgerufenen Infektiösen Mononukleose können die Zellen eines einzelnen CTL-Klones >50 % der CD3+/CD8+ Zellen im Blut ausmachen Fas/FasL (CD95/CD95L) -aktivierte Lymphozyten exprimieren CD95 (Fas) – Induktion der Apoptose -Viele Gewebe sind immunologisch privilegiert, d.h. sie exprimieren konstitutiv Fas Ligand statt Fas. Da CTL´s wie die meisten anderen Zellen auch, Fas kontinuierlich exprimieren, dreht sich der Spieß um. Die autoreaktiven Klone treffen „noch unbewaffnet“ auf die Zellen mit ihrem Fas Ligand und werden so selbst in die Apoptose getrieben Kaskade 1.Fas Ligand bindet an Fas (beide werden als Homotrimere auf der Zelloberfläche präsentiert) 2.Die Bindung des Fas Ligand führt zur Konformationsänderung des Fas Moleküls, welches dann intrazellulär „death Domains“ von Adapterproteinen bindet 3.Die Adapterproteine rekrutieren und aktivieren die Caspase 8, welche dann Caspase 3 spaltet und damit aktiviert 4.Die aktivierte Caspase 3 spaltet dann I-CAD (=Inhibitor of CAD) von CAD ab 5.Die nun freie CAD (Caspase Aktivierte DNAse) kann in den Zellkern gelangen und hier die DNA spalten Zelle geht unter ..Apoptose Störung: Autoimmnun Lyphoproliferatives Syndrom (ALPS) Apoptosesdefektdadurch Persistenz aktivierter Lymphozyten (aktivierte Lymphozyten werden nicht in die Apoptose getrieben) 2.Zytokinprodultion Funktionelle Differenzierung von T-Helferzellen -je nach dem welche Stimuli (instruierenden Zytokine) die naiven Th – Zellen von den APC bekommen, differenzieren sie sich in die verschiedenen Subgruppen der Th-Zellen Übersicht APC induzierend e Zytokine IL-12 Naive Th Signaltransd uktion STAT 4 Effektor Th Transduktions faktor T-bet Produzierte Zytokine IL-4 STAT 6 GATA-3 IL-3 / IL-4 IL-13 /IL-25 Th2 TGF-β IL-6 IL-23 STAT 3 RORyt IL-17 / TNFα GM-CSF /IL-6 IL-22 TH 17 TGF-β STAT 5 FoxP3 TGF-β / IL35 IL-10 Treg IFN-γ / TNFβ ThSubpopulat ion Th1 Effektorfunktion Makrophagenaktivieru ng Klassenwechsel:igG2a Infammation Humurale Immunität Klassenwechsel:IgE,Ig G1 Allergie, Asthma Abwehr parasitärer Inf. Mobilisierung u. Aktivierung von Neutrophilen Inflammation Klassenwechsel Abwehr von Pilzinfektionen Anti-inflammatorisch CAVE: Die Einteilung in TH1, Th2, Th17 ist eine sinnvolle, aber vereinfachte Schematisierung. Es handelt sich um die Endprodukte einer langen Differenzierung. In vivo gibt es Th-Zellen, die Zytokine der verschiedenen Th-Subpopulationen ko-exprimieren! Zytokinrezeptoren: Jak-STAT Signalweg 1.Ligandenbindung auf einer ruhenden Zelle 2.Bindung führt zur Transphosphorylierung der auf der zytoplasmatischen Seite liegenden rezeptorassoziierten Janus-Kinase 3.diese werden dadurch aktiviert und phosphorylieren TBSM (tyrosin-based signalling motifs) auf dem Rezeptor (dienen als Bindungsstelle für die STAT-Faktoren) 4.STAT Faktoren binden und werden durch Janus-Kinase phosphoryliert 5.die STAT Faktoren bilden Dimere und translozieren in dieser Form in den Zellkern und aktivieren wie ihr Name sagt die Transkription Klinik: Defekt des IFN-γ Rezeptors -die Makrophagenaktivierung ist eine Th1 Effektorfunktion -durch die „Unterstützung“ (IFN-γ) der Th1 können die Makrophagen intravesiculäre Bakterien effektiver töten - bei Störungen des Rezeptors, können die Makrophagen die Hilfe nicht nutzen und die Erreger werden nicht bzw. weniger effizient abgetötet T-Zell Toleranz: Regulation / Treg -wesentlicher Phänotyp CD4, CD25(=α-Kette des IL2 Rezeptors) und vor allem FoxP3 Treg -exprimieren IL-10, TGF-β, IL-35 inhibieren die Effektor T-Zelle (Zellarrest) -IL-2 consumption nehmen den Effektorzellen das IL-2 weg, diesen fehlt dann der Stimulus und sie gehen in die ApoptoseBim.mediated apoptosis -granzyme-mediated-Apoptosis -differenzieren sich schon im Thymus aus CAVE: die anderen differenzieren sich erste durch Zytokinwirkung in der Peripherie Einfluss der dendritischen Zellen -immunogenic DC: CD86, MHCII, CD40, CCR7 werden vermehrt exprimiertNFκB↑ dadurch werden vermehrt proinflammatorische Zytokine(IL-2,TNF-α) produziert -tolerogenic DC: CD86, MHCII, CD40, CCR7 werden vermindert exprimiert NFκB↓ wenn trotzdem Ag präsentiert werden kommt es zur Apoptose, Anergie der Th-Zellen oder sie differenzieren sich zu Treg´s Merke: -CD4+ T-Lymphozyten können anhand ihrer Zytokinproduktion in Subpopulationen (Th1,Th2,Th17,Treg..) eingeteilt werden -Die unterschiedlichen Zytokinmuster dienen unterschiedlichen Effektorfunktionen -eine naive CD4+ Zelle differenziert sich nach Antigenerkennung und Co-Stimulation. Die wesentlichen instruktiven Signale sind dabei Zytokine, die von APC produziert werden -Die Einteilung in die sog. Subpopulationen ist hilfreich aber etwas vereinfachend. Flexibilität derPhänotypen 3. B-Zell Hilfe -Th- Zellen helfen den B-Lymphozyten mit ko-stimulatorischen Signalen und Zytokinen sich zu Plasmazellen zu differenzieren 4.Zytotoxizität -vermittelt durch die CD8+ zytotoxischen T-Zellen (CTL) CTL in Aktion -0 minCTL erkennt Zielzelle -1 min Granula werden intrazellulär Richtung Zielzelle transportiert -4 minGranula erreichen die „immunologische Synapse“ -40minGranula befinden sich im Interzellulärraum zwischen CTL und Zielzelle, ZielzelleApoptose Serial Killers 1-CTL erkennt die Virus-infizierte Zelle 2-CTL leiten die programmierten Zelltod ein 3-CTL löst sich, sucht und bindet die nächste Zielzelle ist ein hochspezifischer und gezielter Prozess Vorlesung 7 – B Lymphozyten und Antikörper Allgemein B-Lymphozyten -aus lymphopoetischer Vorläuferzelle -gehören zum adaptiven Immunsystem Funktion -B-Lymphozyten und Plasmazellen produzieren Antikörper -präsentieren T-Lymphozyten Antigene und geben Ko-stimulatorische Signale -produzieren Zytokine und Chemokine -sind wesentlich für die Architektur sekundär lymphatischer Organe und induzieren Keimzentren Antikörper -kommen vor als B-Zell Rezeptor (membrangebunden) oder werden sezerniert Merke: ANTIKÖRPER = IMMUNGLOBULIN = B ZELL REZEPTOR B-Zell Rezeptor -mit zytoplasmatischen Anteilen -ITAM (Immunreceptor Tyrosine based Activation Motif Antigene -Eine Substanz, die die Produktion von Antikörpern auslöst (generiert), ist ein Antigen -Herkunft: Bakterien, Viren, körpereigene Substanzen, Nahrungsmittel -Chemie: können Proteine, Kohlenhydrate oder Fette sein -Ein Pathogen kann gleichzeitig verschiedene Antigene haben -Antigene haben verschiedene Epitope und jeder AK erkennt nur EIN individuelles Epitop -Jede B-Zelle hat EINEN klonalen Rezeptor und jeder AK erkennt EIN individuelles Epitop -Antikörper erkennen konformationelle Epitope Haptene -sind sehr kleine Moleküle <2500 Da die nur eine Immunantwort auslösen können, wenn sie an größerer Moleküle (Carrier) gebunden sind -die alleinige Bindung der Haptene kann keine Immunantwort auslösen -die Immunisierung erfolgt dann gegen das Hapten Carrier Konjugat Antikörper-Antigenbindung -nicht kovalent! Sondern durch; -elektrostatische Anziehungskräfte -Wasserstoffbrückenbindungen -Van der Wals Kräfte -hydrophobe Wechselwirkungen Avidität -(lat. avidus-begieren)-ImmunologieBindungsstärke, die Kraft mit der polyklonale Antikörper (Antiseren) ein multivalentes Antigen binden können Konsequenzen der Antigenerkennung -Proliferation -Differenzierung -Antikörperproduktion B-Zellen exprimieren B-Zell Rezeptor und PRR´s • -PRR´s erkennen die biologische Herkunft (verschiedene evolutionär konservierte Merkmale ,die für bestimmt Erregerklassen charakteristisch sind -jedoch limitierte Zahl invarianter Rezeptoren • die B-Zell Rezeptoren erkennen Strukturen d.h. definierte kleine Fragmente einzelner Moleküle -anscheinend unbegrenzte Anzahl klonaler Antikörper Antikörperstruktur • Leichte Ketten : κ oder λ -jeder AK hat entweder eine κ oder λ Leichteketten -Verhältnis im Serum κ : λ (65 : 35) • Schwere Ketten: verschiedene Isotypen -Jedes AK Molekül hat einen Isotyp der schweren Kette IgM-µ , IgD-δ , IgG-γ 1-4 , IgA-α 1-2 , IgE-ε IgM -schwere Kette µ -Pentamere / Hexamer verbunden durch J-Kette -ca. 900 kDa -[serum]1,5mg/ml, t1/2 ca. 6 Tage -ist das früheste Immunglobulin -Keine Affinitätsreifung -alle nativen B-Zellen tragen IgM als BZR auf ihrer Oberfläche -lösliches IgM verlässt die Blutbahn kaum -jedes IgM Molekül hat 10-12 identische Bindungsstellen von denen fünf gleichzeitig genutzt werden können -sehr gut Komplementaktivierung (klassischer Aktivierung) IgD -kommt auf der Oberfläche von B-Zellen vor, im Serum fast nicht nachweisbar -naiver Antigenrezeptor -ca. 185 kDa -Seine Funktion ist noch weitgehend unbekannt IgG -4 Subklassen (IgG 1-4) -machen ca 80% der Serum-Immunglobuline aus [13,5 mg/ml] -ist ein Monome und erreicht auch in extrazellulären Flüssigkeiten die Serumkonzentration -Hat mit ca. drei Wochen die längste HWZ aller Ig -eignet sich daher besonders gut zur Substitutionstherapie bei Antikörpermangel -ist als einzigstes Ig plazentagängig (Leihimmunität) CAVE:Rhesusfaktorinkompatibilität -Funktionen: Neutralisation, Makrophagenaktivierung (FcγR), Komplementaktivierung IgA -existiert in drei Formen: Monomer, Dimer mit J-Kette und als sekretorisches IgA (>3g/d) -zwei Subklassen IgA 1-2 -sekretorisches IgA findet sich nicht im Serum -ca. 160 k Da, [Serum] 3,5 mg/ml, HWZ ca 6 Tage -kommen vor allem auf den äußeren Oberflächen des Körpers vor (Schleimhäute..) sowie im/in Speichel, Tränen, Muttermilch -die wichtigsten Funktionen sind die Neutralisation und Makrophagenaktivierung IgE -nur sehr geringe Serumkonzentration [Serum] 0,05mg/ml , HWZ 3 Tag -Mastzellen und eosinophile Granulozyten habe einen IgE Rezeptor (FCεR) auf ihrer Oberfläche und binden IgE mit hoher AffinitätVerleiht diesen Zellen Antigenspezifität -wichtig bei Abwehr von Parasiten -für allergische Reaktionen vom Soforttyp verantwortlich Diversität durch Zusammensetzung nach dem Baukastenprinzip Schwere Kette: Leichte Kette: -variable Region (48) -variable Region (41κ,34λ) -diverse Region (23) -KEINE -joining Region -joining Region -konstante Region -konstante Region Genomische Organisation -λ Leichteketten Lokus auf Chrom 22 -κ Leichteketten Lokus auf Chrom 2 -Schwereketten Lokus auf Chrom 14 Somatische Rekombination der kappa Leichtkette 1.V-J Umlagerung auf der Keimbahn κ-Ketten DANN 2.umgeordnete Kappa Ketten DNA wird abgelesen (Transkription) 3.primäres RNA Transkript wird gespleißt 4mRNA entstehtTranslationVorläuferpeptidModifikationκ Leichte Kette Somatische Rekombination des schweren Kette 1.D-J Umlagerung der Keimbahnformation der schweren Ketten DNA 2.V-DJ Umlagerung 3.umgeordnete Schwereketten DNA wird transkripiert 4.primäres Transkript wird gespleißtTranslationVorläuferpeptidschwere Kette Rekombinations Signal Sequenzen (RSS) -die Keimbahensequenzen für leichte und schwere Ketten enthalten sog. RSS, die von den VDJ Rekombinasen (RAG 1und 2) erkannt werden -ohne die Rekombinasen (RAG) keine T-/B-Zellen VDJ Rekombination 1.RAG bindete die RSS auf der DNA (jeweil vor bzw.nach der V/J Sequenz) 2.Komplex aus RAG /RSS und V/J Sequenz entsteht 3.RAG spaltet die RSS´s zusammen mit der DNA Schleife zwischen der J/V Sequenz heraus 4.die nun „offenen“ Enden der V/J Sequenzen werden von Ku 70/80 gebunden 5.DNA PK bindet an die Enden und Artemis öffnet die DNA Enden (Haarnadeln) 6.Die TdT (Terminale desoxyribonucleotidly transferase) prozessiert die Enden 7.DNA Ligase IV verbindet / schließt die Enden 2.48x106 Möglichkeiten der Kombination + zusätzliche Diversität durch ungenaue Rekombination