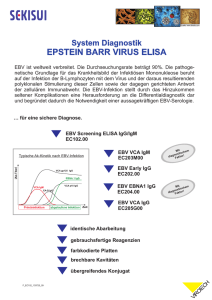
recomBlot CMV IgG [Avidität] recomBlot CMV IgM
Werbung
![recomBlot CMV IgG [Avidität] recomBlot CMV IgM](http://s1.studylibde.com/store/data/001466067_1-19b9c0d0e783903b60fdf05609a5f5d9-768x994.png)
0,.52*(1 *HEUDXFKVLQIRUPDWLRQ UHFRPBlot CMV IgG [Avidität] / IgM UHFRP%ORW&09,J*>$YLGLWlW@ UHFRP%ORW&09,J0 Immunoblot-Test mit rekombinant produzierten und gelelektrophoretisch aufgetrennten Antigenen zur Bestimmung von IgG- und IgM-Antikörpern, sowie Aviditätsbestimmung von IgG-Antikörpern gegen &09 in humanem Serum oder Plasma. $OOJHPHLQHV9HUZHQGXQJV]ZHFN Der UHFRP%ORW &09ist ein qualitativer in vitro-Test zum Nachweis und zur sicheren Identifizierung von IgG- bzw. IgM-Antikörpern gegen das Cytomegalie-Virus in humanem Serum oder Plasma. Der UHFRP%ORW &09 wird zur Bestätigung von im Screening-Test positiven Proben verwendet. Der Test erlaubt durch die elektrophoretische Auftrennung der Antigene, im Unterschied zu Enzymimmunoassays oder Spottests, eine sichere Identifizierung und Lokalisation von spezifischen Antikörpern. 'DV&\WRPHJDOLH9LUXV Das humane Cytomegalie-Virus (CMV) gehört zu der Familie der Herpesviridae. Infektionen mit CMV sind weltweit verbreitet. Das lebenslang persistierende Virus wird durch Schmierinfektionen bzw. direkten Schleimhautkontakt, sexuell, pränatal oder iatrogen (Bluttransfusion, Transplantation) übertragen. Die meisten erworbenen CMV-Infektionen verlaufen nach einer Inkubationszeit von vier bis acht Wochen inapparent. Klinische Manifestationen variieren stark in Abhängigkeit von Lebensalter bzw. Abwehrlage. Bei immunkompetenten Menschen verlaufen CMV-Infektionen meist asymptomatisch bzw. mit geringen Symptomen. Bei immunsupprimierten Personen (Transplantatempfänger, Tumor- und AIDS-Patienten) ist CMV eine häufige Erkrankungs- und Todesursache. Primärinfektionen während der Schwangerschaft führen in ca. 40 % der Fälle zu pränatalen Infektionen und perinatal infizierten Frühgeborenen mit bis zu 10 % schweren Schädigungen und Erkrankungen. Ein in der Schwangerschaft reaktiviertes Virus kann ebenfalls vertikal übertragen werden; allerdings sind die klinischen Folgen geringer und die Selbstheilungstendenz gut. CMV-verursachte Organschädigungen treten in unterschiedlicher Häufigkeit bei Patientengruppen auf. Die Folgen sind entweder direkt auf die Virusvermehrung oder auf, durch das Immunsystem vermittelte, indirekte CMV-Einflüsse zurückzuführen. Direkte Schädigungen sind z.B. bei AIDS-Patienten Retinitis und gastrointestinale Ulzera und bei Transplantatempfängern v.a. Pneumonie. Besonders gefürchtet werden die atypische Pneumonie (mit relativ hoher Letalität) und die seltener auftretende Enzephalitis. Durch die immunmodulierende Wirkung wird die Vermehrung und Pathogenese bestimmter fakultativ pathogener Erreger (z.B. Pilze, Pneumocystis) begünstigt. Bei Transplantatempfängern kann CMV eine Transplantatabstoßung bewirken. 'LDJQRVWLN Die momentan angewandten Methoden zur CMV-Diagnostik basieren entweder auf dem Nachweis CMV-spezifischer Antikörper oder auf dem Nachweis des Virus oder von Virusbestandteilen (z.B. Virusisolierung, pp65-Antigen, PCR). Die zum Einsatz kommende Methode ist abhängig von der jeweiligen Vorbefundung und der zu klärenden Fragestellung. Die serologische Diagnostik einer CMV-Infektion hat einen wichtigen Stellenwert und findet besonders in folgenden Fällen Anwendung: • Nachweis einer Primärinfektion bei immunkompetenten Patienten • Bestimmung des Infektionsstatus von Spendern und Empfängern in der Transplantationsmedizin • Feststellung des Infektionsstatus bei Blutspendern • Schwangerendiagnostik Das Screening auf CMV-spezifische Antikörper erfolgt in der Regel mit Hilfe eines ELISAs. Er liefert neben einer qualitativen Aussage auch eine quantitative Bestimmung der humoralen Immunantwort. Allerdings ist nicht immer eine eindeutige, differenzierte Aussage über den Infektionsstatus einer Primärinfektion einerseits und einer zurückliegenden Infektion bzw. Reaktivierung andererseits möglich. -1- UHFRPBlot UHFRPBlot CMV IgG [Avidität] / IgM *HEUDXFKVLQIRUPDWLRQ 0,.52*(1 Der UHFRPBlot CMV bietet hier den Vorteil, dass Reaktivitäten gegen Einzelantigene nachgewiesen werden können. In der frühen Phase einer Infektion findet man in der Regel Antikörper, die hauptsächlich gegen die Tegumentproteine p150 und p65 sowie die Nicht-Struktur-Proteine IE1 und CM2 gerichtet sind. Gemeinsame Antikörper gegen die Glykoproteine gB1 und gB2 tauchen typischerweise erst 6-8 Wochen nach der Erstinfektion auf. Reaktivierte CMV-Infektionen können generell serologisch nur bedingt diagnostiziert werden. Eine lang anhaltende hohe IgG-Reaktivität gegen p150, das Membran-Glykoprotein (gB1, gB2) sowie auch gegen CM2, p65 und IE1, bei positivem IgM-Ergebnis, kann jedoch als ein Hinweis auf eine Reaktivierung gewertet werden. Dies muss jedoch in jedem Fall durch den Nachweis von pp65 oder durch eine positive PCR (Nachweis einer akuten Virämie) bestätigt werden. Unter einer CMV-Reaktivierung ist die Wiederaufnahme einer lytischen Vermehrung in einer latent infizierten Person zu verstehen. Das Ausmaß dieser Vermehrung kann sehr gering und von kurzer Dauer sein, z.B. bei kurzzeitiger Störung des Immunsystems durch andere Infektionen oder sonstige Ursachen. Die Störung der Immunantwort kann aber auch lang andauernd und massiv sein z.B. bei Patienten mit Immundefizienz oder unter Immunsuppressiva. Alle Zwischenstadien sind möglich. Die klassische Infektionsserologie beruht auf der Beobachtung, dass erregerspezifische IgM-Antikörper nur vorübergehend gebildet werden, die entsprechende IgG-Antwort aber lange andauert. So ergibt sich aufgrund eines IgM-Befundes ein Hinweis auf eine akute Infektion, während ein IgG-Befund ohne paralleles IgM auf eine länger zurückliegende Infektion hindeutet. Aufgrund der Variabilität der Immunantwort und durch das Auftreten aberranter serologischer Verläufe (z.B. persistierende, reaktivierte oder fehlende IgM-Antwort) kann jedoch diese klassische Vorgehensweise in nicht wenigen Fällen zu Fehlschlüssen führen. Diese diagnostische Lücke kann durch die Bestimmung der Avidität (Gesamt-Bindungskraft zwischen einer Population von Antikörpern zu einem Antigen) der IgG-Antikörper weitgehend geschlossen werden. Der diagnostische Nutzen der Aviditätsbestimmung basiert auf der Aviditätsreifung der IgGAntikörper im Verlauf der humoralen Immunantwort auf CMV. Mit fortschreitender Infektionsdauer nimmt die Reifung der Immunantwort, d.h. die Erhöhung der Avidität der IgG-Antikörper durch Vermehrung des Anteils an hoch avidem IgG zu. Niedrig avides IgG zeigt daher meist eine primäre Infektion an, während hoch avides IgG typisch für eine zurückliegende oder reaktivierte Infektion ist. Durch die Bestimmung der Avidität einzelner IgG-Antikörper können somit frische von zurückliegenden Infektionen unterschieden werden (siehe 11.5) . Für die Durchführung der Aviditätsbestimmung kann das Aviditätsreagenz von MIKROGEN bezogen werden. 7HVWSULQ]LS Für den UHFRPBlot CMV IgG bzw. IgM werden die spezifischen Cytomegalie-Virus- Antigene IE1, p150, CM2, p65, gB1 und gB2 mit Hilfe rekombinanter (FROL Zellen hergestellt. Die verwendeten gereinigten, rekombinanten Antigene werden mittels SDS-Polyacrylamid-Gelelektrophorese nach ihrem Molekulargewicht aufgetrennt. Die CMV-Proteine werden dann elektrophoretisch auf eine NitrozelluloseMembran übertragen (Western-Blotting). Die Membran wird anschließend zur Blockierung freier Bindungsstellen mit einer Proteinlösung inkubiert, gewaschen und nach Zerschneiden in Streifen in Röhrchen verpackt. Zum Nachweis von CMV spezifischen Antikörpern werden die Streifen mit der verdünnten Serum- oder Plasmaprobe inkubiert, wobei die Antikörper sich an die Antigene auf den Streifen anlagern. Nicht gebundene Antikörper werden anschließend abgewaschen und die Streifen in einer zweiten Inkubation mit anti-human-IgG bzw. anti-human-IgM inkubiert, das mit Meerrettich-Peroxidase gekoppelt ist. Mit einer durch die Peroxidase katalysierten Färbereaktion werden spezifisch gebundene Antikörper nachgewiesen. Falls eine Reaktivität gegen eines der CMV-Proteine gefunden wird, erscheint diese als dunkle Bande auf dem Streifen. Als Reaktionskontrolle ist am oberen Ende der Streifen (unter der Nummer) eine Bande mit anti-humanImmunglobulin aufgetragen, die bei jedem Serum eine Reaktion zeigen muss. -2- 0,.52*(1 *HEUDXFKVLQIRUPDWLRQ UHFRPBlot CMV IgG [Avidität] / IgM 9HUZHQGHWHUHNRPELQDQWH$QWLJHQH 7DEHOOHRekombinante CMV-Antigene 5HNRPELQDQWHV $QWLJHQ /HVHUDKPHQ3URWHLQ *U|HGHVUHNRPELQDQWHQ $QWLJHQV>N'D@ 3URWHLQHLQRUGQXQJ ,( UL123/IE1/1 53 Nichtstruktur-Protein, „immediate early“-Protein S UL32/pp150 50 Tegument-Protein &0 UL44, UL57/p52 (DBP) 45 Nichtstruktur-Protein S UL83/pp65 31 Tegument-Protein J% UL55/gB 25 Membran-Glykoprotein gB J% UL55/gB 18 Membran-Glykoprotein gB 3DFNXQJVLQKDOW Die Reagenzien einer Packung reichen für 20 Bestimmungen. Jeder Reagenziensatz enthält: 100 ml Waschpuffer (]HKQIDFKNRQ]HQWULHUW) Enthält Phosphat-Puffer, NaCl, KCl, Detergenz, Konservierungsmittel: Methylisothiazolon und Oxypyrion 45 ml Chromogenes Substrat Tetramethylbenzidin (TMB, JHEUDXFKVIHUWLJ) 5g Magermilchpulver 2 Stück Inkubationsschalen mit je 10 Vertiefungen 1 Vorentwickelter Kontrollstreifen (kitspezifisch) 1 Gebrauchsinformation 1 Auswertebogen UHFRP%ORW&09,J*>$YLGLWlW@ Jeder Reagenziensatz enthält zusätzlich zu den unter Punkt 5 aufgeführten Komponenten: 2 Stück 70 µl Röhrchen mit 10 fortlaufend nummerierten Western-Blot-Teststreifen beschichtet mit CMV-Antigenen. Schwachpositiv Serumkontrolle IgG (5RWH Verschlusskappe) Humaner Ursprung, anti-HIV-1/2, anti-HCV und HBs-Ag negativ 60 µl Anti-human IgG Konjugat(WDXVHQGIDFKNRQ]HQWULHUW, *UQH Verschlusskappe) Aus Kaninchen, enthält NaN3 $YLGLWlWVEHVWLPPXQJ Für die Bestimmung der Avidität von CMV IgG-Antikörpern ist als Zusatz auf Wunsch das Aviditätsreagenz mit entsprechender Gebrauchsinformation lieferbar. 1 Aviditätsreagenz (Feststoff) für 60 ml gebrauchsfertige Lösung Art. Nr. 11010 -3- UHFRPBlot UHFRPBlot CMV IgG [Avidität] / IgM *HEUDXFKVLQIRUPDWLRQ 0,.52*(1 UHFRP%ORW&09,J0 Jeder Reagenziensatz enthält zusätzlich zu den unter Punkt 5 aufgeführten Komponenten: 2 Stück 70 µl Röhrchen mit 10 fortlaufend nummerierten Western-Blot-Teststreifen beschichtet mit CMV-Antigenen. Schwachpositiv Serumkontrolle IgM (:HLVVHVerschlusskappe) Humaner Ursprung, anti-HIV-1/2, anti-HCV und HBs-Ag negativ 100 µl Anti-human IgM Konjugat (IQIKXQGHUWIDFKNRQ]HQWULHUW, /LOD Verschlusskappe) Aus Kaninchen, enthält NaN3 =XVlW]OLFKEHQ|WLJWH5HDJHQ]LHQHUIRUGHUOLFKHV=XEHK|U Deionisiertes Wasser, Absaugsystem mit Desinfektionsfalle, Mikropipetten, Plastikpinzette, Schüttler, Messzylinder, Laborwaage. +LQZHLVH]XP7HVWXQGGHQ5HDJHQ]LHQ 9RUVLFKWVPDUHJHOQ * Für die Herstellung der Kontrollseren wird Blut von Spendern verwendet, bei denen keine Antikörper gegen HIV 1/2, HCV und kein Hepatitis Bs-Antigen nachgewiesen wurden. Da trotzdem eine Infektion nicht mit Sicherheit ausgeschlossen werden kann, muss das Produkt mit der gleichen Sorgfalt behandelt werden wie die Patientenproben. * Während des gesamten Testablaufs müssen geeignete Einmalhandschuhe getragen werden. * Die Konjugate enthalten Natriumazid. Eine Berührung mit der Haut oder Schleimhaut ist zu vermeiden. * Sämtliche Reagenzien und Materialien, die mit potentiell infektiösen Proben in Berührung kommen, müssen mit geeigneten Desinfektionsmitteln behandelt oder mindestens 1 Stunde bei 121°C autoklaviert werden. * Inkubationsschalen nur einmal verwenden. * Streifen vorsichtig mit einer Plastikpinzette handhaben. +LQZHLVH]XU+DQGKDEXQJ Die Reagenzien vor und nach Gebrauch bei 2°C - 8°C lagern, QLFKWHLQIULHUHQ. Vor Testbeginn sind alle Bestandteile für mindestens 30 Minuten auf 18°C - 25°C (Raumtemperatur) zu temperieren. Die Testdurchführung erfolgt ebenfalls bei Raumtemperatur. Vor Gebrauch die Kontrollseren sowie die konzentrierten Konjugate gut durchmischen. Die Patientenseren ebenfalls gut mischen. Das Röhrchen mit den Teststreifen ist erst unmittelbar vor Gebrauch zu öffnen, um eine Kondenswasserbildung zu vermeiden. Die nicht benötigten Streifen verbleiben im Röhrchen und werden weiterhin bei 2°C - 8°C gelagert (Röhrchen wieder gut verschließen, Teststreifen dürfen vor Versuchsbeginn nicht feucht werden!). Die Schwachpositiv Kontrolle muss bei jedem Versuchsdurchgang unabhängig von der Anzahl der zu testenden Seren mitgeführt werden. Nur so ist die korrekte Testinterpretation möglich. Die Packungen tragen ein Verfallsdatum, nach dessen Erreichen keine Qualitätsgarantie mehr übernommen werden kann. Es dürfen nur Einzelreagenzien verwendet werden, deren Chargennummer mit der entsprechenden Chargennummer auf dem Etikett der Kitverpackung übereinstimmt. Der Test ist nur von geschultem und autorisiertem Fachpersonal durchzuführen. Bei substantiellen Änderungen am Produkt, bzw. der Anwendungsvorschrift kann die Anwendung außerhalb der von MIKROGEN vorgegebenen Zweckbestimmung liegen. Automatisierung ist möglich, nähere Informationen erhalten Sie von MIKROGEN. -4- 0,.52*(1 *HEUDXFKVLQIRUPDWLRQ UHFRPBlot CMV IgG [Avidität] / IgM +HUVWHOOXQJGHU/|VXQJHQ +HUVWHOOXQJGHVJHEUDXFKVIHUWLJHQ:DVFKSXIIHUV Dieser Puffer wird für die Serum- und Konjugatverdünnung sowie die Waschschritte benötigt. Vor dem Verdünnen ist das Volumen des Waschpuffers für die entsprechende Anzahl der durchzuführenden Tests zu bestimmen. Das Magermilchpulver wird zuerst in Waschpuffer-Konzentrat vorgelöst und diese Mischung dann mit deionisiertem Wasser auf das Endvolumen aufgefüllt (Verdünnung: 1 + 9). Die benötigten Mengen sind der Tabelle 2 zu entnehmen. Volumina für in der Tabelle nicht aufgeführte Streifen-Anzahlen sind rechnerisch zu ermitteln. Gebrauchsfertiger Waschpuffer kann bei 2°C - 8°C vier Wochen gelagert werden. 7DEHOOH Waschpuffer pro eingesetzte Teststreifen HLQJHVHW]WH 7HVWVWUHLIHQ 0DJHUPLOFK 3XOYHU :DVFKSXIIHU .RQ]HQWUDW 'HLRQLVLHUWHV :DVVHU JHEUDXFKVIHUWLJHU :DVFKSXIIHU 1 0,1 g 2 ml 18 ml 20 ml 2 0,2 g 4 ml 36 ml 40 ml 3 0,3 g 6 ml 54 ml 60 ml 5 0,5 g 10 ml 90 ml 100 ml 10 1g 20 ml 180 ml 200 ml 15 1,5 g 30 ml 270 ml 300 ml 20 2g 40 ml 360 ml 400 ml +HUVWHOOXQJGHU.RQMXJDWO|VXQJHQ Die Konjugatlösung für die IgG- bzw. IgM-Bestimmung ist unmittelbar vor Gebrauch herzustellen, eine Lagerung der gebrauchsfertigen Konjugatlösung ist nicht möglich. Ein Teil des IgG-Konjugat-Konzentrats wird mit 1000 Teilen gebrauchsfertigem Waschpuffer verdünnt (1 + 1000). Ein Teil des IgM-Konjugat-Konzentrats wird mit 500 Teilen gebrauchsfertigem Waschpuffer verdünnt (1 + 500). Die benötigten Mengen sind der Tabelle 3 zu entnehmen. Volumina für in der Tabelle nicht aufgeführte Streifen-Anzahlen sind rechnerisch zu ermitteln. 7DEHOOH Volumina der Anti-human-IgG- bzw. IgM-Konjugat-Verdünnung HLQJHVHW]WH 7HVWVWUHLIHQ ,J*.RQMXJDW .RQ]HQWUDW ,J0.RQMXJDW .RQ]HQWUDW JHEUDXFKVIHUWLJHU :DVFKSXIIHU 1 2 µl 4 µl 2 ml 2 4 µl 8 µl 4 ml 3 6 µl 12 µl 6 ml 5 10 µl 20 µl 10 ml 10 20 µl 40 µl 20 ml 15 30 µl 60 µl 30 ml 20 40 µl 80 µl 40 ml Die Mengen sind ohne Totvolumen berechnet. Je nach Abarbeitung (manuell bzw. an einem Gerät) bitte zusätzliche Konjugatlösung für 1 bis 3 Streifen ansetzen. 6XEVWUDWO|VXQJ Das Substrat ist gebrauchsfertig. Vor Beginn der Färbung auf Raumtemperatur (18°C - 25°C) bringen. Eine Kontamination der nicht verwendeten Substratlösung durch unsterile Pipettenspitzen etc. muss unbedingt vermieden werden, da dadurch die Sensitivität des Testes beeinträchtigt werden kann. -5- UHFRPBlot UHFRPBlot CMV IgG [Avidität] / IgM *HEUDXFKVLQIRUPDWLRQ 0,.52*(1 /DJHUXQJXQG+DOWEDUNHLW Die Reagenzien vor und nach Gebrauch bei 2°C - 8°C lagern. Gebrauchsfertiger Waschpuffer kann bei 2°C - 8°C vier Wochen gelagert werden. Die Konjugatlösung muss immer frisch zubereitet werden. 3UREHQPDWHULDO Das Probenmaterial kann Serum oder Plasma sein, das nach Entnahme möglichst rasch vom Blutkuchen getrennt wurde, um eine Hämolyse zu vermeiden. Hitzeinaktivierte Proben können zu erhöhten Hintergrundreaktionen führen. Eine mikrobielle Kontamination der Probe ist unbedingt zu vermeiden. Unlösliche Stoffe sind vor der Inkubation aus der Probe zu entfernen. Die Verwendung von lipämischen, hämolysierten oder trüben Proben kann einen dunklen Hintergrund auf den Streifen UHFRPBlot CMV IgG/IgM ergeben. Diese Proben können darüber hinaus zu verfälschten Ergebnissen führen und sollten daher nicht verwendet werden. $FKWXQJ 6ROOHQ GLH %HVWLPPXQJHQ QLFKW VRIRUW HUIROJHQ NDQQ GDV 3UREHQPDWHULDO ELV ]X :RFKHQ EHL && DXIEHZDKUW ZHUGHQ (LQH OlQJHUH /DJHUXQJ GHU 3UREHQ LVW GXUFK $XIEHZDKUXQJ EHL &RGHUWLHIHUP|JOLFK(LQZLHGHUKROWHV(LQIULHUHQXQG$XIWDXHQGHU3UREHQZLUGZHJHQGHU *HIDKUIHKOHUKDIWHU5HVXOWDWHQLFKWHPSIRKOHQ 7HVWGXUFKIKUXQJ $OOJHPHLQHV Die Reproduzierbarkeit der Ergebnisse hängt in starkem Maße vom gleichmäßigen Waschen der Streifen ab. Die unter 9.3 und 9.5 beschriebenen Waschfrequenzen sollten deshalb immer eingehalten werden. 1. ,QNXEDWLRQGHU3UREHQ Für jeden Testansatz wird eine Vertiefung einer Inkubationsschale benötigt. In die Vertiefungen werden je PO des gebrauchsfertigen Waschpuffers pipettiert. In die mit gebrauchsfertigem Waschpuffer gefüllten Vertiefungen wird anschließend je ein Teststreifen vorsichtig mit Hilfe einer Pinzette eingetaucht. Die Streifennummerierung zeigt nach oben. $FKWXQJ 'LH 6WUHLIHQ PVVHQ YROOVWlQGLJ PLW JHEUDXFKVIHUWLJHP :DVFKSXIIHU EHQHW]W XQG XQWHUJHWDXFKWVHLQ Verwendete Röhrchennummer und Streifennummer im Auswertebogen notieren. 2. 3UREHQ]XJDEH ,J*,J07HVWGXUFKIKUXQJO einer unverdünnten Probe (Humanserum oder Plasma) oder der entsprechenden Schwachpositiv Kontrolle werden je Inkubationsansatz zum Teststreifen pipettiert (Verdünnung 1 + 100). Bitte achten Sie darauf, die Probe an einem Ende des untergetauchten Streifens in den Waschpuffer einzupipettieren und schnellstmöglich durch vorsichtiges Schütteln der Inkubationswanne einzumischen. Probennummern und zu detektierende Immunglobulinklasse (IgG, IgM) im Auswertebogen notieren. Die Inkubationsschale wird mit dem Kunststoffdeckel abgedeckt und unter leichtem Schütteln 6WXQGH bei Raumtemperatur inkubiert. $FKWXQJ (V LVW GDUDXI ]X DFKWHQ GDVV GLH ,QNXEDWLRQVO|VXQJHQ QLFKW LQ DQGHUH 9HUWLHIXQJHQ YHUVFKOHSSWZHUGHQLQVEHVRQGHUHEHLPgIIQHQXQG6FKOLHHQGHV'HFNHOVVLQG6SULW]HU]X YHUPHLGHQ -6- 0,.52*(1 *HEUDXFKVLQIRUPDWLRQ UHFRPBlot CMV IgG [Avidität] / IgM :DVFKHQ 1. Nach der Inkubation werden die Kunststoffdeckel vorsichtig von den Inkubationsschalen abgenommen. 2. Die Serumverdünnung wird vorsichtig aus den einzelnen Vertiefungen abgesaugt. $FKWXQJ 1DFK GHP $EVDXJHQ GHU /|VXQJHQ DXV HLQHU 9HUWLHIXQJ VLQG GLH 3LSHWWHQVSLW]HQ ]X ZHFKVHOQRGHUQDFKMHGHP$EVDXJYRUJDQJJXW PLW GHLRQLVLHUWHP :DVVHU ]X VSOHQ GD GLH *HIDKUHLQHU9HUVFKOHSSXQJEHVWHKW %HL PDVFKLQHOOHU $EDUEHLWXQJ VLQG GLHVEH]JOLFK GLH +LQZHLVH GHV *HUlWHKHUVWHOOHUV ]X EHDFKWHQ 3. In jede Vertiefung werden anschließend PO des gebrauchsfertigen Waschpuffers gegeben und für 0LQXWHQ unter leichtem Schütteln auf dem Schüttler gewaschen. Nach dem Waschvorgang wird der Waschpuffer abgesaugt. 4. Der Waschschritt unter Punkt 3 wird insgesamt GUHLPDO durchgeführt. ,QNXEDWLRQPLW3HUR[LGDVH.RQMXJDW Nach dem Waschen der Streifen werden in jede Vertiefung PO der entsprechend vorbereiteten Konjugatlösung (siehe Tabelle 3) gegeben und 0LQXWHQ unter leichtem Schütteln bei Raumtemperatur inkubiert. Dabei wird die Inkubationsschale mit dem Kunststoffdeckel abgedeckt. :DVFKHQ Die Konjugatlösungen werden aus den Inkubationswannen abgesaugt und die Streifen erneut gewaschen (vergleiche 9.3). 6XEVWUDWUHDNWLRQ In jede Vertiefung werden PO 6XEVWUDWO|VXQJ gegeben und ±0LQXWHQ unter leichtem Schütteln und unter Beobachtung bei Raumtemperatur inkubiert. $FKWXQJ 'HQ)lUEHSUR]HVVEHREDFKWHQXQGDOOH6WUHLIHQVRODQJHLQGHU6XEVWUDWO|VXQJEHODVVHQELVEHL GHQ PLW GHU 6FKZDFKSRVLWLY 6HUXPNRQWUROOH LQNXELHUWHQ 6WUHLIHQ GLH S%DQGH VFKZDFK ]X VHKHQLVW %HL KRFKSRVLWLYHQ 6HUHQ NDQQ HV ]X HLQHU hEHUUHDNWLRQ GHU )lUEXQJ NRPPHQ (V ZLUG HPSIRKOHQEHLVROFKHQ6WUHLIHQGLH)lUEXQJYRU]HLWLJ]XEHHQGHQ $EVWRSSHQGHU5HDNWLRQ 1. Nach Absaugen der Substratlösung werden die Streifen dreimal kurz mit deionisiertem Wasser gewaschen. 2. Die Streifen werden vorsichtig mit einer Plastikpinzette aus dem Wasser entnommen und zum Trocknen für ca. 2 Stunden zwischen 2 Lagen saugfähigen Papiers gelegt. Anschließend können die Streifen auf dem beigelegten Auswertebogen aufgeklebt und die Ergebnisse protokolliert werden. 3. Die Streifen sollten vor Licht geschützt aufbewahrt werden. 'XUFKIKUXQJGHU$YLGLWlWVEHVWLPPXQJ Die Durchführung der Aviditätsbestimmung mit dem UHFRPBlot CMV Gebrauchsinformation zu dem Aviditätsreagenz (Artikel-Nr. 11010) beschrieben. -7- IgG wird in der UHFRPBlot UHFRPBlot CMV IgG [Avidität] / IgM *HEUDXFKVLQIRUPDWLRQ 0,.52*(1 =XVDPPHQIDVVXQJGHU7HVWGXUFKIKUXQJ 1. alle Reagenzien auf Raumtemperatur bringen 2. in 2 ml gebrauchsfertigem Waschpuffer die Streifen einlegen, die Streifen müssen komplett untergetaucht sein 3. jeweils 20 µl von der Probe bzw. Kontrolle einpipettieren 4. 1 Stunde bei Raumtemperatur unter leichtem Schütteln inkubieren 5. dreimal je 5 Minuten, mit je 2 ml gebrauchsfertigem Waschpuffer, auf dem Schüttler waschen 6. 2 ml gebrauchsfertige Konjugatlösung zugeben 7. 45 Minuten bei Raumtemperatur unter leichtem Schütteln inkubieren 8. dreimal je 5 Minuten, mit je 2 ml gebrauchsfertigem Waschpuffer, auf dem Schüttler waschen 9. 1,5 ml der Substratlösung zugeben; 5 - 10 Minuten bei Raumtemperatur unter leichtem Schütteln inkubieren. Sollbanden siehe 9.6 10. mindestens dreimal mit deionisiertem Wasser waschen 11. 2 Stunden zwischen 2 Lagen saugfähigen Papiers trocknen und das Ergebnis ablesen $XVZHUWXQJ %HZHUWXQJGHU%DQGHQLQWHQVLWlW 1. Bei jeder Testdurchführung muss unabhängig von der Anzahl der Proben die Schwachpositiv Serumkontrolle mitgeführt werden. Die Schwachpositiv Serumkontrolle dient zur Abgrenzung der Reaktivität von der Hintergrund-Reaktivität (Cutoff). 2. Notieren Sie im beigefügten Auswertebogen Datum, Chargen- und Röhrchen-Nummer, sowie die detektierte Antikörperklasse. 3. Tragen Sie die Proben-Identifizierungs-Nummern in das Protokollblatt ein. 4. Kleben Sie nun mit einem Klebestift die dazugehörigen Teststreifen in die entsprechenden Felder des Auswertebogens. Richten Sie dazu die Teststreifen mit der Reaktions-Kontrollbande an der eingezeichneten Markierungslinie aus. Kleben Sie dann mit einem durchsichtigen Klebeband die Teststreifen links von der Markierungslinie an. Flächiges Ankleben der ganzen Teststreifen mit Klebestift oder Klebeband kann zu Veränderungen der Färbung führen. 5. Den vorentwickelten Kontrollstreifen mit den markierten Antigenbanden zur Orientierung an die aufgeklebten Teststreifen legen, und die reagierenden Banden identifizieren. Der vorentwickelte Kontrollstreifen ist kitspezifisch und stammt aus demselben Nitrozellulose-Block wie die Teststreifen im Testkit. Die Molekulargewichte bzw. die Bezeichnungen der Antigenbanden sind markiert. 6. Die Bandenintensitäten auf dem Probenstreifen werden im Vergleich zur Schwachpositiv Kontrolle gesondert für jede Immunglobulinklasse bewertet (s. 11.2 bzw. Tabelle 4) und in den Auswertebogen eingetragen. .RQWUROOHUJHEQLVVH Das Mitführen der Schwachpositiv Kontrolle ist unerlässlich. Dabei sollen die Testbedingungen (Sensitivität) geprüft und die Reaktivität mit den einzelnen Antigenbanden bestätigt werden. Die Lokalisation der Banden muss mit dem beigefügten Kontrollstreifen übereinstimmen. Die Kontrollbande (Reaktions-Kontrolle) unterhalb der Streifennummer dient zur Überprüfung der Testdurchführung, und muss in jedem Fall eine deutliche Färbung zeigen. Die mit der Schwachpositiv-Serumkontrolle inkubierten Teststreifen dienen als Cutoff und sollten nachfolgende Bandenmuster aufzeigen: -8- 0,.52*(1 • *HEUDXFKVLQIRUPDWLRQ UHFRPBlot CMV IgG [Avidität] / IgM ,J*6FKZDFKSRVLWLY6HUXPNRQWUROOH&XWRII Es sollten folgende Banden zu sehen sein: Reaktions-Kontrollbande, p150, weitere Banden können zusätzlich erscheinen. Reaktions-Ktr. • IE1 p150 CM2 p65 gB1 gB2 ,J06FKZDFKSRVLWLY6HUXPNRQWUROOH&XWRII Es sollten folgende Banden zu sehen sein: Reaktions-Kontrollbande, p150, weitere Banden können zusätzlich erscheinen. Reaktions-Ktr. IE1 p150 CM2 p65 gB1 gB2 Die Bewertung der Intensität aller Banden, sowohl im IgG als auch im IgM, orientiert sich an der p150Bande der Schwachpositiv-Kontrolle. 7DEHOOHBandenintensität Intensität Banden - keine Reaktion sehr schwache Intensität (geringer als die p150-Bande der Schwachpositiv-Kontrolle) +/- schwache Intensität (entsprechend der p150-Bande der Schwachpositiv-Kontrolle) + gut sichtbare Intensität (stärker als die p150-Bande der Schwachpositiv-Kontrolle) 2+ sehr starke Intensität 3+ 7HVWHUJHEQLVVHXQG7HVWLQWHUSUHWDWLRQ Die serologische Immunantwort des Menschen auf eine CMV-Infektion zeichnet sich durch eine hohe Variabilität aus. Vor allem die Tatsache, dass IgM-Antikörper in einigen Fällen noch über Jahre nach der Infektion nachweisbar bleiben bzw. frische Infektionen in seltenen Fällen sehr geringe oder gar nicht nachweisbare IgM-Titer aufweisen können, erschwert die Interpretation serologischer Befunde. Für die Beurteilung des CMV-Immunstatus sollten immer die Ergebnisse des IgG- und IgM-Nachweises zusammen betrachtet werden. ,QWHUSUHWDWLRQGHV,J*1DFKZHLVHV 7DEHOOH Auswertung der Banden beim IgG-Nachweis ,J*QHJDWLY • keine CMV-spezifischen Banden • Banden in sehr schwacher Intensität (entspricht +/-) • isolierte p65-Bande in schwacher Intensität, auch zusammen mit weiteren Banden in sehr schwacher Intensität (entspricht +/-) • Antikörper gegen p150 in mindestens schwacher Intensität (entspricht +), (in der Regel finden sich auch Antikörper gegen weitere Antigene) • p150 negativ, oder sehr schwache Intensität (entspricht +/-), aber CM2 in gut sichtbarer Intensität (entspricht 2+) sowie mindestens eine weitere Bande in schwacher Intensität (entspricht +) • alle anderen Konstellationen ,J*SRVLWLY ,J*IUDJOLFK -9- UHFRPBlot UHFRPBlot CMV IgG [Avidität] / IgM *HEUDXFKVLQIRUPDWLRQ 0,.52*(1 ,QWHUSUHWDWLRQGHV,J01DFKZHLVHV 7DEHOOHAuswertung der Banden beim IgM-Nachweis ,J0QHJDWLY • keine spezifischen Banden • Banden mit sehr schwacher Intensität (entspricht +/-) • isolierte Bande (außer p150) mit schwacher Intensität (entspricht +), im Fall von p65 auch zusammen mit weiteren Banden in sehr schwacher Intensität (entspricht +/-) • Antikörper gegen p150 mit mindestens schwacher Intensität (entspricht +) und zusätzlich mindestens eine weitere Bande in schwacher Intensität (entspricht +) • p150 als isolierte Bande in gut sichtbarer Intensität (entspricht 2+) • alle anderen Konstellationen ,J0SRVLWLY ,J0IUDJOLFK =XVDPPHQIDVVHQGH7HVWLQWHUSUHWDWLRQ Die Testergebnisse im UHFRPBlot CMV IgG, IgM lassen sich LQ GHU 5HJHO wie unten beschrieben beurteilen. Es ist zu beachten, dass es in Einzelfällen Abweichungen des Verlaufs der Immunantwort von diesen typischen Konstellationen geben kann. Dies muss bei der Interpretation der Testergebnisse berücksichtigt werden (s.a. 12.2 und 12.3.). • UHFRPBlot CMV IgG positiv, Reaktivität gegen J% QHJDWLY (Reaktivität gegen gB1-Bande kann vorhanden sein) UHFRPBlot CMV IgM positiv oder negativ 9HUGDFKWDXI&093ULPlULQIHNWLRQ oder 9HUGDFKW DXI &09,QIHNWLRQ GLH PLQGHVWHQV :RFKHQ ]XUFNOLHJW J% 1RQUHVSRQGHU Zur Abklärung der beiden Möglichkeiten sollte eine IgG-Aviditätsbestimmung durchgeführt werden (siehe 11.5) • UHFRPBlot CMV IgG positiv, NHLQH5HDNWLYLWlWJHJHQSXQGJ% UHFRPBlot CMV IgM positiv 9HUGDFKWDXI &093ULPlULQIHNWLRQLQQHUKDOEGHUHUVWHQ:RFKHQQDFK,QIHNWLRQ • UHFRPBlot CMV IgG positiv, 5HDNWLYLWlW JHJHQ J% (mit oder ohne Reaktivität gegen gB1) in mindestens schwacher Intensität vorhanden UHFRPBlot CMV IgM positiv (auch Resttiter möglich) oder bereits negativ 9HUGDFKWDXI &09,QIHNWLRQGLHPLQGHVWHQV:RFKHQ]XUFNOLHJW • UHFRPBlot CMV IgG positiv PLW LVROLHUWHU 5HDNWLYLWlW JHJHQ S (mit Reaktivität gegen gB1 und/oder gB2) UHFRPBlot CMV IgM meist negativ (positiver, persistierender IgM-Titer gegen p150 möglich) 9HUGDFKWDXI ]XUFNOLHJHQGH&09,QIHNWLRQLQGHU5HJHOlOWHUDOV0RQDWH $XIJUXQG GHU 9DULDELOLWlW GHU ,PPXQDQWZRUW LQVEHVRQGHUH EHL LPPXQVXSSULPLHUWHQ 3DWLHQWHQ VROOWHQ GLH WKHUDSHXWLVFKHQ .RQVHTXHQ]HQ GHU VHURORJLVFKHQ %HIXQGXQJ LPPHU LP =XVDPPHQKDQJPLWGHQNOLQLVFKHQ'DWHQJH]RJHQZHUGHQ - 10 - 0,.52*(1 *HEUDXFKVLQIRUPDWLRQ UHFRPBlot CMV IgG [Avidität] / IgM +LQZHLVH]XU7HVWLQWHUSUHWDWLRQ - Antikörper gegen p150 sind in der Regel bei jeder CMV-Infektion nachweisbar. Es kann vorkommen, dass im IgG unmittelbar nach Erstinfektion keine Reaktivität gegen p150 vorhanden ist. - Bei einer Erstinfektion werden im IgG außer den - in den meisten Fällen auftretenden - Antikörpern gegen p150 auch Antikörper gegen IE1, CM2 und p65 gebildet. Es sind keine Antikörper gegen das Glykoprotein gB2 vorhanden. In der Regel liegt ein positiver IgM-Befund vor (meist Abfall des IgMTiters nach 6 bis 12 Wochen). - IgG-Reaktivität gegenp150 und Glykoproteine (gB1 und/oder gB2) ohne sonstige Reaktivitäten im IgG und ein negatives IgM-Ergebnis sind typisch für eine länger zurückliegende Infektion (in der Regel älter als 6 Monate). - Antikörper gegen gB1 können bereits eine Woche nach Serokonversion auftreten, Antikörper gegen gB2 findet man in der Regel frühestens nach 6 - 8 Wochen. Die Anwesenheit von Antikörpern gegen gB2 schließt somit mit hoher Wahrscheinlichkeit eine CMV-Infektion in den letzten 6 - 8 Wochen aus. Anders verhält es sich, wenn nur Antikörper gegen gB1 zu finden sind. Hier kann es sich um eine Erstinfektion mit einer extrem frühen Antikörperbildung gegen gB1 oder um eine zurückliegende Infektion eines gB2-Nonresponders handeln. - Die Wahrscheinlichkeit einer negativen Reaktivität gegen gB1 und/oder gB2 bei zurückliegenden Infektionen („gB-Nonresponder“) besteht nach den Evaluierungsdaten zu ca. 20%. Diese können mittels der Aviditätsbestimmung der Antikörper gegen IE1, p150 und CM2 von Primärinfektionen unterschieden werden (siehe dazu Punkt 11.3.3 und 11.5.2 ). - Reaktivierte CMV-Infektionen können generell serologisch nur bedingt diagnostiziert werden. Eine lang anhaltende hohe IgG-Reaktivität gegen p150, das Membran-Glykoprotein (gB1, gB2) sowie auch gegen CM2, p65 und IE1, bei positivem IgM-Ergebnis, kann jedoch als ein Hinweis auf eine Reaktivierung gewertet werden. Dies muss jedoch in jedem Fall durch den Nachweis von pp65 oder durch eine positive PCR (Nachweis einer akuten Virämie) bestätigt werden. - Generell muss aufgrund der Variabilität der Immunantwort die serologischen Befundung als Ergänzung zum klinischen Bild betrachtet werden. Für die Interpretation der Testergebnisse sind in jedem Fall auch die klinischen Befunde und die zugehörige Anamnese mit einzubeziehen. Bei unklaren oder fraglichen Befunden empfiehlt es sich ein Folgeserum anzufordern. Dunkle Teststreifen: Manche Seren von Patienten können auf dem gesamten Nitrozellulose-Streifen eine dunkle, durchgängige oder gemusterte Färbung erzeugen (z.B. bei Seren von Patienten mit Milcheiweiß-Allergien). Hierfür sind unterschiedliche Faktoren aus dem jeweiligen Patienten-Serum verantwortlich. Die Auswertung dieser Streifen ist in der Regel nur mit Einschränkungen möglich. So sind z.B. "inverse" Banden (weisse Banden auf dunklem Hintergrund) als negativ zu werten. Das entsprechende Serum sollte in jedem Fall mittels anderer serologischer Methoden überprüft werden. 'LDJQRVHHUZHLWHUXQJGXUFK$YLGLWlWVEHVWLPPXQJ Die Bestimmung der Avidität von CMV IgG-Antikörpern ist mit dem Aviditätsreagenz, Artikel-Nr. 11010 möglich. Da im UHFRPBlot CMV die Antigene getrennt dargestellt werden, kann die Avidität der entsprechenden Antikörper einzeln betrachtet werden - ein wichtiger Aspekt aufgrund der unterschiedlichen Aviditätsreifung der Antikörper. Über die Bestimmung der Avidität der Antikörper gegen IE1, p150 und CM2 kann der Infektionszeitpunkt zusätzlich eingegrenzt werden. Bei einer Erstinfektion sind Antikörper gegen IE1, p150 und CM2 in der Regel niedrig avide, während bei einer zurückliegenden Infektion sowohl Antikörper gegen IE1, p150 und CM2, soweit vorhanden, meist hoch avide sind. 7HVWSULQ]LSXQG7HVWGXUFKIKUXQJ Die Testdurchführung der Avidität wird in der Gebrauchsinformation zum Aviditätsreagenz (Artikel-Nr.: 11010) detailliert beschrieben. Die Abarbeitung der Avidität im UHFRPBlot CMV IgG entnehmen Sie bitte dieser Anleitung. - 11 - UHFRPBlot UHFRPBlot CMV IgG [Avidität] / IgM *HEUDXFKVLQIRUPDWLRQ 0,.52*(1 ,QWHUSUHWDWLRQGHU$YLGLWlWLPUHFRP%ORW&09,J* • Vergleichen Sie die Intensitäten der entsprechenden Banden auf den beiden Teststreifen (IgGStreifen und Aviditätsstreifen), die mit dem gleichen Serum inkubiert wurden. Achten Sie darauf, ob sich die Intensitäten verändert haben. Banden auf dem IgG-Streifen, die in ihrer Reaktivität geringer als der Cutoff sind, werden nicht berücksichtigt. • Bei hoher Avidität nimmt die Bandenintensität des Aviditätsstreifens nicht bis kaum ab (Bandenintensität von 75 bis 100% des IgG-Streifens). Von niedriger Avidität spricht man bei mindestens 50%iger Intensitätsabnahme. • Nur die Aviditätsreifung von $QWLN|USHU JHJHQ ,( S XQG &0 wird für eine weiterführende Diagnostik betrachtet. Die Aviditätsreifung von Antikörpern gegen p65 ist sehr variabel und eignet sich deswegen nicht. Die Aviditätsreifung von Antikörpern gegen gB1 und gB2 spielt eine untergeordnete Rolle, da v.a. bei fehlenden Antikörpern gegen gB2 eine weitere Abklärung der Befunde durch die Aviditätsbestimmung nötig ist. • Eine komplette bis starke Intensitätsabnahme (niedrige Avidität) YRQ PLQGHVWHQV ]ZHL GHU GUHL $QWLJHQEDQGHQ,(SXQG&0 ist als ein sehr wahrscheinlicher Hinweis auf eine Erstinfektion (innerhalb der letzten 14 Wochen) zu sehen. • Sind zwei der drei betrachteten Antikörper (gegen IE1, p150 und CM2) hoch avide, so liegt mit hoher Wahrscheinlichkeit eine Infektion vor, die mindestens 6 - 8 Wochen zurückliegt. • Bei der Aviditätsreifung der Antikörper ist es wichtig zu beachten, dass es sich um einen fließenden Prozess handelt. Das parallele Auftreten von niedrig aviden und hoch aviden Seren in dem Zeitraum von 6 – 14 Wochen ist kein Widerspruch, sondern lediglich ein Ausdruck der individuell unterschiedlichen Aviditätsreifung. Während bei einem Patienten die Aviditätsreifung nach ca. 6 – 8 Wochen abgeschlossen sein kann, findet man bei einem anderen Patienten niedrig avide Seren bis zu einem Zeitraum von 14 Wochen (siehe dazu auch die Evaluierungsdaten unter 12.3) • Bei intermediären Aviditäten (Bandenintensität zwischen 50 und 75% des IgG-Streifens) können keine Aussagen über den Infektionszeitpunkt getroffen werden. • Generell gilt, dass für die Aviditätsbeurteilung keine absoluten Regeln aufgestellt werden können. Es ist zu beachten, dass niedrige Aviditäten auch bei zurückliegenden Infektionen zu finden sind, da eine Reifeverzögerung der Avidität möglich ist. • Die Interpretation der Avidität muss immer im Zusammenhang mit den gesamten Untersuchungsergebnissen erfolgen. Unklare oder fraglich serologische Ergebnisse sollten mit einem 2 bis 3 Wochen später abgenommenen Folgeserum noch einmal getestet werden. .OLQLVFKH(UJHEQLVVH 6HQVLWLYLWlWXQG6SH]LILWlW ,J* Insgesamt wurden Seren mit dem UHFRPBlot CMV ,J* im Vergleich mit einem kommerziell erhältlichen ELISA getestet. Dieses Kollektiv bestand aus Proben einer Routinediagnostik, 15 CMVSeroverläufen mit insgesamt Proben, 7 Serokonversionen mit insgesamt Seren, Seren mit IgM-Vorbefund sowie Proben mit potentiell problematischen Proben (Autoimmunerkrankungen, Schwangere, EBV-Frischinfektionen, ikterische, hämolytische oder lipämische Seren). ,J* UHFRPBlot CMV IgG ELISA CMV IgG positiv negativ fraglich positiv 327 4 1 negativ 2 193 10 fraglich 0 8 2 - 12 - 0,.52*(1 *HEUDXFKVLQIRUPDWLRQ UHFRPBlot CMV IgG [Avidität] / IgM Für die Betrachtung von Sensitivität und Spezifität wurden die fraglichen Ergebnisse nicht verwendet. Im Vergleich mit dem verwendeten, kommerziellen ELISA ergibt sich: Spezifität: 193/(4 + 193) x 100 = 98,0% Sensitivität: 327/(327 + 2) x 100 = 99,4% 25 der getesteten Seren (4,4%) weisen ein diskrepantes Ergebnis auf (inklusive der fraglichen Befunde): Etwa die Hälfte davon zeigt im UHFRPBlot eine stärkere Reaktivität; der Großteil dieser Proben lässt sich zugunsten des UHFRPBlot CMV erklären, da es sich meist um Vertreter von Verläufen handelt. Der zweite Teil der diskrepanten Befunde zeigt im Blot eine geringere Reaktivität im Vergleich zum ELISA. Alle Seren liegen im IgG-Titer an der unteren Nachweisgrenze; es handelt sich hier um Schwankungen bzw. Befunde im „Cutoff“-Bereich. ,J0 Seren wurden im UHFRPBlot CMV ,J0 im Vergleich mit einem kommerziell erhältlichen ELISA getestet. Diese Proben sind bis auf wenige Ausnahmen mit dem Serenkollektiv der IgG-Evaluierung übereinstimmend. ,J0 ELISA CMV IgM UHFRPBlot CMV IgM positiv negativ fraglich positiv 174 20 11 negativ 3 308 2 fraglich 5 28 7 Für die Betrachtung von Sensitivität und Spezifität wurden die fraglichen Ergebnisse nicht verwendet. Im Vergleich mit dem verwendeten, kommerziellen ELISA ergibt sich: Spezifität: 308/(20 + 308) x 100 = 93,9% Sensitivität: 174/(174 + 3) x 100 = 98,3% Bei insgesamt 58 Proben ist im UHFRPBlot CMV eine stärkere Reaktivität verglichen mit dem ELISA aufgetreten. (ELISA negativ/Blot positiv (19); ELISA negativ/Blot fraglich (28); ELISA fraglich/Blot positiv (11)). Ca. 3/4 der Ergebnisse lassen sich zugunsten des UHFRPBlot CMV erklären, z.B. gleichzeitig auftretende, hoch positive IgG-Titer, Reaktivierungen, kurz zurückliegende Erstinfektionen. In diesen Fällen erscheint ein IgM-Titer wahrscheinlich und kann Ausdruck einer höheren IgM-Sensitivität des Blots bei bestimmten Proben sein. Bei ca. 15 Proben handelt es sich entweder um IgG-positive Proben mit einem Resttiter im IgM oder um IgG-negative Seren mit einer unspezifischen IgM-Reaktion, die nur im Blot reaktiv gefunden werden. 10 Seren zeigen im Blot eine geringere Reaktivität als im ELISA (ELISA positiv/Blot fraglich (5) bzw. negativ (3), ELISA fraglich/Blot negativ (2)). Während 7 Seren aus Verläufen und Serokonversionen stammen und das fragliche/positive IgM Ergebnis im ELISA erklärbar wäre, bedürfen die restlichen drei Proben der weiteren Abklärung. (YDOXLHUXQJVGDWHQ]XU(LQJUHQ]XQJGHV,QIHNWLRQV]HLWSXQNWV In einer externen Studie wurden 69 Verläufe (insgesamt 258 Seren) untersucht. Die Ergebnisse sind im folgenden zusammengefasst. - 13 - UHFRPBlot UHFRPBlot CMV IgG [Avidität] / IgM *HEUDXFKVLQIRUPDWLRQ 0,.52*(1 ,J*5HDNWLYLWlWJHJHQJ%%DQGHQ In der Verlaufsstudie wurde der zeitliche Verlauf des Auftretens von IgG-Antikörpern gegen gB untersucht. Es zeigte sich, dass bei ca. 17% der Verläufe Antikörper gegen gB1 schon vor Ablauf von 6 Wochen gefunden wurden. Antikörper gegen gB2 dagegen wurden in der Regel erst nach Ablauf von 6 bis 8 Wochen gefunden, lediglich bei einem Verlauf waren diese Antikörper schon vor Ablauf von 6 bis 8 Wochen nachweisbar. Die Anwesenheit von Antikörpern gegen gB2 schließt somit mit hoher Wahrscheinlichkeit eine Infektion innerhalb der letzten 6 bis 8 Wochen aus. )HKOHQGH,J*5HDNWLYLWlWJHJHQSEHLIULVFKHQ,QIHNWLRQHQ In der Verlaufsstudie war bei 20 Verläufen (29%) im frühen Stadium der Infektion das Fehlen von IgGAntikörpern gegen p150 zu beobachten (bei gleichzeitig positivem IgG-Befund). Bei 19 dieser 20 Verläufe wurden diese Antikörper innerhalb der ersten 6 bis 8 Wochen nach Infektion gebildet. Lediglich ein Verlauf wies Antikörper gegen p150 erst zu einem späteren Zeitpunkt auf. Das Fehlen von Antikörperreaktivitäten gegen p150 (bei einem positiven IgG-Befund) spricht somit für eine frische Infektion innerhalb der ersten 6 - 8 Wochen nach Infektion. ,J*5HDNWLYLWlW JHJHQ LVROLHUWHV S PLW $QWLN|USHUQ JHJHQ J% XQGRGHU J% EHL ODQJ ]XUFNOLHJHQGHQ,QIHNWLRQHQ Isolierte IgG-Antikörper gegen p150 (d.h. ohne Reaktivitäten gegen IE1, CM2 und p65), gB1 und/oder gB2 charakterisieren eine lang zurückliegende Infektion. In der Verlaufsstudie wurde auch das Auftreten diese Reaktivitätsmusters untersucht. In dem Zeitraum bis zu 24 Wochen nach Infektion zeigte ein Serum IgG-Antikörper gegen p150 und gB1 und/oder gB2. Dieses Serum stammt aus einem Verlauf dessen Serokonversionszeitpunkt nicht bekannt und die zeitliche Einordnung folglich nicht gesichert ist. Das Auftreten von IgG-Antikörpern gegen p150 und gB1 und/oder gB2 (ohne weitere Reaktivität im IgG) spricht somit in der Regel für eine Infektion, die länger als 6 Monate zurückliegt. (YDOXLHUXQJVGDWHQ]XU$YLGLWlW Der Nachweis von IgG- und IgM-Antikörpern und die Aviditätsbestimmung mit Hilfe des UHFRPBlot CMV erfolgte in externen Labors. Als Referenz-ELISAs wurden kommerziell erhältliche ELISA-Teste (teilweise mit Aviditätsbestimmung) verwendet, die nach Herstellerangaben durchgeführt wurden. Insgesamt wurden 237 Seren untersucht, um die Entwicklung der Immunantwort und der Avidität im zeitlichen Verlauf beobachten zu können. Die untersuchten Seren setzten sich zum einen aus Blutspendern, die seit mindestens 2 Jahren im ELISA nachweislich seropositiv für CMV waren, zum anderen aus Serokonversionen und Verläufen von frischen CMV-Infektionen (u.a. Schwangerenseren) zusammen. Bei Verläufen wurde der Beginn der Infektion entweder ab der ersten positiven Serumprobe oder bei Auftreten der ersten klinischen Symptome gesetzt. 18 Seren mit negativen bzw. fraglichen Befund wurden aus der Bewertung ausgeschlossen. Bei niedriger Avidität von zwei der drei relevanten Antikörper (IE2, p150, CM2), lag bei 96,3% der Patienten (77/80) die CMV-Infektion nicht länger als 14 Wochen zurück. Bei hoher Avidität von zwei der drei relevanten Antikörper (IE2, p150, CM2), lag mit einer Wahrscheinlichkeit von 98,4% (57/58 Seren) die CMV-Infektion mindestens 6-8 Wochen zurück. /LWHUDWXU Die ausführliche Literaturliste finden Sie im englischen Teil der Gebrauchsinformation ab Seite 29 Auf Anforderung senden wir Ihnen gerne weiterführende Literatur zur CMV-Diagnostik zu. (UNOlUXQJGHU6\PEROH Die Tabelle mit der Erklärung der Symbole finden Sie im englischen Teil der Gebrauchsinformation auf Seite 30. - 14 - 0,.52*(1 ,QVWUXFWLRQVIRUXVH UHFRPBlot CMV IgG [Avidität] / IgM UHFRP%ORW&09,J*>$YLGLW\@ UHFRP%ORW&09,J0 Immunoblot test for the detection of IgG and IgM antibodies against Cytomegalovirus (CMV). On request reagents for the avidity determination can be supplied. *HQHUDODVSHFWV UHFRP%ORW &09 is a qualitative in vitro test for detection and reliable identification of IgG and IgM antibodies against the Cytomegalovirus in human serum or plasma. UHFRP%ORW&09 is used to confirm repeated positive results for samples in screening tests. In contrast to enzyme-based immunoassays and spot tests, the electrophoretic antigen separation employed by this test method facilitates reliable identification and localisation of specific antibodies. &\WRPHJDORYLUXV The human Cytomegalovirus (HCMV) is a herpesvirus which is ubiquitously distributed in the human population. The lifelong persisting virus is transmitted by smear infections or by direct contact to the mucosa (sexual, prenatal or iatrogenic transmission by blood transfusion or transplantation). Generally primary infection in immunocompetent patients is asymptomatic after an incubation period of four up to eight weeks. The high variability of clinical manifestations depends on age and immunocompetence. In immunocompromised individuals such as transplant recipients, AIDS and tumour patients, HCMV infection may lead to severe and life-threatening illness. Primary infection during pregnancy with intrauterine transmission occurs in about 40% of cases and infected new-borns suffer from severe damages in 10% of all cases. The vertical HCMV transmission to the fetus may follow recurrent maternal infections as well. However the clinical consequences of recurrent infections are more moderate and offer good prognosis for the neonate. The organ damages caused by HCMV are observed in different frequencies depending on groups of patients. HCMV causes morbidity either directly (e.g. CMV retinitis and colitis in AIDS patient or pneunomitis in transplant recipients) or indirectly through its immune-modulating properties (e.g. increased bacterial and fungal infections). Severe complications are also the atypical pneumonia (high mortality) and the rare incidence of encephalitis. Furthermore HCMV can cause organ rejection in transplant recipients. 'LDJQRVLV The CMV diagnostic methods currently in use are based either on detection of CMV-specific antibodies, detection of the virus itself or detection of virus components (e.g. virus isolation, pp65 antigen, PCR). The method used depends on the previous findings and the specific problem confronted in each case. Serological diagnostics are important in CMV infections and are required in the following cases in particular: • Detection of a primary infection of immunocompetent patients • Determination of the infection status of donors and recipients of medical transplants • Determination of the infection status of blood donors • Diagnostics in pregnancy Screening for CMV-specific antibodies is usually done with the help of an ELISA. This assay provides both qualitative information and a quantitative determination of the humorale immune response. However, an unequivocal, differentiated infection status of primary infection or former infection respectively reactivation cannot always be obtained. The advantage of UHFRPBlot CMV is that it can detect reactivities to individual antigens. In the early phase of an infection, one usually finds antibodies directed mainly against the proteins of tegument p150 and p65 as well as against the non-structural-proteins IE1 and CM2. Antibodies against glycoproteins gB1 and gB2B normally develop for the first time 6 – 8 weeks after primary infection. - 15 - UHFRPBlot CMV IgG [Avidität] / IgM ,QVWUXFWLRQVIRUXVH 0,.52*(1 Cases of reactivation frequently show IgG antibodies to p150, the membrane glycoprotein (gB1, gB2) and to CM2, p65 and/or IE1 at a readily visible intensity level. In most cases, the IgM result is also positive. The serologic diagnosis of reactivations is limited. However, long persistent and high IgG titre against p150, the membrane glycoproteins (gB1, gB2), IE1, CM2 and p65, combined with positive IgM titre, could be an indication of reactivation. This must be verified by pp65 antigenemia or PCR (detection of acute viremia). A CMV reactivation is defined as the resumption of a lytic proliferation in a latently infected person. The degree of proliferation may be very mild and short-lived, e.g. reflecting a brief immune system disturbance due to another infection or other causes. On the other hand, the inhibition of the immune response may also be long-lasting and massive, e.g. in patients suffering from immunodeficiency or under therapy with immuno suppressants. Every intermediate degree between these two extremes is possible. Classic infection serology is based on the observation that pathogen-specific IgM antibodies are produced only temporarily, whereas the corresponding IgG response is of longer duration. Therefore, an IgM finding can supply evidence of an acute infection, whereas an IgG finding without parallel IgM is indicative of a long-past infection. Due to the variability of the immune response and the occurrence of aberrant serological courses (e.g. persistent, reactive or lacking IgM response), this classic procedure may however lead on a wrong diagnostic conclusion in a number of cases. Diagnostics can be supplement by determination of avidity of the IgG antibodies (total bond strength between a population of antibodies to an antigen). The determination of avidity is useful because it is based on the process of avidity maturation of IgG antibodies in the course of humorale immune response to CMV. The longer the duration of infection, the maturation of immune response will increase, i.e. there will be a greater part of IgG antibodies of high avidity. Mostly low-avidity IgG is thus indicative of a primary infection, whereas high-avidity IgG is typical of past or reactivated infections. Therefore, primary and past infections can be differentiated based on determination of IgG antibody avidity (see 11.5). The avidity reagent required for determination of avidity can be obtained from MIKROGEN. 7HVWSULQFLSOH For the UHFRPBlot CMV IgG or IgM, the specific F\WRPHJDORYLUXV antigens IE1, p150, CM2, p65, gB1 and gB2 are produced with the help of recombinant (FROL cells. The purified recombinant antigens used are separated according to their molecular weights using SDS polyacrylamide gel electrophoresis (SDSPAGE). The CMV proteins are then transferred to a nitrocellulose membrane by electrophoresis (Western Blotting). The membrane is then incubated with a protein solution to block the free binding sites, washed, cut into strips and packed in tubes. In the procedure to detect CMV-specific antibodies, the strips are incubated with the diluted serum sample, whereby the antibodies bind to the antigens on the strips. Non-bound antibodies are then washed off and the strips are subjected to a second incubation with anti-human IgG or anti-human IgM coupled with horseradish peroxidase. Specifically bound antibodies are detected by means of a colour reaction catalysed by the peroxidase. A reactivity to one of the CMV proteins appears as a dark band on the strip. As a reaction control, a band with anti-human immunoglobulin is also applied at the upper end of the strips (below the number) that must show a reaction to every serum. - 16 - 0,.52*(1 ,QVWUXFWLRQVIRUXVH UHFRPBlot CMV IgG [Avidität] / IgM 7KHUHFRPELQDQWDQWLJHQVXVHG 7DEOH 5HFRPELQDQW&09DQWLJHQV recombinant antigen Open reading frame/protein Molecular weight of recombinant antigen [kDa] Classification of protein IE1 UL123/IE1/1 53 Non structure protein, „immediate early“-protein p150 UL32/pp150 50 Tegument protein CM2 UL44, UL57/p52 (DBP) 45 Non structure protein p65 UL83/pp65 31 Tegument protein gB1 UL55/gB 25 Membrane glycoprotein gB gB2 UL55/gB 18 Membrane glycoprotein gB 3DFNDJHFRQWHQWV UHFRP%ORW&09 The reagents in a pack are sufficient for 20 determinations. Each reagent set contains: The reagents in a pack are sufficient for 20 determinations. Each reagent set contains: 100 ml Wash and dilution buffer (WHQWLPHVWKHconcentration) contains phosphate buffer, NaCl, KCl, detergent and preservative 45 ml Substrate solution Tetramethylbenzidin (TMB, UHDG\WRXVH 5g Skim milk powder 2 pieces Incubation trays with 10 wells each 1 Predeveloped control strip (kit specific) 1 Instructions for use 1 Evaluation form UHFRP%ORW&09,J* Additionally to the components listed under Point 5 each reagent set contains: 2 pieces Test tubes with 10 consecutively numbered western blot test strips coated with&09antigens 70 µl Weak positive IgG serum control (UHG screw cap) Human origin, anti HIV-1/2, anti-HCV and HBs-Ag negative 60 µl Anti-human IgG conjugate (JUHHQ screw cap, , WKRXVDQGWLPHVWKH FRQFHQWUDWLRQ) from rabbit, contains NaN3 - 17 - UHFRPBlot CMV IgG [Avidität] / IgM ,QVWUXFWLRQVIRUXVH 0,.52*(1 'HWHUPLQDWLRQRIDYLGLW\ For avidity detection of IgG antibodies against CMV the following additional reagent supplementary to UHFRPBlot CMV IgG is available: 1 Avidity reagent (solid) for 60 ml ready-to-use solution Art. No. 11010 UHFRP%ORW&09,J0 Additionally to the components listed under Point 5 each reagent set contains: 2 pieces Test tubes with 10 consecutively numbered western blot test strips coated with&09antigens 70 µl Weak positive IgM serum control (ZKLWH screw cap) Human origin, anti HIV-1/2, anti-HCV and HBs-Ag negative 100 µl Anti-human IgM conjugate (OLODF screw cap, ILYHKXQGUHGWLPHV WKHFRQFHQWUDWLRQ) from rabbit, contains NaN3 $GGLWLRQDOUHDJHQWVDQGDFFHVVRU\HTXLSPHQWUHTXLUHG Deionised water, vacuum extraction system with disinfection trap, micro pipettes, plastic forceps, shaker, metric cylinder with graduations, scales. ,QIRUPDWLRQRQWHVWDQGUHDJHQWV 3UHFDXWLRQV * Control sera are from blood donors verified for the absence of antibodies to HIV 1/2, HCV and no Hepatitis Bs-antigen. Since an infection cannot be excluded with absolute certainty despite this precaution, the product must be treated with the same care as the patient samples. * Suitable single-use gloves must be worn during the entire test procedure. * The conjugates contain sodium azide. Avoid contact with skin or mucosa. * All reagents and materials contaminated with potentially infectious samples must be treated with suitable disinfectants or autoclaved at 121°C for at least 1 hour. * Use incubation trays once only. * Handle strips carefully with a plastic forceps. +DQGOLQJLQIRUPDWLRQ Store reagents before and after use at 2°C - 8°C, GRQRWIUHH]H. Temper all components before starting the test for at least 30 minutes to 18°C - 25°C (room temperature). Both the test and incubation procedures are carried out at room temperature. Mix the control sera and concentrated conjugates well before use. Mix the patient sera well before use as well. Do not open the tube containing the test strips until just before use to avoid condensation of water. The strips that are not used must be left in the tube and stored further at 2°C - 8°C (reclose tube tightly, test strips must not become moist before testing!). Weak positive controls must always be run parallel to the sera being tested, regardless of how many are being tested. This is the only way to ensure correct test interpretation. A quality guarantee can only be given up to the expiry date on the packages. Only reagents with lot numbers corresponding to the respective lot number on the label of the kit package may be used. The test must be performed by well-trained and authorised qualified personnel. - 18 - 0,.52*(1 ,QVWUXFWLRQVIRUXVH UHFRPBlot CMV IgG [Avidität] / IgM In case of substantial modifications of the product or the instructions for use, the application of the test might differ from the purpose intended by MIKROGEN. Automation is possible, please refer to MIKROGEN for details. 3UHSDUDWLRQRIVROXWLRQV 3UHSDUDWLRQRIUHDG\WRXVHZDVKEXIIHU This buffer is used for both serum and conjugate dilution as well as for the washing steps. Prior to dilution, the volume of wash buffer required for the corresponding number of tests must be determined. The skim milk powder is first dissolved in wash buffer concentrate. This mixture is then filled up with deionised water to the final volume (dilution: 1 + 9). See Table 2. for the amounts required. Volumes for numbers of test strips not listed in the table have to be determined by calculation. Ready-to-use wash buffer can be stored at 2°C - 8°C for four weeks. 7DEOH Wash buffer per test strip used 7HVWVWULSV XVHG 6NLPPLON SRZGHU :DVKEXIIHU FRQFHQWUDWH 'HLRQLVHG ZDWHU 5HDG\WRXVHZDVK EXIIHU 1 0,1 g 2 ml 18 ml 20 ml 2 0,2 g 4 ml 36 ml 40 ml 3 0,3 g 6 ml 54 ml 60 ml 5 0,5 g 10 ml 90 ml 100 ml 10 1g 20 ml 180 ml 200 ml 15 1,5 g 30 ml 270 ml 300 ml 20 2g 40 ml 360 ml 400 ml 3UHSDUDWLRQRIFRQMXJDWHVROXWLRQV The conjugate solution for the IgG resp. IgM test is to be prepared immediately before use. It is not possible to store the ready-to-use conjugate solution. One part of IgG conjugate concentrate is diluted with 1000 parts of ready-to-use wash buffer (1 + 1000). One part of IgM conjugate concentrate is diluted with 500 parts ready-to-use wash buffer (1 + 500). The amounts used are listed in Table 3. Volumes for numbers of test strips not listed in the table have to be determined by calculation. 7DEOH Volumes for anti-human IgG resp. IgM conjugate dilution 7HVWVWULSV XVHG ,J*FRQMXJDWH FRQFHQWUDWH ,J0FRQMXJDWH FRQFHQWUDWH 5HDG\WRXVHZDVK EXIIHU 1 2 µl 4 µl 2 ml 2 4 µl 8 µl 4 ml 3 6 µl 12 µl 6 ml 5 10 µl 20 µl 10 ml 10 20 µl 40 µl 20 ml 15 30 µl 60 µl 30 ml 20 40 µl 80 µl 40 ml The volumes have been calculated without dead volume. Depending on handling (manually or by machine processing) please prepare conjugate solution for additional 1 to 3 strips. - 19 - UHFRPBlot CMV IgG [Avidität] / IgM ,QVWUXFWLRQVIRUXVH 0,.52*(1 6XEVWUDWHVROXWLRQ The substrate is ready for use! Bring to room temperature (18°C - 25°C) before starting the colour reaction. Avoid contamination of the unused substrate solution by nonsterile pipette tips, etc. at all costs since this may affect test sensitivity. 6WRUDJHDQGVWDELOLW\ Store reagents at 2°C - 8°C before and after use. Ready-to-use wash buffer can be stored at 2°C - 8°C for four weeks. The conjugate solution is to be prepared always freshly. 6DPSOHPDWHULDO The sample material can be serum or plasma that is separated from the coagulum as soon as possible after sampling. Heat-inactivated samples may result in raised background reaction levels. A microbial contamination of the sample is to be avoided at all costs. Insoluble substances are to be removed from the sample prior to incubation by means of centrifugation. Use of lipaemic, haemolytic or turbid samples may result in a dark background in the UHFRPBlot CMV IgG/IgM. These samples may also result in false results and should therefore not be used. ,PSRUWDQW ,IWKHWHVWVDUHQRWFDUULHGRXWLPPHGLDWHO\WKHVDPSOHVFDQEHVWRUHGIRUXSWRZHHNVDW& &/RQJHUVWRUDJHRIWKHVDPSOHVLVSRVVLEOHDW&RUFROGHU5HSHDWHGIUHH]LQJDQGWKDZLQJ RIWKHVDPSOHVLVQRWUHFRPPHQGHGEHFDXVHWKLVPD\DIIHFWWKHTXDOLW\RIWKHUHVXOWV 7HVWSURFHGXUH *HQHUDO The reproducibility of the results depends to a great extent on consistent washing of the strips. The washing frequencies described under 9.3. and 9.5 should therefore always be maintained. 1. ,QFXEDWLRQRIVDPSOHV One well in the incubation tray (see 6) is required per sample to be tested. PO of ready-to-use wash buffer is pipetted into each well. Then one test strip is carefully dipped into each of the wells filled with ready-to-use wash buffer using a plastic forceps. The strip number must face upwards. ,PSRUWDQW 7KHVWULSPXVWEHFRPSOHWHO\ZHWDQGLPPHUVHGLQWKHZDVKEXIIHU Record the tube and strip numbers used on the evaluation sheet. 2. Adding the samples ,J*DQG,J07HVWSURFHGXUHO of an undiluted sample (human serum or plasma) or of the corresponding weak positive control, are pipetted into the proper wells (GLOXWLRQ). Please be sure to add the sample at one end of the immersed strips into the wash buffer and mix as soon as possible by shaking the tray carefully. Record the sample numbers on the evaluation sheet. Cover the incubation tray with the plastic lid and incubate for KRXU at room temperature while shaking gently. ,PSRUWDQW 0DNH VXUH WKH LQFXEDWLRQ VROXWLRQV DUH QRW FDUULHG RYHU LQWR RWKHU ZHOOV EH SDUWLFXODUO\ FDUHIXOWRDYRLGVSODVKLQJZKHQRSHQLQJDQGFORVLQJWKHOLGULVNRIFURVVFRQWDPLQDWLRQ - 20 - 0,.52*(1 ,QVWUXFWLRQVIRUXVH UHFRPBlot CMV IgG [Avidität] / IgM :DVKLQJ 1. Following incubation, the plastic lids are carefully removed from the incubation trays. 2. The serum dilution is carefully aspirated from the individual wells. ,PSRUWDQW :KHQ WKH VROXWLRQV KDYH EHHQ DVSLUDWHG IURP D ZHOO WKH SLSHWWH WLS KDV WR EH FKDQJHG RU ULQVHG ZHOO ZLWK GHLRQLVHG ZDWHU DIWHU HDFK DVSLUDWLRQ SURFHGXUH WR SUHYHQW FURVV FRQWDPLQDWLRQ ,QWKHFDVHRIPDFKLQHSURFHVVLQJWKHUHIHUHQFHVRIWKHHTXLSPHQWPDQXIDFWXUHUKDYHWREH FRQVLGHUHG 3. Then place PO of the ready-to-use wash buffer in each well and wash on the shaker while shaking gently for PLQXWHV. The wash buffer is aspirated after the washing procedure. 4. Carry out the washing step under 3. a total of WKUHHWLPHV. ,QFXEDWLRQZLWKSHUR[LGDVHFRQMXJDWH After washing the strips, place PO of the appropriately prepared FRQMXJDWH VROXWLRQ (see Table 3). into each well and incubate for PLQXWHV while shaking gently at room temperature, whereby the incubation tray is covered with the plastic lid. :DVKLQJ The conjugate solutions are aspirated from the wells and the strips are washed again (see 9.3). 6XEVWUDWHUHDFWLRQ Add PO VXEVWUDWH VROXWLRQ into each well and incubate for PLQXWHV, shaking gently and under observation, at room temperature. ,PSRUWDQW 2EVHUYHWKHFRORXUUHDFWLRQSURFHVVDQGOHDYHDOOVWULSVLQWKHVXEVWUDWHVROXWLRQXQWLOWKHVWULSV LQFXEDWHGZLWKWKHZHDNSRVLWLYHVHUXPFRQWUROVKRZWKHS%DQG 7KHFRORXUUHDFWLRQPD\EHH[FHVVLYHZLWKKLJKO\SRVLWLYHVHUD5HFRPPHQGDWLRQ6WRSWKH FRORXUUHDFWLRQLQVXFKVWULSVHDUOLHU 6WRSSLQJWKHUHDFWLRQ 1. After the solution is aspirated, wash the strips briefly three times with deionised water. 2. Use a plastic forceps to remove the strips carefully from the water and place them between 2 layers of absorbent paper to dry for about 2 hours. The strips may be adhesively attached to the enclosed evaluation sheet and the results may be recorded. 3. The strips should be stored protected from exposure to light. 7HVWSURFHGXUHRIDYLGLW\GHWHUPLQDWLRQ The avidity test procedure with UHFRPBlot CMV IgG is described in detail in the instructions for use for the avidity reagent (Article No.: 11010). - 21 - UHFRPBlot CMV IgG [Avidität] / IgM ,QVWUXFWLRQVIRUXVH 0,.52*(1 6XPPDU\RIWKHWHVWSURFHGXUH 1. bring all reagents to room temperature 2. deposit the strips in 2 ml ready-to-use wash buffer and take care that they are completely immersed in the ready-to-use wash buffer 3. add 20 µl of patient sample resp. control serum 4. incubate for 1 hour at room temperature while shaking gently 5. wash on the shaker three times with 2 ml of ready-to-use wash buffer for 5 minutes each time 6. add 2 ml appropriately prepared conjugate solution 7. incubate at room temperature for 45 minutes while shaking gently 8. wash on the shaker three times with 2 ml of ready-to-use wash buffer for 5 minutes each time 9. add 1.5 ml of the substrate solution, incubate while shaking at room temperature for 5 – 15 minutes. Bands see 9.6 10. wash the strips at least three times with deionised water 11. dry the strips between 2 layers of absorbent paper for 2 hours and read off the result (YDOXDWLRQ (YDOXDWLRQRIEDQGLQWHQVLW\ 1. A positive control resp. weak positive control must be included in each test run, irrespective of the number of samples. The reactivity of the weak positive control serves as cutoff and as a discrimination from the background reactivity. 2. On the attached evaluation sheet, record the date, batch and tube number, and the detected antibody class. 3. Enter the sample identification number on the protocol sheet. 4. Now attach the corresponding test strips with a glue stick into the corresponding fields of the evaluation sheet. To do this, place the test strips with the reaction control band on the marking lines. Then use clear adhesive tape to attach the test strips left from the marking line. Complete sticking of the test strip with glue or adhesive tape may lead to aberrations of the colouring. 5. Place the predeveloped control test strip with the labelled antigen bands on the fixed test strips in such a way that the reaction control bands are aligned. The predeveloped test strip is kit specific and comes from the same nitrocellulose sheet as the test strips in the test kit. The molecular weights and names of the antigen bands are marked. 6. Band intensities are assessed by comparison with the weak positive control (refer to 11.2 resp. Table 4). Please record the values in the evaluation sheet. &RQWUROUHVXOWV The controls must always be run parallel to the sera being tested. The test conditions (sensitivity) are to be examined and reactivity with the individual antigen bands are to be confirmed. The localisation of the antigen bands must agree with the attached control strip (kit specific). The control band (reaction control) below the strip number is used to check the correct performance of the test. This band must show a distinct colouring. The test strips incubated with the weak positive serum control show the following band patterns: - 22 - 0,.52*(1 • ,QVWUXFWLRQVIRUXVH UHFRPBlot CMV IgG [Avidität] / IgM ,J*ZHDNSRVLWLYHFRQWUROFXWRII The following bands should be visible: Reaction control, p150 must appear, further bands may also appear. Reaction-Ctrl. • IE 1 p150 CM 2 p65 gB1 gB2 ,J0ZHDNSRVLWLYHFRQWUROFXWRII The following bands should be visible: Reaction control, p150 must appear, further bands may also appear. Reaction-Ctrl. IE 1 p150 CM 2 p65 gB1 gB2 For evaluation of intensity of all bands the p150 band both in the case of IgG testing and IgM testing is referred to. 7DEOH (YDOXDWLRQRIEDQGLQWHQVLW\ %DQGV ,QWHQVLW\ Negative - very weak intensity (intensity weaker than the p150 band of the +/- weak positive control) weak intensity (same intensity as with the p150 band of the weak positive serum control) + well visibly intensity (stronger intensity as with the p150 band of the 2+ weak positive serum control) 3+ very strong intensity 7HVWUHVXOWVDQGWHVWLQWHUSUHWDWLRQ The serological immune response of humans to a CMV infection is highly variable. The interpretation of serological findings is rendered more different in particular by the fact that IgM antibodies may remain detectable for many years after the infection and that primary infections may induce very low-level or even undetectable IgM titres. For evaluation of CMV immune status, the results of the IgG and IgM detection procedures should always be considered together. ,QWHUSUHWDWLRQRI,J*GHWHFWLRQWHVW 7DEOH(YDOXDWLRQRIEDQGVLQ,J*GHWHFWLRQWHVW ,J*QHJDWLYH • no CMV specific bands • Bands with very weak intensity (corresponding to +/-) • Isolated p65 band of weak intensity (corresponding to +), even together with further bands of very weak intensity (corresponding to +/-) • Antibodies against p150 at least of weak intensity (corresponding to +), (normally there are antibodies against more antigens as well) • p150 negative, CM2 of well visibly intensity (corresponding to 2+) and at least one further band of weak intensity (corresponding to +) • All other constellations ,J*SRVLWLYH ,J*ERUGHUOLQH - 23 - UHFRPBlot CMV IgG [Avidität] / IgM ,QVWUXFWLRQVIRUXVH 0,.52*(1 ,QWHUSUHWDWLRQRI,J0GHWHFWLRQWHVW 7DEOH(YDOXDWLRQRIEDQGVLQ,J0GHWHFWLRQWHVW ,J0QHJDWLYH • No specific bands • Bands with very weak intensity (corresponding to +/-) • isolated band (except p150) of weak intensity (corresponding to +), in the case of p65 even together with further bands of very weak intensity (corresponding to +/-) • Antibodies against p150 at least of weak intensity (corresponding to +) and at least one further band of weak intensity (corresponding to +) • Isolated p150 band with well visible intensity (corresponding to 2+) • all other constellations ,J0SRVLWLYH ,J0ERUGHUOLQH 6XPPDU\RIWHVWLQWHUSUHWDWLRQ Normally the test results of the UHFRPBlot CMV IgG, IgM are evaluated as below. Please consider the variances of the typically developing immune response in particular cases. This must be included in the test interpretation (see also 12.2 and 12.3). • UHFRPBlot CMV IgG positive, reactivity toJ%QHJDWLYH (reactivity togB1 is possible) UHFRPBlot CMV IgM positive or negative VXVSHFWRI SULPDU\LQIHFWLRQ or VXVSHFWRI &09LQIHFWLRQDWOHDVWZHHNVDJRJ%QRQUHVSRQGHU To verify the two possibilities, avidity determination should be performed (see 11.5) • UHFRPBlot CMV IgG positive, UHDFWLYLW\WRSDQGJ%QHJDWLYH UHFRPBlot CMV IgM positive VXVSHFWRI SULPDU\LQIHFWLRQZLWKLQWKHILUVWZHHNVDIWHULQIHFWLRQ • UHFRPBlot CMV IgG positive, UHDFWLYLW\ WR J% at least of weak band intensity (reactivity to gB1 positive or negative) UHFRPBlot CMV IgM positive (residual IgM titre) or already negative • VXVSHFWRI &09LQIHFWLRQDWOHDVWZHHNVDJR UHFRPBlot CMV IgG positive ZLWKLVRODWHGUHDFWLYLW\WRS (with reactivity to gB1 and/or gB2) UHFRPBlot CMV IgM mostly negative (positive, persistent IgM titre against p150 is possible) VXVSHFWRI IRUPHU&09LQIHFWLRQQRUPDOO\DWOHDVWPRQWKVDIWHULQIHFWLRQ 'XH WR WKH LQKHUHQW YDULDELOLW\ RI WKH LPPXQH UHVSRQVH SDUWLFXODUO\ FRQFHUQLQJ LPPXQRVXSSUHVVHGSDWLHQWVWKHUDSHXWLFFRQVHTXHQFHVRIFRQFOXVLRQVGUDZQIURPVHURORJLFDO ILQGLQJVVKRXOGDOZD\VWDNHWKHFOLQLFDOGDWDLQWRFRQVLGHUDWLRQ 11.4 1RWHVRQWHVWLQWHUSUHWDWLRQ - Antibodies against p150 are usually be induced in every CMV infection. It may occur that no IgG antibodies against p150 are found LPPHGLDWHO\ after primary infection. - In primary infection, the IgG antibodies against p150 are detected, but antibodies against IE 1, CM2 and p65 are included as well. No antibodies against the glycoprotein (gB1, gB2) are present. Normally the IgM titre is positive (IgM titre declines after 6 - 12 weeks) - 24 - 0,.52*(1 ,QVWUXFWLRQVIRUXVH UHFRPBlot CMV IgG [Avidität] / IgM - IgG reactivity against p150 and against glycoproteins (gB1 and/or gB2) without further IgG reactivity and with a negative IgM result are typical of a long-past infection (normally at least 6 months ago). - Antibodies against gB1 may appear as early as a week after seroconversion. Whereas antibodies to gB2 are detected after 6-8 weeks at the earliest. Thus presence of anti-gB2 excludes a primary CMV infection within the first 6 – 8 weeks most likely. It is a different matter if only antibodies to gB1 are detected. This may indicate a primary infection with extremely early anti-gB1 formation or a former infection of gB2 non responder. - The incidence of former infection with negative reactivity against gB1 and/or gB2 (gB non responder) is about 20% according to evaluation data. The discrimination between primary infection (without reactivity to gB1 and/or gB2) and former infection (with lacking reactivity to gB1 and/or gB2) is possible by the determination of antibody avidity of IE1, p150 and CM2 (see 11.3.3 and 11.5.2). - The serologic diagnosis of reactivations is limited. However, long persistent and high IgG titre against p150, the membrane glycoproteins (gB1, gB2), IE1, CM2 and p65, combined with positive IgM titre, could be an indication of reactivation. This must be verified by pp65 antigenemia or PCR (detection of acute viremia). - Due to the inherent variability of the immune response, serological test results should always be considered in connection with the clinical picture. Clinical data and medical history must be included in the test interpretation. Unclear or borderline results should be checked by an additional patient sample. Dark test strips: A few sera of patients may generate a dark general or patterned colouring on the whole nitrocellulose strip (e.g. sera of patients with milk protein allergies). Different factors according to the patient serum are responsible for this phenomenon. The evaluation of these strips is usually possible only with some restrictions. E.g. “inverse“ bands (white bands on dark background) are assessed as negative. The corresponding serum should strictly be retested by use of other serological methods. ([WHQVLRQRIGLDJQRVLVZLWKDYLGLW\GHWHUPLQDWLRQ Determination of the avidity of CMV IgG antibodies is possible by using the avidity reagent, article no. 11010. The UHFRPBlot CMV detects reactivities to individual, singular antigens. Therefore the avidity of each antibody can be considered separately – an important aspect due to the inconsistent avidity maturation of each antibody. The determination of the antibody avidity of IE1, p150 and CM2 gives additional information about the infection time. Normally primary infections show low-avide antibodies to IE1, p150 and CM2, whereas high-avide antibodies to IE1, p150 and CM2 (if present) are characteristic for former infections. 7HVWSULQFLSOHDQGWHVWSURFHGXUH The testing procedure for avidity is described in detail in the instructions for use accompanying the avidity reagent (article no. 11010). See these instructions for use for the detailed procedure for determining avidity in UHFRPBlot CMV IgG. ,QWHUSUHWDWLRQRIDYLGLW\LQWKHUHFRP%ORW&09,J* - Compare the intensities of the corresponding bands on the two test strips incubated with the same serum (IgG strip and avidity strip). Check whether the intensities have changed. Reactivities on the IgG strip below the cutoff control (very weak intensities) should not be considered. - At high avidity levels, the band intensity on the avidity strip is reduced either not at all or practically not at all (band intensity of 75 to 100% of the level on the IgG strip). At low avidity the intensity should be reduced by at least 50%. - Only the avidity maturation of DQWLERGLHV DJDLQVW ,( S DQ G&0 should be considered for advanced diagnostics. The avidity maturation of anti-p65 is highly variable and is therefore not suitable for this purpose. The avidity maturation of anti-gB1 and anti-gB2 is of secondary importance since, especially if there are no anti-gB2 antibodies, the findings will have to be clarified by means of avidity determination. - 25 - UHFRPBlot CMV IgG [Avidität] / IgM - ,QVWUXFWLRQVIRUXVH 0,.52*(1 Most likely a complete, or pronounced reduction in avidity (low avidity) LQ DW OHDVW WZR RI WKH DQWLERG\UHDFWLYLW\RI,(SDQG&0can be taken as a highly probable indication of a primary infection (within the last 14 weeks). - If two of the three relevant antibodies (anti-IE1, anti-p150 and anti-CM2) are highly avide, a former infection (> 6-8 weeks after infection) is highly probable. - Please consider that the maturation of avidity is a flowing process. The parallel occurrence of low and highly avide sera (between 6 – 14 weeks after infection) is not inconsistent but contributes to the individual maturation of avidity: Some patients could show highly avide sera already after 6 – 8 weeks whereas some patients sera are low avide until 14 weeks after infection (see also evaluation data 12.3). - Intermediate avidity (band intensity of 50 to 75% of the level on the IgG strip) gives no additional information about the infection time. - In general, no absolutely valid rules can be defined for avidity evaluation. The possibility of delayed avidity maturation must be considered, if former infections show low avide antibodies. - Interpretation of avidity must always be carried out in connection with the overall examination results. If indistinct or borderline results are obtained, it is recommended to test an additional patient sample after 2 to 3 weeks. &OLQLFDOUHVXOWV 6HQVLWLYLW\DQGVSHFLILFLW\ ,J* A total of sera were tested with UHFRPBlot CMV ,J* in comparison with a commercially available ELISA. This collective comprised samples from routine diagnostics, 15 CMV serum courses with a total of samples, 7 seroconversions with a total of sera, sera with previous IgM findings and samples with potentially problematical samples (autoimmune diseases, pregnancies, primary EBV infections, icteric, haemolytic or lipaemic sera). ,J* UHFRPBlot CMV IgG ELISA CMV IgG positive Negative Borderline positive 327 4 1 negative 2 193 10 borderline 0 8 2 The indeterminate positive results were not evaluated for sensitivity and specificity. Results of comparison with the commercial ELISA used: Specificity: 193/(4 + 193) x 100 = 98.0% Sensitivity: 327/(327 + 2) x 100 = 99.4% The results for 25 of the sera tested (4.4%) showed discrepancies (including the indeterminate findings): About half of these showed a stronger reactivity in UHFRPBlot; most of these samples can be explained in favour of UHFRPBlot, since most of them represent courses. The other half of the discrepant findings show a lower level of reactivity in the blot than the ELISA. All sera are at the lower detection limit for the IgG titre; these are variations or findings within the "cutoff" range. - 26 - 0,.52*(1 ,QVWUXFWLRQVIRUXVH UHFRPBlot CMV IgG [Avidität] / IgM ,J0 were tested in UHFRPBlot CMV ,J0 in comparison with a commercially available ELISA. With a few exceptions, these samples corresponds to the serum collective in the IgG evaluation. ELISA CMV IgM IgM UHFRPBlot CMV IgM positive Negative borderline positive 174 20 11 negative 3 308 2 borderline 5 28 7 The indeterminate positive results were not evaluated for sensitivity and specificity. Results of comparison with the commercial ELISA used: Specificity: 308/(20 + 308) x 100 = 93.9% Sensitivity: 174/(174 + 3) x 100 = 98.3% Stronger reactivity than with ELISA was recorded for a total of 58 samples. (ELISA negative/Blot positive (19); ELISA negative/Blot indeterminate (28); ELISA indeterminate/Blot positive (11)). About 3/4 of the results can be explained in favour of the Blot, e.g. concurrent high positive IgG titres, reactivations, recent first infections. In these cases, an IgM titre would appear probable and may be an expression of a greater IgM sensitivity of the Blot in certain samples. About 15 of the samples were either IgG-positive samples with a residual titre in IgM or IgG-negative sera with a non-specific IgM reaction only determined to be reactive in the Blot. Ten sera show a lower level of reactivity in the Blot than in ELISA (ELISA positive/Blot indeterminate (5) or negative (3), ELISA indeterminate/Blot negative (2)). Whereas 7 sera come from courses and seroconversions and the indeterminate/positive IgM result in the ELISA would be explicable, the remaining three samples require further clarification. (YDOXDWLRQGDWDIRUGHWHUPLQDWLRQRIGDWHRILQIHFWLRQ An external study involving 69 courses of seroconversions (totally 258 samples) was achieved. The results are summarised below. ,J*UHDFWLYLW\WRJ% In the external study the temporal occurrence of IgG antibodies against gB was analysed. About 17% of the courses already revealed antibodies against gB1 before 6 weeks after seroconversion. Normally antibodies against gB2 do not occur until 6 to 8 weeks after a primary infection. Only one course showed these antibodies earlier in time. Antibodies against gB2 exclude an infection within the first 6 to 8 weeks with high probability. $EVHQW,J*UHDFWLYLW\DJDLQVWSLQSULPDU\LQIHFWLRQ 29% (20 courses) of the external study did not show any IgG reactivity against p150 (otherwise IgG reactivity is positive) in the early infection stage. Mostly antibodies against p150 were formed within the first 6 to 8 weeks after infection (found in 19 of 20 courses). Only one course showed these antibodies later in time. Therefore absent antibodies against p150 indicate a primary infection within the first 6 to 8 weeks. ,J*UHDFWLYLW\DJDLQVWLVRODWHGSZLWKDQWLERGLHVDJDLQVWJ%DQGRUJ%LQIRUPHULQIHFWLRQ Isolated IgG antibodies against p150 (without any reactivity to IE1, CM2 and p65) and antibodies against gB1 and/or gB2 are characteristic for former infection. The external study revealed only one sample with this antibody pattern within 24 weeks after infection (the definite seroconversion point of this course was not reproducible). Therefore the occurrence of IgG antibodies against p150, gB1 and/or gB2 indicates a former infection (at least 6 months after seroconversion) normally. - 27 - UHFRPBlot CMV IgG [Avidität] / IgM ,QVWUXFWLRQVIRUXVH 0,.52*(1 $YLGLW\HYDOXDWLRQGDWD Detection of IgG and IgM antibodies and avidity determination using the UHFRPBlot CMV were carried out in an external laboratory. The reference ELISAs were commercially available and were applied according to manufacturer’s instructions. Totally 237 sera were analysed to observe the development of the immune response and of the course of avidity. The samples comprised blood donors (seropositive for CMV-ELISA since at least 2 years) and seroconversions respectively courses of primary infections. The onset of infection was defined either by the first positive serum or by the first appearance of clinical symptoms. 18 sera with negative or borderline diagnostic findings were excluded from the evaluation. Low avidity of at least two of three relevant antibodies (IE1, p150, CM2) indicated primary infection (within the last 14 weeks) in 96,3% (77/80). High avidity of at least two of three relevant antibodies(IE1, p150, CM2) presented former infections (> 6 – 8 weeks after seroconversion) in 98,4% (57/58). - 28 - 0,.52*(1 ,QVWUXFWLRQVIRUXVH UHFRPBlot CMV IgG [Avidität] / IgM /LWHUDWXUH (1) Brennan, D. C.: &\WRPHJDORYLUXVLQUHQDOWUDQVSODQWDWLRQ J. Am Soc Nephrol 2001 Apr., 12(4): 848-55 (2) Jahn, G., V.C. Scholl, B. Traupe, et al.: 7KHWZRPDMRUSKRVSKRSURWHLQVSSDQGSSRIKXPDQ&\WRPHJDORYLUXVDQGWKHLU DQWLJHQLFSURSHUWLHV J. Gen. Virol. 68 (1987) 1327-1337. (3) Landini, M. P., A. Ripalti, K. Sra, et al.: +XPDQ&\WRPHJDORYLUXVVWUXFWXUDOSURWHLQV,PPXQHUHDFWLRQDJDLQVWSSV\QWKHWLF SHSWLGHV J. Clin. Microbiol. 29 (1991) 1868-1872. (4) Weber, B., Prosser, F., Munkwitz, A., Doerr, H. W.: 6HURORJLFDOGLDJQRVLVRI&\WRPHJDORYLUXVLQIHFWLRQFRPSDULVRQRIHQ]\PH LPPXQRDVVD\VIRUWKHGHWHFWLRQRI+&09VSHFLILF,J0DQWLERG\ Clin. Diagn. Virology, 2 (1994): 245-259. (5) (6) (7) (8) Lazzarotto, T.; Galli, C.; Pulvirenti, R.; Rescaldani, R.; Vezzo, R.; La Gioia, A.; Martinelli, C.; La Rocca, S.; Agresti, G.; Grillner, L.; Nordin, M.; van Ranst, M.; Combs, B.; Maine, G.T.; Landini, M.P.:(YDOXDWLRQ RI WKH $EERWW $[6<0 &\WRPHJDORYLUXV &09 LPPXQRJOREXOLQ0,J0DVVD\LQFRQMXFWLRQZLWKRWKHU&09,J0WHVWVDQGD&09DYLGLW\DVVD\ Clin. Diagn. Lab Immunol 2001 Jan., 8(1): 196-8. Loenen, W.A., Bruggeman, C.A., Wiertz, E.J.: ,PPXQH HYDVLRQ E\ KXPDQ &\WRPHJDORYLUXV OHVVRQV LQ LPPXQRORJ\ DQG FHOO ELRORJ\Semin. Immunol. 2001 Feb.; 13(1): 41-9. Mach, M.; Kropff, B.; Dal Monte, P.; Britt, W.: &RPSOH[IRUPDWLRQE\KXPDQ&\WRPHJDORYLUXVJO\FRSURWHLQV0JS8/DQG1 JS8/ J. Virol 2000 Dez.; 74(24): 11881-92. Preiser, W.; Brauninger, S.; Schwerdtfeger, R.; Ayliffe, U.; Garson, J.A.; Brink, N.S.; Franck, S.; Doerr, H.W.; Rabenau, H.F.:(YDOXDWLRQ RIGLDJQRVWLFPHWKRGVIRUWKHGHWHFWLRQRI&\WRPHJDORYLUXVLQUHFLSLHQWVRIDOORJHQHLFVWHPFHOOWUDQVSODQWV J. Clin. Virol. 2001 Jan.; 20(1-2): 59-70. (9) (10) Prosch, S.; Reinke, P.; Volk, H.D.; Kruger, D.H.: =\WRPHJDOLHYLUXVLQIHNWLRQHQ EHL (SLGHPLRORJLH'LDJQRVWLN7KHUDSLH Internist (Berl.) 2000 Nov.; 41(11): 1253-60; 1262. Reimer K., Meisel H.: +XPDQHV =\WRPHJDOLHYLUXV in: T. Porstmann (Hrsg.) Diagnostische Bibliothek, Band 1; Virusdiagnostik, Blackwell Wissenschafts-Verlag Berlin.Wien 1996, 258-278. &\WRPHJDOLHYLUXV, in Labor und Diagnose, 5. Auflage, TH-Books Verlagsgesellschaft mbH, Frankfurt/Main, 1998; S.1262- (11) Thomas L.: 1263. (12) Trincardo, D. E., Rawlinson, W. D.: 37(2): 187-92 (13) (14) (15) (16) (17) (18) (19) 3DWLHQWHQ QDFK 2UJDQWUDQVSODQWDWLRQ &RQJHQLWDODQGSHULQDWDOLQIHFWLRQVZLWK&\WRPHJDORYLUXV J. Paediatr Child Health 2001 Apr., Vornhagen R., W. Hinderer, B. Plachter, G. Jahn, T.H. The and H.-H. Sonneborn &RQVWUXFWLRQ RI UHFRPELQDW DXWRORJRXV IXVLRQ SURWHLQVZKLFKHQDEOHV,J*VSHFLILFVHURGLDJQRVLVRISDVW+&09LQIHFWLRQBiotest Bulletin 5 1995, 221-227 Vornhagen Rolf, Bodo Plachter, Walter Hinderer, T.Hauw The, Jacoba van Zanten, Lukas Matter, Christian A. Schmidt, Hans-H. Sonneborn and Gerhard Jahn (DUO\ 6HURGLDJQRVLV RI$FXWH+XPDQ&\WRPHJDORYLUXV,QIHFWLRQE\(Q]\PHOLQNHG,PPXQRVRUEHQW $VVD\8VLQJ5HFRPELQDW$QWLJHQVJournal of Clinical Microbiology 1994, 981-986 Vornhagen Rolf, Walter Hinderer, Hans-H. Sonneborn, Gregor Bein, Lukas Matter, T. Hauw The, Gerhard Jahn and Bodo Plachter7KH '1$%LQGLQJ 3URWHLQ S8/ RI +XPDQ &\WRPHJDORYLUXV ,V D 0DMRU 7DUJHW $QWLJHQ IRU WKH ,PPXQRJOREXOLQ 0 $QWLERG\ 5HVSRQVHGXULQJ$FXWH,QIHFWLRQJournal of Clinical Microbiology 1995, 1927-1930 Vornhagen Rolf, Walter Hinderer, Hans-H. Sonneborn, Gregor Bein, Lukas Matter, T. Hauw The, Gerhard Jahn and Bodo Plachter ,PPXQRJOREXOLQ $6SHFLILF 6HURGLDJQRVLV RI $FXWH +XPDQ &\WRPHJDORYLUXV ,QIHFWLRQ E\ 8VLQJ 5HFRPELQDW 9LUDO $QWLJHQV.Journal of Clinical Microbiology 1996, 1020-1023 Sipewa M. J., Goubau P., Bodéus M.: (YDOXDWLRQ RI D &\WRPHJDORYLUXV *O\FRSURWHLQ % UHFRPELQDQW (Q]\PH ,PPXQRDVVD\ WR GLVFULPLQDWHEHWZHHQDUHFHQWDQGDSDVWLQIHFWLRQ. Journal of Clinical Microbiology 2002, 3689-3693 Lazzarotto T., Varani S., Guerra B., Nicolosi A., Lanari M., Landini M. P.: 3UHQDWDO LQGLFDWRUV RI FRQJHQLWDO &\WRPHJDORYLUXV LQIHFWLRQ. J. Pediatrics 2000, 90-95 Lazzarotto T., Spezzacatena P., Varani S., Gabrielli L., Pradelli P., Guerra B., Landini M. P.: $QWLF\WRPHJDORYLUXV $QWL&19 LPPXQRJOREXOLQ*DYLGLW\LQLGHQWLILFDWLRQRISUHJQDQWZRPHQDWULVNRIWUDQVPLWWLQJFRQJHQLWDO&09LQIHFWLRQ. Clin. Diagn. Lab. Immunol. 1999, 127-129 We will be pleased to send you further literature on diagnosis of CMV infections at your request. - 29 - UHFRPBlot CMV IgG [Avidität] / IgM ,QVWUXFWLRQVIRUXVH 0,.52*(1 ([SODQDWLRQVRIWKHV\PEROV Contains sufficient for < n > tests amount of tests y°C x°C Evaluation form Instructions for use Consult instructions for use Inhalt ist ausreichend für < n > Ansätze Anzahl der Ansätze Auswertebogen Gebrauchsinformation Gebrauchsinformation beachten Contains in vitro diagnostic device Batch code Do not freeze Inhalt, enthält In vitro Test Chargen-Nummer Nicht einfrieren Catalogue number Use by expiry date Temperature limitation Store between x°C and y°C Bestell-Nummer verwendbar bis Mindesthaltbarkeitsdatum Lagerung bei x°C bis y°C UHFRP%ORW&09,J* UHFRP%ORW&09,J0 Artikel-Nr./ Article No.: Artikel-Nr./ Article No.: optional als Zusatzreagenz zu 5502 HUKlOWOLFK: optionally DYDLODEOH in addition to Art.-No. 5502 Artikel-Nr./ Article No.: $YLGLWlWVUHDJHQ]$YLGLW\UHDJHQW Gebrauchsinformation Version/ Instructions for use version: GIRBCM011DE.DOC gültig ab/ valid from: Januar/ January 2006 0,.52*(1 GmbH Floriansbogen 2-4 D-82061 Neuried Germany www.mikrogen.de Tel: Fax: +49 (0)89 54 80 1-0 +49 (0)89 54 80 1-100 [email protected] QM-SYSTEM zertifiziert durch: QM System certified according to: - 30 -