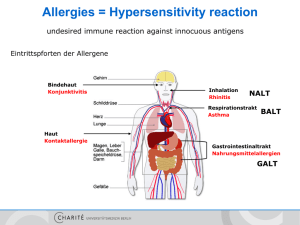
Induktion von Granzym B in humanen B
Werbung

Institut für Naturheilkunde und klinische Pharmakologie Universität Ulm (Direktor: Prof. Dr. med. Thomas Simmet) Induktion von Granzym B in humanen B-Zellen durch virale Antigene Dissertation zur Erlangung des Doktorgrades der Medizin der Medizinischen Fakultät der Universität Ulm Kai Sontheimer geboren in Mühlacker 2014 Amtierender Dekan: Prof. Dr. Thomas Wirth 1. Berichterstatter: Prof. Dr. Bernd Jahrsdörfer 2. Berichterstatter: Prof. Dr. Thomas Barth Tag der Promotion: 23. April 2015 Meinen Eltern I Inhaltsverzeichnis: Abkürzungsverzeichnis 1 2 Einleitung 4 1 1.1 Grundlagen der zellulären Immunreaktion auf Pathogene 1 1.2 Das Zytokin Interleukin 21 2 1.3 Die Serinprotease Granzym B 3 1.4 Zielsetzung der Arbeit 4 Material und Methoden 2.1 Material 3 III 5 5 2.1.1 Laborausstattung 5 2.1.2 Reagenzien und Kits 7 2.1.3 Antikörper und Fluorochrome 9 2.1.4 Puffer und Lösungen 9 2.1.5 Zellen 11 2.2 Methoden 11 2.2.1 Isolation von mononukleären Zellen aus peripherem Blut 11 2.2.2 Isolation von mononukleären Zellen aus Nabelschnurblut 12 2.2.3 B-Zell-Isolation 13 2.2.4 Zellkultur und Stimulation der Zellen 14 2.2.5 Durchflusszytometrie 14 2.2.6 Reverse Transkriptase-Polymerase-Kettenreaktion (RT-PCR) 16 2.2.7 Granzym B ELISpot 17 2.2.8 Konfokale Mikroskopie 18 2.2.9 Statistik 18 Ergebnisse 19 3.1 Induktion von Granzym B-mRNA in B-Zellen durch Interleukin 21 19 3.2 Granzym B-Expression in CD5+ B-Zellen aus Nabelschnurblut 21 3.3 Granzym B-Induktion durch virale Antigene in B-Zellen 23 3.4 CD5+ B-Zellen in Kontakt mit viralen Antigenen 25 3.5 Induktion von Granzym B in B-Zellen durch Toll-like-Rezeptor-Signale 27 3.6 Vergleich der Granzym B-Expression in CD5+ und CD5- B-Zellen 29 3.7 CD5+ B-Zellen sezernieren enzymatisch aktives Granzym B 31 Diskussion 4.1 De-novo-Synthese von Granzym B in B-Zellen durch Interleukin 21 33 33 II 4.2 Granzym B-Expression in B-Zellen durch virale Antigene 35 4.3 Besonderheiten Granzym B+ CD5+ B-Zellen 39 4.4 Mögliche Funktionen von Granzym B+ B-Zellen 41 5 Zusammenfassung 46 6 Literaturverzeichnis 48 Danksagung 58 Lebenslauf 59 III Abkürzungsverzeichnis: AGE Agarose gel electrophoresis Al(OH)3 Aluminiumhydroxid Anti-BCR AffiniPure F(ab´)2 fragment rabbit anti-human IgA+IgG+IgM (H+L) antibody BCIP/NBT-Puffer 5-bromo-4-chloro-3-indolyl-phosphate/nitroblue tetrazolium Puffer BCR B-Zell-Rezeptor Bp Basenpaar BSA Bovines Serum Albumin CBMC Cord blood mononuclear cell CD Cluster of differentiation cDNA Complementary DNA CLL Chronisch lymphatische Leukämie DMSO Dimethylsulfoxid DNA Desoxyribonukleinsäure dNTP Desoxyribonukleosid-triphosphate DTT Dithiothreitol EDTA Ethylendiamintetraacetat EK Endkonzentration im Versuchsansatz ELISpot Enzyme-linked immunosorbent spot FACS Flourescence-activated cell sorter FCS Fetal calf serum FSC Forwardscatter FSME Frühsommer-Meningoenzephalitis g Erdbeschleunigung GrB Granzym B HeLa Henrietta Lacks (Zelllinie) HCL Salzsäure Ig Immunglobulin IRS Inhibitory sequences I.U. International units JAK Janus-Kinase IV kDa Kilodalton KHCO3 Kaliumhydrogenkarbonat IL Interleukin MACS Magnetic activated cell sorting MgCl2 Magnesiumchlorid MHC Major histocompatibility complex M-MLV-RT Moloney murine leukemia virus reverse transcriptase mRNA Messenger RNA NaOH Natriumhydroxid NH4CL Ammoniumchlorid ODN Oligodesoxyribonukleotide PBMC Peripheral blood mononuclear cell PBS Dulbecco´s Phosphate Buffered Saline PBS-T 0,1 % Tween 20 in Dulbecco´s Phosphate Buffered Saline PCR Polymerase-Ketten-Reaktion PE R-Phycoerythrin PE-Cy5 R-Phycoerythrin-Cyanin 5 PerCP Peridinin-chlorophyll-protein complex RNA Ribonukleinsäure RPL-32 Ribosomal protein L32 RT-PCR Reverse Transkriptase-Polymerase-Kettenreaktion SDS Sodium dodecyl sulfate SEM Standard error of the mean SSC Sidewardscatter STAT Signal Transducer and Activator of Transcription TAE TRIS-Acetat-EDTA Taq Thermus aquaticus TLR Toll-like-Rezeptor TRIS Tris(hydroxymethyl)-aminoethan Einleitung 1 1 Einleitung 1.1 Grundlagen der zellulären Immunreaktion auf Pathogene Das Immunsystem des Menschen besteht aus einem angeborenen und einem erworbenen Teil. Das angeborene Immunsystem bildet die erste Barriere gegen Infektionen durch Viren, Bakterien, Parasiten oder Pilze. Wesentliche Bestandteile sind die Phagozyten, wie Makrophagen oder Granulozyten, welche lösliche Pathogene anhand ihrer, im menschlichen Organismus nicht vorkommenden Molekülstrukturen erkennen, aufnehmen und dadurch unschädlich machen. Neben den Phagozyten sind die Natürlichen Killerzellen (NK-Zellen) und die Natürlichen Killer-T-Zellen (NKT-Zellen) ebenfalls auf die direkte Erkennung evolutionär konservierter Antigenstrukturen als Gefahrensignale spezialisiert und übernehmen die frühzeitige Bekämpfung intrazellulärer Pathogene [1, 7, 89]. Die repetitiven Antigenstrukturen werden von den Zellen der angeborenen Immunität durch die Gruppe der pattern recognition receptors erkannt. Dazu zählen die Scavenger-Rezeptoren, die NOD-like-Rezeptoren, die RIG-I-like-Rezeptoren, C-Typ-Lektin-Rezeptoren und die verschiedenen Toll-like-Rezeptoren (TLR) [59]. Das adaptive Immunsystem hingegen erkennt Pathogene über hochspezialisierte, antigenspezifische Rezeptoren und erfordert dafür das Zusammenwirken verschiedener Zellarten mit gegenseitiger Stimulation. Antigene werden dabei von professionellen antigenpräsentierenden Zellen aufgenommen, prozessiert und über MHC-Klasse II Moleküle den CD4+ TH-Zellen präsentiert [84]. Diese veranlassen ihrerseits durch ZellZell-Interaktionen und Zytokinfreisetzung antigenspezifische B- und T-Zellen zur klonalen Vermehrung und initiieren die spezifische Immunantwort auf das Pathogen [17, 52, 58]. Dieser Prozess ist sehr zeitaufwändig und kann mehrere Tage in Anspruch nehmen. In dieser akuten Phase einer Infektion muss die angeborene Immunität ein Ausbreiten der Infektion verhindern, bis die adaptive Immunität vollständig etabliert ist [83]. Die zytotoxische Immunantwort gegen eine virusinfizierte Zelle erfolgt durch NK-Zellen, NKT-Zellen oder spezifische CD8+T-Zellen. Diese sogenannten Killerzellen besitzen hierfür spezielle Oganellen, die zytotoxischen Granula, welche einen lytischen Enzymkomplex aus Granzym B (GrB), Perforin, Cathepsin C und Serglycin enthalten [55, 73]. Neben diesen Killerzellen ist bis heute keine weitere Lymphozytenpopulation dafür bekannt, eine GrB-vermittelte, zytotoxische Immunreaktion zu induzieren. Einleitung 2 1.2 Das Zytokin Interleukin 21 Interleukin 21 (IL-21) ist ein, im Jahr 2000 neu entdecktes, Zytokin aus der Interleukin 2-Familie [65]. Der IL-21-Rezeptor gehört zu den Klasse-I-Zytokinrezeptoren und besitzt einen IL-21-spezifischen Anteil und einen Anteil, den er sich mit weiteren Zytokinen der Interleukin 2-Familie teilt. Diese gemeinsame γ-Kette der Zytokinrezeptoren für IL-2, IL-4, IL-7, IL-9, IL-15 und IL-21 wird wegen Ihrer Homologie innerhalb der Gruppe auch als common γ-chain (γc) bezeichnet [2]. Eine Mutation im Gen des γc-Teil führt zu einem Ausfall der Signaltransduktion durch den Rezeptor und ist Ursache für die angeborene Immunschwäche X-linked severe combined immunodeficiency (XSCID), bei der keine natürlichen Killerzellen (NK-Zellen) und T-Zellen gebildet werden können, und es zur Ausbildung nicht funktionsfähiger B-Zellen kommt [62]. Die Signaltransduktion durch den IL21-Rezeptor erfolgt über den JAK/STAT-Signalweg mit Aktivierung der Janus-Kinasen (JAK) 1 und 3 und nachfolgender Aktivierung der Signal Transducer and Activator of Transcription (STAT) 1, 3, 5a und 5b [32, 48]. IL-21 wird hauptsächlich von NKT-Zellen und CD4+ T-Zellen produziert [20, 65]. Es ist eines der ersten Zytokine, die bei einer viralen Infektion in erhöhten Konzentrationen im Blut gefunden werden [82] und wirkt auf verschiedene Zellen des Immunsystems. Der IL21-Rezeptor wurde bereits auf Lymphozyten, wie B- und T-Zellen, aber auch auf NK-Zellen, dentritische Zellen und Makrophagen identifiziert [11, 43, 63, 65]. Für die Ergebnisse dieser Arbeit sind vor allem die Wirkungen von IL-21 auf B- und T-Zellen von Bedeutung. In CD8+ T-Zellen und in NK-Zellen führt IL-21 zu einer Proliferation und zu einer erhöhten zytotoxischen Aktivität der Zellen [54, 65]. Dabei wird die Transkription von Granzym B-mRNA in den zytotoxischen Zellen durch Interleukin 21 induziert [53, 93]. In B-Zellen ist die Wirkung von IL-21 abhängig von der auf die Zellen einwirkenden Kostimulation. Zum Einen kann IL-21 eine apoptotische Wirkung auf B-Zellen haben oder einen Zell-Zyklus-Arrest induzieren, wenn diese keinerlei Kostimulation erfahren [43]. Zum Anderen führt eine Kostimulation durch CD40-Ligand oder B-Zell-Rezeptoraktivierung zu einer Proliferation der B-Zellen und zur Differenzierung zu Plasmazellen [25, 49]. Einleitung 3 In B-Zellen von Patienten mit chronisch lymphatischer Leukämie konnte durch Stimulation mit IL-21, zusammen mit B-Zell-Rezeptor aktivierenden Antikörpern oder CpG Oligodesoxyribonukleotiden (ODN), die Induktion der Serinprotease Granzym B nachgewiesen werden [41]. Diese interessanten, neuen Ergebnisse zur B-ZellDifferenzierung konnten zuletzt von unserer Arbeitsgruppe auch in B-Zellen gesunder Spender reproduziert werden [33] und legen die Vermutung nahe, dass diese GrB-prduzierenden B-Zellen im menschlichen Immunsystem eine bisher unbekannte physiologische Rolle einnehmen könnten. 1.3 Die Serinprotease Granzym B Granzym B (GrB) ist ein wichtiger Bestandteil der zytotoxischen Granula von CD8+ T-Zellen und NK-Zellen [55]. Es handelt sich um eine Serinprotease mit einem Molekulargewicht von 32 kDa, welche ihre Substrate bevorzugt nach Aspartatresten spaltet [77]. Die Produktion des Granzym B erfolgt als inaktives Proenzym, um eine Apoptose in der Effektorzelle zu verhindern. Nach dem Transport vom Golgi-Apparat in die lysosomalen Granula findet die Aktivierung des Granzym B durch Cathepsin C statt. Anschließend liegt das aktive Granzym B an Serglycin gebunden vor [69]. Ein weiterer essentieller Bestandteil der zytotoxischen Organellen ist das lytisch wirkende Protein Perforin [83]. Zusammen werden diese Inhaltstoffe freigesetzt, um eine virusinfizierte oder maligne entartete Zielzelle zu attackieren. Dazu bilden die Lymphozyten nach Erkennung eines passenden Antigens durch ihren Rezeptor eine sekretorische Synapse aus und entleeren den Inhalt der Granula in den synaptischen Spalt [9]. Nach der Translokation von Granzym B in das Zytoplasma der Zielzelle durch Perforin [44] induziert Granzym B die Apoptose entweder durch Spaltung der Caspasen 3, 7, 8 und 10, oder durch den Caspase-unabhängigen Weg mit Spaltung von BID3 und Freisetzung von Cytochrom C aus den Mitochondrien [55, 83]. Neben diesen für die Induktion der Apoptose wichtigen Substrate für Granzym B wurden in den letzten Jahren auch extrazellulär vorkommende Substrate von Granzym B beschrieben, was alternative Funktionen des Granzym B vermuten lässt. So konnte gezeigt werden, dass Granzym B den Wachstumsfaktor für Fibroblasten FGFR1 schneidet und damit wachstumshemmend wirken kann [57]. Außerdem scheint ein Einfluss auf die Blutgerinnung durch Spaltung des für die Thrombozytenfunktion essentiellen Einleitung 4 von-Willebrandt-Faktors (vWF) möglich zu sein [14]. Auch eine Mitwirkung von Granzym B beim Umbau der extrazellulären Matrix durch Spaltung von Proteoglycanen wurde beschrieben [26]. Dies könnte unter anderem für degenerative Gelenkerkrankungen mit einem erhöhten GrB-Spiegel im Blut von Bedeutung sein [13]. Zusätzlich konnte eine Prozessierung von Autoantigenen durch Granzym B nachgewiesen werden [21, 71] und die Spaltung des Acetylcholin-Rezeptors, mit einer möglichen Beteiligung an der Entstehung einer Myasthenia gravis [16]. Als GrB-Produzenten für diese alternativen Funktionen wurden bereits einige nicht-zytotoxische Zellarten beim Menschen identifiziert. So konnte Granzym B bereits in Mastzellen, basophilen Granulozyten, Makrophagen, dentritischen Zellen, und in neutrophilen Granulozyten nachgewiesen werden [42, 46, 70, 81, 85, 88]. Nicht zuletzt wurde die Expression von Granzym B sowohl in B-Zellen von Patienten mit chronisch lymphatischer Leukämie (CLL), als auch in B-Zellen gesunder Probanden nachgewiesen [33, 41]. 1.4 Zielsetzung der Arbeit Basierend auf den zuvor beschriebenen Ergebnissen war es das Ziel der vorliegenden Arbeit, die GrB-Expression in B-Zellen zu analysieren, um erste Hinweise auf eine mögliche physiologische Funktion dieser neu entdeckten B-Zell-Population zu finden. Um eine in-vivo-Relevanz der in vitro gewonnen Erkenntnisse zu belegen, sollte ein natürlicher Stimulus für die GrB-Induktion in B-Zellen identifiziert und die GrB-Expression auf m-RNA-Ebene untersucht werden. Dabei lag das Hauptaugenmerk auf einer möglichen Beteiligung der GrB+ B-Zellen an der antiviralen Immunantwort, da in einer frühen Phase der Infektion bereits hohe IL-21-Spiegel im Blut gemessen werden können. Die CD5+ B-Zellen sollten dabei im Speziellen untersucht werden, da sie einerseits als Produzenten der natürlichen IgM-Antikörper einem eher primitiven und unspezifischen Teil des Immunsystems zugerechnet werden und damit eine breitere Palette an Antigenen erkennen können. Andererseits gelang der erste Nachweis von GrB in B-Zellen bei CLL-Patienten, welche ebenfalls das CD5-Molekül exprimieren. Abschließend sollte die Frage beantwortet werden, ob GrB+ B-Zellen in der Lage sind, an einer zytotoxischen Immunantwort mitzuwirken. Material und Methoden 5 2 Material und Methoden 2.1 Material Nachfolgend sind alle verwendeten Materialen und Gerätschaften tabellarisch aufgeführt. 2.1.1 Laborausstattung Tabelle 1: Laborausstattung Produkt: Hersteller: CellQuest Pro™ BD Bioscienses Heidelberg, D Durchflusszytometer: FACScan BD Immunozytometrische Systeme, Heidelberg, D Elispot PVDF-Boden Platten Millipore, Bradford, MA, USA (96-well) Eppendorfgefäße Sarstedt, Nümbrecht, D FACS-Röhrchen Sarstedt, Nümbrecht, D Falcon™ Pipetten für Pipettierhilfe BD Biosciences, Heidelberg, D Feinwaage Sartorius AG, Göttingen, D FlowJo Software Tree Star, Ashland, Oregon, USA (Version 8.7.1) Flächendesinfektionsmittel Sigma-Aldrich Laborchemikalien GmbH, (Isopropanol 70%) München, D Gel Kammer Bio-Rad Laboratories GmbH, München, D Gene Amp PCR System 9700 Applied Biosystems, Darmstadt, D Handdesinfektionsmittel Aseptoman®Pur Desomed, Freiburg,D Handschuhe (Latex, puderfrei) Ansell Healthcare, Brüssel, B Handschuhe (Nitril, puderfrei) Ansell Healthcare, Brüssel, B Heizblock Memmert GmbH, Schwarbach, D ibiTreat®-chamber-slide ibidi, Martinsried, D Imunnospot 3 software CTL Cellular Technology Ltd., Cleveland, OH, USA Imunnospot Series 1 Analyzer CTL Cellular Technology Ltd., Cleveland, OH, USA Inkubator Thermo Forma Inc. Waltham, MA, USA Material und Methoden 6 Konfokales Mikroskop: - CSU10 confocal scan head Yokogawa, Tokyo, Japan - Inverses Mikroskop: Axio Observer Zeiss, Göttingen, D - Ölimmersionsobjektiv: Olympus, Hamburg, D - UPlanSApo x60/1.35 - Environmental control Pecon, Erbach, D - Bild-Splitter: OptoSplit II Cairn Reasearch, Faversham, UK - EMCCD Kamera (DV-887) Andor, Bethesda, MD, USA - Software Bildprozessierung NIH, Bethesda, MD, USA Kühl-Gefrierkombination Liebherr-Hausgeräte, Ochsenhausen, D Lichtmikroskop: Olympus CK-2 Olympus, Hamburg, D LS-MACS Trennsäulen Miltenyi Biotec, Bergisch Gladbach, D Magnetrührer: IKAMAG Rec G IKA Labortechnik, Staufen,D Microsoft Office 2004 für Mac Microsoft Corporation Redmond, WA, USA MidiMACS™-Seperator Miltenyi Biotec, Bergisch Gladbach, D Milli-Q® Wasseraufbereitungssystem Millipore, Bredford, MA, USA Multikanalpipette VWR International, Lutterworth, UK Multiwell Rundboden Kulturplatten BD Biosciences Heidelberg, D (48- und 96-well) Pipetten (2 µl; 20 µl; 100µl ; 200 µl; Eppendorf AG, Hamburg, D 1000µl) Pipettenspitzen Eppendorf AG, Hamburg, D Pipettierhilfe: Pipetboy comfort/acu Integra Biosciences, Farnwald, D Polypropylen-Falcon™-Röhrchen 15ml, BD Biosciences Heidelberg, D 50ml Power Pack Bio-Rad Laboratories GmbH, München, D Safety-Multifly®-Kanülen Sarstedt, Nümbrecht, D Schüttelgerät: Vortex-Genie 2 Scientific Industries, Inc., Bohemia, NY Sterilbank BDK, Luft und Steriltechnik GmbH, Sonnenbühl, D Vacutainer® Multi Sample Luer Adapters BD Biosciences Heidelberg, D Vacutainer® One-Use-Holder BD Biosciences Heidelberg, D Material und Methoden Vacutainer®-Röhrchen 10ml, 7 BD Biosciences Heidelberg, D 170 I.U. Na-Heparin Vakuum Pumpe: Vaccum Regulator, BioRad Laboratories, Hercules, USA Flow Rate 900 cu ft/min Vernichtungsbeutel Sarstedt, Nümbrecht, D Wasserbad Julabo Innovate Temperature Technology, Seelbach, D Zählkammer (Neubauer) Brand, Wertheim, D Zellkulturflaschen T175 Sarstedt, Nümbrecht, D Zellschaber Sarstedt, Nümbrecht, D Zentrifuge: Hettich Rotina 48RS HettichLab, Wertheim, D Zentrifuge: Sigma 4K-15 Sigma Laborzentrifugen GmbH, Osterode am Harz, D Zentrifuge: Sigma 2K-15 Sigma Laborzentrifugen GmbH, Osterode am Harz, D 2.1.2 Reagenzien und Kits Tabelle 2: Reagenzien und Kits Produkt: Hersteller: Agarose TAE Blend 2% Sigma-Aldrich Laborchemikalien GmbH, München, D AIM-V Medium Gibco BRL, Grand Island, New York, USA Aluminiumhydroxid (Al(OH)3) Sigma-Aldrich Laborchemikalien GmbH, München, D Ammoniumchlorid (NH4Cl) Merck, Darmstadt, D B Cell Isolation Kit II Miltenyi Biotec, Bergisch Gladbach, D Biocoll Trennlösung Biochrome AG, Berlin, D Bovines Serum Albumin (BSA) Carl Roth GmbH & Co. KG, Karlsruhe, D Brefeldin A Epicentre Biotechnologies, Madison WI, USA Bromphenolblau Sigma-Aldrich Laborchemikalien GmbH, München, D CpG ODN 2243 (IRS ctr.) Coley Pharmaceuticals, Langenfeld, D Material und Methoden Dimethylsulfoxid (DMSO) 8 Sigma-Aldrich Laborchemikalien GmbH, München, D Dinatrium-ethylendiamin-tetraacetat Merck, Darmstadt, D Dihydrat (Na2EDTA) Dithiothreitol (DTT) Sigma-Aldrich Laborchemikalien GmbH, München, D dNTP Mix 10 mM Invitrogen, Carlsbad, CA, USA Dulbecco´s Phosphate Buffered Saline PAA The Cell Culture Company, Pasching, (PBS) A Ethanol 70% Merck, Darmstadt, D Ethidiumbromid Lösung Sigma-Aldrich Laborchemikalien GmbH, München, D Fetal calf serum (FCS) PAA Laboratories GmbH, Cölbe, D FSME IMMUN Erwachsene Baxter, Heidelberg, D Human Granzyme B Elispot kit GenProbe Diaclone, Besacon, F Kaliumhydrogenkarbonat (KHCO3) Merck, Darmstadt, D Magnesium Chlorid (MgCl2) 50 mM Invitrogen, Carlsbad, CA, USA Natriumhydroxid (NaOH) Merck, Darmstadt, D Oligonukleotide (IRS 661; IRS 869) Biomers, Ulm, D Paraformaldehyd Merck, Darmstadt, D PCR-Ladder 100 Basenpaare (Bp) Thermo Scientific, Schwerte, D PCR Primer Biomers, Ulm, D PCR-Puffer (10 x) Invitrogen, Carlsbad, CA, USA Penicillin/Streptomycin (100 x) PAA Laboratories GmbH, Cölbe, D’ Recombinant human interleukin-21 (IL-21) BioSource, Camarillo, CA, USA RPMI-1640 Medium Sigma-Aldrich Laborchemikalien GmbH, München, D Saccharose Sigma-Aldrich Laborchemikalien GmbH, München, D Saponin AppliChem, Darmstadt, D Sodium dodecyl sulfate (SDS) Sigma-Aldrich Laborchemikalien GmbH, München, D Taq DNA Polymerase Invitrogen, Carlsbad, CA, USA Material und Methoden 9 Trypanblau Biochrom AG, Berlin, D Tween® 20 Sigma-Aldrich Laborchemikalien GmbH, München, D 2.1.3 Antikörper und Fluorochrome Tabelle 3 Antikörper und Fluorochrome Produkt: Hersteller: Affin pure F(ab´)2 fragment rabbit Jackson ImmunoResearch Laboratories, anti-human IgA+IgG+IgM (H+L) Inc., West Grove, PA, USA (anti-BCR) Anti-human Granzym B (Klon GB 12) Invitrogen, Carlsbad, CA, USA R-Phycoerythrin (PE) CD19 Peridinin-chlorophyll-protein BD Biosciences, Heidelberg, D complex (PerCP) CD19 R-Phycoerythrin (PE) BD Biosciences, Heidelberg, D CD5 R-Phycoerythrin-Cyanin5 (PE-Cy5) BD Biosciences, Heidelberg, D CellMask™ Deep Red-Membranfärbung Invitrogen, Carlsbad, CA, USA Dynabeads mRNA DIRECT kit Invitrogen, Carlsbad, CA, USA Fc-Rezeptor Block-Reagenz Miltenyi Biotec, Bergisch Gladbach, D GranToxiLux™ fluorogenes GrB-Substrat OncolImmunin Inc., Gaithersburg, MD, USA Isotypenkontrolle Maus IgG1 GE Healthcare, München, D R-Phycoerythrin (PE) 2.1.4 Puffer und Lösungen Tabelle 4 Puffer und Lösungen Produkt: Zusammensetzung: 10 x PCR-Puffer - Mg 200 mM TRIS-HCl (pH 8,4) 500 mM KCl 5 x Reverse transcriptase (RT)-Puffer 250 mM TRIS-HCI (pH 8,3) 375 mM KC1 15 mM MgCl2 Material und Methoden AGE loading dye (10 x) 10 6,67 g Saccharose in 10 ml A. dest. 0,025% Bromphenolblau 1% SDS 0,1 mM EDTA ACK-Lyse-Puffer 0,15 M NH4Cl 1 mM KHCO3 0,1 mM Na2EDTA MilliQ (Reinstwasser) Blockier-Puffer 1% BSA in PBS 0,5% Tween® 20 Buffer A (Dynabeads mRNA DIRECT kit) 10 mM TRIS-HCl (pH 7,5) 0.15 M LiCl 1 mM EDTA 0.1% LiDS Buffer B (Dynabeads mRNA DIRECT kit) 10 mM TRIS-HCl (pH 7,5) 0.15 M LiCl 1 mM EDTA cDNA converter buffer mastermix 1 µl 0,1 M DTT (per sample) 1 µl DMSO 7 µl MilliQ-Wasser 4 µl 5x RT Puffer 1 µl 10mM dNTP Fixations-Puffer 20 g Paraformaldehyd 250 ml MilliQ 5 ml 1 M NaOH 50 ml 10-fach PBS Lysis-Buffer 100 mM TRIS-HCl (pH 7,5) (Dynabeads mRNA DIRECT kit) 500 mM LiCl 10 mM EDTA (pH 8,0) 1% LiDS 5 mM Dithiothreitol (DTT) MACS-Puffer 1 l PBS 0,5% BSA 2 mM EDTA Material und Methoden PCR mastermix (per sample) 11 14,5 µl steriles aqua destillata 2,5 µl 10 x PCR-Puffer - Mg 0,75 µl 50 mM MgCl2 0,5 µl dNTP 1 µl 10 mM forward Primer 1 µl 10 mM reverse Primer Permeabilisierungs-Puffer 0,25% Saponin in PBS TE Puffer 10 mM TRIS-HCL (pH 8,0) 1 mM EDTA 2.1.5 Zellen Die Isolation von B-Zellen erfolgte aus dem Blut erwachsener, gesunder Spender. Die Spenden erfolgten freiwillig, nach ausführlicher Aufklärung und Einwilligung in die Teilnahme an der Studie: „Granzym B-sezernierende B-Zellen: Physiologische Bedeutung und neuer Ansatz für die Therapie B-Zell-abhängiger Erkrankungen“. Die Isolation der CD5+ B-Zellen erfolgte aus Nabelschnurblut nach primärer Sectio caesarea. Die Spenden erfolgten freiwillig, nach informierter Einwilligung der Mütter in die Teilnahme an der Studie: „Granzym-B-sezernierende B-Zellen: Physiologische Bedeutung und neuer Ansatz für die Therapie B-Zell-abhängiger Erkrankungen – B1-Zellen aus Nabelschnurblut“. Beide Studien wurden von der Ethikkommission der Universität Ulm geprüft und bewilligt. Die verwendeten Cervix-Karzinomzellen (HeLa-Zellen) stammen von der University of Iowa, Iowa City, USA. Sie wurden in Zellkulturflaschen in dem Nährmedium RPMI-1640 mit 10% FCS und 1% Penicillin/Streptomycin kultiviert. 2.2 Methoden 2.2.1 Isolation von mononukleären Zellen aus peripherem Blut Die Gewinnung von mononuklären Zellen aus peripherem Blut, im Weiteren als peripheral blood mononuclear cells (PBMCs) beschrieben, erfolgte aus heparinisiertem Vollblut. Am Tag der Isolation wurden den Probanden 150 ml Blut aus einer Armvene abgenommen. Die Abnahme erfolgte mit einer Butterflykanüle (21 Gauge) und einem Vacutainer-System (170 I.U. Heparin/10 ml). Die entnommenen 150 ml Vollblut wurden mit Dulbecco´s Phosphate Buffered Saline (PBS) im Verhältnis 1:3 verdünnt. Jeweils 35 ml des verdünnten Vollblutes wurden langsam auf 15 ml Biocoll-Trennlösung in 50 ml Röhrchen Material und Methoden 12 geschichtet. Die Biocoll-Trennlösung wurde zuvor im Wasserbad auf 37 °C erwärmt. Die Abtrennung der Erythrozyten und der Granulozyten erfolgte durch einen Dichtegradienten bei Zentrifugation (Sigma 4K-15) mit 1000 g Beschleunigung für 15 Minuten bei 20 °C. Anschließend wurde der Buffycoat, mit den enthaltenen PBMCs, über dem Biocoll mit einer 10 ml Pipette vorsichtig abgenommen und in neue Röhrchen überführt. Zur Entfernung des mit abgenommenen Biocolls, wurden die Zellen einmal in PBS gewaschen. Dazu wurden die Zellsuspensionen mit PBS im Verhältnis 1:2 verdünnt und mit 400 g Beschleunigung für zehn Minuten bei 20 °C zentrifugiert (Sigma 4K-15). Der Überstand wurde abgeschüttet und die verbleibende Flüssigkeit über den Zell-Pellets mit einer 200 µl Pipette vollständig abgenommen. Anschließend wurden die Zellen in jedem Röhrchen in 1000 µl PBS resuspendiert und in ein einziges Röhrchen überführt. Die Abscheidung der Thrombozyten von den PBMCs erfolgte mit einer niedrigen Beschleunigung von 200 g für 15 Minuten bei 20 °C. Die leichteren Thrombozyten verblieben hierbei in dem Überstand direkt über dem Pellet und wurden durch sorgfältiges Absaugen mit einer 200 µl Pipette entfernt. Nach Resuspension der Zellen in 500 µl PBS wurde 5 ml ACK-Lyse-Puffer zugegeben, um die verbliebenen Erythrozyten durch ihre verminderte osmotische Resistenz zu lysieren. Nach sieben Minuten wurde die Lyse durch Hinzufügen von 45 ml PBS gestoppt. Die Zellen wurden anschließend bei 4 °C und 400 g Beschleunigung für sieben Minuten zentrifugiert (Hettich Rotina 48RS), um den Lyse-Puffer auszuwaschen. Nach Abgießen des Überstandes erfolgte die Resuspension der so gewonnen PBMCs in 50 ml PBS. Die Zellen wurden danach in der Neubaur-Zählkammer gezählt und in gewünschter Anzahl für die Isolation der einzelnen Lymphozytenpopulationen verwendet. 2.2.2 Isolation von mononukleären Zellen aus Nabelschnurblut Für die Isolation der mononukleären Zellen des Nabelschnurblutes, im Weiteren als Cord blood mononuclear cells (CBMCs) bezeichnet, wurden aus den Nabelschnurgefäßen circa 50 ml Blut entnommen. Die Abnahme erfolgte in einer sterilen 20 ml Spritze mit einer 20 Gauge-Kanüle. Das Blut wurde unverzüglich in heparinisierte Vacutainer-Röhrchen (170 I.U. Heparin/10 ml) überführt und anschließend mit PBS im Verhältnis 1:5 verdünnt. 35 ml der verdünnten Lösung wurden langsam auf 15 ml Biocoll geschichtet. Das weitere Vorgehen entsprach im Wesentlichen der oben beschriebenen PBMC-Isolation. Im Falle einer sichtbaren Verunreinigung des Buffycoats durch zahlreiche Erythrozyten erfolgte eine zweite Biocoll-Isolation. Für diesen Zwischenschritt wurden die Zellen gesammelt und bei 4 °C und 400 g Beschleunigung für sieben Minuten zentrifugiert (Hettich Rotina 48RS). Für die Resuspension des Zellpellets wurde der, zuvor gesammelte, Material und Methoden 13 Überstand der ersten Biocoll-Isolation verwendet. Auf diese Weise konnte eine vergleichbare Dichte der Zellsuspension erreicht werden. Von den 70 ml der Lösung wurden jeweils 35 ml auf 15 ml Biocoll geschichtet und mit 1000 g Beschleunigung für 15 Minuten bei 20 °C zentrifugiert (Sigma 4K-15). Durch diesen Zwischenschritt konnten die meisten im Buffycoat zurückgebliebenen Erythrozyten entfernt werden. Alle Weiteren Schritte der Isolation wurden nun analog zur oben beschriebenen PBMC-Isolation nach dem Sammeln des Buffycoats durchgeführt. 2.2.3 B-Zell-Isolation Die B-Zell-Isolation aus den PBMCs und CBMCs erfolgte durch negative Selektion mittels Magnetic activated cell sorting (MACS). Das verwendete B Cell Isolation Kit II der Firma Miltenyi enthält Biotin-gekoppelte Primärantikörper gegen die Oberflächenantigene: cluster of differentiation (CD)-2, CD14, CD16, CD36, CD43 und CD235a. Diese werden auf NK-Zellen, T-Zellen, dendritischen Zellen, Granulozyten, Monozyten und Erythrozyten exprimiert, fehlen jedoch auf B-Zellen. Dadurch werden alle Zellen, außer der gewünschten B-Zell-Population mit dem Primärantikörper markiert. In einem zweiten Schritt wird der Primärantikörper mit einem anti-Biotin-Antikörper gekoppelt. Dieser Sekundärantikörper ist an paramagnetische Teilchen (microBeads) gebunden und ermöglicht damit eine Trennung der Zellpopulationen in einem Magnetfeld. Die gesamte Isolation wurde gekühlt auf Eis durchgeführt, um eine unspezifische Antikörperbindung zu verhindern. Die Zellen wurden bei 4 °C und 400 g Beschleunigung für sieben Minuten zentrifugiert (Hettich Rotina 48RS). Das Pellet wurde in 20 µl MACS-Puffer pro zehn Millionen Zellen resuspendiert und 5 µl des Biotingekoppelten Primärantikörpers pro zehn Millionen Zellen zugegeben. Nach Überführung in ein neues Röhrchen, wurden die Zellen für zehn Minuten bei 4 °C inkubiert, um eine Bindung der Antikörper an die Zielstrukturen zu ermöglichen. Als Nächstes wurden jeweils 15 µl MACS-Puffer und 10 µl anti-Biotin-Antikörper pro zehn Millionen Zellen zugegeben. Erneut erfolgte der Transfer in ein neues Röhrchen, um den Anteil der Zellen ohne Kontakt zu den paramagnetischen Antikörpern zu minimieren. Nach 15-minütiger Inkubation bei 4 °C wurden die Zellen mit 2 ml MACS-Puffer pro zehn Millionen Zellen gewaschen. Nach siebenminütiger Zentrifugation (Hettich Rotina 48RS) bei 4 °C und 400 g Beschleunigung, wurden die Zellen in 500 µl MACS-Puffer pro 100 Millionen Zellen resuspendiert. Für die Negativselektion der B-Zellen wurden die, mit Eisenwolle gefüllten, LS-MACS-Trennsäulen in dem MidiMACS™-Seperator platziert. Die Säulen wurden mit 3 ml MACS-Puffer gespült und anschließend jeweils mit maximal Material und Methoden 14 100 Millionen Zellen pro Säule beladen. Durch das Magnetfeld im Separator wurden die, mit microBeads-Antikörpern gekoppelten, Zellen an der Eisenwolle adsorbiert und zurückgehalten. Um die Ausbeute an B-Zellen zu erhöhen, wurde jede Säule dreimal mit je 3 ml MACS-Puffer gespült. Die B-Zellen wurden gezählt und in AIM-V Medium überführt. Zur Überprüfung Phycoerythrin (PE)-markierten der Reinheit wurden anti-CD19-Antikörpern die gefärbt Zellen mit und im Durchflusszytometer gemessen. Die Reinheit lag dabei stets über 99%. Die Fraktion der zurückgehaltenen nicht-B-Zellen wurde für Kontrollen aus den Säulen gespült, nachdem diese aus dem Magnetfeld entfern wurden und ebenfalls in AIM-V Medium überführt. 2.2.4 Zellkultur und Stimulation der Zellen Die B-Zellen wurden für die angegebenen Zeitspannen in AIM-V Medium bei 37 °C und 5% CO2 inkubiert. Die Konzentration der Zellen in den 96-well-Runboden Platten betrug 1x106 Zellen pro Milliliter in einem Volumen von 200 µl/well. Die Stimulation der Zellen erfolgte mit den jeweils angegebenen Reagenzien. Interleukin-21 (IL-21) wurde in einer Endkonzentration (EK) von 50 ng/ml eingesetzt. Für die Aktivierung des B-Zell-Rezeptors wurde Affin pure F(ab´)2 fragment rabbit anti-human IgA+IgG+IgM (H+L) antibody (anti-BCR) in einer EK von 6,5 µg/ml eingesetzt. Für die Stimulation der Zellen mit viralen Antigenen wurde der Impfstoff FSME-Immun eingesetz. Dieser enthält FSME-Antigene (Stamm Neudörfl) adsorbiert an 0,35 mg Aluminiumhydroxid (Al(OH)3). Zur Hemmung der Toll-like Rezeptor (TLR)-Signaltransduktion wurden folgende Oligodesoxyribonukleotide (ODN) in den angegebenen Konzentrationen eingesetzt: IRS 661 (5´-TGCTTGCAAGCTTGCAAGCA-3´) IRS 896 (5´-TCCTGGAGGGGTTGT-3´) gegegn gegen TLR7-Aktivierung, TLR9-Aktivierung und IRS ctr. (5´-TCCTGCAGGTTAAGT-3´) ohne eine inhibitorische Wirkung auf beide Rezeptortypen. 2.2.5 Durchflusszytometrie Für die Analyse im Durchflusszytometer wurden die Zellen nach der angegebenen Zeit aus ihren Kulturplatten in Flourescence-activated cell sorter (FACS)-Röhrchen überführt. Die bei der Vorbereitung der Zellen nötigen Waschschritte, wurden jeweils wie folgt durchgeführt: Zu den abgenommenen Zellen wurden 3 ml PBS in die Röhrchen gegeben. Anschließend erfolgte die Sedimentation in der Zentrifuge (Hettich Rotina 48RS) bei 400 g Beschleunigung für sieben Minuten und 4 °C. Der Überstand wurde danach vorsichtig bis auf ungefähr 200 µl abgesaugt. Die darin enthaltenen Zellen wurden Material und Methoden 15 resuspendiert und waren bereit für die Analyse im Zytometer, oder die weitere Färbung mit fluoreszierenden Antikörpern. Oberflächenfärbung: Für die Analyse von Oberflächenantigenen wurden die Zellen einmal gewaschen, um das rote Medium zu entfernen. Anschließend erfolgte die Inkubation mit 5 µl des jeweiligen Antikörpers, gegen das zu untersuchende Antigen, für 15 Minuten bei Raumtemperatur. Nach erneutem Waschen in PBS wurden die Zellen im Durchflusszytometer analysiert. Intrazelluläre Färbung auf Granzym B: Für die intrazelluläre Färbung auf Granzym B (GrB) wurden die Zellen nach der angegebenen Zeitspanne mit Brefeldin A, in einer Endkonzentration (EK) im well von 1 µg/ml für weitere vier Stunden bei 37 °C und 5% CO2 inkubiert. Dadurch wurde die Proteinsekretion der Zellen gehemmt und das synthetisierte GrB intrazellulär gespeichert. Anschließend wurden die Zellen in FACS-Röhrchen überführt und mit PBS gewaschen. Zur Fixierung der Zellproteine wurde 100 µl Fixations-Puffer zugegeben. Nach 15 Minuten Inkubation bei Raumtemperatur wurden die Zellen in PBS gewaschen und anschließend 100 µl Permeabilisierungs-Puffer zugegeben. Um eine unspezifische Bindung des anti-GrB-Antikörpers zu verhindern, wurden auch 2 µl Fc-Rezeptor Block-Reagenz zugefügt. Nach zehn Minuten Inkubation bei 4 °C und Waschen in PBS wurden die Zellen mit 2 µl des PE-markierten anti-Granzym B-Antikörpers gefärbt und für 15 Minuten lichtgeschützt inkubiert. Die Analyse im Durchflusszytometer erfolgte nach Waschen in PBS in einem Volumen von 200µl. Um eventuell noch vorhandene unspezifische Antikörperbindung zu quantifizieren, wurde analog zur Granzym B-Färbung jeweils auch eine Isotypenkontrolle mit dem entsprechenden PE-markierten IgG1-Antikörpern gefärbt. Messung und Datenanalyse: Die Messung der Zellen erfolgte im FACScan mit der CellQuest Pro-Software. Die Rohdaten wurden mit der FlowJo-Software 8.7.1 analysiert und die gezeigten Plots damit erstellt. Material und Methoden 16 2.2.6 Reverse Transkriptase-Polymerase-Kettenreaktion (RT-PCR) Die RT-PCR erfolgt in zwei Schritten. Zuerst wird die aus den Zellen isolierte mRNA in stabile und lagerfähige, komplementäre DNA transkribiert, welche anschließend mit einer PCR amplifiziert werden kann. Gewinnung der complementary DNA (cDNA): Die RNA-Isolation erfolgte mit dem Dynabeads mRNA DIRECT kit der Firma Invitrogen. Dynabeads sind magnetische Teilchen, die poly-T-Nukleotide auf ihrer Oberfläche tragen. Damit wird der poly-A-Schwanz am 3´-Ende von eukaryoten-mRNA gebunden. Durch platzieren eines starken Magneten wird bei jedem Waschen in Pufferlösung die mRNA durch die Dynabeads zuverlässig im Eppendorfgefäß fixiert. Dadurch ist es möglich, den gesamten Überstand aus den Eppendorfgefäßen zu entnehmen, ohne die mRNA zu verlieren. Zur Vorbereitung der Dynabeads wurden für 5 x 105 Zellen jeweils 25 µl Dynabeads in ein 0,5 ml Eppendorf-Gefäß pipettiert, mit Lysis-Puffer gewaschen und dieser vor Zugabe des Lysates wieder entfernt. Die B-Zellen wurden nach 16 Stunden Inkubation gezählt und jeweils eine halbe Million Zellen pro Versuchsansatz für die mRNA-Isolation vorbereitet. Die Zellen wurden zentrifugiert (Hettich Rotina 48RS; 400 g Beschleunigung, 7 min bei 25 °C) und mit PBS gewaschen. Das Pellet wurde anschließend mit 150 µl Lysis-Puffer resuspendiert. Nach fünf Minuten Lyse wurde das Zell-Lysat auf die vorbereiteten Dynabeads gegeben. Die Dynabeads wurden mit der 200 µl Pipette im Lysat resuspendiert und für zehn Minuten inkubiert. Der Überstand wurde abgenommen und die Dynabeads zweifach mit 300 µl Buffer A gewaschen. Anschließend wurden die Dynabeads mit 250 µl Buffer B gewaschen und in 150 µl RTPuffer resuspendiert. Für die Transkription der mRNA in cDNA wurde die, im Kit enthaltene, Moloney murine leukemia virus reverse transcriptase (M-MLV-RT) benutzt. Die Dynabeads fungierten hierbei als Primer für die Neusynthese der cDNA. Dem cDNA converter buffer mastermix wurde die M-MLV-RT in einer Endkonzentration von 4 U/µl zugefügt und davon anschließend 16 µl zu den Dynabeads gegeben. Die cDNA-Synthese erfolgte für 60 Minuten im Heizblock bei 37 °C. Danach wurden die Dynabeads erneut mit dem Magneten fixiert, der Überstand abgenommen und 50 µl TE-Puffer hinzugefügt. Um die mRNA von der cDNA zu trennen, wurden die Proben für zwei Minuten auf 95 °C erhitzt. Anschließend wurde sofort, nach Platzierung des Magneten, der Überstand mit der gelösten mRNA vollständig abgenommen. Schließlich wurden die cDNA-Beads noch einmal mit 50 µl TE-Puffer gewaschen und zur Aufbewahrung in 100 µl TE-Puffer resuspendiert. Material und Methoden 17 Polymerase chain reaction (PCR): Für die PCR wurden von der gewonnenen cDNA je 5 µl in einem 25 µl Reaktionsvolumen eingesetzt. Der PCR mastermix (s. 2.1.4) wurde gekühlt vorbereitet. Folgende Primer wurden für Granzym B und das ribosomale RPL-32 verwendet: Tabelle 5: PCR-Primer forward Primer (GrB): 5´-CCA TCC AGC CTA TAA TCC TA-3´ reverse Primer (GrB): 5´-CCT GCA CTG TCA TCT TCA CCT-3´ forward Primer (RPL-32): 5´-AGT TCC TGG TCC ACA ACG TC-3´ reverse Primer (RPL-32: 5´GAT GCC AGA CAG TTT TT-3´ Die Taq-DNA-Polymerase wurder in einer Endkonzentration von 0,2 U/µl zuletzt hinzugefügt. Die Amplifikation der cDNA-Vorlage im Thermocycler (Gene Amp PCR System 9700) erfolgte für Granzym B für 23 Zyklen und für RPL-32 für 26 Zyklen. Jeder Zyklus beinhaltete folgende Schritte: Aufschmelzen der DNA bei 94 °C für 30 Sekunden, Anlagern der Desoxyribonukleosid-triphosphate (dNTP) bei 53 °C für 30 Sekunden und ligieren des komplementären DNA-Stranges durch die Taq-DNA-Polymerase bei 72 °C für ebenfalls 30 Sekunden. Zur Herstellung des Agarose-Gels wurden 0,75 g Agarose in 50 ml Milli-Q Wasser unter Erhitzen gelöst und nach abkühlen auf 55 °C 2,8 µl Ethidiumbromid zugegeben. Von den Proben wurden jeweils 5 µl in dem 1,5%igen Agarose-Gel mit einem 100 bp-ladder für 25 Minuten bei 100 V Spannung laufen gelassen und anschließend unter UV-Licht Fotografiert. 2.2.7 Granzym B-ELISpot Für den Granzym B Elispot wurde das Human Granzyme B Elispot kit der Firma GenProbe Diaclon verwendet. Die PVDF-Boden Platten wurden am Vortag mit 25 µl/well Ethanol 70% für 30 Sekunden bei Zimmertemperatur inkubiert und anschließend dreimal mit 100 µl/well PBS gewaschen. 50 µl Capture-Antikörper wurde in 5 ml PBS gelöst und davon 50 µl/well über Nacht bei 4 °C inkubiert, um die Antikörper auf der Platte zu fixieren. Am nächsten Morgen wurden die Platten mit PBS gewaschen und mit 100 µl skimmed milk (2%) für zwei Stunden inkubiert. Anschließend wurden die Platten erneut mit 100 µl PBS gewaschen und 105 Zellen in 100 µl AIM-V in die wells überführt. Die Zellen wurden mit den angegebenen Substanzen stimuliert und für 16 Stunden bei 37 °C und 5 % CO2 inkubiert. Danach wurden die Zellen durch Ausschütten aus den wells entfernt. Die Platten wurden mit 0,1% Tween 20 in PBS (PBS-T) für zehn Minuten bei 4 °C inkubiert und anschließend drei mal mit PBS-T gewaschen. 50 µl des Detection- Material und Methoden 18 Antikörpers wurde in 5 ml PBS mit 1% BSA gelöst und 50 µl davon in die wells gegeben. Nach 90 Minuten Inkubation bei 37 °C wurden die Platten mit PBS-T dreifach gewaschen und danach 100 µl Streptavidin-Alkaline-Phosphatase (1:5000) in die wells gegeben. Die Platten wurden für 60 Minuten bei 37 °C inkubiert. Nach erneutem dreifachen Waschen mit PBS-T und zusätzlichem Spülen mit destilliertem Wasser, wurden jeweils 50 µl BCIP/NBT-Puffer in die wells gegeben und für zehn Minuten in Dunkelheit inkubiert. Anschließend wurden die Platten mit destilliertem Wasser gründlich gewaschen und getrocknet. Gelesen wurden die Platten mit dem Immunospot Series 1 Analyzer sowie der Immunospot 3 Software. 2.2.8 Konfokale Mikroskopie Jeweils 2x105 CD5+ B-Zellen wurden für 24 Stunden in 96-well Rundbodenplatten mit IL21 in einer EK von 50 ng/ml und anti-BCR in einer EK von 6,5 µg/ml stimuliert. Anschließend wurden sie für die Oberflächenfärbung in FACS-Röhrchen überführt und mit 5 µl Peridinin-chlorophyll-protein complex (PerCP)-markierten anti-CD19-Antikörpern für 15 Minuten lichtgeschützt inkubiert. Die Antikörper wurden durch waschen in PBS entfernt und die Zellen in AIM-V resuspendiert. Als Ziel-Zellen wurden 2,5x 104 HeLaZellen auf ibiTreat®-chamber-slides aufgebracht und für 30 Minuten inkubiert um die Adhäsion der Zellen am Boden zu ermöglichen. Anschließend erfolgte die Membranfärbung mit CellMask™ Deep Red in einer Konzerntration von 5 µl/ml Medium. Die Zellen wurden fünf Minuten inkubiert, danach das Medium abgenommen und die Zellen fünf Mal mit 100 µl PBS vorsichtig gewaschen. 2x 105 der vorbereiteten CD5+ B-Zellen wurden zu den HeLa-Zellen gegeben und mit IL-21 (50 ng/ml) und antiBCR (6,5µg/ml) für weitere 16 Stunden gemeinsam inkubiert. Danach wurden 50 µl des flourogenen Granzym B Substrats (GranToxiLux™) zu den Zellen gegeben und die Zellen mit dem konfokalen Mikroskop für sieben Stunden analysiert. Die 3D-Rekonstruktion der Bilder erfolgte mit ImageJ64 (Version 1.4). 2.2.9 Statistik Datenanalyse und Statistik wurden mit Microsoft Excel 2004 durchgeführt. Die graphische Darstellung der Ergebnisse erfolgte in Microsoft Excel und Powerpoint 2004. Bei Zusammengefassten Ergebnissen wurde der Standardfehler der Mittelwerte (SEM) angegeben. Die Signifikanz der Ergebnisse wurde mit dem Students t-Test berechnet wobei ein p-Wert kleiner als 0,05 als signifikant angesehen wurde. Ergebnisse 19 3 Ergebnisse 3.1 Induktion von Granzym B-mRNA in B-Zellen durch Interleukin 21 Vorarbeiten haben gezeigt, dass B-Zellen gesunder Spender in der Lage sind, nach Stimulation des B-Zell-Rezeptors und unter Einfluss von Interleukin 21 (IL-21) die Serinprotease Granzym B (GrB) zu sezernieren. Das erste Ziel dieser Arbeit war es, die GrB-Expression in B-Zellen sowohl auf Proteinebene, als auch auf Nukleinsäureebene zu untersuchen und miteinander zu vergleichen. Dazu wurden B-Zellen gesunder Spender für 16 Stunden mit IL-21 und B-Zell-Rezeptor-Antikörper (anti-BCR) stimuliert und ihre GrB-Expression analysiert. Post-translational wurde Granzym B in der Durchflusszytometrie durch spezifische Antikörper detektiert. Für die prä-translationale Analyse auf mRNA-Ebene wurde die Reverse-Transkriptase-Polymerase-Kettenreaktion (RT-PCR) verwendet. In unstimulierten B-Zellen war dabei kein Granzym B nach intrazellulärer Färbung nachweisbar (Abbildung 1.1). Mit IL-21 stimulierte B-Zellen zeigten wie erwartet eine geringe GrB-Expression in der FACS-Analyse. Durch gleichzeitige Aktivierung des B-Zell-Rezeptors mit anti-BCR, wurde in 25 % der B-Zellen intrazelluläres Granzym B nachgewiesen. Von den entsprechend behandelten Zellen wurde außerdem die mRNA nach der Inkubationszeit extrahiert und für die PCR-Analyse in cDNA umgeschrieben. In unstimulierten B-Zellen war durch RT-PCR keine GrB-mRNA nachweisbar (Abbildung 1.2). Eine Transkription der mRNA erfolgte erst nach Inkubation in Anwesenheit von IL-21. Die stärkere Bande nach zusätzlicher Stimulation mit anti-BCR ist auf einen höheren Prozentsatz an GrB+ B-Zellen zurückzuführen. Die Ergebnisse belegen, dass Granzym B in B-Zellen nicht konstitutiv exprimiert ist. Erst durch den Einfluss von IL-21 wird die Transkription der GrB-mRNA eingeleitet und es beginnt die Differenzierung in Richtung GrB-sezernierender B-Zellen. Ergebnisse 20 Abbildung 1: Interleukin 21 induziert die Transkription von Granzym B (GrB)-mRNA in B-Zellen. 1.1: Isolierte B-Zellen gesunder Spender wurden, wie angegeben, mit Interleukin 21 (50 ng/ml) und B-Zell-Rezeptor-Antikörper (anti-BCR) (6,5 µg/ml) für 16 Stunden inkubiert. Anschließend wurde Brefeldin A zur Hemmung der GrB-Sekretion für weitere vier Stunden hinzugegeben. Die Zellen wurden intrazellulär mit PE-markierten anti-GrB-Antikörpern gefärbt und im Durchflusszytometer analysiert. Um unspezifische Antikörperbindung auszuschließen, wurde eine Isotypenkontrolle mit PE-markierten anti-IgG1-Antikörpern gefärbt. Es sind Zebraplots eines repräsentativen Experimentes gezeigt (n>3). Die Anzahl GrB+ B-Zellen ist in Prozent angegeben. 1.2: Isolierte B-Zellen gesunder Spender wurden für 16 Stunden, wie angegeben, mit Interleukin 21 (50 ng/ml) und anti-BCR (6,5 µg/ml) inkubiert. Anschließend wurde die mRNA aus je 5x105 B-Zellen extrahiert und die RT-PCR durchgeführt. Als Kontrolle für eine gleichmäßige Beladung des Gels diente hierbei das houskeeping-gene RPL32. Ein repräsentatives Gel ist abgebildet. (n=3) Ergebnisse 21 3.2 Granzym B-Expression in CD5+ B-Zellen aus Nabelschnurblut Die Untersuchung weiterer B-Zell-Fraktionen ergab, dass nicht nur B-Zellen aus dem peripheren Blut Erwachsener Spender in der Lage sind Granzym B zu exprimieren. Auch B-Zellen aus dem Nabelschnurblut gesunder Kinder zeigten nach Stimulation mit IL-21 eine signifikant erhöhte GrB-Expression. Mit zusätzlicher B-Zell-Rezeptoraktivierung durch anti-BCR konnte auch hier eine deutlich stärkere GrB-Expression erreicht werden. Innerhalb von 16 Stunden entwickelten sich dabei über 35% der Zellen zu GrB+ B-Zellen (Abbildung 2). Abbildung 2: B-Zellen aus Nabelschnurblut entwickeln sich zu GrB+ B-Zellen durch B-ZellRezeptor-Aktivierung in Anwesenheit von Interleukin 21. Isolierte B-Zellen aus dem Nabelschnutblut gesunder Kinder wurden, wie abgebildet, mit Interleukin 21 (IL-21) (50 ng/ml) und B-Zell-Rezeptor-Stimulanz (anti-BCR) (6,5 µg/ml) für 16 Stunden inkubiert. Die Dot-Plots zeigen ein repräsentatives Experiment. Die Prozentsätze GrB+ B-Zellen sind angegeben. Das Balkendiagramm fasst drei verschiedene Experimente zusammen. Die Fehlerbalken zeigen den Standardfehler der Mittelwerte (SEM). Im Gegensatz zu B-Zellen aus dem peripheren Blut erwachsener Spender, exprimiert ein Großteil der B-Zellen aus Nabelschnurblut das Oberflächenmolekül CD5 (Abbildung 3.1). Dabei bilden sie eine homogene Population mit unterschiedlicher CD5-Expression. Anhand der median fluorescence intensity (MFI) wurden die Zellen in eine Population mit hoher und niedriger CD5-Expression unterteilt und die Anzahl GrB+ B-Zellen gemessen. Dabei konnte kein signifikanter Unterschied im Prozentsatz GrB+ B-Zellen zwischen beiden Populationen in Bezug auf die CD5-Expression festgestellt werden (Abbildung 3.2). Somit kann bei der Betrachtung der GrB-Expression in B-Zellen aus Nabelschnurblut von einer einheitlichen, CD5+ B-Zellpopulation ausgegangen werden. Ergebnisse 22 Abbildung 3: B-Zellen aus Nabelschnurblut stellen in Bezug auf ihre GrB-Expression eine einheitliche, CD5+ Population dar. 3.1: Isolierte B-Zellen aus dem Nabelschnurblut gesunder Kinder wurden mit PE-Cy5-markierten anti-CD5-Antikörpern gefärbt und im Durchflusszytometer analysiert. Die Zahlen im Gate geben den Prozentsatz CD5 + B-Zellen wieder. Es ist ein repräsentatives Experiment abgebildet. (n=4) 3.2: Isolierte B-Zellen aus Nabelschnurblut wurden für 16 Stunden mit Interleukin 21 (IL-21) (50 ng/ml) und B-Zell-Rezeptor-Stimulanz (anti-BCR) (6,5 µg/ml) inkubiert. Nach der Oberflächenfärbung mit PE-Cy5-markierten anti-CD5-Antikörpern wurde die Intrazellulärfärbung mit PE-markierten anti-GrB-Antikörpern durchgeführt. Die CD5+ B-Zellpopulation wurde, anhand der CD5 median flourescence intensity (MFI), in eine Fraktion mit hoher (CD5 high) und eine mit niedriger (CD5 low) CD5-Expression geteilt. Innerhalb dieser Gates wurde der Prozentsatz GrB+ B-Zellen verglichen. Die Dot-Plots auf der linken Seite zeigen ein repräsentatives Experiment. Das Balkendiagramm rechts zeigt die Zusammenfassung von vier verschiedenen Experimenten. Die Fehlerbalken zeigen den Standardfehler der Mittelwerte (SEM). Ergebnisse 23 3.3 Granzym B-Induktion in B-Zellen durch virale Antigene Ein weiteres Ziel dieser Arbeit war die Identifikation eines natürlichen Stimulus für die GrB-Expression in B-Zellen. IL-21 wird unter anderem in der Akutphase viraler Infektionen von TH-Zellen produziert und ist dabei auch vermehrt im Serum nachweisbar. Aus diesem Grund war es nahe liegend, die GrB-Expression in B-Zellen nach Kontakt mit viralen Antigenen zu untersuchen. Dafür wurden B-Zellen gesunder Spender vor einer geplanten Impfung gegen Frühsommer-Meningoenzephalitis (FSME) in vitro mit dem FSME-Impfstoff und IL-21 stimuliert. Außerdem erfolgten Kontrollen, jeweils 12 Tage nachdem die Spender die erste und zweite Impfdosis erhalten hatten. Die Zellen von nicht geimpften Probanden zeigten dabei nach Inkubation mit IL-21 eine leichte GrB-Expression, analog zu den zuvor beschriebenen Versuchen. Es konnte jedoch keine signifikante Zunahme der GrB-Expression durch zusätzliche Stimulation mit viralen Antigenen in Form des FSME-Impfstoffes festgestellt werden (Abbildung 4.1). Zwölf Tage nach der ersten Impfung der Spender gegen FSME war dagegen bereits eine leichte Steigerung der GrB-Expression nach in vitro Inkubation für 16 Stunden in Anwesenheit des Impfstoffes und IL-21 zu beobachten. Dieser Effekt war konzentrationsabhängig, aber nicht signifikant erhöht zu der Anzahl an GrB+ B-Zellen nach Stimulation mit IL-21 allein. Nach Abschluss der Immunisierung der Spender gegen FSME mit der zweiten Impfdosis zeigten die Zellen eine signifikant erhöhte GrB-Expression in Anwesenheit von IL-21 gegenüber den Zellen ungeimpfter Spender. Außerdem konnte eine signifikante Steigerung der GrB-Expression durch zusätzliche Stimulation mit dem FSME-Impfstoff gegenüber IL-21 alleine gezeigt werden (Abbildung 4.2). Ergebnisse 24 Abbildung 4: B-Zellen exprimieren Granzym B (GrB) nach in-vivo Exposition und erneuter Stimulation mit viralen Antigenen in Anwesenheit von Interleukin 21 (IL-21). Isolierte B-Zellen von gesunden Spendern wurden sowohl vor einer Impfung gegen Frühsommer-Meningoenzephalitis (FSME) als auch 12 Tage nach der ersten und der zweiten Impfung mit und ohne IL-21 und FSME-Impfstoff in den angegebenen Konzentrationen für 16 Stunden inkubiert. 4.1: Die Zebraplots zeigen einen repräsentativen Versuch. Der Prozentsatz GrB+ B-Zellen nach intrazellulärer Färbung mit PE-markierten anti-GrB-Antikörpern und Analyse im Durchflusszytometer ist abgebildet. 4.2: Das Diagramm zeigt die Zusammenfassung von Versuchen mit geimpften und nicht geimpften Spendern (n≥5). Prozentsätze an GrB+ B-Zellen sind dargestellt. Die Fehlerbalken zeigen den Standardfehler der Mittelwerte (SEM). Ergebnisse 25 Der, für diese Versuche verwendete, FSME-Impfstoff enthält neben den viralen Antigenen auch Aluminiumhydroxid (Al(OH)3) als immunstimulierendes Adjuvanz. Um eine unspezifische Immunstimulation GrB-Expression auszuschließen, als Ursache wurden der Kontrollen beobachteten mit IL-21 Zunahme und der Al(OH)3 durchgeführt (Abbildung 5). Dabei konnte keine vermehrte GrB-Expression in B-Zellen durch Zugabe von Al(OH)3 in verschiedenen Konzentrationen festgestellt werden (Abbildung 5.1). Die Steigerung der GrB-Expression nach Stimulation mit FSME-Impfstoff war im Vergleich zur Negativkontrolle mit Al(OH)3 signifikant erhöht (Abbildung 5.2). Abbildung 5: Aluminiumhydroxid (Al(OH)3) induziert kein Granzym B (GrB) in B-Zellen in Anwesenheit von Interleukin 21 (IL-21). Isolierte B-Zellen gesunder Spender (geimpft) wurden mit den angegebenen Konzentrationen von Al(OH)3 mit und ohne Interleukin 21 für 16 Stunden inkubiert. 5.1: Das Kurven-Diagramm zeigt den Prozentsatz GrB+ B-Zellen als Zusammenfassung von 3 unabhängigen Versuchen nach intrazellulärer GrB-Färbung und Analyse im FACS. 5.2: Im Balken-Diagramm ist der Vergleich zwischen der Negativkontrolle mit Al(OH)3 und der Stimulation mit FSME 100 ng/ml bei Zellen geimpfter Spender als Prozentsatz GrB+ B-Zellen dargestellt (n≥3). Die Fehlerbalken zeigen den Standardfehler der Mittelwerte (SEM). 3.4 CD5+ B-Zellen in Kontakt mit viralen Antigenen Da zuvor bereits gezeigt werden konnte, dass sich auch CD5+ B-Zellen aus Nabelschnurblut nach Stimulation durch den B-Zell-Rezeptor unter Einfluss von IL-21 zu GrB+ B-Zellen entwickeln, wurden sie ebenfalls mit dem FSME-Impfstoff stimuliert und die GrB-Expression im FACS gemessen. Dabei zeigte sich, dass sich eine starke GrB-Expression nicht nur mit dem künstlichen B-Zell-Rezeptor Stimulanz (anti-BCR) erzielen ließ. Die Zellen reagierten in ähnlich starker Weise auch auf einen erstmaligen Ergebnisse 26 Kontakt mit viralen Antigenen in Anwesenheit von IL-21 (Abbildung 6.1). Eine vorherige in-vivo Exposition war hierfür, im Gegensatz zu den B-Zellen erwachsener Spender, nicht notwendig. Die Granzym B Expression war dabei, sowohl mit 10 ng/ml als auch mit 100 ng/ml FSME-Impfstoff in Anwesenheit von IL-21 gegenüber der Kontrolle mit IL-21 allein signifikant erhöht (Abbildung 6.2). Diese Ergebnisse könnten auf eine Rolle der CD5+ B-Zellen bei einer frühen, anti-viralen Immunantwort hindeuten, bevor eine adaptive zelluläre Immunität etabliert ist. Abbildung 6: CD5+ B-Zellen exprimieren Granzym B (GrB) bereits beim ersten Kontakt mit viralen Antigenen unter Einfluss von Interleukin 21. Isolierte CD5+ B-Zellen aus Nabelschnurblut wurden in Anwesenheit von Interleukin 21 (IL-21) (50ng/ml) und der angegebenen Konzentration des FSME-Impfstoffes für 16 Stunden inkubiert und anschließend mit PE-markierten + anti-GrB-Antikörpern intrazellulär gefärbt. Der Prozentsatz von GrB B-Zellen ist angegeben. 6.1: Die Dot-Plots Experiment (n≥3). zeigen 6.2: Das den Prozentsatz Balken-Diagramm GrB+ B-Zellen zeigt die in einem repräsentativen Zusammenfassung von drei unterschiedlichen Experimenten. Fehlerbalken geben den Standardfehler der Mittelwerte an (SEM). Ergebnisse 27 3.5 Induktion von Granzym B in B-Zellen durch Toll-like-RezeptorSignale Der hohe Prozentsatz GrB+ CD5+ B-Zellen nach erstmaligem Antigenkontakt durch Stimulation mit dem FSME-Impfstoff war allein durch eine B-Zell-Rezeptor vermittelte Signaltransduktion nicht zu erwarten. Bei der anti-viralen Immunantwort spielen auch Toll-like-Rezeptoren (TLR) zur Erkennung von Pathogenen eine große Rolle. Um ihren Einfluss auf die Differenzierung von B-Zellen zu GrB+ B-Zellen zu untersuchen, wurden Versuche mit TLR-inhibierenden Oligodesoxyribonukleotiden (ODN) durchgeführt. Das verwendete ODN IRS 661 blockiert spezifisch den TLR7 ohne intrinsische Aktivität. Das ODN IRS 869 ist ein kompetitiver Antagonist am TLR9. Es zeigte sich, dass die Differenzierung zu GrB+ B-Zellen in Anwesenheit von IL-21 und B-Zell- Rezeptoraktivierung durch die verwendeten ODN signifikant gehemmt werden kann (Abbildung 7.1). Sowohl mit IRS 661 als auch mit IRS 869 ließ sich eine signifikante Reduktion der GrB+ B-Zellen nachweisen. Die durchgeführten Kontrollen mit dem IRS ctr. schließen eine toxische Wirkung der ODN auf die B-Zellen aus und machen eine Beteiligung der TLR-Signalwege bei der B-Zell-Differenzierung zu GrB+ B-Zellen wahrscheinlich. Die Ergebnisse der FACS-Analyse konnte im ELISpot bestätigt werden (Abbildung 7.2). Die Untersuchung von CD5+ B-Zellen, die nach Stimulation mit dem FSME-Impfstoff und IL-21 Granzym B exprimierten, zeigte eine signifikante Hemmung der GrB-Produktion durch IRS 869 (Abbildung 7.3). Durch das ODN IRS 661 wurde ebenfalls eine Inhibition der GrB-Produktion nachgewiesen, welche jedoch schwächer ausfiel und statistisch nicht signifikant war. Ergebnisse 28 Abbildung 7: Toll-like-Rezeptor (TLR)-blockierende Oligonukleotide hemmen die Granzym B (GrB)-Induktion in B-Zellen. 7.1: B-Zellen gesunder Spender wurden mit Interleukin 21 (IL-21) (50 ng/ml), B-Zell-Rezeptor-Stimulanz (anti-BCR) (6,5 µg/ml) und den angegebenen Oligonukleotiden in den beschriebenen Konzentrationen für 16 Stunden inkubiert, anschließend intrazellulär mit PE-markierten anti-GrB-Antikörpern gefärbt. IRS 661 hemmt spezifisch TLR7 und IRS 869 blockiert spezifisch TLR9. Das Kontroll-ODN IRS ctr. zeigt keine inhibitorische Wirkung auf beide Rezeptoren. Das Kurven-Diagramm zeigt die Auswertung von mittels Durchflusszytometrie analysierten Experimenten (n=3). 7.2: Ein repräsentativer ELISpot zeigt die Hemmung der GrB-Sekretion in CD5- B-Zellen durch die angegebenen Oligonukleotide (n=3). 7.3: CD5+ B-Zellen wurden mit FSME-Impfstoff (100 ng/ml) in Anwesenheit von Interleukin 21 (50 ng/ml) und den entsprechenden Oligonukleotiden (1 µM) für 16 Stunden inkubiert. Die GrBExpression wurde im Durchflusszytometer nach intrazellulärer Färbung mit PE-markierten GrBAntikörpern gemessen Das Balken-Diagramm zeigt die Zusammenfassung der FACS-Versuche (n=3). Ergebnisse 29 3.6 Vergleich der Granzym B-Expression in CD5+ und CD5- B-Zellen Bei der vergleichenden Untersuchung der CD5+ B-Zellen aus Nabelschnurblut mit den CD5- B-Zellen erwachsener Spender zeigte sich eine deutliche Überlegenheit der CD5+ B-Zellen im Hinblick auf ihr Potential als GrB-produzierende B-Zellen. Mit einem ELISpot wurde die Sekretion des gebildeten Granzym B der Zellgruppen analysiert (Abbildung 8.1). Es zeigte sich eine gut doppelt so große Anzahl an GrB-sezernierenden Zellen unter den CD5+ B-Zellen im Vergleich zu den CD5- B-Zellen. Dabei war keine erhöhte GrB-Sekretion nach alleiniger Stimulation mit IL-21 nachweisbar. Diese Beobachtung legt nahe, dass es durch IL-21 zwar zu einer Induktion von Granzym B in BZellen kommt, dieses jedoch erst nach einem weiteren Signal über den B-Zell-Rezeptor auch sezerniert wird. Diese Ergebnisse wurden in der vergleichenden Anlyse der Daten aus der Durchflusszytometrie bestätigt (Abbildung 8.2). Es zeigte sich insgesamt eine signifikant höhere GrB-Expression der CD5+ B-Zellen, sowohl unter Einfluss von IL-21 als auch mit zusätzlicher Aktivierung des B-Zell-Rezeptors. Ergebnisse 30 Abbildung 8: CD5+ B-Zellen zeigen unter Einfluss von Interleukin 21 (IL-21) und B-Zell-Rezeptor-Antikörpern (anti-BCR) eine stärkere Granzym B (GrB)-Expression als CD5- B-Zellen. 8.1: CD5+ B-Zellen aus Nabelschnurblut und CD5- B-Zellen aus dem peripheren Blut erwachsener Spender wurden in einer Konzentration von 105 Zellen/well für 16 Stunden in PVDF-Boden-Platten mit Interleukin 21 (50 ng/ml) und anti-BCR (6,5 µg/ml) wie angegeben inkubiert und der ELISpot anschließend entwickelt. 8.2: CD5+ B-Zellen aus Nabelschnurblut und CD5- B-Zellen aus dem peripheren Blut erwachsener Spender wurden 16 Stunden, wie angegeben, mit IL-21 (50 ng/ml) und anti-BCR (6,5 µg/ml) inkubiert und anschließend intrazellulär mit PEmarkierten anti-GrB-Antikörpern gefärbt. Die Dot-Plots zeigen ein repräsentatives Experiment (n≥3). Das Balkendiagramm fasst die Ergebnisse der Versuche zusammen. Fehlerbalken zeigen den Standardfehler der Mittelwerte (SEM). Ergebnisse 31 Die stärkere GrB-Expression in CD5+ B-Zellen zeigte sich im Besonderen als Reaktion auf den erstmaligen Kontakt mit viralen Antigenen ohne eine vorhergegangene Immunisierung in vivo. Die GrB-Expression in CD5+ B-Zellen war dabei zehnfach stärker im Vergleich zu CD5- B-Zellen. (Abbildung 9). Abbildung 9: CD5+ B-Zellen exprimieren beim ersten Kontakt mit viralen Antigenen signifikant mehr Granzym B (GrB) im Vergleich zu CD5- B-Zellen. CD5 + B-Zellen und CD5- B-Zellen wurden mit und ohne Interleukin 21 (IL-21) (50 ng/ml) und FSME-Impfstoff (100 ng/ml) 16 Stunden inkubiert und nach intrazellulärer Färbung auf Granzym B im Durchflusszytometer analysiert. Die Dot-Plots zeigen den Vergleich zweier repräsentativer Experimente. Das Balkendiagramm fasst die Ergebnisse der Versuche zusammen (n≥3). Fehlerbalken zeigen den Standardfehler der Mittelwerte (SEM). 3.7 CD5+ B-Zellen sezernieren enzymatisch aktives Granzym B Eine mögliche physiologische Rolle von GrB-sezernierenden B-Zellen wäre die Mitwirkung an einer zytotoxischen Immunantwort gegen virus-infizierte Zellen oder auch Tumorzellen. Entscheidend dafür ist, dass das produzierte Granzym B nicht nur von den Ergebnisse 32 B-Zellen sezerniert wird, sondern auch enzymatische Aktivität besitzt und in die Zielzellen gelangen kann. Aufgrund ihrer Fähigkeit, Granzym B in großen Mengen zu sezernieren, wurden CD5+ B-Zellen mit potentiellen Zielzellen inkubiert. Die Zell-Zell-Interaktion wurde dabei mit einem konfokalen Mikroskop untersucht (Abbildung 3). Es zeigte sich, dass GrB+ B-Zellen in direkter Nachbarschaft zu einer HeLa-Zelle (Cervix-KarzinomZelllinie) das enzymatisch aktive Granzym B sezernierten. Dieses enzymatisch aktive Granzym B konnte dabei auch intrazellulär in den HeLa-Zellen nachgewiesen werden. Da Hela-Zellen selbst kein GrB exprimieren, belegen diese Aufnahmen die Translokation von enzymatisch aktivem GrB einer B-Zelle in eine potentielle Zielzelle. Abbildung 10: CD5+ B-Zellen sezernieren enzymatisch aktives Granzym B (GrB), welches in Zielzellen transloziert wird. CD5+ B-Zellen hoher Reinheit (99%) wurden für 24 Stunden mit Interleukin 21 (50 ng/ml) und anti-BCR (6,5 µg/ml) stimuliert. Anschließend wurden sie mit PerCP-markierten anti-CD19-Antikörpern gefärbt (blau in der Abbildung) und für weitere 16 Stunden zusammen mit HeLa-Zellen (Membranfärbung mit CellMask Deep Red, rot in der Abbildung) inkubiert. Anschließend wurde 50 µl fluorogenes GrB-Substrat (grün in der Abbildung) zugegeben und die Zellen mit dem konfokalen Mikroskop für sieben Stunden gefilmt. Dargestellt ist eine HeLa-Zelle, die von mehreren B-Zellen umgeben ist. Die oberer Reihe zeigt Horizontalschnitte durch die Zellen. Unten ist eine 3D-Rekonstruktion der Zellen abgebildet. Die Abbildung ist repräsentativ für verschiedene HeLa-Zellen aufgenommen in zwei unterschiedlichen Experimenten. Diskussion 33 4 Diskussion 4.1 De-novo-Synthese von Granzym B in B-Zellen durch Interleukin 21 B-Zellen tragen, als Teil der humoralen Immunität, einen beträchtlichen Teil zur Abwehr verschiedenster Pathogene bei. Sie sind als Produzenten der natürlichen IgM-Antikörper, welche unspezifisch eine Vielzahl von Epitopen erkennen können, neben dem Komplement-System ein Teil der angeborenen Immunität. Als Teil der adaptiven Immunantwort liefern sie spezifische Antikörper, nach klonaler Selektion und Differenzierung zu Plasmazellen. Durch die Entdeckung von Granzym B in humanen B-Zellen erweitert sich unser Verständnis für ihre Rolle im Immunsystem des Menschen um weitere, neuartige Funktionen wie dies auch für andere GrB-sezernierende Zellen wie Mastzellen, basophile Granulozyten oder plasmazytoide dentritische Zellen der Fall zu sein scheint [42, 81, 85]. Nachdem in Vorarbeiten unserer Arbeitgruppe bereits Granzym B in B-Zellen gesunder Probanden durch Durchflusszytometrie nachgewiesen werden konnte, war es das erste Ziel dieser Arbeit, diese Ergebnisse durch Untersuchung der mRNA zu validieren und die erhaltenen Daten mit den Ergebnissen einer parallel durchgeführten Messung im Durchflusszytometer zu vergleichen. Dabei stand die Frage im Vordergrund, ob Granzym B in B-Zellen konstitutiv exprimiert wird, oder eine Neusynthese des Moleküls stattfindet. Bereits die Ergebnisse der Durchflusszytometrie legen den Schluss nahe, dass es sich um eine Neusynthese von Granzym B handelt, da in unstimulierten B-Zellen direkt nach der Blutentnahme bisher kein Granzym B durch Antikörperbindung nachgewiesen werden konnte. Dabei ist jedoch die, im Vergleich zu einer PCR-Analyse, geringere Spezifität und Sensitivität der Durchflusszytometrie zu beachten. Außerdem bestünde die Möglichkeit, dass GrB-mRNA präformiert in B-Zellen gespeichert ist und die Bildung des fertigen Proteins ein post-transkriptionaler Vorgang ist, wobei die Translation an den Ribosomen nach entsprechenden Signalen eingeleitet wird. Die in Kapitel 3.1 beschriebenen Ergebnisse dieser vergleichenden Analyse bestätigten die Hypothese, dass es sich bei der Induktion von Granzym B in B-Zellen um eine Neusynthese handelt und Ganzym B nicht konstitutiv in B-Zellen exprimiert wird. In unstimulierten B-Zellen aus dem peripheren Blut Erwachsener konnte keine GrB-mRNA mit der eingesetzten RT-PCR nachgewiesen werden. Um eine gleichmäßige Beladung des Diskussion 34 Gels zu gewährleisten wurde das ribosomale Gen RPL-32 als Houskeeping-Kontrolle eingesetzt, da in Pilotexperimenten gezeigt wurde, dass es durch eine Stimulation des B Zell-Rezeptors nicht vermehrt transkribiert wird. Damit war eine semi-quantitative Analyse der PCR-Daten möglich. Es zeigte sich, dass durch IL-21 die Transkription der GrB-mRNA eingeleitet wird und damit eine Differenzierung in Richtung GrB+ B-Zellen beginnt. In der Durchflusszytometrie zeigte sich eine signifikante Zunahme der GrB+ B Zellen durch eine Stiumulaiton des B-Zell-Rezeptors mit aktivierenden Antikörpern (anti-BCR) und Interleukin 21. Diese vermehrte GrB-Expression konnte in Form einer stärkeren Bande im Agarose-Gel der PCR ebenfalls belegt werden. Interessanterweise zeigten Ettinger et al. bei ähnlichen Versuchen zur B-Zell-Differenzierung, dass IL-21 ein starker Stimulus für die Entwicklung zu antikörper-sezernierenden Plasmazellen ist [25]. Sowohl naive, als auch Memory-B-Zellen entwickelten sich dabei nach gleichzeitiger Stimulation mit CD40-Ligand und anti-BCR unter Einfluss von IL-21 zu Plasmazellen. Ohne eine CD40-Aktivierung war dieser Effekt deutlich abgeschwächt, womöglich dadurch ausgelöst, dass sich die B-Zellen zu GrB+ B-Zellen entwickelten. Diese grundlegende Rolle von CD40-Ligand bei der B-ZellDifferenzierung in Anwesenheit von IL-21 wird durch den Befund gestützt, dass CD40Ligand zu einer konzentrationsabhängigen Suppression der GrB-Expression in B Zellen, welche mit IL-21 und anti-BCR stimuliert wurden, führt [35]. So scheint es für die Reaktion auf IL-21 von entscheidender Bedeutung zu sein, welche kostimulatorischen Signale auf die B-Zelle einwirken. Bei der T-Zell-abhängigen B-ZellAktivierung mit Aktivierung des B-Zell-Rezeptors und gleichzeitigem CD40-Signal entwickeln sich B-Zellen in Anwesenheit von IL-21 zu Plasmazellen als Teil der humoralen Immunantwort [49]. Bei Fehlen des CD40-Signals hingegen exprimieren die BZellen, wie hier gezeigt werden konnte, Granzym B-mRNA und entwickeln sich zu GrB+ B-Zellen. Diese Ergebnisse sprechen in Zusammenschau für eine richtungsweisende Funktion des kostimulatorischen CD40-Liganden bei der B-Zell-Entwicklung. Granzym B wurde das erste Mal in B-Zellen durch Jahrsdörfer et al. unter anderem auf B-Zellen von Patienten mit chronisch lymphatischer Leukämie (CLL) nachgewiesen [41]. Diese malignen Zellen exprimieren das Lymphozyten-Antigen CD5 auf ihrer Oberfläche. Daher richtete sich die Aufmerksamkeit bei der Suche nach einer, im gesunden menschlichen Organismus natürlicherweise vorkommenden, B-Zell-Population mit der Diskussion 35 Fähigkeit zur GrB-Expression besonders auf CD5+ B-Zellen. Das Oberflächenmolekül CD5 ist ein T-Zell-Marker, welcher auch auf einigen B-Zell-Populationen zu finden ist [6]. Beim Menschen finden sich CD5+ B-Zellen in größerer Anzahl in den serösen Körperhöhlen, im Nabelschnurblut und bei bestimmten Autoimmunerkrakungen [24, 39, 92]. Um das GrB-Potential von CD5+ B-Zellen zu untersuchen, konzentrierten wir uns dabei auf B-Zellen aus Nabelschnurblut. Die aus dem Nabelschnurblut isolierten B-Zellen zeigten dabei eine ähnliche Reaktion auf die Stimulation mit IL-21 und anti-BCR, wie sie zuvor bereits bei CD5- B-Zellen erwachsener Probanden gezeigt werden konnte. Auf alleinige Stimulation mit IL-21 bildeten bereits 18 Prozent der B-Zellen Granzym B. Mit einer zusätzlichen Aktivierung des B-Zell-Rezeptors entwickelten sich über 35 Prozent der Zellen innerhalb von 16 Stunden zu GrB-produzierenden B-Zellen. Bei diesen Experimenten stand die Frage einer Korrelation zwischen der Expression von Granzym B und CD5 auf B-Zellen im Vordergrund unseres Interesses. Die Oberflächenfärbung der B-Zellen aus Nabelschnurblut ergab eine homogene Expression von CD5 auf über 90 % der B-Zellen. Ähnlich hohe Werte (75-95%) werden auch in der Literatur für den Phänotyp von fetalen und B-Zellen aus Nabelschnurblut angegeben [36, 39]. Eine Unterteilung der Population anhand der median flourescence intensity (MFI) in Subpopulationen mit hoher und niedriger CD5-Expression zeigte keinen signifikanten Unterschied in der Anzahl der GrB+ B-Zellen. Daraus kann man schließen, dass es sich bezüglich ihrer Fähigkeit zur GrB-Expression bei B-Zellen aus Nabelschnurblut um eine einheitliche, CD5+ B-ZellPopulation handelt. 4.2 Granzym B-Induktion in B-Zellen durch virale Antigene Die Übertragung dieses, in vitro nachgewiesenen, neuen Differenzierungsweges von B-Zellen in ein in-vivo-Modell erforderte die Identifikation eines natürlichen Stimulus für die GrB-Induktion in B-Zellen als Ersatz für die, in den ersten Experimenten eingesetzten B-Zell-Rezeptor aktivierenden Antikörper. Wie bereits gezeigt wurde ist eine Grundvoraussetzung für die GrB-Induktion in B-Zellen die Anwesenheit des Botenstoffes IL-21. Dieser ist besonders in der akuten Phase einer Virusinfektion im Blut von Patienten in erhöhten Konzentrationen nachweisbar [13, 82]. Um eine mögliche Rolle von GrB+ B-Zellen bei viralen Infektionen zu untersuchen, Diskussion 36 bedienten wir uns eines Modells mit in-vivo Exposition der Probanden und anschließender in-vitro-Stimulation der B-Zellen. Unserer Hypothese folgend, sollte dieses Vorgehen zu einer Vermehrung antigenspezifischer B-Zellen im Körper der Spender führen. Dadurch sollte gewährleistet werden, dass genügend B-Zellen mit dem passenden B-Zell-Rezeptor isoliert werden, um einen Effekt durch die in-vitro-Stimulation messen zu können. Bei der Untersuchung der B-Zellen aus dem Blut ungeimpfter Probanden zeigte sich eine GrB-Expression nach Stimulation mit IL-21 und anti-BCR, analog zu den zuvor beschriebenen Versuchen. Es konnten jedoch keine GrB+ B-Zellen nach einer Stimulation mit dem FSME-Impfstoff und IL-21 nach 16 Stunden Inkubationszeit in der FACS-Analyse nachgewiesen werden. Aufgrund der geringen Wahrscheinlichkeit eines ausreichend großen Vorkommens an antigenspezifischen B-Zellen mit dem passenden Rezeptor für die im Impfstoff enthaltenen FSME-Antigene, waren diese Ergebnisse wenig überraschend und nach unserer Hypothese zu erwarten. Nach der ersten Impfung gegen FSME zeigten die B-Zellen der Probanden eine leicht gesteigerte GrB-Expression nach der Stimulation mit IL-21. Nach Abschluss der FSMEImmunisierung in Form der zweiten Impfdosis innerhalb von 4 Wochen zeigten die B-Zellen eine noch deutlichere Zunahme der GrB-Expression unter IL-21-Stimulation. Diese vermehrte GrB-Expression durch die IL-21-Stimulation bei geimpften Spendern könnte durch eine vermehrte IL-21-Rezeptorexpression erklärt werden. Dieser Vorgang wurde bei B-Zellen als eine Antwort auf eine in-vitro-Stimulation mit TLR7-Agonisten bereits beobachtet [72]. Zudem wurde eine höhere IL-21-Rezeptor Expression bei Patienten mit einer HIV-Infektion gefunden [72]. Es gibt auch Hinweise darauf, dass eine vermehrte Expression von IL-21-Rezeptoren auf B-Zellen, für eine erfolgreiche Immunisierung bei HIV-positiven Patienten gegen Influenza nötig ist [64]. Diese Befunde weisen auf eine vermehrte Expression des IL-21-Rezeptors auf den B-Zellen geimpfter Spender als mögliche Erklärung für unsere Beobachtungen hin. Nach der zweiten Impfung gegen FSME zeigte sich zudem eine konzentrationsabhängige Zunahme der GrB-Expression der B-Zellen nach erneuter Stimulation mit dem FSME-Impfstoff. GrB+ B-Zellen sind dabei wahrscheinlich Teil der, nach einer Impfung stark vermehrten, Memory-B-Zell-Population im peripheren Blut [8] und besitzen einen FSME-spezifischen B-Zell-Rezeptor. Die GrB-Expression war im Vergleich zur Kontrolle mit IL-21 signifikant erhöht und lässt sich damit durch eine vermehrte Expression des Diskussion 37 Zytokinrezeptors nicht erklären. Eine unspezifische Reaktion auf das im Impfstoff enthaltene Adjuvanz Aluminiumhydroxid konnte durch die Kontrollversuche ebenfalls ausgeschlossen werden, so dass in Zusammenschau der Befunde alles für eine virusspezifische Reaktion der B-Zellen spricht. Die klassische zytotoxische Immunantwort auf eine Virusinfektion mit klonaler Vermehrung zytotoxischer CD8+ T-Zellen benötigt mehrere Tage und setzt die Präsentation der Antigene durch professionelle antigenpräsentierende Zellen, nach deren Migration in die Lymphknoten, voraus [28, 83]. Während dieser Zeit übernehmen die Zellen der angeborenen Immunität wie NK-Zellen oder NKT-Zellen die Bekämpfung von infizierten oder maligne entarteten Zellen [1, 7, 89]. Dabei sezernieren die NKT-Zellen unter anderem IL-21 [20], welches als eines der ersten Zytokine im Plasma nach einer Virusinfektion in erhöhten Konzentrationen gefunden wird [40]. Dadurch wird ein physiologisches Milieu geschaffen, das die Differenzierung zu GrB+ B-Zellen in dieser frühen Phase am Ort der Infektion ermöglicht. Diese B-Zellen könnten, als Brücke zwischen der angeboren und der erworbenen Immunität, mit dem sezernierten Granzym B einer überschießenden Immunantwort entgegenwirken, bis eine vollständige T-Zell-Aktivierung erfolgt ist und sich antigenspezifische T-Zellen am Ort der Infektion einfinden. Für diese neuartige Funktion im Immunsystem des Menschen sind B-Zellen mit ihrem Rezeptor hervorragend ausgestattet. Dieser erlaubt ihnen eine schnelle Erkennung von antigenen Strukturen, entweder frei im Plasma gelöst oder auch innerhalb größerer Viruspartikel. Eine Präsentation durch die professionellen antigenpräsentierenden Zellen ist dabei nicht nötig. Außerdem können sie eine breitere Palette an Antigenen erkennen, als dies mit dem T-Zell-Rezeptor möglich ist, welcher dabei ausschließlich auf Peptide beschränkt ist. Dazu zählen unter anderem auch Nukleinsäuren, Glykolipide und Glykosaminoglykane [47, 87]. Neben dem B-Zell-Rezeptor dienen auch Toll-like-Rezeptoren (TLR) den B-Zellen dazu, Antigenstrukturen von Pathogenen zu erkennen. Dabei sind besonders TLR7 und TLR9 auf B-Zellen im peripheren Blut exprimiert und dienen der Erkennung von Virusbestandteilen [18]. Erste Hinweis auf eine Beteiligung der TLR bei der GrB-Induktion in B-Zellen ergaben sich aus den Versuchen mit CD5+ B-Zellen. Es zeigte Diskussion 38 sich eine unerwartet starke GrB-Expression beim ersten Antigenkontakt mit den FSMEImpfstoffen. Bis zu 30 % der Zellen exprimierten nach dem Kontakt mit dem FSME-Impfstoff Granzym B. Dieser beobachtete Prozentsatz an GrB+ B-Zellen war zu hoch, als dass es sich hierbei ausschließlich um antigenspezifische B-Zellen mit dem passenden B-Zell-Rezeptor handeln konnte. Aus diesem Grund stellten wir die Hypothese auf, dass außer dem B-Zell-Rezeptor auch eine TLR-Aktivierung bei der GrB-Induktion in B-Zellen von Bedeutung sein könnte. Um den Einfluss von TLR-Signalen auf die Differenzierung zu GrB+ B-Zellen zu untersuchen, verwendeten wir Oligodesoxynukleotide (ODN), welche jeweils spezifisch an TLR7 und TLR9 binden, ohne eine intrinsische Aktivität zu besitzen [5]. In B-Zellen, die mit IL-21 und anti-BCR stimuliert wurden, konnte eine konzentrationsabhängige Inhibition der GrB-Expression sowohl durch IRS 661 als auch durch IRS 869 nachgewiesen werden. Die Negativkontrolle mit dem IRS ctr., welches keine inhibitorische Wirkung auf TLR7 oder TLR9 aufweist, schloss dabei einen zytotoxischen Effekt der ODN auf die B-Zellen als Ursache aus. Diese Ergebnisse lassen sich nicht ohne Weiteres erklären, da weder in anti-BCR noch in IL-21 TLR-Agonisten enthalten sind. Eine mögliche Hypothese zur Erklärung unserer Beobachtung wäre eine gemeinsame Endstrecke der Signaltransduktion durch den B-Zell-Rezeptor und durch Toll-like-Rezeptoren bei der GrB-Induktion. Dabei wäre es denkbar, dass sich die Signale gegenseitig verstärken, oder aber unter Einfluss der inhibitorischen ODN, gehemmt werden. Eine solche synergistische Wirkung wurde beispielsweise für die B-Zell-Aktivierung mit nachfolgendem antigen-abhängigen class-switch bereits beschrieben [67, 68]. Neueste Erkenntnisse von Guerrier et al. deuten außerdem darauf hin, dass TLR9 auf B-Zellen nicht nur in den Endosomen exprimiert wird, sondern auch auf der Zelloberfläche vorkommt und dort als ein Korezeptor für den B-Zell-Rezeptor agieren könnte [31]. Hierzu sind sicher noch weitere Untersuchungen nötig, jedoch unterstützen unsere Ergebnisse ebenfalls die Hypothese einer direkten Interaktion des TLR9 auf B-Zellen mit dem B-Zell-Rezeptor. Damit wäre die beobachtete Hemmung der inhibitorischen Oligonukleotide auf die BCR-induzierte GrB-Expression zu erklären. In CD5+ B-Zellen, die mit viralen Antigenen stimuliert wurden, konnte durch die inhibitorischen ODN eine ähnliche Reaktion beobachtet werden. Eine Hemmung der TLR9-Signaltransduktion durch IRS 869 führte zu einer signifikanten Reduktion der GrB+ B-Zellen. Eine weitaus schwächere Reaktion, welche nicht signifikant war, zeigte sich mit dem TLR7-Antagonisten. Da in dem FSME-Impfstoff Partikel enthalten sind, die Diskussion 39 den TLR9 aktivieren können, ist die beobachtete Reaktion der CD5+ B-Zellen in diesem Fall wahrscheinlich auf eine Aktivierung der B-Zellen über den TLR9 zurückzuführen und kann damit die hohe Anzahl an GrB+ B-Zellen bei einem erstmaligen Antigenkontakt erklären. Somit konnte zum ersten Mal gezeigt werden, dass humane B-Zellen im Rahmen einer akuten Immunreaktion in der Lage sind, Granzym B als Antwort auf einen physiologischen Stimulus durch virale Antigene und IL-21 zu produzieren. Die Erkennung der Gefahrensignale erfolgt dabei über den B-Zell-Rezeptor unter Beteiligung des TLR9-Signalweges und ermöglicht den B-Zellen eine besonders schnelle GrB-Produktion, bevor die klassischen zyotoxischen Zellen des adaptiven Immunsystems durch Antigenpräsentation vollständig aktiviert sind. 4.3 Besonderheiten Granzym B+ CD5+ B-Zellen CD5+ B-Zellen stellen eine besondere B-Zell-Subpopulation mit einzigartigen Eigenschaften dar. Durch Versuche in Mausmodellen wurden sie als Produzenten der natürlichen IgM-Antikörper identifiziert [38] und galten lange als eigenständige B-ZellReihe mit klonaler Vermehrung. Später haben sich die Hinweise darauf vermehrt, dass das Oberflächenmolekül CD5 in adulten B-Zellen durch entsprechende Signale induziert werden kann und es sich bei den CD5+ B-Zellen um keine eigenständige B-Zell-Linie fetalen Ursprungs handelt [19, 37, 90]. Die Entwicklung zu CD5+ B-Zellen aus fetalen Vorläuferzellen läuft jedoch schneller ab [6] und die meisten B-Zellen im menschlichen Nabelschnurblut exprimieren das Oberflächenmolekül CD5 (siehe Kapitel 3.2). CD5+ B-Zellen gelten auch beim Menschen als Hauptquelle der natürlichen IgM-Antikörper, die eine wichtige Rolle in der frühen Abwehr von Pathogenen spielen [24]. Aus diesem Grund können die CD5+ B-Zellen auch dem angeborenen Teil des Immunsystems zugerechnet werden [24]. Die geringe Spezifität ihrer Antikörper, welche sie zu einer schnellen Immunreaktion gegen verschiedene Pathogene befähigt, birgt auch das Risiko einer Autoimmunreaktion. So konnten CD5+ B-Zellen aus dem Blut von Patienten mit Rheumatoider Arthritis (RA) oder systemischem Lupus erythematodes (SLE) als Produzenten der polyspezifischen und autoreaktiven IgM-Antikörper identifiziert werden [15, 36]. Diesen Erkenntnissen widersprechen allerdings neuere Publikationen, die Diskussion eine 40 regulatorische Funktion von CD5+ B-Zellen postulieren, welche Autoimmunreaktionen verhindern soll [23, 91, 92]. Obwohl die genauen Mechanismen dahinter nicht geklärt sind, verdeutlichen die bisherigen Erkenntnisse die besondere Rolle von CD5+ B-Zellen innerhalb der B-Zellpopulation und machen weitere Untersuchungen zu ihren Aufgaben im Immunsystem des Menschen nötig. Im Rahmen meiner Arbeit konnte ich zum ersten Mal zeigen, dass CD5+ B-Zellen eine weitere Sonderstellung unter B-Zellen innehaben und in einem besonderen Maße dazu in der Lage sind, Granzym B zu produzieren. Bei meinen Versuchen zeigte sich, dass bereits durch eine alleinige Stimulation mit IL-21 bis zu 20 Prozent der CD5+ B-Zellen Granzym B exprimierten. Die Expressionsrate war unerwartet hoch und wurde in diesem Umfang bei CD5- B-Zellen nicht beobachtet. Selbst B-Zellen von geimpften Probanden, die wie bereits erläutert wurde, eine gesteigerte GrB-Expression unter Einfluss von IL-21 zeigten, kamen an die gemessenen Werte der CD5+ B-Zellen aus Nabelschnurblut nicht heran. Eine naheliegende Erklärung für diese Ergebnisse wäre eine erhöhte Il-21Rezeptorexpression auf CD5+ B-Zellen. Tatsächlich konnte eine vermehrte Expression des Rezeptors bei der Untersuchung von CD5+ B-Zellen von Patienten mit SLE nachgewiesen werden [34]. Diese Ergebnisse machen eine Beteiligung einer vermehrten IL-21Rezeptorexpression auf den CD5+ B-Zellen aus Nabelschnurblut ebenso wahrscheinlich, da diese Zellen einen vergleichbaren Phänotyp wie CD5+ B-Zellen von Lupuspatienten besitzen und vergleichbare Eigenschaften nachgewiesen wurden [78]. Durch zusätzliche Aktivierung des B-Zell-Rezeptors mit anti-BCR konnte die GrB-Expression noch mehr als verdoppelt werden. Der direkte Vergleich mit CD5- B-Zellen belegte die signifikante Überlegenheit der CD5+ B-Zellen in ihrem Vermögen, Granzym B zu produzieren. Die in Kapitel 3.6 vorgestellten Ergebnisse zeigen einen rund doppelt so hohen Prozentsatz an GrB+ B-Zellen bei den CD5+ B-Zellen aus Nabelschnurblut in der FACS-Analyse. Die anschließende Analyse der GrB-Sekretion durch B-Zellen im ELISpot konnte diese Zahlen bestätigen. Es zeigte sich, dass auch rund doppelt so viele B-Zellen in der CD5+ B-Zell-Population nach Stimulation mit anti-BCR und IL-21 Granzym B sezernierten. Ein wichtiger Nebenbefund bei den Ergebnissen aus der ELISpot-Untersuchung war, dass die CD5+ B-Zellen trotz der signifikant gesteigerten GrB-Expression durch IL-21-Stimulation das Enzym nicht sezernierten. Die vermehrte Sekretion bedurfte die Diskussion 41 zusätzliche Aktivierung des B-Zell-Rezeptors. Die B-Zellen entwickeln sich somit durch IL-21 zu GrB+ B-Zellen ohne jedoch direkt mit der Freisetzung ihres Effektormoleküls zu beginnen. Für eine physiologische Bedeutung der GrB-sezernierenden B-Zellen macht diese Beobachtung durchaus Sinn, da nur durch ein zweites Signal über einen Rezeptor zur Erkennung von Pathogenen eine zielgerichtete und somit antigenspezifische Immunantwort ermöglicht wird. Besonders trat der Unterschied beider B-Zell-Populationen bei der Untersuchung ihrer Reaktion auf virale Antigene hervor. Während CD5- B-Zellen bei erstmaligem Kontakt mit viralen Antigenen in Form des FSME-Impfstoffes in Anwesenheit von IL-21 keine signifikante GrB-Expression zeigten, konnte bei CD5+ B-Zellen direkt eine Reaktion beobachtet werden. Sowohl mit 10 ng/ml als auch mit 100 ng/ml FSME-Impfstoff konnte eine signifikante Steigerung der GrB-Expression gegenüber der Kontrolle mit IL-21 allein nachgewiesen werden. Im direkten Vergleich mit CD5- B-Zellen zeigten die CD5+ B-Zellen eine hochsignifikant gesteigerte GrB-Expression um den Faktor zehn. Eine mögliche Erklärung für das große Potential von CD5+ B-Zellen könnte in ihrer höheren TLR9-Expression liegen [22], da wie bereits erläutert, der TLR9-Signalweg neben dem B-Zell-Rezeptor zur GrB-Induktion in B-Zellen beiträgt. Diese Ergebnisse belegen zum einen die deutliche Überlegenheit von CD5+ B-Zellen bei der GrB-Produktion, zum anderen legen sie eine Funktion der GrB+ CD5+ B-Zellen besonders in einer frühen Phase der Immunantwort auf Pathogene nahe. Damit unterstützen sie die Vermutung, dass diese spezielle B-Zell-Population einem eher primitiven und weniger spezifischen Ast des Immunsystems angehört [24] und damit besondere Bedeutung für die Immunantwort im Neugeborenen mit mehrheitlich CD5+ B-Zellen haben könnte. 4.4 Mögliche Funktionen von Granzym B+ B-Zellen Die in dieser Arbeit gezeigten Ergebnisse lassen auf eine Mitwirkung von GrB+ B-Zellen bei einer frühen Immunantwort auf eine virale Infektion schließen. GrB+ B-Zellen könnten damit zu den, bei verschiedenen viralen Infektionen im Plasma nachgewiesenen, erhöhten GrB-Spiegeln beitragen [4, 80, 82]. Die naheliegendste Funktion von GrB-sezernierenden B-Zellen wäre dabei eine zytotoxische Immunreaktion mit Zerstörung von virusinfizierten Zellen. Diskussion 42 Um seine apoptotische Wirkung entfalten zu können, muss Granzym B in das Zytoplasma der Zielzelle gelangen. Bei der klassischen zytotoxischen Immunantwort gegen virusinfizierte Zellen bilden T-Lymphozyten mit den Zielzellen eine Immunologische Synapse aus, die zur Transduktion des Granzym B in die Zielzelle dient. Dabei wird neben Granzym B auch Perforin als Inhalt der zytotoxischen Granula in den synaptischen Spalt freigesetzt, welches die Freisetzung des Granzym B aus den Endosomen gewährleistet [9]. Da B-Zellen kein Perforin exprimieren [33], stellte sich uns zuerst die Frage, ob B-Zellen auch ohne Perforin in der Lage wären ihr Granzym B in die Zielzelle zu translozieren. Dazu bedienten wir uns dem in Kapitel 3.7 beschrieben Modell mit CD5+ B-Zellen als Effektorzellen und HeLa-Zellen als potentielle Zielzellen. Aufgrund ihrer besonders starken GrB-Sekretion nach Stimulation über den B-Zell-Rezeptor unter Einfluss von IL21 fiel die Wahl dabei auf CD5+ B-Zellen. Die HeLa-Zellen wurden verwendet, da diese selbst kein Granzym B exprimieren und einfacher in Zellkultur zu halten waren als virusinfizierte Zellen. In diesem Modell konnte nach 16-stündiger Koinkubation unter dem konfokalen Mikroskop eine Translokation von enzymatisch aktivem Granzym B in die HeLa-Zellen nachgewiesen werden. Die daran beteiligten CD5+ B-Zellen befanden sich in direkter Nachbarschaft zu den HeLa-Zellen, so dass es möglich ist, dass neben den aktivierenden anti-BCR-Antikörpern auch eine direkte Zell-Zell-Interaktion in den beobachteten Prozess involviert ist. Die Aufnahme von Granzym B in eine Zelle kann auch ohne Perforin erfolgen. Tatsächlich gibt es auch in der Literatur viele Hinweise auf alternative Wege der GrB-Aufnahme. Lediglich die Freisetzung von Granzym B aus den Endosomen in das Zytoplasma benötigt ein endosomolytisches Molekül wie etwa Perforin [12, 27]. Die Aufnahme in die Zielzelle selbst kann durch Flüssigphasen-Endozytose und Mannose-6-Phosphat vermittelte Aufnahme stattfinden [50, 66]. Für eine Freisetzung aus den Endosomen wurden ebenfalls zahlreiche alternative Moleküle zum Perforin beschrieben. So wurden zahlreiche virusassoziierte Moleküle identifiziert die endosomolytische Eigenschaften aufweisen, um so dem Virus zu ermöglichen, in das Zytoplasma der Zielzelle einzudringen [61, 74, 76]. Damit gilt Perforin heute nicht mehr als unabdingbar für die Induktion der GrB-vermittelten Apoptose [27, 50]. Diskussion 43 Die Versuche mit HeLa-Zellen wiederum, weisen darauf hin, dass es sich hierbei auch um eine durch Hitze-Schock-Proteine (HSP) vermittelte Aufnahme handeln könnte, da diese von Tumorzellen auf ihrer Oberfläche exprimiert werden und eine GrB-vermittelten Apoptose in Abwesenheit von Perforin durch diese Proteine bereits gezeigt werden konnte [30]. Die Ergebnisse der konfokalen Mikroskopie legen ein Rolle der CD5+ B-Zellen bei einer zytotoxischen B-Zell-vermittelten Immunantwort nahe, obwohl eine Apoptose der HeLa-Zellen während den sieben Stunden der Beobachtung nicht sicher nachgewiesen werden konnte. Hierfür sind weitere Versuche notwendig, in denen die Zellviabilität direkt untersucht wird. Ergebnisse aus nachfolgenden Untersuchungen unserer Arbeitsgruppe konnten zumindest für Granzym B, welches aus B-Zell-Linien wie ARH-77 stammt, eine zytotoxische Wirkung auf HeLa-Zellen nachweisen [35], so dass es sehr wahrscheinlich erscheint, dass auch CD5+ B-Zellen eine zytotoxische Funktion ausüben können. Für die antivirale Immunreaktion der GrB+ B-Zellen könnte das Fehlen von Perforin sogar eine funktionelle Bedeutung haben. Ohne die Möglichkeit, eine virusinfizierte Zelle an den auf ihr exprimierten MHC-Antigen-Komplexen zu erkennen, wäre eine zielgerichtete zytotoxische Immunantwort nicht möglich. Aus evolutionärer Sicht macht es daher Sinn, dass B-Zellen kein Perforin exprimieren. Das von ihnen sezernierte Granzym B könnte vielmehr zusammen mit den Viruspartikeln in infizierte Körperzellen aufgenommen werden und auf diese Weise zu einer Apoptose der Zellen führen. Dieser hypothetische Mechanismus wird durch mehrere Studien gestützt die zeigen konnten, dass exogenes Granzym B durch Viruspartikel pro-apoptotisch auf Zielzellen wirkt [27, 60]. Damit wäre sowohl der Transport in das Zytoplasma durch die endosomolytischen Eigenschaften der Viren gesichert, als auch eine Spezifität der Immunantwort garantiert, da nur von Viren infizierte Zellen in die Apoptose übergehen würden. Auf diesem Weg könnten GrB+ B-Zellen einer initialen Virusreplikation entgegenwirken, bis die adaptive Immunreaktion vollständig etabliert ist. Als Induktoren für GrB+ B-Zellen könnten, neben den bereits erwähnten NKT-Zellen, auch CD4+ T-Zellen dienen. Diese sind an der Etablierung der adaptiven Immunreaktion beteiligt und bedingen normalerweise eine Differenzierung von B-Zellen zu Plasmazellen durch CD40-Ligand-Expression und der Sekretion von IL-21 sowie IL-4 [3, 25, 49]. Dazu Diskussion müssen 44 CD4+ T-Zellen durch antigenpräsentierende Zellen über ihren T-Zell-Rezeptor (CD3) und den Korezeptor CD28 aktiviert werden. Im Gegensatz hierzu reicht für die IL-21-Sekretion bereits ein einfaches Calcium-Signal aus, wie es durch eine alleinige T-Zell-Rezeptoraktivierung zustande kommen kann [45, 65]. Damit könnten in der Frühphase einer Virusinfektion inkomplett aktivierte CD4+ T-Zellen, durch IL-21Sekretion, als Induktoren für GrB+ B-Zellen fungieren, während sie nach einer vollständigen Aktivierung durch antigenpräsentierende Zellen und zusätzlicher CD40-Ligand-Expression die Differenzierung zu Plasmazellen einleiten [25]. Tatsächlich ist es bereits gelungen, diese Hypothese in-vitro zu belegen. Nachfolgend durchgeführte Experimente unserer Arbeitgruppe haben gezeigt, dass inkomplett aktivierte + CD4 T-Zellen in der Lage sind, Granzym B in B-Zellen zu induzieren, wohingegen nach einer vollständigen Aktivierung durch zusätzliche CD28-Stimulation kein Granzym B in B-Zellen induziert wurde [35]. Damit wäre die GrB-Produktion in B-Zellen zeitlich auf eine frühe Phase der Infektion begrenzt. Die Terminierung ihrer GrB-Produktion würde durch CD40L-Kostimulation erfolgen, sobald vollständig aktivierte CD4+ T-Zellen am Ort der Infektion vorhanden sind. Gleichzeitig würden diese CD4+ T-Zellen dann eine Differenzierung der antigenspezifischen B-Zellen in Plasmazellen einleiten. Neben der Mitwirkung der GrB-sezernierenden B-Zellen an einer zytotoxischen Immunreaktion, sind auch weitere, alternative Funktionen des sezernierten Granzym B denkbar. So gibt es Hinweis darauf, dass Serinproteasen wie Granzym B zytokinähnliche Funktionen haben und so zu einer generalisierten, inflammatorischen Immunantwort beitragen könnten [60, 79]. Außerdem wurde Granzym B als eines der Effektormoleküle von regulatorischen T-Zellen [29, 75, 86] und regulatorisch wirkenden dentritischen Zellen [42] identifiziert. Diese Ergebnisse könnten auf eine ähnliche, immunmodulatorische Funktion des von B-Zellen sezernierten Granzym B hindeuten. In einer kürzlich veröffentlichen Arbeit konnte diese GrB-abhängige, regulatorische Funktion von GrB+ B-Zellen von unserer Arbeitsgruppe belegt werden [56]. Damit könnte Granzym B ein allgemeines Merkmal regulatorisch wirkender Zellen des menschlichen Immunsystems darstellen. In den letzten Jahren wurden vermehrt B-Zell-Subpopulationen mit immunsuppressiven und damit regulatorischen Eigenschaften beschrieben [10, 51]. Interessanterweise wurde als gemeinsames Merkmal regulatorischer B-Zellen dabei unter anderem die Expression des Oberflächenmoleküls CD5 identifiziert [23, 91], welches ebenso mit einem erhöhten Potential zur GrB-Expression in CD5+ B-Zellen assoziiert ist. Diskussion 45 Dieser Befund unterstützt die Vermutung einer regulatorischen Funktion vor allem der GrB+ CD5+ B-Zellen, und unterstreicht gleichzeitig die Wichtigkeit weiterer Untersuchungen auf dem Gebiet GrB-sezernierender B-Zellen. Letztendlich könnten GrB-sezernierende B-Zellen in einer frühen Phase einer Virusinfektion eine duale Rolle einnehmen. Einerseits kann das von ihnen sezernierte Granzym B direkt bei der Bekämpfung der Infektion helfen, indem es zusammen mit den Viren in die Zellen gelangt und Apoptose induziert, bevor eine Replikation des Virus stattfindet. Andererseits könnte das sezernierte Granzym B zusätzlich immunmodulatorische Aufgaben haben und so beispielsweise die Proliferation von antigen-unspezifischen T-Zellen am Ort der Infektion verhindern, bis antigenspezifische T-Zellen eintreffen. Insbesondere die regulatorischen Funktionen GrB+ B-Zellen sollten Gegenstand zukünftiger Studien sein. Erkenntnisse über ihre genaue Funktion im menschlichen Immunsystem könnten neue Therapiemöglichkeiten für Krankheiten mit einer gestörten Regulation des Immunsystems, wie Autoimmun- und Krebserkrankungen, eröffnen. Außerdem könnten sich neue Erkenntnisse über das Immunsystem im Neugeborenen mit seinen mehrheitlich CD5+ B-Zellen ergeben, sowie Möglichkeiten für die Entwicklung neuer Adjuvantien in Impfstoffen, welche die GrB-Expression in B-Zellen regulieren und damit eventuell ein besseres Ansprechen auf eine Impfung ermöglichen könnten. Zusammenfassung 46 5 Zusammenfassung Interleukin 21 (IL-21) ist ein im Jahr 2000 neu entdecktes Zytokin aus der Interleukin 2Familie, welches vielerlei Aufgaben innerhalb des Immunsystems besitzt. Seine Wirkung auf unterschiedliche Lymphozytenpopulationen ist abhängig von den jeweiligen Kofaktoren, die zusätzlich vorhanden sind. In B-Zellen kommt es vor allem zu einer Differenzierung zu Plasmazellen und zum Antigenswitch durch komplett aktivierte cluster of differentiation (CD) 4+ T-Zellen, welche zusätzlich CD40-Ligand exprimieren. Neuere Ergebnisse unserer Arbeitsgruppe haben gezeigt, dass IL-21, bei Fehlen einer Kostimulation mit CD40-Ligand, die Serinprotease Granzym B (GrB) in B-Zellen induziert. Diese Ergebnisse bilden die Grundlage für die vorliegende Arbeit, welche eine mögliche Funktion dieser neu entdeckten Fähigkeit von B-Zellen näher beleuchten soll. Das primäre Ziel war dabei die Identifikation eines natürlichen Stimulus für GrB-Induktion in B-Zellen. Außerdem sollte eine mögliche Mitwirkung solcher B-Zellen bei einer zytotoxischen Immunantwort untersucht werden. Durch Analyse der messenger Ribonukleinsäure (mRNA) konnte gezeigt werden, dass Granzym B in B-Zellen nicht konstitutiv exprimiert ist, sondern dass es unter Einfluss von IL-21 neu synthetisiert wird und damit ein neuer Differenzierungsweg in B-Zellen eingeleitet wird. Auf der Suche nach einem physiologischen Stimulus für die GrB-Induktion in B-Zellen wurde eine mögliche Rolle GrB+ B-Zellen bei viralen Infektionen genauer untersucht, da in einer frühen Phase der Infektion erhöhte IL-21-Spiegel im Blut nachweisbar sind. Zu diesem Zweck wurden B-Zellen von gesunden Pobanden vor und nach einer Impfung gegen Frühsommer-Meningoenzephalitis (FSME) auf ihr Potential als GrB-produzierende B-Zellen untersucht. Es konnte dabei gezeigt werden, dass B-Zellen geimpfter Spender, aber keine naiven B-Zellen ungeimpfter Probanden in der Lage waren, signifikante Mengen an GrB nach einer in-vitro Stimulation mit FSME-Antigenen und IL-21 zu exprimieren. Die Untersuchung der CD5+ B-Zellpopulation aus Nabelschnurblut ergab ein besonders hohes Potential dieser speziellen B-Zell-Population, GrB zu exprimieren. Zum einen war die Expression sowohl mit IL-21, als auch mit zusätzlicher Aktivierung durch B-Zell-Rezeptor-aktivierende Antikörper (anti-BCR), im Vergleich zu CD5- B-Zellen Zusammenfassung 47 signifikant erhöht. Zum anderen zeigte sich ein bedeutender Unterschied im Verhalten der B-Zellen auf einen erstmaligen Kontakt mit viralen Antigenen. CD5- B-Zellen erwachsener Spender benötigten eine in-vivo-Konditionierung durch die abgeschlossene FSME-Impfung, um auf den Antigenkontakt in-vitro mit GrB-Expression zu reagieren. Dagegen zeigten CD5+ B-Zellen eine direkte, signifikant erhöhte GrB-Expression bei erstmaligem Antigenkontakt. Die GrB-Expression konnte dabei durch Zugabe von Toll-like-Rezeptor 9-(TLR9)-blockierenden Oligonukleotiden signifikant gehemmt werden, so dass eine Antigenerkennung sowohl durch den B-Zell-Rezeptor als auch durch den TLR9-Signalweg für die GrB-Induktion in B-Zellen möglich ist. Für eine antivirale Immunreaktion ist es außerdem von Bedeutung, dass in B-Zellen kein Perforin exprimiert wird. Bei gleichzeitiger Expression von Perforin zur Translokation von GrB in das Zytoplasma könnte es zu einer ungerichteten Immunreaktion durch GrB-sezernierende B-Zellen kommen. In den letzten Jahren wurden zahlreiche alternative Moleküle zur Vermittlung von GrB-induzierter Apoptose beschrieben. Neben verschiedenen Viruspartikeln sind dies auch Hitze-Schock-Proteine, wie sie von Tumorzellen auf ihrer Oberfläche exprimiert werden. Hierdurch könnte eine spezifische Immunreaktion garantiert werden, ohne dass eine major histocompatibility complex (MHC)-abhängige Antigenerkennung nötig ist. Durch Versuche mit einem fluorogenen GrB-Substrat gelang in dieser Arbeit der Nachweis, dass Granzym B von CD5+ B-Zellen einerseits enzymatische Aktivität besitzt und andererseits auch in Tumorzellen transloziert wird. Damit sind alle theoretischen Voraussetzungen erfüllt, um bei einer zytotoxischen Immunantwort mitzuwirken. Neben der Induktion von Zellapoptose wurden zahlreiche weitere Funktionen des GrB beschrieben. Vor allem eine immunregulatorische Funktion erscheint dabei immer wahrscheinlicher und legt zusammen mit meinen Ergebnissen die Vermutung einer dualen Rolle von GrB+ B-Zellen in einer frühen Phase einer Virusinfektion nahe. Nach der Erkennung des Pathogens entwickeln sich dabei B-Zellen zu GrB-sezernierenden Zellen. Das freigesetzte GrB kann dann einer intitialen Virusreplikation durch Induktion von Apoptose in infizierten Zellen entgegenwirken und andererseits eine regulatorische Funktion auf parakrinem Wege erfüllen und damit die weitere Immunreaktion beeinflussen. Diese Ergebnisse könnten sowohl für neue Therapien gegen virale Infektionen, als auch bei Erkrankungen mit einer Fehlregulation der Immunreaktion wie Tumor- oder Autoimmunerkrankungen von großer Bedeutung sein und bedürfen weiterführender Untersuchungen. Literaturverzeichnis 48 6 Literaturverzeichnis [1] Ambrosino E, Berzofsky JA and Terabe M: Regulation of tumor immunity: the role of NKT cells. Expert Opin Biol Ther 8: 725-734 (2008) [2] Asao H, Okuyama C, Kumaki S, Ishii N, Tsuchiya S, Foster D and Sugamura K: Cutting edge: the common gamma-chain is an indispensable subunit of the IL-21 receptor complex. J Immunol 167: 1-5 (2001) [3] Avery DT, Bryant VL, Ma CS, de Waal Malefyt R and Tangye SG: IL-21-induced isotype switching to IgG and IgA by human naive B cells is differentially regulated by IL4. J Immunol 181: 1767-1779 (2008) [4] Bade B, Lohrmann J, ten Brinke A, Wolbink AM, Wolbink GJ, ten Berge IJ, Virchow JC, Jr., Luttmann W and Hack CE: Detection of soluble human granzyme K in vitro and in vivo. Eur J Immunol 35: 2940-2948 (2005) [5] Barrat FJ, Meeker T, Gregorio J, Chan JH, Uematsu S, Akira S, Chang B, Duramad O and Coffman RL: Nucleic acids of mammalian origin can act as endogenous ligands for Toll-like receptors and may promote systemic lupus erythematosus. J Exp Med 202: 11311139 (2005) [6] Berland R and Wortis HH: Origins and functions of B-1 cells with notes on the role of CD5. Annu Rev Immunol 20: 253-300 (2002) [7] Biron CA and Brossay L: NK cells and NKT cells in innate defense against viral infections. Curr Opin Immunol 13: 458-464 (2001) [8] Blanchard-Rohner G, Pulickal AS, Jol-van der Zijde CM, Snape MD and Pollard AJ: Appearance of peripheral blood plasma cells and memory B cells in a primary and secondary immune response in humans. Blood 114: 4998-5002 (2009) [9] Bossi G, Trambas C, Booth S, Clark R, Stinchcombe J and Griffiths GM: The secretory synapse: the secrets of a serial killer. Immunol Rev 189: 152-160 (2002) [10] Bouaziz JD, Yanaba K and Tedder TF: Regulatory B cells as inhibitors of immune responses and inflammation. Immunol Rev 224: 201-214 (2008) Literaturverzeichnis [11] 49 Brandt K, Bulfone-Paus S, Foster DC and Ruckert R: Interleukin-21 inhibits dendritic cell activation and maturation. Blood 102: 4090-4098 (2003) [12] Browne KA, Blink E, Sutton VR, Froelich CJ, Jans DA and Trapani JA: Cytosolic delivery of granzyme B by bacterial toxins: evidence that endosomal disruption, in addition to transmembrane pore formation, is an important function of perforin. Mol Cell Biol 19: 8604-8615 (1999) [13] Buzza MS and Bird PI: Extracellular granzymes: current perspectives. Biol Chem 387: 827-837 (2006) [14] Buzza MS, Dyson JM, Choi H, Gardiner EE, Andrews RK, Kaiserman D, Mitchell CA, Berndt MC, Dong JF and Bird PI: Antihemostatic activity of human granzyme B mediated by cleavage of von Willebrand factor. J Biol Chem 283: 22498-22504 (2008) [15] Casali P, Burastero SE, Nakamura M, Inghirami G and Notkins AL: Human lymphocytes making rheumatoid factor and antibody to ssDNA belong to Leu-1+ B-cell subset. Science 236: 77-81 (1987) [16] Casciola-Rosen L, Miagkov A, Nagaraju K, Askin F, Jacobson L, Rosen A and Drachman DB: Granzyme B: evidence for a role in the origin of myasthenia gravis. J Neuroimmunol 201-202: 33-40 (2008) [17] Cerutti A, Zan H, Schaffer A, Bergsagel L, Harindranath N, Max EE and Casali P: CD40 ligand and appropriate cytokines induce switching to IgG, IgA, and IgE and coordinated germinal center and plasmacytoid phenotypic differentiation in a human monoclonal IgM+IgD+ B cell line. J Immunol 160: 2145-2157 (1998) [18] Chiron D, Bekeredjian-Ding I, Pellat-Deceunynck C, Bataille R and Jego G: Toll- like receptors: lessons to learn from normal and malignant human B cells. Blood 112: 2205-2213 (2008) [19] Cong YZ, Rabin E and Wortis HH: Treatment of murine CD5- B cells with anti-Ig, but not LPS, induces surface CD5: two B-cell activation pathways. Int Immunol 3: 467476 (1991) Literaturverzeichnis [20] 50 Coquet JM, Kyparissoudis K, Pellicci DG, Besra G, Berzins SP, Smyth MJ and Godfrey DI: IL-21 is produced by NKT cells and modulates NKT cell activation and cytokine production. J Immunol 178: 2827-2834 (2007) [21] Darrah E and Rosen A: Granzyme B cleavage of autoantigens in autoimmunity. Cell Death Differ 17: 624-632 (2010) [22] Dasari P, Nicholson IC, Hodge G, Dandie GW and Zola H: Expression of toll-like receptors on B lymphocytes. Cell Immunol 236: 140-145 (2005) [23] DiLillo DJ, Matsushita T and Tedder TF: B10 cells and regulatory B cells balance immune responses during inflammation, autoimmunity, and cancer. Ann N Y Acad Sci 1183: 38-57 (2010) [24] Duan B and Morel L: Role of B-1a cells in autoimmunity. Autoimmun Rev 5: 403- 408 (2006) [25] Ettinger R, Sims GP, Fairhurst AM, Robbins R, da Silva YS, Spolski R, Leonard WJ and Lipsky PE: IL-21 induces differentiation of human naive and memory B cells into antibody-secreting plasma cells. J Immunol 175: 7867-7879 (2005) [26] Froelich CJ, Zhang X, Turbov J, Hudig D, Winkler U and Hanna WL: Human granzyme B degrades aggrecan proteoglycan in matrix synthesized by chondrocytes. J Immunol 151: 7161-7171 (1993) [27] Froelich CJ, Orth K, Turbov J, Seth P, Gottlieb R, Babior B, Shah GM, Bleackley RC, Dixit VM and Hanna W: New paradigm for lymphocyte granule-mediated cytotoxicity. Target cells bind and internalize granzyme B, but an endosomolytic agent is necessary for cytosolic delivery and subsequent apoptosis. J Biol Chem 271: 29073-29079 (1996) [28] Germain RN and Stefanova I: The dynamics of T cell receptor signaling: complex orchestration and the key roles of tempo and cooperation. Annu Rev Immunol 17: 467-522 (1999) [29] Gondek DC, Lu LF, Quezada SA, Sakaguchi S and Noelle RJ: Cutting edge: contact-mediated suppression by CD4+CD25+ regulatory cells involves a granzyme Bdependent, perforin-independent mechanism. J Immunol 174: 1783-1786 (2005) Literaturverzeichnis [30] 51 Gross C, Koelch W, DeMaio A, Arispe N and Multhoff G: Cell surface-bound heat shock protein 70 (Hsp70) mediates perforin-independent apoptosis by specific binding and uptake of granzyme B. J Biol Chem 278: 41173-41181 (2003) [31] Guerrier T, Pochard P, Lahiri A, Youinou P, Pers JO and Jamin C: TLR9 expressed on plasma membrane acts as a negative regulator of human B cell response. J Autoimmun DOI: 1-7 (2014) [32] Habib T, Senadheera S, Weinberg K and Kaushansky K: The common gamma chain (gamma c) is a required signaling component of the IL-21 receptor and supports IL21-induced cell proliferation via JAK3. Biochemistry 41: 8725-8731 (2002) [33] Hagn M, Schwesinger E, Ebel V, Sontheimer K, Maier J, Beyer T, Syrovets T, Laumonnier Y, Fabricius D, Simmet T and Jahrsdorfer B: Human B Cells Secrete Granzyme B When Recognizing Viral Antigens in the Context of the Acute Phase Cytokine IL-21. J Immunol 183: 1838-1845 (2009) [34] Hagn M, Ebel V, Sontheimer K, Schwesinger E, Lunov O, Beyer T, Fabricius D, Barth TF, Viardot A, Stilgenbauer S, Hepp J, Scharffetter-Kochanek K, Simmet T and Jahrsdorfer B: CD5+ B cells from individuals with systemic lupus erythematosus express granzyme B. Eur J Immunol 40: 2060-2069 (2010) [35] Hagn M, Sontheimer K, Dahlke K, Brueggemann S, Kaltenmeier C, Beyer T, Hofmann S, Lunov O, Barth TF, Fabricius D, Tron K, Nienhaus GU, Simmet T, Schrezenmeier H and Jahrsdorfer B: Human B cells differentiate into granzyme Bsecreting cytotoxic B lymphocytes upon incomplete T-cell help. Immunol Cell Biol 90: 457-467 (2012) [36] Hardy RR, Hayakawa K, Shimizu M, Yamasaki K and Kishimoto T: Rheumatoid factor secretion from human Leu-1+ B cells. Science 236: 81-83 (1987) [37] Haughton G, Arnold LW, Whitmore AC and Clarke SH: B-1 cells are made, not born. Immunol Today 14: 84-87; discussion 87-91 (1993) [38] Hayakawa K, Hardy RR, Honda M, Herzenberg LA and Steinberg AD: Ly-1 B cells: functionally distinct lymphocytes that secrete IgM autoantibodies. Proc Natl Acad Sci U S A 81: 2494-2498 (1984) Literaturverzeichnis [39] 52 Hayakawa K and Hardy RR: Normal, autoimmune, and malignant CD5+ B cells: the Ly-1 B lineage? Annu Rev Immunol 6: 197-218 (1988) [40] Holm C, Nyvold CG, Paludan SR, Thomsen AR and Hokland M: Interleukin-21 mRNA expression during virus infections. Cytokine 33: 41-45 (2006) [41] Jahrsdörfer B, Blackwell SE, Wooldridge JE, Huang J, Andreski MW, Jacobus LS, Taylor CM and Weiner GJ: B-chronic lymphocytic leukemia cells and other B cells can produce granzyme B and gain cytotoxic potential after interleukin-21-based activation. Blood 108: 2712-2719 (2006) [42] Jahrsdörfer B, Vollmer A, Blackwell SE, Maier J, Sontheimer K, Beyer T, Mandel B, Lunov O, Tron K, Nienhaus GU, Simmet T, Debatin KM, Weiner GJ and Fabricius D: Granzyme B produced by human plasmacytoid dendritic cells suppresses T-cell expansion. Blood 115: 1156-1165 (2010) [43] Jin H, Carrio R, Yu A and Malek TR: Distinct activation signals determine whether IL-21 induces B cell costimulation, growth arrest, or Bim-dependent apoptosis. J Immunol 173: 657-665 (2004) [44] Kägi D, Ledermann B, Burki K, Seiler P, Odermatt B, Olsen KJ, Podack ER, Zinkernagel RM and Hengartner H: Cytotoxicity mediated by T cells and natural killer cells is greatly impaired in perforin-deficient mice. Nature 369: 31-37 (1994) [45] Kim HP, Korn LL, Gamero AM and Leonard WJ: Calcium-dependent activation of interleukin-21 gene expression in T cells. J Biol Chem 280: 25291-25297 (2005) [46] Kim WJ, Kim H, Suk K and Lee WH: Macrophages express granzyme B in the lesion areas of atherosclerosis and rheumatoid arthritis. Immunol Lett 111: 57-65 (2007) [47] Kipps TJ: Human B cell biology. Int Rev Immunol 15: 243-264 (1997) [48] Konforte D and Paige CJ: Identification of cellular intermediates and molecular pathways induced by IL-21 in human B cells. J Immunol 177: 8381-8392 (2006) [49] Kuchen S, Robbins R, Sims GP, Sheng C, Phillips TM, Lipsky PE and Ettinger R: Essential role of IL-21 in B cell activation, expansion, and plasma cell generation during CD4+ T cell-B cell collaboration. J Immunol 179: 5886-5896 (2007) Literaturverzeichnis [50] 53 Kurschus FC, Kleinschmidt M, Fellows E, Dornmair K, Rudolph R, Lilie H and Jenne DE: Killing of target cells by redirected granzyme B in the absence of perforin. FEBS Lett 562: 87-92 (2004) [51] Lampropoulou V, Calderon-Gomez E, Roch T, Neves P, Shen P, Stervbo U, Boudinot P, Anderton SM and Fillatreau S: Suppressive functions of activated B cells in autoimmune diseases reveal the dual roles of Toll-like receptors in immunity. Immunol Rev 233: 146-161 (2010) [52] Lane P, Traunecker A, Hubele S, Inui S, Lanzavecchia A and Gray D: Activated human T cells express a ligand for the human B cell-associated antigen CD40 which participates in T cell-dependent activation of B lymphocytes. Eur J Immunol 22: 25732578 (1992) [53] Leonard WJ and Spolski R: Interleukin-21: a modulator of lymphoid proliferation, apoptosis and differentiation. Nat Rev Immunol 5: 688-698 (2005) [54] Leonard WJ, Zeng R and Spolski R: Interleukin 21: a cytokine/cytokine receptor system that has come of age. J Leukoc Biol 84: 348-356 (2008) [55] Lieberman J: The ABCs of granule-mediated cytotoxicity: new weapons in the arsenal. Nat Rev Immunol 3: 361-370 (2003) [56] Lindner S, Dahlke K, Sontheimer K, Hagn M, Kaltenmeier C, Barth TF, Beyer T, Reister F, Fabricius D, Lotfi R, Lunov O, Nienhaus GU, Simmet T, Kreienberg R, Moller P, Schrezenmeier H and Jahrsdorfer B: Interleukin 21-induced granzyme B-expressing B cells infiltrate tumors and regulate T cells. Cancer Res 73: 2468-2479 (2013) [57] Loeb CR, Harris JL and Craik CS: Granzyme B proteolyzes receptors important to proliferation and survival, tipping the balance toward apoptosis. J Biol Chem 281: 2832628335 (2006) [58] Luckheeram RV, Zhou R, Verma AD and Xia B: CD4(+)T cells: differentiation and functions. Clin Dev Immunol 2012: 925135 (2012) [59] Mahla RS, Reddy MC, Prasad DV and Kumar H: Sweeten PAMPs: Role of Sugar Complexed PAMPs in Innate Immunity and Vaccine Biology. Front Immunol 4: 248-264 (2013) Literaturverzeichnis [60] 54 Metkar SS, Menaa C, Pardo J, Wang B, Wallich R, Freudenberg M, Kim S, Raja SM, Shi L, Simon MM and Froelich CJ: Human and mouse granzyme a induce a proinflammatory cytokine response. Immunity 29: 720-733 (2008) [61] Nicola AV and Straus SE: Cellular and viral requirements for rapid endocytic entry of herpes simplex virus. J Virol 78: 7508-7517 (2004) [62] Noguchi M, Yi H, Rosenblatt HM, Filipovich AH, Adelstein S, Modi WS, McBride OW and Leonard WJ: Interleukin-2 receptor gamma chain mutation results in X-linked severe combined immunodeficiency in humans. Cell 73: 147-157 (1993) [63] Ozaki K, Kikly K, Michalovich D, Young PR and Leonard WJ: Cloning of a type I cytokine receptor most related to the IL-2 receptor beta chain. Proc Natl Acad Sci U S A 97: 11439-11444 (2000) [64] Pallikkuth S, Pilakka Kanthikeel S, Silva SY, Fischl M, Pahwa R and Pahwa S: Upregulation of IL-21 receptor on B cells and IL-21 secretion distinguishes novel 2009 H1N1 vaccine responders from nonresponders among HIV-infected persons on combination antiretroviral therapy. J Immunol 186: 6173-6181 (2011) [65] Parrish-Novak J, Dillon SR, Nelson A, Hammond A, Sprecher C, Gross JA, Johnston J, Madden K, Xu W, West J, Schrader S, Burkhead S, Heipel M, Brandt C, Kuijper JL, Kramer J, Conklin D, Presnell SR, Berry J, Shiota F, Bort S, Hambly K, Mudri S, Clegg C, Moore M, Grant FJ, Lofton-Day C, Gilbert T, Rayond F, Ching A, Yao L, Smith D, Webster P, Whitmore T, Maurer M, Kaushansky K, Holly RD and Foster D: Interleukin 21 and its receptor are involved in NK cell expansion and regulation of lymphocyte function. Nature 408: 57-63 (2000) [66] Pinkoski MJ, Hobman M, Heibein JA, Tomaselli K, Li F, Seth P, Froelich CJ and Bleackley RC: Entry and trafficking of granzyme B in target cells during granzyme Bperforin-mediated apoptosis. Blood 92: 1044-1054 (1998) [67] Pone EJ, Zan H, Zhang J, Al-Qahtani A, Xu Z and Casali P: Toll-like receptors and B-cell receptors synergize to induce immunoglobulin class-switch DNA recombination: relevance to microbial antibody responses. Crit Rev Immunol 30: 1-29 (2010) [68] Pone EJ, Zhang J, Mai T, White CA, Li G, Sakakura JK, Patel PJ, Al-Qahtani A, Zan H, Xu Z and Casali P: BCR-signalling synergizes with TLR-signalling for induction of Literaturverzeichnis 55 AID and immunoglobulin class-switching through the non-canonical NF-kappaB pathway. Nat Commun 3: 767-779 (2012) [69] Raja SM, Wang B, Dantuluri M, Desai UR, Demeler B, Spiegel K, Metkar SS and Froelich CJ: Cytotoxic cell granule-mediated apoptosis. Characterization of the macromolecular complex of granzyme B with serglycin. J Biol Chem 277: 49523-49530 (2002) [70] Rissoan MC, Duhen T, Bridon JM, Bendriss-Vermare N, Peronne C, de Saint Vis B, Briere F and Bates EE: Subtractive hybridization reveals the expression of immunoglobulin-like transcript 7, Eph-B1, granzyme B, and 3 novel transcripts in human plasmacytoid dendritic cells. Blood 100: 3295-3303 (2002) [71] Rosen A and Casciola-Rosen L: Autoantigens as substrates for apoptotic proteases: implications for the pathogenesis of systemic autoimmune disease. Cell Death Differ 6: 612 (1999) [72] Ruffin N, Lantto R, Pensieroso S, Sammicheli S, Hejdeman B, Rethi B and Chiodi F: Immune activation and increased IL-21R expression are associated with the loss of memory B cells during HIV-1 infection. J Intern Med 272: 1365-2796 (2012) [73] Russell JH and Ley TJ: Lymphocyte-mediated cytotoxicity. Annu Rev Immunol 20: 323-370 (2002) [74] Saeed MF, Kolokoltsov AA, Freiberg AN, Holbrook MR and Davey RA: Phosphoinositide-3 kinase-akt pathway controls cellular entry of ebola virus. PLoS Pathog 4: e1000141 (2008) [75] Salti SM, Hammelev EM, Grewal JL, Reddy ST, Zemple SJ, Grossman WJ, Grayson MH and Verbsky JW: Granzyme B regulates antiviral CD8+ T cell responses. J Immunol 187: 6301-6309 (2011) [76] Seth P: Mechanism of adenovirus-mediated endosome lysis: role of the intact adenovirus capsid structure. Biochem Biophys Res Commun 205: 1318-1324 (1994) [77] Shi L, Kam CM, Powers JC, Aebersold R and Greenberg AH: Purification of three cytotoxic lymphocyte granule serine proteases that induce apoptosis through distinct substrate and target cell interactions. J Exp Med 176: 1521-1529 (1992) Literaturverzeichnis [78] 56 Sims GP, Ettinger R, Shirota Y, Yarboro CH, Illei GG and Lipsky PE: Identification and characterization of circulating human transitional B cells. Blood 105: 4390-4398 (2005) [79] Sower LE, Froelich CJ, Allegretto N, Rose PM, Hanna WD and Klimpel GR: Extracellular activities of human granzyme A. Monocyte activation by granzyme A versus alpha-thrombin. J Immunol 156: 2585-2590 (1996) [80] Spaeny-Dekking EH, Hanna WL, Wolbink AM, Wever PC, Kummer AJ, Swaak AJ, Middeldorp JM, Huisman HG, Froelich CJ and Hack CE: Extracellular granzymes A and B in humans: detection of native species during CTL responses in vitro and in vivo. J Immunol 160: 3610-3616 (1998) [81] Strik MC, de Koning PJ, Kleijmeer MJ, Bladergroen BA, Wolbink AM, Griffith JM, Wouters D, Fukuoka Y, Schwartz LB, Hack CE, van Ham SM and Kummer JA: Human mast cells produce and release the cytotoxic lymphocyte associated protease granzyme B upon activation. Mol Immunol 44: 3462-3472 (2007) [82] ten Berge IJ, Wever PC, Wolbink AM, Surachno J, Wertheim PM, Spaeny LH and Hack CE: Increased systemic levels of soluble granzymes A and B during primary cytomegalovirus infection after renal transplantation. Transplant Proc 30: 3972-3974 (1998) [83] Trapani JA, Sutton VR and Smyth MJ: CTL granules: evolution of vesicles essential for combating virus infections. Immunol Today 20: 351-356 (1999) [84] Trombetta ES and Mellman I: Cell biology of antigen processing in vitro and in vivo. Annu Rev Immunol 23: 975-1028 (2005) [85] Tschopp CM, Spiegl N, Didichenko S, Lutmann W, Julius P, Virchow JC, Hack CE and Dahinden CA: Granzyme B, a novel mediator of allergic inflammation: its induction and release in blood basophils and human asthma. Blood 108: 2290-2299 (2006) [86] Vignali DA, Collison LW and Workman CJ: How regulatory T cells work. Nat Rev Immunol 8: 523-532 (2008) Literaturverzeichnis [87] 57 Vos Q, Lees A, Wu ZQ, Snapper CM and Mond JJ: B-cell activation by T-cell- independent type 2 antigens as an integral part of the humoral immune response to pathogenic microorganisms. Immunol Rev 176: 154-170 (2000) [88] Wagner C, Stegmaier S and Hansch GM: Expression of granzyme B in peripheral blood polymorphonuclear neutrophils (PMN), myeloid cell lines and in PMN derived from haemotopoietic stem cells in vitro. Mol Immunol 45: 1761-1766 (2008) [89] Waldhauer I and Steinle A: NK cells and cancer immunosurveillance. Oncogene 27: 5932-5943 (2008) [90] Wortis HH, Teutsch M, Higer M, Zheng J and Parker DC: B-cell activation by crosslinking of surface IgM or ligation of CD40 involves alternative signal pathways and results in different B-cell phenotypes. Proc Natl Acad Sci U S A 92: 3348-3352 (1995) [91] Yanaba K, Bouaziz JD, Haas KM, Poe JC, Fujimoto M and Tedder TF: A regulatory B cell subset with a unique CD1dhiCD5+ phenotype controls T cell-dependent inflammatory responses. Immunity 28: 639-650 (2008) [92] Youinou P and Renaudineau Y: The paradox of CD5-expressing B cells in systemic lupus erythematosus. Autoimmun Rev 7: 149-154 (2007) [93] Zeng R, Spolski R, Finkelstein SE, Oh S, Kovanen PE, Hinrichs CS, Pise-Masison CA, Radonovich MF, Brady JN, Restifo NP, Berzofsky JA and Leonard WJ: Synergy of IL-21 and IL-15 in regulating CD8+ T cell expansion and function. J Exp Med 201: 139148 (2005) Danksagung 58 Danksagung An dieser Stelle möchte ich mich herzlichst bei allen Kollegen und Freunden bedanken, die mich bei dieser Arbeit unterstützt und begleitet haben. Mein besonderer Dank gilt dabei meinem Doktorvater Professor Dr. med. Bernd Jahrsdörfer, der mir die Möglichkeit bot, als Mitglied seiner Arbeitsgruppe an der Erforschung der Granzym B-sezernierenden B-Zellen mitzuarbeiten. Seine Fachkenntnis und hilfreiche Beratung ermöglichten mir die Erstellung dieser Arbeit. Ohne seine unermüdliche Unterstützung und sein Engagement wäre es sehr schwierig gewesen, mir die komplexe Thematik und die immunologischen Arbeitsweisen anzueignen. Besten Dank für die vielen Denkanstöße und die etlichen Stunden des Korrekturlesens. Ich möchte mich ebenso besonders bei Dr. med. Magdalena Hagn für die hervorragende Betreuung während meiner gesamten Arbeit bedanken. Ihre Ideen und Unterstützung trugen entscheidend zum Gelingen dieser Arbeit bei. Durch die zahlreichen Diskussionen und die konstruktiven Gespräche wurde sie eine wertvolle Wegbegleiterin und Freundin. Ich möchte mich bei Thamara Bayer für die gute und kurzweilige Zusammenarbeit im Labor und ihre Hilfe beim Erarbeiten der Methodik bedanken. Auch möchte ich mich bei Professor Dr. med. Thomas Simmet für die Möglichkeit bedanken, meine Experimente am Institut für Naturheilkunde und klinische Pharmakologie durchzuführen. Für die Hilfe bei der Gewinnung der Nabelschnur-Blutspenden möchte ich mich bei Privatdozent Dr. med. Frank Reister und dem gesamten Team des Kreissaals des Universitätsklinikums Ulm bedanken. Ebenso gilt mein Dank in besonderem Maße all den freiwilligen Blutspendern ohne deren Zellen meine Experimente nicht möglich gewesen wären. Ich danke Dr. med. Daniel Zanker für die vielen Stunden voll konstruktiver Gespräche in den letzten Jahren und seine wertvollen Anmerkungen beim Korrekturlesen dieser Arbeit. Meinen Eltern, die mich stets auf meinem Weg begleitet und unterstützt haben, gebührt mein größter Dank für ihr stets offenes Ohr und die zahlreichen aufmunternden Gespräche. Veröffentlichungen: Die vorliegende Arbeit enthält Abbildungen und Inhalte die bereits im Rahmen folgender Veröffentlichungen publiziert wurden [33-35, 56]. Lebenslauf 59 Lebenslauf „Lebenslauf aus Gründen des Datenschutzes entfernt.“ Lebenslauf 60 „Lebenslauf aus Gründen des Datenschutzes entfernt.“ Lebenslauf 61 „Lebenslauf aus Gründen des Datenschutzes entfernt.“