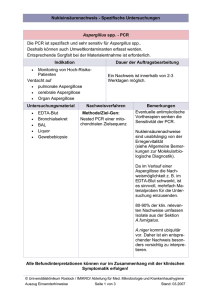
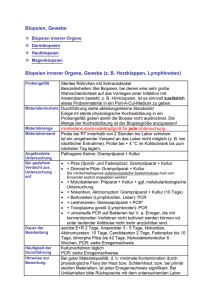
PCR bei IDEXX Vet Med Labor
Werbung

Oktober 07
Diagnostic
Update
%"4-"#03'®35*&33;5&
PCR bei IDEXX Vet•Med•Labor
Methodik und Relevanz für die tierärzliche Praxis
PCR (Polymerase Chain Reaction)
Das Basisverfahren molekulargenetisch-diagnostischer
Untersuchungen stellt die Polymerase Kettenreaktion
(Polymerase Chain Reaction, PCR) dar. Zu diesen Untersuchungen gehören der Nachweis von Infektionserregern
sowie genetische Mutationsanalysen. Die PCR ermöglicht
den empfindlichen Nachweis geringster Antigen-Konzentrationen im Patientenmaterial durch in vitro-Vermehrung
definierter DNA- bzw. RNA-Genabschnitte.
Der diagnostische Vorteil der PCR liegt in der Möglichkeit,
Technik der PCR
Die PCR läuft in drei Reaktionsschritten ab:
Im ersten Reaktionsschritt wird die zu vervielfältigende
(amplifizierende) DNA durch Erhitzen auf eine hohe Temperatur (z. B. 94° C) in zwei komplementäre Einzelstränge
aufgetrennt (denaturiert).
aus der Vielzahl der in einer Probe enthaltenen Nukleinsäuren (DNA oder RNA) ein spezifisches Segment soweit
zu vervielfältigen (amplifizieren), dass man es zum Nachweis messbar machen oder zur weiteren Identifizierung /
Charakterisierung sequenzieren kann. Es handelt sich bei
dem zum Infektionserregernachweis amplifizierten Nukleinsäuresegment um erregerspezifische DNA- oder RNASequenzen oder beim Nachweis von Erbkrankheiten um
Genabschnitte, auf denen eine entsprechende Veränderung (Mutation) lokalisiert ist. Zur Geschlechtsbestimmung
bei Vögeln wird beispielsweise ein Genomabschnitt amplifiziert, der aufgrund von Sequenzpolymorphismen auf dem
männlichen und dem weiblichen Geschlechtschromosom
unterschiedlich zusammengesetzt ist.
(Primer) anlagern (hybridisieren) kann. Der Bereich der
Template DNA zwischen den beiden Primern ist das DNASegment, das amplifiziert wird.
Die Spezifität der Primer für den nachzuweisenden Genomabschnitt wird anhand von Homologievergleichen mit
den in Datenbanken (GenBank/EMBL database) abgelegten Sequenzinformationen gewährleistet.
Die Primer dienen als Anknüpfungspunkt für die hitzestabile DNA-Polymerase (z. B. Taq-Polymerase).
Im zweiten Reaktionsschritt wird die Temperatur soweit abgesenkt, dass sich an jeden DNA-Einzelstrang (Template
DNA) ein spezifisches, komplementäres Oligonukleotid
In einem dritten Reaktionsschritt werden die Primer in
Anwesenheit eines hohen molaren Überschusses an
Desoxyribonukleosidtriphosphaten (dNTPs) mit Hilfe der
DNA-Polymerase Template-spezifisch verlängert. Es ent-
PCR
Polymerase Kettenreaktion
Blutzellen
Extraktion
Blutprobe
DNA
Auftrennen der DNA-Doppelhelix in zwei komplementäre Einzel
stränge (Denaturierung)
A
Wiederholungszyklen zur
exponentiellen Amplifikation
{
Amplifikation
í
í
Zielspezifische
Sequenz
Replizierte/
verdoppelte
Zielsequenz
C
B
Anbindung der
Primer an zielspezifische Sequenz
(Hybridisierung)
stehen dadurch zwei neue DNA-Doppelstränge. Das bei
der Reaktion entstandene Verlängerungsprodukt dient
wieder als Template für die ebenfalls im Überschuss
vorhandenen Primer.
Der Zyklus aus Denaturierung, Hybridisierung und
Verlängerung wird so oft wiederholt, bis die für weiterführende Analysen notwendige Menge an Reaktionsprodukt
(identische Kopien des Ausgangs-DNA-Segments)
entstanden ist.
Verschiedene Modifikationen im Testprotokoll erweitern
den Einsatzbereich der PCR.
Sie ermöglichen z. B.
• die Amplifikation von RNA für den Nachweis von
RNA-Viren oder Genexpressionsprodukten
• die Erhöhung der Spezifität und Sensitivität durch
Verwendung eines weiteren spezifischen
Primerpaares in der sogenannten “nested PCR”
vom Reaktionsbehälter und die Gelelektrophorese sind
zeitraubend und vergrößern die Gefahr einer möglichen
DNA-Verschleppung und Ko ntamination; die Wahrscheinlichkeit falsch positiver Ergebnisse ist erhöht. Aus diesem
Grund wird bei IDEXX Vet·Med·Labor eine große Anzahl
von Kontroll- und Sicherheitsmassnahmen (Extraktionskontrollen, Reagenzienkontrollen, Negativkontrollen,
quantifizierte Positivkontrollen, Kontaminationsmonitoring
in den Labors) durchgeführt, um die Kontaminationsgefahr
zu überwachen und auf ein Minimum zu reduzieren.
Die konventionelle Block-PCR ist seit dem Anfang der
1990er Jahre verfügbar, sie wird jedoch mehr und mehr
durch die real time-PCR ersetzt werden.
Was ist der Unterschied zwischen konventioneller und real time-PCR?
Konventionelle Block-PCR
In einem konventionellen PCR-Test wird die DNA-Amplifikation in einem sogenannten Block-Thermocycler
durchgeführt. Nach Abschluss der Reaktion muss die
amplifizierte DNA vom PCR-Instrument entfernt und über
eine Gelelektrophorese weiter prozessiert werden, um sie
sichtbar zu machen. Die Entnahme des PCR-Produktes
Vorteile der real time-PCR
In einem real time-PCR-Test beinhaltet die Reaktionsmischung zusätzlich zu den die Spezifität gewährleistenden
Oligonukleotid-Primern eine ebenfalls hochspezifisch nur
an die amplifizierte bzw. zu amplifizierende Target-DNA
bindende fluoreszenzmarkierte Sonde.
Die während der PCR freigesetzte Fluoreszenz ist direkt
proportional zur vorhandenen Target-DNA-Menge und wird
fortwährend über die Dauer der Amplifikationsreaktion
durch das PCR-Instrument gemessen.
Die amplifizierte DNA muss darum den Reaktionsbehälter
nicht verlassen, Ergebnisse sind schnell verfügbar.
Durch das geschlossene System ist die Gefahr einer Kontamination und DNA-Verschleppung erheblich reduziert
bzw. fast auszuschließen.
Neben ihrer hohen Sensitivität und Spezifität liegen die
größten Vorteile der real time-PCR in ihrer Schnelligkeit
und der Quantifizierung.
IDEXX Vet·Med·Labor bietet sowohl eigenständige real
Endpunktdetektion von PCR-Produkten mittels Agarose-Gelelektrophorese nach Abschluss einer konventionellen PCR.
Fluoreszenz-Messung zur Detektion positiver PCR-Produkte nach
Abschluss einer real time-PCR.
• die Quantifizierung der Ausgangs-DNA/-RNA durch
die Verwendung interner Standards z. B. mittels
real time-PCR
å
å Denaturierung
Die mit Fluoreszenz-Farbstoffen markierte
sequenzspezifische Sonde bindet noch
nicht an die DNA; der dem Reporterfarbstoff
(rot) benachbarte Quencher-Farbstoff (grau)
ç
verhindert die Entstehung einer messbaren
Fluoreszenz
ç Annealing
é
Primer und Sonde binden an DNA; der dem
Reporterfarbstoff (rot) benachbarte Quencher-Farbstoff (grau) verhindert weiterhin die
Entstehung einer messbaren Fluoreszenz
é+è Elongation
è
tionelle Block-PCR) wird auch nicht bestimmt, in welcher
Menge die Nukleinsäure in der Probe vorliegt. Quantitative
PCR-Methoden sind aber für relevante Parameter durch die
real time-PCR möglich.
Durch die 5‘-3‘-Exonucleaseaktivität der
Taq-Polymerase Hydrolyse der Sonde;
Reporter- und Quencher-Farbstoff werden
voneinander getrennt, die Fluoreszenz des
Reportesr-Farbstoffs wird messbar!.
time-PCR-Tests (IDEXX realPCR™) als auch Profile an, die
aus mehreren real time-PCR-Testsystemen bestehen und
aus einer einzigen Patientenprobe durchgeführt werden
können.
IDEXX realPCR™ Testergebnisse sind in der Regel bereits
wenige Stunden nach Probeneingang, spätestens jedoch
24 – 36 Stunden nach Probeneingang verfügbar.
Das geschlossene real time-PCR-System wie auch die
konventionelle PCR in Kombination mit strenger Prozesskontrolle und konstantem Qualitätsmanagement gemäß
unseren Akkreditierungsbestimmungen (DIN ISO 17025),
der DIN 58967-60 und der MIQ (Qualitätsstandards in der
mikrobiologisch-infektiologischen Diagnostik) liefern Ihnen
zuverlässige Resultate.
Wann sollten Sie PCR als ein diagnostisches
Werkzeug wählen?
Die PCR ist ein ausgezeichnetes diagnostisches Mittel,
um die Anwesenheit eines Infektionserregers in kranken
Tieren zu bestätigen oder auszuschließen. Wie bei anderen
diagnostischen Verfahren auch sollte die PCR nicht isoliert
angewendet werden. Beziehen Sie immer klinische Anzeichen/Symptome und andere Testergebnisse in die Diagnose mit ein.
Welche Bedeutung hat ein positives, welche
ein negatives PCR-Ergebnis?
Testinterpretation in der Erregerdiagnostik
Ein positives PCR-Ergebnis zeigt an, dass die gesuchte
Nukleinsäure im Untersuchungsmaterial vorhanden ist.
Eine Aussage darüber, ob der dadurch nachgewiesene
Erreger lebens- und vermehrungsfähig ist, kann nicht getroffen werden. Mit den üblichen PCR-Techniken (konven-
Es ist zu beachten, dass durch die hohe Sensitivität der
PCR-Technik schon geringste Kontaminationen mit der
gesuchten Nukleinsäure zu falsch positiven Ergebnissen
führen. Daher ist ein steriles Vorgehen bei der Probenentnahme und -verpackung notwendig.
Ein negatives PCR-Ergebnis zeigt an, dass zum Zeitpunkt
der Untersuchung das gesuchte Nukleinsäure-Segment in
der Probe nicht amplizifierbar war, entweder weil es nicht
oder in zu geringer Menge in der Probe vorlag.
Falsch negative Ergebnisse entstehen bei der Verwendung
ungeeigneter Proben, Inhibitoren (z. B. Heparin) enthaltender Proben und bei unsachgemäßer Behandlung der
Proben vor und während des Transportes (z. B. wiederholtes Einfrieren und Auftauen). Inhibitoren werden jedoch
bei der PCR-Analyse erkannt und wenn möglich entfernt.
Dadurch können durch Inhibitoren verursachte falsch
negative Ergebnisse vollständig vermieden werden. Sollte
eine Entfernung der Inhibitoren nicht möglich sein, wird das
Ergebnis entsprechend kommentiert.
PCR in der tierärztlichen Praxis
Die PCR ist eine Nachweismethode, bei der DNA / RNA
mit hoher Spezifität und Sensitivität nachgewiesen wird.
Dementsprechend ergeben sich für die Diagnostik andere
Indikationsgebiete als beispielsweise bei einem Antikörpernachweis. Im Folgenden soll ein Überblick über einige
Einsatzmöglichkeiten von molekularer Diagnostik mittels
PCR in der tierärztlichen Praxis gegeben werden.
Molekulargenetische Untersuchungen
Bei sehr vielen heriditären Erkrankungen ist die Lokalisation des Gendefektes bekannt. Mit Hilfe der PCR kann in
diesen Fällen eindeutig nachgewiesen werden, ob das
getestete Tier Träger des Defektes ist und diesen an seine
Nachkommen weitergeben kann bzw. selber Gefahr läuft,
zu erkranken. Die gentechnischen Untersuchungen werden
aus Schleimhautabstrichen oder EDTA-Blut durchgeführt.
Die Probenentnahme ist also nicht oder minimal invasiv
und kann auch bereits bei Welpen komplikationslos durchgeführt werden. Das Ergebnis ist eindeutig. Die genetischen Tests geben sowohl für die Zucht als auch für das
Einzeltier eine wertvolle Auskunft.
Geschlechtsbestimmung
Bei Vögeln ist die Geschlechtsbestimmung häufig nur mit
invasiven Mitteln (Endoskopie) möglich. Die PCR bietet
eine nicht bzw. minimal invasive Diagnostik mit eindeutiger
Aussage. Bereits eine Feder mit Federkiel oder ein Tropfen
EDTA-Blut reichen für die Geschlechtsbestimmung aus.
Selbst direkt nach dem Schlupf ist eine eindeutige Aussage über das Geschlecht durch die molekulare Analyse der
Eischale (Eihaut) möglich. Die Geschlechtsbestimmung ist
bei mehreren hundert Vogelarten möglich. Wenn Sie die
Untersuchung einer exotischen Art wünschen, nehmen Sie
bitte vorab Kontakt mit dem Labor auf.
Erregernachweis
Eine Infektionskrankheit kann mittels direktem Erregernachweis oder über Antikörper, die der Körper gegen den
Erreger gebildet hat, diagnostiziert werden. Die Bildung
von Antikörpern erfordert einige Zeit – i. d. R. ca. 14 Tage,
während derer einige Infektionen klinisch bereits bedeutsam sind. Ein großer Vorteil der PCR gegenüber serologischen Untersuchungen ist, dass Erreger häufig schon
vor einer Serokonversion, d.h. innerhalb der ersten 10 bis
14 Tage einer Infektion nachweisbar sind. Mit Hilfe der PCR
wird DNA / RNA detektiert. Im Falle einer Infektion wird
das Virus, das Bakterium bzw. der Parasit direkt nachge-
wiesen. Ein positives Ergebnis ist also beweisend für die
Anwesenheit des jeweiligen Erregers. Umgekehrt schließt
ein negatives Ergebnis eine Infektion nicht 100%ig aus.
Es bedeutet, dass zum Zeitpunkt der Untersuchung das
gesuchte Nukleinsäure-Segment in der Probe nicht amplifizierbar war, entweder weil es nicht oder in zu geringer
Menge in der Probe vorlag. Vor der Probenentnahme muss
also überlegt werden, in welchem Material (z. B. Blut, Urin,
Liquor, Organbioptat) sich der Erreger vermutlich in ausreichender Menge befindet. Außerdem sollte darauf geachtet
werden, dass bei Abstrichen auch Zellmaterial gewonnen
wird. Bei vielen Infektionen ist der Erreger zum Beispiel in
der Fieberphase, die ja häufig mit einer Bakteriämie/Virämie/Parasitämie einhergeht, im Blut nachweisbar.
Im Folgenden sollen einige Beispiele aus der Praxis die
Einsatzmöglichkeiten der molekularen Diagnostik mittels
PCR bei Infektionserkrankungen verdeutlichen.
1. Babesiose
Bei einer akuten Babesiose muss so schnell wie möglich
eine eindeutige Diagnose gestellt werden. Antikörper sind
aber oft erst 10 bis 14 Tage p. i. nachweisbar. Die Babesia
spp.-PCR aus dem EDTA-Blut gilt als Nachweismethode
der Wahl.
2. Mycoplasma haemofelis
Eine Infektion mit Mycoplasma haemofelis oder Candiatus
M. haemominutum (ehemals Haemobartonellen) soll abgeklärt werden. Auch in diesem Fall eignet sich EDTA-Blut als
Material für die PCR-Untersuchung. Der mikroskopische
Nachweis ist möglich, weist aber eine deutlich niedrigere
Sensitivität auf und ist daher nicht zu empfehlen.
3. Ehrlichiose/Anaplasmose
Auch wenn die klinischen Erkrankungen Ehrlichiose und
Anaplasmose sich unterscheiden, ist die Diagnostik ähnlich und wird daher parallel beschrieben:
Bei einem Hund besteht der Verdacht auf eine Ehrlichiose oder Anaplasmose. Der Hund hat seit wenigen Tagen
klinische Symptome. Eine Serokonversion findet bei einer
Ehrlichiose häufig erst 28 Tage post infektionem statt. Zur
Diagnosestellung wird eine PCR aus dem EDTA-Blut auf
Ehrlichia canis bzw. Anaplasma spp. durchgeführt. Zusätzlich kann mittels PCR aus Milz- bzw. Knochenmarksbioptaten ein Erregernachweis durchgeführt werden.
4. Staupevirusinfektion
Ein junger Hund hat Symptome, die verdächtig für eine
akute Staupevirusinfektion sind. Der Hund ist vor 4 Wo-
chen zum ersten Mal gegen Staupe geimpft worden. Der
Antikörpernachweis kann in diesem Fall nicht weiterhelfen,
da Impf- und Feldinfektion nicht unterschieden werden
können. Die PCR ist die Nachweismethode der Wahl. Welches Material geeignet ist, richtet sich nach den klinischen
Symptomen: bei Durchfall - ein Rektumschleimhautabstrich, bei Augen- / respiratorischen Symptomen – ein
Konjunktival- bzw. Nasenabstrich, bei Fieber – EDTA-Blut.
Wichtig ist, dass Zellmaterial (und nicht nur Eiter) gewonnen wird.
5. Chlamydien-, Mycoplasmen-, Herpesvirusinfektion des
Auges
Bei einer Katze wird eine einseitige Konjunktivitis festgestellt, die nach Therapie mit Gentamicin Augensalbe zwar
vorrübergehend besser wurde, dann aber wieder aufflammte. Inzwischen sind beide Augen betroffen. Die Katze
zeigt konjunktivale Hyperämie, Chemosis und serösen
Augenausfluss. Der Tierarzt möchte eine Chlamydieninfektion, sowie Infektionen mit Mycoplasmen und felinem
Herpesvirus ausschliessen. Die Probenentnahme für eine
PCR-Diagnostik von der Konjunktiva bzw. Kornea sollte mit
Hilfe eines sterilen trockenen Tupfers oder einer Cytobrush
erfolgen. Damit ausreichend Zellmaterial in der Probe
vorhanden ist, muss diese (nach lokaler Anästhesie) unter
leichtem Druck entnommen werden.
6. Felines Coronavirus
Die FIP / Coronavirus-Infektion der Katze bedeutet für den
praktischen Tierarzt nach wie vor eine diagnostische Herausforderung. Derzeit ist eine Unterscheidung zwischen
Felinem Infektiösen Peritonitisvirus (FIPV) und Felinem Enteralem Coronavirus (FECV) selbst mittels PCR noch nicht
möglich. Der Nachweis von Felinem Coronavirus (FCoV)
in Punktat oder Liquor spricht für das Vorliegen einer FIP,
vor allem wenn die Klinik und andere labordiagnostische
Befunde (Serologie, klinische Chemie) in dieselbe Richtung
weisen. Ein wichtiger Bestandteil der Pathogenese der FIPInfektion ist die Infektion von Monozyten und Makrophagen. Daher gilt der Nachweis von FCoV mittels PCR in der
Monozyten/Makrophagenfraktion des EDTA-Blutes (Buffy
Coat) als sehr spezifisch für eine FIP-Infektion.
Im Kot hingegen gibt der PCR-Nachweis von FCoV lediglich einen Hinweis auf eine Coronavirusinfektion. Er dient
der Identifizierung von Virusausscheidern. Da das Virus intermittierend ausgeschieden wird, kann die Sensitivität des
Testes erhöht werden, indem Sammelkotproben untersucht
werden.
7. Felines Immunodefizienzvirus (FIV)
Bei Infektionen mit dem Felinen Immunodefizienzvirus (FIV)
ist nach wie vor der Antikörpernachweis die Nachweismethode der Wahl. Mittels PCR können fraglich positive
oder negative ELISA-Ergebnisse überprüft werden, denn
in frühen Infektionsstadien können Antikörper noch nicht
nachgewiesen werden und im Endstadium der Erkrankung
sinken die Antikörper gelegentlich unter die Nachweisgrenze. Bei Katzenwelpen unter 6 Monaten Lebensalter können
maternale Antikörper zu positiven serologischen Ergebnissen führen, aus denen nicht auf eine Infektion des Welpen
geschlossen werden kann. In diesen Fällen eignet sich die
PCR aus dem EDTA-Blut zum Nachweis des FIV-Progenoms.
8. Felines Leukämievirus (FeLV)
Auch bei der Infektion mit dem Felinen Leukämievirus
(FeLV) dient die PCR vor allem der Überprüfung von ELISA-Ergebnissen (Antigennachweis), die mit der Klinik des
Tieres nicht korrelieren. Auf Grund ihrer hohen Spezifität
kann die PCR bei fraglichen Ergebnissen vor allem bei
latenten bzw. regressiven Infektionen als Bestätigungstest eingesetzt werden. Die Sensitivität der PCR aus dem
EDTA-Blut ist von der Zahl der infizierten Zellen, dem sogenannten Provirus-load, abhängig.
9. Leptospirose
Viele Tiere sind gegen Leptospirose geimpft, so dass im
Falle eines Infektionsverdachtes der Antikörpernachweis
den Tierarzt vor die Problematik stellt, Impf- und Infektionstiter zu unterscheiden. Zusätzlich kann eine klinische
Erkrankung bereits vor dem Auftreten spezifischer Antikörper bestehen. In der akuten Krankheitsphase (in den ersten
2 Wochen) kann der Erreger am besten aus dem Blut,
danach aus dem Urin mittels PCR nachgewiesen werden.
Die Ausscheidung mit dem Urin kann Monate bis Jahre
andauern. Mit Hilfe der PCR aus dem Urin können auch
chronische Ausscheider identifiziert werden. Da die Ausscheidung intermittierend ist, kann eine Sammelurinprobe
die Sensitivität der PCR Untersuchung steigern.
10. Parvovirose
Wie bei den meisten Infektionen, gegen die routinemäßig
geimpft wird, stellt sich auch bei der Parvovirose das Problem, dass Impf- und Infektionsantikörpertiter nicht unterschieden werden können. Auch in diesem Fall ist die PCR
eine sehr sensitive und spezifische Nachweismethode.
Sowohl beim Hund als auch bei der Katze kann das Virus
aus Kot oder Rektalabstrichen nachgewiesen werden.
Diagnostic
Update
Die neuen PCR Profile
Beim Hund wird außerdem routinemäßig eine Differenzierung in Impfstamm CPV 2 und Wildstämme CPV 2a / CPV
2b durchgeführt. Dies ist von diagnostischem Interesse, da
das Impfvirus 2 – 12 Tage nach der Impfung ebenfalls ausgeschieden werden kann. Die Ausscheidung von Feldvirus
beginnt ca. 3 – 4 Tage p.i. und hält i.d.R. 7 – 10 Tage an.
11. Leishmaniose
Die Leishmaniose ist eine Erkrankung, bei der die meisten
Hunde, die klinische Symptome zeigen, auch Antikörper
aufweisen. Tiere, welche asymptomatisch infiziert sind,
haben häufig keine oder niedrige Antikörpertiter. Bei diesen
Tieren ist der Nachweis mittels PCR hilfreich. Auch bei
Tieren mit positivem Antikörpertiter kann mittels PCR aus
Hautbioptaten überprüft werden, ob die jeweilige Veränderung Leishmanien-bedingt ist. Bei der Leishmaniose ist
das zu untersuchende Material sehr wichtig. Geeignet sind
bei Hautläsionen Hautbiopsien, bei Lymphadenopathie
Lymphknotenpunktate oder -bioptate, bei Rhinitis Nasenabstriche. Ausserdem ist der Nachweis aus Knochenmark-,
Leber- und Milzbioptaten sehr sensitiv. Auch aus Konjunktivaltupfern (beider Augen) können häufig Leishmanien
mittel PCR isoliert werden. Der PCR Nachweis aus dem
Blut ist ungeeignet.
Ab sofort verfügbar!
Antragscheine Molekulare
Diagnostik (PCR)
• Erregernachweise
• Mutationsanalysen
• Abstammungsnachweis
Profil Material
Profil Augeninfektionen Katze
Abstrich
Chlamydophila felis
(Konjunktiva /
Mycoplasma felis
Kornea)
Felines Herpesvirus (FHV 1)
Profil Oberer Atmungstrakt
Abstrich
Chlamydophila felis
(Rachen)
Felines Calicivirus
Felines Herpesvirus
Mycoplasma felis
Mykoplasmen Profil
EDTA Blut
Mycoplasma haemofelis Candidatus Mycoplasma
haemominutum
Candidatus Mycoplasma
turicensis
Zeckenprofil
Babesia spp.
Ehrlichia / Anaplasma spp.
Borrelia burgdorferi sensu lato
FSME
Zecke
Zeckenprofil – Blut
Babesia spp. Ehrlichia / Anaplasma spp.
EDTA Blut
Vogelprofil I – Basic
Feder / EDTA
PBFD-Virus
Polyoma-Virus
Vogelprofil II
Feder / EDTA
Basic + Cp. psittaci
+ Abstrich / Kot
Vogelprofil IlI
Feder / EDTA
Basic + Geschlechtsbestimmung Vogelprofil IV
Basic + Cp. psittaci +
Geschlechtsbestimmung
Autoren: Jörg Balzer, Dr. rer. nat. Abteilungsleitung Molekularbiologie
Maja Hirsch, Dr. med. vet.
FTA Klein- und Heimtiere
Literatur auf Anfrage
Feder / EDTA
+ Abstrich / Kot
Vet Med Labor GmbH
Division of IDEXX Laboratories
Mörikestraße 28/3
D–71636 Ludwigsburg
%"4-"#03'®35*&33;5&
Tel: +49 – (0)1802 – 83 86 33
Fax: +49 – (0) 7141 – 648 35 55
www.idexx.de
www.vetmedlabor.de
D-083-0807