Teil 2: Zellzyklus
Werbung

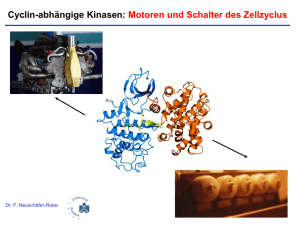
Teil 2 Der Zellzyklus und mögliche Störungen durch chemische Substanzen Hemmung der Zellzyklusprogression Gesteigerte oder unkontrollierte Zellzyklusprogression Hyperplasie Aplasie Karzinogenese Proliferierende Hepatozyte Proliferation bei der Leberregeneration Hoehme et al., PNAS, 107(23), 10371-6, 2010 Proliferierende Tumorzellen Proliferation von Tumorzellen Multistep Process of Carcinogenesis Procarcinogen Threshold mechanisms Metabolic activation Genotoxic carcinogen DNA damage Proliferation DNA mutations Metabolic inactivation DNA repair Cell cycle arrest Apoptosis Proliferation Multistep process of oncogene activation and tumor suppressor inactivation Proliferation Tumor Apoptosis Control by immune system Die Stadien des Zellzyklus Aus: Lodish, Molekulare Zellbiologie Cycline und Cyclin abhängige Kinasen (cdc): Motoren des Zellzyklus Cyclin abhängige Kinase (cdc) Cyclin cdc ohne Cyclin: inaktiv cdc mit Cyclin: aktiv Cycline und Cyclin abhängige Kinasen (cdk): Motoren des Zellzyklus Cyclin abhängige Kinase (cdk) Cyclin cdk ohne Cyclin: inaktiv cdk mit Cyclin: aktiv Phosphorylierung von Proteinen an Serin o. Threonin Aktivierung bzw. Inaktivierung nachgeschalteter Faktoren Beispiel: Aktivierung der cdk2 durch Komplexbildung mit Cyclin A cdk2 cdk2 Cyclin A Oszillation der Cycline D E A B Konzentration in der Zelle Cyclin G1 S G2 M Stadien des Zellzyklus Gegenwärtiges Modell für Säugerzellen Warum werden Cycline zu definierten Zellzyklusphasen wieder abgebaut? Ubiquitinligase (APC) Aus: Lodish, Molekulare Zellbiologie Regulation des Abbaus von Cyclin B /cdk 2 - Die Bindung des Erkennungsproteins (APC) ist Voraussetzung dafür, daß die Ubiquitin-Ligase aktiv werden kann. - Es gibt für viele Proteinklassen unterschiedliche Erkennungsproteine, aber nur eine Ubiquitinligase. MPF: Mitose promovierender Faktor; APC: Anaphase promoting complex (Erkennungsprotein) Gegenwärtiges Modell für Säugerzellen Die D-Cycline: Sensoren für Wachstumsfaktoren Wachstumsfaktor Zelle Rezeptor Signaltransduktions-Kaskade Verstärkte Transkription von Cyclin D Kern Aktivierung von cdk4, cdk6 G1–spezifische cdk/Cyclin-Komplexe G1-spezifische cdk/Cyclin-Komplexe aktivieren den Transkriptionsfaktor E2F E2F stimuliert die Transkription von Cyclin E / cdk2 Transkription von u.a: Aktiver Cyclin E / Cdk2-Komplex ● Dihydrofolatreduktase ● DNA-Polymerase α ● Cdc2 ● Cyclin A Übergang in die S-Phase Gegenwärtiges Modell für Säugerzellen Voraussetzung für die Zellteilung: Auflösung der Kernmembran Aufbau der Kernmenbran Elektronenmikroskopische Aufnahme der Kernfaserschicht Kernmembran: nuclear membrane Kernfaserschicht: nuclear lamina ● Lamin-Dimere polymerisieren zu Filamenten ● Phosphorylierung der Dimere an endständigem Serin treibt die Lamin-Dimere auseinander Aktives Cyclin B / cdk2: Auslösung der Mitose • Frühe Mitosevorgänge sind Folgen der Phosphorylierung durch Cyclin B / cdc2 (MPF) Beispiel Nr. 1: - Phosphorylierung von Kernlaminen (Lamin A) → Depolymerisation → Auflösung der Kernmembran - Phosphorylierung von Histon H1 → Kondensation der Chromosomen Trennung der Schwesterchromatiden nach Proteolyse der Proteinbrücke Abbau von Cyclin B: Abschluß der Mitose • Späte Mitosevorgänge sind Folgen der Dephosphorylierung durch „konstitutiv aktive“ Phosphatasen nach Abbau von Cyclin B / cdc2 Beispiel Nr. 1: Dephosphorylierung von Myosin → Steigerung der Kontraktilität des Myofilaments → Schwesterchromatide werden getrennt Gegenwärtiges Modell für Säugerzellen Steigerung der Kontraktilität von Myofilamenten: Ausfall der Phosphorylierung der inhibitorischen Stelle des Myosins nach Abbau von Cyclin B Abbau von Cyclin B: Abschluß der Mitose • Späte Mitosevorgänge sind Folgen der Dephosphorylierung durch „konstitutiv aktive“ Phosphatasen nach Abbau von Cyclin B / cdc2 Beispiel Nr. 2: Dephosphorylierung von Laminen der Kernmembran → Negative Ladung der Lamin-Dimere wird aufgehoben → Polymerisierung und Neubildung der Kernmembran wird wieder möglich Neubildung der Kernmembran → werden dephosphoryliert Gegenwärtiges Modell für Säugerzellen Regulation der Cdks • 1. P53 DNA-Schädigung P53-Akkumulation Transkription von P21 (synonym: CIP1 oder WAF1) Bindung an: - cdk4 / Cyclin D - cdk2 / Cyclin E G1 - Block Inaktivierung 2. Aktivierende und inaktivierende Domäne der cdk 2 Aktivierende Domäne: Phosphorylierung durch CAK (cdc aktivierende Kinase) (= cdc 7 / Cyclin H) → durch Phosphorylierung dieser aktivierenden Domäne (Thr-161) wird das katalytische Zentrum mit der ATPBindestelle frei (siehe Bild: DeBond et al., Nature 363, 595, 1993) Inaktivierende Domäne: - Wee 1 phosphoryliert und inaktiviert somit cdk2 - cdc25 dephosphoryliert und aktiviert somit cdk 2 3. Die INK-Familie Wichtigste Vertreter: p15INK4b, p16INK4a, p18INK4c, p19INK4d Mechanismus: Bindung an cdk4 und/oder cdk6 Abdissoziation von Cyclin D G1-Block 4. p21, p27, p57 Mechanismus: (i) Bindung an cdk4-, cdk6-, cdk2-Cyclin Komplexe → Inaktivierung (ii) Hemmung von CAK (Hemmung der Phosphorylierung der aktivierenden Domäne von cdc 2) Aktive Form der cdk2 (MPF) Cyclin B cdk2 Aktivierende Inaktivierende Domäne Domäne Krebs durch Störungen der Zellzykluskontrolle - Mutationen im P53-Gen (erblich: Li-Fraumeni) - Mutationen im Rb-Gen (erblich: Retinoblastom) Auslösende Substanzen: alle gentoxischen Mutagene Krebs durch Störungen der Zellzykluskontrolle - Überexpression von Cyclinen Beispiel: Integration des Hepatitis B-Virus vor das Cyclin A-Gen → Chimäres Protein, mit nicht-funktioneller Abbau-Sequenz - Zervixkarzinom durch Infektion mit dem Papillomvirus (HPV) HPV Expression der Proteine: E6 E7 Bindung an p53 Bindung an Rb Folgen: Inaktivierung von p53 und Rb Fusion mitotischer Zellen mit in der G1-Phase befindlichen Zellen Nachweis, daß die Phosphorylierungsstelle des Lamin A (Serin) für die Auflösung der Kernfaserschicht unerlässlich ist: - Gerichtete Mutagenese: Ersatz des Serins der normalen Phosphorylierungsstelle durch Alanin. Alanin kann nicht phosphoryliert werden. - Nachweis von Lamin A mit Fluorochrom-markierten Antikörpern - Nachweis von DNA mit dem Fluoreszenzfarbstoff DAPI Mutiertes Lamin A verhindert die Auflösung der Kernfaserschicht und die Trennung der Tochterkerne aus : Heald and McKeon, Cell 61, 579, 1990 Wildtyp Färbung von Lamin Färbung von DNA Mutierte Phosphorylierungsstelle Färbung von Lamin Färbung von DNA Nachweis, daß p53 für den G1-Block verantwortlich ist Kuerbitz et al., PNAS 89, 7491, 1992 Nachweis der Induktion von Zellzyklusprogression durch Die G1-Cycline (Cln1, Cln2, Cln2) bei Hefen - Glucose inaktiviert den GAL1-Promotor - Überexpression von Cln3 nach Glucoseentzug →Zunahme der Zellzahl in der S- und G2-Phase Richardson et al., Cell 59, 1989 Nachweis, daß Cyclin D für die DNA-Synthese unerläßlich ist DNA-Färbung mit DAPI Fluoreszein gekoppelter Antikörper gegen BRDU Texasrot gekoppelter Zweit-Antikörper gegen den AntiCyclin D Antikörper Baldin et al., Genes Dev. 7, 812, 1993 Die Stadien des Zellzyklus Aus: Lodish, Molekulare Zellbiologie