2012 Labordiagnostik_CDI Version1
Werbung

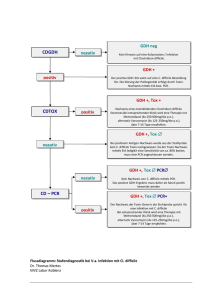
Empfehlungen zur Labordiagnostik bei Clostridium difficile-Infektionen C. difficile ist der häufigste Erreger nosokomialer, Antibiotika-assoziierter Durchfallerkrankungen (CDI). Daneben kommen C. difficile assoziierte Durchfallerkrankungen besonders im ambulanten Bereich auch ohne besondere Antibiotika Exposition vor („community-acquired CDI“). C. difficile ist einer der häufigsten bakteriellen Erreger von Durchfällen im Kinder- und Jugendalter. Bei Kindern <1 Jahr wird dagegen sehr häufig eine asymptomatischen Durchseuchung mit C. difficile beobachtet, so dass in dieser Altersgruppe in der Regel keine spezifische Diagnostik durchgeführt werden soll. Krankheitsauslösend sind ausschließlich Toxin produzierende „toxigene“ Stämme, die von „nicht-toxigenen“ Stämmen ohne Krankheitsrelevanz abgegrenzt werden müssen. Indikation für die mikrobiologische Diagnostik bei Verdacht auf CDI Die Diagnose der CDI orientiert sich primär am klinischen Befund. Dieser wird durch die parallel durchgeführte mikrobiologische Diagnostik gestützt. Dies bedeutet, dass ausschließlich symptomatische Patienten untersucht werden sollen. Folgeuntersuchungen bei Patienten mit erfolgreich behandelten Patienten mit CDI werden nicht empfohlen. -2- Tabelle 1: Mikrobiologische Methoden zum Nachweis von C. difficile Häufig verwendete Zeitbedarf Methoden Eigenschaften Anaerobe Kultur auf 3-7 Tage Selektivmedien, Hohe Sensitivität z.B. Cycloserine, Hohe Spezifität Cefoxitin, Fructose (CCFA, CLO) Toxin A/B Antigen Tests (EIA)* 1-3 Stunden Hohe Spezifität Geringe Sensitivität Glutamat Dehydrogenase (GLDH) Antigen Test (EIA) 1-3 Stunden Hohe Sensitivität für C. difficile Toxinnachweis fehlt Toxin PCR 2-24 Stunden Hohe Sensitivität Hohe Spezifität Bemerkung Goldstandard. Bestätigungstest für die Infektion mit klinisch relevanten Stämmen durch Nachweis der Toxinproduktion (Toxigene Kultur). Weitere genotypische und phänotypische Charakterisierung möglich (z.B. schwere bzw. rekurrente Fälle, nosokomiale Ausbrüche) Wenig sensitiver Nachweis der toxigenen Infektion. Aufgrund geringer Sensitivität kann der Toxin EIA nicht mehr als isolierter Suchtest empfohlen werden. Suchtest für die C. difficile Infektion. Unterscheidung von toxigenen und nicht-toxigenen Stämmen durch Zusatztests notwendig (z.B. Toxin EIA, PCR, Kultur). Sensitiver Direktnachweis der toxigenen Infektion. Durch den Nachweis charakteristischer Gene (Multiplex PCR) ist bereits häufig eine limitierte Subtypisierung möglich (z.B. Hinweis für Ribotyp 027). * Der Toxinnachweis aus Stuhl mithilfe der Zellkultur wird aufgrund der Komplexität der Zellkultur kaum noch diagnostisch eingesetzt. -3- Diagnostisches Procedere Aus Gründen der Praktikabilität und der Notwendigkeit einer hohen diagnostischen Sensitivität wird in der Regel ein zwei- bzw. mehrstufiges diagnostisches Vorgehen empfohlen. 1. Sensitiver C. difficile Suchtest a. Glutamat Dehydrogenase (GLDH) Antigen Test im Stuhl (EIA) Bemerkung: Mithilfe eines negativen GLDH Tests kann eine C. difficile Infektion mit hoher Sensitivität ausgeschlossen werden, d.h. weiterführende Untersuchungen sind in der Regel nicht indiziert. 2. Der positive GLDH Suchtest erfordert die weitere Differenzierung der „toxigenen“ vs. der „nicht-toxigenen“ Infektion a. Anaerobe Anzucht mit toxigener Kultur (Goldstandard) b. Toxin Antigen Nachweis im Stuhl (EIA) Bemerkung: Der Toxin A/B Nachweis beweist die toxigene Infektion. Der negative Toxin A/B Test schließt jedoch die toxigene Infektion aufgrund geringer Sensitivität NICHT aus. => Weiterer Bestätigungstest mithilfe der toxigenen Kultur oder PCR sinnvoll c. PCR mit Nachweis von Toxin Genen im Stuhl Bemerkung: Bei Diskrepanz der beiden Antigen Tests (GLDH positiv / Toxin negativ) kann die Frage toxigene vs. nicht-toxigene Infektion mithilfe der PCR definitiv geklärt werden -43. Typisierung von C. difficile Isolaten a. Genotypisierung mit Ribotypisierung oder surface-layer protein A Sequenzierung (slpAST) Bemerkung: Diese Untersuchung wird in spezialisierten Laboratorien angeboten (s. Konsiliarlabor C. difficile, Universität des Saarlandes) b. Resistentestung (z.B. E-Teste)* Bemerkung: Die anaerobe Anzucht auf Spezialmedien (z.B. CLO, CCFA Agar) wird bei allen Patienten mit schweren bzw. rekurrenten Infektionen empfohlen. Bei unkomplizierten Fällen kann der PCR Nachweis von C. difficile Toxingenen aufgrund der hohen Sensitivität und Spezifität wohl auch ein einzeitiges Vorgehen rechtfertigen. Umfangreiche klinische Studien stehen jedoch noch aus. * Die Antibiotika Resistenztestung von C. difficile wird aufgrund der aktuellen Resistenzsituation nur bei kritisch Kranken und bei Patienten mir Rekurrenz obligat empfohlen. Die Testung von Indikatorsubstanzen wie Moxifloxacin und Erythromycin/Claritromycin kann als Suchtest für epidemisch auftretende „hypervirulente“ Ribotyp 027 Stämme genutzt werden; leider weisen z.B. auch Ribotyp 001 Stämme ein identisches Resistenzmuster auf, so dass die zuverlässige Typisierung ausschließlich genotypisch mithilfe molekulargenetischer Verfahren erfolgen kann. Konsiliarlaboratorium für Clostridium difficile e-mail: [email protected] Institut für Medizinische Mikrobiologie und Hygiene Staatliche Medizinaluntersuchungsstelle Universitätsklinikum des Saarlandes Direktor: Prof. Dr. Mathias Herrmann Kirrberger Straße, Gebäude 43 66424 Homburg/Saar Ansprechpartner: PD Dr. Lutz von Müller Telefon: 06841 162-3907, -3912 (Labor), -3900 (Sekretariat) Telefax: 06841 162-3985 e-mail: [email protected]