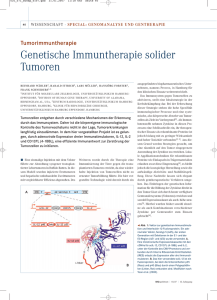
neuroendokrine tumoren - Netzwerk Neuroendokrine Tumoren (NeT)
Werbung

Neu Patientenbroschüre re roe Tum ndok ore rine n NEUROENDOKRINE TUMOREN des Magen-Darm-Traktes und der Bauchspeicheldrüse (GEP-NET) Umfassend fassend und d vverständlich erständlich iinformiert nformiertt • Geschichte • Diagnose • Selbsthilfeorganisationen für Patienten • Verschiedene Krankheitsbilder • Behandlungsmöglichkeiten • Kurzes Lexikon medizinischer Begriffe In Zusammenarbeit mit: Netzwerk Neuroendokrine Tumoren (NeT) e. V. Bundesorganisation Selbsthilfe NeuroEndokrine Tumoren e. V. AG NET der Deutschen Gesellschaft für Endokrinologie Covidien Deutschland GmbH Eine Initiative von Vorwort Neuroendokrine GEP-Tumoren (GEP-NET) sind im Vergleich zu Krebserkrankungen wie Lungen- Brust- oder Darmkrebs äußerst selten. Krebs 383,000 Erkrankungen pro Jahr GEP-Tumoren • 4000 Erkrankungen pro Jahr Bezogen auf 100.000 Einwohner werden in Deutschland pro Jahr nur ca. zwei bis fünf Neuerkrankungen diagnostiziert, insgesamt sind das – bezogen auf 80 Millionen Einwohner – also kaum mehr als etwa 1600 bis 4000 neu erkrankte Patienten pro Jahr. Entsprechend dieser geringen Häufigkeit gab es in der Vergangenheit nur ein äußerst geringes Informationsangebot für betroffene Patienten. Sie finden in den ohne größeren Aufwand zugänglichen Medien praktisch keine Informationen zu Ihrer Erkrankung. So ist es für Sie sehr schwer, sich über den wissenschaftlichen Fortschritt und die damit verbundenen Behandlungsmöglichkeiten zu informieren. Aufgaben und Ziele dieser Broschüre sind es daher, Ihnen als Patienten mit einem endokrinen GEP-Tumor – aber auch Ihren Angehörigen – einen ersten Überblick über die Erkrankung und ihre verschiedenen Formen zu geben. Dabei soll Ihnen zuerst ein Einblick in die Zusammenhänge der Krankheit, ihrer Mechanismen und ihrer Beschwerden vermittelt werden. Des Weiteren erfahren Sie das Wichtigste über die zur genauen Abklärung Ihrer Krankheit notwendigen Untersuchungen, über Behandlungsmöglichkeiten und die begleitenden Kontrolluntersuchungen. Am Ende dieser Broschüre finden Sie ein kurzes Lexikon mit den wichtigsten medizinischen Fachbegriffen. So werden Sie sich mit Ihrem Arzt besser verständigen und entsprechend Ihrer Situation und Ihrer Bedürfnisse genauer nachfragen und sich Klarheit verschaffen können. Als gut informierter Patient ist es Ihnen möglich, Ihren Heilungsprozess günstig zu beeinflussen, denn je besser Sie über Ihre Krankheit und über die verschiedenen Möglichkeiten Ihrer Behandlung informiert sind, um so aktiver und selbstverantwortlicher können Sie bei der Bewältigung Ihrer Erkrankung mitarbeiten. München, im Dezember 2008 (aktualisierte Auflage November 2010) Prof. Dr. med. R. Arnold 3 Inhalt 1. Was sind neuroendokrine GEP-Tumoren 6 1.1 Zuerst ein Überblick 6 1.2 Einblicke in die Geschichte der Entdeckung und Erforschung von GEP-Tumoren 9 2. Die verschiedenen Formen neuroendokriner GEPTumoren, ihre Symptome und Beschwerden 12 2.1 Karzinoide des Magen-Darm-Trakts 12 2.1.1 Inaktive Karzinoide 13 2.1.2 Das Karzinoid-Syndrom (aktive Tumoren) 13 2.2 Das Gastrinom (Zollinger-Ellison-Syndrom) 15 2.3 Das Insulinom 17 2.4 Weitere seltenere GEP-NET 18 2.4.1 Das Glukagonom 18 2.4.2 Das VIPom 20 2.4.3 Das Somatostatinom 21 2.4.4 Das MEN-Syndrom 22 3. Wie können GEP-Tumoren erkannt und gefunden werden? 26 3.1 Die klinische Diagnose 26 3.2 Die Labordiagnose 26 3.3 Der Tumormarker Chromogranin A 29 3.4 Die Darstellung von GEP-Tumoren durch bildgebende Verfahren 30 3.4.1 Die Computertomographie (CT) und die Magnetresonanztomographie 31 4 3.4.2 Die endoskopische Ultraschall-Untersuchung 32 3.4.3 Die Somatostatinrezeptor-Szintigraphie 33 3.4.4 Die Angiographie 37 3.4.5 Die Positronen-Emissions-Tomographie (PET) 38 3.4.6 Die Verlaufskontrolle 38 4. Wie können GEP-Tumoren behandelt werden? 39 4.1 Die chirurgische Entfernung 39 4.2 Die Behandlung mit Medikamenten 41 4.2.1 Somatostatin-Analoga 41 4.2.2 Interferon-α 47 4.2.3 Chemotherapie 48 4.3 49 Lokal ablative Behandlungsverfahren 4.3.1 Transarterielle Chemoembolisation (TACE) 49 4.3.2 Perkutane Alkoholinstillation 50 4.3.3 Radiofrequenzablation (RF) 51 4.3.4 Laserinduzierte interstitielle Thermotherapie (LITT) 51 4.3.5 Kryotherapie 51 4.3.6 Perkutane transarterielle 90Yttrium-Brachytherapie (selektive interne Radiotherapie, SIRT) 4.4 52 Die Radioligandentherapie (Peptidrezeptor-vermittelte Radiotherapie, PRRT) 52 4.5 Verlaufskontrollen 54 5. Patientenorganisationen 56 5.1 Netzwerk Neuroendokrine Tumoren (NeT) e. V. 56 5.2 Bundesorganisation Selbsthilfe NeuroEndokrine Tumoren e. V. 59 6. Erfahrungsberichte 61 7. Ausgewählte Internet-Adressen 67 8. Kleines Lexikon der medizinischen Begriffe 68 5 1. Was sind neuroendokrine GEP-Tumoren? 1.1 Zuerst ein Überblick Mit dem Kürzel GEP-NET werden in der medizinischen Fachsprache die (hormonproduzierenden) Gastro-Entero-Pankreatischen neuroendokrinen Tumoren bezeichnet*. Die drei Buchstaben stehen für die Organe bzw. die Orte, an denen diese Tumoren sich am häufigsten entwickeln: Gastro = Magen Entero = Darm Pankreas = Bauchspeicheldrüse GEP-Tumoren sind selten. Pro Jahr werden etwa 2 bis 5 neue Tumoren pro 100.000 Einwohner registriert – in der Bundesrepublik also ca. 1.600 bis 4.000 neue Fälle jährlich. Die GEP-Tumoren entwickeln sich aus hormonproduzierenden (endokrinen) Zellen, die überall im Verdauungssystem, aber auch an anderen Stellen des Körpers vorkommen und die Aufgabe haben, bestimmte Stoffe zu produzieren, die den Verdauungsprozess steuern. Von ihren Eigenschaften her besitzen diese Zellen Ähnlichkeiten mit Nervenzellen und von ihrer Funktion her zählen sie zu den inneren Drüsen. Daher werden sie neuroendokrine Zellen genannt. Die Mehrzahl dieser Tumoren entsteht also im Magen-Darm-Trakt. Ganz ähnliche Tumoren können aber auch in der Lunge, im Thymus, selten auch im Bereich der Eierstöcke, der Nieren und der Haut entstehen, weil auch hier neuroendokrine Vorläuferzellen vorkommen. * Alternative Bezeichnungen: Karzinoid, Apudom, neuroendokriner Tumor (NET), neuroendokrines Karzinom. Wir werden in dieser Broschüre den Ausdruck GEPTumoren oder GEP-NET verwenden. 6 Schematische Darstellung neuroendokriner Zellen Die GEP-Tumoren, die sich aus solchen Zellen entwickeln, werden dementsprechend auch als neuroendokrine Tumoren (abgekürzt NET) bezeichnet. Ungefähr zwei Drittel der GEP-Tumoren sind funktionell inaktiv, das heißt, sie schütten keine Hormone aus, obgleich sie Hormone oder andere Stoffe enthalten, die für endokrine Zellen typisch sind. Sie verursachen über längere Zeit kaum Beschwerden. Erst wenn ihr Wachstum weit fortgeschritten ist, kann es durch die Verdrängung benachbarter Organe oder Gewebestrukturen zu Beschwerden kommen. Weil die typischen Symptome fehlen, kann eine Diagnose oft erst lange Zeit, Jahre oder Jahrzehnte nach Entstehung dieser Tumoren gestellt werden. Etwa ein Drittel der GEP-Tumoren setzt aufgrund der Entwicklung aus hormonproduzierenden Zellen Hormone oder Hormon-ähnliche Stoffe frei. Man unterscheidet zunächst zwischen hormonbildenden Tumoren der Bauchspeicheldrüse (Pankreas) und hormonbildenden Tumoren des Magen-DarmTraktes, letztere werden oftmals auch „Karzinoide“ genannt. Je nachdem, welches Hormon ein derartiger Tumor produziert, kann er unterschiedliche Beschwerden verursachen und wird in diesem Zusammenhang auch nach dem gebildeten Hormon benannt. 7 Insgesamt kann man neuroendokrine GEP-Tumoren in drei Gruppen einteilen: 1. Tumoren, die Hormone freisetzen (funktionell aktiv) • Gastrinom • Insulinom • Glukagonom • VIPom Vorwiegend in der Bauchspeicheldrüse • Somatostatinom • Karzinoid-Syndrom Vorwiegend im Magen-Darm-Trakt 2. Tumoren, die kein Hormon freisetzen, obgleich sie Hormone enthalten (funktionell inaktiv) 3. Tumoren im Rahmen einer multiplen endokrinen Neoplasie (= MEN; funktionell aktiv oder inaktiv) Eine nähere Beschreibung der einzelnen Tumoren finden Sie im nächsten Kapitel. Eine andere Einteilung berücksichtigt den Ort ihrer Entstehung: Vorderdarm, Mitteldarm, Hinterdarm (siehe Abbildung auf Seite 9). 8 Ösophagus (Speiseröhre) Vorderdarm Ösophagus (Speiseröhre) Magen Duodenum (Zwölffingerdarm) Pankreas (Bauchspeicheldrüse) Bronchopulmonal (in Lunge/Bronchien) <1 2–30 2–5 <1 10–25 Mitteldarm Oberer Teil des Dünndarms Unterer Teil des Dünndarms Appendix (Wurmfortsatz) Leber Ovar (Eierstock) 1–2 15–20 19–35 <1 <1 Hinterdarm Colon (Dickdarm) Rektum (Mastdarm) Unbekannt 2–5 10–12 <1–2 Leber Magen Gallenblase Pankreas (Bauchspeicheldrüse) Duodenum (Zwölffingerdarm) Colon transversum Colon ascendens (aufsteigender Teil des Grimmdarms) Colon descendens Jejunum (Leerdarm) + Ileum (Krummdarm) Caecum (Blinddarm) Appendix (Wurmfortsatz) Rectum (Mastdarm) Ursprung und Häufigkeit neuroendokriner Tumoren (Angaben in %) (Abb. modifiziert nach Glandula NeT, Heft 8-2006, Seite 21; Beitrag von Prof. Dr. med. T. Meyer, Chirurgische Universitätsklinik Erlangen) 1.2 Einblicke in die Geschichte der Entdeckung und Erforschung von GEP-Tumoren • Schon im Jahre 1880 beschrieb Lubarsch einen neuen Tumortyp, den er bei der Untersuchung des Dünndarms zweier verstorbener Patienten fand. Anhand seiner Beschreibung wissen wir, dass es sich um ein Karzinoid bzw. um einen GEP-Tumor handelte. • Der Name „Karzinoid“ wurde 1907 von Oberndorfer eingeführt. Karzinoid bedeutet „karzinomähnlich“. Oberndorfer wollte so zum einen auf die Ähnlich- 9 keit mit den Karzinomen hinweisen, mit denen Karzinoide die Fähigkeit gemeinsam haben, Tochtergeschwülste (Metastasen) zu bilden. Des Weiteren wollte er damit zum Ausdruck bringen, dass Karzinoide meist viel langsamer wachsen als Karzinome. • Bayliss und Starling entdeckten im Jahre 1902 das Sekretin als erstes Hormon. Sie bezeichneten diese Substanz als „Hormon“ (das griechische Wort „Hormon“ bedeutet „zur Aktivität erwecken“), weil sie die Sekretion der Bauchspeicheldrüse aktiviert. Wenig später entdeckte Edkins das Gastrin, ein Hormon, das die Magensäureproduktion anregt. 1921 wurde das Insulin, das den Zuckerspiegel im Blut kontrolliert, durch den kanadischen Arzt Frederick Banting entdeckt. 1927 wurde das Cholezystokinin mit seiner die Entleerung der Gallenblase steuernden Wirkung von Ivy und Oldberg beschrieben. Diese Pionierarbeiten bildeten das Fundament für die klinische Erforschung der hormonell aktiven GEP-Tumoren. • Im Jahr 1930 präsentierte Cassidy einen Patienten mit einer anfallsartig auftretenden starken Gesichtsrötung, die bei Erregung oder während einer Mahlzeit noch stärker wurde. Das war die erste Beschreibung des Karzinoid-Syndroms. • Der Zusammenhang zwischen diesem Symptom und einem GEP-Tumor wurde zwischen 1952 und 1954 erkannt. In dieser Zeit wurden das Karzinoid-Syndrom und sein Beschwerdebild spezifisch beschrieben, nachdem aus einem Tumor des Magen-Darm-Traktes das Serotonin und die Substanz P isoliert worden waren. Diese Stoffe können, wenn sie im Überfluss vorliegen, eine anfallsartige Gesichtsrötung, Durchfall, eine Verengung der Bronchien (Atemwege) und Schädigung der Herzklappen verursachen. 10 • Im Jahr 1955 berichteten die Chirurgen Zollinger und Ellison über zwei Patienten mit einer ungewöhnlichen Kombination von Symptomen. Die Patienten litten unter Zwölffingerdarmgeschwüren, überhöhter Magensäurebildung und Durchfällen. Zollinger und Ellison vermuteten eine hormonelle Ursache. Ihre Vermutung wurde 1964 bestätigt, als es gelang, das Hormon Gastrin, das die Magensäureproduktion anregt, in reiner Form zu isolieren und einen Gastrin produzierenden Tumor – ein „Gastrinom“ – als die Ursache der beschriebenen Krankheit (Zollinger-Ellison-Syndrom) zu identifizieren. • Wenig später, im Jahr 1958, beschrieben Verner und Morrison einen Tumor der Bauchspeicheldrüse, der von nicht beherrschbaren wässrigen Durchfällen und Kaliummangel begleitet wurde. Die anschließende Erforschung dieser Krankheit zeigte, dass der Tumor ein Hormon produziert, das diese Symptome verursacht. Das Hormon wurde Vasoaktives Intestinales Peptid (d.h. gefäßwirksames Darmhormon), kurz VIP, genannt und der entsprechende Tumor als „VIPom“ und die Erkrankung als Verner-Morrison-Syndrom (alternativ: Pankreatische Cholera) bezeichnet. In den vergangenen 30 Jahren wurden mit der Verbesserung und Verfeinerung der Nachweismethoden für die verschiedenen Hormone und Hormon-ähnlichen Stoffe des Verdauungssystems weitere Typen von GEP-NET entdeckt und erforscht. Wir werden sie im nächsten Kapitel im Einzelnen besprechen. 11 2. Die verschiedenen Formen neuroendokriner GEP-Tumoren, ihre Symptome und Beschwerden 2.1 Karzinoide des Magen-Darm-Trakts Lokalisation Das sogenannte „Karzinoid“ ist der häufigste GEP-Tumor. Fast 50 % aller GEP-Tumoren sind Karzinoide und treten im Magen-Darm-Trakt auf. Sie können sich an verschiedenen Stellen des Magen-Darm-Trakts entwickeln. Vorzugsweise sind sie in verschiedenen Abschnitten des Dünndarms lokalisiert. Der Wurmfortsatz (Appendix), der Magen und der Dickdarm sind weitere bevorzugte Entstehungsorte. Etwa 10 % der Karzinoide kommen in anderen Organsystemen, z.B. in der Lunge und im Thymus vor. Karzinoide können sich an verschiedenen Stellen des Magen-Darm-Trakts entwickeln (angedeutet durch die roten Punkte) 12 2.1.1 Inaktive NET des Magen-Darm-Trakts Etwa 50 % der Magen-Darm-NET sind funktionell inaktiv, das heißt, sie setzen keine Hormone frei. Diese NET verursachen in der Regel erst spät im Verlauf der Krankheit Beschwerden. Die Symptome – z.B. Bauchschmerzen, Gewichtsverlust, Blutung oder Gelbsucht – sind uncharakteristisch. Sie sind auf die Einschränkung der Darmdurchblutung durch Ummauerung der den Darm versorgenden Blutgefäße durch eine Bildung von kollagenreichem Bindegewebe (sog. desmoplastische Reaktion) oder auf die Verdrängung benachbarter Organe oder Strukturen durch den wachsenden Tumor und dessen Metastasen zurückzuführen. Manchmal enstehen aber bereits früh Beschwerden, so unter Umständen bei NET der Appendix, die zu Symptomen einer akuten Appendizitis (Entzündung des Wurmfortsatzes, „Blinddarmentzündung“) Anlass geben können. Hier führt in der Regel die chirurgische Entfernung der Appendix (Appendektomie) zur Heilung, weil die dafür verantwortlichen Tumoren meist sehr klein sind. Auch NET des Enddarms werden häufig im Rahmen einer Routine-Darmspiegelung so frühzeitig entdeckt, dass ihre endoskopische Entfernung zur vollständigen Heilung führt 2.1.2 Das Karzinoid-Syndrom (aktive Tumoren) Hormonell aktive Karzinoide produzieren dagegen größere Mengen verschiedener Hormone, die in die Blutbahn gelangen. In den ersten Stadien der Erkrankung entstehen dadurch keine Beschwerden, weil die Leber diese Tumorhormone zu harmlosen Produkten abbaut. Wenn die Funktion der Leber aber durch Tochterabsiedlungen (Metastasen) des ursprünglichen Tumors beeinträchtigt ist, erhöht sich die Konzentration der Hormone im Blut und es entwickelt sich ein sog. Karzinoid-Syndrom. Die erhöhten Konzentrationen der verschiedenen Hormone führen dann zu unterschiedlichen Beschwerden. Tumoren, die für das Karzinoid-Syndrom verantwortlich sind, liegen meist im Dünndarm (Jejunum, Ileum). Häufig finden sich hier auch mehrere Tumoren. 13 Symptome und Beschwerden Die typischen Beschwerden für ein Karzinoid-Syndrom, die einzeln oder gemeinsam auftreten können, sind: 1. Anfallsartige Gesichtsrötung (Flush), die sich manchmal auf den gesamten Oberkörper ausdehnt und zum Teil von Herzklopfen und Schweißausbrüchen begleitet wird 2. Krampfartige Bauchschmerzen (bedingt durch die Einschränkung der Darmdurchblutung durch desmoplastische Reaktion, d.h. durch eine Verengung/ Sklerose der den Darm versorgenden Blutgefäße) und Durchfälle. Die krampfartigen Bauchschmerzen bestehen häufig bereits über Jahre und wurden in der Regel als „funktionell“ fehlgedeutet. Manchmal führen diese Bauchbeschwerden zu einem „akuten Abdomen“. Der Chirurg findet dann als Folge der Mangeldurchblutung einen bläulich veränderten Darm. 3. Herzbeschwerden 4. Atembeschwerden Patient mit typischen Anzeichen eines Flush (Gesichtsrötung) (Abbildung mit freundlicher Genehmigung von Prof. Dr. med. R. Arnold, München) 14 Die Häufigkeit des Auftretens dieser Beschwerden ist unterschiedlich. Am häufigsten – d.h. bei über 80 % der Patienten – treten Bauchschmerzen und Durchfälle auf. Es folgen Gesichtsrötung mit etwa 50 %, Atembeschwerden mit 20 % und schwere Atemnot mit 6 %. Herzbeschwerden entwickeln sich langsam und können zwischen 30 % und 50 % der Patienten mit einem Karzinoid-Syndrom betreffen. Nach heutiger Auffassung, die aber noch nicht als sicher gilt, wird die anfallsartige Gesichtsrötung durch gefäßaktive Stoffe wie Kallikrein, Substanz P und Neuropeptid K verursacht. Dieselben Hormone scheinen auch für die Atembeschwerden verantwortlich zu sein. Durchfälle werden auf die Tumorhormone Serotonin und Prostaglandin zurückgeführt. Das Serotonin scheint auch die Ursache für die Schädigung der Herzklappen und die dadurch entstehenden Herzbeschwerden zu sein. 2.2 Das Gastrinom (Zollinger-Ellison-Syndrom) Das Gastrinom oder Zollinger-Ellison-Syndrom (benannt nach den beiden Ärzten, die diese Krankheit als erste aus klinischer Sicht beschrieben haben) ist der zweithäufigste bösartige Tumor unter den GEP-Tumoren. Viele Gastrinome haben bereits zum Zeitpunkt ihrer Entdeckung Tochterabsiedlungen (Metastasen) gebildet. Gastrinome finden sich überwiegend in der Bauchspeicheldrüse und im Zwölffingerdarm 15 Lokalisation Die Verteilung Gastrin-produzierender Tumoren (Gastrinome) ist unterschiedlich. Sie kommen in etwa gleicher Häufigkeit (je 40 %) in der Bauchspeicheldrüse und im Zwölffingerdarm (Duodenum) vor. Etwa 10 % entstehen in anderen Organen. Der Nachweis des Tumors ist nicht immer möglich, weil die Tumoren besonders bei Sitz des Primärtumors im Duodenum oft sehr klein sind und so auch einer subtilen Diagnostik entgehen. Bei 30 % der Patienten mit den für ein Gastrinom typischen Beschwerden gelingt er mit den üblichen Verfahren nicht. Besonders die duodenalen Gastrinome sind häufig mit einer multiplen endokrinen Neoplasie Typ 1 (MEN 1) assoziiert. Symptome Gastrinome produzieren an erster Stelle Gastrin, ein Hormon, das die Magensäureausschüttung anregt. Das Ergebnis der Überproduktion von Gastrin ist eine Übersäuerung des Magens. Folge daraus sind Bauchbeschwerden, die Bildung von Zwölffingerdarmgeschwüren und Durchfälle – die Symptome eben, die typisch für das ZollingerEllison-Syndrom sind. Andere Hormone, die ebenfalls in Gastrinomzellen nachgewiesen wurden, scheinen keine wesentlich ausgeprägten Symptome und Beschwerden zu bedingen. 16 Gastrinome führen zu einer erhöhten Ausschüttung von Magensäure 2.3 Das Insulinom Lokalisation Das Insulinom ist der häufigste hormonproduzierende Tumor der Bauchspeicheldrüse (Pankreas) und in über 95 % gutartig. Etwa 30 % aller hormonell aktiven Tumoren der Bauchspeicheldrüse sind Insulinome. Diese Tumoren bestehen fast ausschließlich aus den insulinproduzierenden Zellen und produzieren selbst unkontrolliert Insulin, das Hormon, das den Zuckerspiegel im Blut steuert. Insulinome sind etwa gleichmäßig zu je einem Drittel auf Ein Insulinom liegt in der Regel Pankreas-Kopf, -Mittelteil und -Schwanz verteilt. in der Bauchspeicheldrüse Weniger als 1 % werden außerhalb der Bauchspeicheldrüse und in ihrer unmittelbaren Nachbarschaft gefunden. Symptome und Beschwerden Die Überproduktion von Insulin senkt den Zuckerspiegel im Blut und verursacht eine anhaltende Unterzuckerung. Allerdings sind die bekannten Beschwerden von Unterzuckerung wie Mattigkeit, Schwächegefühl, Zittern, Herzklopfen, Schwitzen, Hungergefühl, Gewichtszunahme und Nervosität bei Insulinom-Patienten oft weniger ausgeprägt als bei Insulin-spritzenden Diabetikern mit Zeichen der Unterzuckerung. Im Vordergrund stehen hier Störungen des zentralen Nervensystems wie Kopfschmerzen, Verwirrung, Sehstörungen, Störungen der Bewegungskoordination und Lähmungen sowie manchmal ausgeprägte Persönlichkeitsstörungen. In einigen wenigen Fällen können sich diese Symptome bis zur Bewusstlosigkeit, Krampfanfällen und Koma entwickeln. All diese Störungen sind auf die Unterzuckerung des Gehirns zurückzuführen (und können auch bei Unterzuckerung aus anderen Gründen auftreten). 17 Blutzucker (BZ) 160 mg/dl 140 Aufnahme von Kohlenhydraten Ausschüttung von Insulin Regulation des Blutzuckerspiegels in den Normbereich Übermäßige Produktion von Insulin durch ein Insulinom bewirkt Absenkung des Blutzuckerspiegels unter den Normbereich 120 100 Normale BZ-Spiegel 80 60 Absenkung des Blutzuckerspiegels durch Insulin 2.4 Weitere seltenere GEP-NET 2.4.1 Das Glukagonom Lokalisation Glukagonome entstehen fast ausschließlich in der Bauchspeicheldrüse. Inaktive Glukagonome Sie finden sich ausschließlich in der Bauchspeicheldrüse und werden zufällig, z.B. bei einer Operation der Bauchspeicheldrüse entdeckt. Sie sind auch typisch für die multiple endokrine Neoplasie Typ 1 (MEN 1). Bei der histologischen Untersuchung sind die Zellen der in der Regel sehr kleinen Tumoren voll von Glukagon, das die Zellen aber nicht freisetzen. Diese Tumoren werden fast nie bösartig. Aktive Glukagonome (Glukagonom-Syndrom) Hier handelt es sich um meist große Tumoren der Bauchspeicheldrüse, die in die Leber metastasieren können. Sie produzieren große Mengen des Hormons Glukagon, des Gegenspielers von Insulin: Während das Insulin den Zuckerspiegel senkt, erhöht das Glukagon diesen Spiegel. Diese Hormonüberproduktion führt zum Glukagonom-Sydrom. 18 Blutzucker (BZ) 160 mg/dl 140 120 Normale BZ-Spiegel 100 80 60 40 Ausschüttung von Glukagon Mobilisierung von Glukose Regulation des Blutzuckerspiegels in den Normbereich Übermäßige Produktion von Glukagon durch ein Glukagonom bewirkt Erhöhung des Blutzuckerspiegels über den Normbereich Erhöhung des Blutzuckerspiegels durch Glukagon Symptome und Beschwerden Die Erhöhung des Zuckerspiegels ist allerdings mild und es ist selten notwendig, eine Insulintherapie einzuleiten. Oft leiden die Patienten unter einem ausgeprägten Gewichtsverlust und Blutarmut (Anämie) und abwechselnd an Verstopfungen und Durchfällen. Das typische, sichtbare Symptom eines Glukagonom-Syndroms ist ein chronischer, wandernder, schwerer Ausschlag an Armen und Beinen, der oft von Entzündungen der Mundhöhle und der Zunge begleitet wird. Patientin mit typischem Ausschlag als Folge eines Glukagonoms (Abbildung mit freundlicher Genehmigung von Prof. Dr. med. R. Arnold, München) 19 2.4.2 Das VIPom Das VIPom entsteht durch die Überproduktion eines gefäßaktiven Hormons, das in der Medizin als vasoaktives intestinales-Peptid (VIP) bezeichnet wird. VIPome sind in der Regel große und maligne Tumoren und sehr selten. Sie machen weniger als 2 % aller GEP-Tumoren aus. Lokalisation Zu 90 % sind sie in der Bauchspeicheldrüse und zu 10 % insbesondere bei Kindern im Grenzstrang des Rückenmarks lokalisiert. Andere Organe sind äußerst selten Sitz eines VIPoms. In der Bauchspeicheldrüse selbst entwickeln sich etwa ein Viertel der Tumoren im Pankreas-Kopf und die restlichen drei Viertel im Mittelteil und Schwanz. Symptome und Beschwerden Die Überproduktion von VIP führt zu einer für das VIPom typischen Kombination von Beschwerden: Wässrige Durchfälle mit einer Ausscheidungsmenge von bis zu acht Liter pro Tag, Kaliummangel, Flüssigkeitsmangel und Magensäuremangel. Als Begleitsymptome sind oft Muskelschwäche, Übelkeit, Erbrechen und Bauchkrämpfe zu beobachten. In einigen Fällen entwickelt sich während der Durchfallattacken eine anfallsartige Gesichtsrötung (Flush) ähnlich wie beim Karzinoid-Syndrom. Etwa 50 % der Patienten leiden unter relativ konstanten Durchfällen. 20 2.4.3 Das Somatostatinom Auch das Somatostatinom gehört zu den sehr seltenen Tumortypen und umfasst nicht mehr als 1 % aller GEP-Tumoren. Manche Spezialisten sind sogar der Auffassung, dass es dieses Krankheitsbild gar nicht gibt, weil die für ein Somatostatinom typischen Beschwerden häufig auch in der Allgemeinbevölkerung anzutreffen sind. Das wirft die Frage auf, ob die Symptome wirklich tumorbedingt sind. Man geht heute eher davon aus, dass die zugrunde liegenden Tumoren funktionell inaktiv sind. Die Somatostatinproduktion durch den Tumor beweist das Krankheitsbild eines Somatostatinoms nicht, da auch andere Tumoren, insbesondere funktionell inaktive, d.h. stumme GEP-Tumoren, häufig Somatostatinzellen enthalten. Lokalisation Etwa 55–75 % der Somatostatinome sind in der Bauchspeicheldrüse und hier hauptsächlich im Kopf des Organs lokalisiert. Die restlichen Tumoren befinden sich überwiegend im Zwölffingerdarm. Hier können sie im Rahmen der multiplen endokrinen Neoplasie Typ 2b (MEN 2b) vorkommen. Symptome und Beschwerden Die typische Kombination von Symptomen ist nur selten vorhanden (Zuckerkrankheit, Durchfälle, Fettstühle, Magensäuremangel, Blutarmut und Gallensteine). In den meisten Fällen sind die Symptome sehr variabel und häufig auch nur mild ausgeprägt. Alle Symptome sind auf eine die Organfunktion hemmende Wirkung des Somatostatins zurückzuführen. 21 2.4.4 Das MEN-Syndrom MEN ist die Abkürzung für multiple endokrine Neoplasie, was so viel wie mehrfache hormonproduzierende Tumoren bedeutet. Man unterscheidet zwischen dem MEN 1- und dem MEN 2-Syndrom. Hier geht es um das MEN 1Syndrom. Tumoren, die innerhalb eines MEN 1-Syndroms auftreten, sind im Gegensatz zu den bisher beschriebenen Formen erblich bedingt. Sie lassen sich auf einen Defekt im Erbgut der Patienten zurückführen. Dieser Defekt wird so vererbt, dass er bei der Hälfte der Nachkommen eines betroffenen Elternteils wieder im Erbgut auftritt. Nicht betroffene Kinder können den Defekt nicht weiter vererben. Lokalisation Beim MEN-Syndrom können verschiedene Tumorkombinationen auftreten. GEP-Tumoren sind insbesondere beim MEN 1-Typ anzutreffen. Es handelt sich in der Regel um Tumoren der Bauchspeicheldrüse wie Insulinom, Glukagonom und Gastrinom (siehe dort). Gleichzeitig entwickeln sich Tumoren der Nebenschilddrüsen und/oder der Hirnanhangdrüse. Diese Tumoren können gleichzeitig oder nacheinander auftreten. 22 Beim MEN-Syndrom können an verschiedenen Stellen Tumoren auftreten Bildausschnitt oben rechts: Auch die Hirnanhangdrüse (Hypophyse) kann betroffen sein Symptome und Beschwerden Die Beschwerden beim MEN 1-Syndrom sind unterschiedlich, je nachdem, welche Hormon-produzierenden Tumoren sich entwickeln. Das Hormon der Nebenschilddrüse, das Parathormon, regelt den Kalzium- und Phosphathaushalt im Körper. Bei niedrigem Kalziumspiegel im Blut bewirkt das Parathormon eine vermehrte Freisetzung von Kalzium aus den Knochen und eine vermehrte Ausscheidung von Phosphat über die Nieren. Ist die Ausschüttung von Parathormon 23 durch den Nebenschilddrüsentumor erhöht, erhöht sich auch das Blutkalzium übermäßig. Das überschüssige Kalzium muss über die Nieren ausgeschieden werden und begünstigt die Bildung von Nierensteinen. Die Knochen verlieren mit der Zeit immer mehr Kalzium, wodurch es zu Knochen- und Gelenkschmerzen kommen kann. Die Störung des Kalziumhaushalts führt auch oft zu chronischer Verstopfung. Die häufigsten Symptome beim MEN 1-Syndrom sind Folge einer Tumorentwicklung in verschiedenen Organsystemen. Folgen eines Tumors der Nebenschilddrüse: • Nierensteine • Chronische Verstopfung Folge eines Tumors der Bauchspeicheldrüse mit Insulin-Produktion: • Unterzuckerung mit Zittern und Heißhunger Folge eines Gastrinoms: • Oberbauchbeschwerden und Magen-/Zwölffingerdarmgeschwüre Folge eines Glukagonoms: • Keine oder uncharakteristische Beschwerden 24 Bei Tumoren des Vorderlappens der Hirnanhangdrüse können dazu die Symptome der Überproduktion verschiedener Hormone auftreten: 1. Wachstumshormon: Bei Jugendlichen Riesenwuchs und bei Erwachsenen die sog. Akromegalie, ein vermehrtes Wachstum der Körperenden wie Nase, Lidwülste, Kinn, Hände und Füße 2. Prolaktin (steuert indirekt Sexualhormone und Fruchtbarkeit): Milchsekretion und Störungen der Regelblutung bei Frauen, Potenzprobleme bei Männern 3. ACTH (adrenokortikotropes Hormon, steuert die Freisetzung der Hormone der Nebennierenrinde): Gewichtszunahme, Hautveränderungen, Bluthochdruck, Muskelschwäche und Zuckerkrankheit Tumoren des Vorderlappens der Hirnanhangdrüse können die Produktion verschiedener 1. 2. 3. Hormone beeinflussen Zusätzliche Informationen zu MEN 1 finden Sie in einer Patientenbroschüre der MEN 1-Datenbank, die über das Netzwerk NeT zu beziehen ist (siehe Kapitel Patientenorganisationen). 25 3. Wie können GEP-Tumoren erkannt und gefunden werden? 3.1 Die klinische Diagnose Die GEP-Tumoren bieten aufgrund ihrer Vielfältigkeit eine Anzahl von diagnostischen Problemen, die den Einsatz verschiedener Methoden und Techniken verlangen. Der diagnostische Prozess für die GEP-Tumoren beginnt in der Praxis des niedergelassenen Arztes oder in der Klinik. Aufgrund der Symptome und der Befunde der ärztlichen Untersuchungen wird als erstes eine Verdachtsdiagnose gestellt. Sind die Symptome typisch für einen bestimmten Tumortyp, wie z.B. die anfallsartige Gesichtsrötung beim Karzinoid-Syndrom oder die massiven wässrigen Durchfälle beim VIPom, kann diese Verdachtsdiagnose meist schnell bestätigt werden. Sind die Symptome aber untypisch, so dass sie auch bei anderen nicht-tumorbedingten Erkrankungen auftreten können, wird die Tumordiagnose erst im Rahmen des „diagnostischen Work-Up“ gestellt. Bei funktionell inaktiven und langsam wachsenden Tumoren wird die Diagnose erst dann gestellt, wenn der Tumor durch seine Größe Beschwerden verursacht. Man hat berechnet, dass es im Einzelfall 5–10 Jahre dauern kann, bis ein solcher funktionell inaktiver Tumor schließlich diagnostiziert wird. 3.2 Die Labordiagnose Bei hormonell aktiven Tumoren stehen biochemische Untersuchungen, die sich am klinischen Verdacht orientieren, an erster Stelle. Der Nachweis entsprechend erhöhter Hormonspiegel im Blut oder der Hormonabbauprodukte im Urin gibt Aufschluss. Es versteht sich von selbst, dass bei inaktiven Tumoren solche Untersuchungen nicht eingesetzt werden können. 26 Der Nachweis der Hormonüberproduktion gelingt nicht immer. In einigen Fällen werden normale Hormonspiegel gemessen, obwohl die bestehenden Symptome auf eine Überproduktion hinweisen. In solchen Fällen werden sog. Provokationstests eingesetzt. So gelingt es auch in unklaren Fällen, die Erhöhung des entsprechenden Hormonspiegels nachzuweisen. Die am häufigsten eingesetzten Provokationsmethoden sind das kontrollierte Fasten und die Verabreichung von Stoffen, die anregend auf die Hormonproduktion wirken. In der folgenden Tabelle sind die wichtigsten dieser Tests zusammengefasst: Tumortyp Insulinom Gastrinom VIPom Beweisende Laborwerte Spezieller Test Neuroglukopenie (mangelnde Energieversorgung des Gehirns durch Zucker-[Glukose-] Mangel) Niedrige Blutglukose; dabei inadäquat zu hohe Serum-Insulin- bzw. CPeptidwerte (absolut sind die Insulin- und C-Peptidspiegel häufig nicht erhöht) Fastentest über max. 72 Stunden. Dabei regelmäßige Bestimmungen von Blutzucker und SerumInsulin bzw. C-Peptid Magen- und Zwölffingerdarmgeschwüre, Bauchschmerzen, wässrige Durchfälle Serum-Gastrin , Übermäßige Säuresekretion Sekretintest: Dabei steigt das Gastrin innerhalb von 2–5 Minuten „paradox“ um mindestens das Doppelte an Wässrige, massive (bis zu 8 l) Durchfälle, Schwäche, Muskelkrämpfe , Serum-VIP Serum-Kalium , verminderte Säuresekretion keiner , Serum-Glukagon Serum-Aminosäuren keiner Serum-Somatostatin , diabetische Stoffwechsellage keiner Leitsymptome (Hautausschlag: Wanderndes migraGlukagonomtorisches Erythem), Syndrom Diabetes mellitus (Zuckerkrankheit) SomatostatinomSyndrom Gallensteine, Diabetes mellitus, Bauchschmerzen, breiige Durchfälle Verschiedene Testverfahren im Rahmen der Labordiagnose 27 Die Methode der Wahl beim Karzinoid-Syndrom ist der Nachweis von Chromogranin A im Blut (siehe Kapitel 3.3) sowie eines spezifischen Abbauprodukts von Serotonin im Urin. Es handelt sich um die 5-Hydroxyindolessigsäure, abgekürzt 5-HIES. Für die Bestimmung dieses Stoffes muss der Urin über 24 Stunden in einem speziellen, mit Essigsäure versehenen Gefäß gesammelt werden. Da Serotonin auch in vielen Nahrungsmitteln, wie z.B. Tomaten, Nüssen oder Bananen enthalten ist, muss der Patient für mindestens 48 Stunden vor der Urinsammlung auf den Verzehr solcher Produkte verzichten, um ein falsches Ergebnis der Urinuntersuchung zu vermeiden. Nahrungsmittel, die durch ihren Serotoningehalt ein falsches Ergebnis bedingen können Auberginen Avocados Ananas Bananen Johannisbeeren Kiwis Mirabellen Melonen Pflaumen Stachelbeeren Tomaten Walnüsse Auch bestimmte Medikamente können zu falschen erhöhten (z.B. Paracetamol) oder falschen erniedrigten (z.B. Aspirin) Werten führen. Sie müssen daher rechtzeitig abgesetzt werden. 28 Arzneimittel mit möglichem Einfluss auf die 5-HIES-Bestimmung Arzneimittel, die ein falsches erhöhtes Ergebnis bedingen können Arzneimittel, die ein falsches erniedrigtes Ergebnis bedingen können Acetanilid Cumarine Coffein Ephedrinhydrochlorid Metamphetamin Methocarbamol Paracetamol Phenacetin Phenobarbital Phentolamin Aspirin Chlorpromazin Isoniazid Levodopa Promethazin Streptozotocin Die Aussagekraft einer einmaligen Bestimmung der 5-HIES im Urin ist nicht immer ausreichend. Daher wird sie in der Regel an drei aufeinander folgenden Tagen wiederholt. 3.3 Der Tumormarker Chromogranin A Eine weitere diagnostische Methode ist der Nachweis von sog. Tumormarkern im Blut. Man unterscheidet spezifische und allgemeine Tumormarker. Spezifische Marker sind z.B. das Serumgastrin beim Zollinger-Ellison-Syndrom, das VIP beim VIPom, das Glukagon beim Glukagonom-Syndrom u.a. Bei den allgemeinen Tumormarkern handelt es sich ebenfalls um Stoffe, die von den Tumorzellen produziert und in die Blutbahn abgegeben werden. Der wichtigste allgemeine Tumormarker für GEP-Tumoren ist das Chromogranin A. Dieser Stoff, eine Zucker-Eiweiß-Verbindung, ist bei funktionell aktiven und inaktiven Tumoren in 80–100 % der Fälle erhöht. Andererseits finden sich erhöhte Chromogranin-A-Spiegel auch ohne einen GEPTumor, so bei der Typ-A-Gastritis (atrophische Gastritis), bei Einnahme von Hemmern der Magensäuresekretion (Protonenpumpenhemmer) und bei einer eingeschränkten Nierenfunktion. Daher eignet sich ein positiver Nachweis von Chromogranin A nur zur Therapiekontrolle bei Patienten mit histologisch gesi- 29 cherten GEP-Tumoren. Für funktionell inaktive GEP-Tumoren und bei Patienten mit Karzinoid-Syndrom ist Chromogranin A heute der wichtigste Tumormarker. Weil Chromogranin A auch ohne einen GEP-Tumor erhöht sein kann, sollte eine Chromogranin-A-Bestimmung unbedingt unterbleiben, wenn es nur um die Frage geht, ob evtl. ein GEP-Tumor vorliegen könnte, auch wenn alle bildgebenden Verfahren gegen einen Tumor sprechen. Neuroendokriner GEP-Tumor (produziert den Tumormarker Chromogranin A) CgA Der GEP-Tumor gibt Chromogranin A (CgA) ins Blut ab Das Chromogranin A kann mittels Blut-Test nachgewiesen werden Chromogranin A aus Tumorzellen kann im Blut nachgewiesen werden 3.4 Die Darstellung von GEP-Tumoren durch bildgebende Verfahren Die Ortung des Tumors und seiner eventuell vorhandenen Tochterabsiedlungen ist die Voraussetzung für die Planung gezielter Behandlungsmaßnahmen und insbesondere der notwendigen chirurgischen Eingriffe. Am Anfang einer Diagnose steht häufig die Endoskopie zur Erkennung von Tumoren im Magen, 12-Fingerdarm oder Dickdarm. Die Kapselendoskopie eignet sich zum Auffinden von Tumoren des Dünndarms. Bei großen Tumoren oder bei Vorliegen von Metastasen in der Leber oder in Bauchlymphknoten erlaubt bereits der konventionelle Bauch-Ultraschall die Feststellung eines Tumors. 30 Natürlich ist für die Bestimmung des Tumortyps dann noch eine Feinnadelpunktion des Primärtumors oder einer seiner Tochtergeschwülste erforderlich. GEP-Tumoren sind in den meisten Fällen aber sehr klein und bilden sich oft innerhalb von Organen, z.B. in der Bauchspeicheldrüse oder der Darmwand. Hier sind in letzter Zeit besonders empfindliche Ortungsverfahren entwickelt worden, die eine gute Darstellung auch kleiner und subtiler Veränderungen ermöglichen. 3.4.1 Die Computertomographie (CT) und die Magnetresonanztomographie (MRT) Als Tomographie bezeichnet man in der Medizin die schichtweise Darstellung von inneren Organen und Strukturen. Dieses Verfahren, das schon in der konventionellen Röntgendiagnostik seit langer Zeit eingesetzt wird, konnte durch computerunterstützte Steuerung in den letzten zwei Jahrzehnten verfeinert werden. Auch bei der MRT wird das Gewebe schichtweise dargestellt. Im Gegensatz zur CT funktioniert die Kernspintomographie (MRT) der Leber. In beiden Leberlappen findet sich eine Vielzahl von MRT ohne Röntgenstrahlen. Metastasen (markiert durch * ). (Quelle: Glandula NeT, Heft Der Wert der tomographischen Verfahren 7-2006, Seite 40. Beitrag von liegt vor allem in der Erfassung von Tochterabsiedlungen des ursprünglichen Tumors in den Prof. Dr. Hans-Joachim Wagner, Berlin) Lymphknoten oder der Leber. Für die Ortung der GEP-Tumoren selbst ist der Nutzen dieser Verfahren von deren Größe abhängig. Tumoren, die im Durchmesser kleiner als 0,5 cm sind, werden nur zu etwa 10 % geortet. CT und MRT sind gleichwertige Untersuchungen. 31 3.4.2 Die endoskopische Ultraschall-Untersuchung Um die Nachteile der üblichen Ultraschalluntersuchung bei der Ortung kleinerer Tumoren zu überwinden, wurden spezielle Ultraschallköpfe entwickelt, die mit einem Endoskop oder einer Sonde in den Körper eingeführt werden und sich so in die Nähe des vermuteten Tumors bringen lassen. Dadurch erhöht sich die Empfindlichkeit der Ultraschalluntersuchung um ein Mehrfaches. Es lassen sich alle Bereiche des Verdauungssystems untersuchen, die mit einem Endoskop Bei der endoskopischen Ultraschalluntersuchung wird der Ultraschall- erreichbar sind. Das sind die Speiseröhre, kopf im Körper in die Nähe des der Magen und der Zwölffingerdarm und die vermuteten Tumors gebracht. Die benachbarten Organe sowie der Enddarm. Abbildung zeigt, wie das Endoskop Neben der Ortung der Tumoren ist mit dieser Methode auch eine Abschätzung der über die Speiseröhre in den Magen und dann in den Zwölffingerdarm gelangt örtlichen Tumorausbreitung möglich. Die Erfolgsraten bei der Ortung von Gastrinomen liegen bei bis zu 90 %. Bei Insulinomen, die fast immer innerhalb der Bauchspeicheldrüse wachsen, erreicht der endoskopische Ultraschall ebenfalls Erfolgsraten bis zu 90 %. Wie mit der Szintigraphie (siehe nächstes Kapitel) lassen sich mit dem endoskopischen Ultraschall auch hormonell inaktive Tumoren darstellen. 32 Endosonographie der Bauchspeicheldrüse mit Darstellung eines ca. 1 cm messenden neuroendokrinen Tumors (Insulinom). Der Tumor stellt sich als echoarme (dunkle), glatt begrenzte Struktur im umliegenden Bauchpeicheldrüsengewebe dar (Quelle: Glandula NeT, Heft 7-2006, Seite 26. Beitrag von Prof. Dr. med. Matthias M. Weber, Mainz) 3.4.3 Die Somatostatinrezeptor-Szintigraphie Die meisten GEP-Tumoren haben an ihrer Oberfläche spezifische Andockstellen (Rezeptoren) für das Hormon Somatostatin. An diesen Stellen muss das Hormon aufgenommen werden, um seine steuernde Funktion auf die Zelle ausüben zu können. Solche Rezeptoren kommen auch im gesunden Gewebe vor, aber ihre Dichte ist bei den GEP-Tumoren stark erhöht. Diesen Umstand nutzt das Verfahren der Somatostatinrezeptor-Szintigraphie. Injektion und Bindung einer Marker-Substanz zur Szintigraphie 33 Dabei wird ein stabiler Somatostatin-ähnlicher Stoff mit 111 Indium (einem radio- aktiven Stoff) markiert und dem Patienten in die Vene gespritzt. Die radioaktiv markierte Substanz bindet an die Somatostatinrezeptoren der Tumorzellen und die erhöhte Radioaktivität wird mit einem speziellen Gerät, der Gamma-Kamera, registriert. Mit dieser Methode kann der gesamte Körper untersucht werden. Im Bild der Gamma-Kamera erscheinen die Tumoren und ihre Tochterabsiedlungen als dunkle Stellen. Ganzkörperszintigraphie: Eine physiologische Anreicherung der markierten Substanz (sog. „Tracer“) findet sich in Leber, Nieren und Milz. Der Pfeil markiert die Tracerbindung an die Somatostatinrezeptoren eines Lungentumors. L = Leber, M = Milz, N = Niere. (Quelle: Glandula NeT, Heft 7-2006, S. 28; Original von Dr. med. A. Nömayr, Erlangen) Mit diesem Verfahren lassen sich bis zu 90 % der GEP-Tumoren und ihre Tochterabsiedlungen orten. Die Trefferquote ist bei Gastrinomen noch höher. Weniger erfolgreich ist die Somatostatinrezeptor-Szintigraphie bei der Erfassung von Insulinomen. Das ist darauf zurückzuführen, dass die Insulinomzellen zwar auch vermehrt Somatostatinrezeptoren besitzen, möglicherweise aber von einem 34 anderen Typ, der das markierte Diagnostikum nicht so stark bindet. Andere Somatostatin-ähnliche Stoffe, die sich besser an diesem Typ von Rezeptoren binden, sind in der Entwicklung. Diese Ortungsmethode ist so spezifisch und genau, dass sie heute bei der Diagnose der GEP-Tumoren als bildgebendes Verfahren der ersten Wahl eingesetzt wird. Ein positives Szintigramm hat auch prognostische Bedeutung: Der ermittelte Somatostatin-Rezeptorstatus kann Aufschluss über den Grad der Malignität (Entdifferenzierung) von Tumoren bzw. Tumorzellen geben. Der SomatostatinRezeptorstatus korreliert in der Regel gut mit der sekretionshemmenden Wirkung von Somatostatin-Analoga. Eine spezielle Vorbereitung des Patienten für die Szintigraphie ist nicht erforderlich, insbesondere muss keine Nahrungskarenz eingehalten werden. Eventuell ist vor der Szintigraphie die orale Gabe eines milden Laxans (Abführmittel) notwendig. Eine Somatostatin-Therapie kann fortgeführt werden. Unter der Voraussetzung, dass der für die Therapie zuständige Arzt zustimmt, wird jedoch eine Unterbrechung der Therapie für die Dauer von drei Tagen empfohlen. 3.4.4 Die Angiographie Angiographie bedeutet die Darstellung von Blutgefäßen im Röntgenbild. Dazu wird eine für Röntgenstrahlen undurchlässige Lösung in die Blutbahn gespritzt, ein sog. Röntgenkontrastmittel. Im Röntgenbild sind dann die Blutgefäße zu erkennen. Da die Um Blutgefäße im Röntgenbild sichtbar zu GEP-Tumoren in der Regel sehr machen, wird ein Kontrastmittel injiziert gut mit Blutgefäßen versorgt sind, d.h. besser als das umliegende Gewebe durchblutet sind, kann die Angiographie zur Darstellung des Tumors eingesetzt werden. 35 Angiographie. Die Spitze des Katheters (markiert durch den Pfeil) liegt in der Leberarterie. Beim Einspritzen des Kontrastmittels zeigt sich eine kräftige Durchblutung der Metastasen (markiert durch *). (Quelle: Glandula NeT, Heft 7-2006, Seite 41. Beitrag von Prof. Dr. Hans-Joachim Wagner, Berlin) Die Trefferquote dieser Methode liegt bei Gastrinomen und Insulinomen bei bis zu 60 %, bei Tochterabsiedlungen von Gastrinomen in der Leber sogar bei bis zu 86 %. Die Angiographie lässt sich gut mit einem CT oder MRT kombinieren, wodurch sich die Tumornachweisrate erhöht. 3.4.5 Die Positronen-Emissions-Tomographie (PET) PET ist ein relativ neues bildgebendes Verfahren, das darauf beruht, dass bestimmte Stoffe wie z.B. Glukose (radioaktiv markierte Fluor-18- Deoxyglukose = FDG), Amine (5-Hydroxytryptophan = 5-http) oder speziell markierte Somatostatin-Analoga (SMS-Rezeptor-PET mit sog. Gallium-68-DOTATOC) in die Tumorzelle aufgenommen werden und mittels PET die zelluläre Verstoffwechselung dieser Stoffe sichtbar gemacht werden kann. Das Verfahren wird bisher nicht routinemäßig in der Standarddiagnostik von NET eingesetzt und kommt nicht an allen Behandlungszentren zur Anwendung. In Frage kommt zur Darstellung der Tumoren ggf. auch eine so genannte PET/CT. Das ist eine Kombination aus zwei unterschiedlichen bildgebenden Untersuchungsverfahren, nämlich der PET und der Computertomographie (CT). Bei bestimmten Fragestellungen ergänzen sich die Informationen von PET und CT hervorragend und erlauben eine sehr genaue Diagnostik. 3.4.6 Die Verlaufskontrolle Viele der hier beschriebenen biochemischen und bildgebenden Verfahren werden auch bei der sehr wichtigen und regelmäßig notwendigen Verlaufskontrolle nach erfolgter Operation oder der Therapie mit Medikamenten eingesetzt. Mehr darüber finden Sie im nächsten Kapitel über die Behandlung der GEP-Tumoren. 36 Radioaktive Substanzen in Diagnostik und Therapie In der Medizin werden heute routinemäßig sog. Radionuklide für die bildgebende Diagnostik eingesetzt. Ein wichtiges Verfahren zur Lokalisierung von Tumoren ist die Szintigraphie. Dabei werden dem Patienten radioaktiv markierte Stoffe (Tracer) injiziert, die sich in dem zu untersuchenden Gewebe besonders gut anreichern und bei ihrem Zerfall Gamma-Strahlen aussenden. Diese werden von einer Gamma-Kamera aufgezeichnet. Für die Diagnostik neuroendokriner Tumoren wird ein radioaktiv markiertes Somatostatin-Analogon verwendet, das 111 111 Indium-Octreotid. Indium zerfällt mit einer Halbwertszeit von 67,3 Stunden zu nicht radio- aktivem 111 Cadmium. Die bei einer Szintigraphie frei werdende Energie (Äquivalentdosis) beträgt etwa 0,5 mSv (Milli-Sievert). Im Vergleich dazu liegt die Äquivalentdosis, der wir in Deutschland in der Natur ausgesetzt sind, bei durchschnittlich 0,34 mSv pro Jahr. Die Strahlenbelastung durch die Szintigraphie ist demnach relativ gering und erfolgt nur über eine sehr kurze Zeit. In der nuklearmedizinischen Therapie werden Radiopharmaka eingesetzt, die Beta- oder seltener Alpha-Strahlen abgeben. Diese Strahlungsarten zeichnen sich durch eine geringe Durchdringungstiefe (meist wenige Millimeter) aus und entfalten ihre Wirkung am Ort der Anreicherung im Organismus. Die längsten Erfahrungen bestehen mit der Radioiodtherapie des Schilddrüsenkarzinoms. Dabei erhält der Patient eine Kapsel mit einem radioaktiven Iodisotop (131Iod), das sich im Schilddrüsengewebe und iodspeichernden Metastasen anreichert. Beim Zerfall sendet 131 Iod Beta-Strahlen aus, die die umliegenden Zellen zerstören. Die Reichweite der Beta-Strahlung im Gewebe beträgt nur etwa 2 Millimeter. Deswegen kann die Radioiodbehandlung sehr gezielt unter weitgehender Schonung des gesunden Gewebes wirksam werden. 37 Ähnlich verhält es sich mit der 90 Yttrium-DOTATOC-Therapie, die speziell zur Behandlung neuroendokriner Tumoren eingesetzt wird. Das instabile 90Yttrium zerfällt, die Strahlenreichweite beträgt 1–6 mm. Das hat den Vorteil, dass auch bei sehr kleinen Tumorherden die emittierte Strahlung überwiegend im Tumor wirksam wird und gesundes Gewebe weitgehend geschont bleibt. Zudem klingt die Beta-Strahlung des Yttriums rasch wieder ab (Halbwertszeit = 2,7 Tage). Fazit: Die radioaktive Belastung des Patienten durch ein nuklearmedizinisches Untersuchungs- oder Therapieverfahren ist in der Regel gering, der Nutzen überwiegt das Risiko bei Weitem. Darstellung eines Szintigraphiebefundes (Doppelisotopentechnik 111Indium, sog. „anatomical landmarking“. Abbildung von Covidien Deutschland GmbH) 38 4. Wie können GEP-Tumoren behandelt werden? 4.1 Die chirurgische Entfernung Wie bei anderen Tumoren ist auch hier der chirurgische Eingriff zur Entfernung des Tumors und seiner möglichen Tochterabsiedlungen die Therapie der ersten Wahl. Ziel des Chirurgen ist es, möglichst den Primärtumor und soweit möglich bereits bestehende Metastasen vollständig zu entfernen. Das klingt einfach, kann aber den Chirurgen in einigen Fällen vor Probleme stellen. Ein chirurgischer Eingriff zur Entfernung des Tumors und seiner möglichen Tochterabsiedlungen ist in der Regel die Therapie der ersten Wahl Besonders bei den Insulin-produzierenden Tumoren der Bauchspeicheldrüse, die sehr klein und deshalb schwer zu finden sind, gibt es gelegentlich Probleme, die aber von einem erfahrenen Chirurgen fast immer gelöst werden können. Dabei können neue bildgebende Methoden hilfreich sein: 39 • Bei Tumoren der Bauchspeicheldrüse können während des Eingriffes spezielle Ultraschallsonden eingesetzt werden. • Bei der Untersuchung der Zwölffingerdarmwand auf kleine Tumoren wie Gastrinome hat sich die Methode der Durchleuchtung der Zwölffingerdarmwand von innen bewährt (Transillumination). Dabei wird der Zwölffingerdarm eröffnet und kann auch direkt inspiziert bzw. mit der Hand ausgetastet werden. Diese Methoden, zusammen mit der Abtastung der Organe durch den erfahrenen Chirurgen, führen in fast 100 % zur Ortung des Tumors und schaffen die Voraussetzung für eine erfolgreiche Operation. Auch wenn der Tumor bereits sehr groß ist und aufgrund seiner Lokalisation oder seines Entwicklungsstadiums nicht vollständig zu entfernen ist, kann eine teilweise Entfernung angezeigt sein: Die Verringerung der Tumormasse führt oft zu einer Abnahme der Hormonproduktion und so zu einer Besserung der Beschwerden. Wie schon erwähnt, werden auch Tochterabsiedlungen, wenn sie zugänglich sind, chirurgisch entfernt. Oft ist es dabei notwendig, einen Teil des betroffenen Organs mit heraus zu operieren. So werden Tochterabsiedlungen in der Leber, wenn sie nur in einem der zwei Leberlappen lokalisiert sind, zusammen mit dem betroffenen Lappen entfernt, wenn die alleinige Entfernung der Metastasen nicht möglich ist. Das restliche Lebergewebe kann die Funktion des entfernten Leberanteils in Folge mit übernehmen. 40 4.2 Die Behandlung mit Medikamenten Die Ziele einer medikamentösen Behandlung sind: 1. die Beschwerden zu lindern (Senkung der Hormonausschüttung), 2. das Tumorwachstum zu stoppen, 3. die Lebensqualität des Patienten zu verbessern. Die Wahl des Medikaments oder einer Kombination von Medikamenten muss sich jeweils am Tumortyp orientieren. Es gibt nur wenige Medikamente, die für einen universellen Einsatz bei den unterschiedlichen Typen von GEP-Tumoren geeignet sind. Sie sollen hier an erster Stelle beschrieben werden. 4.2.1 Somatostatin-Analoga Das im Hypothalamus (im Gehirn gelegene übergeordnete Steuerzentrale des Hormonsystem, s. Glossar) gebildete Somatostatin ist ein natürlicher Gegenspieler des Wachstumshormons, indem es dessen Produktion und Ausschüttung in der Hirnanhangdrüse, einer weiteren wichtigen Steuerzentrale des Hormonsystems, hemmt. Außerdem entfaltet Somatostatin eine sog. „antisekretorische Wirkung“, d.h., es verringert die Hormonproduktion in verschiedenen Körperzellen, so unter anderem die Insulin- und Glukagonproduktion der Bauchspeicheldrüse, die Freisetzung von Gastrin im Magen und sogar die Säuresekretion aus den säureproduzierenden Zellen des Magens. Somatostatin und seine Analoga entfalten ihre Wirkung durch Bindung an spezifische Zelloberflächenstrukturen, den sog. Somatostatin-Rezeptoren. Diese sind auch sehr häufig auf der Oberfläche der Zellen von GEP-NET vorhanden, was die Wirksamkeit von Somatostatin-Analoga bei diesen Tumoren erklärt. Somatostatin-Analoga können zum einen die übermäßige Hormonproduktion aus endokrinen GEPTumoren hemmen und zum anderen auch häufig die Vermehrung von endokrinen Tumorzellen eindämmen, d.h., sie können zu einem Stillstand, in seltenen Fällen auch zu einem Rückgang des Tumors führen. 41 Die spezifische Bindung von Somatostatin bzw. eines SomatostatinAnalogons (blaue Kugeln) an die Somatostatin-Rezeptoren (bunte Strukturen), die auf der Oberfläche der Tumorzellen vorkommen, vermittelt die Hemmung des Wachstumshormons. Bei Depotformen von Somatostatin-Analoga ist der Wirkstoff z.B. in Mikrokapseln eines Polymers (hellblaue Kapseln) eingebettet und garantiert so eine konstant gute therapeutische Wirkung über mehrere Wochen Die Entwicklung des ersten Somatostatin-Analogons 1968 wurde im Hypothalamus der Ratte erstmals ein Peptid (Eiweißstoff) entdeckt, das die Wachstumshormon-Sekretion hemmt. Die Struktur von Somatostatin und seine Wirkung wurden im Jahr 1973 durch R. Guillemin beschrieben. Für ihre Forschung auf diesem Gebiet wurden Schally und Guillemin 1977 durch den Nobelpreis gewürdigt. Bevor Guillemins Entdeckung medizinisch genutzt werden konnte, verging aber noch einige Zeit. Der schnelle Zerfall des natürlichen Somatostatins machte den Einsatz dieser Substanz als Medikament für eine Langzeittherapie erst einmal unmöglich. Durch die Entwicklung einer stabileren, dem Somatostatin in seiner Struktur und vor allem in seiner Wirkung sehr ähnlichen Substanz, einem sog. Somatostatin-Analogon, öffnete die SANDOZ-Forschung 1982 den Weg für eine neue, vielversprechende medikamentöse Therapie der Akromegalie und der neuroendokrinen Tumoren. 42 Aminosäuren notwendig für die Bindung an Somatostatinrezeptoren Grafik links: Struktur des natürlichen Somatostatins aus 14 Aminosäuren Grafik rechts: Struktur eines Analogons aus 8 Aminosäuren Somatostatin-Analoga gelten heute in der Behandlung der Akromegalie und der neuroendokrinen Tumoren als die medikamentöse Therapie der Wahl. Die Leistungen dieses ohne hohe Investitionen in eine umfangreiche Forschung nicht denkbaren Arzneimittels fanden 1991 Anerkennung in der Verleihung des renommierten internationalen Preises für innovative Arzneimittel (Prix Galien) für das erste und auch heute noch meist verwendete Somatostatin-Analogon. Anwendung Zunächst standen Somatostatin-Analoga nur als kurzwirksame Form zur Verfügung, die 3 x täglich unter die Haut (subkutan) gespritzt werden mussten. Eine ambulante Injektionstherapie führt jedoch häufig – mehr als andere medikamentöse Maßnahmen – zu spürbaren Einschränkungen in der Lebensqualität des Patienten. 43 Mehr Lebensqualität durch langwirkende Depotformen Bei der Entwicklung neuer Darreichungsformen stand die ständige praktische Verbesserung der Lebensqualität des Patienten im Mittelpunkt aller Bemühungen. Dies führte zur Entwicklung von Darreichungsformen mit Langzeit-Wirkung, sog. Depotformen. In einem aufwendigen Verfahren wird dafür der Wirkstoff in die Mikrokapseln eines Polymers eingebaut. Die Mikrokapseln werden im Körper nur langsam abgebaut und das Somatostatin-Analogon wird verzögert (retardiert) über einen längeren Zeitraum freigesetzt. Die erhältlichen Depotformen müssen in der Regel nur einmal im Monat in den Muskel (i.m.) bzw. tief subkutan injiziert werden. Das Monatsdepot ist genauso gut verträglich wie die bisher dreimal täglich zu injizierende Form. Heute erhalten Patienten in der Regel ein Depot-Somatostatin-Analogon verabreicht. Die kurz wirksame Form ist heute aber weiter von Bedeutung für die Einstellung auf die Therapie in den ersten Behandlungstagen sowie bei Bedarf als zusätzliche Maßnahme, wenn durch die Depotform die Symptome nicht ausreichend kontrolliert werden können. Mikroskopische Aufnahme der Mikrokapseln, in die das SomatostatinAnalogon eingebettet ist (Depotform) 44 Somatostatin-Analoga bei den verschiedenen GEP-NET Somatostatin-Analoga haben, wie das natürliche Somatostatin, zweierlei Wirkungen: 1. Sie hemmen die Produktion von Hormonen und Hormon-ähnlichen Stoffen durch die Tumorzellen. Die Beschwerden werden dadurch gelindert oder in vielen Fällen vollständig behoben. 2. Studien sprechen dafür, dass sie eine hemmende Wirkung auf das Tumorwachstum haben. Eine Reihe der mit Somatostatin-Analoga behandelten NET erreichen einen lang anhaltenden Wachstumsstillstand und einige wenige sogar eine Verkleinerung. Andere Tumoren wachsen allerdings langsam weiter. Vor allem die in Deutschland durchgeführte PROMID Studie hat bei bestimmten NET des Mitteldarms nachgewiesen, dass unter der Behandlung mit dem in der Studie untersuchten Somatostatin-Analogon die Zeit bis zum Fortschreiten des Tumorwachstums gegenüber der Kontrollbehandlung mit einem Scheinmedikament (Placebo) deutlich verlängert werden konnte. Das bedeutet, das Risiko eines weiteren Tumorwachstums wurde durch das Somatostatin-Analogon bei dieser Art von NET verringert. Für einige GEP-Tumoren, wie z.B. das KarzinoidSyndrom, das VIPom und das Glukagonom-Syndrom, ist die Behandlung mit Somatostatin-Analoga die Therapie der ersten Wahl. Beim Karzinoid-Syndrom (Leitsymptome: anfallsartige Gesichtsrötung [Flush], Durchfälle und Bauchschmerzen) lassen unter Somatostatin-Analoga die Häufigkeit der Flush-Anfälle und ihre Intensität deutlich nach. Die Durchfälle und die begleitenden Bauchschmerzen werden weitgehend beherrscht und verschwinden in einigen Fällen vollständig. Lebensrettend können Somatostatin-Analoga in der Behandlung und Vorbeugung einer Verengung der Bronchien mit starker Atemnot sein, die sich im Rahmen einer Karzinoidkrise z.B. während einer Narkose entwickeln kann. 45 Beim VIPom (Leitsymptome: massive Durchfälle bis zu 8 l pro Tag, Austrocknung, Kaliummangel) werden unter Somatostatin-Analoga die Durchfälle und somit auch der Flüssigkeits- und Kaliumverlust gestoppt. Beim Glukagonom-Syndrom (Leitsymptome: Schwerer Hautausschlag, Mundschleimhautentzündung, Blutarmut und Zuckerkrankheit) bewirken Somatostatin-Analoga eine dramatische Besserung des Hautausschlags. Die Schleimhautentzündungen bilden sich zurück und das Blutbild normalisiert sich allmählich. Die Zuckerkrankheit kann sich allerdings unter der Behandlung mit Somatostatin-Analoga verschlechtern. Grund dafür ist, dass SomatostatinAnaloga nicht nur die Überproduktion von Glukagon, sondern auch die normale Insulinproduktion hemmen. Bei Insulinomen ist die Gabe von Somatostatin-Analoga weniger erfolgreich. Nur etwa die Hälfte der Insulinome sprechen darauf an. Man vermutet, dass entweder nicht alle Insulinome Somastotatinrezeptoren besitzen oder dass ein anderer Somatostatinrezeptor-Typ vorliegt, an den die Somatostatin-Analoga nicht oder nur sehr schwach anbinden können. Die Behandlung des Insulinoms mit Somatostatin-Analoga muss am Anfang unter strenger Überwachung erfolgen. Der Grund dafür ist, dass Somatostatin-Analoga auch auf die Produktion von Glukagon, dem Gegenspieler von Insulin, eine hemmende Wirkung ausüben. Dadurch kann in einigen Fällen die Unterzuckerung verschlimmert werden. Erst wenn dies ausgeschlossen wurde, darf eine regelmäßige Behandlung mit Somatostatin-Analoga verordnet werden. In der Behandlung des Gastrinoms spielen Somatostatin-Analoga eine untergeordnete Rolle. An erster Stelle werden Medikamente wie z.B. die Protonenpumpenhemmer eingesetzt, die an der Magenschleimhaut wirken und dort die Magensäureproduktion hemmen. Gute Verträglichkeit Somatostatin-Analoga werden in der Regel sehr gut vertragen. Nebenwirkungen sind meist vorübergehend und von leichter Ausprägung. 46 Bei Therapiebeginn treten bei einigen Patienten vorübergehend Bauchschmerzen, Blähungen, Übelkeit, Fettstühle und Durchfälle auf. Andere bekannte Nebenwirkungen sind Schmerzen, Kribbeln oder Brennen mit Rötung und Schwellung an der Injektionsstelle, insbesondere dann, wenn das Präparat nicht vor dem Spritzen auf Zimmertemperatur erwärmt wurde. Diese Beschwerden dauern in der Regel nicht länger als 15 Minuten. Nach Langzeitgabe von Somatostatin-Analoga (länger als 3–6 Monate) bilden sich bei einigen Patienten aufgrund einer Verminderung der Beweglichkeit der Gallenblase Gallensteine. Bei einer Langzeitbehandlung mit Somatostatin-Analoga empfiehlt es sich daher, in Abständen von etwa drei Monaten die Gallenblase mit Ultraschall auf Steine untersuchen zu lassen. 4.2.2 Interferon-α Interferone sind natürlich vorkommende Stoffe, die eine steuernde Rolle im Abwehrsystem (Immunsystem) des Körpers spielen. Sie können insbesondere Abwehrmechanismen gegen Viren und Tumorzellen in Gang setzen. Der genaue Mechanismus der wachstumshemmenden Wirkung der Interferone auf Tumoren ist nicht bekannt. Wir wissen nur so viel: • Sie hemmen die Vermehrung von Tumorzellen, indem sie die Zellteilung blockieren. • Sie verändern die Oberfläche der Tumorzellen so, dass weiße Blutzellen (die T-Lymphozyten) sie als feindliches Ziel erkennen und angreifen. • Sie verkürzen die Lebensdauer der Tumorzellen. In der Therapie der GEP-Tumoren wird in der Regel Interferon-α eingesetzt. Die Dosierung wird individuell festgelegt und beträgt zwischen 3 und 5 Millionen Einheiten 3- bis 7-mal pro Woche. 47 Mit der Interferon-α-Therapie erreicht etwa ein Drittel der Patienten einen Wachstumsstillstand, etwa 10 % sogar eine Verkleinerung des Tumors. Die Hormonproduktion geht bei knapp der Hälfte der Patienten um mindestens 50 % zurück. Ein Nachteil von Interferon-α im Vergleich zu den Somatostatinähnlichen Wirkstoffen ist das Nebenwirkungsprofil. Am Anfang der Therapie treten grippeähnliche Symptome wie Fieber, Kopf- und Gliederschmerzen auf. Diese Symptome lassen sich durch die gleichzeitige Gabe von entzündungshemmenden Medikamenten mit der Injektion des Interferons mildern. Als Langzeitnebenwirkungen sind andauernde Müdigkeit, Gewichtsverlust, Blutbildveränderungen, Haarausfall und Störungen des körpereigenen Abwehrsystems sowie depressive Verstimmungszustände bekannt. Alle Nebenwirkungen zusammen sind die Ursache für Therapieabbrüche bei etwa 15–20 % der Patienten. Interferon-α wird bei GEP-NET daher nicht als medikamentöse Ersttherapie empfohlen, sondern, falls nötig, in der Regel erst nach den Somatostatin-Analoga eingesetzt. Zwei Studien mit einer Kombination von Somatostatin-Analoga und Interferon-α zeigen, dass die Kombination nicht besser wirkt als die jeweiligen Einzelstoffe. Interessant ist, dass in der Kombination die Nebenwirkungen von Interferon-α gemildert zu sein scheinen. In der Kombinationstherapie wird das langwirksame Somatostatin-Analogon mit Interferon-α zusammen eingesetzt. 4.2.3 Chemotherapie Im Gegensatz zu anderen Tumortypen spielt die Chemotherapie bei den GEP-Tumoren eine untergeordnete Rolle. Aufgrund vorliegender Beobachtungen ist diese Behandlungsmethode nur bei fortschreitenden Pankreastumoren sowie schnell wachsenden Tumoren und nur, wenn andere Therapiemöglichkeiten fehlgeschlagen haben, zu vertreten. Bei Pankreastumoren wird in der Regel eine Kombination von Streptozotocin und Doxorubicin, bei sehr schnell wachsenden Tumoren eine Kombination von Cisplatin und Etoposid eingesetzt. Nicht angebracht ist eine Chemotherapie bei metastasierten GEP-Tumoren des Dünn- und Dickdarms. 48 4.3 Lokal ablative Behandlungsverfahren Bei den lokal ablativen Verfahren werden einzelne Tumorabsiedlungen gezielt unter bildgebender Kontrolle entfernt. 4.3.1 Transarterielle Chemoembolisation (TACE) Chemoembolisation bedeutet den Verschluss des Gefäßes, das den Tumor oder seine Tochterabsiedlung mit Blut versorgt. Diese Methode, die unter Einsatz chemischer Mittel erfolgt, wird hauptsächlich zur Behandlung von Tochterabsiedlungen des Tumors in der Leber angewendet, die nicht chirurgisch entfernt werden konnten. Das ist – ohne einen Leberschaden zu verursachen – möglich, weil die Leber zu etwa 75 % aus der Pfortader mit Blut versorgt wird und nur zu 25 % aus der Leberarterie. Im Gegensatz dazu erhalten Tumoren oder ihre Tochterabsiedlungen zu fast 80 % ihre Blutversorgung aus der Leberarterie. Um die Chemoembolisation durchzuführen, wird eine Sonde in der Leistengegend in eine Schlagader eingeführt und bis zur Leberarterie geleitet. Dann werden mit der Sonde die Tumorgefäße angesteuert und ein Gemisch von tumorschädigenden Wirkstoffen (z.B. Doxorubicin) eingespritzt. Anschließend werden die Tumorgefäße mit kleinen Gelatinepartikeln verschlossen, um eine weitere Versorgung des Tumors durch sauerstoffhaltiges Blut zu verhindern. Die so erzielte Unterversorgung des Tumors mit Blutsauerstoff und die Wirkung des Zytostatikums führen zum Absterben der Tumorzellen. Dieser Eingriff kann in Abständen von 2–3 Monaten wiederholt werden. Nach einer Chemoembolisation können für kurze Zeit Bauchschmerzen, Erbrechen, Fieber, Anstieg der Leberenzyme im Blut und eine Verschlechterung der Leberfunktion auftreten. 49 Einbringen einer chemischen Substanz zur Schädigung des Tumors (Chemoembolisation) 4.3.2 Perkutane Alkoholinstillation Auch diese Methode wird in der Regel zur Behandlung von Tochterabsiedlungen in der Leber eingesetzt. Dabei wird unter Ultraschall- oder CT-Kontrolle eine dünne Nadel durch die Haut (perkutan) bis zum Tumor geführt. Durch diese Nadel wird Alkohol in das Tumorgewebe gespritzt. Der Alkohol verteilt sich im Tumor und erreicht die kleinen Blutgefäße, die den Tumor mit Blut versorgen. Das Blut in diesen Gefäßen gerinnt durch die Wirkung des Alkohols, die Blutgerinnsel verstopfen die Gefäße und unterbrechen so die Blutversorgung des Tumors. Die Tumorzellen sterben ab. 50 Im Vergleich zur Chemoembolisation ist die perkutane Alkoholinstillation einfacher durchzuführen und bei etwa gleichen Erfolgsaussichten kostengünstiger. Sie eignet sich allerdings nur für Patienten mit wenigen und kleinen Lebermetastasen. Komplikationen nach diesem Eingriff sind selten. Als Nebenwirkungen können vorübergehend Schmerzen und Fieber auftreten. 4.3.3 Radiofrequenzablation (RFA) Die RFA beruht auf der Wechselwirkung hochfrequenter Wechselstromfelder, die zu einer Erhitzung des Gewebes führen. Unter Lokalanästhesie wird Ultraschall- oder CT-gesteuert eine Sonde in die Tumormetastase eingeführt, an deren Spitze Temperaturen bis 100 °C erreicht werden. Durch die so erzielte Koagulationsnekrose stirbt das Tumorgewebe ab. Die Methode eignet sich bei bis zu vier Metastasen. 4.3.4 Laserinduzierte interstitielle Thermotherapie (LITT) Hierbei handelt es sich um eine photothermische Tumorzerstörung. Über optische Fasern werden Laserstrahlen nahe dem Infrarotbereich in die Metastasen abgegeben. Die Laserenergie wird vom Tumor aufgenommen und führt dort zu einer Temperaturerhöhung und so zum Absterben des Gewebes. Das Verfahren wird in Allgemeinnarkose oder in Lokalanästhesie durchgeführt. Das Aufsuchen der Metastasen erfolgt CT-gesteuert. Die Methode ist auf das Vorhandensein weniger Metastasen beschränkt. 4.3.5 Kryotherapie Hierbei wird das Metastasengewebe innerhalb kurzer Zeit auf <100 °C unter den Gefrierpunkt abgekühlt. Die intrazelluläre Eisbildung führt zur sofortigen Zellnekrose. Die Untersuchung wird unter MRT-Kontrolle durchgeführt, da sich gefrorenes Gewebe so besser erkennen lässt. Auch hier erfolgt die Punktion unter Allgemein- oder Lokalanästhesie. 51 4.3.6 Perkutane transarterielle 90Yttrium-Brachytherapie (selektive interne Radiotherapie, SIRT) Ähnlich wie bei der Chemoembolisation wird bei diesem Verfahren über eine in die Leberarterie eingebrachte Sonde eine Embolisation durch einen radioaktiven Stoff durchgeführt. Man verwendet dazu in Plastikkügelchen (Mikrosphären) eingeschlossenes 90Yttrium. Durch das radioaktive Yttrium werden die Tumorzellen bestrahlt (Reichweite der Strahlung im Körper: ca. 1,2 cm/Mikrosphäre). Aufgrund einer Halbwertszeit der radioaktiven Substanz von 64 Stunden klingt die Radioaktivität im Körper schnell ab. Beurteilung der lokal ablativen Verfahren Mit Ausnahme der Chemoembolisation gibt es zu den genannten Verfahren keine prospektiven vergleichenden Studien. Der Wert der Verfahren ist also derzeit noch nicht abzuschätzen. Die genannten Verfahren sind als experimentell zu betrachten. Ihre Anwendbarkeit bei einem bestimmten Patienten richtet sich nach der Erfahrung des jeweiligen Zentrums. 4.4 Die Radioligandentherapie (Peptidrezeptorvermittelte Radiotherapie, PRRT) Auch hierbei handelt es sich um eine relativ neue Methode, für die es bislang nur wenige prospektive Studien gibt und die in ihrer Wertigkeit noch nicht abschließend beurteilt werden kann. Die Gesetzlichen Krankenkassen der Bundesrepublik Deutschland lehnen daher die generelle Übernahme der Kosten einer Behandlung derzeit noch ab. Dennoch lassen bislang vorliegende Ergebnisse, unter anderem aus den Niederlanden und der Schweiz, vermuten, dass es sich hier um eine wahrscheinlich sehr wirksame Behandlungsmethode handelt. 52 Die PRRT beruht darauf, dass die allermeisten GEP-Tumoren auf ihrer Oberfläche Rezeptoren für Somatostatin, besonders vom Subtyp 2, tragen. Diese Tumoreigenschaft wird bereits bei der Somatostatinrezeptor-Szintigraphie genutzt. Für die PRRT wird nun nicht der Radioligand oder 177 111 Indium, sondern 90Yttrium Lutetium verwendet. Beide Strahlenquellen (sog. Betastrahler) können über eine chemische Substanz (Chelatbildner, sog. Linker) fest an SomatostatinAnaloga (z.B. DOTA-TOC, DOTA-TATE, DOTA-NOC) gebunden und dann intravenös verabreicht werden. Die Strahlenquelle gelangt dann über die Blutbahn gezielt bis zu den Somatostatinrezeptoren des GEP-Tumors und dessen Metastasen, wird über die Tumorzelloberfläche in die Zelle aufgenommen und bestrahlt so den Tumor. Voraussetzung für diese Therapie ist also ein hoher Somatostatinrezeptorbesatz der Tumorzellen, der vor der Behandlung durch eine Somatostatin-Rezeptorszintigraphie nachgewiesen werden muss. Als Nebenwirkungen der Therapie können eine Verschlechterung der Nierenfunktion und Veränderungen im Blutbild auftreten. Nach bisherigen Ergebnissen konnte bei bis zu 50 % der behandelten Patienten ein Rückgang des Tumors oder lang anhaltender Tumorwachstumsstillstand beobachtet werden. Besonders eignen sich offenbar Patienten mit geringer Tumormasse und langsamem Tumorwachstum. Dagegen sprechen schnell wachsende Tumoren und sog. undifferenzierte Tumoren schlecht auf die Radioligandentherapie an. Da diese Behandlungsmethode noch exprimentell und nicht zugelassen ist, wird sie erst eingesetzt, wenn andere Therapieverfahren (Operation, Medikamente wie Somatostatin-Analoga) nicht den gewünschten Erfolg gebracht haben. 53 4.5 Verlaufskontrollen Der Erfolg der Therapie wird mit den gleichen Methoden beurteilt, die für die Diagnose eingesetzt werden. Daher ist eine regelmäßige sorgfältige Nachsorge sehr wichtig. Das klinische Maß für den Therapieerfolg ist die Rückbildung der typischen, durch die Hormonüberproduktion der aktiven Tumoren verursachten Beschwerden. Biochemisch kann die Therapie durch Bestimmung der jeweiligen Hormone im Blut oder ihrer Abbauprodukte im Urin kontrolliert werden. Die regelmäßige Nachsorge mit verschiedenen Diagnosemethoden ist wichtig 54 Zur Beobachtung der hormonell inaktiven Tumoren eignet sich die Bestimmung von Tumormarkern (wie z.B. Chromogranin A) im Blut. Die Kombinationen aller dieser Methoden bei den regelmäßigen Kontrollen, die in der Regel alle drei bis sechs Monate erfolgen, erlaubt es, den Krankheitsverlauf unter der Therapie exakt zu verfolgen. So können rechtzeitig Entscheidungen über notwendige Anpassungen der Therapie, wie z.B. Erhöhung der Medikamentendosis, Einsatz von Medikamentenkombinationen, chirurgische Eingriffe oder andere Behandlungsmaßnahmen, getroffen werden. Die Therapiekontrolle muss auch die Kontrolle der Nebenwirkungen der eingesetzten Medikamente einbeziehen. Die Kontrollmaßnahmen richten sich nach dem bekannten Nebenwirkungsprofil der Medikamente. 55 5. Patientenorganisationen 5.1 Netzwerk Neuroendokrine Tumoren (NeT) e. V. Das Netzwerk Neuroendokrine Tumoren (NeT) e. V. ist ein gemeinnütziger Verein, in dem sich Betroffene, Angehörige und Ärzte zusammengeschlossen haben. Hier finden Menschen mit neuroendokrinen Tumoren Verständnis, Hilfe und jede Menge an Wissen und Erfahrung. Zur fachlichen Unterstützung steht den Mitgliedern ein wissenschaftlicher Beirat aus Fachärzten zur Seite. Das Netzwerk NeT wurde im Jahr 2000 unter der Dachorganisation Netzwerk Hypophysen- und Nebennierenerkrankungen e. V. gegründet und ist seit 6. Juli 2005 ein eigener eingetragener Verein. Hilfe zur Selbsthilfe In erster Linie möchte das Netzwerk NeT Hilfe zur Selbsthilfe geben, indem es den Erfahrungsaustausch unter den Betroffenen, sowie den Kontakt zu Ärzten und anderem medizinischen Fachperonal fördert. Eine wichtige Plattform dafür sind die Regionalgruppen, die es mittlerweile in verschiedenen Bundesländern gibt. Hier treffen sich die Mitglieder regelmäßig, tauschen ihre Erfahrungen aus und erfahren in Fachvorträgen Neues über Diagnostik und Therapie ihrer Erkrankung. Da die Gruppen in der Regel von einem Endokrinologen unterstützt und begleitet werden, werden auf diesen Treffen auch individuelle Fragen kompetent beantwortet. Informationen über die Erkrankung Neben der Organisation der Regionalgruppen will das Netzwerk NeT auch dazu beitragen, den enormen Informationsbedarf der Betroffenen zu decken. In der Mitgliederzeitschrift Glandula NeT, die zweimal jährlich erscheint, werden 56 medizinische Zusammenhänge erläutert, neue Diagnoseverfahren und Therapiekonzepte vorgestellt und über aktuelle Themen aus Wissenschaft und Forschung berichtet. Außerdem werden in der Glandula NeT Erfahrungsberichte von Patienten, Kontaktwünsche, Veranstaltungshinweise, Buchtipps, Leserbriefe und weitere interessante Informationen veröffentlicht. Den Mitgliedern stehen außerdem verschiedene Broschüren – wie diese hier – zur Verfügung, die von Experten auf dem Gebiet der neuroendokrinen Tumoren verfasst wurden. Ein „Highlight“ ist der jährlich stattfindene überregionale Neuroendokrine TumorTag des Netzwerk NeT, auf dem namhafte Referenten aktuelle Entwicklungen in Diagnostik und Therapie vortragen und Fragen aus dem Auditorium beantworten. In verschiedenen Workshops werden darüber hinaus spezielle Themen eingehend erläutert und diskutiert. Besuchen Sie das Netzwerk im Internet Auf der Homepage des Netzwerk NeT www.karzinoid.info oder www.neuroendokrine-tumoren.de finden Sie aktuelle Informationen zum Verein, zu den neuroendokrinen Tumoren sowie Links zu interessanten Websites. Das Forum bietet Ihnen die Möglichkeit, sich direkt mit anderen Betroffenen auszutauschen. 57 So erreichen Sie das Netzwerk NeT e. V. Sie haben Fragen zur Mitgliedschaft? Sie suchen einen Ansprechpartner, mit dem Sie sich über Ihre Erkrankung austauschen können? Sie benötigen eine Broschüre über Ihre Erkrankung? Oder Sie haben eine wichtige Information, die Sie – z.B. über die Glandula NeT – auch den anderen Betroffenen zukommen lassen wollen? Dann wenden Sie sich einfach an die Geschäftsstelle in Erlangen. Das Netzwerk-Büro ist besetzt: Montag, Mittwoch und Freitag von 9.00 bis 12.00 Uhr Telefonnummer: 0911/ 252 89 99 Wenn Sie außerhalb der Bürozeiten anrufen, können Sie eine Nachricht auf dem Anrufbeantworter hinterlassen oder Sie werden an einen Ansprechpartner weitergeleitet. Fax: 0911/ 255 22 54 Internet: www.glandula-net-online.de oder www.netzwerk-net.de Email: [email protected] Postanschrift: Netzwerk für Neuroendokrine Tumoren (NeT) e. V. Wörnitzstraße 115a 90449 Nürnberg 58 5.2 Bundesorganisation Selbsthilfe NeuroEndokrine Tumoren e. V. Die Initiative zur Gründung einer Selbsthilfegruppe verdanken wir Herrn Peter Rohn, selbst Tumorpatient. Die „NeuroEndokrine Tumoren Selbsthilfegruppe e. V.“ wurde im Jahre 2000 ins Leben gerufen. Seit dem 17.05.2001 ist sie im Vereinsregister des Amtsgerichtes Berlin – Charlottenburg – eingetragen und hat ihren Sitz in Berlin. Aufgaben und Ziele: • Gegenseitige Information und Unterstützung von Patienten und deren Angehörigen • Aufklärung von Betroffenen, Angehörigen, behandelnden Ärzten und der Öffentlichkeit zur Verbesserung der Kenntnisse in allen relevanten Bereichen • Sammlung, Herstellung und Verbreitung von Informationsmaterial • Gesprächs- und Erfahrungsaustausch • Der Verein verfolgt ausschließlich und unmittelbar gemeinnützige Zwecke • Der Verein ist selbstlos tätig, er verfolgt nicht eigene wirtschaftliche Zwecke • Die Mitglieder der Gruppe Berlin-Brandenburg treffen sich einmal im Monat • Die Mitglieder der Gruppen in den Bundesländern treffen sich vierteljährlich oder nach Absprache mit den regionalen Ansprechpartnern Am 22. März 2003 kam es zur Namensänderung in „Bundesorganisation Selbsthilfe NeuroEndokrine Tumoren e. V.“ Derzeit gehören dem Verein bundesweit ca. 250 Mitglieder an. 59 Ein ganz wesentliches Kennzeichen der „Bundesorganisation Selbsthilfe NeuroEndokrine Tumoren e. V.“ stellt die gegenseitige Unterstützung der Erkrankten durch Kranke dar. Sie erreichen uns unter folgender Adresse: BS-NET e. V. Zentrale Poststelle Haus 6 / Oranienburger Straße 285 13437 Berlin Tel: 030/419-94804 Fax: 030/419-94806 Internet: www.net-shg.de E-Mail: [email protected] Das Büro ist besetzt von Montag – Mittwoch von 09.00 – 12.00 Uhr und Donnerstag – Freitag von 10.00 – 12.00 Uhr Auch außerhalb der Sprechzeiten erfolgt eine Beratung durch Fr. Engel (030 / 21 47 39 81) und Fr. Hanack (0571 / 38 57 466) bis 19 Uhr. 60 6. Erfahrungsberichte In diesem Kapitel werden Patienten mit neuroendokrinen Tumoren über ihre Erfahrungen mit der Erkrankung berichten. Zu Beginn jedoch zunächst ein Interview, das im November 2006 mit einem Karzinoid-Patienten geführt wurde. Interview beim NET-Patiententag in Mainz, November 2006: H.-W. D. (56) – Karzinoid-Patient Wann wurde bei Ihnen ein neuroendokriner Tumor festgestellt und unter welchen Symptomen haben Sie damals gelitten? Der Tumor wurde im April 2002, also vor etwa viereinhalb Jahren, diagnostiziert. Ein Jahr zuvor, etwa ab Sommer 2001, litt ich unter dauerhafter Gesichtsrötung und häufigen Hitzewallungen. Etwa drei bis vier Mal pro Woche kamen morgens anfallsartige Gesichtsrötungen, die so genannten Flushs, hinzu. Etwa zwei bis drei Mal pro Woche hatte ich eine Stunde nach dem Mittagessen einen kurzen, intensiven Durchfall. Wie lange hat es gedauert, bis nach Auftreten der Beschwerden die Diagnose gestellt werden konnte? Wurde die Diagnose bei Ihrem Hausarzt oder einem spezialisierten Zentrum gestellt? Etwa ein Jahr nach Auftreten der Symptome hatte ich während eines Fußballspiels Druckschmerzen unter dem rechten Rippenbogen. Als diese drei Tage später beim Sport wieder auftraten, habe ich mich bei meinem Hausarzt vorgestellt. Eine Ultraschalluntersuchung offenbarte drei weiße runde Flecken auf dem Leberlappen. Zwei Tage später wurden bei einer ambulanten Computertomographie (CT) Lebermetastasen festgestellt. Nach meiner stationären Aufnahme im Herz-Jesu-Krankenhaus in Dernbach wurden weitere Untersuchungen wie Magen-Darmspiegelung, Bronchoskopie, weitere CTs und ein ERCP durchgeführt. 61 Außerdem bekam ich eine Bauchspiegelung, bei der Gewebeproben entnommen und in der Pathologie untersucht wurden. Die Ärzte stellten daraufhin die Diagnose eines neuroendokrinen Tumors. Welche Maßnahmen wurden nach der Diagnose getroffen? Wie wurden Sie behandelt? Nach der Behandlung in Dernbach wurde ich Anfang Mai für weitere Untersuchungen in die Uniklinik Mainz eingewiesen, um den Primärtumor zu finden. Dort wurden diagnostische Maßnahmen wie PET, Knochenszintigram, Bronchoskopie, Magen-Darm-Spiegelungen sowie eine Ganzkörperszintigraphie durchgeführt. Der Primärtumor konnte jedoch bis heute nicht lokalisiert werden. Neben drei Chemoembolisationen erhielt ich eine medikamentöse Therapie mit einem Somatostatin-Analogon*. Welche Behandlung erhalten Sie heute? Wie geht es Ihnen damit und was hat sich verbessert? Die Behandlung besteht bis heute aus der Depotform eines SomatostatinAnalogons, das einmal monatlich gespritzt wird. Die Nebenwirkungen sind gering, es bildet sich lediglich Gallengries. Gebessert haben sich vor allem die Symptome: Ich habe wesentlich weniger Gesichtsrötungen, fast keine Hitzewallungen mehr, selten Flushs und kaum noch Durchfälle. Was würden Sie einem Patienten raten, bei dem heute die Diagnose eines neuroendokrinen Tumors gestellt wird? Nach dem Schock der Diagnose sollte man erst einmal Ruhe bewahren, den Kopf einschalten und keine übereiligen Beschlüsse fassen. Die Betroffenen sollten mit Vertrauenspersonen sprechen und sich in einer Fachklinik behandeln lassen. Den Fachärzten sollte volles Vertrauen geschenkt werden, man sollte selbst auch versuchen, positiv zu denken, wenn nötig auch mit professioneller Hilfe. * Die Medikamentennamen wurden durch die Nennung der Wirkstoffgruppen ersetzt 62 Falls möglich, sollten sich die Patienten weiterhin sportlich betätigen, ihren Hobbys nachgehen, weiter arbeiten und so offensiv wie möglich mit der Krankheit umgehen. In der Glandula NeT, der Mitgliederzeitschrift des Netzwerk NeT e. V., berichten Patienten mit neuroendokrinen Tumoren darüber, wie die Krankheit bei ihnen entdeckt wurde, unter welchen Beschwerden sie leiden, welche Therapieversuche bei ihnen mit welchem Erfolg durchgeführt wurden und wie sie sich letztlich mit der Tumor-Krankheit „arrangiert“ haben. Die meisten Erfahrungsberichte machen Mut, zeigen sie doch, dass die intensive Auseinandersetzung mit der Erkrankung, die aktive Mitarbeit bei der Behandlung und nicht zuletzt auch der Erfahrungsaustausch mit anderen Betroffenen dazu beitragen, besser mit den Beschwerden umgehen und den Verlauf positiv beeinflussen zu können. Doch lesen Sie selbst – die folgenden Ausschnitte aus den Erfahrungsberichten werden Ihnen zeigen, dass es viele Menschen gibt, die ein ähnliches Schicksal mit Ihnen teilen. Erfahrungsbericht Patient 1 Lange Zeit war ich im Ungewissen Krampf- bzw. kolikartige Bauchschmerzen, explosionsartige Durchfälle und zunehmendes Erbrechen veranlassten mich über viele Jahre hinweg, ärztliche Hilfe in Anspruch zu nehmen. Gastroskopien, Koloskopien und Rektoskopien ließ ich über mich ergehen – immer ohne Befund. Nach einem tastbaren Befund im rechten Unterbauch wurde nach einer Operation 1982 lediglich ein Nabelbruch beseitigt. Meine Beschwerden aber wurden ständig schlimmer. Infolge sichtlicher Gewichtsabnahme und zunehmendem Leistungsabfall zog der Gastroenterologe einen Chirurgen hinzu. Dieser fand wieder den tastbaren Befund im rechten Unterbauch und hielt eine Operation für erforderlich. 1988 wurde ich dann operiert. Nach etwa 6 Tagen im Ungewissen wurde ich mit der Tatsache konfrontiert, dass es sich um einen Karzinoidtumor handele und eine 63 nochmalige Operation erforderlich wäre, um diesen Tumor zu entfernen. Die zweite Operation erfolgte kurz darauf. Hierbei wurden ein Teil des Dünndarms, der aufsteigende Strang des Dickdarms und der rechte Eierstock entfernt. Über die Metastasierung der Leber und Lunge ließ man mich vorerst im Unklaren; das erfuhr ich erst durch meine Krankenakte. Ich unterzog mich im Anschluss sofort einer Chemotherapie mit Fluoroblastin. Damit war die Behandlung in der damaligen DDR für mich erschöpft. Endlich kam auch für mich die Wende Erst nach der Grenzöffnung erhielt ich im August 1991 die Möglichkeit, mich in der Uniklinik Göttingen vorzustellen. Nach gründlichen Untersuchungen, wie Ultraschall, CT, Röntgen und einer Octreotid-Szintigraphie, wurde ich zunächst auf ein Somatostatin-Analogon* eingestellt. Die Dosis musste aber aufgrund nochmaliger Untersuchungen erhöht werden. Dazu kamen 3 x 3 Mio. Einheiten Interferon-alfa pro Woche. Mein Allgemeinbefinden besserte sich, die Flush-Symptomatik ging zurück und die Durchfälle beschränkten sich (unter Loperamid morgens) auf die Vormittage. Nach einem grippalen Infekt im März 1993 hatte ich laufend Fieberattacken, litt unter Nachtschweiß und starkem Gewichtsverlust (10 kg). Der Arzt ordnete eine Chemotherapie mit Dacarbazin in 4-wöchentlichen Abständen an. Diese Therapie wurde nach 13 Zyklen abgesetzt. Ich erholte mich langsam, nahm an Gewicht zu. Dank der Medikamente gingen die Beschwerden zurück Im Februar 1998 erfolgte meine Einstellung auf das Monatsdepot des Somatostatin-Analogons. Zunächst traten bei niedriger Dosierung dieses Monatsdepots wieder vermehrt Flush und Durchfälle auf. Auch bei höherer Dosierung kam es zu keiner wesentlichen Besserung. Die Erhaltungsdosis liegt nun bei 2 x der höchstdosierten Darreichungsform des Somatostatin-Analogons alle 28 Tage, bei Bedarf spritze ich Einzeldosen subkutan hinzu. Dazu kommen 3 x wöchentlich 3 Mio. Einheiten Interferon-alfa. 64 Mein Leben hat dank der Medikamente an Qualität gewonnen. Im Laufe der Jahre wurden viele neue Erkenntnisse in der Behandlung dieser seltenen Art von Tumoren gewonnen. Ich hoffe, dass die medizinische Forschung weiterhin Fortschritte erzielen kann, von der wir Karzinoid-Patienten profitieren. Erfahrungsbericht Patient 2 Bloß nicht aufgeben! Wenn ich heute über mein Leben nachdenke, weiss ich, dass ich trotz meiner Erkrankung viel Glück hatte. Hier meine Krankengeschichte: Als 10-jähriger Knabe durchlebte ich eine Polio-Erkrankung. Eine leichte Gehbehinderung blieb zurück, das ist aber zum Glück nicht schlimm. Lange Zeit passierte nicht Besonderes, außer einigen leichteren Unfällen durch Übermut, Mopedfahren usw. – zum Glück nichts Ernstes. In der 4. Lebensdekade begannen Sehstörungen und Schwindelattacken. Es wurde eine Multiple Sklerose diagnostiziert – Folge: Schwerbehinderung von 70 % und ein „G“ im Ausweis. Zum Glück konnte ich weiter arbeiten wie bisher, der Gleichgewichtssinn litt etwas, sonst geht’s ganz gut. Es hätte mich härter treffen können. Schon wieder einmal Glück gehabt. Dann kam irgendwann der Diabetes mit der notwendigen Spritzerei dazu. Das ist sehr schade – nie wieder Kuchen, Schokolade und die anderen geliebten süßen Sachen. Damit konnte ich mich auch noch abfinden. Mir bleibt ja die Diätschokolade, sehr lecker – schon wieder Glück gehabt. Doch dann erhielt ich die Diagnose, die mich schwer mitgenommen hat – Bauchspeicheldrüsenkrebs. Das war ein schwerer Hammer, der nicht mehr zu überspielen war. Nach dieser Diagnose und der Ausdehnung der Krankheit hätte sich meine Krankengeschichte laut ärztlicher Einschätzung eigentlich in 6 Monaten erledigt. Die Ärzte waren ratlos, der Oberarzt saß neben mir am Krankenbett, eröffnete mir die Ergebnisse und wischte sich die Tränen ab. Das hat mich sehr getroffen, nun war wohl bald Schluss. 65 Trotz Glukagonom und Metastasen muss es weiter gehen Die Onkologen wollten mit schweren Geschützen auffahren, waren sich aber nicht sicher, ob es nützt oder schadet. Die Leber füllte sich immer mehr mit Metastasen. Ich ließ in der Uni Frankfurt die fünf größten Metastasen mit Laserenergie LITT eindampfen. Das kostete uns 10.000 DM. Die Familienkasse schrumpfte arg zusammen. Die Krankenkasse wollte auch dann noch nicht zahlen, als ich vor dem Sozialgericht klagte. Die Richter und der Geschäftsführer der Kasse waren sehr betroffen, konnten aber nicht anders entscheiden. Sei es drum, irgendwie musste es gehen. Ich lebte zu allseitigem Erstaunen weiter. Keiner hinterfragte bisher diese merkwürdige Entwicklung, alle waren nur erstaunt. Bei den vierteljährlichen Kontrollen zollte man mir viel Aufmerksamkeit, aber keine echte Hilfe. Dies änderte sich aber, als ich an einen hochqualifizierten, interessierten Endokrinologen geriet, der den Glukagonspiegel messen ließ. Statt 100 waren da 2500 Einheiten im Blut – klarer Fall, der Krebs war ein Glukagonom. Plötzlich gab es einen wirksamen Wachstumsbremser: das Somatostatin-Analogon*. Die Metastasen sind z.Zt. gestoppt – da hatte ich wieder einmal ein Superglück!!! Die Untersuchungen zeigen, dass das Glukagonomgeschwür ganz wild das Medikament aus dem Blut einsammelt. Jetzt werden wir in Basel versuchen, ein strahlendes, angereichertes Medikament zu spritzen, das sich in den Geschwüren sammelt und das Krebsgewebe hoffentlich verödet. Da die Chirurgen eine Operation ablehnen, ist 90Yttrium-DOTATOC meine einzige Chance. Nun wollen wir mal abchecken ob die Krankenkasse das zahlen wird. Vielleicht lasse ich mich sonst im Krankenbett nach Basel schieben, das sehen wir dann bestimmt in der Tagesschau. Bis jetzt bin ich zuversichtlich dass es klappt. Vielleicht habe ich Glück? P.S.: Ich schildere mein Leben hier so ausführlich, um zu zeigen, dass man sich nie aufgeben oder sich durchhängen lassen darf. Egal was passiert, irgendwie geht’s weiter. Ich drücke Euch allen ganz fest die Daumen, dass Ihr auch so viel Glück habt! 66 7. Ausgewählte Internet-Adressen • Netzwerk Neuroendokrine Tumoren (NeT) e.V.: http://www.karzinoid.info oder www.neuroendokrine-tumoren.de • Bundesorganisation Selbsthilfe NeuroEndokrine Tumoren e.V.: http://www.net-shg.de • Patientenseite: http://www.leben-mit-net.de • Deutsche Gesellschaft für Endokrinologie e. V.: http://www.endokrinologie.net • Deutsches Register Neuroendokrine Gastrointestinale Tumore (NET-Register): http://www.net-register.org • NETumorAdvisor website for patients with neuroendocrine tumors (auch mit deutscher Übersetzung): http://www.netumoradvisor.org/german/ • Deutsches MEN 1-Register: http://www.men1.de/ • Selbsthilfegruppe MEN 1: http://www.glandula-online.de/men1_net/ • Deutsche Krebshilfe e. V.: http://www.krebshilfe.de • Deutsche Krebsgesellschaft e. V.: http://www.krebsgesellschaft.de 67 8. 68 Kleines Lexikon der medizinischen Begriffe Ablatives Behandlungsverfahren, Ablation: (lat. ablatio - Abtragung, Ablösung) Entfernen von Körpergewebe (z.B. Tumorgewebe) bzw. Körperteilen. Dies umfasst auch indirektes Entfernen durch Veröden bei Kathetereingriffen. ACTH Abkürzung für adrenokortikotropes Hormon. ACTH wird im HypophysenVorderlappen gebildet und steuert die Produktion und Ausschüttung von Glukokortikoiden und Mineralokortikoiden, die in der Nebennierenrinde gebildet werden. Adenom Gutartige Geschwulst, die von Drüsenzellen ausgeht und oft eine oder mehrere bestimmte Drüsen imitiert, dadurch auch die entsprechenden Hormone (Schilddrüsenhormon, Hypophysenvorderlappenhormone, Nebennierenhormone usw.) im Übermaß bilden und ausschütten kann. Es werden keine Tochtergeschwülste gebildet (Metastasen). Als Mikroadenom bezeichnet man ein Adenom mit weniger als 1 cm Größe, Makroadenome sind definiert mit einer Größe von mehr als 1–2 cm. Akromegalie (akro: Spitze, hier Körperenden; mega: groß). Erkrankung, die durch übermäßige Ausschüttung von Wachstumshormon aus einem gutartigen Geschwulst der Hirnanhangdrüse hervorgerufen wird. Äußert sich unter anderem in vergröberten Gesichtszügen, sowie vergrößerten Händen und Füßen. Aminosäure Eine Aminosäure ist der einfachste Baustein des Eiweißes. Mehr als 10 Aminosäuren bilden ein Polypeptid. Mehr als 100 Aminosäuren bilden ein Eiweiß (Protein). Analogon Substanz, die in der Struktur dem Vorbild ähnelt und sich deshalb auch an die entsprechenden Rezeptoren einer Zelle binden kann (z.B. Somatostatin-Analogon). Die Wirkung muss nicht unbedingt die gleiche sein wie die des Vorbildes. So kann ein Analogon auch nur den Rezeptor blockieren und bewirkt damit z.B., dass die im Körper dafür vorgesehene Substanz nicht mehr an diesen Rezeptor binden kann. Anamnese Krankengeschichte eines Patienten. Angiographie Röntgenologische Darstellung der Gefäße (Arterien, Venen, Lymphgefäße) nach Injektion eines Kontrastmittels. Autopsie Untersuchung zur Feststellung der Todesursache. Bauchspeicheldrüse Pankreas, lang gestreckte Drüse im Bauchraum. Die Bauchspeicheldrüse produziert Verdauungssäfte, die sie in den Dünndarm abgibt. Diese Verdauungssäfte enthalten verschiedene Anteile, die bei der Verdauung von Eiweißen, Fetten und Kohlenhydraten eine wichtige Rolle spielen. Außerdem werden in der Bauchspeicheldrüse Insulin (blutzuckersenkend) und Glukagon (blutzuckersteigernd) gebildet; diese Stoffe werden nicht in den Darm, sondern in das Blut abgegeben. Bildgebende Verfahren Röntgen, klassischer Ultraschall, endoskopischer Ultraschall, Somatostatinrezeptor-Szintigraphie, Computertomographie (CT), Magnetresonanztomographie (MRT), Angiographie, Positronen-Emissions-Tomographie (PET). Biochemische Verfahren Laboruntersuchungen, bei denen mit den Methoden der Chemie die Lebensvorgänge im Organismus (Stoffwechsel, Verdauung, u.ä.) untersucht werden. Biopsie Entnahme einer Gewebeprobe zur mikroskopischen Untersuchung. Bronchien/ Bronchus Verästelungen der Luftröhre zur Verteilung der Luft bis in die einzelnen Lungenbläschen, wo dann der Sauerstoff vom Blut aufgenommen werden kann. Chemoembolisation Verschluss einzelner, einen Tumor ernährender Blutgefäße durch Einbringen chemischer Mittel über einen Katheter. Ziel ist die Unterbindung der Versorgung des Tumors und somit eine Schädigung des Tumorgewebes. Chemotherapie Spezifische Hemmung von Infektionserregern oder Tumorzellen im Organismus mittels Chemotherapeutika (Substanzen, die im Idealfall den Stoffwechsel der Infektionserreger oder der Tumorzellen schädigen, ohne andere Zellen anzugreifen). Cholezystokinin In der Dünndarmschleimhaut gebildetes Hormon, das die Entleerungsbewegungen der Gallenblase fördert. Chromogranin A Eiweißsubstanz und allgemeiner Tumormaker für GEP-Tumoren. Wird von normalen endokrinen Zellen und GEP-Tumorzellen produziert und in die Blutbahn abgegeben. Colon Hauptanteil des Dickdarms. Computertomographie (CT) Computergestütztes bildgebendes Röntgen-Verfahren. In einer Röhre (welche nicht so lang ist wie beim MRT) wird beim Patienten ein bestimmter Körperteil in Schichten durchstrahlt und elektronisch in Bilder umgesetzt, in denen sich die verschiedenen Gewebe gut voneinander unterscheiden lassen. 69 70 Depotpräparat Arzneiform, die durch eine langsame Freisetzung eines Wirkstoffes über längere Zeit eine konstante Blutkonzentration dieses Wirkstoffes gewährleistet. Diabetes mellitus „Zuckerkrankheit“, siehe unter Insulin. Diagnose (klinische Diagnose, Labordiagnose, Verdachtsdiagnose) Erkennung, Eingrenzung und genaue Benennung einer Krankheit und der Krankheitszusammenhänge und Ursachen. Diarrhoe Durchfall Dopamin Überträgersubstanz, die an bestimmten Nerven, unter anderem auch im Gehirn, freigesetzt wird. Eine von vielen Wirkungen ist die Freisetzung von Wachstumshormon. Dopaminagonist Substanz, die dem Dopamin in der Struktur ähnelt und sich an die Dopaminrezeptoren anlagert und so in der Hypophyse hemmend auf die Wachstumshormonfreisetzung wirkt, da der Rezeptor für das wirksame Dopamin blockiert wird. Je mehr Rezeptoren durch den Agonisten blockiert werden, desto weniger Wachstumshormon wird freigesetzt. Duodenum Zwölffingerdarm, an den Magen anschließender Darmabschnitt. Elektrolyte Für den Ablauf der vitalen Vorgänge wichtige Substanzen, wie z.B. Kalium, Natrium, Kalzium, Magnesium. Embolisation Verschluss einzelner, den Tumor ernährender Blutgefäße durch Einbringen kleiner Partikel über einen Katheter (siehe Chemoembolisation). Endokrin Die Ausschüttung von Hormonen betreffend. Endokrinologie Lehre von der Funktion innerer hormonbildender Drüsen (Schilddrüse, Hypophyse, Nebenniere, Hypothalamus, Eierstöcke, Hoden, usw.). Ethanol, auch Äthanol Äthylalkohol (wird allgemein als Alkohol bezeichnet). Flush Anfallsartige Rötung von Gesicht (und Oberkörper), bedingt durch die plötzliche Erweiterung der Hautgefäße. Gamma-Strahlen Energiereiche elektromagnetische Wellenstrahlung, die beim radioaktiven Zerfall ausgesendet wird. Anwendung z.B. für die Strahlentherapie mit Kobalt-60. Gamma-Strahlen schwärzen den Film einer Gamma-Kamera und können so bestimmte Organe oder Gewebe darstellen (siehe Szintigraphie). Gastrin Hormon, das die Salzsäureproduktion des Magens steuert. Gastrinom (Zollinger-EllisonSyndrom) Tumor, der durch Gastrinproduktion der Tumorzellen zu einer gesteigerten Produktion von Magensäure führt. Gefäßaktive Stoffe Substanzen, die eine Wirkung auf Spannung und Durchlässigkeit der Gefäßwände haben und somit die Durchblutung beeinflussen. GEP-Tumoren Gastro-entero-pankreatische Tumoren = Tumoren im Bereich des Magen-Darm-Traktes und der Bauchspeicheldrüse (Pankreas). Gigantismus Proportionierter Riesenwuchs bei vermehrter Bildung von Wachstumshormon vor dem Abschluss des Knochenwachstums, d.h. vor und während der Pubertät. Glukagon Hormon der Bauchspeicheldrüse, das mit dem Insulin zusammen den Zuckerstoffwechsel steuert. Insulin wirkt blutzuckersenkend, Glukagon steigert dagegen den Blutzucker durch Mobilisierung der Zuckerreserven, z.B. in der Leber. Glukagonom Tumor des Verdauungstraktes, der Glukagon produziert. Glukose Traubenzucker Hormon Boten- oder Signalstoff, der von speziellen Zellen gebildet und in die Blutbahn abgegeben wird. Bereits kleinste Hormonmengen können bestimmte Stoffwechselabläufe im Körper auslösen. 5-Hydroxyindolessigsäure Abgekürzt mit 5-HIES. Abbauprodukt von Serotonin, das im Urin ausgeschieden wird. Vermehrte Ausschüttung beim Karzinoid-Syndrom. Die Bestimmung der Menge der 5-HIES im 24 Stunden Urin dient als diagnostische Maßnahme zur Erkennung des Karzinoid-Syndroms. Hyperglykämie „Überzuckerung“ – erhöhter Blutzuckerspiegel. Hypoglykämie „Unterzuckerung“ – zu niedriger Blutzuckerspiegel. Hypophyse (Hirnanhangdrüse) Kirschkerngroßes, unterhalb der Gehirnbasis gelegenes Organ, das eine große Rolle bei der Regulation des Hormonhaushalts des Menschen spielt. Besteht aus dem Hypophysenvorderlappen und dem Hypophysenhinterlappen. Hypophysenhinterlappen (HHL) Ist mit dem Hypothalamus verbunden und speichert die Hormone Oxytozin und ADH (Antidiuretisches Hormon, Vasopressin), die im Hypothalamus gebildet werden. Das Oxytozin wirkt auf die Gebärmutter und auf die Brustdrüse, das ADH reguliert den Körperflüssigkeitshaushalt. 71 72 Hypophysenvorderlappen (HVL) Hormonproduzierende Drüse. Im HVL werden folgende Hormone gebildet: Das Wachstumshormon (Growth hormone = GH, synonym: Somatotropes Hormon = STH), zwei gonadotrope Hormone, nämlich das Follikelstimulierende Hormon (FSH) und das Luteinisierende Hormon (LH), das Prolaktin, das Thyreotropin (TSH) und das Adrenocorticotropin (ACTH). Diese Hormone regulieren die Funktion bestimmter Drüsen im Körper, nämlich Schilddrüse (TSH), Keimdrüsen (Geschlechtsdrüsen = Hoden oder Eierstöcke) (LH, FSH), Brustdrüse (Prolaktin) und Nebennierenrinde (ACTH), GH reguliert u.a. das Knochenwachstum. Hypothalamus Unter dem Thalamus (= „Sehhügel“) gelegener Teil des Zwischenhirns, in dem Regulierungshormone gebildet werden, die über den Hypophysenstiel in die Hypophyse gelangen und dort spezifisch die Ausschüttung von Hormonen stimulieren oder hemmen. Steuert z.B. auch die Wärmeregulation oder den Blutdruck. Ileum Krummdarm, unterer Anteil des Dünndarms. Immuntherapie Therapie zur Unterstützung des körpereigenen Immunsystems. Injektion Verabreichung eines Arzneimittels durch Spritzen. Insuffizienz Funktionsstörung Insulin Hormon, das in der Bauchspeicheldrüse gebildet wird und den Blutzucker senkt. Wenn Insulin zu wenig wirkt (Insulinresistenz) oder wenig/gar kein Insulin mehr gebildet wird, steigt der Blutzucker stark an. Diese Krankheit heißt Zuckerkrankheit oder Diabetes mellitus. Insulinom Insulinproduzierender Tumor der Bauchspeicheldrüse. Interferon (Interferon-α) Interferone sind natürlich vorkommende Stoffe, die eine steuernde Rolle im Abwehrsystem (Immunsystem) des Körpers spielen. Sie können insbesondere Abwehrmechanismen gegen Viren und Tumorzellen in Gang setzen. Interferon, insbesondere Interferon-α, wird als Medikament zur Unterstützung des Immunsystems eingesetzt. Jejunum Leerdarm, vorderer Teil des Dünndarms. Kalium In Pflanzen und vielen Mineralien vorkommendes Alkalimetall. Unentbehrlicher Bestandteil jeder Zelle. Funktion: Steuerung von elektrischen Vorgängen der Zellen, insbesondere von Nerven und Muskeln; auch wichtig für den Wasserhaushalt der Zellen und des Körpers. Kallikrein Gewebehormon, wichtig für die Funktion der glatten Muskulatur des Darms, der Gebärmutter und der Gefäße. Kalzium Weit verbreitetes, z.B. in Kalk und Kalksandstein vorkommendes Leichtmetall. Kalzium ist wichtig für die Knochenbildung. Darüber hinaus hat Kalzium antiallergische und gefäßabdichtende Funktionen, sowie Funktionen bei der Blutgerinnung. Auch bei der Erregung der Nervenzellen und der Muskulatur spielt es eine zentrale Rolle. Kollaps Zusammenbruch Koma Bewusstlosigkeit, ein Zustand tiefster, durch äußere Reize nicht zu unterbrechender Bewusstseinsstörung. Leitsymptom Symptom, durch das sich eine Erkrankung hauptsächlich bemerkbar macht. Laserinduzierte interstitielle Thermotherapie (LITT) Über optische Fasern werden Laserstrahlen gezielt in Metastasen abgegeben. Durch die Hitzeentwicklung stirbt das Tumorgewebe ab. Lokalisation Ort des Vorkommens. Lymphknoten In die Strombahn der Lymphgefäße eingeschaltete, etwa linsen- bis bohnengroße Knoten, die als Filter für schädliche und fremde Teile wie z.B. Erreger, Gifte, Tumorzellen oder Zellabbauprodukte funktionieren. Magnetresonanztomographie (MRT) Bildgebendes Verfahren ohne Einsatz von Strahlen. In einer Röhre werden von einem bestimmten Körperteil elektronische Bilder aufgenommen, die z.B. Informationen liefern, ob eine Vergrößerung eines Organs stattgefunden hat. Die MRT wird auch als „Kernspin-Untersuchung“ bzw. NMR bezeichnet. MEN Multiple Endokrine Neoplasien. Seltene Erbkrankheit, bei der mehrere verschiedene (multiple) Tumoren (Neoplasien) innerer, hormonproduzierender (endokriner) Organe auftreten können. Metastase Tochteransiedlung eines bösartigen Tumors. Nebenniere Halbmondförmige, der Niere aufsitzende hormonbildende Drüse. Im Nebennierenmark werden Adrenalin, Noradrenalin und Dopamin gebildet, in der Nebennierenrinde die Kortikoide, z.B. Cortisol, und die männlichen Sexualhormone. Nebenschilddrüsen Vier linsengroße, lebenswichtige Drüsen, die der Schilddrüse von hinten anliegen und in denen das Parathormon gebildet wird (weiteres siehe dort). Neoplasie Autonome, ungeregelte Neubildung von Gewebe. Neuroendokrin Das Nerven- und Hormonsystem betreffend. 73 74 Neuropeptid K Eine für den Nachweis von Karzinoiden wichtige Substanz. Neuropeptid K wird von den Karzinoidzellen als Vorstufe für verschiedene Hormone gebildet und kann dann im Blut nachgewiesen werden. Pankreas Bauchspeicheldrüse Parathormon In den Nebenschilddrüsen gebildetes Hormon, das den Kalzium- und Phosphathaushalt des Körpers regelt. Bei niedrigem Kalziumspiegel im Blut bewirkt das Parathormon eine vermehrte Freisetzung von Kalzium aus den Knochen und eine vermehrte Ausscheidung von Phosphat über die Nieren. Ist die Ausschüttung von Parathormon durch einen Nebenschilddrüsentumor erhöht, ist auch das Blutkalzium übermäßig erhöht. Das überschüssige Kalzium muss über die Nieren ausgeschieden werden und begünstigt die Bildung von Nierensteinen. Die Knochen verlieren mit der Zeit immer mehr Kalzium, wodurch es zu Knochen- und Gelenkschmerzen kommen kann. Außerdem kann die Störung des Kalziumhaushalts auch oft zu chronischen Verstopfungen führen. Pentagastrin Substanz, die die Sekretion von Magensaft fördert. Peptid Kurzkettiges Eiweiß, das sich aus mehreren Aminosäuren (den kleinsten Eiweißbausteinen) zusammensetzt. Perkutan Durch die Haut. PET Positronen-Emissions-Tomographie, ein bildgebendes nuklearmedizinisches Verfahren, mit dem sich Stoffwechselvorgänge im Körper sichtbar machen lassen. Tumorzellen können an ihrem beschleunigten Zuckerstoffwechsel erkannt werden. Dazu wird dem Patienten ein mit einem Positronenstrahler markierter Stoff (Radiopharmakon, z.B. Fluor-Deoxyglukose = FDG) injiziert, der sich insbesonders in den stoffwechselaktiven Tumorzellen anreichert. Diese lassen sich anhand der beim Zerfall des Radiopharmakons ausgesandten Strahlen mit Hilfe eines Scanners lokalisieren. Pfortader Die große Vene, die das gesamte aus der Bauchhöhle zurückfließende venöse Blut sammelt und zum Herzen leitet. Photothermisch Durch spezielles Laserlicht (daher „photo-“) hervorgerufene Wärmeerzeugung (daher „-thermisch“) zur Zerstörung von Tumorgewebe. Prolaktin Hormon des Hypophysenvorderlappens, das die Milchbildung steuert. Prostaglandine In verschiedenen Körpergeweben gebildete Hormone mit vielfältiger Wirkung, wie z.B. Gefäßerweiterung, Wachstum von Schleimhautzellen, Wehentätigkeit bei der Geburt. Radiofrequenzablation Methode zur lokalen „Verkochung“ von Gewebe. Mit einer Sonde, an deren Spitze durch hochfrequente Wechselstromfelder Temperaturen bis 100 °C erzeugt werden, lassen sich Metastasen CT-gesteuert gezielt koagulieren. Radioligandentherapie Im Gegensatz zur konventionellen externen Strahlentherapie handelt es sich bei der Radioligandentherapie um eine „interne“ Strahlentherapie, bei der sich das intravenös verabreichte Radiopharmazeutikum spezifisch im Tumor anreichert. Die selektive Bindung an die Tumorzellen wird dadurch erreicht, dass man als Trägermolekül ein Somatostatin-Analogon verwendet, das wie ein Schlüssel in die auf den GEP-Tumorzellen meist in besonders hoher Anzahl vorhandenen Somatostatinrezeptoren passt. An das Trägermolekül ist ein radioaktiver Strahler (z.B. 90Yttrium oder 111 Lutetium) gebunden, der die Tumorzellen mit einer Reichweite von 1–6 mm bestrahlt. Auch als PRRT bezeichnet. Retardiert Hinausgezögert, verlängert. Arzneimittel mit Retardwirkung haben durch eine besondere Zubereitungsform eine wesentlich verlängerte Wirkung. Rezeptor(bindung) Ein Rezeptor ist eine Empfangs- oder Aufnahmestelle auf der Oberfläche einer Zelle für bestimmte Reize. Einige Zellen binden z.B. Hormone an ihren Rezeptoren, wodurch eine spezielle Funktion in oder an der Zelle ausgelöst wird. An diese Rezeptoren können auch künstlich hergestellte Substanzen (z.B. Medikamente) binden und dadurch eine Wirkung erzielen. Ein Beispiel ist die Bindung von Somatostatin (oder einem Analogon) an die Somatostatinrezeptoren. Röntgenkontrastmittel Hilfsmittel zur Darstellung von Körperräumen, Hohlorganen und Gefäßen, die z.B. für die Röntgen-Darstellung von Magen oder Darm getrunken oder zur Darstellung von Blutgefäßen gespritzt werden können. Sekretin Hormon, das im Zwölffingerdarm freigesetzt wird und eine Ausschüttung (Sekretion) von Verdauungssäften der Bauchspeicheldrüse und der Galle bewirkt. Sekretion Absonderung. Äußere Sekretion: Absonderung eines Stoffes, der von Drüsen durch einen Ausführungsgang nach außen an die Haut oder an die Schleimhaut abgegeben wird. Somatostatin Im Hypothalamus gebildetes Hormon, das die Ausschüttung anderer Hormone (z.B. Wachstumshormon, Schilddrüsen-stimulierendes Hormon, ACTH, Insulin, Glukagon, Gastrin) hemmt. Somatostatinom GEP-Tumor, dessen Zellen Somatostatin produzieren. Somatostatinome kommen in der Bauchspeicheldrüse und im Zwölffingerdarm vor. Wirkung, wie z.B. Gefäßerweiterung, Wachstum von Schleimhautzellen, Wehentätigkeit bei der Geburt. 75 76 Sonde Starres oder elastisches, stab- oder röhrenförmiges Instrument zur Einführung in Hohlorgane des Körpers (z.B. Magensonde, Herzkatheter). Suspension Aufschwemmung von feinen festen Teilchen in einer Flüssigkeit (Suspendierlösung). Symptom Krankheitszeichen Syndrom Symptomkomplex, Gruppe von gleichzeitig auftretenden Krankheitszeichen. Synthetisch Künstlich hergestellt. Szintigraphie Nuklearmediziniche Untersuchungsmethode. Verfahren, bei dem kurzlebige radioaktiv markierte Substanzen dem Körper zugeführt, im Körper räumlich verteilt und dann z.B. mit einer Gamma-Kamera registriert werden. Therapie Behandlung einer Krankheit, Heilverfahren. T-Lymphozyt Weißes Blutkörperchen mit wichtiger Abwehrfunktion innerhalb des Immunsystems. Transillumination Beleuchtung eines Organs (z.B. Zwölffingerdarm) von innen. Tumor Allgemein jede umschriebene Schwellung von Körpergeweben; im engeren Sinn Geschwulst, die je nach ihrem Wachstumsverhalten als gutoder bösartig eingestuft wird. Tumormarker (Chromogranin A) Stoffe, die von den Tumorzellen produziert und in die Blutbahn abgegeben werden. Der spezifische Tumormarker für GEP-Tumoren ist das Chromogranin A. Überzuckerung Hyperglykämie – erhöhter Blutzuckerspiegel. Ultraschalldiagnostik Diagnostisches bildgebendes Verfahren unter Anwendung von Ultraschallwellen. Die Wiedergabe von Bewegungen und Abläufen ist möglich und es besteht keine Strahlenbelastung. Unterzuckerung Hypoglykämie – zu niedriger Blutzuckerspiegel. VIP (vasoaktives intestinales Polypeptid) Substanz, die eine Wirkung auf die Wasserdurchlässigkeit der Gefäße der Darmschleimhaut hat und so u.a. zu wässrigen Durchfällen führt. VIPom Tumor, der VIP produziert und vor allem zu wässrigen Durchfällen führt. Wachstumshormon STH, GH. Im Hypophysenvorderlappen gebildetes Hormon, welches das Wachstum in der Jugend reguliert. Zentrales Nervensystem Das Nervensystem in Gehirn und Rückenmark wird als zentrales Nervensystem bezeichnet. In Ergänzung zu diesem System gibt es das periphere Nervensystem, das aus Nervensträngen (Leitungen) besteht, welche Impulse des zentralen Nervensystems zu den Erfolgsorganen (z.B. Muskeln) leiten. Zwölffingerdarm Direkt an den Magen anschließender oberer Teil des Dünndarmes, dessen Länge in etwa der Breite von zwölf Fingern entspricht. Zytostatika (Chemotherapeutika) Medikamente, die direkt wachstumshemmend bzw. abtötend auf Tumorzellen wirken. 77 Notizen: 78 79 301919 11/2010 Novartis Pharma GmbH, 90429 Nürnberg Eine Initiative von Novartis Oncology Deutschland Roonstr. 25 90429 Nürnberg www.novartisoncology.de