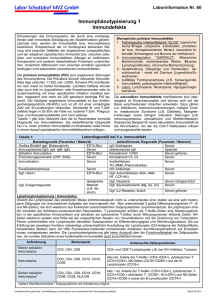
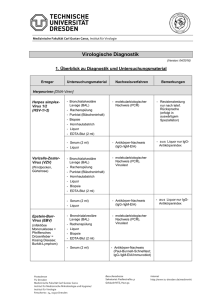
Laborinformationsblätter
Werbung
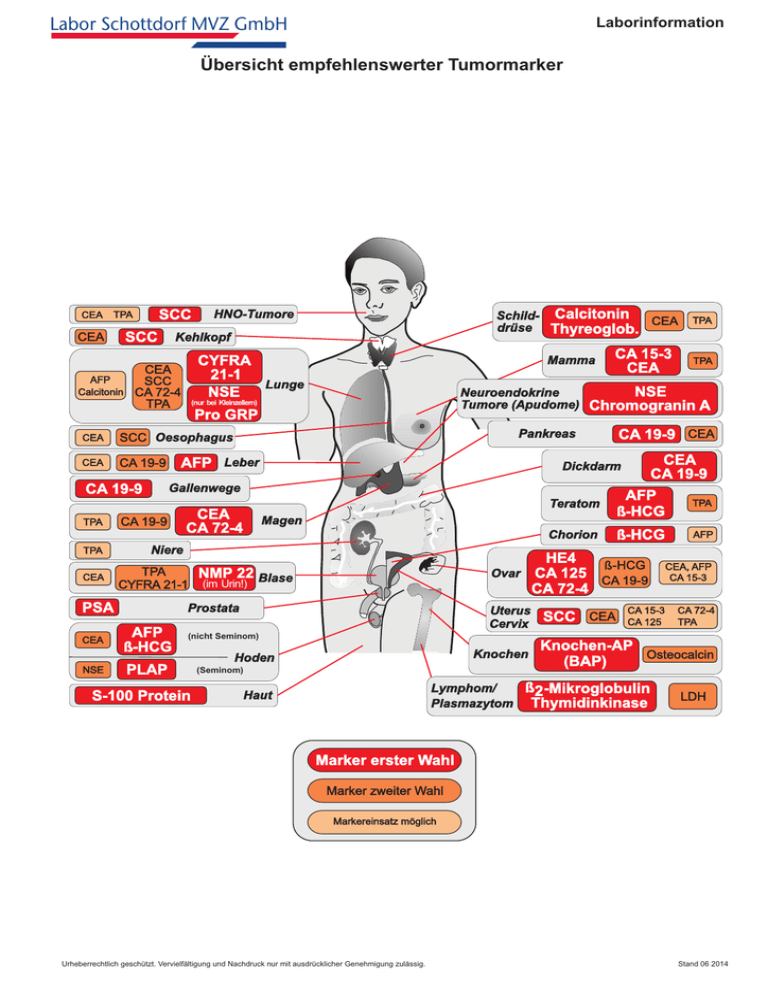
Labor Schottdorf MVZ GmbH Laborinformation Übersicht empfehlenswerter Tumormarker CEA SCC TPA SCC CEA AFP Calcitonin Kehlkopf CYFRA 21-1 Lunge NSE CEA SCC CA 72-4 TPA CEA CA 19-9 AFP Leber CA 19-9 NSE Ovar Prostata S-100 Protein AFP ß-HCG TPA Chorion ß-HCG AFP HE4 ß-HCG CA 125 CA 19-9 CA 72-4 Uterus SCC Cervix (nicht Seminom) PLAP Teratom Magen TPA NMP 22 Blase CYFRA 21-1 (im Urin!) AFP ß-HCG CEA CA 19-9 Dickdarm Niere PSA CEA CEA CA 72-4 TPA CA 19-9 CEA Pankreas Gallenwege CA 19-9 CEA CA 15-3 CEA TPA NSE Neuroendokrine Tumore (Apudome) Chromogranin A Pro GRP SCC Oesophagus TPA Mamma (nur bei Kleinzellern) CEA TPA Schild- Calcitonin CEA drüse Thyreoglob. HNO-Tumore Knochen Hoden (Seminom) Lymphom/ Plasmazytom Haut CEA CA 15-3 CA 125 CEA, AFP CA 15-3 CA 72-4 TPA Knochen-AP Osteocalcin (BAP) -Mikroglobulin Thymidinkinase LDH Marker erster Wahl Marker zweiter Wahl Markereinsatz möglich Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 06 2014 Laborinformation Nr. 1 Tuberkulose Diagnostik und häufige Fragestellungen Erreger: Mykobakterien des MTB-Komplex (M. tuberculosis, M. africanum, M. bovis, M. microti, M. canetti) Übertragung: hauptsächlich aerogen, mittels kleinster erregerhaltiger Tröpfchen, z. B. durch Husten, Niesen, Sprechen, medizinischen Maßnahmen an den Atemwegen Formen: pulmonal (offen/geschlossen), extrapulmonal (jedes Organ möglich), Miliartuberkulose (generalisiert) Symptomatik: subfebrile Temperaturen, Gewichtsverlust, Nachtschweiß, Schwäche evtl. unspezifische Entzündungszeichen (z. B. BSG↑), in 15% der Fälle keine Symptome Labordiagnostische Methoden (Weitere Hinweise zu den Untersuchungsmaterialien im Leistungsverzeichnis) Methode Bakteriologische Untersuchung (Kultur und Mikroskopie) 1)2) IGRA (Interferon y Release Assay) Quantiferon TB Gold T-Spot TB Mykobakterien-PCR (MTB-Komplex) Material Sputum, Bronchialsekret, BAL, Magensaft, Urin, Blut, Liquor, Stuhl, Biopsien, Punktate, Knochenmark Je 1 ml Blut (bis zur Füllmarke) in 3 Spezialröhrchen 10 ml Heparinblut Sputum, BAL, Liquor, Punktate, Magensaft, Urin Anmerkungen Goldstandard, sensitivstes Verfahren bei Verdacht auf Tuberkulose, ggf. mehrwöchige Bebrütungszeit Resistenztestung aus Kultur möglich, weist auch atypische Mykobakterien nach Ausschlussdiagnostik; Präanalytik unbedingt beachten! Bebrütung innerhalb von 16 h, aufrecht stehend, kontinuierlich für 16-24 h bei 37°C. Modalitäten ggf. mit dem Labor vorab klären (Bebrütung im Labor möglich). Entnahmezeitpunkt und Bebrütungszeit auf dem Materialbegleitschein vermerken. Ausschlussdiagnostik; eilige Einsendung an das Labor Schnellerer, aber weniger sensitiver Nachweis als die Kultur, keine Erfassung atypischer Mykobakterien 1) Vorteile der IGRAs gegenüber dem Tuberkulin-Hauttest (THT): kein Booster-Effekt, keine Störung durch frühere BCGImpfung, höhere Spezifität bei verbesserter Sensitivität, für Meldung als Berufskrankheit erforderlich 2) Als Kassenleistung z. Z. nur abrechnungsfähig vor Therapie mit Medikamenten, die vor Anwendung einen TB-Ausschluss (latent oder aktiv) erfordern, bei HIV-Infektion, Dialyse oder Organtransplantation. Diagnostik nach Fragestellungen V. a. behandlungsbedürftige, aktive Tbc (z. B. bei therapierefraktärer Pneumonie, Husten/Fieber unklarer Ätiologie) Tuberkulose Ausschluss vor immunmodulatorischer Therapie (lt. DZK-Empfehlungen) Postexpositioneller Ausschluss einer Tuberkulose-Infektion Anamnese, klin. Untersuchung, Röntgen-Thorax in 2 Ebenen, ggf. CT-Thorax, ggf. Bronchoskopie Labor: Mikroskopie, Kultur mit Resistenztestung, evtl. PCR 1) Anamnese Immunsuppression, frühere Infektion, Impfstatus, TB-Kontakte/Herkunft, Vorbefunde (THT, IGRA, Röntgen-Thorax) 2) Ausschluss einer latenten Tuberkulose (LTBI) mittels Interferon y Release Assay (IGRA) Weiteres Vorgehen nach Ergebnis des IGRAs (Hinweis: unter Immunsuppression eingeschränkt aussagefähig) i.d.R. keine Chemoprävention erforderlich negativ chemopräventive Therapie nach Ausschluss einer positiv behandlungsbedürftigen aktiven Tuberkulose nicht auswertbar zunächst Test aus neuer Probe wiederholen (evtl. mit alternativem IGRA), wenn erneut nicht auswertbar, Tuberkulin-Hauttest durchführen 3) Umfassende Aufklärung über erhöhtes TB-Risiko und regelmäßige Abfrage tuberkulosetypischer Symptome Altersentsprechenden Algorithmus der aktuellen DZK-Empfehlungen für Umgebungsuntersuchungen beachten (www.pneumologie-de)! Definiton der Resistenzen lt. WHO: Mono-Resistenz Polyresistenz Multi-drug-resistant tuberculosis (MDR-TB) Extensively drugresistant tuberculosis (XDR-TB) gegen ein einziges Antituberkulotikum Gegen mehr als ein Antituberkulotikum, nicht Isoniazid und Rifampicin gleichzeitig Mindestens Resistenz gegen die zwei Erstrangmedikamente Isoniazid und Rifampicin MDR + Resistenz gegen ein Fluorchinolon und mindestens ein injizierbares Zweitrangmedikament (Amikacin, Capreomycin, Kanamycin) Antituberkulotische Therapie: → detaillierte Therapieregimes in den DZK-Empfehlungen Standardtherapie: 4 Mon. Isoniazid, Rifampicin, Pyrazinamid, Ethambutol + 2 Mon. Isoniazid, Rifampicin Eine Tuberkulose-Therapie sollte von diesbezüglich erfahrenen Ärzten durchgeführt werden, da zu den Risikofaktoren für eine Infektion mit resistenten Mykobakterien neben Kontakt mit resistentem Tuberkulosefall und Herkunft aus einem Land mit hoher MDR-TB-Prävalenz - eine vorangegangene nicht-effektive antituberkulöse Behandlung bzw. Therapieversagen zählen. Mittlerweile gibt es über die WHO-Definition hinaus Fälle mit „totally-drug-resistant“ (TDR/ XXDR) -Tuberkulose (gegen alle getesteten Medikamente resistent). Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 11 2014 Labor Schottdorf MVZ GmbH Laborinformation Nr. 2 Tuberkulose Algorithmen zur Umgebungsuntersuchung Zentrifugale Umgebungsuntersuchung (lt. Deutschem Zentralkomitee zur Bekämpfung der Tuberkulose [DZK]) bei: a) Tuberkulose des Respirationstrakte (mikroskopischer Nachweis säurefester Stäbchen in respiratorischen Sekreten, kultureller / molekularbiologischer Nachweis von M. tuberculosis-Komplex in respiratorischen Sekreten bei unbekanntem Ergebnis der mikrobiologischen Diagnostik) b) wenn der Indexfall als Infektionsquelle einer weiteren Tbc-Erkrankung gelten kann c) wenn das Obduktionsergebnis auf eine Gefährdung hinweist Bei anderen Tuberkuloseformen gehen die aktuellen Empfehlungen selbst bei Erregerausscheidung nicht von einer realistischen Ansteckungsgefahr aus. unauffällig Kinder < 5 Jahre Gesonderte Hinweise in den DZK-Empfehlungen gibt es z.B. für Gemeinschafts-/Betreuungseinrichtungen, Betriebe, Beschäftige im Gesundheitswesen, Justizvollzugsanstalten, Nutzer von öffentlichen Verkehrsmitteln und Ausbrüchen. Bei berufsbedingten Expositionen sollte unbedingt der Betriebsarzt hinzugezogen werden und ggf. auch an eine Meldung als Berufserkrankung gedacht werden. Tuberkulin-Hauttest (IFN-g-Test) Röntgen-Thorax (TRU) auffällig Wer? • Personen mit engem Kontakt zum Indexfall während des infektiösen Stadiums (Hustenbeginn/in den letzten 2-6 Mon. vor Diagnose) • Definition „enger Kontakt“ (Schwellenwert): Indexpatient mit positiver Mikroskopie: mehr als 8 h Aufenthalt im selben Raum. Indexpatient mit negativer Mikroskopie/positiver Kultur: mehr als 40 h Aufenthalt im selben Raum. • Übertragungen bei kurzer, jedoch intensiver Exposition (z. B. Tanzen, Kampfsport, med. Eingriffe) nicht ausgeschlossen Induration > 5 mm nein IFN-g-Test positiv nein Klinische Untersuchung Erneut THT (IFN-g-Test) nach 8² Wochen + Untersuchung negativ Induration > 5 mm oder IFN-g-Test positiv Chemoprävention (+ TRU + Untersuchung nach 3 Monaten) ja Ggf. TRU nach Abschluss nein Chemoprophylaxe beenden Fortführung der Chemoprophylaxe als Chemoprävention unauffällig Diagnostik TRU auffällig positiv Gefahr der frühen Generalisation mit schweren Erkrankungsformen wie z. B. tuberkulöse Meningitis, Miliartuberkulose! Antituberkulotische Therapie Tuberkulin-Hauttest (IFN-g-Test) Klinische Untersuchung Kinder 5 bis < 15 Jahre Induration > 5 mm nein Erneut THT/IFN-g-Test nach 8 Wochen + Klinische Untersuchung ja IFN-g-Test positiv nein ja Röntgen-Thorax auffällig Diagnostik Induration > 5 mm oder IFN-g-Test positiv? ja unauffällig negativ Chemoprävention nein Röntgen-Thorax nach Abschluss Keine weiteren Maßnahmen positiv Antituberkulotische Therapie IFN-g-Test 8 Wochen nach letztem Kontakt Kontaktperson ab 15 Jahren negativ Bei erhöhtem Risiko zusätzlich oder ggf. bei Erwachsenen > 50 Jahre statt IFN-g-Test (optional) unverzüglich Röntgen-Thorax positiv Beratung, keine weiteren Maßnahmen Röntgen-Thorax + Untersuchung unauffällig auffällig negativ Diagnostik positiv Chemoprävention ja Röntgen-Thorax nach Abschluss Antituberkulotische Therapie nein Beratung, TRU-Kontrolle binnen 1 Jahres unauffällig Quelle: nach Diel R. et al.: „Neue Empfehlungen für die Umgebungsuntersuchungen bei Tuberkulose“, Pneumologie 2011, 65:359-378, www.Pneumologie.de Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Keine weiteren Maßnahmen Stand 11 2014 Laborinformation Nr. 3 Arthritiden 1 Einteilung Entzündlich-rheumatische Erkrankungen umfassen Erkrankungen unterschiedlicher Genese und dem gemeinsamen Merkmal einer entzündlichen Reaktion an Gelenken und/ oder Knochen. Häufig handelt es sich um Multisystemerkrankungen mit Beteiligung des Bindegewebes innerer Organe (Gefäße, Herz, Lunge, Auge, Haut u. a.). Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 01 2010 Laborinformation Nr. 4 Labor Schottdorf MVZ GmbH Arthritiden 2 Klinik und Labordiagnostik Basisdiagnostik und Screening: BSG, CRP, großes Blutbild, Elektrophorese, RF-IgM, CCP-Ak, ASL quant., ANA, HLA-B27, Urin-Status Erkrankung Infektiöse Arthritis Akute bakterielle (septische) Arthritis Gelenk-, Knochentuberkulose Lyme-Arthritis (Borrelien) Lues Infekt-reaktive Arthritis Akutes rheumatisches Fieber Klinik Laborparameter Material hochfieberhafte Monarthritis, purulenter Erguss chronisch destruierende Arthritis, bevorzugt Befall tragender Gelenke: Wirbel, Hüftgelenke, Knie. Tuberkulöse Spondylarthritis kombiniert mit tuberkulöser Osteomyelitis der Brustwirbelsäule wandernde Oligoarthritis, asymmetrischer Befall, am häufigsten große Gelenke betroffen (Knie, Sprunggelenke, Ellenbogen, weiterhin Finger- u. Kiefergelenke), massiver Erguss Osteochondritis und Perichondritis mit typischen Deformitäten bei Lues connata (sehr selten) Erregeranzucht Gelenkpunktat, Blutkultur, Eiter Heparinblut (T-Spot) / Spezialröhrchen (QFT) wandernde Polyarthritis, kardiale und ZNSBeteiligung (Chorea minor), subkutane Knötchen Reaktive Arthritis bei Urogenital- und Darminfektionen meist Oligoarthritis großer Gelenke im Gefolge eines enteralen oder urogenitalen Infektes (1-4 Wochen), ggf. kombiniert mit Urethritis und Uveitis (Reiter-Syndrom) Begleitarthritis bei viralen Erkrankungen meist transiente Mitbeteiligung von Gelenken im Rahmen akuter Virusinfektionen, chron. Arthritiden bei chron. Virushepatitis B und C Spondylarthropathien Spondylitis ankylosans (M. Bechterew) Psoriasisarthritis Beginn meist als Sacroileitis, im Verlauf zunehmende Wirbelsäulen- und Thoraxversteifung, Augen- (Uveitis) und Herzbeteiligung (AV-Block) breites Spektrum unterschiedlicher Manifestationen an verschiedenen Gelenken möglich, geht in 15-20% der Fälle einer Psoriasis voraus Befall verschiedener Gelenke möglich, Aktivität korreliert oft mit Diarrhoe, meist keine erosiven Veränderungen T-Spot-TB oder Quantiferon-TB Gold Erregeranzucht Mykobakterien-PCR Borrelien-Serologie Gelenkpunktat Biopsiematerial Serum Borrelien-PCR* Gelenkpunktat Lues-Serologie Serum Nachweis ß-hämolysierender Streptokokken der Serogruppe A+C Antistreptolysin, Anti-DNAse B, AntiHyaluronidase Antikörper gegen Chlamydia trachomatis, Yersinien, Campylobacter, Salmonellen, Shigellen Nachweis enteropathogener Erreger Nachweis von Erregern urogenitaler Infektionen (Gonokokken, Mykoplasmen/ Ureaplasmen, Chlamydia trachomatis) HLA B27 (ca. 70% positiv) serologische Diagnostik: Parvo B19, Hepatitis B und C, EBV, CMV, Dengue u.a. Tonsillenabstrich, Eiter HLA-B27 (> 90 % positiv) EDTA-Blut Serum Serum Stuhl Urogenitalabstrich, Urin EDTA-Blut Serum keine spezifische Labordiagnostik HLA-B27 (ca. 70% positiv) EDTA-Blut Serum Zoeliakie x-ANCA, Becherzell-Ak, Ak gegen exokrines Pancreas, Saccharomyces cerevesiae-Ak Calprotectin Transglutaminase-Ak, Gliadin-Ak M. Whipple PCR auf Tropheryma whipplei* Darmschleimhautbiopsie RF-IgM, CCP-Ak, MCV-Ak Serum ANA, ENA, dsDNS-Ak, ANCA, zirkulierende Immunkomplexe, Komplement C3 und C4 Serum Harnsäure Serum Harnsäurekristalle Gelenkpunktat Kalziumpyrophosphatkristalle Gelenkpunktat Arthritis bei chronischentzündlichen Darmerkrankungen Colitis ulcerosa/ M. Crohn) Systemische entzündliche Erkrankungen Rheumatoide Arthritis Morgensteifigkeit der Gelenke, symmetrische Polyarthritis, primäre Lokalisation: Hand- und Fingergelenke, Rheumaknoten, erosive Arthritis, gelenknahe Osteoporose Arthritis bei Kollagenosen meist nicht erosive Oligo- oder Polyarthritis und Vaskulitiden mit wechselndem Gelenkbefall Kristallarthropathien Arthritis urica (Gicht) Pyrophosphat-Arthropathie (Pseudogicht) Gichtanfall: meist Monarthritis im Großzehengrundgelenk mit Rötung und schmerzhafter Schwellung chronische Gicht: asymmetrische Arthritis mit periartikulären Tophi akuter Anfall gichtähnlich, am häufigsten Knie-, Schulter- u. Handgelenke befallen oft bei bereits bestehender Osteoarthrose und Chondrokalzinose, schwerer destruierender Verlauf Stuhl Serum * Untersuchungen sind keine oder stark eingeschränkte Kassenleistung Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Labor Schottdorf MVZ GmbH Laborinformation Nr. 5 Autoimmundiagnostik 1 Kollagenosen Autoimmundiagnostik weitere Parameter Ha ut Ni er e Lu ng Ge e le Mu nke sk Ös eln op Ge hag us fä Ra ße yn He a u d rz ZN S Ge rin Ma nun ge g Al n-D lge a me rm in AN A ds DN EN S A SS - S c r -A e e n ing SS -B Sm nR N Sc P/Sm l-7 Jo 0 -1 My os A N i ti s C Bl o t AM A A Ak ti n Ce nt Ca rom rd ere Lu iolilp -Ak pu in s RF Antik -Ak , C oag CP ula ns Differentialdiagnose Organsystem Kollagenose-Screen. SLE Albumin/Urin subkutaner LE Sjögren-Syndrom Kryoglobuline MCTD/Sharp-Syndrom Albumin/Urin CREST-Syndrom Kälteaggl., Immunfixation Sklerodermie Albumin/Urin Polymyositis Tumorsuche Dermatomyositis Albumin/Urin rheumatoide Arthritis Vaskulitiden PR-3, MPO-Ak, Albumin/Urin M. Wegener PR-3-Ak, SDS-PAGE rapid progressive GN Albumin/Urin, SDS-PAGE Raynaud-Syndrom Kälteaggl., Immunfixation primär biliäre Zirrhose AMA-M2-Ak autoimmune Hepatitis LKM-1-Ak, LP-Ak primär skleros. Cholangitis Becherzell-Ak Marker 1. Wahl Marker 2. Wahl betroffenes Organsystem Marker bei autoimmun-vermittelter Gerinnungsstörung GN s ive titi s liti ku Va s og pr pid ra M. W eg en re er ss pa He un mm toi au är im pr yn Ra M. bil au iär d eZ oly irr ar ho thr se itis is sit ro ch /D lyPo Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. nis er er od ler Sk ch mi ma e nd Sy eP ro tom m yo s ntö nre ög Sj ed ,m LE ba ku ika tk me uta n yth Er su LE st (S . Lu LE pu s ) Sy ES CR Autoantikörper Aktin-Ak AMA ANA-IFT c-ANCA p-ANCA Cardiolipin-Ak CCP-Ak Centromere-Ak dsDNS-Ak Fibrillarin-Ak Jo-1-Ak Ku-Ak LKM-Ak LP-Ak Lupus Antikoagulans Mi-2-Ak MPO-Ak PM-Scl-Ak PR-3-Ak RF-IgM Ribosomen-Ak RNA-Polymerasen-Ak Scl-70-Ak Sm-Ak SS-A-Ak SS-B-Ak To-Ak U1-n-RNP-Ak MC TD (S TS ha yn rp dr -S häufig om yn dr em om weniger häufig ato ) de s Autoantikörper und Krankheitskorrelation Stand 07 2014 Labor Schottdorf MVZ GmbH Laborinformation 6 Autoimmun-Erkrankung 2 Organspezifische Autoimmunität ZNS Paraneoplast. Syndrom Neuronale Ak,Hu-,Ri-, Yo-Ak,MA2-Ak,CV2-Ak, Amphiphysin-Ak ZNS Enzephalitis Guillain Barre S. AMPA-Rezeptor-Ak, NMDA-Rezeptor-Ak Gangliosid-Ak Polyneuropathie IgM-Gammopathie MAG-Ak Speicheldrüsen Sjoergren-Syndrom ANA, SS-A-, SS-B-Ak Auge Neuromyelitis optica Sjögren Syndrom Uveitis Aquaporin4-Ak ANA, SS-A-, SS-B-Ak ANCA, ANA Nase M. Wegener ANCA, PR3-Ak Neben-Schilddrüse Hypoparathyreoidismus Parathyreoidea-Ak Mund Pemphigus Pemphigoid Desmosomen-Ak Basalmembran-Ak Ösophagus Kollagenose CREST-Syndrom ANA, Scl70-Ak Centromer-Ak Schilddrüse M. Basedow Hashimoto-Thyreoiditis TRAK TPO-Ak Haut Pemphigus Pemphigoid-Ak Desmosomen-Ak Haut-Basalmembran Lunge Kollagenose, M. Wegener Lungenfibrose ANA, ANCA, PR3-Ak t-RNS-Synthetase-Ak Muskel Myasthenie Lambert-Eaton-Syndrom Myotonie Dermatomyositis AChRA, MuSK, Titin-Ak Ca-Kanal-Ak K-Kanal-Ak ANA, Myositis-Blot Leber Autoimmunhepatitis ANA, GMA, Aktin-Ak, LKM, LP-Ak Gallenwege AMA, Centromer-Ak Primär biliäre Zirrhose Primär skleros. Cholangitis x-ANCA, PR3-Ak Magen Gastritis Typ A Darm Colitis ulcerosa M. Crohn Niere Kollagenose Vaskulitis Glomerulonephritis M. Wegener Nebenniere NNR-Insuffizienz PCA, Intrinsic-Faktor-Ak ANCA, Becherzell-Ak Pankreas exokrin-Ak, ASCA ANA ANCA,MPO-Ak GBM-Ak,PhospholipaseA2-Rezeptor-Ak ANCA,PR3-Ak NNR-Ak Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Pankreas Diabetes mellitus Pankreatitis autoimmun Darm Gluten-Enteropathie ICA, IA-2-Ak, ZnT8-Ak GAD-2-Ak, Insulin-Ak Carboanhydrase-Ak TTG-IgA, Gliadin-Ak Endomysium-IgA Ovar Sterilität, Amenorrhoe Polyendokrinopathie-S. Ovar-Ak Ovar-Ak, NNR-Ak Thrombozyten Thrombozytopenie TT Purpura Thrombozyten-Ak ADAMTS-13-Ak Erythrozyten Anämie hämolytisch Coombs-Test dir./indir. Testis Sterilität Polyendokrinopathie-S. Testis-Ak Testis-Ak, NNR-Ak Stand 07 2014 Laborinformation Nr. 7 ADH abhängige Störungen des Wasser- und Elektrolythaushaltes Das Antidiuretische Hormon (ADH), synonym: Arginin-Vasopressin (AVP), ist ein Peptidhormon des Hypophysenhinterlappens. Es entsteht durch Spaltung eines Prohormons in die Peptide ADH, Neurophysin II und CT-proVasopressin (CT-proAVP, Copeptin). ADH stimuliert die Wasserrückresorption in den distalen Tubuli und den Sammelrohren der Niere. Typische Krankheitsbilder sind der Diabetes insipidus (ADH-Mangel oder verminderte Wirkung) und das Syndrom der inadäquaten ADHSekretion (siehe Tabelle). Als Marker für die Beurteilung der ADH-Sekretion eignet sich das wesentlich stabilere CT-proVasopressin, das in äquimolarer Menge sezerniert wird. Die Beurteilung sollte immer im Zusammenhang mit der Plasmaosmolalität und des SerumNatriums erfolgen. Weiterhin sinnvoll sind Bestimmungen der Urinosmolalität und des Urin-Natriums. Interpretationshilfen und Algorithmen zur Stufendiagnostik sind in den unteren Abbildungen dargestellt. Diabetes insipidus: Syndrom der inadäquaten ADH-Sekretion (SIADH): Verminderte Fähigkeit der Nieren, bei Wasserentzug konzentrierten Harn zu produzieren. Ein Mangel an ADH (zentraler Diabetes insipidus) bzw. ein fehlendes Ansprechen der Niere auf ADH (renaler Diabetes insipidus) führen zu einem starken Wasserverlust mit der Folge einer hypertonen Dehydratation. Synonym: Schwartz-Bartter-Syndrom. Bezogen auf die Blutplasma-Osmolalität ist die Ausschüttung von ADH unangemessen hoch. Daraus resultieren eine gesteigerte Wasserretention und eine Verdünnungshyponatriämie (hypotone Hyperhydratation). 80% der Fälle sind paraneoplastisch bedingt (v.a. beim kleinzelligen Bronchial-Ca). SIADH Diabetes insipidus centralis Diabetes insipidus renalis Pathophysiologie unangemessen hohe ADHSekretion unzureichende ADH-Sekretion ADH-Rezeptordefekt Ätiologie meist paraneoplastisch idiopathisch (ca. 1/3 der Fälle); sekundär bei Tumoren, nach Schädel-Hirn-Traumata oder Infektionen des ZNS erblich (X-chromosomal- oder autosomal-rezessiv); erworben bei Nierenerkrankung Klinik Übelkeit, Erbrechen, Kopfschmerzen, Muskelkrämpfe, evtl. neurologische Symptome deutlich gesteigerte Urinmenge, starkes Durstgefühl, deutlich erhöhte Trinkmenge Plasma/ Serum: CT-proVasopressin↑, + + Na ↓, K ↓, Osmolalität ↓ CT-proVasopressin↓, + Na ↑, Osmolalität ↑ Urin: Na ↑, Osmolalität ↑↑ Labor + Weitere Diagnostik + CT-proVasopressin ↑, + Na ↑, Osmolalität ↑ + Na ↓, Osmolalität ↓↓ Na ↓, Osmolalität ↓↓ Desmopressin-Test: Urin-Osmolalität steigt an Desmopressin-Test: Urin-Osmolalität unverändert weitere Diagnostik empfohlen Material: CT-proVasopressin Osmolalität im Plasma + + Na , K EDTA-Blut EDTA-Blut Serum Osmolalität im Urin + Na im Urin Urin Urin 1) Gebrauchsanweisung CT-proAVP Brahms/Thermo Scientific 2012 Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 04 2015 Laborinformation Nr. 8 Labor Schottdorf MVZ GmbH Lyme-Borreliose Labordiagnostik Die Lyme-Borreliose ist eine durch die Spirochäte Borrelia burgdorferi hervorgerufene und die häufigste durch Zecken übertragene Infektionskrankheit. Sie ist eine Multisystemerkrankung, die mehrere Stadien durchlaufen kann. Epidemiologie Die drei häufigsten in Europa verbreiteten Unterarten der Gattung Borrelia burgdorferi sensu lato sind Borrelia afzelii (ca. 40%), Borrelia garinii (ca. 40%) sowie Borrelia burgdorferi sensu stricto (ca. 20%). Borrelia spielmanii wurde kürzlich als neue Art beschrieben. Borrelien werden durch Zecken der Gattung Ixodes (In Europa: Ixodes ricinus – Gemeiner Holzbock) übertragen. In Deutschland sind adulte Zecken im Durchschnitt zu 20%, Nymphen zu 10% und Larven nur zu etwa 1% infiziert. Die Übertragung erfordert einen längeren Saugakt (ca. 12-24 h). Nach bisherigen Erkenntnissen führt ein Zeckenstich bei 1,5 – 6% der Betroffenen zur Infektion (einschließlich der klinisch inapparenten Fälle); bei 0,3 – 1,4% ist mit einer manifesten Erkrankung zu rechnen. Erfolgt der Stich durch eine infizierte Zecke, erhöht sich die Übertragungswahrscheinlichkeit auf über 20%. In Endemiegebieten sind bei bis zu 25% der Bevölkerung, bei Risikogruppen (Forstarbeiter, Jäger) bis zu 40% Borrelien-Ak nachweisbar. Viele Zeckenstiche bleiben unbemerkt. Die Infektion hinterlässt keine Immunität, Reinfektionen sind möglich. Labordiagnostik Antikörpernachweise: - Borrelien-Ak IgG und IgM (LIA) im Serum als Suchtest - Borrelien-Ak IgG und IgM (Immunblot) im Serum als Bestätigungstest - Borrelien-spezifischer Antikörperindex im Liquor/Serum-Paar bei V. a. Neuroborreliose Erregernachweis mittels PCR in Hautbioptat*, Synovialflüssigkeit oder -gewebe* und Liquor ELISPOT Borrelien* im Heparinblut Untersuchung der Zecke auf Borrelien mittels PCR* *Keine Kassenleistung! Hinweise zu den Untersuchungen Antikörpernachweise Borrelien-Ak IgM werden in der Regel 2-6 Wochen nach Zeckenstich positiv und persistieren 3-6 Monate; in Einzelfällen längere Persistenz (bis zu 3 Jahren) möglich. Prädominanz im Stadium I. Borrelien-Ak IgG erscheinen durchschnittlich nach 4-8 Wochen. IgG-Ak gegen VLsE sind jedoch gelegentlich schon vor dem Auftreten von IgM nachweisbar. Prädominanz bei längerer Krankheitsdauer. Persistenz über Jahrzehnte möglich, bei Kindern oft schnellerer Abfall. Als Suchtest wird im Labor ein Lumineszenzimmunoassay (LIA) verwendet, positive oder grenzwertige Ergebnisse werden mit einem Immunblot bestätigt. Bei zweifelhaften Ergebnissen sollte der Befund innerhalb von 2 Wochen kontrolliert werden. Serologische Verfahren eignen sich nicht zur Kontrolle des Therapieerfolges. PCR Sensitivität im Hautbioptat (Erythema migrans, Acrodermatitis) und in Synovialflüssigkeit oder -gewebe (Lyme-Arthritis) ca. 50-70%, im Liquor (bei akuter Neuroborreliose) nur ca. 1030%. ELISPOT Borrelien Nachweis der Interferon-gamma Freisetzung von Lymphozyten nach Stimulation mit Borrelien-Antigenen. In Einzelfällen positive Reaktion noch vor der Bildung von IgM. Der ELISPOT wird im Vergleich zu IgG-Antikörpern wahrscheinlich früher negativ (nach ca. 6 Monaten bis 1 Jahr). Neues Verfahren mit noch begrenzter Datenlage. Untersuchungen bei V. a. Neuroborreliose Der Nachweis eines erhöhten Liquor/Serum-Antikörperindex (>1,5) gilt als das sensitivste Testverfahren (50-70%), die Sensitivität der PCR ist deutlich geringer. Weitere Befunde: Zunahme der Liquorzellzahl auf einige Hundert/µl mit mononukleärem Zellbild und Erhöhung der Immunglobuline im Liquor (IgG, IgA und IgM: sogenannte Dreiklassenreaktion). Stadien, Klinik und Antikörpernachweis der Borreliose Latenz Stadium 1 Stadium 2 Stadium 3 Tage bis Wochen bis zu 1 Jahr Jahre bis Jahrzehnte Lymphadenosis cutis Akrodermatitis chronica benigna atrophicans Organsystem Haut (Erreger überwiegend Erythema migrans Borrelia afzelii) Lyme-Arthritis Gelenke Nervensystem (Erreger überwiegend Borrelia garinii) (meist ein großes Gelenk, Knie oder Sprunggelenk betroffen) Akute Neuroborreliose meist mit Fazialisparese (häufig bei Kindern) Lymphozytäre Meningoradikulitis Bannwarth Chronische Enzephalomyelitis Abduzens- oder Fazialisparese Lyme-Karditis, AV-Block Herz Myoperikarditis Antikörper positiv in % Borrelien-IgG 10 - 50 50 - 100 90 - 100 Borrelien-IgM 50 - 90 15 - 70 3-7 Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 06 2008 Laborinformation Nr. 9 Labor Schottdorf MVZ GmbH Antiphospholipid-Syndrom Definition und Krankheitsbild Das Antiphospholipid-Syndrom (APS) ist eine Autoimmunerkrankung, die mit venösen und arteriellen Thrombosen, Spontanaborten und Schwangerschaftskomplikationen einhergeht. Die Erkrankung tritt isoliert als primäres APS oder als Begleiterkrankung (sekundäres APS) anderer Autoimmunerkrankungen (vor allem beim systemischen Lupus erythematodes, seltener bei M. Crohn, Immunthrombozytopenie, chronischer Polyarthritis, Vaskulitis) auf. Ein APS ist bei Frauen häufiger als bei Männern. Krankheitsursache sind so genannte Antiphospholipid-Antikörper, die an Komplexe aus negativ geladenen Phospholipiden und Proteinen (Cardiolipin, ß2-Glykoprotein-1, Phophatidylserin oder Prothrombin) binden. Diese Antikörper führen in vitro zu einer Verlängerung der PTT, sind jedoch in vivo nicht mit einer Blutungsneigung sondern im Gegenteil mit einer Thromboseneigung verbunden. Es muss zwischen Patienten mit eindeutigem APS und solchen unterschieden werden, bei denen nur vorübergehend Anti-Phospholipid-Ak nachweisbar sind (z.B. bei viralen oder bakteriellen Infektionskrankheiten). Bei Kindern werden diese Antikörper Infektions-assoziiert relativ häufig gefunden, Patienten mit Malignomen können ebenfalls Anti-Phospholipid-Ak entwickeln. Die Diagnose stützt sich daher auf die Klinik und den labordiagnostischen Nachweis (siehe Tabelle); letzterer sollte bei mindestens zwei Untersuchungen im Abstand von mindestens 12 Wochen positiv sein. Der labordiagnostische Nachweis umfasst Cardiolipin-Ak, ß2-Glykoprotein-1-Ak (ß2-GP1-Ak) und die unten aufgeführten gerinnungsphysiologischen Teste auf Lupus-Antikoagulans. Tab.: Diagnosekriterien für das APS Klinische Symptome - venöse oder arterielle Thrombose - intrauteriner Fruchttod nach der 10. SSW eines morphologisch normalen Fetus - Frühgeburt wegen (Prä-)Eklampsie oder Plazentainsuffizienz vor der 34. SSW - drei oder mehr Spontanaborte vor der 10. SSW, die durch andere Ursachen nicht erklärbar sind Laborkriterien - Lupus antikoagulans - Cardiolipin-Ak* - ß2-Glykoprotein-1-Ak* *IgG oder IgM, mittlerer oder hoher Titer Klinische Symptome bzw. Indikationen Rezidivierende, ungeklärte Thrombosen Venenthrombose Beinvenen, Armvenen, Vena cava inferior, Nierenvene, Budd-Chiari-Syndrom, Sinusvenenthrombose Lungenembolie, Nierenvenenthrombose Arterienthrombose ZNS: Schlaganfall, transitorische ischämische Attacken Augenarterienthrombose Koronarien: Herzinfarkt Extremitäten: AVK Schwangerschaftskomplikationen rezidivierende Spontanaborte, intrauteriner Fruchttod, Frühgeburt, Präeklampsie, Wachstumsretardierung des Föten Thrombozytopenie meist gering ausgeprägte Thrombozytopenie Unerklärbare Ergebnisse von Gerinnungstests meist PTT-Verlängerung, selten niedriger Quick Lupus erythematodes und andere Kollagenosen Labordiagnostik Gerinnungsphysiologischer Nachweis von Lupus-Antikoagulans (LA) = Nachweis der durch Anti-Phospholipid-Ak verursachten Verlängerung der PTT Darunter fallen folgende einzelne Gerinnungsuntersuchungen, die zusammen durchgeführt und bewertet werden (nicht einzeln anforderbar): Lupus sensitive PTT: Messung der PTT mit einem Reagenz, das besonders empfindlich auf Lupus-Antikoagulans reagiert LA Screening: basiert auf der dRVVT (diluted Russell´s Viper Venom Time); der Test enthält wenig Phospholipide und ist deshalb sehr sensitiv gegenüber Lupus antikoagulans. LA Bestätigungstest: Spezifitätsnachweis bei positivem Ergebnis der Screeningteste. Durch Zusatz von Phospholipiden im Überschuss werden die Anti-Phospholipid-Ak im Patientenplasma neutralisiert, dadurch verkürzt sich die PTT. Als weiterer Bestätigungstest wird ggf. ein PTT-Mischversuch (Mischung des Patientenplasmas mit einem Normalplasma) angeschlossen. Ein APS ist anzunehmen bei Vorliegen eines der genannten Symptome zusammen mit mindestens einem Laborkriterium. Labordiagnostischer Nachweis bei mindestens zwei Untersuchungen im Abstand von > 12 Wochen. Cardiolipin-Ak (EIA) Cardiolipin-Ak sind gegen den Komplex aus Cardiolipin und 2-Glykoprotein1 gerichtet. Falsch positive Ergebnisse werden bei Infektionskrankheiten (z.B. Lues, Hepatitis B, Helicobacter pylori-Infektion) und Malignomen gefunden. Bei Infektionen nachgewiesene Cardiolipin-Ak sind meist niedrig konzentriert. 30 - 50% der Patienten mit mittleren und hohen Cardiolipin-AK-Titern zeigen klinische Symptome des APS. Cardiolipin-Ak IgG Cardiolipin-Ak IgG in hohen Konzentrationen sind sehr stark mit einem Risiko für venöse Thrombosen und Lungenembolie assoziiert. Cardiolipin-Ak IgM Cardiolipin-Ak IgM sind weniger spezifisch und in niedriger Konzentration auch bei Gesunden vor allem nach Infektionskrankheiten nachweisbar. 2-Glykoprotein1-Ak IgG/IgM (EIA) Die Höhe der Antikörper korreliert eng mit dem Thromboserisiko bei APS. Falsch positive Ergebnisse treten seltener auf als bei den Cardiolipin-Ak. 2-Glykoprotein 1 hemmt die Bildung von Faktor Xa. Diese gerinnungshemmende Funktion wird durch 2-GP1-Ak gestört. Anforderung und Material Cardiolipin-Ak EIA 2-GP1-Ak EIA Lupus-Antikoagulans 1 ml Serum 1 ml Serum 3 ml Citratplasma gefroren Hinweise 1) Der Cardiolipin-Mikroflockungstest ist eine Zusatzuntersuchung zur Klärung der Therapienotwendigkeit und zur Verlaufskontrolle der Lues-Infektion. Für die Diagnostik eines APS ist dieser Test zu unempfindlich. 2) Lupus-Antikoagulans u./o. Cardiolipin-Ak können im Zusammenhang mit einem sekundären APS bei Lupus erythematodes auftreten und sind bei dieser Indikation als Zusatzuntersuchung sinnvoll. Da aber nur ca. ein Drittel der Lupus-Patienten AntiPhospholipid-Ak bildet, sind sie als Suchtest nicht geeignet. Als Screeningtest bei V.a. Kollagenose ANA anfordern! Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 10 Labor Schottdorf MVZ GmbH Chlamydia trachomatis Erreger Chlamydia trachomatis ist ein Gram-negatives Bakterium, dessen Vermehrung obligat intrazellulär in Zylinderepithelzellen erfolgt. Verschiedene Serotypen (A,B,C; D bis K; L1-3) rufen vor allem Erkrankungen des Urogenitaltraktes und der Konjunktiven hervor (siehe Tabelle). Die in Mitteleuropa auftretenden Infektionen werden fast ausschließlich von den C. trachomatis Serotypen D bis K verursacht. Klinische Bedeutung Die genitale Chlamydieninfektion ist die häufigste sexuell übertragbare bakterielle Erkrankung. Unbehandelt persistieren die Erreger über einen Zeitraum von mehreren Jahren (durchschnittlich 4 Jahre). Die Erkrankung verläuft bei 80% der infizierten Frauen und bei 50% der Männer asymptomatisch. Die in der Regel leichte Symptomatik präsentiert sich bei Frauen als ungewöhnlicher vaginaler Ausfluss, Zwischenblutung, Blutung nach dem Verkehr oder Dysurie, bei Männern als Harnwegsinfekt mit Ausfluss, gelegentlich als Prostatitis/ Epididymitis oder Proktitis. Bei Frauen kann eine aszendierende Infektion über die Tuben zu chronisch entzündlichen Veränderungen im kleinen Becken führen (Pelvic Inflammatory Disease, PID). Die Infektion mit C. trachomatis ist die häufigste infektiöse Ursache für Infertilität. Reaktive Arthritis und M. Reiter sind mögliche immunologisch bedingte Folgeerkrankungen bei beiden Geschlechtern. Eine Infektion mit C. trachomatis erhöht das Risiko für die Übertragung von HIV und kann als Kofaktor für die Entwicklung eines Zervixkarzinoms bei HPV-positiven Frauen wirken. Epidemiologie Übertragung sexuell oder intra partum als Schmierinfektion Inkubationszeit 1-3 Wo. 300.000 jährliche Neuerkrankungen in Deutschland Prävalenz: 2-5%, bei Personen unter 25 Jahre 5-10%. Diagnostik Erregernachweis Der Nachweis des Erregers oder Erreger-spezifischer Nukleinsäure erfolgt im Urin, aus Urogenitalabstrichen oder im Sperma. Wegen der häufig sehr geringen Erregerkonzentration sollten hochsensitive Nukleinsäureamplifikationsverfahren (z.B. PCR) zum Einsatz kommen. Weiterführende Diagnostik In Risikogruppen sollten Doppelinfektionen mit Gonokokken und anderen Erregern sexuell übertragbarer Krankheiten in Betracht gezogen werden. Ggf. sinnvoll sind daher der Gonokokkennachweis im Urin (PCR) sowie der Ausschluss einer Lues (TPHA-Test) und einer HIV-Infektion. Therapie Antibiotika der Wahl gegen C. trachomatis sind Tetrazykline, Makrolide und Gyrasehemmer. Sexualpartner müssen konsequent mitbehandelt werden, um eine Reinfektion zu verhindern. Therapiedauer: mindestens 14 Tage Screening auf genitale C. trachomatis-Infektionen bei Frauen Das Screening auf C. trachomatis ist in den MutterschaftsRichtlinien verankerter Bestandteil der Vorsorgeuntersuchungen für Schwangere und sollte bei der ersten Vorstellung nach Feststellung der Schwangerschaft erfolgen. Weiterhin können sexuell aktive Frauen bis zum vollendeten 25. Lebensjahr einmal jährlich („im Krankheitsfall“=4 Quartale) ein Screening auf C. trachomatis in Anspruch nehmen. Das Screening sollte auch im Zusammenhang mit einem Schwangerschaftsabbruch angeboten werden. Im Rahmen von Screeninguntersuchungen stellt ausschließlich die Untersuchung einer Urinprobe mittels NAT eine über den EBM abrechnungsfähige Leistung dar. Anforderung und Material Erregernachweise 5-10 ml Spontanurin C. trachomatis-PCR im Urinröhrchen oder Becher, keinen Urikult verwenden ! Bevorzugt 1. Portion vom Morgenurin einsenden (keinen Mittelstrahlurin), da hier die Erregerkonzentration am höchsten ist. Urogenitalabstrich trockenen Tupfer, keinen Tupfer mit Gel einsenden ! Kein Screening, nur als kurative Leistung bei Krankheitsverdacht ! Antikörpernachweis Die Serologie kann den Erregernachweis nur ergänzen. Antikörper der Klasse IgA steigen 2-4 Wo., IgG-AK 6-8 Wo. nach Primärinfektion an, IgM-Ak spielen für die Diagnostik keine Rolle. Hohe IgGund nachweisbare IgA-Ak sprechen für eine floride Infektion, hochtitrige oder lang persistierende IgA-Ak sind oft mit chronischen Infektionen oder einer reaktiven Arthritis assoziiert. Bei einer C. trachomatis bedingten Tubenschädigung mit Infertilität finden sich häufig Antikörper gegen chlamydiales Heat Shock Protein 60 (cHSP60-IgG). Der Abfall der Antikörperkonzentration nach ausgeheilter Infektion kann 1-2 Jahre dauern. 1ml Sperma Antikörpernachweise C. trachomatis-AK 1 ml Serum (IgA, IgG, cHSP60cHSP60-IgG bitte gezielt anfordern ! IgG) Serotyp A-C D-K L1-3 Assoziierte Erkrankungen Vorkommen Übertragung Trachom (chronische Keratokonjunktivitis, Erblindung) Mann: Urethritis, Prostatitis, Epididymitis, Proktitis, Konjunktivitis Reaktive Arthritis, M. Reiter Frau: Urethritis, Proktitis, Zervizitis, Bartholinitis, Endometritis, Salpingitis, Adnexitis, PID, Konjunktivitis, Infertilität, ektope Schwangerschaft Reaktive Arthritis, M. Reiter Neugeborene: Einschlusskörperchen-Konjunktivitis, atypische Pneumonie Lymphogranuloma venereum Tropen Schmierinfektion weltweit Sexualkontakte Schmierinfektion bei Konjunktivitis („Schwimmbadkonjunktivitis“) weltweit Tropen, weltweit als Koinfektion bei HIV zunehmend intra partum bei Passage durch den Geburtskanal Sexualkontakte Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Labordiagnostik bevorzugtes Verfahren fett PCR (Augenabstrich) Antikörper PCR (Urin, Sperma, Prostatasekret, Harnröhrenabstrich) Antikörper PCR (Urin, Cervixabstrich) Antikörper incl. cHSP60-IgG PCR (Augenabstrich, Trachealsekret, Rachenspülwasser) PCR (Ulcusabstrich, Lymphknotenaspirat) Stand 07 2014 Laborinformation Nr. 11 Labor Schottdorf MVZ GmbH Durchfallerreger Durchfallerkrankungen in der Allgemeinarztpraxis Durchfallerkrankungen gehören zu den häufigsten Ursachen für Arztbesuche. In den meisten Fällen verläuft die Infektion selbstlimitierend und bedarf keiner antibiotischen Therapie. In folgenden Fällen ist jedoch eine mikrobiologische Diagnostik angezeigt: Schwere blutige Durchfälle, schwerer oder protrahierter Verlauf, kürzliche Auslandsaufenthalte in Risikoländern, Umgebungserkrankungen, stationäre Patienten mit nosokomial erworbener Infektion, Immunschwäche, V.a. C. difficile induzierte Kolitis, Säuglinge unter 3 Monaten und V.a. hämolytisch-urämisches Syndrom. Eine Sentinelstudie in Allgemeinarztpraxen zeigte, dass bei etwa ¼ der Fälle ein Erreger gefunden wird. Noroviren waren die häufigste Ursache gefolgt von C. difficile, Rotaviren, Campylobacter, Salmonellen, Adenoviren, Lamblien, Cryptosporiden und Yersinien (siehe Tabelle). Erreger Noroviren Clostridium difficile Rotaviren Campylobacter Enteritische Salmonellen Adenoviren Pathogene E. coli Lamblien Cryptosporidien Yersinia enterocolitica EHEC Shigellen Typhöse Salmonellen *Studie in Allgemeinarzt praxen 36 % 19 % 17 % 9% 7% 5% 3% 3% 1% - + Gemeldete Fälle in D 2012 (RKI) 113.286 39.289 62.880 20.849 7065 4228 1385 2705 1531 526 101 *Huhulescu et al. Etiology of Acute Gastroenteritis in Three Sentinel General Practices, Austria 2007. Infection 2009;37(2):103-8 + Infektionsepidemiologisches Jahrbuch für 2012 RKI, Berlin, 2013 Therapie In der Regel müssen leichte Infektionen mit enteritischen Salmonellen, Campylobacter und Yersinien nicht antibiotisch behandelt werden. Bei schweren und protrahierten Verläufen ist in der Regel Ciprofloxacin (Salmonellen, Shigellen, Yersinien) oder Azithromycin (Campylobacter) Mittel der Wahl. Bei Nachweis von EHEC sollte i.d.R. auf ein Antibiotikum verzichtet werden (cave Auslösung eines HUS). Obligat ist die antibiotische Therapie bei Infektionen mit Salmonella Typhi, Vibrio cholerae, Entamoeba histolytica, Giardia lamblia, und Clostridium difficile (bei schweren oder fortbestehenden Symptomen). Erreger Clostridium difficile Diarrhoe oder Kolitis Salmonella, Shigella, EIEC, Aeromonas, Plesiomonas, Vibrio (non Cholerae) Campylobacter jejunii Yersinia enterocolitica EHEC, STEC Giardia lamblia Cryptosporidium Entamoeba histolytica Empirische Therapie Metronidazol 3 x 500 mg (Vancomycin 4 x 125-500 mg), 10-14 Tage Ciprofloxacin 2 x 500 mg, 7-14 Tage, (Azithromycin 1 x 500 mg, 3-7 Tage) Azithromycin 1 x 500 mg, 3 Tage Ciprofloxacin 2 x 500 mg (Cotrimoxazol 2 x 0,96 g), 7 Tage Keine Antibiotika! Metronidazol 3 x 250 mg, 5 Tage (Nitazoxanid 2 x 500 mg, 3 Tage) Symptomatisch (Nitazoxanid 2 x 500 mg, 3 Tage, in Deutschland nicht erhältlich) Metronidazol 3 x 500 mg, 7-10 Tage danach Paromomycin 3 x tgl. für 7 weitere Tage Namentliche Meldepflicht Behandelnder Arzt (§ 6 IfSG): Bei V. a. Lebensmittelvergiftung oder Erkrankung an einer akuten infektiösen Gastroenteritis und Tätigkeit mit Lebensmitteln im Sinne des § 42 IfSG oder wenn mehrere Erkrankungen auftreten bei denen ein epidemischer Zusammenhang vermutet wird. Labor (§ 7 IfSG): Nachweis von Salmonellen, Shigellen, Campylobacter, Yersinia enterocolitica, Cryptosporidien, pathogene E. coli (EHEC, EPEC, ETEC, EIEC), Norovirus, Rotavirus, Giardia lamblia, Vibrio cholerae O1 und O139. Vorschriften für Gemeinschaftseinrichtungen Nach § 34 IfSG dürfen Personen, die an Cholera, einer EHEC Infektion, Typhus, Paratyphus oder Shigellose erkrankt sind keinen Kontakt zu den Betreuten haben. Die Wiederzulassung ist nur mit Zustimmung des Gesundheitsamtes möglich. Eine klinische Genesung und 3 unabhängige neg. Stuhlproben werden i.d.R. gefordert. Beschäftigungsverbote beim Umgang mit Lebensmitteln Nach § 42 IfSG dürfen Personen, die an einer infektiösen Gastroenteritis erkrankt sind oder Shigellen, Salmonellen, EHEC oder Choleravibrionen ausscheiden, beim Herstellen, Behandeln und Inverkehrbringen von Lebensmitteln nicht beschäftigt werden. Labordiagnostik Das Transportgefäß sollte zu ca. 1/3 mit der Stuhlprobe befüllt werden (blutige, schleimige, eitrige Anteile bevorzugt entnehmen). Bei V.a. Parasiten und Protozoen wird die Untersuchung von 3 Stuhlproben an unterschiedlichen Tagen empfohlen (Einsendung am Entnahmetag). Die Anforderung „pathogene Keime“ beinhaltet nur die Untersuchung auf Salmonellen, Shigellen, Campylobacter und Yersinien. Andere Erreger (siehe Tabelle) müssen separat angefordert werden! Ein Antibiogramm sollte bei typhösen Salmonellen, Shigellen, und Choleravibrionen, angefordert werden; bei Kleinkindern, älteren Patienten und Immunsupprimierten auch bei enteritischen Salmonellen, Yersinien, Campylobacter und Aeromonas. Indikation Basisuntersuchung Diarrhoe “pathogene Keime” Wässrige Diarrhö Blutige Diarrhö Nach Auslandsreise Kinder < 6J Rezidivierende Abdominalbeschwerden Immunsuppression Antibiotikatherapie in den letzten 6 Wochen Persistierende Diarrhö > 3 Wochen Stat. Aufenthalt ab Tag 4 Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Wichtigste Erreger Salmonellen, Shigellen, Campylobacter, Yersinien + Noro-, Rota-, Adeno-, Astroviren, Lamblien, Cryptosporidien + Clostridium difficile, EHEC, Aeromonas, Vibrio + pathogene E. coli , Vibrio, Adeno-, Astro-, Noro-, Rotaviren, Lamblien, Cryptosporidien, Amoeben, Kokzidien, Wurmeier + EPEC, EHEC, Rota-, Adenoviren, Lamblien +Yersinien, Clostridium difficile, Lamblien, Wurmeier + Cryptosporidien, Microsporidien, Kokzidien, Adeno-, Astro-, Noro-, Rotaviren, Pseudomonas, Klebsiella oxytoca, C. perfringens, S. aureus, Pilze, Aeromonas, Mykobakterien + Clostridium difficile (GDH + Toxin EIA) + Clostridium difficile, EPEC , EHEC, EAEG, Cryptosporidien, Lamblien, Kokzidien Nur Clostridium difficile Stand 08 2014 Labor Schottdorf MVZ GmbH Laborinformation Nr. 12 Darmerkrankung Chronische Diarrhoe Definition und Pathophysiologie Labordiagnostik Basisdiagnostik Chronische Diarrhoe ist gekennzeichnet durch ein Stuhlgewicht > 250g/Tag bei über 3 StuhlMikrobiologie entleerungen/Tag, eher dünnflüssiger Konsistenz und einer Dauer > 2-3 Wochen. Blut / Entzündung Je nach zugrunde liegender Funktionsstörung Verdauungssekrete kommt es zu typischen Stühlen. Dabei können gleichzeitig mehrere Diarrhoeformen vorliegen (z. B. exsudative und osmotische Diarrhoe). Parameter Material TPE (”Typhus/Paratyphus/Enteritidis”-Gruppe), pathogene E.coli (inkl. Shiga-Toxin) okkultes Blut im Stuhl, Albumin, Hämoglobin immunol.*, Hämoglobin/Haptoglobin-Komplex*, a-1-Antitrypsin, Lysozym, Lactoferrin, Calprotectin Gallensäuren, Pankreatische Elastase b-Carotin* (bei mangelnder Fettresorption im Serum vermindert < 470 µg/l 3 x Stuhl Stuhl 3 x Stuhl Serum hochspezifisch für Steatorrhoe, Parameter der Wahl, besser als Fett im Stuhl) Chronische Diarrhoe kann Manifestation einer ernsthaften organischen Erkrankung sein und erfordert eine weitergehende Diagnostik. Entzündungsstatus Malabsorption CRP, Elektrophorese, Ferritin, IgG, IgA, IgM Differentialblutbild BKS Calcium, Phosphat, Albumin, Vitamin B12, Vitamin D (25-OH) Diarrhoeform Ursachen Parameter Exsudative Diarrhoe Störungen von Sekretion und Resorption: wässrige, schleimige Diarrhoe durch Adhäsion von Pathogenen oder Toxinen mit Zerstörung des Bürstensaums oft blutige Diarrhoe durch Mucosainvasion lokale Gewebeschädigung (Erosionen, Nekrosen, Ulcerationen) durch Autoimmunprozesse Vorwiegend Dickdarmbeteiligung 3 x Stuhl TPE, pathogene E.coli [EHEC (inkl. Shiga-Toxin)] Infektion Clostridium diff. (inkl. Toxin), Amöben (Stuhl + Serum), Lamblien,Cryptosporidien, Kokzidien, Wurmeier Nach Auslandsaufenthalt zusätzlich: Aeromonas spp., Vibrio spp., Balantidium coli Bei Immunschwäche zusätzlich: Fakultativ path. Darmkeine (u. a. Proteus spp., Klebsiella oxytoca, Aeromonas hydrophila / caviae, Pseudomonas spp., andere Nonfermenter), S. aureus, C. perfringens, Mykobakterien spp., Mikrosporidien, Pilze Stuhl: eher dunkel, blutig häufig schleimig kleine Mengen Antibiotika assoziiert Colitis ulcerosa Morbus Crohn Dünndarmbeteiligung M. Whipple Osmotische Diarrhoe Hyperosmolarer, nicht resorbierbarer Nahrungsbrei mit nachfolgendem Wassereinstrom bei Enzymmangel oder Resorptionsstörung, oft mit Gewichtsverlust und Ernährungsmängeln. Auslösung auch durch Fruktose, Sorbitol, Mannitol in Obst, Kaugummi, Diätnahrung u. a.. Stuhl: • fettig, übelriechend, • große Mengen, • Besserung durch Fasten Malabsorption infolge Zöliakie (Sprue) Kohlenhydrat-Malabsorption Laktoseintoleranz Fruktoseintoleranz Nahrungsmittelallergie induzierter Diarrhoe Laxantienabusus Medikamente Maldigestion infolge Gallensäuremangel durch Cholestase Gallensäureverlustsyndrom (M. Crohn, Ileumresektion) Exokr. Pankreasinsuffizienz Sekretionsstörung bei Mukoviszidose Serum EDTA-Blut BKS-Röhrchen Serum Clostridium difficile (GDH + Toxin) x-ANCA, Becherzell-Ak, Vitamin B12, Vitamin D (25-OH) a-1-Antitrypsin, Lysozym, Lactoferrin, Calprotectin Exokrine Pankreas-Ak, Saccharomyces cerevesiae-Ak, Vitamin B12, Vitamin D25 a-1-Antitrypsin, Lysozym, Lactoferrin, Calprotectin 3 x Stuhl Serum 3 x Stuhl PCR auf Tropheryma whipplei* Dünndarmbiopsie (nativ) Gliadin-, Transglutaminase-Ak Serum Laktosebelastungstest Laktase-Genuntersuchung Fruktosebelastungstest RAST auf Nahrungsmittel (FX5 als Screening, Einzelallergene nach Anamnese) 5 x NaFNaF-Blut (s. LV) EDTA-Blut 5 x Atemluft (s. LV) Serum Laxantiennachweis Medikamentenscreening mit Angabe des nachzuweisenden Wirkstoffes 24h-Urin Spontanurin GOT, GPT, g-GT, AP, Bilirubin ges., b-Carotin*, CEA, CA19-9 Gallensäuren gesamt, Pankreatische Elastase Gallensäuren gesamt Serum 3 x Stuhl Pankreatische Elastase, b-Carotin* Pankreatische Elastase, b-Carotin* Genetische Untersuchung auf Mukoviszidose 3 x Stuhl, Serum 3 x Stuhl, Serum EDTA-Blut Serum Serum 3 x Stuhl 3 x Stuhl Sekretorische Diarrhoe Gesteigerte Elektrolyt- und Wassersekretion nach Aktivierung der Adenylatzyklase durch Bakterientoxine, Hormone des Gastrointestinaltraktes. Vorwiegend Dünndarmerkrankung Bakterielle Enterotoxine Stuhl: • wässrig, schaumig, hell, • kein Blut/Schleim, • große Mengen, • unverdaute Nahrungsreste • keine Besserung durch Fasten Endokrine Ursachen Hyperthyreose Karzinoidsyndrom Zollinger-Ellison-Syndrom Wechsel Diarrhoe / Obstipation Bei Stenosen im distalen Colon (Carcinome, Divertikulitis) Veränderte Darmmotilität Stuhleinklemmung / Tumor Hämoglobin immunol.*, Hämoglobin/Haptoglobin-Komplex*, M2-PK* Stuhl CEA, CA19-9 Serum Stuhl: • bakterielle Verflüssigung im Wechsel mit Obstipation • kleine Stuhlmengen Diabetische Neuropathie Sklerodermie Aktives Glukagonom Reizkolon HbA 1c ANA, Scl-70-Ak Glukagon Ausschlussdiagnose Verner-Morrison-Syndrom (VIPom) TPE, pathogene E.coli (inkl. Shiga-Toxin), Clostridien (inkl. Toxine) 3 x Stuhl Vibrio spp. TSH basal, ggf. fT3, fT4 5-OH Indolessigsäure, Chromogranin A Gastrin-Stimulationstest Genetische Untersuchung zum Ausschluss von MEN1 VIP Serum 24h-Urin+HCL/Serum Serum gefr. EDTA-Blut 3ml EDTA-Plasma gefr. (Trasylolröhrchen) EDTA-Blut Serum EDTA-Pl. gefroren * keine Kassenleistung Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 13 Diabetes mellitus Klassifikation und Labordiagnostik Klassifikation Typ 1-Diabetes (T1D): Typ 2-Diabetes (T2D): Gestationsdiabetes (GDM): Maturity Onset Diabetes of the Young (MODY): Andere spezifische Diabetes-Typen: Zerstörung der B-Zellen des Pankreas durch Autoimmunprozess, führt zum absoluten Insulindefizit. Manifestation meist im Kindes- und Jugendalter, zunehmend auch im Erwachsenenalter (differentialdiagnostische Abgrenzung zum Typ 2-Diabetes!) als Late Autoimmune Diabetes of the Adult (LADA) relativer Insulinmangel (nicht ausreichende Insulinsekretion bei peripherer Insulinresistenz) erstmals während der Schwangerschaft aufgetretene Glukosetoleranzstörung Diabetes auf der Basis verschiedener genetischer Defekte, Abgrenzung von anderen Diabetesformen und vom GDM notwendig, spezifische Therapie je nach zugrunde liegendem Defekt Endokrinopathien (u.a. Hypercortisolismus, Phäochromozytom, Glucagonom, Wachstumshormonproduzierende Tumoren), Erkrankungen des exokrinen Pankreas, Hämochromatose, Medikamenten-assoziiert Parameter des Glukosestoffwechsels Parameter Blutzucker HbA1c Insulin HOMA-Index Proinsulin C-Peptid Auto-Ak Indikation Diagnostik eines Diabetes mellitus oder GDM: Bestimmung als Zufallsglukose, Nüchternglukose oder nach Belastung (oGTT) Blutzuckerselbstkontrolle bei bekanntem Diabetes Diagnostik eines Diabetes mellitus (nicht GDM!) Langzeitparameter für die Stoffwechseleinstellung Beurteilung einer Insulinresistenz bei Risikopatienten und bei PCO-Syndrom (HOMA-Index), Insulinom Insulinom, Restsekretion bei T1D, Erschöpfung der ß-Zellen bei T2D, DD zwischen T1D (LADA) und T2D DD zwischen T1D (LADA) und T2D bzw. MODY Risiko der Entwicklung eines T1D bei Familienangehörigen Ak gg. Insulin, Inselzellen, Glutamatdecarboxylase (GAD65), Tyrosinphosphatase (IA-2) und Zink Transporter 8 (ZnT8) Bemerkungen Bewertung auf der Basis des Abnahmezeitpunktes und der Indikation (siehe unten) Material NaF/Citrat-Blut Verfälschung des HbA1c-Wertes möglich bei: - Hämoglobinvarianten (methodenabhängig) - Zustände mit erhöhter oder erniedrigter Lebensdauer der Erythrozyten - Chemischer Modifikation von Hämoglobin (Urämie, hochdosierte ASS-Dauertherapie) - Hemmung der Glykierung (z. B. Dauertherapie mit Vitamin C oder E) - Schwangerschaft - Transfusionen EDTA-Blut Serum gefroren/ NaF/Citrat-Blut Serum Vorliegen von mindestens zwei Autoantikörpern Serum gilt als sicheres Zeichen für eine Autoimmunreaktion gegen Inselzellen. Ca. 70% dieser Patienten entwickeln innerhalb von 10 Jahren einen T1D. Entscheidungsgrenzen und diagnostisches Vorgehen (Flussschema, nach [1]) HbA1c < 5,7 % (< 39 mmol/mol) = Ausschluss eines Diabetes 5,7 - 6,4 % (39-47 mmol/mol) = Grenzbereich ≥ 6,5 % (≥ 48 mmol/mol) = Diabetes wahrscheinlich Plasmazucker zufällig, nicht ≥ 200mg/dl (≥ 11,1 mmol/l) = Diabetes nüchtern nüchtern 100-125mg/dl (5,6 mmol-6,9 mmol/l) = abnorme Nüchternglukose (IFG)* ≥ 126 mg/dl (≥ 7,0 mmol/l) = Diabetes. oGTT 140-199 mg/dl (7,8-11,0 mmol/l) = 2h-Wert gestörte Glukosetoleranz (IGT)* ≥ 200mg/dl (≥ 11,1 mmol/l) = Diabetes Symptome des Diabetes HbA1c *IFG und IGT gelten als Prädiabetes; Progression zum Diabetes in einem Jahr: IFG: 5%, IGT: 10%, IFG+IGT: 20% < 5,7 Nüchternglukose (NPG) oder oGTT Ein MODY sollte ausgeschlossen werden bei: - Insulinabhängigem Diabetes bei Kindern und jungen Erwachsenen (<35 J.) mit fehlendem Nachweis von Auto-Ak und geringem Insulinbedarf nach 2 Jahren Diabetesdauer (<0,5 E/kg KG/Tag) - T2D bei Kindern und Jugendlichen ohne Übergewicht - Diabetes seit drei Generationen in der Familie - Gestationsdiabetes: In ca. 2 % aller Fälle einer Glukosetoleranzstörung in der Schwangerschaft wird ein MODY 2 demaskiert. Häufigste Formen sind MODY 2 (Mutation der Glukokinase) und MODY 3 (Mutation des HNF1A). Aufgrund der Bedeutung für Therapie und Langzeitprognose sollte bei begründetem Verdacht die genetische Abklärung erfolgen. 5,7 bis < 6,5 % ≥ 6,5 % NPG ≥126 mg/dl u./o. 2h-oGTT ≥200 mg/dl NPG 100-125 mg/dl u./o. 2h-oGTT 140-199 mg/dl NPG <100 mg/dl u./o. 2h-oGTT <140 mg/dl Diagnose: Diabetes Diagnose: Kein Diabetes Aufklärung über Diabetesrisiko, Lifestyle-Intervention, Behandlung von Risikofaktoren. Erneute Risikobestimmung und HbA1c nach 1 Jahr. Literatur: [1] Definition, Klassifikation und Diagnostik des Diabetes mellitus. Praxisleitlinie der DDG 2014 (www.ddg.de). [2] Prädisposition, frühe Stadien und Phänotypen des Typ-1-Diabetes. DMW 2014;139:1100–1104. [3] Prädisposition und Phänotypen des MODY – Implikationen für Diagnostik und Therapie. DMW 2014;139:1127–1130. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 11 2015 Laborinformation Nr. 14 Diphtherie Einleitung Die Diphtherie ist eine ansteckende Infektionskrankheit, die von Corynebacterium diphtheriae verursacht wird. Sie manifestiert sich am häufigsten in der Tonsillopharyngeal-Region (Rachendiphtherie). Seltener sind auch Larynx, Nase, Trachea, Bronchien, Haut und Wunden betroffen. Corynebakterien sind aerobe, unbewegliche grampositive Stäbchen. Der wichtigste Virulenzfaktor von C. diphtheriae ist das Diphtherietoxin, welches die Proteinsynthese der Wirtszellen hemmt und zu schweren systemischen Komplikationen führen kann. Es wird nur von phageninfizierten Corynebakterien gebildet. Nichttoxigene C. diphtheriae-Stämme verursachen nur selten Infektionen. Neben C. diphtheriae können auch Stämme der engverwandten Spezies C. ulcerans und C. pseudotuberculosis das Bild einer Diphtherie verursachen. Der Mensch ist das einzige epidemiologisch relevante Reservoir für C. diphtheriae. C. ulcerans und C. pseudotuberculosis können dagegen von Tieren auf den Menschen übertragen werden. Die Rachendiphtherie wird durch Tröpfchen von Mensch zu Mensch übertragen, die Hautdiphtherie durch direkten Kontakt (selten über kontaminierte Gegenstände). Ohne Behandlung beträgt die Ansteckungsfähigkeit ca. 2 Wochen, bei Antibiotikatherapie 2-4 Tage. Klinische Verlaufsformen Die Rachendiphtherie beginnt ca. 2-5 Tage nach Infektion mit Halsschmerzen, Fieber und Schluckbeschwerden. Später kommt es zu Heiserkeit, Stridor, Gaumensegellähmung und Lymphknotenschwellung. Auf Tonsillen, Gaumen und Uvula bilden sich grau-weiße Beläge, die beim Abstreifen bluten (sog. Pseudomembranen). Die Erkrankung kann bis zu einer Atemwegsobstruktion fortschreiten (Krupp). Bei Befall der Nasenschleimhaut (Nasendiphtherie) kommt es zu serosanguinösem Ausfluss. Bei der Kehlkopfdiphtherie dominieren Husten und Heiserkeit. Differentialdiagnostisch müssen eine Streptokokkenangina, die Angina Plaut Vincentii, eine infektiöse Mononukleose und eine Epiglottitis abgegrenzt werden. Neben den respiratorischen Symptomen kann es durch die Dissemination des Diphtherietoxins zu einer Organschädigung kommen. Dies tritt häufiger bei schwerer respiratorischer Erkrankung auf. Bei bis zu 2/3 der Fälle entsteht eine Myokarditis, die ca. 7-14 Tage nach Beginn der respiratorischen Beschwerden beginnt. Bei ca. 5% der Patienten kommt es zu einer Polyneuritis. Zu den seltenen Komplikationen gehören Nierenversagen, Enzephalitis, Hirninfarkt, Lungenembolie, Endokarditis. Nichttoxigene C. diphtheriae Stämme sind mit Endokarditis, Osteomyelitis und septischer Arthritis assoziiert. Die Haut- oder Wunddiphtherie kommt überwiegend in den Tropen vor. Sie entsteht auf der Basis bereits vorhandener Dermatosen oder Verletzungen. Die Klinik entspricht der von sekundären bakteriellen Hautinfektionen. Es kann aber auch zu chronischen Ulzera mit grauen Membranen kommen. Systemische toxische Manifestationen sowie die Entwicklung einer Rachendiphtherie sind selten. Gesetzliche Bestimmungen (IfSG) Nach § 6 des IfSG besteht für den behandelnden Arzt bereits bei Krankheitsverdacht eine Meldepflicht (namentliche Meldung). Das Labor meldet nach § 7 den Nachweis eines toxinbildenden Stammes. Nach § 34 des IfSG dürfen Personen, die an Diphtherie erkrankt sind, Gemeinschaftseinrichtungen nicht betreten. Eine Wiederzulassung von Erkrankten und Kontaktpersonen ist i.d.R. erst möglich, wenn 3 negative Nasen- und Rachenabstriche (frühestens 24 h nach Absetzen der Antibiotika) im Abstand von mindestens 24 h vorliegen. Therapie Bei der Rachendiphtherie ist die frühzeitige Gabe von Antitoxin zur Neutralisierung von nicht-zellgebundenem Toxin unerlässlich. Antibiotikum der Wahl ist initial Penicillin G. Makrolide, Doxycyclin, Clindamycin, Rifampicin, Cephalosporine und Carbapeneme sind ebenfalls wirksam. Therapiedauer: 14 Tage. Bei engen Kontaktpersonen sollten Nasen- und Rachenabstriche entnommen und unabhängig vom Impfstatus eine Antibiotikaprophylaxe mit Penicillin G einmalig i.m. oder Erythromycin für 7-10 Tage durchgeführt werden. Symptomlose Keimträger sollten ebenfalls antibiotisch behandelt werden. Liegt die letzte Impfung mehr als 5 Jahre zurück, sollte eine Auffrischimpfung verabreicht werden. Labordiagnostik Parameter Kultureller DiphtherieErregernachweis DiphtherieAntikörper (Nur zur Kontrolle des Impfschutzes) Epidemiologie In der EU ist die Diphtherie sehr selten geworden. So wurden im Jahr 2011, laut ECDC, 20 Fälle gemeldet. Endemisch ist die Diphtherie jedoch weiterhin in Afrika sowie in folgenden Ländern anzutreffen: Russland, Ukraine, Lettland, Afghanistan, Indien, Indonesien, Philippinen und Haiti. Daher kann es bei nicht geimpften Reisenden und deren Kontaktpersonen zu Erkrankungen kommen. In Deutschland wurden 2012, laut Epidemiologischem Jahrbuch (RKI), 9 Diphtheriefälle gemeldet (siehe Abbildung). Material / Hinweise Abstrich in Transportmedium (Rachen-, Kehlkopf-, Nasen-, Wundabstrich). Bei kulturellem Nachweis von C. diphtheriae, C. ulcerans, C. pseudotuberculosis erfolgt der Toxin-Nachweis mittels Elek-Test und PCR 1 ml Serum Entnahme vor beabsichtigter Grundimmunisierung oder Auffrischimpfung, sowie 4-6 Wochen nach Impfung. < 0,1 IU/ml Kein Impfschutz anzunehmen, Auffrischimpfung oder Grundimmunisierung entsprechend der Impfanamnese empfohlen 0,1-1,0 IU/ml Impfschutz unsicher, Auffrischimpfung empfohlen > 1,0 IU/ml Impfschutz anzunehmen Literatur: Diphtherie RKI-Ratgeber für Ärzte 2013 Mikrobiologisch-Infektiologischer Qualitätsstandards. DGHM. Heft 13: Infektionen des Mundes und der oberen Atemwege Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 11 2014 Labor Schottdorf MVZ GmbH Laborinformation Nr. 15 Drogennachweis 1 Zum Drogennachweis bitten wir Sie folgende Punkte zu beachten: 1. Drogennachweis ist nur aus humanem Material möglich (s. unten) 2. Keine Drogen zur Untersuchung einsenden, da wir nach dem Betäubungsmittelgesetz keine Drogen entgegennehmen dürfen 3. Unbedingt die zu bestimmenden Drogen oder Drogengruppe auf dem Überweisungsschein angeben 4. Ggf. vor Einsendung Rücksprache mit dem Labor halten 5. Bei nicht aufgeführten Drogen sofortige Probenentnahme (wegen des engen Zeitfensters) und Rückruf im Labor bezüglich der Untersuchungsmöglichkeit Die Nachweisbarkeitsdauer ist von zahlreichen Faktoren abhängig, z. B. Absorptions-, Resorptionsverhältnisse, Nahrung, Antazida, Pharmakokinetik, Alter, Krankheiten, Gewöhnung, Flüssigkeitsaufnahme, Clearance, pH, Applikationsmenge, -form, -frequenz. Durch diese multifaktorielle Abhängigkeit kann die Nachweisbarkeitsdauer nur ein Richtwert sein. Mit Abweichungen beträchtlichen Ausmaßes nach oben bzw. unten muss stets gerechnet werden. Anforderung und Untersuchungsmaterial Parameter Drogen (wie unten) Alkohol im Blut CDT Material 50 ml Morgenurin Haar* 10 ml Heparin-Blut Serum *Haarprobe als bleistiftdicken Strang von 5 cm Länge am Hinterkopf dicht über der Haargrenze abschneiden, Haarspitze und Haaransatz markieren, bei kürzerem Haar mehrere Entnahmen. Dabei entsprechen 3 cm Haar einem Untersuchungszeitraum von ca. 3 Monaten. Je weiter entfernt von der Haarwurzel die Entnahme erfolgt, desto länger zurückliegende Zeiträume werden untersucht. Im Serum sind Nachweisempfindlichkeit und Nachweisbarkeitsdauer der Drogen schlechter, da die Substanzen in niedrigen Konzentrationen vorliegen. Vor Einsendung anderen Materials (z. B. Magensaft) bitte mit Labor Rücksprache halten. Substanz/-gruppe Nachweisbarkeitsdauer Wirkung Hinweise Alkohol (Äthanol) abhängig v. d. Anfangskonz. Abbau pro h bis 0,2 Promille reduz. Reaktion, verstärkte Diurese, Rausch u. a., psych./phys. Abhängigkeit Zur Überwachung der Alkoholabstinenz Bestimmung von CDT im Serum ETG/Ethylglucuronid (Ethanolmetabolit) Nachweisdauer abhängig von der aufgenommenen Alkoholmenge bis zu 72 h im Urin. ETG lagert sich im Haar ab und ermöglicht Aussagen über den Alkoholkonsum der letzten Monate CDT HWZ ca. 14 Tage Amphetamine Metamphetamine 48 h (stark vom pH-Wert des Urins abhängig) Schlaflosigkeit, Depression, Erschöpfung, Apathie, Verfolgungswahn, aufputschend/halluzinogen, starke psychische Abhängigkeit Barbiturate 24 h (kurz wirksame: z. B. Secobarbital) 2-3 Wochen (lang wirkende: z. B. Phenobarbital) klassische Benzodiazepine etwa 3 Tage nach therap. Dosis bis zu 4-6 Wochen nach Langzeitanwendung 24-28 h (Urin) reduziertes Urteilsvermögen, Konzentrationsmangel, Angst, Psychosen, Depression, psych./phys. Abhängigkeit reduziertes Urteilsvermögen, Konzentrationsmangel, Angst, Psychosen, Depression, psych./phys. Abhängigkeit CDT (wie GGT, MCV, Methanol) indirekter Marker des Alkoholkonsums ETG, CDT und Methanol können zur Abstinenzkontrolle eingesetzt werden. Im Gruppentest werden u. a. erfasst: Amphetamin, Metamphetamin, Designerdrogen, MDMA, MDE, MDA u. a. Phenylalkylamine. Streetname in der Szene: Adam, Arbeiterkoks, Crank, Crystal, Ecstasy, Eve, ICE, Schabo, Speed, XTC, u. a. Im Gruppentest werden u. a. erfasst: Secobarbital, Phenobarbital, Pentabarbital u. a. Barbituratderivate 24-36 h (einmaliges Rauchen) 5 Tage (mäßiger Raucher, 4x/Wo.) 10 Tage (starker Raucher, täglich) 20-70 Tage bei chron. Abusus reduz. Kurzzeitgedächtnis, Reaktion und Motivation, Halluzinationen, Hirnzellschäden, gestörte Immunabwehr, Gefahr der psych. Abhängigkeit Passive Inhalation führt zu keinem positiven Befund. THC-Mobilisierung aus Fettgewebe auch bei längerer Abstinenz bei Gewichtsabnahme, körperlicher Arbeit. Streetname in der Szene: Bommels, Bubble, Heck, Pickles, Piece, Sticks, Shit, Gras GHB (Gamma-HydroxiButtersäure) (Liquid-Ecstasy) aus Urin Neben Flunitrazepam, Chloraldurat, Valiquid Bestandteil von K.O.-Tropfen. ca. 3-4 h euphorisierend, berauschend, Verstärkung v. Sinneseindrücken, erhöhtes Kontaktbedürfnis, bei Überdosierung schlagartige Bewusstlosigkeit GBL aus Urin Prodrug der GHB Industriell in großen Mengen als Lösungsmittel in der chem. Industrie verwandt. (Keine illegale Substanz, Selbstkontrolle der Industrie bzgl. Abgabe) Nachweis über GHB Es wird der Hauptmetabolit Benzoylecgonin erfasst. Streetname in der Szene: Cocam, Koks, Schnee, Crack Benzodiazepine (z. B. Diazepam) Buprenorphin (SubutexR) Cannabinoide (z. B. Haschisch, Marihuana, THC) (Gamma-Butyrolacton) Kokain Metabolit: Benzoylecgonin 2-4 Tage Methadon Metabolit: EDDP ca. 3 Tage LSD Aus Urin dosisabhängig durchschnittlich 48 bis 72 h Opiate 2 Tage (stark abhängig von der Dosis u. a. Faktoren) Ein immunchemisch positiver Opiatbefund muss - außer bei Pholcodin - innerhalb von 3-4 Tagen negativ werden, ansonsten ist an eine erneute Opiataufnahme zu denken 2-4 Tage 2-4 Wochen bei chron. Abusus Phencyclidin Im Gruppentest werden auch erfasst: Flunitrazepam (z. B. RohypnolR), evtl. Bestandteil von K.O.-Tropfen, Bromazepam, Triazolam Opiatsubstitutionstherapie Umwandlung im Organismus in 60 Sekunden in GHB Schlaflosigkeit, Erschöpfung, Halluzinationen, Leberschäden, Depression, starke psychische Abhängigkeit stark schmerzdämpfend, euphorisierende Wirkung der Opiate fehlt verändertes Orts- und Zeitgefühl, Flashback-Psychose, halluzinogen, Verfolgungswahn, starke psychische Abhängigkeit Euphorie, verengte Pupillen, Angst, Depressionen, Appetitlosigkeit, psych./phys. Abhängigkeit halluzinogen, starke psychische Abhängigkeit Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Zur individuellen Dosisanpassung quantitative Bestimmung im Serum Nachweis von Lysergsäurediethylamid mittels EIA-Methode Bestätigung mit LCMS Gruppentest: Nachweis von Heroin, Monoacetylmorphin (MAM), Morphin, Codein, Dihydrocodein (DHC) und anderen Opiatderivaten. Bei positivem Befund kann nur über eine Bestätigungsanalyse zwischen den verschiedenen Opiaten unterschieden werden, z. B. zwischen Codein (aus Rcodeinhaltigen Hustensedativa), DHC (z. B. Remedacen ), Monoacetylmorphin (ein Metabolit des Heroins) und Morphin. In Deutschland wenig verbreitet. Streetname in der Szene: Angel Dust, PCP Stand 07 2014 Laborinformation Nr. 16 Drogennachweis 2 Bewertung und Interpretation Negativer Befund Folgende Möglichkeiten sind zu berücksichtigen: - es hat kein Drogenkonsum stattgefunden - der Konsum liegt weit zurück - die Konzentration ist zu niedrig (z. B. Spontanurin nach flüssigkeitsreicher Mahlzeit) - die konsumierte Droge wurde mit dem Verfahren nicht erfasst Manipulation des Untersuchungsmaterials Starke Flüssigkeitsaufnahme vor Arztbesuch Verdünnung der Originalprobe z. B. auf der Toilette in der Praxis Abgabe von Fremdurin Zusatz von Salzen, Zucker, Toilettenreiniger, Flüssigseife, Desinfektionsmittel, Säuren, Laugen, Vitaminen und anderem. Ausschluss der Manipulation Urinabgabe unter Sicht Überprüfung des Urinstatus: pH, Temperatur (frisch gewonnener Urin sollte ca. 35 – 38°C ergeben), Farbe, Kreatininwert, Dichte, Osmolalität. Positiver Befund Folgende Möglichkeiten sind zu bedenken: Unspezifische Gruppentests (immunologisch) durch: - unspezifische Kreuzreaktionen von in der Matrix vorhandenen körpereigenen Substanzen - vom Arzt verordnete Medikamente (z. B. bei Benzodiazepinen, Barbituraten, Amphetaminen und der Opiatgruppe) speziell bei der Opiatgruppe: - Drogenkonsum von Heroin - Einnahme von codein- und/oder dihydrocodeinhaltigen Präparaten oder anderen Opiaten - Verzehr größerer Mengen von morphinhaltigen Nahrungsmitteln (z. B. Mohnkuchen) Bestätigungsanalyse Immunologische Suchtests müssen lt. NUB-Richtlinien oder bei forensischer Fragestellung bei positiven Ergebnissen mit einem Test anderer Technologie und besserer Spezifität bestätigt werden. Opiatgruppentest (GT) und Bestätigungsanalyse bei Gebrauch verschiedener Opiate Heroin (Diamorphin) wird mit sehr kurzer Halbwertszeit – drei Minuten – überwiegend in 6-Mononacetylmorphin umgewandelt. In einem etwas langsameren Schritt erfolgt die Metabolisierung zu Morphin. Der Nachweis von Monoacetylmorphin ist beweisend für den Heroinkonsum. GT MAM DHC Codein Morphin + + - - + + - + - - + + - + + + + + + - - + +/- Abkürzung + MAM GT DHC Bewertung Spektrum wie bei Heroingebrauch; Monoacetylmorphin ist im Urin nur in niedriger Konzentration für kurze Zeit (2-8 h) nachweisbar, so dass diese Befundkonstellation sehr selten auftritt. Spektrum wie bei Dihydrocodein (Remedacen®)-Therapie; kein Hinweis auf Einnahme von Heroin u. a. morphinbildenden Substanzen Dihydrocodein und Morphin nachgewiesen; V. a. Einnahme von morphinhaltigen Substanzen V. a. zusätzliche Einnahme von codeinhaltigen Medikamenten und anderen morphinbildenden Substanzen (z. B. Heroin) neben Dihydrocodein ( z. B. Remedacen®) V. a. Einnahme von codeinhaltigen Medikamenten Bedeutung positiv negativ Monoacetylmorphin Opiatgruppentest Dihydrocodein Hinweis Bei einer Substitutionstherapie mit Methadon (Polamidon®) bzw. Buprenorphin (Subutex®) ist der Opiatgruppentest negativ, da Methadon und Buprenorphin analytisch keine Kreuzreaktivität zeigen. Bei positivem Opiatbefund ist in solch einem Fall von einem Beigebrauch von Opiaten (z. B. Heroin, Codein o. a.) auszugehen. Cannabisgebrauch: Nachweisbarkeit im Urin und Serum bei einmaligem und regelmäßigem Gebrauch Urin: Der inaktive Hauptmetabolit der Cannabinoide ist die THC-Carbonsäure (THC-COOH). Diese ist bei einmaligem oder gelegentlichem Konsum ca. 2-4 Tage nachweisbar. Da einige Metabolite im Fettgewebe gespeichert werden, verlängert sich die Nachweisbarkeit nach regelmäßigem Konsum auf 2-6 Wochen. In Einzelfällen wurden bei Dauerkonsumenten auch nach 3 Monaten Abstinenz noch positive Befunde erhoben. Unter Abstinenz sollte die Konzentration kontinuierlich abfallen. Zu beachten ist ferner, dass auch durch Passivrauchen eine messbare Aufnahme von Cannabis erfolgt. Serum: THC-COOH ist nach einmaligem Konsum 2-3 Tage, nach regelmäßigem Konsum ca. 3 Wochen nachweisbar (gelegentlich länger). Die pharmakologisch aktiven Metabolite Δ9-Tetrahydrocannabinol (THC) und 11-OH-Tetrahydrocannabinol (THC-Hydroxy, 11-OH-THC) sind jedoch nur in einem kurzen Zeitfenster von etwa 6 h nach Gebrauch im Serum nachweisbar (in geringer Konzentration maximal bis zu 24 h). Dem Nachweis von THC und THC-Hydroxy kommt daher im Zusammenhang mit Verkehrsdelikten eine besondere Bedeutung zu. Weiterführende Literatur ist auf Anfrage im Labor erhältlich. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 11 2015 Laborinformation Nr. 18 Labor Schottdorf MVZ GmbH Epstein-Barr-Virus (EBV) Infektiöse Mononukleose Erreger Das Epstein-Barr-Virus (EBV) gehört zur Familie der Herpesviren. Während einer Primärinfektion infiziert das Virus zunächst Epithelzellen des Rachenraumes und dann in einer zweiten Phase B-Lymphozyten des schleimhautassoziierten lymphatischen Gewebes. Nach Kontrolle der Primärinfektion durch das Immunsystem des Patienten wird das Virus nicht komplett eliminiert, sondern besitzt wie andere Herpesviren die Fähigkeit zur Persistenz. Daher besteht lebenslang die Möglichkeit der endogenen Reaktivierung einer EBVInfektion, die bei Immungesunden in der Regel asymptomatisch verläuft, bei stark immunsupprimierten Patienten jedoch schwere, u.U. lebensbedrohliche Krankheitsbilder verursachen kann. Epidemiologie Die Übertragung erfolgt üblicherweise durch Speichel; eine Übertragung durch Blut- und Blutprodukte oder über Organspenden ist möglich, spielt jedoch in der Praxis nur eine untergeordnete Rolle. Die EBV-Infektion ist deshalb hauptsächlich eine Erkrankung des Kindes- und Jugendalters („Kissing Disease“), im Alter von 30 Jahren haben ca. 90 % aller Personen die Infektion durchlaufen. EBV-assoziierte Erkrankungen Das typische klinische Bild einer EBV-Primärinfektion ist die infektiöse Mononukleose (IM) mit Fieber, Tonsillitis, Exanthem, Milz- und Lymphknotenschwellung, sowie variabler Beteilung anderer Organsysteme (Leber, Herz, ZNS). Die chronisch aktive EBV-Infektion (CAEBV) zeichnet sich durch rezidivierende IM-ähnliche Symptome wie Fieber, Lymphadenopathie, Erschöpfung, Hepatosplenomegalie, Arthralgien und Myalgien aus. Der Verlauf ist variabel von moderat bis lebensbedrohlich. Eine schwere Komplikation nach Transplantationen ist die EBV-getriggerte posttransplantative lymphoproliferative Erkrankung (PTLD). Ein seltener X-chromosomal-rezessiver Immundefekt, die X-gebundene lymphoproliferative Erkrankung (XLD) manifestiert sich bei betroffenen männlichen Individuen als Folge einer EBV-Primärinfektion im Kindes- oder frühen Erwachsenenalter. EBV ist die Ursache für das endemische Burkitt-Lymphom (Afrika) und das Nasopharynxkarzinom (Asien), weiterhin besteht eine Assoziation zum M. Hodgkin. Labordiagnostik Die Basisdiagnostik umfasst das große Blutbild sowie die Bestimmung von CRP, GPT, GOT und GGT. Die spezifische Diagnostik erfolgt über den Nachweis von Antikörpern gegen das Viruscapsid-Antigen (Anti-VCA-IgG und -IgM), das Nukleus-1-Antigen (Anti-EBNA1-IgG) und das Early-Antigen (AntiEA-IgG; siehe Tabelle) mittels Enzym- oder Chemilumineszenzimmunoassay. Der EBV-Immunblot mit paralleler Detektion von Antikörpern gegen verschiedene Virusproteine kommt in diagnostischen Problemfällen zum Einsatz. Für die chronisch aktive EBV-Infektion sowie für Reaktivierungen im Zusammenhang mit Immunsuppression ist die Bestimmung der EBV-Viruslast mittels PCR richtungsweisend. Differentialdiagnostisch sollten ggf. eine Streptokokkenangina, eine Infektion mit anderen lymphotropen Erregern (insbesondere HIV und CMV) sowie ein Lymphom ausgeschlossen werden. Material Basislabor: Antikörpernachweise: EBV-PCR: Streptokokkennachweis: EDTA-Blut, Serum Serum EDTA-Blut Tonsillenabstrich Typische Veränderungen von Laborparametern bei einer EBV-Infektion Parameter Kommentar Großes Blutbild Meist geringe bis mäßige Erhöhung der Gesamtleukozytenzahl mit relativer Lymphozytose und Monozytose; typisch: Nachweis „lymphatischer Reizformen“ (Pfeiffer-Zellen) im Ausstrich. Meist keine oder nur geringfügige Erhöhung bis ca. 20 mg/l CRP Variable Leberbeteiligung: wenn vorhanden, dann Erhöhung auf das 2-5 fache des Referenzbereichs, GPT (ALT), GOT selten Werte oberhalb des 10 fachen Referenzbereichs. (AST), GGT Erhöhung nahezu obligat als Ausdruck der Aktivierung von Lymphozyten und einer Leberbeteiligung. LDH Vermehrung der γ-Globulinfraktion durch polyklonale Stimulation von B-Lymphozyten mit konsekutiver EiweißImmunglobulinsynthese (meist IgM). Elektrophorese Spezifische Diagnostik einer EBV-Infektion Parameter Kommentar In den meisten Fällen zum Zeitpunkt der klinischen Manifestation vorhanden; in einigen Fällen Anti-VCA-IgG Serokonversion im Verlauf. Persistiert lebenslang. Frühester serologischer Marker einer EBV-Infektion; persistiert ca. 3-6 Monate, gelegentlich länger. Anti-VCA-IgM Cave: nicht alle Patienten bilden Anti-VCA-IgM ! Auftreten nach ca. 6 Wo. bis 3 Mon.: zeigt Ausheilung der Primärinfektion und Übergang in latente Anti-EBNA1-IgG Phase an. Lebenslange Persistenz. Kann bei Patienten, die kein Anti-VCA-IgG bilden, einziger Marker einer durchlaufenen EBV-Infektion sein. 5% der Patienten bilden niemals Anti-EBNA ! Positiv bei akuten Infektionen, chronisch aktiven Infektionen oder als Zeichen einer Reaktivierung. Anti-EA-IgG Nachweis einer EBV-Virämie. Diagnostisch bedeutsam bei chronisch aktiver Infektion oder EBV-PCR bei Reaktivierungen im Zusammenhang mit Immunsuppression. Typische Parameterkonstellationen Anti-VCA-IgG Anti-VCA-IgM Anti-EBNA1 ─ ─ ─ ─ + ─ Anti-EA EBV-PCR Beurteilung Kein Anhalt für EBV-Infektion. Mögliche Akutinfektion, Verlaufskontrolle zum Ausschluss unspezifischer Reaktionen. + + ─ Akute Infektion. + ─ + Abgelaufene Infektion. + +/─ ─ + + Chronisch aktive Infektion. + +/─ + + + Reaktivierte Infektion. "+" = nachweisbar, "─" = nicht nachweisbar, keine Angabe: Bestimmung spielt für die Fragestellung keine Rolle, grau hinterlegt: Parameter ist für die Fragestellung richtungsweisend. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 06 2008 Laborinformation Nr. 19 Labor Schottdorf MVZ GmbH Helicobacter pylori Gastritis, Magen-, Duodenalulcus Erreger und Krankheitsbilder Helicobacter pylori ist ein gramnegatives Bakterium, das eine chronische Infektion der Magenschleimhaut verursacht. Assoziierte Krankheitsbilder: Gastritis Typ B, Magen- und Duodenalulcera, Riesenfaltengastritis, MALT-Lymphom, Magenkarzinom. Bei Infektion mit Helicobacter pylori-Stämmen, die den Pathogenitätsfaktor CagA (Cytotoxin assoziiertes Gen A) exprimieren, besteht ein deutlich erhöhtes Risiko für die genannten Erkrankungen. Es wird angenommen, dass CagA als bakterielles Onkoprotein direkt an der Tumorentstehung beteiligt ist. Eine Infektion mit CagA-positiven Helicobacter pylori-Stämmen wird im Helicobacter pylori IgG Westernblot erkannt. Epidemiologie Vorkommen bei 20-60 % der getesteten Personen je nach untersuchter Population. Helicobacter pylori verursacht jährlich weltweit ca. 500.000 Todesfälle durch Magenkarzinome. Klinik Oberbauchbeschwerden, Appetitverlust, Gewichtsabnahme, morgendlicher Nüchternschmerz, Sodbrennen, Übelkeit, Erbrechen unklarer Ursache. Häufig asymptomatischer Verlauf. Vor Therapiebeginn wird ein eindeutiger Helicobacter pylori-Nachweis gefordert. Therapie (Beispiele) Primäre Therapieschemata: 2 x 40mg Pantoprazol + 2 x 1.000mg Amoxicillin + 2 x 500mg Clarithromycin (7 Tage) oder 2 x 20mg Omeprazol + 2 x 500mg Metronidazol + 2 x 250mg Clarithromycin (7 Tage) Therapieversagen: Bei Versagen der Primärtherapie wird generell die Helicobacter pyloriKultur mit Resistenztestung empfohlen. Labordiagnostik gesicherte Indikationen: ratsame Indikationen: Ulkuserkrankungen, atrophische Gastritis, erstgradige Verwandschaft mit Magenkarzinom-Patienten, MALTLymphom Helicobacter pylori-assoziierte funktionelle Dyspepsie, Helicobacter pylori-Infektion bei gleichzeitiger Therapie mit Acetylsalicylsäure bzw. NSAR Parameter Erläuterung Material Helicobacter pylori-Kultur Indikationen: Bei klinischer Indikation zur Endoskopie. Zur Resistenztestung (nach 2x Therapieversagen obligat, nach 1x Therapieversagen empfohlen). Z. n. Magenteilresektion. - PPI, Wismut und Antibiotika mindestens 2 Wochen vor Biopsieentahme absetzen - 2 Antrum- und 2 Korpusbiopsien empfohlen - Bioptate tief in Transportmedium versenken (2 Bioptate pro Röhrchen) - unverzüglich bei Raumtemperatur als eilig gekennzeichnet und lichtgeschützt an das Labor weiterleiten - bisherige Antibiotika-Therapie sowie Therapieresistenz unbedingt angeben! Bioptate in SpezialTransportmedium Portagerm pylori Sensitivität: 70 – 92% Spezifität: 90 – 100% Häufige Ursachen für falsch negative Ergebnisse: Biopsie unter PPI, Antibiotika oder Wismut, Probe älter als 24 Stunden, Kontamination des Bioptats mit Formalin, bakterizide Entschäumer vor Biopsie, Biopsie nur des Antrums, Test in akuter Blutungssituation Helicobacter pylori-AntigenNachweis im Stuhl Sensitivität: 90 – 100% Spezifität: 94 – 100% 13 C-Harnstoff-Atemtest Sensitivität: 93 – 96% Spezifität: 90 – 100% Helicobacter pyloriAntikörper Sensitivität: 94 – 97% Spezifität: 100% Indikationen: Zur Therapiekontrolle (frühestens 2 Wochen nach Absetzen von PPI oder Wismut, 4 Wochen nach Absetzen von Antibiotika). Patient < 45 Jahre ohne Malignomverdacht. Kontraindikation für Biopsie (z. B. Gerinnungsstörung). Stuhlprobe Nachweis von Helicobacter pylori-Antigen in Stuhlproben. Der Stuhlantigen-EIA ist 13 dem C-Harnstoff-Atemtest gleichwertig. Indikationen: wie bei Stuhlantigen-EIA 13 C-markierter Harnstoff wird oral verabreicht und vom Enzym Urease, das in hoher 13 13 Konzentration im Helicobacter vorliegt, in CO2 und Ammoniak gespalten. CO2 13 diffundiert ins Blut und wird in der Atemluft gemessen. Eine erhöhte CO2Konzentration in der Atemluft ist Folge der Helicobacter pylori-Ureaseaktivität. Indikationen: Primärdiagnostik bei nicht vorbehandelten Patienten. Erkennung asymptomatischer Helicobacter pylori-Träger. Nicht zur Therapiekontrolle geeignet. Atemluft in SpezialRöhrchen vor und nach 13 C-Harnstoff 3ml Serum Helicobacter pylori IgG EIA Helicobacter pylori IgG steigt bei Infektion in 95 – 97 % der Fälle mit der Infektion an und bleibt hoch. Vereinzelt wird langsames Absinken beobachtet. Nach erfolgreicher Therapie kommt es in bis 50 % zur Normalisierung nach 12 Monaten. Ein Wiederanstieg ist Hinweis auf Reinfektion. Helicobacter pylori IgA EIA Helicobacter pylori IgA-Konzentration korreliert mit der Gastritisaktivität. Nach erfolgreicher Therapie kommt es schon nach 6 Wochen zum Ak-Abfall. In 90 % Normalisierung nach 12 Monaten. Ein Wiederanstieg ist Hinweis auf Reinfektion. Helicobacter pylori IgG Westernblot Differenzierung von Helicobacter pylori-Stämmen mit hohem und weniger hohem Risiko für die Entwicklung von Gastritis, Ulcera und Magenkarzinom durch Nachweis von Ak gegen CagA. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 11 2008 Laborinformation Nr. 20 Labor Schottdorf MVZ GmbH Hepatitis B Labordiagnostik HBV-Labordiagnostik Suchtest HBsAg Anti-HBc Anti-HBs + + V. a. akute HBV-Infektion + - HBsAg, Anti-HBc, Anti-HBs (falls nur Anti-HBc positiv) abgelaufene Hepatitis bestätigt positives HBsAg: HBeAg, HBV-DNA nach 2-4 Wo Kontrolle von HBsAg, Anti-HBc, Anti-HBcIgM + + HBeAg, Anti-HBe; Anti-HBcIgM; bei schwerem Verlauf: Anti-HDV, HBV-DNA + - / ALT↑ Anti-HBcIgM, HBV-DNA (DD akute Infektion, Escape-Variante, Anti-HBc-Only) V. a. chronische HBV-Infektion (ab 6 Monaten Dauer) + bestätigt positives HBsAg: HBeAg, HBV-DNA, nach 2-4 Wo: Kontrolle Anti-HBc + - + + + - / ALT↑ - HBeAg, Anti-HBe, (Anti-HBcIgM nur bei DD akut), HBV-DNA, Anti-HDV bestätigt negatives Anti-HBs → HBV-DNA HBV-DNA in sehr geringer Menge nachweisbar → Anti-HBc-Only: keine Hepatitis, aber Übertragungsrisiko und u.U. Reaktivierung mit Hepatitis unter Immunsuppression DD: abgelaufene Hepatitis-Infektion (mit Verlust / fehlender Bildung von Anti-HBs), Low-Level-Carrier, Hepatitis C-Koinfektion, unspezifische Reaktion HBV-Verlaufskontrolle akute HBV-Infektion chronische HBV-Infektion HBsAg-Trägerstatus Transaminasen u. Quick nach Bedarf HBsAg/Anti-HBs alle 3-12 Monate bis zur Serokonversion HBsAg negativ / Anti-HBs < 10 IU/l Kontrolle nach 12 Monaten nach klinischer Aktivität, zunächst alle 3, später alle 12 Monate; bei Vorliegen einer Leberzirrhose alle 6 Monate; Leberentzündungs- u. Lebersyntheseparameter (GOT, GPT, GGT, Cholinesterase, Albumin), Blutbild, Quick HBeAg (sofern initial positiv), wenn negativ Anti-HBe HBsAg, wenn negativ Anti-HBs HBV-DNA bei HCC-Risiko: AFP Transaminasen (bei Anstieg siehe chron. HBV-Infektion), HBV-DNA im 1. Jahr mind. 3x, im 2. Jahr mind. 2x, danach alle 12 Monate HBeAg alle 12 Monate, wenn negativ: Anti-HBe, HBsAg wenn HBsAg negativ: Anti-HBs bei erhöhtem HCC-Risiko: AFP nach Risikoprofil alle 3-12 Monate Therapieindikation akut chronisch i.d.R. keine Indikation i.d.R. keine, Sonderfälle: schwere akute / fulminante Hepatitis B mit Quick < 50% 1. ohne Leberzirrhose - HBV-DNA > 2000 IU/ml + wiederholte ALT↑ o. Histo > A1/F1(> Minimalveränderungen) - Extrahepatische Manifestationen - HCC-Risiko 2. mit Leberzirrhose + HBV-DNA positiv HBsAg-Träger: wiederholt HBV-DNA negativ / <2000 IU/ml, wiederholt normale Transaminasen, höchstens minimale entzündliche Aktivität / geringe Fibrose (Leberbiopsie) Therapiebegleitende Laboruntersuchungen Vor Therapie Labordiagnostische Ziele Während der Therapie * Untersuchung z. Z. keine Kassenleistung HBV-DNA, HBV-Genotypisierung (nur bei therapeut. Relevanz)*, klin.-chem. Labortests (z.B. Blutbild, GPT, GOT, GGT, Bilirubin, Quick, Albumin, Glukose, Kreatinin, TSH) Ausschluss von Koinfektionen (Anti-HCV, Anti-HDV ggf. PCR*, HIV-Test, Lues), Hepatitis AImmunität (Anti-HAV), DD Autoimmunhepatitis / PBC (ANA, LKM, GMA, SLA, AMA); HCCRisiko (AFP) dauerhaft HBV-DNA <2000 IU/ml (ideal: negativ); im Idealfall HBsAg-Verlust, normale ALT HBeAg alle 3 Monate, bei Verlust Anti-HBe (sofern HBeAg initial positiv) HBV-DNA nach 4 u. 12 Wochen, dann alle 3-6 Monate HBsAg/Anti-HBs bei Verlust des HBeAg u./o. anhaltendem DNA-Abfall (<200 IU/ml). Quantitatives HBsAg kann unter Therapie hilfreich sein. klin.-chem. Labortests alle 3 Monate bzw. unter Interferon Woche 1, 2, 4, 8, 12, 16, danach jeden 2. Monat (z.B. Blutbild, GPT, GOT, GGT, Albumin, Bilirubin, Kreatinin, Quick, ggf. TSH) HBV-Resistenztestung* bei Virämieanstieg unter Nukleos(t) id-Analoga bzw. fehlendem initialem Ansprechen trotz gesicherter Therapieadhärenz, unklare Vortherapien primäres virologisches Nichtansprechen: Abfall der Viruslast < 1 log10 nach 3 Monaten sekundäre Resistenz: nach primärem Ansprechen Anstieg der Viruslast um mindestens 1log10 über den niedrigsten Wert unter fortgesetzter antiviraler Therapie Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 04 2013 Laborinformation Nr. 21 Labor Schottdorf MVZ GmbH Hepatitis C Labordiagnostik HCV-Diagnostik Parameter Anti-HCV Anti-HCV-Immunoblot HCV-RNA-PCR (2x3ml EDTA-Blut) Erläuterung Virologisch-serologische HCV-Diagnostik Suchtest mit Immunoassay nach Hepatitis C-AK; diagnostisches Fenster: circa 6 Wo Bestätigungstest zur Erkennung unspezifischer Reaktivitäten im Immunoassay HCV-RNA bereits 1-2 Wo nach der Infektion detektierbar; intermitt. Virämie mögl. -> Wdh. bei initial nicht nachweisbarer HCV-RNA in 6-12 Mo qualitativ: Differenzierung bei positiven Anti-HCV / Akutinfektion? quantitativ: Therapieplanung und Verlaufskontrolle Weitere Labordiagnostik bei Erstdiagnose (Diagnostik vor Therapie s.u.) Klinisch-chemische Basistests V.a. fortgeschr. Lebererkrankung V.a. Leberzirrhose, HCC-Risiko↑, verd. Leberherd Koinfektionen / Immunität Transaminasen, GGT, AP, K, Na, Kreatinin, Gesamteiweiß, Eiweiß-Elektrophorese, Bilirubin, TSH, Gerinnungsstatus, Blutbild zusätzlich Albumin, CHE, Quick/INR AFP HBs-Ag, HIV-Test , Anti-HAV Verlaufskontrolle einer nicht-therapierten chronischen HCV-Infektion Keine Leberzirrhose (V.a.) Leberzirrhose alle 6 bis 12 Mo alle 3 bis 6 Mo Blutbild, Transaminasen, Lebersynthesefunktion (z.B. CHE, Albumin, Quick/INR), Bilirubin Blutbild, Transaminasen, Lebersynthesefunktion, Bilirubin AFP zunächst alle 3 Mo, dann alle 6 Mo Untersuchungen bei HCV-Therapie Erläuterungen Parameter / Intervall Basislabor / Kontraindikationen Koinfektionen bzw. Immunität großes Blutbild, GPT, GOT, GGT, Bilirubin, Quick, Albumin, Glukose, Kreatinin, TSH HBs-Ag, HIV-Test, Anti-HAV DD Autoimmunhepatitis/ PBC ANA, LKM, GMA, SLA, AMA Hepatozelluläres Karzinom AFP Therapieplanung HCV-Genotyp, HCV-Viruslast Prädiktor für IFN-Therapieansprechen IL28B- Polymorphismen Bei HCV-Genotyp 1 u. 4 besseres IFN-Therapieansprechen bei IL28BGenotypen CC bzw. TT; keine Assoziation bei HCV-Genotyp 2 u. 3 Polymorphismen der NS3/4-Protease * + GT1a : v.a. R155K (alle Proteaseinhibitoren) GT1b : A156, V36, T54, V36+A155 (Boceprevir/Telaprevir), D168A / R155K (makrozyklische Inhibitoren) Vor Therapie Resistenz gegen NS3/4-Protease-Inhibitoren (aktuell keine klinische Relevanz) Während Therapie großes Blutbild Allgemeinlabor GPT, GOT, GGT, Glukose, Krea HCV-Viruslast (HCV-RNA-PCR quantitativ) TSH IFN + RBV Genotyp 1 (4-6) Woche 4 Woche 12 Woche 24 + Boceprevir + Telaprevir IFN + RBV Genotyp 2/3 Woche 12 Woche 24 Woche 4 + 12 Woche 24 Woche 4 Woche 12 Woche 24 Therapiemonitoring (SVR) * Untersuchung z. Z. keine Kassenleistung + Woche 2, 4, 8, 12, danach alle 4-6 Wochen Woche 4, 8, 12, danach alle 4-6 Wochen alle 12 Wochen u. jederzeit bei klinischem V.a. Schilddrüsendysfunktion kein HCV-RNA-Nachweis (Rapid-Responder) und initial < 600 000 - 800 000 IU/ml → ggf. Verkürzung der Therapiedauer auf 24 Wo kein HCV-RNA-Nachweis → 48 Wo Viruslast-Abfall < 2log10-Stufen bzw. HCV-RNA > 30 000 IU/ml → Abbruch HCV-RNA nachweisbar → Abbruch Negativierung der in Wo 12 noch nachweisbaren HCV-RNA → 72 Wo HCV-RNA ≥ 100 IE/ml → Abbruch HCV-RNA-Nachweis positiv → Abbruch HCV-RNA ≥ 1000 IE/ml → Abbruch HCV-RNA-Nachweis positiv → Abbruch kein HCV-RNA-Nachweis (Rapid-Responder) u. Initial < 800 000 IU/ml → ggf. 16 Wo; kein HCV-RNA-Nachweis, initial ≥ 800 000 IU/ml → 24 Wo Viruslast-Abfall < 2log10-Stufen → Abbruch HCV-RNA negativ → 48 Wo bei Therapieende, 12 u. 24 Wochen nach Therapie, danach jährlich aktuell noch kein Routineparameter Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 04 2013 Laborinformation Nr. 22 Labor Schottdorf MVZ GmbH HIV-Infektion Labordiagnostik 1) Diagnosestellung (serologische Teste) HIV-Suchtest: erfasst Antikörper gegen HIV 1/2 und HIV 1-p24-Antigen Bestätigungsteste (bei positivem Suchtest): HIV 1-Westernblot, HIV 2-Westernblot, p24-Antigen-Nachweis Untersuchungsgang und Interpretation der Ergebnisse Bei negativem Suchtest ist die Untersuchung abgeschlossen, bei reaktivem Suchtest erfolgt als Bestätigungstest zunächst der HIV 1-Blot. Fällt dieser negativ aus, folgen HIV 2-Blot und HIV 1-p24-Ag-Nachweis. Ein positiver Befund sollte durch die Einsendung einer 2. Probe bestätigt werden. Es besteht nichtnamentliche Meldepflicht gemäß Infektionsschutzgesetz. Unspezifisch (d. h. nicht im Blot oder p24-Ag-Nachweis bestätigte) grenzwertige und reaktive Ergebnisse des Suchtestes sollten durch eine Zweiteinsendung im Zeitraum von 2 Wochen überprüft werden, um eine Akutinfektion sicher auszuschließen. Tab.: Interpretation der wichtigsten serologischen Befundkonstellationen Suchtest negativ grenzwertig/reaktiv HIV 1 u./o. HIV 2-Blot HIV 1-p24-Ag negativ negativ grenzwertig/reaktiv grenzwertig negativ reaktiv reaktiv positiv negativ positiv Interpretation HIV-negativ HIV-negativ, unspezifische Reaktion im Suchtest mit hoher Wahrscheinlichkeit HIV-negativ unspezifische Reaktionen im Suchtest und Blot Infektion mit HIV 1 oder (sehr selten) HIV 2 Akutinfektion mit HIV 1 wahrscheinlich Besondere Beachtung verdient die Befundkonstellation einer Akutinfektion. Zu diesem Zeitpunkt ist die Viruslast am höchsten, die Wahrscheinlichkeit der Übertragung auf weitere Personen am größten. Der Patient muss deshalb ohne Verzögerung auf diesen Umstand hingewiesen werden. Eine früh eingeleitete antiretrovirale Therapie (ART) kann möglicherweise die Langzeitprognose entscheidend verbessern. Leistungsfähigkeit und Grenzen der serologischen Testverfahren Ein negativer Suchtest schließt eine HIV-Infektion aus, sofern kein Verdacht auf eine Akutinfektion besteht. Durch die Einbeziehung des p24-Ag in die Teste der 4. Generation können Akutinfektionen in der Regel bereits nach 2-4 Wochen diagnostiziert werden. Dennoch kann in Ausnahmefällen das Zeitfenster bis zur Serokonversion 3 Monate betragen. Bei Neugeborenen gilt ein positives Ergebnis nicht als Nachweis einer HIV-Infektion, da mütterliche Leihantikörper bis zu 18 Monate im Serum des Kindes nachgewiesen werden können. In diesem Fall empfiehlt sich der Nachweis virusspezifischer Nukleinsäure mit einem Amplifikationsverfahren (HIV 1-RNA-PCR, s. u.). 2) Verlaufs- und Therapiekontrolle HIV 1-RNA-PCR Die HIV-Viruslast im Plasma ist das wichtigste Instrument zur Therapieüberwachung. Nach Therapiebeginn sollte die Viruslast innerhalb der ersten 4 Wochen auf ein Hundertstel und nach 3-4 Monaten unter die Nachweisgrenze absinken, bei sehr hoher Plasmavirämie spätestens nach 6 Monaten. Darüber hinaus eignet sich die HIV-PCR zur Diagnostik von Akutinfektionen und intrauterin oder peripartal erworbener Infektionen sowie zur Abklärung unklarer serologischer Befunde. Falsch negative Befunde der HIV 1-RNA-PCR können bei Infektionen mit HIV 1, Gruppe N, auftreten; eine Infektion mit HIV 2 wird mit Routineverfahren ebenfalls nicht erfasst. Testfrequenz: bei Diagnosestellung, anschließend alle 2-3 Monate, bei Therapieeinleitung und -umstellung evtl. kurzfristiger. Intermittierend nachweisbare geringe Anstiege der Viruslast (bis ca. 200 Kopien/ml, sog. „Blips“), kurzfristig (~ 2Wo.) kontrollieren (Cave Resistenzentwicklung!) Absolutzahl der CD4 (THelfer)-Lymphozyten Der langsame Abfall der Zahl der CD4 (THelfer)-Lymphozyten ist die wesentliche Ursache für das zunehmende zelluläre Immundefizit im Verlaufe einer HIV-Infektion. Je geringer die Zahl der CD4-Zellen, desto wahrscheinlicher ist das Auftreten AIDS-definierender opportunistischer Infektionen und Tumore. Bei CD4-Zellzahlen < 350/µl soll - unabhängig von anderen Faktoren - immer eine Therapie erfolgen. Der Therapieerfolg spiegelt sich abhängig von Alter und Begleiterkrankungen in einem variablen Anstieg der CD4+-Zellzahl wieder. Unter ART beobachtet man im Mittel einen Anstieg der CD4-Lymphozyten um ca. 150/µl im ersten Jahr bei vorher unbehandelten Patienten. Das immunologische Therapieversagen (=fehlender Anstieg oder Absinken der CD4-Lymphozyten) folgt in der Regel verzögert dem virologischen Therapieversagen. Ein signifikanter Abfall der CD4-Lymphozyten bei supprimierter HIV-Viruslast kann auf komplizierende Erkrankungen hindeuten (z.B. Leberzirrhose, Tuberkulose, maligne Lymphome). Testfrequenz: alle 2-3 Monate parallel zur Kontrolle der Viruslast und bei jeder wesentlichen Änderung des Gesundheitszustandes HIV-Resistenztestung Nachweis von Mutationen im HIV 1-Genom, die mit einer Resistenz gegen einzelne Virostatika oder Virostatikagruppen (nukleosidische und nichtnukleosidische Inhibitoren der Reversen Trankriptase, Protease-, Integrase- und Fusionsinhibitoren) assoziiert sind. Vor einer Therapie mit Maraviroc (Celsentri®) muss ein Tropismus-Test durchgeführt werden, da das Medikament ausschließlich bei CCR5-tropen HIV 1-Viren nicht jedoch bei CXCR4-tropen Viren wirksam ist. Die Resistenztestung sollte immer im Zusammenhang mit einer Viruslastbestimmung erfolgen. Bei einer HIV-Viruslast < 200 Kopien/ml ist die Untersuchung nicht, bei einer Viruslast < 1000 Kopien/ml ggf. aus technischen Gründen nur eingeschränkt durchführbar (Ausnahme: Tropismus-Test). Resistenztestung immer unter laufender ART durchführen, da nach Therapieabbruch oder in Therapiepausen der fehlende Selektionsdruck die Akkumulation von Wildtyp-Revertanten begünstigt. Eine bereits erfolgte Resistenzentwicklung wird dadurch verschleiert. Indikation: bei primärem oder sekundärem Therapieversagen und vor Umstellung der Therapie. Bei Therapie-naiven Patienten sollte die Suche nach Resistenzmutationen im Reverse-Transkriptase-Gen und im Protease-Gen vor Beginn der antiviralen Therapie erfolgen. Material: Suchtest: HIV 1-RNA-PCR, CD4-Lymphozyten: HIV-Resistenztestung: 1 ml Serum oder 3 ml EDTA-Blut 2x 3 ml EDTA-Blut (bitte separate Probenröhrchen abnehmen) 2x 3 ml EDTA-Blut (mit Angaben zur aktuellen ART und Therapieanamnese) Lit.: Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-Infektion, Version 2012 Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Labor Schottdorf MVZ GmbH Laborinformation Nr. 23 Hormondiagnostik Gynäko-endokrine- und Fertilitätsdiagnostik LH Laborparameter FS H Pr ola bT ktin SH Be taÖs HCG tra Pr diol og e Te ster sto on AM ster o ng H es DH . EA SH -S BG An dr o 17 sten -O H dio Co -Pr n rtis og es ol t. Klinik/Fragestellung Abnahmehinweis / weitere Diagnostik Hormonstatus 21.-23. Zyklustag Sterilität 3.-5. Zyklustag, Spermien Ak Follikel-Stimulation Follikelphase Hyperprolaktinämie Zyklus- / Blutungsstörungen prämenstruelles Syndrom Mitte Lutealphase C. luteum-Insuffizienz Mitte Lutealphase Hirsutismus, Akne, androg. Alopezie 3.-5. Zyklustag, Ferritin, Cortisol, 17-OHP PCO-Syndrom/Hyperthekosis 3.-5. Zyklustag, HOMA-Index,ACTH-, DXM-Test Alopezie 3.-5.Tag,BB,Ferritin,Kupfer,Zink,Biotin,Selen,Vit.D V. a. Enzymdefekte der NNR ACTH-Test,11DOC,Aldosteron-Renin-Quot. V. a. Klimakterium Östron bei Adipositas V. a. gestörte Frühgravidität Libidostörung Mastopathie, -dynie / Galaktorrhoe Lutealphase Pubertas praecox GnRH-Test Pubertas tarda GnRH-Agonisten-Test LH Verdachtsdiagnose FS H Pr ola k bT tin SH Ös tra dio Pr og l es te Te sto ron ste AM ro ng H es DH . EA S SH BG An dr o 17 sten dio -O H n Co -Pro rtis ge st. ol Typische Befundkonstellationen, Klinik und weitere Diagnostik weitere Diagnostik Klimakterium Follikelreifungsstörung Corpus-luteum-Insuffizienz N, Gonadendysgenesie genetische Untersuchung Turner-Syndrom Chromosomenanalyse Gonadotropinresistente Ovarien testikuläre Feminisierung Ovar-Ak N, Chromosomenanalyse N, PCO-Syndrom N, HOMA-Index N postpuberales AGS Hyperthekosis ACTH-Test N, N () Hyperandrogenämie, eher ovariell Hyperandrogenämie, eher adrenal Cyproteronacetat: Abfall v. Testosteron ges. () () M. Cushing DXM-Test: Abfall von DHEA-S DXM-Test, Cortisol i. Speichel 23:00 Uhr bis 40 ab 40 Hyperprolaktinämie, funktionell Hyperprolaktinämie, tumorverdächtig () Nach Ausschl. Pharmaka, Stress etc.: bTSH, HGH, MCP Test MCP-Test, bTSH, HGH / CCT, NMR Kraniopharyngeom N, N, N, N, CCT, NMR / HGH-Stimulationstest Anorexia nervosa N, N, GnRH-Stimulationstest Kallmann-Syndrom ,N Mayer-von Rokitansky-Küster-Syndr. Geruchssinnprüfung TRH-Test, GnRH-Test, ACTH-Test Panhypopituitarismus N N N Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. (bei prim. Amenorrhoe) US, i. v. Pyelogramm Stand 05 2014 Laborinformation Nr. 24 Labor Schottdorf MVZ GmbH Lipidstoffwechselstörungen Hyper- und Dyslipoproteinämien Einleitung Lipoproteine sind aus Lipiden (Cholesterin [Chol], Triglyceride [TG], Phospholipide) und Apolipoproteinen zusammengesetzte Partikel mit micellarer Struktur, die den Lipidaustausch zwischen verschiedenen Organen und Geweben gewährleisten. Man unterscheidet die Triglycerid-reichen Chylomikronen und VLDL (Very-low-density-Lipoproteine) von den vorwiegend Cholesterin transportierenden LDL (Low-density-Lipoproteine) und den überwiegend Cholesterinester und Proteine enthaltenden HDL (High-density-Lipoproteine; siehe Tabelle). Hyper- und Dyslipoproteinämien sind durch Konzentrations- u./o. Kompositionsveränderung eines oder mehrerer Lipoproteine im Plasma gekennzeichnet. Die Einteilung erfolgt auf genetischer und pathophysiologischer Grundlage in primäre oder sekundäre Formen; die Einteilung aufgrund des Phänotyps in der Lipidelektrophorese nach Fredrickson hat nur noch untergeordnete Bedeutung für die Klassifizierung primärer Hyperlipoproteinämien. Für die Praxis bewährt sich die Einteilung in Therapiegruppen nach Art und Intensität der lipidsenkenden Therapie auf der Basis der unter Berücksichtigung des kardiovaskulären Risikos anzustrebenden Zielwerte. Lipidanteil Hauptapolipoproteine Stoffwechsel/ Hauptfunktion >98%, überwiegend TG Chylomikronen Apo B48, Apo C, Apo E 88%, überwiegend TG (ca. 15% Chol) VLDL Apo B100, Apo C, Apo E LDL HDL 75%, überwiegend Chol Apo B100 50%, überwiegend Cholesterin-Ester und Phospholipide Apo A1, Apo E Atherogenität Synthese im Darm aus Nahrungstriglyceriden. Transport über D. thoracicus in die V. cava. Im Plasma Abbau der TG durch Wirkung der endothelständigen Lipoproteinlipase (Kofaktor: Apo CII). Umwandlung in Chylomikronen-Remnants, Abbau in der Leber. Funktion: Transport exogener TG. Synthese in der Leber. Im Plasma Abbau der Triglyceride durch Wirkung der Lipoproteinlipase. Umwandlung in Intermediate Density-Lipoproteine (IDL) und LDL. Funktion: Transport der endogen aus Kohlenhydraten synthetisierten Triglyceride in die Peripherie. Cholesterintransport in periphere Gewebe über Bindung von Apo B an LDL-Rezeptor. Alternativer Abbau über Scavenger-Rezeptor auf Makrophagen: Bildung von Schaumzellen als atherogener Mechanismus. Lipidaustausch zwischen peripheren Geweben und der Leber sowie mit anderen Lipoproteinen im Plasma. Remnants: ++ IDL: ++ +++ antiatherogen I. Basisdiagnostik II. Weiterführende Diagnostik Gesamt-Cholesterin (Chol), Triglyceride (TG), LDL-Cholesterin (LDL-C), HDL-Cholesterin (HDL-C) Material: Serum Blutentnahme nüchtern, d.h. >12h Nahrungskarenz, >48h Vermeidung kalorischer Exzesse. Die übermäßige Zufuhr von Vitamin C stört die Bestimmung und führt zu falsch niedrigen Werten. Auffällige Befunde sollten vor einer Therapieentscheidung bei einer erneuten Blutentnahme nach zwei bis vier Wochen bestätigt werden. Apolipoprotein A1, Apolipoprotein B und Quotient ApoB/ApoAI, Lipidelektrophorese, Lipoprotein (a) Auf der Basis dieser Werte ergibt sich folgende einfache Einteilung der Hyperlipoproteinämien für die Praxis: LDL-Hypercholesterinämie Hypertriglyceridämie Kombinierte Hyperlipoproteinämie HDL-Erniedrigung Chol ↑ ↑ TG ─ ↑ LDL-C ↑ HDL-C ─ ─ (↓) ↑ ↑ ↑ (↓) ─ ─ ─ ↓ III. Ausschluss sekundärer Hyperlipoproteinämien Phänotyp Hypercholesterinämie (LDL ↑) Hypertriglyceridämie (VLDL ↑ u./o. Chylomikronen ↑) Kombinierte Hyperlipoproteinämie (LDL ↑ u. VLDL ↑) Mögliche Ursachen Hypothyreose Akute intermittierende Porphyrie Diabetes mellitus Typ 2 Alkoholabusus (HDL oft ↑) Chronische Niereninsuffizienz Übermäßige Kalorienzufuhr Medikamente: ß-Blocker Nephrotisches Syndrom Cushing Syndrom Hypothyreose Medikamente: Thiazide, Glukokortikoide IV. Diagnostik primärer Hyper- und Dyslipoproteinämien (Auswahl) Bezeichnung Polygene Hypercholesterinämie Familiäre Hypercholesterinämie (FH) Familiäres defektes Apo B100 (FDB) Familiäre Dysbetalipoproteinämie (Hyperlipidämie Typ III) Familiäre Hypertriglyzeridämie Lipoproteinlipase-Defizienz Apolipoprotein C-II-Defizienz Familiäre kombinierte Hyperlipoproteinämie Hepatischer Lipase Mangel Vermehrte Fraktion LDL; Chol ~ 250-400 mg/dl LDL; LDL-C heterozygot 220-650 mg/dl homozygot 500-1000 mg/dl LDL; Cholesterinerhöhung geringer als bei FH, korreliert mit Art der Mutation Chylomikronen und VLDLRemnants; „broad-ß“-Fraktion in der Lipidelektrophorese Chylomikronen und VLDL; TG ~ 200-500 mg/dl Chylomikronen, (VLDL); TG >> 1000 mg/dl VLDL und LDL; LDL-C mäßig erhöht bis 220 mg/dl, TG ~ 180-300 mg/dl VLDL-Remnants; TG deutlich; Chol mäßig erhöht KHKRisiko ↑↑ PankreatitisRisiko Häufigkeit Gendefekt* normal sehr häufig polygen ↑↑↑ ↑ heterozygot 1:500 homozygot: 1:106 LDL-Rezeptor ↑↑ ↑ heterozygot 1:750 ApoB100 ↑↑ ↑ 1:5000 ApoE (E2-Homozygotie) normal ↑ 1:500 unbekannt normal ↑↑↑ 1:106 LPL ApoC2 ↑↑ normal 1:300 unbekannt ↑ ↑↑ < 1:106 HTGL Isolierte HDL-Erniedrigung HDL-C unter 40 mg/dl ist ein unabhängiger Risikofaktor für eine KHK. HDL-Verminderungen treten überwiegend sekundär im Rahmen eines Metabolischen Syndroms oder einer durch andere Ursachen bedingten Hyperlipoproteinämie auf. Extreme Verminderungen (HDL-C < 10 mg/dl) sind meist Ausdruck einer genetisch bedingten Hypo- oder An-Alphalipoproteinämie. Primäre HDL-Mangel-Syndrome können molekulargenetisch diagnostiziert werden. Bezeichnung Lecithin-Cholesterin-Acyltransferase-Defizienz (Fish-Eye-Disease) Apolipoprotein A1-Defizienz An-Alpha-Lipoproteinämie (Tangier-Krankheit) Zugrunde liegender Gendefekt LCAT Apo A1 ABCA1 *Für die grau hinterlegten Defekte ist eine molekulargenetische Diagnostik etabliert (Material: EDTA-Blut). Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 02 2010 Laborinformation Nr. 26 Labor Schottdorf MVZ GmbH Lebererkrankungen / Hepatitis Labordiagnostik-Übersicht Basisdiagnostik in Abhängigkeit von der Fragestellung Fragestellung Screening Leberzellnekrose Cholestase Synthesefunktion Enzephalopathie Akute Hepatitis Chronische Hepatitis Ikterus Med. / tox. Hepatopathie Lebertumoren Fettleber /-hepatitis Unklare AP-Erhöhung Parameter GPT [ALAT], GGT, Cholinesterase GLDH, GGT, GPT, GOT (DeRitis-Quotient: GOT/GPT <1 leichterer Leberschaden, eher entzündlich, >2 schwerer Leberschaden a.e. Nekrosetyp) GGT, AP, Bili direkt und gesamt, ferner: GPT, GOT, GLDH, Lipase (bei Pankreasbeteiligung) Cholinesterase, Albumin, Quick, ATIII; Schweregrad: Gerinnungsfaktor V-Aktivität Ammoniak GPT, GOT [ASAT] (GPT> GOT), GGT, ferner: AP, GLDH GOT, GPT, GGT, in schweren Fällen: CHE, Albumin, ATIII, Quick GPT, GOT, GGT, AP, Bili gesamt und direkt, ggf. bei Hämolyse: LDH, Haptoglobin, kleines Blutbild mit Retikulozyten, Coombstest GPT, GOT, GGT und GLDH, ferner: AP, Bili Alkohol: GGT, MCV, CDT* GOT, GLDH, GGT, AFP GGT, GPT, GOT Knochenspezifische AP, AP-Isoenzyme Weiterführende Diagnostik ausgewählter Erkrankungen Fragestellung Hepatitis A Suchtest Akute Hepatitis A Immunität Hepatitis B Suchtest Akute Hepatitis B Diagnose Verlaufskontrolle Chronische Hepatitis B Diagnose Therapie / Verlauf Infektiosität Mutterschaftsvorsorge vor Impfung bzw. abgelaufene Hepatitis B Immunität nach Impfung Hepatitis C Suchtest Akute Hepatitis C Chronische Hepatitis C Diagnose Infektiosität Therapie Hepatitis D Hepatitis E Weitere Infektionen mit variabler Leberbeteiligung Autoimmunhepatitis Primäre biliäre Zirrhose Primär sklerosierende Cholangitis Hämochromatose M. Wilson α1-Antitrypsinmangel M. Meulengracht Parameter Anti-HAV [IgG+IgM], wenn positiv: Anti-HAV-IgM Anti-HAV-IgM, (HAV-RNA im Stuhl*) Anti-HAV quantitativ HBs-Ag, Anti-HBc, (Anti-HBs) HBs-Ag, Anti-HBc, Anti-HBc-IgM, (HBe-Ag, HBV-DNA-PCR**) HBe-Ag, Anti-HBe, HBs-Ag, Anti-HBs HBs-Ag: Persistenz > 6 Monate HBV-DNA-PCR**, HBe-Ag, Anti-HBe, (HBs-Ag, Anti-HBs) HBs-Ag, (HBe-Ag, HBV-DNA-PCR**) HBs-Ag Anti-HBc, wenn positiv: HBs-Ag, Anti-HBs Anti-HBs Anti-HCV Anti-HCV-Serokonversion, im diagnostischen Fenster HCV-RNA-PCR qualitativ** HCV-RNA: Persistenz > 6 Monate HCV-RNA-PCR qualitativ HCV-RNA-PCR quantitativ**, HCV-Genotypisierung** Anti-HDV, HDV-RNA-PCR*: nur sinnvoll bei gleichzeitig bestehender Hepatitis B Anti-HEV-IgG, Anti-HEV-IgM, HEV-RNA (Plasma, Stuhl)* viral: EBV, CMV, VZV, HIV, Dengue, Gelbfieber, West-Nil-Virus, Coxsackie bakteriell: Lues, Rickettsiosen, Brucellose, Leptospirose, Typhus Protozoen u. Parasiten: Malaria, Amöbiasis, Echinokokkose, Leberegel IgG, ANA, Ak gegen Lebermikrosomen [LKM], glatte Leber-Ak-Blot : Muskelzellen [SMA], Leber-Pankreas-Antigen [SLA], IgM, Antimitochondriale Ak [AMA], AMA-M2, ggf. ergänImmunblot mit AAk-Nachweis gg. zend Ak gg. SP100, Centromer, gp210 AMA M2, 3E (BPO), Sp100, PML, x-ANCA, IgG4 gp210, LC-1, LKM-1, SLA/LP Serumtransferrinsättigung, Ferritin, HFE-C282Y(H63D, S65C)-Gen-Polymorphismus Coeruloplasmin, Kupfer im Urin, Mutationsanalyse des ATP7B-Gens α1-Antitrypsin, Mutationsanalyse des Protease-Inhibitor 1 (PI)-Gens Dinukleotid-Expansion im UGT1A1-Promotor [UDP-Glucuronyltransferase-Gen] * Untersuchung z. Z. keine Kassenleistung ** Untersuchung eingeschränkte Kassenleistung (Diagnosebezug bzw. Häufigkeit der Anforderung) Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 04 2013 Laborinformation Nr. 27 Labor Schottdorf MVZ GmbH Keuchhusten Pertussis- und Parapertussis-Diagnostik Keuchhusten ist eine durch das Bakterium Bordetella pertussis hervorgerufene Infektionskrankheit die mit charakteristischen, im Säuglingsalter lebensgefährlichen Hustenanfällen einhergeht. Der eng verwandte Erreger Bordetella parapertussis verursacht ein keuchhustenähnliches Krankheitsbild, das aufgrund der fehlenden Synthese des Pertussis-Toxins durch einen milderen und kürzeren Verlauf gekennzeichnet ist. Schematische Darstellung zum Nasopharyngealabstrich Epidemiologie Übertragung durch Tröpfcheninfektion mit sehr hoher Kontagiosität. Infektiosität besteht schon in der Inkubationsphase, ist im Stadium catarrhale am höchsten und besteht bis ca. 3 Wochen nach Beginn des Stadium konvulsivum. Auch geimpfte Personen können nach Keuchhustenkontakt vorübergehend Erreger ausscheiden ohne selbst zu erkranken. Die Immunität nach Impfung oder durchlaufener Infektion besteht nur über einen begrenzten Zeitraum, so dass auch im Erwachsenenalter regelmäßige Auffrischungsimpfungen indiziert sind. Es gibt keine Kreuzimmunität nach Infektionen zwischen B. pertussis und B. parapertussis. Klinik Nach einer Inkubationszeit von 1-2 Wochen verläuft eine PertussisInfektion typischerweise in 3 Stadien: I) Stadium catarrhale: Dauer 1-2 Wochen mit Symptomen eines grippalen Infektes II) Stadium konvulsivum: Dauer 4-6 Wochen Hustenanfälle, inspiratorischer Stridor, Apnoe-, Zyanoseepisoden, Erbrechen, subfebrile Temperatur Säuglinge: schwerer Verlauf, Apnoen Erwachsene: oft nur lang andauernder Husten ohne typische Hustenanfälle III) Stadium decrementi: Dauer 6-10 Wochen mit langsam rückläufiger Symptomatik Komplikationen Pneumonie und Otitis media durch Sekundärinfektionen, selten zerebrale Krampfanfälle. Labordiagnostik Indikation/Fragestellung Inkubation, St. catarrhale Stadium konvulsivum Stadium decrementi Impfschutz Laborparameter Erregernachweis (PCR) Erregernachweis (bis 4 Wochen nach Symptombeginn) Antikörpernachweis Antikörpernachweis Pertussis-Toxin IgG Antikörper Differentialdiagnosisch wichtige Erreger Mycoplasma pneumoniae, Chlamydophila pneumoniae, Haemophilus influenzae, Adeno-, RS-Viren, Influenza- und Parainfluenza-Viren Erregernachweis von B. pertussis und B. parapertussis mittels PCR in Nasopharyngealabstrichen Der Erregernachweis ist Erfolg versprechend im Stadium catarrhale und bis max. 4 Wochen nach Symptombeginn im Stadium convulsivum. Da die kulturelle Anzucht des Erregers nur selten gelingt (Transport auf Spezialnährboden notwendig), stellt der Nachweis Erreger-spezifischer Nukleinsäure mittels Polymerase-Kettenreaktion (PCR) die Methode der Wahl dar. Beide Spezies (B. pertussis und B. parapertussis) werden in einem Untersuchungsgang nachgewiesen und molekulargenetisch differenziert. Die PCR kann nicht zwischen lebenden und abgetöteten Bakterien unterscheiden und daher noch bis zu fünf Tage nach Therapiebeginn positiv sein. Probengewinnung Sterilen trockenen Tupfer flach durch den unteren Nasengang bis vor die Rachenhinterwand einführen, dort einige Sekunden belassen und dann im Behälter ins Labor schicken (siehe Abbildung). Achtung, keine Tupfer mit Gel verwenden! Serologische Diagnostik durch Nachweis von Antikörpern gegen B. pertussis und B. parapertussis im Serum Bei der Anforderung „Pertussis-Serologie“ führen wir folgende Antikörpernachweise durch: Pertussis-Toxin IgG Antikörper: Spezifisch für B. pertussis Bei Ausschluss einer kürzlichen Impfung weisen hohe Titer ≥ 100 IU/ml auf eine akute Infektion mit B. pertussis hin. Bordetella spp. IgG und IgA Antikörper Es werden Antikörper gegen ein Gemisch aus filamentösem Hämagglutinin und Pertussis-Toxin nachgewiesen. Das filamentöse Hämagglutinin kommt bei allen Bordetella-Spezies vor. Antikörper werden ab der 2.-3. Woche nach Erkrankungsbeginn oder nach Impfung gebildet. Wichtigste Zeichen einer Akutinfektion sind in erster Linie der Nachweis von IgA-Antikörpern gegen Bortedella spp. und/oder ein hochtitriger Nachweis von Antikörpern gegen PertussisToxin. Bei klinischem V.a. Keuchhusten empfehlen wir die Bestimmung aller drei Antikörper. Bei Einsatz dieser Testkombination führt der zusätzliche Nachweis von IgM-Antikörpern nicht mehr zu einer Steigerung der Sensitivität. Aufgrund der engen Verwandtschaft von B. pertussis und B. parapertussis gelingt die serologische Unter-scheidung beider Spezies nur über das Vorhandensein oder das Fehlen von Antikörpern gegen Pertussis-Toxin. Eine eindeutige Differenzierung ist damit zwar nicht in jedem Fall möglich, aber bei prinzipiell gleicher Therapie auch nicht immer zwingend erforderlich. Da filamentöses Hämagglutinin und Pertussis-Toxin Bestandteile aller in Deutschland zugelassenen Impfstoffe sind, kann eine Immunantwort nach Impfung nicht von der nach einer Infektion unterschieden werden. Eine diagnostische Pertussis-Serologie ist für 1-3 Jahre nach Impfung nicht oder nur eingeschränkt beurteilbar. Bei Fragestellung „Impfschutz“ genügt die Bestimmung der IgGAntikörper gegen das Pertussis-Toxin. Die Bestimmung ist sinnvoll bei Schwangeren, die in infektionsgefährdeten Bereichen tätig sind, und bei immunsupprimierten Patienten, bei denen der Impferfolg dokumentiert werden soll. Im letzteren Fall sind zwei Bestimmungen – vor und ca. 4-6 Wochen nach Impfung erforderlich – um einen Titeranstieg nachzuweisen. Bei Patienten mit fehlender Impf-dokumentation sollte vor dem Hintergrund eines begrenzten Impfschutzes in erster Linie eine Auffrischungsimpfung erfolgen, sofern keine Kontraindikationen bestehen. Therapie Antibiotika können nur bei frühzeitigem Einsatz im Stadium catarrhale die Erkrankung verkürzen, verhindern aber die Ansteckung von Kontaktpersonen und die Entwicklung von Komplikationen. Mittel der ersten Wahl sind Makrolide (z. B. Chlarithromycin, Roxithromycin), bei Makrolidunverträglichkeit Co-trimoxazol. Meldepflicht Nach § 6 des IfSG besteht für den behandelnden Arzt bereits bei Krankheitsverdacht eine Meldepflicht (namentliche Meldung). Das Labor meldet nach § 7 den direkten und indirekten Erregernachweis soweit dieser auf eine akute Infektion hinweist. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 08 2012 Laborinformation Nr. 28 Labor Schottdorf MVZ GmbH Mineralstoffe und Spurenelemente Mineralstoffe und Spurenelemente sind für den Organismus lebensnotwendige Bestandteile von Proteinen, Hormonen und Enzymen. Sie spielen eine Rolle bei der Erregungsleitung, dem Elektronen- und Sauerstofftransport, als Cofaktor bei enzymatischen Reaktionen, als anorganische Matrix von Knochen und Zähnen oder bilden selbst das aktive Zentrum von Enzymen. Mineralstoffe werden auch als Mengenelemente bezeichnet (mehr als 0,01 % der Körpermasse). Zu ihnen zählen Calcium, Magnesium, Natrium, Kalium, Chlorid und Phosphor. Als essentielle Spurenelemente (meist deutlich weniger als 0,01 % der Körpermasse) gelten Chrom, Cobalt, Eisen, Fluor, Jod, Kupfer, Mangan, Molybdän, Selen und Zink. Parameter Chrom (Cr) Mangelursachen Parenterale Ernährung, Malabsorption, Diät Calcium (Ca) Vit. D-Mangel, Malabsorptionssyndrome, Hypoparathyreodismus, Niereninsuffizienz, renal tubuläre Azidose, Medikamente: Diuretika, Antiepileptika, Laxantien, Glucocortikoide Verwendung von enthärtetem Wasser (Filter!) Endemischer Mangel, Hypothyreose, Struma, jodarme Ernährung fetale Entwicklungsstörungen Jod (J) Kupfer (Cu) Magnesium (Mg) Mangan (Mn) Molybdän (Mo) Selen (Se) Zink (Zn) Mangelfolgen Verminderte Glucosetoleranz, periphere Neuropathie Rachitis (Kinder), Osteoporose/ Osteomalazie (Erwachsene), Tetanie Einseitig kuhmilchernährte Kinder, parenterale Ernährung, Malabsorption, Menkes-Syndrom Hypochrome makrozytäre Anämie, Neutropenie, Knochen- und Bindegewebsveränderungen, neurologische Störungen Fasten, Malabsorption, gastro- Neuromuskuläre intestinale Verluste, AlkohoÜbererregbarkeit, lismus, Tubulusschaden, ne- Herzrhythmusstörungen phrotisches Syndrom, Diuretika, Laxantien, Leistungssport Mangel sehr selten, Dermatitis, parenterale Ernährung Knochendeformation, Haarpigmentstörungen, Gerinnungsstörungen Mangel sehr selten, Störungen des Purin- und AmiMalabsorption, parenterale nosäurestoffwechsels (?) Ernährung Mangeldiät, Malabsorption, Kardiomyopathie, parenterale Ernährung, Muskelschwäche, Alkoholismus erhöhtes Krebs- u. Arterioskleroserisiko (?) Vegane Ernährung, Dermatitiden, parenterale Ernährung, Wundheilungsstörungen, Akne, Malabsorptionssyndrome, Alopezie, Alkoholismus, nephrotisches Immundefekte Syndrom, Penicillamintherapie, Acrodermatitis enteropathica Vorkommen Material Bierhefe, Leber, Fleisch, (S*) Käse, Vollkorn, Nüsse Ubiquitär, besonders in Milch und Milchprodukten, Vollkornbrot, Nüssen, grünem Gemüse, Sonnenblumenkernen S, HB Jodiertes Speisesalz, S, U Seefische, Muscheln, Schweineleber Leber, Fische, Schalen, S, HB Nüsse, Kakao, grünes Gemüse Hülsenfrüchte, Vollkornbrot, Käse, Schokolade, Nüsse, Milch S, HB Ubiquitär, besonders in HB, (S*) Vollkornprodukten, Hülsenfrüchten, grünem Gemüse, Tee Milchprodukte, Innerei- (S*) en, Hülsenfrüchte, Spinat Fleisch, Fisch, Eier, S, HB Linsen, Knoblauch, Nüsse Fleisch, Innereien, S, HB Milchprodukte, Fisch, Schalentiere (Muscheln) Material: 2 ml Serum (S) bzw. für die Bestimmung von Mineralien im Vollblut: 2 ml Lithium-Heparinblut (HB), 10 ml Urin (U) für die Jodbestimmung Hinweise: (S*) = Bestimmung im Serum möglich, jedoch nur im Zusammenhang mit arbeitsmedizinischen bzw. toxikologischen Fragestellungen, Mangelzustände nicht erfassbar ! Abrechnungseinschränkungen bei Patienten der GKV (max. zwei Spurenelemente pro Überweisung) Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 29 Monoklonale Gammopathie Immunfixation und freie Leichtketten Eine Monoklonale Gammopathie ist durch eine erhöhte Konzentration eines (seltener zwei oder mehr) monoklonalen Paraproteins gekennzeichnet, das von einem autonom proliferierenden B-Lymphozyten- oder Plasmazellklon sezerniert wird. Es können sowohl vollständige Immunglobuline vom Typ IgG, IgA oder IgM (sehr selten IgD oder IgE) mit den entsprechenden Leichtketten κ (Kappa) oder λ (Lambda), als auch nur die freien Leichtketten (sogenanntes Leichtkettenmyelom) gebildet werden. Selten werden nur Schwerketten synthetisiert. Das monoklonale Paraprotein ist in der Elektrophorese normalerweise als sogenannter M-Gradient („M-Protein“) in der γ-Fraktion (seltener im ßoder α2-Bereich) sichtbar. Der sensitive Nachweis und die Differenzierung des zugrunde liegenden Immunglobulin-Typs gelingen mit Hilfe der Immunfixation. Der Nachweis eines monoklonalen Paraproteins ist jedoch nur ein Hinweis – kein Beweis – für ein Multiples Myelom oder eine andere behandlungsbedürftige Neoplasie der B-Lymphozyten oder Plasmazellen. Bei ausschließlich laborchemischem Nachweis ohne klinische Symptomatik liegt eine Monoklonale Gammopathie unklarer Signifikanz (MGUS) bzw. ein Smouldering Myeloma vor. Einteilung der Gammopathien Monoklonale Gammopathie Unklarer Signifikanz (MGUS) Eine MGUS hat per se noch keinen Krankheitswert. Die Prävalenz beträgt ca. 3,5 % bei Personen über 50 Jahren. Sie erfordert keine spezifische Therapie, gilt jedoch als Präkanzerose, die im Verlauf in eine maligne lymphoproliferative Erkrankung übergehen kann (ca. 1 bis 1,5 % pro Jahr). Die Kriterien für eine MGUS sind: 1. M-Protein < 30 g/l und 2. Klonale Plasmazellen < 10 % im Knochenmark (falls eine Knochenmarksbiopsie durchgeführt wurde) und 3. Fehlen von Symptomen (CRAB Kriterien, siehe unten). Die Verlaufskontrollen bei MGUS erfolgen entsprechend des Risikoprofils. Als Hochrisiko-MGUS wird folgende Konstellation bezeichnet: nicht IgG-Typ + abnormaler Quotient der freien Leichtketten + M-Protein > 15 g/l. Verlaufskontrollen Erstdiagnose: nach 3 und 6 Monaten Niedrigrisiko: nur bei klinischer Symptomatik Hochrisiko: alle 6 bis 24 Monate Multiples Myelom (symptomatisch) Dritthäufigste hämatologische Neoplasie. Monoklonales Paraprotein im Serum und ggf. im Urin vorhanden, klonale Plasmazellen > 10 % im Knochenmark sowie Nachweis von Endorganschäden (CRAB Kriterien, siehe unten). Smouldering Myeloma (asymptomatisch) Konstellation zwischen MGUS und Multiplem Myelom. Klonale Plasmazellen > 10 % im Knochenmark jedoch noch keine Endorganschäden nachweisbar. Solitäres Plasmozytom Isolierter Plasmazelltumor ohne systemische Beteiligung. Die Diagnose muss bioptisch gesichert werden. Therapie der Wahl ist die lokale Bestrahlung in kurativer Absicht, allerdings entwickeln bis zu 50 % der Patienten im weiteren Verlauf ein Multiples Myelom. M. Waldenström (Waldenström Makroglobulinämie) Zusätzlich zu einer IgM-Paraproteinämie findet sich ein lymphoplasmozytisches Lymphom (LPL) mit obligater Infiltration des Knochenmarks. Plasmazell-Leukämie Aggressive Myelomvariante mit einer schlechten Prognose. Die Diagnose wird bei einer Plasmazellzahl von ≥ 2 x 109/l oder bei mehr als 20 % Plasmazellen im peripheren Blut gestellt. Fakultative/ begleitende Monoklonale Gammopathie Bei B-CLL und anderen Non-Hodgkin-Lymphomen. CRAB Kriterien CRAB leitet sich von den englischen Begriffen „hypercalcemia“, „renal insufficiency“, „anemia“ und „bone lesions“ ab. C R Hypercalcämie Niereninsuffizienz A Anämie B Knochenbeteiligung > 2,75 mmol/l Kreatinin ≥ 2,0 mg/dl Hb < 10,0 g/dl oder um ≥ 2,0 g/dl unterhalb des unteren Normwertes Osteolyse oder Osteoporose mit Kompressionsfraktur Eine Therapie ist bei symptomatischem Multiplem Myelom indiziert. Die Erfüllung eines CRAB Kriteriums ist ausreichend. Weitere Behandlungsindikationen sind Schmerzen, eine B-Symptomatik oder ein Hyperviskositätssyndrom. Lit.: Leitlinien der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO) zum MGUS und Multiplen Myelom Labordiagnostik Diagnostik bei V.a. MGUS Großes Blutbild, Elektrolyte (Natrium, Kalium, Calcium), Nierenretentionsparameter (Kreatinin einschl. eGFR, Harnstoff), Gesamteiweiß und Albumin im Serum, Immunglobuline (IgG, IgA, IgM) im Serum, Serumelektrophorese, freie Leichtketten im Serum quantitativ mit Quotient, Immunfixation im Serum, Eiweiß im Urin Diagnostik bei V.a. Multiples Myelom zusätzlich zur Diagnostik bei MGUS: Quick, PTT, LDH, GPT, ß2-Mikroglobulin im Serum; Bildgebung (CT, MRT) und Knochenmarksdiagnostik (Zytologie, Zytogenetik, Histologie) Hinweis zur Eiweiß-Elektrophorese im Serum: Ein M-Gradient (spitzer Peak) findet sich erst ab einer Konzentration von etwa 1 g/l eines monoklonalen Paraproteins. Bei ausschließlicher Synthese von Leichtketten und bei Paraproteinen vom IgDoder IgE-Typ ist in der Elektrophorese in der Regel kein M-Gradient nachweisbar. Deshalb sollte bei weiterbestehendem V.a. eine monoklonale Gammopathie immer eine Immunfixation im Serum und Urin sowie die Bestimmung der freien Leichtketten im Serum durchgeführt werden. Immunfixation im Serum mit Bestimmung von IgG, IgA, IgM V.a. MGUS, Multiples Myelom, Plasmozytom, M. Waldenström, Amyloidose, ungeklärter Antikörpermangel, M-Gradient in der Serumelektrophorese, erhöhte B-Zellzahl, Rezidivdiagnostik nach Knochenmarktransplantation Immunfixation im Urin V.a. Leichtketten-Proteinurie (Bence-Jones Protein), Amyloidose, nachgewiesene monoklonale Gammopathie im Serum Freie Leichtketten im Serum/ Urin Freie Leichtketten erscheinen zuerst im Serum, werden frei glomerulär filtriert und schließlich im Tubulus rückresorbiert und degradiert. Erst bei Überschreitung der Resorptionskapazität der Tubuluszellen oder bei bestehendem Tubulusschaden werden sie im Urin ausgeschieden. Die Ablagerung freier Leichtketten in Organen und Geweben ist Ursache der AL-Amyloidose. Bei den meisten Multiplen Myelomen (nicht nur bei Leichtkettenmyelomen) ist der Quotient der freien Leichtketten (κ/λ) signifikant verschoben. Auch bei ca. 50 % der sogenannten nonsekretorischen Myelome findet sich eine sehr geringe, aber nachweisbare Menge an monoklonalen Leichtketten. ß2-Mikroglobulin (B2M) B2M ist ein wichtiger Tumormarker. Es wird in hoher Dichte auf Lymphozyten exprimiert. Daher korreliert die Serumkonzentration mit dem Lymphozytenumsatz. Aufgrund der renalen Elimination muss zur Beurteilung jedoch gleichzeitig die Nierenfunktion berücksichtigt werden. Auch Erkrankungen mit einem erhöhten Zellumsatz (z.B. Infektionen, Autoimmunerkrankungen) beeinflussen die Serumkonzentration. Proteinurie Nachweis einer beginnenden tubulären Schädigung mittels SDSPAGE-Elektrophorese oder durch die Bestimmung der niedermolekularen Markerproteine (z.B. α1-Mikroglobulin) im Urin. Bei einem Fortschreiten der Erkrankung kann sich auch eine glomeruläre Proteinurie entwickeln. Parameter Immunglobuline, Immunfixation, freie Leichtketten im Serum, ß2-Mikroglobulin Immunfixation, freie Leichtketten, SDS-PAGEElektrophorese im Urin Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Material 1 ml Serum 20 ml Urin Stand 01 2015 Laborinformation Nr. 30 Labor Schottdorf MVZ GmbH Chronische Nierenerkrankung und Proteinurie Die chronische Nierenerkrankung (CKD - chronic kidney disease) ist definiert durch das Vorliegen von abnormen Nierenstrukturen oder einer abnormalen Nierenfunktion. Diese Veränderungen müssen für mehr als 3 Monate bestehen und eine Auswirkung auf die Gesundheit haben. Die wichtigsten labordiagnostischen Hinweise sind eine pathologische Proteinurie/Albuminurie sowie eine verminderte eGFR. Über die beiden Parameter Albuminurie und eGFR erfolgt die Stadieneinteilung der CKD. Die neu hinzugekommene Unterteilung in die eGFR Stadien G3a (45 – 59 ml/min) und G3b (30 – 44 ml/min) begründet sich durch die deutlich schlechtere Prognose des Stadiums G3b hinsichtlich des „overall survivals“ und des Risikos für ein kardiovaskuläres Ereignis (siehe Tabelle). Prognose einer CKD in Abhängigkeit von eGFR und Albuminurie mit Anzahl der empfohlenen Kontrollen pro Jahr Stadium 30 – 300 > 300 Überweisung zum Nephrologen: Proteinurie oder Albuminurie bei zwei unabhängigen Bestimmungen Diabetiker: > 20 mg/l Nicht-Diabetiker: > 200 mg/l eGFR Mikroalbuminurie Makroalbuminurie Verschlechterung der Nierenfunktion > 5 ml/min per 1.73 m2 in einem Jahr Albuminurie [mg/g Kreatinin] < 30 G1 normal > 90 1x/Jahr Ü 2x/Jahr G2 leicht vermindert 60 - 89 1x/Jahr Ü 2x/Jahr G3a leicht – mäßig vermindert 45 - 59 1x/Jahr Ü 2x/Jahr Ü 3x/Jahr G3b mäßig – stark vermindert 30 - 44 Ü 2x/Jahr Ü 3x/Jahr Ü 3x/Jahr G4 stark vermindert 15 - 29 Ü 3x/Jahr Ü 3x/Jahr Ü 4x/Jahr Ü 4x/Jahr Ü 4x/Jahr Ü 4x/Jahr [KDIGO 2012] G5 Nierenversagen < 15 Ü = Überweisung zum Nephrologen eGFR < 45 ml/min per 1.73 m² oder eGFR < 60 ml/min per 1.73 m² und Begleitfaktoren (z. B. Mikroalbuminurie, Proteinurie, Hämaturie, morphologische Veränderungen, nierenspezifische Komorbidität) (laut Empfehlung der Deutschen Gesellschaft für Nephrologie) Erweiterte Untersuchung Screeningparameter Eiweiß im Urinstreifentest Positiv bei Eiweißausscheidungen ab 200 – 300 mg/l. Erfasst keine Mikroalbuminurie! Eiweiß quantitativ im Urin Nachweisgrenze 40 mg/l. Albumin quantitativ im Urin Erfassung noch reversibler Glomerulopathien, z. B. bei Diabetes mellitus, Hypertonie oder generalisierter Gefäßsklerose. eGFR Bestimmung (siehe Laborinformation 50) o Kreatinin im Serum o Cystatin C im Serum DISK-Elektrophorese Die Beurteilung erfolgt unter Berücksichtigung von Gesamteiweiß quantitativ im Urin. Vorteil: Erfasst die meisten Proteine. Differenzierung von prärenal, renal oder postrenal sowie Unterscheidung tubulär / glomerulär. Nachteil: Keine Quantifizierung der einzelnen Proteine möglich. Quantitative Einzelbestimmung von Alpha-1-Mikroglobulin, Albumin, Transferrin, IgG und ggf. Alpha-2-Makroglobulin. Ähnliche Beurteilbarkeit wie Disk-Elektrophorese. Vorteil: Quantitative Verlaufskontrollen. Die Höhe und das Muster der Eiweißausscheidung geben Hinweise auf die Lokalisation und den Schweregrad der Nierenschädigung bzw. erlauben die Abgrenzung zwischen renaler und extrarenaler Proteinurie. Markerproteine Proteinurieform Alpha-1-Mikroglobulin tubulär Albumin selektiv glomerulär Albumin, Transferrin, IgG unselektiv glomerulär Alpha-1-Mikroglobulin, Albumin, Transferrin, IgG (Mischproteinurie) Bence-Jones-Protein prärenal Myoglobin prärenal Hämoglobin prärenal Alpha-2-Makroglobulin postrenal Differentialdiagnosen Pyelonephritis Interstitielle Nephritis Medikamente (z. B. Analgetika) Toxisch (Blei, Cadmium, etc.) Fanconi-Syndrom Renal-tubuläre Azidose Frühstadium einer diabetischen oder hypertensiven Nephropathie Minimal-Change-Glomerulonephritis IgA-Nephritis Frühphase von Autoimmunerkrankungen (z. B. SLE) Orthostatische Stressproteinurie Systemische Vaskulitiden Chronische Pyelonephritis Spätstadien (z. B. diabetische Nephropathie) Renale Amyloidose Myelomniere Multiples Myelom Rhabdomyolyse V. a. prärenales Nierenversagen (Crush-Niere) Intravasale Hämolyse Postrenale Blutung oder Entzündung z. B. bei Steinleiden, Infekten oder malignen Prozessen Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 08 2014 Laborinformation Nr. 31 Labor Schottdorf MVZ GmbH Parvovirus B19 Ringelröteln (Erythema infectiosum) Erreger Das Parvovirus B19 ist der einzige humanpathogene Vertreter der Gattung Parvoviridae; Familie Erythroviridae. Das kleine („parvus“) hüllenlose Virus besteht aus einer einzelsträngigen DNA, die von einem Viruscapsid aus 2 Proteinen (VP1, VP2) umgeben ist. Parvovirus B19 infiziert in erster Linie erythroide Vorläuferzellen und benutzt dazu das Blutgruppenantigen P als Rezeptor. Das P-Antigen wird von Erythroblasten aber auch von Megakaryozyten, Endothelzellen, fetalen Myokardzellen und in der Plazenta exprimiert, wodurch sich die große Bandbreite klinischer Manifestationen erklärt. Epidemiologie Einziges Erregerreservoir ist der Mensch. Parvovirus B19 wird durch respiratorische Sekrete und Speichel als Tröpfchen- oder Kontaktinfektionen übertragen und daher hauptsächlich durch engen Körperkontakt oder kontaminierte Gegenstände innerhalb der Familie oder in Kindereinrichtungen weitergegeben. Die Übertragung über Blut- und Blutprodukte sowie über den Kontakt mit Ausscheidungen ist ebenfalls möglich, spielt jedoch epidemiologisch eine geringere Rolle. Für das Personal in Kindereinrichtungen ist das Risiko einer Infektion an der Arbeitsstätte etwa fünfmal höher als in der übrigen Bevölkerung. Für seronegative Schwangere, die in solchen Einrichtungen tätig sind, wird deshalb lt. Mutterschutzgesetz ein Beschäftigungsverbot bis zum Ende der 20. Schwangerschaftswoche ausgesprochen. Bei immunkompetenten Patienten beginnt die virämische Phase etwa 4-5 Tage nach Infektion und erreicht zwei bis drei Tage später ihren Höhepunkt mit sehr hohen Viruskonzentrationen von 1011-1013 Partikeln/ml Blut, um danach zügig wieder abzufallen. Beim Auftreten des Exanthems nach durchschnittlich 14 Tagen enthalten Blut und Speichel noch etwa 104-108 Viruskopien/ml. Kinder im Exanthemstadium sind praktisch nicht mehr ansteckungsfähig! Bei Kindern ist das Virus in der Regel nach 3-4 Wochen eliminiert; bei Erwachsenen kann die virämische Phase mit 103-107 Viruskopien/ml mehrere Monate, gelegentlich länger, andauern. Die Infektion hinterlässt eine lebenslange Immunität. Die Durchseuchungsraten nehmen proportional zum Alter zu und betragen im Erwachsenenalter ca. 60-70 %. Häufige Manifestationen Ringelröteln (Erythema infectiosum): Nach einem unspezifischem Prodromalstadium entwickelt sich ein makulopapulöses Exanthem mit charakteristischer Ring- oder Girlandenbildung. Es beginnt meist mit feurig-roten Eruptionen an den Wangen und geht dann auf die Streckseiten der Gliedmaßen, den Stamm und das Gesäß über. Keine Schleimhautbeteiligung ! Arthralgien/Arthritis: Überwiegend bei Erwachsenen treten sehr häufig Arthropathien verschiedener Schweregrade auf. Die Parvovirus B19-induzierte Arthritis mit symmetrischem Befall der Handgelenke, aber auch der Fuß-, Knie- und Ellenbogengelenke kann der rheumatoiden Arthritis ähneln. Spontanheilung meist nach 10-14 Tagen, chronische Verläufe sind möglich. Anämie/Thrombozytopenie: Akute, meist transiente Anämie/Thrombozytopenie auch bei asymptomatischem Verlauf. Bei Patienten mit chronischer hämolytischer Anämie besteht die Gefahr aplastischer Krisen. Chronische Verläufe werden hauptsächlich bei immunsupprimierten Patienten beobachtet. Ca. 30% der Infektionen verlaufen asymptomatisch. Therapie Unkomplizierte Infektionen erfordern keine Therapie, ggf. ist eine symptomatische antirheumatische Behandlung erforderlich. Die Anämie wird selten transfusionspflichtig, schwere und chronische Verläufe können mit hochdosierter intravenöser Immunglobulingabe behandelt werden. Parvovirus B19 und Schwangerschaft Bei einer akuten Infektion der Mutter in der Schwangerschaft wird das Virus in ca. 30 % der Fälle transplazentar übertragen. Das gilt auch für symptomlose Infektionen. Infizierbare fetale Erythroblasten bilden sich ab der 10.-12. Schwangerschaftswoche. Komplikationen beim ungeborenen Kind entwickeln sich verzögert, meist 2-8 Wochen nach der akuten Infektion der Schwangeren, gelegentlich später. Im ersten Trimenon kann die fetale Infektion zum Abort führen. Nach dem ersten Trimenon führen ca. 20% der Infektionen durch Zerstörung der Erythroblasten zum Hydrops fetalis, der unbehandelt in ⅔ der Fälle den intrauterinen Fruchttod zur Folge hat. Weitere Komplikationen sind eine über den Geburtstermin hinaus bestehende Anämie und eine fetale Myokarditis. Embryopathien (Fehlbildungen) werden nicht beobachtet. Überwachung infizierter Schwangerer Ca. 90 % aller Schwangerschaften verlaufen nach einer Parvovirus B19-Infektion ungestört, so dass eine invasive Pränataldiagnostik nicht routinemäßig indiziert ist. Bei gesicherter Infektion der Schwangeren (typische Klinik u./o. labordiagnostisch gesicherte Infektion) sollten wöchentliche UltraschallKontrollen (Dopplersonographie zur Erfassung der fetalen Anämie) erfolgen. Bleibt der Befund bis 12 Wochen nach der Infektion der Mutter regelrecht, so ist mit fetalen Komplikation nicht zu rechnen. Auffällige Ultraschallbefunde, die auf einen Hydrops fetalis hindeuten, sollten in einer spezialisierten Einrichtung weiter abgeklärt werden. Durch intrauterine Bluttransfusionen über die Nabelschnurvene können mehr als 80 % der infizierten Feten gerettet werden. Labordiagnostik in Abhängigkeit von der Indikation Parvovirus B19 IgG- und IgM-Antikörper im Serum: - V.a. akute Infektion oder Kontakt zu infizierten Personen während der Schwangerschaft - Differentialdiagnostik unklarer Exantheme, - Differentialdiagnostik von Arthritiden IgM-Antikörper treten meist zeitgleich mit dem Exanthem auf und persistieren ca. 3 Monate, gelegentlich auch nur 3-4 Wochen. Ihr Nachweis gilt als Bestätigung einer Akutinfektion. IgGAntikörper werden 3-7 Tage später positiv und persistieren viele Jahre. Als Suchtest wird ein Enzymimmunoassay durchgeführt, bei Infektionen während der Schwangerschaft empfiehlt sich zusätzlich die Durchführung der IgG-und IgM-Immunblots als Bestätigungsteste. Der Nachweis von IgG-Antikörpern gegen das NS1Protein im Immunblot deutet darauf hin, dass die Infektion mindestens 6 Wochen zurückliegt, da diese Antikörper erst sehr spät gebildet werden. Parvovirus B19 IgG-Antikörper im Serum: - Immunitätsaussage im Rahmen arbeitsmedizinischer Untersuchungen von Schwangeren, die in Einrichtungen mit erhöhtem Infektionsrisiko tätig sind Parvovirus B19-PCR im EDTA-Blut, Fruchtwasser oder Biopsiematerial (eingeschränkte Kassenleistung): - V.a. chronische Infektion - V.a. Infektion immunsupprimierter Patienten - Zusatzdiagnostik bei Infektionen während der Schwangerschaft und V.a. auf fetale Infektion Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 08 2009 Laborinformation Nr. 32 Labor Schottdorf MVZ GmbH Antibiotika-Übersicht (Unter-)Gruppe Phenoxypenicilline Benzylpenicilline Aminopenicilline Wirkstoff Penicillin V (oral) Penicillin G (i.v.) Amoxicillin (oral) Ampicillin (oral, i.v.) Mezlocillin (i.v.) Piperacillin (i.v.) Flucloxacillin (oral, i.v.) Isoxazolylpenicilline ß-LaktamaseHemmerKombinationen Cephalosporine Carbapeneme Monobactame Chinolone (Gyrasehemmer) Aminoglykoside Betalaktam-Antibiotika Ureidopenicilline Amoxicillin/Clavulansäure (oral) Ampicillin/Sulbactam (i.v., i.m.) Piperacillin/Tazobactam (i.v.) G1: Cefaclor (oral) Cefazolin (i.v.) G2: Cefuroxim (oral. i.v.) Cefotiam (i.v.) G3: Cefpodoxim (oral) Cefixim (oral) G3a: Cefotaxim (i.v.) Ceftriaxon (i.v., i.m.) G3b: Ceftazidim (i.v.) Imipenem (i.v.) Meropenem (i.v.) Ertapenem (i.v.) Aztreonam (lokal: Inhalation) Ciprofloxacin (oral, i.v., lokal: Augen, Ohren) Levofloxacin (oral, i.v., lokal: Haut, Augen) Moxifloxacin (oral, i.v., lokal: Augen) Gentamicin (i.v.,i.m., lokal: Haut, Augen, Implantation) Tetracycline Makrolide Lincomycine Tobramycin (i.v., lokal: Augen, Inhalation) Amikacin (i.v., i.m.) Paromomycin (oral, keine system. Wirkung) Kanamycin (lokal: Augen) Doxycyclin (oral, i.v., lokal: periodontal) Minocyclin (oral) Erythromycin (oral, i.v., lokal: Haut, Augen) Clarithromycin (oral, i.v.) Roxithromycin (oral) Azithromycin (oral, i.v., lokal: Augen) Clindamycin (oral, i.v., i.m., lokal: Haut, Vagi- Therapie häufiger Infektionen von ambulanten Patienten: akute Streptokokken-Tonsillopharyngitis 1. Wahl: Penicillin V für 10 Tage alternativ: Cephalosporin G1 (G2) oder Makrolid oder Clindamycin akute Sinusitis Meist viral bedingt. Antibiose nur indiziert bei starken Beschwerden, Fieber >38,3°C, Verstärkung der Beschwerden im Verlauf, chron.-entzündl. Lungenerkrankungen, drohenden Komplikationen, Immunschwäche, schweren Grundleiden und besonderen Risikofaktoren. 1. Wahl: Amoxicillin alternativ: Aminopenicillin + ß-Laktamase-Hemmer, Cephalosporin G2, Makrolid, Cotrimoxazol, Clindamycin, Doxycyclin akute Bronchitis wenn keine COPD, kein Asthma bronchiale, Verlauf <7 Tage vorliegt i. d. R. viral bedingt keine Antibiotika-Therapie empfohlen leichtgradige akute Exazerbation einer COPD 1. Wahl: Amoxicillin für 7 Tage alternativ: Makrolid oder Doxycyclin ambulante Pneumonie ohne Risikofaktoren* 1. Wahl: Amoxicillin für 5-7 Tage alternativ: Makrolid oder Doxycyclin ambulante Pneumonie mit Risikofaktoren* 1. Wahl: Amoxicillin + Clavulansäure für 5-7 Tage (zusätzlich Makrolid, falls Legionellen, Chlamydien und Mykoplasmen erfasst werden sollen) alternativ: Levofloxacin oder Moxifloxacin *Risikofaktoren: schwere Begleiterkrankungen, Antibiotikatherapie in den letzten 3 Monaten, instabiler klinischer Zustand unkomplizierte Zystitis der ansonsten gesunden Frau Fosfomycin Einmalgabe Nitrofurantoin für 7 Tage Nitrofurantoin retard für 5 Tage Bei Kenntnis der lokalen Resistenzlage (<20%): Cotrimoxazol für 3 Tage Trimethoprim für 5 Tage na) Ansamycine Sulfonamide Nitroimidazole Rifampicin (oral, i.v.) Rifaximin (oral, keine systemische Wirkung) Trimethoprim-Sulfamethoxazol (oral, i.v.) Metronidazol (oral, i.v., lokal: Haut, Vagina, periodontal) Nitrofurane Fosfomycin Fusidinsäure Polypeptide Lipopeptide Glycopeptide Nitrofurantoin (oral) Fosfomycin (oral, i.v.) Fusidinsäure (lokal: Haut, Augen) Polymyxin B (lokal: Augen, Ohren) Daptomycin (i.v.) Vancomycin (oral, i.v.) (oral keine systemi- Quellen: 1 S2-Leitlinie „Antibiotikatherapie der Infektionen an Kopf und Hals“ 2008 2 S2k-Leitlinie „Rhinosinusitis“ 2011 3 S3-Leitlinie „Epidemiologie, Diagnostik, antimikrobielle Therapie und Management von erwachsenen Patienten mit ambulant erworbenen tiefen Atemwegsinfektionen sowie ambulant erworbener Pneumonie“ 2009 4 S3-Leitlinie „Harnwegsinfektionen“ 2010 sche Wirkung!) Streptogramine Oxazolidinone Glycylcycline Quinupristin/Dalfopristin (i.v.) Linezolid (oral, i.v.) Tigecyclin (i.v.) Die in diesem Infoblatt aufgeführten Therapie-Empfehlungen können das Studium der jeweils aktuellsten Leitlinien sowie der Fachinformationen der Arzneimittelhersteller nicht ersetzen! Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 04 2013 Laborinformation Nr. 33 Labor Schottdorf MVZ GmbH Schilddrüsen-Diagnostik Bewertung Die freien peripheren Schilddrüsenhormone fT4 (Thyroxin) und fT3 (Trijodthyronin) spielen eine wesentliche Rolle bei der Regulation des Energieumsatzes des Organismus. Ein Regelkreis Hypothalamus → Hypophyse → Schilddrüse → Hypothalamus hält die Schilddrüsenhormonspiegel innerhalb eines bestimmten Konzentrationsbereiches konstant. Niedrige freie Hormonspiegel führen über die Freisetzung des Releasing Hormons TRH zur Synthese von TSH (Thyreoidea-stimulierendes Hormon) im Hypophysenvorderlappen, das das Wachstum der Schilddrüsenfollikel und die Hormonsynthese stimuliert. Umgekehrt unterdrücken hohe Hormonspiegel die Freisetzung von TSH. Über diesen Mechanismus können Funktionseinschränkungen der Schilddrüse über sehr lange Zeiträume kompensiert werden, so dass subklinische Hyper- oder Hypothyreosen (gekennzeichnet durch erniedrigte bzw. erhöhte TSH-Spiegel bei noch normalen Spiegeln von fT3 und fT4) sehr viel häufiger anzutreffen sind als klinisch manifeste Störungen als Folge überschießender oder fehlender Hormonproduktion. Krankheitsbilder mit hoher Prävalenz sind der Jodmangel, Formen der Autoimmunthyreoiditis sowie Knotenstrumen mit oder ohne autonome Hormonproduktion. In der Genese der Autoimmunthyreoiditiden spielen Autoantikörper gegen Strukturen der Schilddrüse die entscheidende Rolle: sie sind u.a. gerichtet gegen die Thyreoidea-Peroxidase (TPO-Ak), das Thyreoglobulin (TAK) und den TSH-Rezeptor (TRAK). Als Tumormarker zur Verlaufskontrolle nach Strumektomie bei follikulären Schilddrüsenkarzinomen eignen sich das humane Thyreoglobulin (hTG) und das CEA. Bei medullären C-Zell-Karzinomen bzw. beim Krankheitsbild der Multiplen endokrinen Neoplasie (MEN) sollte das Calcitonin bestimmt werden. Typische Befundkonstellationen bei Schilddrüsenerkrankungen und Therapiekontrolle Biochemischer Befund Zusätzliche Untersuchungen bTSH fT4 fT3 Euthyreose n n n Subklinische (latente) Hyperthyreose ↓ n n Primäre Hyperthyreose supprimiert ↑ – ↑↑ ↑ – ↑↑ Isolierte T3-Hyperthyreose supprimiert n–↑ ↑↑ Sekundäre Hyperthyreose ↑ n–↑ n–↑ Subklinische (latente) Hypothyreose ↑ n n Primäre Hypothyreose ↑↑ ↓ ↓ (n) ↓ (n) ↓ ↓ HVL-Adenom Z.n. Hypophysen-OP n – (↓) n – (↓) ↓ Schwere extrathyreoidale Erkrankung (NTI) Ziel n Ziel Ziel n n supprimiert n (↑) n n n n Sekundäre Hypothyreose (HVL-Insuffizienz) Low-T3-Syndrom Therapiekontrolle Hormonsubstitution bei Hypothyreose Suppressionskontrolle bei Struma maligna Thyreostasekontrolle (unterer NB) Diagnosen Struma nodosa Kompensiertes Adenom Sonographie, Szintigramm, ggf. Punktion M. Basedow Dekompensiertes Adenom TRAK, TPO-Ak Sonographie, Szintigramm, ggf. Punktion TSH-produzierendes HVL-Adenom (selten) Jodmangel Struma(teil)resektion Thyreostatische Therapie Immunthyreoiditis Hashimoto MRT Sella TPO-Ak, TAK MRT Sella, TRH-Test, Hypophysenhormonbestimmung Zusätzliche Untersuchungen Thyreoglobulin, TSH-Test, Ganzkörperszintigramm TRAK (Verlaufskontrolle M. Basedow) Diagnoserelevante Stör- und Einflussgrößen bei der Bestimmung von Schilddrüsenparametern Parameter basales TSH fT4 fT3 Erhöhung bei Verminderung bei Schlafentzug, Erholungsphase nach schwerer Krankheit, Hypokalzämie, HIV-Infektion, Nebennierenrindeninsuffizienz Fasten, Mangelernährung, Anorexia nervosa Depression, Hyperkaliämie Hypercortisolismus Chlorpromazin, Haloperidol, Lithium, Sulpirid, Metoclopramid, Domperidon, Naloxon, Östrogene Amiodaron (initial) Salizylate, Heparin, Furosemid, Amiodaron L-DOPA, Amiodaron (Langzeittherapie) Corticoide, Somatostatin, Verapamil, Nifedipin, Diphenylhydantoin, Jod-Kontrastmittel Barbiturate Rifampicin schwere extrathyreoidale Erkrankung (NTI) hochdosierte Jodgabe Propanolol, Corticoide, Amiodaron T3-Präparate Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2008 Laborinformation Nr. 35 Labor Schottdorf MVZ GmbH Sexuell übertragbare Krankheiten STD Erreger Erkrankung Klinik Labordiagnostik Antigennachweis / Erregernachweis Methode Treponema pallidum Lues DunkelfeldMikroskopie Antikörpernachweis / Serologie Material Methode Anmerkung Direktnachweis aus Primärläsion in der Frühphase der Infektion Präparat muss sofort mikroskopiert werden Kein Versand möglich! Treponema pallidum-Ak TPHA quantitativ Suchtest (2.-3. Wo. nach Infektion positiv) Verlaufskontrolle, Bewertung der Behandlungsbedürftigkeit Bestätigungstest DD akute oder chronische Infektion, Reinfektion Verlaufskontrolle, Bewertung der Behandlungsbedürftigkeit FTA-ABS Lues-IgM-EIA CardiolipinMikroflockungstest Neisseria gonorrhoeae Gonorrhoe Mikroskopie und Kultur PCR Haemophilus ducreyi Ulcus molle Chlamydia trachomatis Serovar L1-3 Lymphogranuloma venereum (LGV) PCR Chlamydia trachomatis Serovar D - K Frau: Zervizitis, Salpingitis, Endometritis, PID, Konjunktivitis Mann: Urethritis Epididymitis, Prostatitis, Proktitis, Konjunktivitis, reaktive Arthritis Herpes genitalis, Herpes labialis, Keratokonjunktivitis, Meningitis PCR Herpes simplex Virus HSV 1 und 2 Mikroskopie und Kultur IFT PCR (Kassenleistung nur im Liquor) Papillomaviren CIN, Zervix-CA (Häufigste HPV-Typen: 16, 18) HPV PCR Condylomata acuminata Abstrich in Transportmedium (Zervix, Urethra, Konjunktiva, Rachen, Rektum) Trockener Abstrichtupfer (Zervix, Urethra, Rachen, Rektum, Konjunktiva), Urin Abstrich in Transportmedium vom Ulkusgrund Trockener Abstrichtupfer vom Ulkusgrund, Rektum, Eiter, Biopsiematerial Urin, trockener Abstrichtupfer (Zervix, Vagina, Urethra, Rektum, Rachen, Konjunktiva) 2 fixierte Ausstriche vom Bläschengrund (Spezielles Abstrichset im Labor anfordern) Trockener Abstrichtupfer vom Bläschengrund, Liquor, EDTA-Blut Serologie nicht verfügbar Serologie nicht verfügbar EIA (IgG, IgA) Keine Unterscheidung von Chlamydia trachomatis Serovar L1-3 und Serovar D-K EIA (IgG, IgA) Keine Unterscheidung von Chlamydia trachomatis Serovar L1-3 und Serovar D-K. EIA (IgG, IgM) Ergänzende Untersuchung bei aszendierter Infektion (PID) und reaktiver Arthritis Bei Erstinfektionen IgM-positiv. Bei Rezidiv IgM oft nicht nachweisbar, nur geringer oder kein IgG-Titer Anstieg Der direkte Erregernachweis ist vorzuziehen. Zervixabstrich (trockener Tupfer oder Flüssigzytologiemedium) Serologie nicht verfügbar (PCR erfasst Genotyp 16,18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68) (Häufigste HPV-Typen: 6, 11) Gardnerella vaginalis Bakterielle Vaginose Mikroskopie und Kultur Abstrich in Transportmedium Serologie nicht verfügbar Mycoplasma genitalium Urethritis (möglicherweise Prostatitis/ Adnexitis, HWI, Zervizitis, PID) PCR Trockener Abstrichtupfer, Urin, Sperma Serologie nicht verfügbar Ureaplasma urealyticum Urethritis, (möglicherweise Prostatitis/ Adnexitis, HWI, bakterielle Vaginose) Kultur Abstrich in Transportmedium, Urin, Sperma (Kultur erfasst auch M. hominis, Keimzahlbestimmung und Antibiogram möglich) Trockener Abstrichtupfer, Urin, Sperma Urogenitalabstriche, Urin Präparat muss sofort mikroskopiert werden Kein Versand möglich! Abstrich in Transportmedium PCR Trichomonas vaginalis Candida albicans Klebsiella granulomatis (früher Calymnobact. granulomatis) Trichomoniasis Frau: Vaginitis, Urethritis Mann: Urethritis, Prostatitis, Epididymitis Candidiasis Frau: Vaginitis Mann: Balanitis Granuloma inguinalis Donovaniasis Mikroskopie Mikroskopie Kultur Mikroskopie Gewebsausstrich von Biopsie- oder Kürettagematerial Neutralisationstest Der direkte Erregernachweis ist vorzuziehen. Serologie nicht verfügbar EIA (IgA, IgG, IgM) Der direkte Erregernachweis ist vorzuziehen. Serologie nicht verfügbar Die Tabelle enthält Erreger, die über Sexualkontakte übertragbar sind und Symptome und Krankheiten im Urogenitalbereich verursachen. Wichtige sexuell übertragbare Erkrankungen sind weiterhin die HIV-Infektion, die Hepatitis B sowie – mit Einschränkung – Hepatitis C- und Cytomegalie (CMV)Infektionen. Heute seltene Parasitosen wie die Scabies (Krätze; Erreger: Sarcoptes scabiei) und der Filzlausbefall (Phthirus pubis) gehören ebenfalls zu den STD. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Labor Schottdorf MVZ GmbH Laborinformation Nr. 36 Thrombophilie Thrombose-Risiko Definition und Krankheitsbilder Bei Gesunden ist das Blutstillungssystem im Gleichgewicht von gerinnungsfördernden und -hemmenden Faktoren. Thrombophilie ist das Überwiegen gerinnungsfördernder Aktivität im Blut, die zur Thrombose führen kann durch: - verminderte Aktivität gerinnungshemmender Faktoren (Antithrombin, Protein S, -C, Plasminogen, PAI u. a.)v - verminderte Inaktivierung gerinnungsfördernder Aktivität (APC-Resistenz) - erhöhte Aktivität (Fibrinogen, F. VIII) Jede unklare Thrombose oder Embolie sollte labordiagnostisch abgeklärt werden. Kommt es insbesondere bei jungen, sonst gesunden Personen plötzlich oder durch geringen, nicht adäquaten Anlass zu einer Thrombose, sollte an einen genetischen Gerinnungsdefekt gedacht werden. Hereditäre Thrombophilien sind meist bis zum 60. Lj. manifest geworden. Risikofaktoren exogen (erworben) Antikonzeptiva, Schwangerschaft, Wochenbett, Immobilität, langes Sitzen, Varizen, Phlebitiden, Herzinsuffizienz; Phospholipid-Ak bei Lupus erythematodes, Antiphospholipid-Ak Syndrom) Heparin-PF4-Ak bei HIT2 unter Heparin-Therapie Risikofaktoren endogen (genetisch) Faktor V Leiden, Prothrombin-Dimorphismus Hinweise zu Laborparametern APC-Resistenz und Faktor V-Leiden-Mutation Resistenz des Faktor V gegen Inaktivierung durch aktiviertes Protein C (APC). Durch eine Mutation des F. V (Faktor V-Leiden) wird dieser durch APC vermindert abgebaut. Folge ist eine erhöhte F. V-Aktivität mit gesteigerter Thromboseneigung. In Deutschland sind ca. 5 % aller Personen Träger einer Faktor V-Leiden-Mutation. Heterozygoter Status ist mit ca. 10-fach, homozygoter Status mit ca. 100-fach erhöhtem Risiko assoziiert. Zum Nachweis gibt es 2 Laborparameter: 1. APC-Resistenz (Funktionsbestimmung wie oben beschrieben). Test der Resistenz des F.V gegen Inaktivierung durch akt. Protein C. Erst PTT ohne, dann mit Zugabe von akt. Protein C. Bei Gesunden verlängert sich die PTT mit APC auf das 2-5 -fache. Bei Patienten mit APC-Resistenz fällt die Verlängerung geringer aus. 2. Faktor-V-Leiden-Mutation im EDTA-Blut Genetische Bestimmung der Punktmutation an der Position 506 (FVR506Q;) mit Einverständniserklärung des Patienten. Prothrombin-Mutation Erfasst Prothrombin-Dimorphismus G20210A; mit Einverständniserklärung. Vorkommen in ca. 2%. Faktor VIII F. VIII ist ein Akute-Phase-Protein, Beurteilung zusammen mit CrP empfohlen. Persistierende F. VIII-Erhöhung, d. h. ohne Akute-PhaseReaktion, ist mit erhöhtem Thrombose-Risiko assoziiert. Cardiolipin-Ak, b2-Glycoprotein-1-Ak Antikörper, die gegen körpereigene Phospholipide gerichtet sind und die zu Thrombosen und Embolien führen können (den Überbegriff Antiphospholipid-Ak bitte auf dem Anforderungsschein nicht verwenden, sondern einzeln anfordern). Lupus Antikoagulans Ebenfalls Antiphospholipis-Ak, die meist mit einer PTT-Verlängerung einhergehen. Werden beim Lupus erythematodes und beim Antiphospholipid-Syndrom gefunden und führen ebenfalls gehäuft zu venösen Thrombosen und bei Frauen zu Aborten. MTHFR-Mutation Fragliche Assoziation zur venösen Thrombose. Derzeit nur Kassen*1 leistung bei nachgewiesener Hyperhomocysteinämie mit EV . Heparin-induzierte Thrombozytopenie Typ II (HIT II) Bei der HIT II kommt es durch Antikörperbildung gegen Heparin/ Plättchenfaktor 4 zur Thrombozyten-Aktivierung und Thrombosen. Nachweis mittels HIPA-Test (Heparin-induced Platelet Activation). Bei Labordiagnostik Indikation rezidivierende venöse Thrombose, atypische Lokalisation, z. B. Augen, Gehirn-, Mesenterialvenen, Pfortader Lungenembolie Aborte, Frühgeburten wegen Plazentainsuffizienz 3 Material Parameter möglich unter* 1. Stufe Heparin Cumarin APC-Resistenz + Citratplasma gefroren Protein C + Citratplasma gefroren Protein S + Citratplasma gefroren Lupus-Antikoagulans Citratplasma gefroren Cardiolipin-Ak + + Serum ß2-Glykoprotein1-Ak + + Serum Antithrombin Aktivität *2 + Citratplasma gefroren F. VIII + Citratplasma gefroren Gen-Untersuchungen Prothrombin-Mutation Faktor V-(Leiden)-Mutation + + + + EDTA-Blut mit EV* 1 EDTA-Blut mit EV* 2. Stufe Fibrinogen Plasminogen Homocystein *2 *2 + + + + Citratplasma gefroren Citratplasma gefroren Na-Fluorid-Blut 1 Erkrankungen mit Gerinnungsinhibitor-Mangel Lebererkrankung Antithrombin, Protein S, Protein C nephrot. Syndrom Antithrombin Tumor D-Dimer Heparin-ind. Thrombopenie HIPA-Test im Serum Achtung: *1: Einverständniserklärung (EV) bei genetischen Untersuchungen Seit 01.02.2010 muss nach Gendiagnostikgesetz bei Genuntersuchungen eine vom Patienten und Arzt unterschriebene Einverständniserklärung mit eingesandt werden. *2 keine Beeinflussung durch Heparin (unfraktioniert oder niedermolekular) bis zu 1 U/ml. *3 Zeichen + - Bedeutung Parameter aussagekräftig Parameter nicht aussagekräftig Gerinnungsuntersuchung unter Antikoagulation a) Heparine oder Cumarine siehe Tabelle oben (*3) b) Thrombininhibitoren (z.B. Dabigatran), Ergebnisse der Gerinnungsuntersuchungen nicht oder sehr eingeschränkt verwertbar. Bitte folgenden Hinweis zur Anforderung beachten: Bei Thrombose-Risiko bitte „APC-Resistenz“ oder „Faktor V-LeidenMutation“ anfordern, nicht „Faktor V“. „Faktor V“ ist die Bestimmung der F. V-Aktivität, z. B. bei der Fragestellung „F. V-Mangel“, welcher mit Blutungen assoziiert ist. Bei Thrombose-Risiko bitte „Prothrombin-Dimorphismus“ anfordern, nicht „Prothrombin“. „Prothrombin“ ist die Bestimmung der F. II-Aktivität, z. B. bei Blutungsneigung. Citrat-Plasma gefroren Citrat-Plasma sofort nach Blutabnahme 20 Minuten zentrifugieren, den Überstand abheben und in neutralem Gefäß (Art.Nr. 8844 auf Versandmaterial-Bestellschein) einfrieren (siehe Leistungsverzeichnis). TIP: leeres neutrales Gefäß vorfrieren, dadurch weniger Gerinnselbildung. Nach Einfüllen des Plasmas das neutrale Gefäß separat einfrieren, nicht im Kühlelement einfrieren. Nach Durchfrieren in durchfrostetes Kühlelement geben und einschicken. Laborbudget-Ausnahmekennziffer 32011 Diagnostik der hereditären Thrombophilie, des AntiphospholipidSyndroms oder der Hämophilie. erster Heparingabe sind die Antikörper nach 6-20 Tage messbar. Bei zweiter Heparingabe treten die Antikörper nach sehr kurzer Zeit auf. Auftreten der HIT II bei UFH häufiger als bei NMH. HIPA-Test 2ml Serum Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 06 2014 Laborinformation Nr. 37 Labor Schottdorf MVZ GmbH Toxoplasmose Erreger und Epidemiologie Toxoplasmose und Schwangerschaft Die Toxoplasmose ist eine durch das Protozoon Toxoplasma gondii hervorgerufene Anthropozoonose, die weltweit bei Säugetieren und Geflügel verbreitet ist. Die Übertragung auf den Menschen erfolgt über drei Wege: - Verzehr von rohem Gewebszysten-haltigen Fleisch (Schwein, Wiederkäuer, Geflügel); - Orale Aufnahme von Oozysten aus Katzenkot. Sporulierte Oozysten bleiben im Erdboden mehrere Jahre lebensfähig, eine Infektion ist deshalb auch bei der Gartenarbeit oder durch kontaminierte Nahrungsmittel möglich. - Intrauterin (diaplazentar). Die Inkubationszeit beträgt ca. 2-3 Wochen. Die Durchseuchung mit Toxoplasma gondii nimmt proportional mit dem Alter zu, sie liegt in Deutschland im Mittel bei ca. 50-60%. Nur etwa 30-40% aller Frauen im gebärfähigen Alter haben eine Toxoplasmose durchgemacht. Eine akute Toxoplasmoseinfektion der Mutter kann während der Schwangerschaft auf den Feten übertragen werden, unabhängig davon, ob Symptome beobachtet wurden oder nicht. Das Risiko der Transmission nimmt mit zunehmendem Gestationsalter zu (ca. 15% im ersten, ca. 60% im dritten Trimenon), die Häufigkeit symptomatischer fetaler Infektionen sinkt dagegen von ca. 70% im ersten auf ca. 10% im 3. Trimenon. Im 1. Trimenon kann eine unbehandelte Infektion mit einem Abort enden, im 2. und 3. Trimenon dominieren Schädigungen des Gehirns (Hydrocephalus, Mikrocephalie, intracerebrale Verkalkungen), Chorioretinitis sowie Anämie und Thrombozytopenie. Der Schweregrad der Schädigung variiert in weiten Bereichen, diskrete Schäden werden u. U. erst in den ersten Lebensjahren sichtbar (Chorioretinitis, Netzhautnarben, Hörschäden, mentale Retardierung und Epilepsie). Klinik - bis zum Ende der 15. SSW: Spiramycin 3,0 g/d in drei Teildosen - ab der 16. SSW: Kombinationstherapie mit Sulfadiazin (50 mg/kg/d bis max. 4 g/d in vier Teildosen) und Pyrimethamin (50 mg am 1. Tag, danach 25 mg als Einmaldosis). Zusätzlich Gabe von Folinsäure 10-15 mg/d zur Vermeidung von Nebenwirkungen auf die Hämatopoese Die Therapiedauer sollte mindestens 4 Wochen betragen. Es besteht z.Z. kein Konsens darüber, ob die Therapie bis zum Ende der Schwangerschaft fortgeführt werden muss oder ob eine Kombinationstherapie alternierend in 4-wöchigem Rhythmus durch Therapiepausen oder durch Therapiephasen mit Spiramycin unterbrochen werden sollte. 90% aller Toxoplasmoseinfektionen bei Immunkompetenten verlaufen asymptomatisch. Symptomatische Infektionen ähneln einem grippalen Infekt und sind in erste Linie durch Lymphknotenschwellungen im Kopf- und Halsbereich (selten generalisierte LKS) gekennzeichnet. Eine Augenbeteiligung (Chorioretinitis) und eine Enzephalitis sind bei ansonsten gesunden Personen äußerst selten. Nach Ablauf der akuten Infektion gehen die Erreger in einen Latenzzustand über und bilden Zysten in verschiedenen Geweben. Bei schwerer Immunsuppression (AIDS, Z.n. Organtransplantation) ist eine Reaktivierung der Infektion möglich, die sich hauptsächlich als Enzephalitis, seltener als Chorioretinitis manifestiert; generalisierte Verlaufsformen mit Dissemination in verschiedene Organsysteme können auftreten. Therapie während der Schwangerschaft Labordiagnostik der Toxoplasmoseinfektion Parameter ToxoplasmoseIgG (LIA) ToxoplasmoseIgM (LIA) ToxoplasmoseIgM (ELFA) ToxoplasmoseIgA (EIA) ToxoplasmoseIgG-Avidität ToxoplasmoseDNA-PCR Erläuterung IgG-Ak sind etwa zwei Wochen nach Infektion nachweisbar und persistieren lebenslang. Ein positiver IgG-Nachweis vor der Schwangerschaft gilt als Immunitätsnachweis; während der Schwangerschaft oder bei V.a. Akutinfektion sollte eine IgM-Bestimmung angeschlossen werden. Ein negatives Testergebnis schließt eine Toxoplasmoseinfektion mit hoher Wahrscheinlichkeit aus, da im Anfangsstadium nur sehr selten ausschließlich IgM-Ak gefunden werden. Bei Neugeborenen sprechen im Verlauf persistierende oder ansteigende IgG-Antikörper für eine konnatale Toxoplasmose und gegen einen mütterlichen Leihtiter. IgM-Ak werden wenige Tage nach Infektion gebildet. Sie erreichen nach 2-5 Wochen ein Maximum und persistieren ca. 6 Monate. Nicht selten sind IgM-Ak in niedriger Konzentration über mehrere Jahre nachweisbar. Zusatz- und Bestätigungstest bei auffälliger Toxoplasmoseserologie in der Schwangerschaft Material Serum Der Nachweis von IgA-Ak deutet auf eine akute oder kurz zurückliegende Infektion. Als Zusatztest bei der Fragestellung „konnatale Toxoplasmose“ indiziert: ein positives Testergebnis beim Neugeborenen beweist eine konnatale Infektion. Wertigkeit des Testes bei Immunsuppression oder Chorioretinitis umstritten. Zusatztest zur Eingrenzung des Infektionszeitpunktes bei auffälliger Toxoplasmoseserologie (positiver IgM-Nachweis) in der Schwangerschaft. Mit zunehmendem Abstand zur Infektion steigt die Avidität der gebildeten IgG-Antikörper. Eine hohe Avidität schließt eine Akutinfektion in den vergangenen 4 Monaten aus. Direktnachweis des Erregers bei V. a. fetale Infektion, V.a. Reaktivierung einer Toxoplasmose bei Immunsuppression, V. a. cerebrale Toxoplasmose Serum Serum Serum Serum Fruchtwasser, Liquor, Bioptat Interpretation serologischer Befundkonstellationen während der Schwangerschaft IgG (LIA) IgM (LIA) IgM (ELFA) IgG (Avidität) ─ + ─ ─ ─ + ─ + + + + + ++ + ++ hoch niedrig + + + niedrig/ mittel ─ Interpretation Kein Hinweis auf Infektion, keine Immunität. Abgelaufene Infektion, für die Schwangerschaft besteht kein Infektionsrisiko. Wahrscheinlich unspezifischer IgM-Nachweis, Kontrolle notwendig. Auffälliger Befund. Eine Serokonversion der IgG-Antikörper bei kurzfristiger Verlaufskontrolle beweist eine Akutinfektion. Zurückliegende Infektion (> 4 Monate) mit persistierenden IgM-Antikörpern. Akute oder kurz zurückliegende Infektion. Kurz zurückliegende Infektion oder abgelaufene Infektion mit persistierenden IgM-Antikörpern. Eine eindeutige Aussage über den Zeitpunkt der Infektion ist nicht möglich. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 38 Labor Schottdorf MVZ GmbH Nadelstichverletzung Vorgehen bei Kontakt mit infektiösem Material Infektionsrisiko Infektion Allg. Übertragungsrisiko Prävention Hepatitis B HBV-positiver Indexpatient 30% Aktive / passive Impfung Hepatitis C HCV-positiver Indexpatient 3% HIV Von der übertragenen Erregermenge abhängig: HIV-positiver Indexpatient ca. 0,3% Übertragungsrisiko Sofortmaßnahmen Stich / Schnittverletzung Blutfluss fördern durch Druck auf das umliegende Gewebe ≥ 1 Minute Desinfektion der Wunde mit Händedesinfektionsmittel über 10 Minuten/Anlage eines antiseptischen Wirkstoffdepots (auf ausreichenden Abfluss achten wg. Nekrosegefahr!) Stichkanal zur Desinfektion spreizen Kontamination des Auges sofortige gründliche Spülung des Auges mit reichlich Leitungswasser (10 Minuten) Kontamination der Mundhöhle Ausspucken, dann sofortige ausgiebige Spülung mit reichlich Leitungswasser (10 Minuten) Kontamination vorgeschädigter Haut sofortige ausgiebige Spülung und Desinfektion mit Händedesinfektionsmittel (10 Minuten) Weiteres Procedere * Indexpatient Verletzter Patient von dem das Blut / Material bzw. die Nadel stammt. Bei Untersuchung des Indexpatienten vor einer Entscheidung an die Relevanz des diagnostischen Fensters denken! Immer an die Dokumentation des aktuellen Infektionsstatus (HBV, HCV, HIV) denken: AntiHCV und HCV sofort, nach 3 und 6 Monaten; ggf. HBV-Parameter! HBsAg positiv / nicht bestimmbar Postexpositionelle Hepatitis B-Immunprophylaxe in Abhängigkeit vom HBV-Impfstatus des Verletzten (s. u.) HBsAg negativ Diagnostisches Fenster in Überlegungen mit einbeziehen! Ggf. Beginn / Komplettierung der Grundimmunisierung Hepatitis C positiv GPT**, Anti-HCV sofort, in 3 und in 6 Mo, HCV-PCR in 2-4 Wo HIV positiv Hepatitis B Wg. PEP-Indikation (s. u.) Überweisung zu HIV-erfahrenem Arzt (innerhalb 2h nach Verletzung, i.d.R. über 28d, Off-Label-Use ausdrückliches Einverständnis des Pat.); Anti-HIV sofort, in 3 und in 6 Monaten Anti-HCV, Anti-HIV sofort, in 3 und in 6 Monaten HBV in Abhängigkeit vom Impfstatus des Verletzten (s. u.) Unbekannter Infektionsstatus Indexpatient: HBsAg positiv / unbekannt – Postexpositionelle Hepatitis B-Immunprophylaxe u. Laborparameter *** HBV-Impfstatus des Verletzten Letztes Anti-HBs Sofortiges Anti-HBs <10 IU/l Früher >100 IU/l Nur HBV-Impfstoff HBsAg, Anti-HBs, Anti-HBc ** 10-99 IU/l Nie >100 IU/l HBV-Impfstoff + Immunglobulin HBsAg, Anti-HBs, Anti-HBc ** vollständig Anti-HBs >10J./nie unvollständig Keine Maßnahmen bzgl. HBV 100 IU/l Anti-HBs <10J. Anti-HBsBestimmung innerhalb von 48h Maßnahmen und Diagnostik >100 IU/l Keine Maßnahmen bzgl. HBV 10-99 IU/l Nur HBV-Impfstoff *** <10 IU/l Früher >100 IU/l Nur HBV-Impfstoff*** HBsAg, Anti-HBc ** Nie >100 IU/l HBV-Impfstoff + Immunglobulin ***HBsAg, Anti-HBc ** ungeimpft HBV-Impfstoff + Immunglobulin 2 weitere Impfstoffdosen nach Impfschema (BG-Kostenübernahme für 1. Dosis) NonResponder HBV-Impfstoff + Immunglobulin ® evtl. Off-Label-Use von Fendrix * ** *** AntiHCV, Anti-HIV Sofort, in 3 u. in 6 Mo. Beurteilung stützt sich auf die Annahme, dass ein einmaliges Anti-HBs-Ergebnis > 100 IU/ml einen lebenslangen Schutz darstellt. Das Labor kann keine Gewähr für die Aktualität der Information zum Verletzungszeitpunkt gewährleisten! An Unfalldokumentation / D-Arzt denken! Abweichend von den BG-Empfehlungen empfehlen wir die aktuelle Bestimmung von HBsAg, Anti-HBs und Anti-HBc zur Dokumentation zu erwägen. Postexpositionelle Chemoprophylaxe (PEP) (gemäß RKI 07/2002; BG-Kostenübernahme für 1. Dosis) PEP empfohlen PEP anbieten PEP nicht emphehlen perkutane Verletzung mit Injektions-/ Hohlraumnadel: Körperflüssigkeit mit hoher Viruskonzentration (Blut, Liquor, Punktatmaterial, Organmaterial, Viruskulturmaterial), tiefe Verletzung, sichtbares Blut, Nadel nach intravenöser Injektion oberflächliche Verletzung (z. B. mit chirurgischer Nadel) und Indexpatient mit AIDS / hoher HI-Viruslast oberflächliche Verletzung (z. B. mit chirurgischer Nadel), Kontakt zu Schleimhaut / verletzter geschädigter Haut mit Flüssigkeiten mit hoher Viruskonzentration perkutaner Kontakt mit anderen Körperflüssigkeiten als Blut, Kontakt von intakter Haut mit Blut, (Schleim-) Hautkontakt mit Körperflüssigkeiten wie Urin / Speichel Es bestehen Abweichungen zwischen den STIKO / RKI-Empfehlungen und den Empfehlungen der BGW. Orientierende Richtlinien zur BG-Kostenübernahme (ohne Gewähr): Grundimmunisierung >5J: 1 Dosis Hep. B-Impfstoff, Anti-HBs, Anti-HBc; Grundimmunisierung <5J.: Anti-HBs > 100 IE/l: keine weiteren gezahlten Maßnahmen lt. BG; Anti-HBs <100 IE/l / unbekannt: 1 Dosis Hep. B-Impfstoff; Anti-HBs, Anti-HBc; keine Kostenübernahme für Transaminasen. Bei HBV-Ungeimpften bzw. unvollständig Geimpften sollte die Grundimmunisierung im Anschluss begonnen oder komplettiert werden. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 02 2014 Laborinformation Nr. 39 Labor Schottdorf MVZ GmbH Umweltgifte, Schwermetalle Untersuchung Material Vorkommen in Belastung von Symptome (chron. Intox.) Gamma HCH (Lindan) Alpha-HCH Beta-HCH 4 ml Blut im Spezialgefäß Insektiziden, Holzschutzmitteln Begleitstoff des Lindans Begleitstoff des Lindans Fettgewebe, Muttermilch, Blutbildung Hexachlorbenzol (HCB) 4 ml Blut im Spezialgefäß Pflanzenschutzmitteln, Gehirn, Nerven, Muttermilch Pentachlorphenol (PCP) 4 ml Blut im Spezialgefäß oder 10 ml Urin Pilzbekämpfungsmitteln, Nahrungs- Leber, Niere mitteln, imprägnierten Holz, Leder, Tapeten, Textilien DDT und DDE 4 ml Blut im Spezialgefäß Insektizid mit weltweitem Einsatz Fettgewebe Polychlorierte Biphenyle (PCB) 3 ml Serum Weichmacher in Kunststoffen, Kitt, Papier, Gebäudedehnungsfugen Fettgewebe Bisphenol A 10 ml Urin Weichmacher in Kunststoffen, Lacken, Papier, Lebensmittelverpackungen Leber Hormonelle und entwicklungsstörende Wirkung Diisocyanate (MDI, TDI) 10 ml Urin PU-Schäumen, Dämmstoffen, Klebern, Spanplatten, Möbeln Atemwege, Haut Allergien der Haut und Atemwege Polyzyklisch aromatisierte Kohlenwasserstoffe (PAK) 10 ml Urin Ruß, Kunststoffe, Dieselabgase, Feinstaub, Tabakrauch Lunge, Krebserzeugend Chlorierte Kohlenwasser4 ml Blut im stoffe (Perchlorethylen, Dich- Spezialgefäß lormethan, Tri u. a.) Lacken, Farben, Klebstoffen Textil- und Fleckenreiniger Abbeizmitteln, Verdünner Leber, Nervensystem Aromatische Kohlenwasserstoffe (Benzol, Toluol, Xylole u. a.) 4 ml Blut im Spezialgefäß Antiklopfmittel in Treibstoff (Benzol) Klebstoffen Blutbildung (Leukämie) Lösemittel (z. B. Alkohole, Ketone) 4 ml Blut im Spezialgefäß Lösungsmittel, Kosmetika, Polituren, Leber, Nerven Farben, Lacke, Beizen, Verdünner, Putzmittel Cadmium 3 ml EDTABlut Tabakrauch, Batterien, Rostschutzmitteln, Löt- und Schweißrauch, Keramikglasuren, Dünger Nervensystem, Leber, Pankreas, Niere, Schilddrüse Geruchsverlust, Husten Funktionsstörungen und Zellschädigungen der Niere Chrom 3 ml EDTABlut oder 10 ml Urin Farben, Mörtel, Leder, Implantaten, Galvanisierungen, Imprägnierung (z. B. Holz) Haut Magendarmtrakt Atemwege Ekzem (Kontaktallergie) Gastroenteritis Katarrh Blei 3 ml EDTABlut Rostschutz (Mennige), Keramikglasuren bleihaltigen Wasserrohren verbleiten Benzin Blutbildung Nervensystem glatte Muskulatur Niere Quecksilber 3 ml EDTABlut oder 10 ml Urin Pilzbekämpfungsmitteln, Amalgam Holzbeizen, Thermometern Energiesparlampen (Höhensonne etc.), Fisch, Muscheln Blutbildung Gehirn Nervensystem Niere neuropsychologische Veränderungen, Anämie, Gedächtnisstörungen Kopfschmerzen, Krämpfe Müdigkeit, Potenzverlust Schrumpfniere, Zittern metallischer Geschmack Nebenhöhleninfekte, Appetitlosigkeit Arsen 10 ml Urin Böden, Grundwasser, Tabakrauch, Lebensmittel insbesondere Fisch, Reis, Salat Nervensystem, Knochen, Niere, Haare, Nägel Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Allergien Antriebslosigkeit Atemwegsreizungen Augenreizungen Blutungen Diarrhoe Gedächtnisstörungen Hautveränderungen Konzentrationsstörungen gehäufte Infekte, Kopfschmerzen, Müdigkeit Muskelschmerz Parästhesien Übelkeit Schleimhautreizungen Schwindel Atemwege, Haut Augenreizungen Atemwegsreizungen Gedächtnisstörungen Koordinationsstörungen Kopfschmerzen Nervenentzündung Ohrensausen Verdauungsstörungen Schläfrigkeit Schwäche Schwindel Nervenschäden, Hautveränderungen, Stand 07 2014 Laborinformation Nr. 40 Labor Schottdorf MVZ GmbH Vaskulitiden ANCA Definition Vaskulitiden sind charakterisiert durch typische entzündliche Gefäßwandveränderungen verschiedener Blutgefäßtypen. Es werden primäre und sekundäre Vaskulitiden unterschieden. Primäre Vaskulitiden gelten als seltene Erkrankungen. Unter der Annahme, dass sie häufig nicht diagnostiziert werden, sind die bisherigen Inzidenzraten als zu niedrig anzusehen. Für einige der primären Vaskulitiden hat sich die Bestimmung der ANCA (Anti-neutrophile cytoplasmatische Antikörper) etabliert. Jedoch stehen nicht für alle Vaskulitiden spezifische Laborparameter zur Verfügung. Klinik Allgemeinsymptome Abgeschlagenheit, Fieber, Nachtschweiß, Gewichtsverlust Vaskulitis kleiner Gefäße Purpura, Livedo reticularis, Ulcera, Polyneuritis, Kribbeln, Hörsturz, Schwindel, Episkleritis, Doppelbilder, Sehunschärfe, Blindheit, Hämoptysen, Hämaturie, Teerstuhl, Perimyokarditis etc. Vaskulitis mittlerer Gefäße Infarkte verschiedener Organe wie Herz, ZNS, Niere, Darm, Extremitäten u. a. Vaskulitis großer Gefäße Aortenbogensyndrom, Subclavian-Steal-Syndrom, Venenthrombosen Einteilung Vaskulitiden (Chapel Hill Consensus Conference 2012) Gefäßgröße Arteriitis Laborparameter klein ANCA–ass. Vaskulitis mikrosk. Polyangiitis ANCA, MPO-Ak M. Wegener ANCA, PR3-Ak Churg-Strauss Syndrom ANCA, PR3-Ak MPO-Ak, Eosinophile Anti-GBM Erkrankung GBM-Ak Kryoglobulin Vaskulitis Kryoglobuline, Immunfixation Anti-C1q Vaskulitis C1q-Ak IgA Vaskulitis (Schönlein-Henoch) mittel Polyarteriitis nodosa M. Kawasaki HBsAg Endothelzell-Ak groß Takayasu Arteriitis Riesenzell-Arteriitis BKS variabel M. Behçet Cogan Syndrom Systemische Vaskulitis bei Lupus erythematodes bei rheumatoider Arthritis bei Sarkoidose Sekundäre Vaskulitis Hepatitis C Virus Hepatitis B Virus Syphilis-ass. Aortitis Medik. ass. ANCA-ass. Vaskulitis Malignom ass. Vaskulitis Medik. ass. Immunkomplex-Vaskulitis Vaskulitis eines Organes kutane leukozytoklastische Angiitis kutane Arteriitis primäre ZNS-Vaskulitis isolierte Aortitis ANA RF-IgM, CCP-Ak ACE HCV-Ak HBsAg, Anti-HBc TPHA ANCA Tumorsuche Labordiagnostik bei Vaskulitis Indikation V. a. Vaskulitis ANCA, ANA, AMA, RF-IgM, CCP-Ak, Endothelzell-Ak, GBM-Ak, C1q-Ak Eosinophile, Kryoglobuline, Immunfixation im Serum BSG, CRP Sekundäre Vaskulitis HBsAg, Anti-HBc, HCV-Ak, TPHA pr . membranöse Glomerulonephritis Phospholipase A2-Rez.-Ak Entzündungsaktivität Faktor 8-ass. Antigen (vWF) Blutbild, CH50, C3, C4 Nierenfunktion Albumin im Urin Cystatin C, Kreatinin im Serum Urinstatus, Urinsediment Information zu Laborparametern ANCA ANCA sind u. a. gegen Enzyme neutrophiler Granulozyten gerichtet. Sie werden im indirekten Immunfluoreszenztest (IFT) unter Verwendung humaner, äthanol- und formalinfixierter Granulozyten bestimmt. Derzeit werden die IFT-Muster c-, p- und x-ANCA unterschieden. Bei ausschließlicher Verwendung äthanolfixierter Granulozyten können in der Regel x-ANCA nicht von p-ANCA unterschieden werden. ANA und ANCA ANA stellen sich auf äthanolfixierten Granulozyten in der Regel wie p-ANCA dar. Bei ausschließlicher Verwendung äthanolfixierter Granulozyten können in der Regel ANA nicht von pANCA und x-ANCA unterschieden werden. MPO-Ak und PR-3-Ak Zur weiteren Differenzierung hat sich die Bestimmung von Proteinase-3-Ak (PR-3-Ak) und Myeloperoxidase-Ak (MPO-Ak) durchgesetzt. PR-3-Ak finden sich überwiegend bei c-ANCA, MPO-Ak überwiegend bei p-ANCA. Weitere, insbesondere bei p-ANCA gefundene Ak-Spezifitäten sind Kathepsin-D-, Lactoferrin- und Elastase-Ak, die sich in der klinischen Diagnostik nicht durchgesetzt haben. Bei allen ANCA-Mustern finden sich derzeit noch unbekannte AkSpezifitäten nicht bekannter Krankheitsassoziation. IFT-Muster AK-Spezifität c-ANCA PR-3 zytoplasmatisch p-ANCA perinukleär MPO x-ANCA unbekannt Assoziation M-Wegener, mikroskop. Polyarteriitis Churg-Strauss-Syndrom Colitis ulcerosa mikroskop. Polyarteriitis Panarteriitis nodosa pauciimmune nekrotis. GN Churg-Strauss-Syndrom Colitis ulcerosa primär skleros. Cholangitis autoimmune Hepatitis rheumatoide Arthritis Anforderung und Material Autoantikörper ANCA, MPO-, PR-3-Ak ANA, Endothelzell-Ak, ANA Faktor 8-ass. Antigen (vWF) Lupus Antikoagulans Kryoglobuline CH50 (Gesamtkomplementaktivität) C3-, C4-Komplement Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. je 1 ml Serum 1 ml Citratplasma gefroren 1 ml Citratplasma gefroren 3 ml Serum Abnahmehinweise beachten! 1 ml Serum gefroren 1 ml Serum Stand 07 2014 Laborinformation Nr. 41 Labor Schottdorf MVZ GmbH Zöliakie / Gluten-sensitive Enteropathie Definition Zöliakie (Synonyma: Gluten-sensitive Enteropathie, Sprue) ist eine autoimmune Zerstörung des Dünndarmepithels mit Malabsorption, die in genetisch prädisponierten Personen (HLADQ2/8 positiv) durch Aufnahme von Gliadin ausgelöst wird. Prävalenz ca. 1:100, die Zöliakie ist damit eine der häufigsten Autoimmunerkrankungen. Trotz der Möglichkeit einer differenzierten und rationalen Labordiagnostik ist die Zöliakie weit unterdiagnostiziert. Labordiagnostik Zöliakie-Screening Endomysium-IgA, tTG-IgA, Gliadin-Ak Serum - bei IgA-Mangel Endomysium-IgG, tTG-IgG, Gliadin-IgG Serum Verlaufskontrolle tTG-IgA, Gliadin-Ak Serum Zöliakie Risiko-Patienten, Verwandte 1. Grades HLA-DQ2, -DQ8 EDTA-Blut EV*1 Pathophysiologie Gliadin wird durch die Gewebstransglutaminase (tTG; Synonym: Transglutaminase 2, TG2) in der Darmschleimhaut deamidiert. Bei HLA-DQ2/8 positiven Patienten bindet das deamidierte Gliadin deutlich besser an Antigen-präsentierende Zellen. Es kommt zur Bildung von Antikörpern gegen deamidiertes Gliadin und tTG sowie einer entzündlichen Reaktion mit Schädigung der Darmschleimhaut. Die Gliadin-Ak und tTG-Ak im Serum ermöglichen die Diagnose der Zöliakie, (diagnostisch genutztes Epiphänomen), die eigentliche Zerstörung des Zottenepithels erfolgt über T-Zell-abhängige Mechanismen. *1 Seit dem 1.2.2010 muss lt. Gendiagnostikgesetz bei genetischen Untersuchungen eine vom Arzt und Patienten unterschriebene Einverständniserklärung (EV) mit eingesandt werden. Ernährung und Gluten Gliadin sind die prolin- und glutaminreichen Proteine des Glutens. Die Klebereiweiße (Glutene) der in Deutschland hauptsächlich angebauten Getreidearten (Weizen, Roggen, Gerste einschließlich ihrer Kreuzungen und Urformen; sog. Triticeae) sind chemisch eng verwandt und können alle eine Zöliakie auslösen bzw. unterhalten. Betroffene sollten deshalb Nahrungsmittel, die Produkte aus diesen Getreidearten enthalten, strikt meiden. Von der Ernährung mit Produkten aus Hafer wird in Deutschland abgeraten, da die Verarbeitung oft nicht getrennt von den anderen Getreidearten erfolgt und deshalb mit Kontaminationen zu rechnen ist. Als alternative Stärkequellen kommen z. B. Mais, Reis, Buchweizen, Quinoa, Kartoffel und Amaranth in Betracht. Zöliakie assoziierte Erkrankungen Diabetes mellitus Typ 1 ICA, GAD-Ak, IA-2-Ak IgA-Mangel IgA gesamt Hashimoto-Thyreoiditis TPO-Ak Autoimmunerkrankung ANA, AMA, LKM, LP-Ak Differentialdiagnostik der Malabsorption Anämie Ferritin Osteoporose 25-OH-Vitamin D3 Laktoseintoleranz H2- Atemtest neurolog. Symptome Vitamin B12, Vitamin A chron. Müdigkeitsyndrom Ferritin, 25-OH-Vitamin D3 Pankreasinsuffizienz Elastase Colitis ulcerosa x-ANCA Morbus Crohn ASCA, Pankreas exokrin-Ak Spurenelemente Magnesium, Zink, Calcium Serum Serum Serum Serum Serum Serum Serum Serum Stuhl Serum Serum Serum Hinweise zu Laborparametern Endomysium-IgA IFT ist der Goldstandard und zeichnet sich durch Sensitivität und Spezifität von jeweils > 90% aus. Das Zielantigen der Endomysium-Ak ist die Gewebstransglutaminase (tTG). Klinik Kleinkinder Symptome in der Regel 6-9 Monate nach Einführung glutenhaltiger Kost. Symptomtrias chronische Diarrhoe (Steatorrhoe), vorgewölbter Bauch, Gedeihstörung etwa mit 9 - 18 Monaten. tTG-IgA haben bei etwas geringerer Spezifität den Vorteil der Quantifizierbarkeit und sind damit auch zur Verlaufsbeurteilung sehr gut geeignet. tTG-IgG sind nur als ergänzender diagnostischer Parameter bei Patienten mit IgA-Mangel sinnvoll und dort in ca. 50% positiv. Ältere Kinder und Erwachsene oligosymptomatisch Gedeihstörung, Gewichtsverlust, Kleinwuchs, Eisenmangelanämie, chronische Müdigkeit, Aphten, Bauchschmerzen, Obstipation, Diarrhoe, Übelkeit, Appetitverlust, Pubertas tarda, Amenorrhoe, Aborte, Konzentrationsstörung, depressive Verstimmung, chronische Kopfschmerzen, Transaminasenerhöhung, Zahnschmelzdefekte, Osteoporose / Osteopenie Gliadin-Ak (IgA und IgG) Teste auf der Basis von deamidiertem Gliadin haben ältere, weniger spezifische Methoden zum Nachweis von Gliadin-Ak ersetzt. IgA gesamt zur Erfassung des (bei Zöliakie häufigen) IgA-Mangels. Bei IgA-Mangel Gliadin IgG, tTG-IgG empfohlen. Assoziation mit anderen Erkrankungen IgA-Mangel bis zu 5 % der Zöliakiepatienten Autoimmunerkrankungen 10 mal häufiger als Normalpopulation Diabetes mellitus Typ 1 5-10 % der Zöliakiepatienten Hashimoto-Thyreoiditis Dermatitis herpetiformis Duhring T-Zell-Lymphome des Gastrointestinaltraktes Diagnostik Keine glutenfreie Ernährung vor der Erst-Diagnostik (falsch negative Ergebnisse möglich!). Dünndarmzottenbiopsie und Bestimmung Zöliakie- assoziierter Antikörper etwa zeitgleich durchführen. Besserung der klinischen Symptomatik und histologischen Befunde unter glutenfreier Diät. Laborparameter sind geeignet zur - Diagnosestellung und Verlaufskontrolle - Bestimmung des Ausmaßes der Malabsorption und Diagnostik assoziierter Erkrankungen. Im Erwachsenenalter ist die Konkordanz klinischer, serologischer und histologischer Befunde in bis zu 10 % der Fälle nicht gegeben. Ak-Nachweise im Stuhl sind nicht geeignet. HLA DQ2 und HLA DQ8 HLA DQ2 ist bei 90-95 % der Zöliakiepatienten nachweisbar, HLA DQ8 bei weiteren 5 %. Falls HLA DQ2/8 negativ, ist eine Zöliakie nahezu auszuschließen. Umgekehrt ist der Nachweis von HLA DQ2 u./o. DQ8 nicht mit einer Zöliakie gleichzusetzen: etwa 40 % der Mitteleuropäer sind Träger von mindestens einem Risikomerkmal. Ausgehend von einer geschätzten Krankheitsprävalenz von 0,5-1,0 % hat ein Merkmalsträger ein Risiko von etwa 1,25-2,5 % für die Entwicklung einer Zöliakie. Bei Risikopatienten Kontrolle der tTG-IgA alle 2-3 Jahre. ACHTUNG bei Antikörpernachweisen - zur Diagnosestellung: Eine Glutenbelastung (d. h. normale glutenhaltige Nahrung) soll im Zeitraum (Tage-Wochen) vor der Blutentnahme erfolgen. Keine glutenfreie oder glutenarme Ernährung, da hier die Ak unter die Nachweisgrenze abfallen können. HWZ 1-2 Monate. - zur Verlaufskontrolle: Gliadin-Ak verhalten sich proportional zur Krankheitsaktivität. Gliadin-IgA werden meist bereits nach ca. 6-8 Wochen glutenfreier Ernährung negativ, während tTG-IgA länger positiv bleiben. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 03 2014 Laborinformation Nr. 42 Labor Schottdorf MVZ GmbH Arterielle Hypertonie Laboruntersuchungen Definition Als arterielle Hypertonie wird eine dauerhafte Blutdruckerhöhung auf Werte von ≥140 mmHg (systolisch) und/oder ≥90 mmHg (diastolisch) bezeichnet. Das kardiovaskuläre Risiko steigt nahezu linear mit dem systolischen und diastolischen Blutdruck, ein eigentlicher Schwellenwert existiert nicht. Ab dem 50. Lebensjahr ist in Deutschland fast jeder Zweite betroffen. Klassifikation nach Schweregrad Grad systolisch optimal <120 normal <130 noch normal 130-139 1 leicht 140-159 2 mittelschwer 160-179 3 schwer >180 isolierte systolische >140 Hypertonie diastolisch <80 <85 85-89 90-99 100-109 >110 <90 Die primäre (essentielle) Hypertonie umfasst ca. 90% aller Hypertonien, manifestiert sich in der Regel jenseits des 30. Lebensjahres und ist multifaktoriell bedingt. Nicht beeinflussbare Risikofaktoren sind Alter, Geschlecht und genetische Disposition, beeinflussbar sind dagegen Übergewicht, körperliche Inaktivität, Alkoholkonsum und vermehrte Salzaufnahme. Die essentielle Hypertonie tritt oft im Rahmen eines metabolischen Syndroms mit Hyperlipoproteinämie, Hyperurikämie, Insulinresistenz und Adipositas auf. Fragestellung Basisuntersuchungen Sekundäre Hypertonie Hyperaldosteronismus DD: primär vs. sekundär DD: Nierenarterienstenose Hypercortisolismus (Cushing-Syndrom) Phäochromozytom Hyperthyreose Adrenogenitales Syndrom Hyperparathyreoidismus Sekundäre Hypertonieformen sind im Gegensatz zur Primären Hypertonie auf eine organische Ursache zurückzuführen. Dazu zählen renoparenchymatöse und renovaskuläre Hypertonie, endokrine Hochdruckformen, neurogen bedingter Hochdruck, die Aortenisthmusstenose und sehr seltene monogenetische Hochdruckformen. Eine Sonderform der sekundären Hypertonie stellt die schwangerschaftsbedingte Hypertonie (Gestationshypertonie) dar. Sie tritt meist im 3. Trimenon einer Schwangerschaft auf und klingt 1-6 Wochen nach Entbindung wieder ab. Eine Gestationshypertonie mit Proteinurie (≥0.3 g/24h) wird als Präeklampsie (Gestose) bezeichnet. Die schwersten Formen der schwangerschaftsbedingten Hypertonie sind die Eklampsie und das HELLP-Syndrom (Haemolysis; Elevated Liver enzyme levels; Low Platelet count). Hypertonie in der Schwangerschaft ist eine der häufigsten Ursachen der Müttersterblichkeit und der perinatalen Mortalität. Die empfohlenen Basisuntersuchungen erfassen kardiovaskuläre Risikofaktoren und können erste Hinweise auf sekundäre Hypertonieformen geben (renoparenchymatöse Hypertonie: Kreatinin, Albumin im Urin; primärer Hyperaldosteronismus: Kalium; Schlafapnoe: Blutbild). Weitere zum Ausschluss sekundärer Hypertonieformen geeignete Laborparameter sowie Laboruntersuchungen bei schwangerschaftsbedingter Hypertonie sind in den folgenden Tabellen aufgeführt. Parameter Na, K, Kreatinin (GFR), Cholesterin, HDL, LDL, Triglyceride, Harnsäure Blutzucker nüchtern Blutbild, HbA1c Urinstatus (Teststreifen, Sediment), Mikroalbumin Material Serum NaF-Blut EDTA-Blut Urin Aldosteron Aldosteron/Renin-Quotient Captopril-Test: Aldosteron/Renin-Quotient basal und 60/120 min nach 25 mg Captopril Captopril-Test: Renin basal und 60/120 min nach 25 mg Captopril Dexamethason-Hemmtest: Cortisol basal (8:00 Uhr), Gabe von 2mg Dexamethason (23:00 Uhr), Cortisol 2 (2. Tag, 8:00 Uhr) Cortisol im Speichel 23 Uhr freies Cortisol im Urin Metanephrin frei, Normetanephrin frei Adrenalin, Noradrenalin, (Dopamin), Metanephrin, Normetanephrin EDTA-Plasma EDTA-Plasma EDTA-Plasma TSH, fT4 17-OH-Progesteron, 11-Desoxycortisol, Cortisol, Aldosteron, DHEA, Testosteron gesamt Parathormon intakt Calcium, Phosphat EDTA-Plasma Serum Speichel 24h-Urin ohne Zusatz EDTA-Plasma gefr. 24h-Urin mit Salzsäurezusatz Serum Serum EDTA-Plasma Serum Typische Veränderungen klinisch-chemischer Laborparameter bei Gestationshypertonie Hämatokrit >38% <100.000/µl, progredienter Abfall (auch bei Werten im Normbereich) muß innerhalb weniger Thrombozyten Stunden kontrolliert werden (HELLP-Syndrom !) GOT (AST), GPT (ALT), LDH Anstieg über Normbereich Bilirubin (indirekt) >1,2 mg/dl Harnsäure >5 mg/dl ab 32. SSW Kreatinin >0,9 mg/dl ≥0.3 g/24h: Präeklampsie; > 2g/24h engmaschige Überwachung notwendig Eiweiß im Urin Haptoglobin Abfall unter Normbereich D-Dimer Verlaufsbeobachtung: rapider Anstieg spricht für disseminierte intravasale Gerinnung (DIG) Fibrinogen <150 mg/dl Bei ambulanter Betreuung leichter Formen der Gestationshypertonie Kontrolle der Laborparameter mind. 1x wöchentlich; bei Überwachung in der Klinik ggf. tägliche Laborkontrollen Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 43 Labor Schottdorf MVZ GmbH Labordiagnostik neurologischer Erkrankungen Das Labor stellt neben der neurologischen Funktionsdiagnostik und bildgebenden Verfahren eine wesentliche Säule der Diagnostik neurologischer Erkrankungen dar. Laboruntersuchungen in Blut und Liquor liefern wertvolle Hinweise bei Autoimmunneuropathien und sind richtungsweisend bei Stoffwechselerkrankungen und Intoxikationen. Bei Neuropathien im Rahmen paraneoplastischer Syndrome sichert der Nachweis neuronaler Autoantikörper die Diagnose und gibt einen Hinweis auf die zugrunde liegende Tumorerkrankung. Die folgenden Tabellen geben eine Übersicht über mögliche Laboruntersuchungen bei Autoimmunneuropathien, paraneoplastischen Syndromen und Stoffwechselerkrankungen mit Beteiligung des ZNS. Material Autoantikörper: Serum Liquordiagnostik: Liquor/Serum-Paar Abnahmehinweise im Leistungsverzeichnis beachten ! Weitere Parameter: siehe Leistungsverzeichnis Autoimmunneuropathien Erkrankung Neuromyelitis optica Autoantikörper Ak gegen Myelin Oligodendrozyten Glycoprotein (MOG) und Myelin basisches Protein (MBP): Prognose- und Verlaufsparameter, zur Diagnosesicherung nicht geeignet Aquaporin 4-Ak Guillain-Barré-Syndrom Gangliosid-Ak Multiple Sklerose Myasthenia gravis Kollagenosen und Vaskulitiden mit neurologischer Beteiligung Sarkoidose Acetylcholin-Rezeptor-Ak Muskel-spezifische Tyrosinkinase (MuSK)-Ak , Titin-Ak, LRP4-Ak Antinukleäre Antikörper (ANA) mit Differenzierung, ANCA, CardiolipinAntikörper Weitere Labordiagnostik Liquor: Zellzahl/-art: gering erhöht/ mononukleäres Zellbild; intrathekale IgG-Synthese und Nachweis oligoklonaler Banden; erhöhter Antikörperindex für Masern/Röteln/Varizella Zoster Virus (MRZ-Reaktion) Ausschluss einer Multiplen Sklerose Liquor: reine Schrankenstörung mit Albuminerhöhung, meist kein wegweisender Befund BSG, CRP, grosses Blutbild, Kreatinin, IgG, IgA, IgM, Rheumafaktor, Komplementfaktoren C3 und C4, zirkulierende Immunkomplexe ACE, löslicher Interleukin 2-Rezeptor, Ausschluss einer Tuberkulose Autoimmunneuropathien bei paraneoplastischen Syndromen Einige Tumoren exprimieren Antigene, die auch in Nervenzellen auftreten. Die Immunantwort gegen diese Tumorantigene kann zur Autoimmunreaktion gegen Neuronen mit Ausbildung paraneoplastischer Syndrome führen. Diese durch Bildung neuronaler Autoantikörper gekennzeichneten Krankheitsbilder sind eng mit bestimmten Karzinomen wie Mammakarzinom oder kleinzelligem Bronchialkarzinom assoziiert. Da die neurologischen Symptome vor der Diagnose des Karzinoms auftreten können, weist ein positiver Autoantikörpertest frühzeitig auf ein okkultes Karzinom hin. Erkrankung Autoantikörper Assoziierte Tumore Gastrointestinale Anti-Hu (ANNA1) kleinzelliges Bronchialkarzinom Pseudoobstruktion Anti-Hu (ANNA1) kleinzelliges Bronchialkarzinom Hirnstamm-Enzephalitis Anti-Ma2 Seminom Anti-PCA2 kleinzelliges Bronchialkarzinom Anti-Hu (ANNA1) kleinzelliges Bronchialkarzinom Anti-Yo (PCA1) Ovarialkarzinom, Mammakarzinom, kleinzelliges Bronchialkarzinom Kleinhirndegeneration Anti-Tr M. Hodgkin Anti-CV2 (CRMP5) Thymom, Hodenkarzinom, kleinzelliges Bronchialkarzinom Lambert-Eaton-Syndrom Kalzium-Kanal-Ak kleinzelliges Bronchialkarzinom Anti-Hu (ANNA1) kleinzelliges Bronchialkarzinom Limbische Enzephalitis Anti-Ma2 Seminom Anti-PCA2 kleinzelliges Bronchialkarzinom Neuropathie bei IgMAk gegen Myelin-assoziiertes M. Waldenström Gammopathie Glykoprotein (MAG) Opsoklonus-MyoklonusAnti-Ri (ANNA2) Mammakarzinom Syndrom Anti-Hu (ANNA1) kleinzelliges Bronchialkarzinom Sensorische Neuropathie ANNA3 kleinzelliges Bronchialkarzinom Anti-CV2 (CRMP5) Thymom, Hodenkarzinom, kleinzelliges Bronchialkarzinom Anti-GAD kleinzelliges Bronchialkarzinom, Mammakarzinom Stiff-Man-Syndrom Anti-Amphiphysin kleinzelliges Bronchialkarzinom, Mammakarzinom Limbische Enzephalitis Anti-AMPA-Rezeptoren Mamma, Thymom, Bronchial-Karzinom Anti-Glutamat-Rezeptor Anti-NMDA-Rezeptoren Teratome (Typ NMDA)-Enzephalitis Stoffwechselerkrankungen/ Intoxikationen Erkrankung Vitamin B12-Mangel Diabetes mellitus Leberzirrhose Porphyrien Schwermetallintoxikationen Morbus Wilson Labordiagnostik Vitamin B12, Holotranscobalamin, Intrinsic-Faktor-Ak, Parietalzell-Ak Blutzucker, HbA1c Ammoniak, Cholinesterase, Quick, Gerinnungsfaktor VII, Albumin Delta-Aminolävulinsäure, Porphobilinogen und Porphyrine im 24h-Sammelurin, Porphyrine im Plasma Quecksilber-/Cadmiumintoxikation: Bestimmung im EDTA-Blut und im Urin; Bleivergiftung: kleines Blutbild, Blei im EDTA-Blut, Delta-Aminolävulinsäure im Urin Coeruloplasmin, Kupfer im Urin, Mutationsanalyse des ATP7B-Gens Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 45 Labor Schottdorf MVZ GmbH Antioxidantien Freie Radikale und ROS (Oxidantien), Oxidativer Stress Einführung Freie Radikale als Untergruppe reaktiver Sauerstoffverbindungen (ROS) sind chemisch extrem aggressiv, da sie ihr gesamtes Energiepotential augenblicklich und irreversibel freisetzen und dabei Struktur und Funktion von Proteinen, Fetten und Nukleinsäuren (DNA!) etc. schädigen können. Antioxidantien schützen als starke Reduktionsmittel vor unerwünschten Wirkungen freier Radikale. Freie Radikale sind im Menschen nicht direkt messbar. Zur Abschätzung der Belastung mit freien Radikalen werden daher ihre Reaktionsprodukte und verschiedene Antioxidantien bestimmt. Physiologie und Pathophysiologie Labordiagnostik Indikation Oxidative Belastung Antioxidative Kapazität Malondialdehyd oxLDL Endogene Antioxidantien Glutathion-Peroxidase Glutathion-Reduktase Glucose-6-PDH Superoxiddismutase Exogene Antioxidantien Beta-Carotin Vitamin C (Ascorbinsäure) Vitamin E (-Tocopherol) Selen Glutathion Coenzym Q10 Reaktiver Sauerstoff entsteht u. a. in Mitochondrien bei der Atmungskette, in Phagozyten bei Infektabwehr und Entzündung sowie in ischämischem Gewebe. Wirkung freier Radikale Lipidperoxidation, Enzymdenaturierung, Kollagendepolymerisation, Zerstörung von Leukozyten und Erythrozyten. Aber auch: Gefäßpermeabilitätserhöhung, Bildung leukotaktischer Faktoren und Mitwirkung bei der Abtötung von Erregern. Oxidativer Stress, also die erhöhte Belastung mit freien Radikalen, wird in Verbindung gebracht mit der Entstehung von Atherosklerose, Herz- und Gefäßerkrankungen, Katarakt, Karzinomen von Lunge, Zervix, Haut, Ösophagus, Magen, Darm und Prostata sowie Hautalterung und abnehmender Leistungsfähigkeit. Zu oxidativem Stress führen u. a. Pestizide, Medikamente, Luftverschmutzung, Zigarettenrauch, ionisierende Strahlung, Stress oder ein Übermaß an sportlicher Aktivität. Zur Prophylaxe wird derzeit eine an Antioxidantien reiche Kost bzw. deren planmäßige Substitution diskutiert. Bei Patienten mit einseitiger Ernährung oder Malabsorption, z. B. nach Gastrektomie, chron. atrophischer Gastritis, chron. Enteritis, Darmteilresektion und Fettmalabsorption sind verminderte Konzentrationen exogener Antioxidantien zu erwarten. Beispiele für freie Radikale und ROS OH˙ Hydroxyl-Radikal Entstehung u. a. durch energiereiche Strahlung und in entzündetem Gewebe. Es ist davon auszugehen, dass OH˙ sehr effektiv biologische Strukturen schädigt, da die Entgiftungsmechanismen nicht mit der extrem schnellen Reaktion konkurrieren können. O2˙¯ Superoxid-Radikal Entstehung u. a. in mitochondrialer Atmungskette, in Phagozyten und Endothelzellen bei NADPH-Oxidase-Reaktion, bei Oxidation von Fe2+ zu Fe3+ im Hämoglobin, aus Wasser durch ionisierende Strahlen. Vermehrt bei Xenobiotika wie z. B. Paraquat. Primärprodukt für weitere toxische Metaboliten. Abgabe in Extrazellulärraum bei Phagozytose als „oxidative burst“. Inaktivierung durch die Superoxiddismutase. H2O2 Peroxid Entstehung u. a. als Nebenprodukt z. B. der Monoaminoxidase, Uratoxidase oder indirekt aus O2 durch Dismutation, katalysiert durch Superoxiddismutasen. „Entgiftung“ durch Glutathion-Peroxidase und Katalase. Organische Hydroperoxide Entstehung bei Peroxidation ungesättigter Fettsäuren aus Membranlipiden bei Oxidantienbelastung, Zerfall in Aldehyde wie z. B. Malondialdehyd. Parameter Basisuntersuchung Material Serum gefr. Serum gefr. Serum gefr. EDTA-Blut EDTA-Blut EDTA-Blut EDTA-Blut Serum lichtges. Serum gefr. Serum Serum, EDTA-Blut EDTA-Blut gefr. Serum Information zu Laborparametern Antioxidative Kapazität Messung der extrazellulären antioxidativen Kapazität u. a. von Plasmaproteinen, Harnsäure, Vitamin-C und -E. Zu unterscheiden vom mit Elektroden zu messenden Redox-Potential. Malondialdehyd (MDA), oxidiertes LDL (oxLDL) MDA und oxLDL sind Indikatoren der Lipidperoxidation, für oxidativen Stress und u.a. für ein erhöhtes kardiovaskuläres Risiko. Glutathion-Peroxidase, -Reduktase, Selen Glutathion-Peroxidase mit dem katalytischen Zentrum Selen schützt Biomoleküle durch Oxidation von Glutathion, wobei z. B. H2O2 und andere Peroxide reduziert werden. Glutathion-Reduktase regeneriert das dabei oxidierte Glutathion unter Verbrauch von NADPH. Glukose-6-Phosphat-Dehydrogenase (G-6-PDH) regeneriert NADPH. Bei oxidativem Stress oder Enzymmangel z. B. von G6-PDH kommt es u. a. zur Glutathion-Verarmung der Erythrozyten, vermehrtem Anfall von Met-Hb und Zersetzung von H2O2 in hochaggressives OH˙ und OH˙. Superoxiddismutase (SOD) Enzymgruppe, Katalysator der Umsetzung von Superoxid-, Peroxidradikalen. Kupfer-Zink-haltige SOD in Erythrozyten, Manganhaltige SOD in Mitochondrien. Beta-Carotin Vitamin A-Vorläufer; Beteiligung am Sehvorgang, Wachstum, Entwicklung von Epithelgewebe, Reproduktion (Spermatogenese, Plazenta, Fetalentwicklung), Testosteronproduktion. Zur Abschätzung einer Fettmalabsorption. Antioxidans in vitro für Singulett-Sauerstoff. Vitamin C (Ascorbinsäure) Redox-System (regeneriert Vitamin E) sowie starkes Reduktionsmittel. Beteiligt u. a. bei Kollagen-, Carnitin-, Katecholamin-, Tetrahydrofolsäure- und Steroidhormonsynthese. Erhöht die Bioverfügbarkeit von endogenem NO und beeinflusst das Immunsystem. Vitamin E (-Tocopherol; weitere Tocopherole und -trienole) Redoxsystem und Antioxidans im lipophilen Milieu. Schützt das Gefäßendothel und wirkt stark entzündungshemmend. Coenzym Q10 (Ubichinon / Ubichinol) Wichtiges körpereigenes lipophiles Antioxidans mit membranstabilisierendem Effekt (bei Herzrhythmusstörungen) sowie zentraler Funktion in der mitochondrialen Atmungskette. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 46 Multiresistente gramnegative Stäbchen Epidemiologie In den letzten 10 Jahren wurde ein deutlicher Anstieg der βLaktam-Resistenz, insbesondere der Resistenz gegen Cephalosporine der 3. und 4. Generation und der Resistenz gegen Carbapeneme, bei gramnegativen Infektionserregern beobachtet. Im Jahr 2000 lag der Anteil an Cefotaximresistenten Escherichia coli bei unter 1%, heute liegt er zwischen 5 und 12%. Resistenzmechanismen β-Laktamasen sind bakterielle Enzyme, die durch hydrolytische Spaltung den β-Laktamring zerstören. In den 1960er Jahren wurden β-Laktamasen (z. B. TEM-1 oder SHV-1) beschrieben, die Penicilline und SchmalspektrumCephalosporine hydrolysieren können. Punktmutationen führten zur Erweiterung des Substratspektrums der βLaktamasen. Diese sog. Extended-Spectrum-β-Laktamasen (ESBL) können 3. und 4. Generations-Cephalosporine sowie Aztreonam hydrolysieren. In Deutschland ist die vorherrschende Enzymklasse die CTX-M ESBL in E. coli und K. pneumonie Isolaten. Carbapenemasen sind Enzyme, die Carbapeneme (z. B. Meropenem, Ertapenem) und auch fast alle anderen βLaktam-Antibiotika zerstören können. In Deutschland dominieren Enterobacteriaceae mit den Carbapenemasen OXA48, gefolgt von KPC und VIM1; NDM-1 ist noch selten. ESBL- und Carbapenemase-Gene liegen meist auf Plasmiden, die leicht innerhalb einer Spezies und zwischen verschiedenen Spezies übertragen werden können. Weitere Mechanismen, die eine Resistenz gegen 3. Generations-Cephalosporine vermitteln, sind die Überexpression einer chromosomal kodierten AmpC-β-Laktamase oder eine erworbenen AmpC-β-Laktamase. Eine Resistenz gegen Carbapeneme kann auch über einen verminderten Influx durch Porinverlust oder eine Überexpression von Effluxpumpen vermittelt werden. Einteilung der KRINKO Die Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut hat eine rein phänotypische Klassifizierung multiresistenter gramnegativer Stäbchen (MRGN) vorgenommen, da die zugrunde liegenden Resistenzgene sehr vielfältig sind. Für die Beurteilung werden Antibiotika (Acylureidopenicilline, 3./4. GenerationsCephalosporine, Carbapeneme, Fluorchinolone) betrachtet, die als primär bakterizide Therapeutika bei schweren Infektionen eingesetzt werden und deren Wirkungsverlust eine hohe klinische Relevanz hat. Leitsubstanz Enterobakterien Pseudomonas aeruginosa 3 MRGN 4 MRGN 3 MRGN Piperacillin R R Cefotaxim und/oder Ceftazidim R R Imipenem und/oder Meropenem S Ciprofloxacin R Acinetobacter baumanii- complex 4 MRGN 3 MRGN 4 MRGN R R R R R R R R S R R R R R Nur eine der Antibiotikagruppen wirksam. Die Leiter von Krankenhäusern und von Einrichtungen für ambulantes Operieren müssen nach § 23 IfSG das Auftreten von Krankheitserregern mit speziellen Resistenzen und Multiresistenzen fortlaufend aufzeichnen, bewerten und sachgerechte Schlussfolgerungen hinsichtlich erforderlicher Präventionsmaßnahmen daraus ziehen. Hygieneempfehlungen Im Krankenhaus sind für 3 MRGN in Risikobereichen, in denen Patienten mit erhöhter Infektionsgefahr gepflegt werden, Maßnahmen zur Prävention festzulegen und durchzuführen, zum Schutz der nicht besiedelten Patienten. Für 4 MRGN sind aufgrund der limitierten therapeutischen Möglichkeiten Maßnahmen zur Prävention für alle Krankenhausbereiche festzulegen und durchzuführen. Zur Infektionsprävention im ambulanten Bereich sind bei Nachweis von multiresistenten Erregern die konsequent eingehaltenen Standard-Hygienemaßnahmen als Basis in der Regel ausreichend, um die Erregerübertragung zu vermeiden. Bei direktem Patientenkontakt ist das Tragen persönlicher Schutzausrüstung erforderlich (geschlossene, langärmelige Einmalschutzkittel, Einmalhandschuhe). Diagnostische Möglichkeiten Die phänotypische ESBL-Testung wird für Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca und Proteus mirabilis durchgeführt. Für diese Erreger stehen Interpretationskriterien der CLSI zur Verfügung. Phänotypische Untersuchungen auf Carbapenemase-Bildung werden mittels modifiziertem Hodge-Test, EDTA-Test und Borsäure-Test durchgeführt. Phänotypisch positive Ergebnisse werden vom NRZ für gramnegative Krankenhauserreger innerhalb von Studien molekulargenetisch weiter untersucht. Screening Als Screeningmaterial werden Rektalabstriche ggf. zusätzlich Urin und Abstriche von chronischen Wunden eingesetzt, bei Pseudomonas aeruginosa zusätzlich Rachenabstriche, bei Acinetobacter baumanii-complex Mund-Rachenabstriche und großflächige Hautabstriche. Allerdings sind bisher keine Verfahren zum Nachweis von 3 MRGN und 4 MRGN validiert. Bei einer aktiven Surveillance sollen Patienten mit Risiko für eine Besiedelung oder Infektion mit 4 MRGN gescreent und bis zum Vorliegen der Ergebnisse isoliert werden. Als Risikopatienten gelten Patienten mit kürzlichem Kontakt zum Gesundheitssystem in Ländern mit endemischem Auftreten und Patienten, die zu 4 MRGN positiven Patienten Kontakt hatten, d. h. im gleichen Zimmer gepflegt wurden. Eradikation Der Versuch einer Eradikation wird derzeit nicht empfohlen. Therapeutische Optionen bei Infektionen Für die Therapie einer Infektion mit 3 MRGN steht Meropenem/Imipenem zur Verfügung. Die Therapie einer Infektion mit 4 MRGN ist mit einzelnen Reserveantibiotika (z. B. Aminoglykoside, Tigecyclin, Colistin, Polymyxin B) je nach Vorliegen weiterer Resistenzen sehr eingeschränkt möglich. Meldepflicht Nach § 6 (3) IfSG ist dem Gesundheitsamt unverzüglich das gehäufte Auftreten nosokomialer Infektionen, bei denen ein epidemischer Zusammenhang wahrscheinlich ist oder vermutet wird, als Ausbruch nicht namentlich zu melden. Für den Nachweis von Carbapenmasen existieren länderspezifsche Meldepflichten in Hessen und Sachsen von Seiten des Labors. Literatur: Bundesgesundheitsblatt (2012) 55: 1311-1354 Bundesgesundheitsblatt (2012) 55: 1401-1404 Bundesgesundheitsblatt (2012) 55: 1405-1409 Bundesgesundheitsblatt (2005) 48: 1061-1080 Leitfaden zu Organisation und Hygienemanagement in der Arztpraxis, Deutsche Gesellschaft für Krankenhaushygiene 01.03.2013 Epidemiologisches Bulletin 13. Mai 2013, Nr. 19 Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 02 2014 Laborinformation Nr. 47 Malaria-Diagnostik Erreger Plasmodium falciparum Plasmodium knowlesi Plasmodium vivax, ovale Plasmodium malariae Erkrankung Malaria tropica wie Malaria tropica Malaria tertiana Malaria quartana Epidemiologie Häufigste und gefährlichste importierte Tropenkrankheit. Die Plasmodien werden durch Mücken der Gattung Anopheles übertragen. Jährlich etwa 500-600 gemeldete Fälle in Deutschland. Ca. 50% der Fälle betreffen Touristen und Geschäftsreisende, die anderen 50% Einwanderer aus Endemiegebieten und sog. „VFRs“ (visiting friends and relatives). Ca. 70% der in Deutschland diagnostizierten Malariafälle waren durch P. falciparum, weitere 20% durch P. vivax verursacht. Afrika ist das wichtigste Infektionsgebiet (Ursprung für 80% aller Erkrankungen), gefolgt von Asien (10%) und Mittel- und Südamerika (5%). Bei 60% der erkrankten Patienten erfolgte keine oder nur eine unzureichende Chemoprophylaxe. In Deutschland verlaufen ca. 2-3% der Erkrankungen tödlich; Hauptursache ist fast immer zu spät eingeleitete Diagnostik und Therapie! Reiseanamnese Aufenthaltsorte, Reisedauer, Rückflugroute, Datum der Rückkehr. Prophylaxe: Art, Dauer und Dosierung unter Beachtung der aktuellen Resistenzsituation im Reisegebiet. Informationen können bei der Deutschen Gesellschaft für Tropenmedizin und Internationale Gesundheit e.V. (DTG) unter www.dtg.mwn.de abgerufen werden. Selten sind Bewohner in der Umgebung von internationalen Flughäfen betroffen (Airport- und Baggage-Malaria). Eine Übertragung durch Bluttransfusionen oder Nadelstichverletzungen wurde in Deutschland in den letzten Jahren nicht gemeldet. Klinischer Verdacht Bei Patienten mit unklaren Beschwerden nach Aufenthalt in Malariagebieten. Minimale Inkubationszeit: P. falciparum und P. knowlesi: 7 Tage, P. vivax und P. ovale: 12 Tage, P. malariae: 18 Tage. Längere Inkubationszeiten sind bei allen Formen möglich. Durch die Bildung von Ruheformen (P. vivax und ovale) können Rezidive noch nach Jahren auftreten, Infektionen mit P. malariae können (auch ohne Fieber) chronisch verlaufen. Bei jedem fieberhaften Infekt auch längere Zeit nach Aufenthalt in Endemiegebieten und trotz durchgeführter Chemoprophylaxe muss eine Malaria differentialdiagnostisch in Betracht gezogen werden! Jedes Fieber nach Tropenaufenthalt gilt solange als malariaverdächtig (und somit abklärungswürdig) bis das Gegenteil bewiesen ist (→ wiederholte Blutuntersuchungen)! Klinik Müdigkeit, Abgeschlagenheit, Fieber, Schüttelfrost. Typischer Fieberverlauf nur bei Malaria tertiana oder quartana, jedoch nicht bei Malaria tropica! Kopf-, Glieder-, Muskelschmerzen, Diarrhoe, gastrointestinale Beschwerden, Ikterus, Hepatosplenomegalie. Basisdiagnostik Großes Blutbild; CRP Hämolyseparameter: LDH, Bilirubin, Haptoglobin; bei Leberbeteiligung: GOT, GPT Erregernachweise 1. Malaria „Dicker Tropfen“ und Blutausstrich Standardmethode der Malariadiagnostik. Dicker Tropfen: einen Tropfen Blut auf etwa Daumennagelgröße auf einem fettfreien Objektträger verteilen. Bei korrekter Ausführung ist die Schrift einer untergelegten Zeitung gerade noch lesbar. 30 min lufttrocknen lassen. Blutausstrich: wie für Differentialblutbild. Bitte 2 „dicke Tropfen“ und 2 Blutausstriche einsenden. Bei positivem „dicken Tropfen“ ist im Ausstrich die Differenzierung der Plasmodien und die Abschätzung der Erregerdichte möglich. 2. Malaria-Schnellteste Fluoreszensmikroskopischer Parasitennachweis („QBC-Methode“) oder immunologischer Antigennachweis („Schnelltest“) aus dem EDTA-Blut. Schnellteste in erster Linie für die Sofortdiagnostik (POCT) in der Praxis oder auf Auslandsreisen einsetzen. Bei negativem Ergebnis eines Schnelltestes Mikroskopie des Dicken Tropfens bzw. des Blutausstrichs immer zusätzlich durchführen! Alle Erregernachweise der Malaria können in Abhängigkeit vom Zeitpunkt der Entnahme (z. B. außerhalb des Fieberschubs, anbehandelte und chronische Fälle) falsch negativ ausfallen, Es empfiehlt sich, bei negativem Ergebnis die Diagnostik solange zu wiederholen, wie klinisch ein Krankheitsverdacht besteht. Wichtig: bereits gleichzeitig Differentialdiagnosen prüfen: Abnahme von Harn-, Stuhl- und Blutkulturen, VirusSerologie! Malaria-Antikörpernachweis Indikation: - Nachweis eines stattgehabten Malariakontaktes nach nichtgesicherter Diagnose (z.B. zwecks Blutspende-Ausschluss nach angeblicher Malaria). - Zusatztest zum Ausschluss chronischer Verläufe einer Malaria tertiana oder quartana (Bestimmung von Antikörpern gegen P. fieldii und P. malariae gesondert anfordern) Der Antikörper-Nachweis ist zur Diagnose einer akuten Infektion nicht geeignet! Anforderung und Material Material als „eilig“ kennzeichnen! Wir bitten um Angabe einer Telefonnummer, um Ihnen ggf. außerhalb der Praxisöffnungszeiten einen positiven Befund übermitteln zu können. 1. Malaria-Erreger-Direktnachweis „Dicker Tropfen“: luftgetrocknet auf 2 Objektträgern Blut-Ausstrich: luftgetrocknet auf 2 Objektträgern Bei Bedarf werden „Dicke Tropfen“ und Ausstriche im Labor angefertigt. Bitte immer auch EDTA-Blut einsenden! Malaria QBC-Test Malaria Schnelltest 3 ml EDTA-Blut 3 ml EDTA-Blut 2. Malaria-Antikörper 2 ml Serum Bei dringendem Malariaverdacht und absehbarer Verzögerung der Diagnostik (z.B. Probentransport) stellt der sofortige Beginn einer geeigneten Therapie = N(S)M (Notfall(selbst)medikation) eine überlegenswerte und u.U. lebensrettende Option dar. Geeignete Medikamente bzw. Therapieschemata können ebenfalls über die Homepage der DTG unter www.dtg.mwn.de abgerufen werden. Mittel der ersten Wahl bei unkomplizierter M. tropica sind laut WHO Artemisinin-basierte Kombinationspräparate. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 48 Dermatophyten Onychomykose Tinea der freien Haut Erreger Dermatophyten, wie z. B.: Trichophyton rubrum (häufig) Trichophyton interdigitale Epidermophyton floccosum Microsporum spp. Schimmelpilze, wie z. B.: Scopulariopsis brevicaulis Aspergillus spp. Hefepilze (Candida spp.) Dermatophyten, wie z. B.: Trichophyton rubrum (häufig) Trichophyton interdigitale Trichophyton mentagrophytes Microsporum canis Epidermophyton floccosum Untersuchungsmaterial Nagelgeschabsel Hautschuppen Materialgewinnung ⇒ frühestens 2, besser 4 Wochen nach 1 antimykotischer Lokalbehandlung ⇒ leicht ablösbare, bröckelige Nagelteile entfernen und verwerfen ⇒ Nagel mit 70%igem Alkohol desinfizieren (Reinigung von Anflugkeimen und Bak-terienflora) ⇒ Materialentnahme am Übergang von krankem zu gesundem Nagel ⇒ mit Skalpell, scharfem Löffel oder Nagelfräse reichlich feine Nagelspäne aus tieferen Schichten gewinnen ⇒ Material in sterilem Gefäß auffangen ⇒ für jeden Nagel frisches, steriles Instrument verwenden ⇒ keine ganzen Nägel oder mit der Schere abgeschnittenen Nagelteile einschicken ⇒ Entnahmestelle mit 70%igem Alkohol desinfizieren ⇒ Materialentnahme aus dem Randbereich der Läsion, da die Infektion im Zentrum bereits abheilt ⇒ mit Skalpell, Holzspatel oder scharfem Löffel reichlich kleine Schüppchen (40-50) abkratzen und in sterilem Gefäß auffangen ⇒ auf Einsendung größerer Hautfetzen wegen der Möglichkeit der Kontamination mit Umweltkeimen verzichten Diagnostik KOH-Präparat: Durch Behandlung mit Kalilauge werden körpereigene Zellen aufgelöst, während Pilzelemente nicht angegriffen werden und anschließend mikroskopisch nachgewiesen werden können. Dermatophytenkultur: Anzucht auf Spezialnährmedien. Gesamtbebrütungsdauer der Kulturen bis zu 4 Wochen. Therapie Lokalbehandlung: ⇒ bei Leukonychia trichophytica oder distalem subungualem Befall von maximal 1/3 des Nagels ⇒ Nagellacke mit Amorolfin oder Ciclopirox Lokalbehandlung: ⇒ i.d.R. ist eine Lokalbehandlung mit einem Azol (z.B. Clotrimazol), Ciclopiroxolamin, Terbinafin u.a. ausreichend ⇒ Auswahl des Antimykotikums nach Lokali2 sation und Ausprägung Systemische Therapie (Erwachsene): ⇒ Terbinafin (bei Hefen nicht empfohlen), Itraconazol, Fluconazol Systemische Therapie (Erwachsene): ⇒ bei Versagen der Lokalbehandlung, großer Ausdehnung oder hyperkeratotischer 2 Tinea manuum oder pedis ⇒ Einsatz von Itraconazol oder Terbinafin Adjuvante Behandlung: ⇒ für die Kombination von systemischer Therapie mit der vorausgehenden atraumatischen Ablösung Pilz-befallener Nagelanteile mittels Harnstoff-haltiger Salben (20-40% Harnstoff) fanden sich höhere Heilungsraten als bei alleiniger 1 systemischer Therapie ⇒ die Kombination von Terbinafin mit Amorolfin- oder Ciclopirox-haltigen Nagellacken war der Monotherapie mit 1 Terbinafin überlegen ⇒ Nagelextraktion nicht indiziert Quellen: 1 S1-Leitlinie „Onychomykose“ 2 S1-Leitlinie „Tinea der freien Haut“ Die in diesem Infoblatt aufgeführten Therapie-Empfehlungen können das Studium der jeweils aktuellsten Leitlinien sowie der Fachinformationen der Arzneimittelhersteller nicht ersetzen! Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 05 2013 Laborinformation Nr. 49 Bestimmung der Blutungszeit Die Bestimmung der Blutungszeit ist eine einfache, aber wichtige Orientierungsmethode für die Funktion der primären Hämostase. Dazu zählen die Thrombozyten und ein fein abgestimmtes und kompliziertes System aus Gerinnungsfaktoren des Blutes und des Gewebes, die bei Funktionseinbußen oder Verminderungen Störungen der primären Blutungsstillung verursachen können. Eine Kontrolle der Blutungszeit ist besonders vor operativen Eingriffen und bei einer Therapie mit gerinnungshemmenden Medikamenten (z. B. ASS) wichtig. Zur Bestimmung der Blutungszeit in der Arztpraxis gibt es mehrere Methoden: Blutungszeit nach Ivy Methode: An der Innenseite des Unterarmes, an einer Stelle ohne oberflächliche Venen, Narben usw., wird nach entsprechender Desinfektion mit einem vollautomatischen Schneideinstrument (z. B. Surgicutt®, Firma Loxo) ein Schnitt von definierter Länge und Tiefe gesetzt ohne ein sichtbares Gefäß zu verletzen. Während des Vorgangs wird am Oberarm mit einer Blutdruckmanschette ein Druck von 40 mm Hg aufrechterhalten, um den Gewebsdruck so gut wie möglich zu standardisieren. Ohne die Bildung des hämostatischen Pfropfes zu stören, wird das hervorquellende Blut mittels Filterpapier alle 30 Sekunden entfernt. Die Zeitspanne zwischen dem Setzen der Wunde und Eintritt der Blutstillung entspricht der Blutungszeit. Referenzbereich: bis 5 Minuten Blutungszeit nach Duke Methode: Messung der Zeit nach Einstich in den Ohrläppchenrand mit einer Lanzette ca. 3 mm tief, alle 15 Sekunden absaugen des austretenden Bluttropfens mit Filterpapier ohne Berührung des Wundrandes. Referenzbereich: 3 bis 5 Minuten Blutungszeit subaqual nach Marx Methode: Messung der Blutungszeit nach Lanzettenstichverletzung in der Fingerbeere und Eintauchen in ein wassergefülltes Kolbenglas (37 Grad Celsius) bis zum Blutungsstillstand. Referenzbereich: bis 2 Minuten Beurteilung: Eine verlängerte Blutungszeit wird bei hämorrhagischen Diathesen, Thrombozytopenien mit Werten < 100/nl, Thrombozytenfunktionsstörungen (Thrombopathien), Einnahme aggregationshemmender Substanzen und von Willebrand-Jürgens-Syndrom gefunden. Die Blutungszeit wird durch andere Erkrankungen, wie z.B. Urämie, Dysproteinämien, schwere Hypo- bis Afibrinogenämien und Medikamenteneinnahmen (Acetylsalicylsäure, nichtsteroidale Antirheumatika, hohe Heparindosen) beeinflusst. Bei ausschließlich plasmatischen Gerinnungsstörungen ist die Blutungszeit normal! Eine stark verlängerte Blutungszeit zeigt immer eine bedrohliche Blutungsneigung an. Abrechnung: nach EBM Ziffer 32110 – Blutungszeit (standardisiert) Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 50 Abschätzung der GFR Relative GFR bzw. eGFR (estimated) Formeln Basieren auf Kreatinin oder Cystatin C und beziehen sich auf einen Normpatienten mit einer Körperoberfläche von 1.73 m². Sie dienen der Stadieneinteilung einer chronischen Nierenerkrankung (CKD). Zur korrekten Dosierung eines Medikamentes sollten diese Formeln auf die Körperoberfläche des Patienten umgerechnet werden. eGFR Kreatinin Formeln Erwachsene alt Erwachsene neu MDRD-Formel (2000): Kreatinin, Alter, Geschlecht, Rasse [Faktor x 1.21 wenn schwarz] ● ungenau für Werte > 60 ml/min (berechneter Wert zu niedrig) ● ungeeignet für Diabetes mellitus Patienten ● ungenau für ältere Patienten ● Jaffé Methode (Kreatininbestimmung) MDRD-Formel erweitert (1999): Kreatinin, Harnstoff, Albumin, Alter, Geschlecht, Rasse* [Faktor x 1.18 wenn schwarz] ● laut neueren Studienergebnissen keine Vorteile gegenüber MDRD-Formel Kinder alt Schwartz (1976): Kreatinin, Körpergröße, Korrekturfaktor ● relativ ungenau ● Jaffé Methode (Kreatininbestimmung) CKD-EPI-Formel (2010): Kreatinin, Alter, Geschlecht, Rasse [Faktor x 1.16 wenn schwarz] ● bei Werten > 60 ml/min der MDRD-Formel überlegen ● für Diabetes mellitus Patienten geeignet ● genauer für ältere Patienten ● enzymatische Kreatininbestimmung Kinder neu Schwartz (2009-einfach): Kreatinin, Körpergröße ● relativ ungenau ● enzymatische Kreatininbestimmung Fehlerquellen und Probleme: ● Kreatinin-blinder Bereich: Kreatininanstieg erst bei einer Einschränkung der Nierenfunktion von ca. 50 % Berechneter GFR-Wert zu niedrig Berechneter GFR-Wert zu hoch Sehr hohe Muskelmasse Sehr geringe Muskelmasse Verzehr von gekochtem Fleisch vor Blutentnahme Hyperthyreose ( Abfall Serumkreatinin) eGFR Cystatin C Formeln Erwachsene alt Cystatin C nach Grubb: Cystatin C • fehlende Standardisierung Vorteile: • • • Erwachsene neu CKD-EPI-Cystatin-C-Formel: Cystatin C, Alter, Geschlecht • auf das IFCC Referenzmaterial standardisiert erkennt Nierenfunktionseinschränkungen im Kreatinin-blinden Bereich unabhängig von Muskelmasse und Rasse stabile Synthese von Cystatin C, freie glomeruläre Filtration, keine tubuläre Sekretion oder Rückresorption Fehlerquellen und Probleme: Berechneter GFR-Wert zu niedrig Hyperthyreose (Cystatin C erhöht) Berechneter GFR-Wert zu hoch Hypothyreose (Cystatin C vermindert) Hohe Glukokortikoiddosen bei CKD Zur Dosierung eines Medikamentes müssen relative eGFR Werte umgerechnet werden. Hierzu muss der vorhandene Wert mit der Körperoberfläche des Patienten multipliziert und durch 1.73 m² (Körperoberfläche des Standardmenschen) geteilt werden. Formeln, die versuchen die tatsächliche (absolute) GFR abzuschätzen Diese Werte werden zur korrekten Dosierung eines Medikamentes benötigt. Kreatinin-Clearance absolut: Kreatinin, Urin-Kreatinin, 24 h Sammelurin • häufig Sammelfehler bei 24 h Sammelurin • ungeeignet bei Serumkreatininwerten > 2-3 mg/dl, Proteinurie > 3 g/24 h und schwerer Herzinsuffizienz • bildet den Kreatinin-blinden Bereich geringfügig besser ab, als einfache Kreatininbestimmung • geeignet zur Verlaufskontrolle Zur Bewertung der Nierenfunktion im Sinne einer chronischen Nierenerkrankung muss eine Normierung auf eine KOF von 1.73 m² erfolgen. Hierzu wird der der absolute Wert mit 1.73 m² multipliziert und durch die Körperoberfläche des Patienten geteilt. Cockcroft-Gault-Formel: Kreatinin, Alter, Geschlecht, Gewicht • schätzt die Kreatinin-Clearance ab • 30-jährige Erfahrung (basiert allerdings auf veralteten Kreatinin-assays) Anmerkung: Die Einheit der GFR ist ml/min. Die häufig gefundene Einheit ml/min/1.73 m² ist unglücklich gewählt und soll den Bezug auf den Standardmenschen verdeutlichen. Sie ist nicht mathematisch zu verstehen. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 06 2014 Laborinformation Nr. 51 MRSA Was ist ein MRSA? MRSA steht für Methicillin resistenter Staphylococcus aureus. Die Methicillinresistenz von S. aureus ist auf das sogenannte mecA-Gen zurückzuführen, das für ein zusätzliches Penicillinbindeprotein (PBP2a) codiert. Dieser Mechanismus bedingt nicht nur eine Resistenz gegenüber den Penicillinen sondern gegenüber allen Betalaktam-Antibiotika inklusive der Cephalosporine und Carbapeneme. Zusätzlich bilden diese Stämme häufig weitere Resistenzen gegen Ciprofloxacin, Makrolide und Clindamycin aus. Der Anteil an MRSA bei S. aureus aus klinisch relevantem Untersuchungsgut in Deutschland ist in den letzten Jahrzehnten auf ca. 20% angestiegen und hat sich in den letzten Jahren auf diesem Niveau stabilisiert. Wer ist betroffen? MRSA kommt als Besiedler von Haut und Schleimhäuten sowie als Erreger von nosokomialen Infektionen weltweit vor. Die Besiedlung mit MRSA betrifft überwiegend hospitalisierte Patienten (hospital acquired MRSA, HA-MRSA) sowie Bewohner von Alten- und Pflegeheimen (Besiedlungsrate in Deutschland zwischen 0 - 3% der Bewohner). Risikofaktoren für eine MRSA Besiedlung sind eine positive MRSA-Anamnese, Herkunft aus Risikoeinrichtungen oder -ländern, antibiotische Therapie, chronische Pflege, Katheterisierung, Dialysepflicht, Hautläsionen, Kontaktperson von MRSA-Trägern, beruflicher Kontakt zu Tieren in der Landwirtschaft. Die Prävalenz bei der gesunden Bevölkerung in Deutschland ist gering. Hauptorte für eine Besiedlung sind die Nasenvorhöfe, Rachen und Wunden. Was bedeutet CA-MRSA? In den letzten Jahren sind unabhängig von Krankenhausaufenthalten vermehrt Infektionen mit besonderen MRSA Stämmen aufgetreten die community acquired MRSA (CA-MRSA) genannt werden. Diese Stämme verursachen tiefe nekrotisierende Hautund Weichteilinfektionen (z.B. Furunkulose) bei ansonsten gesunden Personen. Selten kommt es zu einer letal verlaufenden nekrotisierenden Pneumonie. Die Fähigkeit der CA-MRSA Stämme schwere Infektionen auszulösen wird mit der Bildung des Pathogenitätsfaktors PVL (Panton-Valentin-Leukozidin) assoziiert der mittels PCR (lukS-lukF Gen) nachgewiesen werden kann. Im Gegensatz zu den HA-MRSA Stämmen besitzen die CA-MRSA Stämme seltener weitere assoziierte Resistenzen. Assoziierte Resistenzen von MRSA (NRZ für Staphylokokken, RKI, Wernigerode 2011) Oxacillin Ciprofloxacin Moxifloxacin Erythromycin Clindamycin Gentamicin Tetracyclin Rifampicin Cotrimoxazol Fusidinsäure Fosfomycin Linezolid Tigecyclin Daptomycin Mupirocin Vancomycin HAMRSA CAMRSA 100% 93% 91,3% 64,3% 59,9% 4,4% 4,6% 1,7% 0,7% 2,7% 0,4% 0% 0% 2,1% 6,6% 0% 100% 21,6% 17,6% 38,4% 9,6% 13,6% 34,4% 0,8% 0% 13,6% Labordiagnostik Bei medizinischer Indikation (nach Abschnitt 32.3 EBM) Die Labordiagnostik beinhaltet die kulturelle Erregeranzucht mit biochemisch gesicherter Speziesdiagnose sowie einwandfrei nachgewiesener Oxacillin-Resistenz. Bei Bedarf kann ein Antibiogramm inklusive Reserveantibiotika erstellt werden. Bei V.a. Vancomycin-Resistenz (VISA, VRSA) kann die MHK für Vancomycin bestimmt werden. Bitte kennzeichnen Sie den Anforderungsschein mit der Indikation (z.B. V.a. MRSA Infektion) als kurative Laborleistung. Anforderung: z. B. pathogene Keime inklusive MRSA Material: Nativmaterial, Blutkultur, Urikult oder ein Abstrichtupfer in Transportmedium. MRSA-Screening nach Abschnitt 30.12 EBM Seit dem 01.04.2012 besteht die Möglichkeit im Rahmen der Vertragsärztlichen Versorgung ein Screening von MRSA-Trägern sowie eine ambulante Eradikationstherapie durchzuführen. Die Laborleistung beinhaltet die kulturelle Anzucht sowie eine einfache Identifizierung der Bakterien. Ein Antibiogramm ist nicht Bestandteil dieser Vergütungsvereinbarung. Voraussetzungen für das Screening (alle 3 müssen erfüllt sein): • Genehmigung der KV zur Abrechnung dieser Leistungen. • Nur bei Risikopatienten die in den letzten 6 Mo. mindestens 4 Tage stationär behandelt wurden. • MRSA Anamnese oder mindestens 2 der folgenden Risikofaktoren (chronische Pflegebedürftigkeit, Antibiotikatherapie in den letzten 6 Mo., liegende Katheter, Dialysepflicht, Hautläsionen). Wenn die oben genannten Voraussetzungen nicht erfüllt sind, kann z.B. ein präoperatives Screening, oder ein Screening auf Wunsch des Pflegeheims zur Implementierung von Hygienemaßnahmen nicht zu Lasten der gesetzlichen Krankenversicherung durchgeführt werden. Anforderung: nur MRSA nach Abschnitt 30.12 EBM. Material: Abstriche der Nasenvorhöfe, Rachen, Dammregion, Achsel, Leiste, evtl. vorhandene Wunden und Hautläsionen. Nur Abstrichtupfer in Transportmedium sind geeignet. Therapie infizierter Patienten Bei schweren MRSA-Infektionen stehen die Reserveantibiotika Vancomycin, Linezolid und Daptomycin (nicht bei Pneumonie) evtl. in Kombination mit einem 2. Antibiotikum (z.B. Rifampicin oder Fosfomycin) zur Verfügung. Bei leichteren Infektionen kommen auch Cotrimoxazol, Doxycyclin und Clindamycin in Betracht. Sanierung besiedelter Patienten Die Sanierung besiedelter Patienten sollte bevorzugt mit lokalen Maßnahmen erfolgen (nicht mit einer systemischen Antibiose). Dekolonisation über 5 Tage mit 3 x tägl. Mupirocin-Nasensalbe in beide Nasenvorhöfe und 2-3 x tägl. Rachenspülung mit Antiseptika (z.B. Chlorhexidin, Octenidin). Bei Besiedlung von anderen Körperstellen werden Ganzkörperwaschungen einschl. der Haare mit antiseptischen Seifen (z.B. auf Octenidin-Basis) empfohlen. Erfolgskontrolle: Frühestens 3 Tage nach Beendigung der Sanierung sollten Kontrollabstriche durchgeführt werden. Im Krankenhaus 3 Kontrollabstrichserien an 3 aufeinander folgenden Tagen. In der Arztpraxis sind nach Abschnitt 30.12 EBM 3 Kontrollabstrichserien vorgesehen: 3 Tage bis 4 Wochen, 3 bis 6 Monate und 11 bis 13 Monate nach Sanierung. Bei positiven Kontrollabstrichen kann eine 2. Eradikationstherapie durchgeführt werden. Eine 3. Eradikationstherapie ist nur nach Vorstellung des Falles in einer Fall- oder Netzwerkkonferenz vorgesehen. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 05 2014 Laborinformation Nr. 52 Influenza / Virusgrippe Labordiagnostik Erreger Umhüllte RNA-Viren aus der Familie Orthomyxoviridae. Man unterscheidet Influenza A- und B-Viren. Influenza A-Viren spielen epidemiologisch die größte Rolle: sie sind verantwortlich für 4 große Pandemien im 20. Jahrhundert, die Pandemie im Jahre 2009 sowie für die Mehrzahl der Grippeerkrankungen in den alle 1-3 Jahre wiederkehrenden Epidemien. Die für den viralen Lebenszyklus und für die Erkennung durch das Immunsystem bedeutsamen Proteine der Virushülle der Influenza A-Viren sind das Hämagglutinin (H) und die Neuraminidase (N). Es gibt mindestens 18 verschiedene Hämagglutinine (H1-H18) und 9 verschiedene Neuraminidasen (N1-N9). Die Nomenklatur der Influenza A-Subtypen (HxNx) basiert auf der Kombination jeweils eines Hämagglutinins mit einer Neuraminidase in einem bestimmten Virusstamm. Auch wenn zirkulierende Virustypen nominell dem gleichen Subtyp zuzuordnen sind, können sie genetisch erhebliche Unterschiede aufweisen (z.B. A/H1N1= Bezeichnung für den Erreger der Spanischen Grippe 1918 und den Pandemiestamm 2009). Influenzaviren unterliegen mutationsbedingt einer hohen Variabilität: dieses auch als Antigendrift bezeichnete Phänomen ist eine wesentliche Ursache für regelmäßig wiederkehrende Grippe-Epidemien. Demgegenüber droht die Gefahr einer Pandemie, wenn neue, durch genetisches Reassortment verschiedener Influenza A-Stämme (Antigenshift) entstandene Subtypen auf eine immunologisch nicht vorbereitete Population treffen. Der für die Pandemie 2009 verantwortliche neue Subtyp der Influenza A/H1N1 („Schweinegrippe“) ist eine solche aus menschlichen, Schweine- und Vogelinfluenzaviren entstandene Variante. In Deutschland verteilten sich in der Saison 2013/14 die Erkrankungen an Virusgrippe auf die Typen Influenza A/H3N2 (ca. 60%), A/H1N1 (Pandemievirus 2009, ca. 30%) und Influenza B (ca. 10%). Daneben zirkuliert eine Vielzahl von Influenza A-Viren in verschiedenen Tierpopulationen. In den letzten Jahren wurden vorwiegend in Asien mehrere Ausbrüche mit von Geflügel auf den Menschen übertragenen Influenza A-Varianten verzeichnet: „Vogelgrippe“. Epidemiologisch bedeutsam waren vor allem die Subtypen H5N1, H9N2, H7N9 und H10/N8, die teilweise schwere und tödliche Infektionen verursacht haben. Die sporadische Übertragung tierpathogener Influenzaviren auf den Menschen wurde in letzter Zeit häufiger beobachtet, was sicher auch einer gesteigerten Surveillance und verbesserten Nachweismethoden geschuldet ist. Varianten mit der Fähigkeit, stabile Infektionsketten in der menschlichen Population zu bilden, besitzen aber das gefährliche Potential für eine neue weltweite Influenzapandemie. Übertragung Übertragung durch Tröpfchen und Aerosole hohe Kontagiosität Inkubationszeit: 1-5 Tage Klinik Hohes Fieber, Kopfschmerz, Schwächegefühl, Husten, Dyspnoe, Muskel- und Gelenkschmerzen, gastrointestinale Symptome. Charakteristisch: abrupter Symptombeginn - „Sudden Onset“ Komplikationen: Pneumonie, bakterielle Superinfektion (Staphylococcus aureus, Haemophilus influenzae!), kardiale Beteiligung Labordiagnostik Basisdiagnostik: - Blutbild (EDTA-Blut): Leukopenie charakteristisch - CRP (Serum): Anstieg > 35 mg/l → V.a. bakterielle Superinfektion - Eisen (Serum): häufig Abfall < 10 µg/dl - Sputum für bakterielle Erregerdiagnostik Spezielle Diagnostik: Influenza A/B-Schnelltest Nur für patientennahe Sofortdiagnostik in der Praxis! Sensitivität abhängig vom verwendeten Test und vom zirkulierenden Spektrum der Influenzaviren. Mutationen der Viren können zu falsch negativen Ergebnissen führen, neue Varianten werden eventuell nicht erfasst. Epidemiologische Situation beachten! Ein positives Ergebnis des Influenza-Schnelltestes bestätigt bei entsprechender Klinik das Vorliegen einer GrippeInfektion. Fast alle kommerziell verfügbaren Teste weisen Influenza A und B-Viren nach und können zwischen den Typen differenzieren. Eine Unterscheidung von Subtypen ist nicht möglich. Ein negatives Ergebnis des Schnelltestes schließt eine Influenza-Infektion nicht aus: in diesem Fall sollte die sensitivere PCR durchgeführt werden. Material: siehe Herstelleranweisung Der Schnelltest ist keine Kassenleistung! Influenza-PCR Hochsensitives Verfahren zur Detektion von Influenzaviren in respiratorischen Sekreten. Die Methode differenziert zwischen Influenza A- und B-Typen. Einige Varianten (z.B. H5N1, H7N9) werden vom eingesetzten Verfahren ebenfalls nachgewiesen (als Influenza A), eine exakte Differenzierung ist jedoch nicht möglich. Falls erforderlich wird das Testverfahren so modifiziert, dass bedeutsame neu zirkulierende Varianten sicher erfasst werden. Im Zusammenhang mit epidemiologischen Fragestellungen kann bei einem positiven Ergebnis ggf. eine Subtypen- bzw. Varianten-spezifische Methode eingesetzt werden. Material: Nasensekret, Nasen- oder Rachenabstrich mit trockenem Tupfer; keine Geltupfer verwenden! Influenza A/B-Serologie Nachweis von IgA- und IgG-Antikörpern gegen Influenza Aund B-Viren. Die Serologie kann bei Krankheitsbeginn noch negativ sein, da die Antikörperbildung verzögert einsetzt. Material: Serum Meldepflicht Lt. § 7 IfSG ist der direkte Nachweis von Influenzaviren meldepflichtig: Schnelltest durch behandelnden Arzt, PCR durch Labor. Lt. § 6 IfSG besteht z.Z. keine Meldepflicht für saisonale Influenzainfektionen durch den behandelnden Arzt. Meldepflichtig sind ggf. Verdacht, Erkrankung oder Tod an Infektionen durch neue Varianten (bedrohliche Erkrankung mit Hinweis auf eine schwerwiegende Gefahr für die Allgemeinheit). Therapie Neuraminidase-Hemmer: Oseltamivir (Tamiflu®), Zanamivir (Relenza®) Frühe Gabe, möglichst innerhalb der ersten 24-48 h! Eingeschränkte Wirksamkeit aufgrund von Resistenzentwicklung möglich: aktuelle epidemiologische Situation beim Einsatz beachten! Antibiotische Behandlung einer bakteriellen Superinfektion Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 53 Calprotectin Entzündliche Darmerkrankungen Epidemiologie • Über 300.000 Menschen leiden in Deutschland an Morbus Crohn oder Colitis ulcerosa. Es handelt sich um schubweise verlaufende chronische Entzündungen des Darms, deren Beginn meist in der Jugend bzw. im jungen Erwachsenenalter liegt. Calprotectin Beschreibung: • Calprotectin ist Diagnostikmarker und Aktivitätsmarker für chronisch-entzündliche Darmerkrankungen. Physiologie: • Das Calprotectin ist ein Calcium- und Zink-bindendes Protein mit antimikrobiellen Eigenschaften. Es stellt einen wesentlichen Zytoplasmabestandteil von neutrophilen Granulozyten und Monozyten dar. Die Calprotectin-Konzentration korreliert daher mit der Anzahl der migrierten Granulozyten im Darmlumen und bildet das Ausmaß/ den Grad der mucosalen Entzündung gut ab. Calprotectin ist im Stuhl stabil und gleichmäßig verteilt, so dass eine einzelne Messung den Gesamtstatus reflektiert. Positive Ergebnisse: • Stark erhöhte Werte finden sich bei chronisch-entzündlichen Darmerkrankungen wie Morbus Crohn und Colitis ulcerosa. • Erhöhte Werte finden sich bei Darminfektionen (Chemotaxis begünstigt Leukozytenmigration durch die Darmwand), bei Erkrankungen mit verstärkter Proliferation (z. B. Neoplasien) und bei Patienten mit Mukoviszidose. • Neugeborene und Säuglinge zeigen ebenfalls erhöhte Werte (wahrscheinlich auf Grund der Anpassungsvorgänge und Besiedlung des frühkindlichen Darms mit der aufkeimenden Darmflora). Vermeidung falsch positiver Ergebnisse: • Zur Vermeidung falsch-positiver Ergebnisse ist ein Ausschluss einer infektiösen Ursache anzuraten (Stuhluntersuchung auf enteropathogene Erreger). • Eine Erhöhung kann auch bei Darmerkrankungen mit entzündlicher Komponente wie Kolonkarzinom oder Divertikulitis auftreten. • Unter Therapie mit NSAID und Protonenpumpenhemmern wurden erhöhte Werte beschrieben. Indikationen für diese Untersuchung: • Differentialdiagnose zwischen einer chronischen Darmentzündung und einem Reizdarmsyndrom • Früher Marker bei chronisch-entzündlichen Darmerkrankungen (Morbus Crohn und Colitis ulcerosa). Bei einem Cut-Off von 50 µg/g Stuhl betragen Sensitivität und Spezifität ca. 90% bzw. 80%, bei Kindern jeweils über 95%. • Calprotectin korreliert mit dem endoskopischen Bild der Mucosaheilung. und ist der beste Aktivitätsmarker zum Therapiemonitoring von entzündlichen Darmerkrankungen. • Rezidiverkennung: Sensitivität und Spezifität betragen 78% bzw. 73% für die Diagnostik eines Rezidivs. Anforderung und Material: • Als Untersuchungsmaterial wird eine bohnengroße Stuhlprobe benötigt. Das fäkale Calprotectin ist sehr stabil und auch ungekühlt mindestens eine Woche haltbar. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 54 Pränatale Risikobestimmungen 70 60 Detektionsraten der Einzelm arker (%) Ältere Methoden zur pränatalen Risikobestimmung basieren auf der Messung biochemischer Marker im Serum der Schwangeren und ermitteln unter Einbeziehung von Ultraschallbefunden und weiterer Patientendaten (Alter!) das Risiko fetaler Chromosomenaberrationen (Trisomie 21-Down-Syndrom, Trisomie 18-Edwards-Syndrom, Trisomie 13-Pätau-Syndrom). Als Grenze für ein erhöhtes Risiko gilt bei der Trisomie 21 ein Wert von 1:250 (entsprechend in etwa dem Altersrisiko einer 40jährigen Schwangeren). Neben dem Erstund Zweittrimester-Screening haben sich weitere Verfahren wie das integrierte und das sequenzielle Screening als Pränatalscreeningmethoden mit höherer Aussagekraft etabliert (siehe Abbildung A). Diese Verfahren werden zunehmend durch die sensitiveren und spezifischeren Methoden zur Sequenzierung freier fetaler DNA im Plasma der Mutter abgelöst („NIPT“- non-invasive prenatal testing). BE (Erstuntersuchung) bevorzugt zwischen SSW 10+0 und 11+6, bis 13+6 möglich (siehe Abbildung B). Parameter: PAPP-A NT-Wert: Kann 11+0 bis 13+6 gemessen und nachgereicht werden. Keine FMF-Lizenz erforderlich, stattdessen wird eine untersucherspezifische NT-Referenz erstellt (kostenlos). BE (Folgeuntersuchung) zwischen SSW 14+0 und 17+6 (in Ausnahmefällen bis 19+6) Parameter: AFP, HCG, uE3, Inhibin A Bestimmung Gestationsalter bevorzugt nach früher SSL - Sequenzielles Screening (Risiko nach ErsttrimesterScreening) - Präzisierung bisher vorliegender Ergebnisse aus ErsttrimesterScreening (PAPP-A, NT) Nur zwischen SSW 11+1 bis 13+6 durchführbar NT-Messung und BE möglichst am selben Tag Parameter: PAPP-A, freies ß-HCG Bestimmung Gestationsalter ergibt sich aus Vorbefund Ersttrimester-Screening - Sequenzielle Folgeuntersuchung: BE zwischen SSW 14+0 bis 17+6 (in Ausnahmefällen bis 19+6) Parameter: AFP, HCG, uE3, Inhibin A Bestimmung Gestationsalter basiert auf SSL (CRL) 2-67 mm (aus 1. Trimenon) oder auf BPD 29-51 mm (zum Zeitpunkt der BE) Präzisierung bisher vorliegender Ergebnisse aus ErsttrimesterScreening - Sequenzielles Screening (Risiko bei niedrigem AFPWert) - - Freies ß-hCG Inhibin A PAPP-A 40 Freies Östriol (uE3) 30 α-Fetoprotein (AFP) 20 10 Integriertes Screening - Nackentransparenz (NT) 50 Neuralrohrdefekt-Screening (AFP < 0,5 MoM) BE zwischen SSW 14+0 bis 17+6 (in Ausnahmefällen bis 19+6) Bestimmung Gestationsalter bevorzugt nach früher SSL (aus 1. Trimenon) Sequenzielle Folgeuntersuchung: - BE zwischen SSW 14+0 bis 17+6 (in Ausnahmefällen bis 19+6) - Parameter: HCG, uE3, Inhibin A Bestimmung Gestationsalter ergibt sich aus Vorbefund Neuralrohrdefekt-Screening 100 1. Trimester 0 10 11 12 2. Trimester 13 15 14 16 Komplette Schwangerschaftswochen 17 18 Abb. B Detektionsraten von einzelnen Screening-Markern im Verlauf des 1. und 2. Trimenons der Schwangerschaft (nach einer Zusammenstellung aus Daten der SURUSS- und FASTER-Studie [1. Trimenon] und des britischen HTA-Reports über Marker im zweiten Trimenon). Ersttrimester-Screening - Nur zwischen SSW 11+1 bis 13+6 durchführbar NT-Messung und BE möglichst am selben Tag Parameter: PAPP-A, freies ß-HCG Bestimmung Gestationsalter basiert auf SSL (CRL) 45-82 mm Zweittrimester-Screening (Triple-Test) - BE zwischen SSW 14+0 bis 17+6 (in Ausnahmefällen bis 19+6) Parameter AFP, HCG und uE3 Bestimmung Gestationsalter bevorzugt nach früher SSL (aus 1. Trimenon) basiert auf SSL (CRL) 2-67 mm (aus 1. Trimenon) oder auf BPD 29-51 mm (zum Zeitpunkt der BE) Zweittrimester-Screening (Quadruple-Test) - BE zwischen SSW 14+0 bis 17+6 (in Ausnahmefällen bis 19+6) Parameter: AFP, HCG, uE3, Inhibin A Bestimmung Gestationsalter bevorzugt nach früher SSL (aus 1. Trimenon) Zweittrimester-Screening (isolierte AFP-Messung) - Neuralrohrdefekt-Screening BE zwischen SSW 14+0 bis 17+6 (in Ausnahmefällen bis 19+6) Bestimmung Gestationsalter bevorzugt nach früher SSL (aus 1. Trimenon) Sequenzierung fetaler DNA im mütterlichen Blut (z.B. Harmony™-Test) - BE ab SSW 10+0 (Anteil der fetalen DNA im mütterlichen Blut mindestens 4%) geringe Störanfälligkeit und hohe Detektionsrate (Sensitivität > 99%). Die Zahl der falsch positiven Befunde liegt unter 0,1%. Hinweis: Pränatale Risikobestimmungen sind prädiktive genetische Untersuchungen im Sinne des Gendiagnostikgesetzes und dürfen nur nach genetischer Beratung durch entsprechend qualifizierte Ärzte veranlasst werden. Beginn der Untersuchung: 95 11. SSW 12. SSW 90 13. SSW 85 14.-18. SSW 80 75 70 65 60 55 50 NT allein PAPP-A+ freies b-hCG ErsttrimesterScreening Integriertes Screening ohne NT Integriertes Screening mit NT TripleQuadrupleUntersuchung Untersuchung Abb. A Detektionsraten verschiedener Screening-Methoden bei einer vorgegebenen Falsch-Positiv-Rate von 5% (Daten aus FASTER-Studie). Die unter-schiedlichen Grauschattierungen be-zeichnen die Schwangerschaftswoche zum Untersuchungszeitpunkt bzw. zum Zeitpunkt der Eingangsuntersuchung beim integrierten Screening. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 55 Knochenstoffwechsel 1 Calcium und Phosphat Der Knochen besteht aus einer Calcium-reichen Mineralsubstanz (vor allem Hydroxylapatit: ein hydroxyliertes Calciumphosphatsalz von hoher Härte), einer organischen Matrix (90 % Kollagen Typ I, Osteonectin, Osteocalcin, Proteoglycane) sowie Knochenzellen (Osteozyten, Osteoblasten und Osteoklasten), die in die Knochenmatrix eingebettet sind. Im Skelettsystem sind ca. 90 % des Gesamtkörperbestandes an Calcium und 85 % des anorganischen Phosphats gebunden, die permanent mit dem extrazellulären Pool ausgetauscht werden. Die Regulation der Calciumhomöostase erfolgt vorrangig über die gemeinsame Wirkung von Parathormon und Vitamin D3. Stellgrösse ist die extrazelluläre Ca-Konzentration im Blut. Zielorgane der Hormonwirkung sind der Knochen (Mineralisation, Demineralisation), der Darm (Ca-Absorption) und die Niere (Ca- und Phosphatausscheidung). Störungen der Calciumhomöostase führen nicht nur zu pathologischen Veränderungen der Knochenstruktur (Osteoporose, Osteomalazie) sondern auch zu Störungen der muskulären Erregung (Hypocalcämie: Tetanie; Hypercalcämie: Muskelschwäche). Weiterhin begünstigt eine erhöhte Ausscheidung von Calcium und Phosphat die Steinbildung in der Niere. Der Calciumstoffwechsel ist eng mit dem Phosphatstoffwechsel gekoppelt. Parameter des Calcium- und Phosphatstoffwechsels Name Calcium (Ca) Phosphat anorganisch Parathormon (PTH) 25 (OH)-Vit. D 1,25(OH)2-Vit. D3/ Calcitriol Calcitonin Parathormon related Peptide Physiologische Funktion Mineralisation des Knochens, neuromuskuläre Erregungsleitung; Abfall der Ca-Konzentration stimuliert Sekretion von PTH aus den Nebenschilddrüsen Mineralisation des Knochens, Puffer im Säure-BasenHaushalt Erhöhung der Ca-Konzentration durch Mobilisation aus dem Knochen und Förderung der Ca-Rückresorption aus dem Glomerulumfiltrat; stimuliert Phosphatausscheidung Hauptanteil der im Serum zirkulierenden Vitamin DMetabolite, entsteht durch 25-Hydroxylierung in der Leber aus in der Haut gebildeten bzw. mit der Nahrung aufgenommenen Vorstufen aktive Form von Vitamin D3, entsteht unter Einfluss von PTH durch 1-Hydroxylierung in der Niere; fördert die Caund Phosphataufnahme aus dem Darm; komplexe Wirkung auf Osteoblasten und Osteoklasten von den C-Zellen der Schilddrüse gebildetes Hormon; senkt den Ca-Spiegel, spielt aber nur untergeordnete Rolle bei der Ca-Homöostase und im Knochenstoffwechsel Sekretionsprodukt endokrin aktiver Tumoren, imitiert durch Bindung an den gleichen Rezeptor die Parathormonwirkung Indikation Basisparameter, ggf. bei Dysproteinämien (Hypoalbuminämie) Berechnung des ionisierten Ca erforderlich Basisparameter Hyperparathyreoidismus Hypoparathyreoidismus (Z.n. Thyreoidektomie, autoimmun) Indikator für Vitaminmangel: Mangel- und Fehlernährung, chronisch entzündliche Darmerkrankungen Material Serum, 24h-Urin (HCl) Serum, 24h-Urin EDTA-Plasma Serum Niereninsuffizienz, Hypoparathyreoidismus, granulomatöse Erkrankungen, Vit. D-Rezeptordefekte Serum Tumormarker beim medullären Schilddrüsenkarzinom und bei multipler endokriner Neoplasie Typ 2 (MEN2) Hypercalcämie bei Tumoren (insbes. Mamma-CA, kleinzelliges Bronchial-CA und Nierenzell-CA) Serum gefroren EDTA-Plasma gefroren Befundkonstellationen bei Störungen des Calcium- und Phosphatstoffwechsels Ursache Ca Serum Phosphat Serum Ca Urin Phosphat Urin PTH intakt ↑ ↓-n n-↑ n-↑ ↑ n-↑ ↓ ↑-↑↑ ↑↑-↑↑↑ ↓-↓↓ ↓-n ↓-n Hypoparathyreoidismus ↓ ↑ Tumorhypercalcämie ↑ ↑ ↑ ↑ ↑ ↓ ↑ ↓-n n-↑ n-↑ n n n n primärer Hyperparathyreoidismus sekundärer Hyperparathyreoidismus renal sekundärer Hyperparathyreoidismus intestinal Sarkoidose Vit. D-Überdosierung Hyperthyreose Glucokorticoidmangel Glucokorticoidexzess ↓-n ↓-n ↑-↑↑ 25 (OH)Vit. D3 ↓↓ ↓ n-↑ n-↑ n-↑ n-↑ ↓ ↑ ↓ n-↑ n-↑ n n n n n ↓-n ↓-n ↓-n ↓-n n n ↓-n 1,25(OH)2Vit. D3 ↓ ↑↑ ↑ ↑ weitere Diagnostik Ausschluss MEN1 und MEN2 Ausschluss chron. entz. Darmerkrankung Ausschluss MgMangel, Nebenschilddrüsen-Ak PTH-related Peptide ACE,sIL2-Rezeptor TSH, fT4 Cortisol, ACTH DXM-Hemmtest Thiazideinnahme "↑" = erhöht, "↓" = erniedrigt , "n" = normal; grau hinterlegt: Parameter ist für die Fragestellung richtungsweisend; keine Angabe: Bestimmung spielt für die Fragestellung keine Rolle Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Labor Schottdorf MVZ GmbH Laborinformation Nr. 56 Knochenstoffwechsel 2 Osteoporose, Knochenauf- und abbau Die Osteoporose ist eine systemische Skeletterkrankung, bei der eine unzureichende Knochenfestigkeit ein erhöhtes Frakturrisiko bedingt. Die verminderte Knochenfestigkeit resultiert aus reduzierter Knochendichte und/ oder Knochenqualität. Hauptmanifestationen sind Frakturen der Wirbelkörper (Sinterfrakturen) und Schenkelhalsfrakturen, die oft eine erhebliche Behinderung der Betroffenen zur Folge haben. Daher sind besonders bei älteren Menschen (Frauen in der Menopause, Männer >60 Jahre) unter Berücksichtigung individueller Risikofaktoren rechtzeitige präventive Maßnahmen angezeigt. Risikofaktoren: Alter (Verdoppelung des Risikos pro Lebensdekade beim älteren Menschen), Geschlecht (Frauen: 2fach höheres Risiko als Männer), Rauchen, Immobilität, Untergewicht (BMI <20), genetisches Risiko (anamnestisch proximale Femurfraktur bei einem Elternteil), Einnahme bestimmter Medikamente (z.B. Glukokortikoide, Antiepileptika) Die Primärdiagnostik schließt neben Anamnese und klinischem Befund eine Knochendichtemessung und ggf. eine Röntgenuntersuchung der Brust- und Lendenwirbelsäule ein. Die in diesem Rahmen empfohlenen Laboruntersuchungen (Basis- und Erweiterungsdiagnostik; siehe Tabelle 1) ermöglichen in erster Linie die Unterscheidung zwischen einer primären und sekundären Osteoporose bzw. Osteopathie. Viele Knochenerkrankungen gehen mit einem erhöhten Knochenumsatz einher. Bei der Osteoporose unterscheidet man low- und high-Turnover Varianten, wobei letztlich immer in der Bilanz ein Verlust an Knochenmasse zu verzeichnen ist. Für die Beurteilung des Knochenumsatzes stehen verschiedene biochemische Marker des Knochenauf- und -abbaus zur Verfügung. Diese Parameter haben in der Primärdiagnostik nur einen begrenzten Nutzen, ermöglichen aber eine Therapieüberwachung und Verlaufsbeurteilung der Osteoporose. Ein weiterer Vorzug der Knochenumbaumarker besteht darin, dass sie Veränderungen der Knocheneigenschaften unter Therapie anzeigen, bevor sich die Knochendichte messbar verändert hat. Da Kollagen auch Bestandteil anderer Bindegewebe ist, kann die Spezifität einzelner Marker eingeschränkt sein (Tabelle 2). Basisdiagnostik der Osteoporose Tabelle 1: Parameter Calcium und Phosphat im Serum AP (+ Gamma-GT) Kreatinin Serum-Eiweißelektrophorese TSH BSG/ CRP/ grosses Blutbild 25 (OH)-Vit. D Fragestellung Basisuntersuchungen zur Erkennung von Störungen des Calcium- und Phosphatstoffwechsels Erhöhter Knochenumsatz, Metastasen (Gamma-GT zum Ausschluss einer hepatischen AP-Erhöhung) Renale Osteopathie (Kreatinin >2-3 mg/dl) Suchtest für Plasmozytom Ausschluss Hyperthyreose Ausschluss entzündlicher Ursachen Vitamin D-Mangel, Malabsorption Material Serum Serum Serum Serum Serum EDTA, Serum Serum Erweiterungsdiagnostik in Abhängigkeit von der Fragestellung Parameter Parathormon intakt Cortisol/ DXM-Hemmtest Immunfixation/ freie Leichtketten FSH/ Östradiol Testosteron gesamt Tabelle 2: Fragestellung Hyperparathyreoidismus Hyperkortisolismus/ M. Cushing Plasmozytom Hypogonadismus (junge Frau) Hypogonadismus (Mann) Material EDTA-Plasma Speichel, Serum Serum, Urin Serum Serum Parameter des Knochenumsatzes Indikation (I)/ Besonderheiten (B) Spezifität Material Knochenaufbau: Osteoblasten I: M. Paget, Knochenmetastasen, prim. und sek. Hyperparathyreoidismus, Knochen-AP Osteomalazie, high-Turnover Osteoporose (Verlaufskontrolle), funktionelle ++ Serum (BAP) Osteoblastendefekte (Hypophosphatasämie) B: keine Beeinträchtigung durch Niereninsuffizienz I: Glukokortikoid-bedingte Osteopenie (Osteoblastenaktivität vermindert), Osteocalcin Serum +++ Knochenmetastasen, high-Turnover Osteoporose (Verlaufskontrolle) (OC) gefroren B: Akkumulation bei Niereninsuffizienz Prokollagen I I: Monitoring einer Therapie mit rekombinantem Parathormon, M. Paget N-termiales + Serum B: Akkumulation bei Niereninsuffizienz, Beeinflussung durch LeberfunktionsPropeptid (PINP) störungen, eingeschränkte Spezifität Knochenabbau: Osteoklasten I: Osteoporose (Verlaufskontrolle), Erkrankungen mit erhöhter KnochenPyridinolin (PYD)/ PYD: ++ Morgenurin Desoxypyridinolin resorption DPD:+++ lichtgeschützt (DPD) ”Crosslinks” B: Pyridinolin kommt auch im Knorpel vor: Erhöhung auch bei Arthritiden I: Osteoporose (Verlaufskontrolle), Erkrankungen mit erhöhter KnochenresorpTartrat-resistente tion: wenig etablierter Parameter Serum +++ saure Phophatase B: keine Beeinträchtigung durch Leber- und Nierenfunktionsstörungen, Nahgefroren (TRAP 5b) rungsaufnahme stört nicht, keine Tagesrhythmik, Erhöhung durch Hämolyse I: Osteoporose (Verlaufskontrolle), Erkrankungen mit erhöhter KnochenresorpC-terminales Telotion: wenig etablierter Parameter EDTA++ peptid B: Akkumulation bei Niereninsuffizienz, Beeinflussung durch LeberfunktionsPlasma (CTX, ß-Crosslaps) störungen, Erniedrigung durch Hämolyse, Abnahme nüchtern ! Knochenumsatzparameter unterliegen meist einer zirkadianen Rhythmik. Zur Vergleichbarkeit der Werte Blutabnahme zwischen 7:00 und 9:00 Uhr morgens empfohlen. Urinproben zur Therapiekontrolle zur gleichen Tageszeit gewinnen. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 01 2016 Laborinformation Nr. 57 Tropen-/Reisemedizin I Leitsymptom Diarrhoe Die am häufigsten nach einer Tropenreise auftretenden Symptome sind Diarrhoe, gefolgt von Fieber und Hautveränderungen. Nur bei Reisen in südlich der Sahara gelegene Gebiete Afrikas nimmt als Folge der Malaria tropica das Leitsymptom Fieber die erste Stelle ein. Insgesamt hängen aber weniger als 20% der nach einer Reise zum Arztbesuch führenden fieberhaften Erkrankungen ursächlich mit der Reise zusammen. Zu den häufigeren Reise-assoziierten Infektionserkrankungen gehören auch Harnwegsinfektionen und Pneumonien. Anamnese Reiseland, Aufenthaltsorte im Reiseland, Transitaufenthalte; Reisezeitpunkt, Reisedauer, Zeitpunkt der Rückkehr (Inkubationszeit !); Malariaprophylaxe, Impfungen, Erkrankungen und Behandlung; Reiseumstände: z.B. Trekking oder Hotel, Hygienebedingungen, Kontakt mit Risikogruppen, berufliche Tätigkeit im Reiseland Erreger von Diarrhoe Vorkommen Klinik Aeromonas ssp. / Plesiomonas shigelloides Weltweit, v. a. tropische Gebiete Campylobacter spp. Screeningparameter Blutbild, Eosinophile Material EDTA-Blut CRP, IgE, GOT, GPT, GGT, CK, Kreatinin Serum Malaria-Nachweis dicker Tropfen luftgetrockneter Ausstrich EDTA-Blut pathogene Keime Stuhl, Urin pathogene Keime (Nase, Ohr, Rachen etc.) Abstrich Inkubationszeit Diagnostik Stuhl wässrig, blutig, manchmal protrahierter Verlauf 2-5 Tage 1 x Stuhl Weltweit Südostasien, Nordafrika Abdominalschmerz, Fieber, oft Tenesmen, Stuhl schleimig, oft blutig 2-11 Tage 1 x Stuhl Escherichia coli (darmpathogene Stämme: EHEC, ETEC, EAEC, EIEC) Weltweit (kontaminierte Lebensmittel, Rohmilch) Cholera- oder Ruhrähnliche Durchfälle, oft blutiger Stuhl, vor allem bei Kleinkindern hämolytischurämisches Syndrom möglich 1-6 Tage 1 x Stuhl Lebensmittelvergiftung durch Enterotoxinbildner (Staph. aureus, Bac. cereus, Clostridium perfringens) Weltweit Starkes Krankheitsgefühl, oft Erbrechen, blutigschleimige Diarrhoe; Einsetzen der Symptomatik kurz nach einer Mahlzeit, oft in der Gruppe 1-6 Stunden (Enterotoxinnachweis in Nahrungsmittelresten oder Erbrochenem) 1 x Stuhl (spez. anfordern) Salmonella spp. (enteritische Salmonellen) Weltweit Diarrhoe, evtl. Fieber, Erbrechen Selten Komplikatoinen: Sepsis, Meningitis 6 Stunden bis 3 Tage 1 x Stuhl Salmonella Typhi / Paratyphi (typhöse Salmonellen) v. a. Indien, trop. Afrika, Südamerika (weltweit) Fieber, Erbrechen, Diarrhoe = Spätsymptom Komplikationen: Sepsis, Meningitis 6-30 Tage 1 x Stuhl (Nachkontrolle) Akutdiagnostik: Blutkultur Shigella spp. Weltweit Stuhl schleimig, blutig, eitrig, oft Tenesmen, Fieber v. a. SO-Asien, Indien, N- Komplikationen: schwere Dehydratation, Afrika Darmblutung, Perforations-Peritonitis 12-96 Stunden (bakterielle Ruhr) 1 x Stuhl Vibrio cholerae Südliches Afrika, Indien, Akuter Brechdurchfall, Stuhl reiswasserähnlich, volumiSO-Asien, Karibik (Haiti!) nös (bis 20 l/Tag) Allg. Katastrophengebiete: Hochwasser / Erdbeben 16-72 Stunden 1 x Stuhl Vibrio non-cholerae Weltweit Leichtere choleraähnliche Diarrhoe schwere Infektionen / Sepsis ohne Diarrhoe möglich 16-72 Stunden 1 x Stuhl Yersinia spp. Weltweit Pseudoappendizitis, rezidivierende Abdominalschmerzen, Arthritis, Erythema nodosum, Fieber; bei Immunschwäche ggf. Sepsis, Lymphadenopathie, Abszessbildung 2-7 Tage 1 x Stuhl Parasiten/ Protozoen Reiseland angeben, sonst Untersuchung nur auf Amöben und Lamblien Cryptosporidien, Microsporidien Weltweit Wässrige, fieberfreie Diarrhoe, abdominelle Krämpfe, bei Immunkompetenten meist nach 5-10 Tagen selbstlimitierend, chronischer Verlauf bei HIV-Patienten möglich 1-30 Tage 3 x Stuhl (Sonderanforderung nötig) Cyclospora cayetanensis Weltweit Wässrige Diarrhoen für 2-9 Wochen, chronischer Verlauf bei HIV-Patienten möglich 2-7 Tage 3 x Stuhl (Sonderanforderung nötig) Entamöba histolytica Weltweit, Südostasien Schwarzafrika Stuhl blutig-schleimig: „Himbeergelee-Stuhl“, Tenesmen, rezidivierende Diarrhoe; symptomarme oder symptomlose Verläufe möglich; Spätkomplikation: Amöbenleberabszess Wenige Tage bis mehrere Monate, Jahre möglich (Leberabszess) 3 x Stuhl (bei Verdacht auf AmöbenLeberabszess: Serologie = Antikörpernachweis) Isospora belli Weltweit, v. a. Wässrige, rezidivierende Diarrhoen, bei ImmunkompeMittelmeergebiete, Asien, tenten nach Wochen bis Monaten selbstlimitierend Südamerika chronischer Verlauf bei HIV-Patienten möglich 2-13 Tage 3 x Stuhl Lamblien Weltweit, Südostasien, Karibik 2-10 Tage 3 x Stuhl Malaria Siehe Tropenmedizin II; kann auch mit Leitsymptom Diarrhoe einhergehen! Würmer Weltweit Unspezifische gastrointestinale Beschwerden, Gewichtsabnahme, ggf. Lungenreaktion, Anämie Variabel 3 x Stuhl auf Wurmeier bzw. Wurm direkt einsenden Adenoviren Weltweit Fieber, Erbrechen, wässrige Diarrhoe 1-3 Tage 3 x Stuhl Astroviren Weltweit Fieber, Erbrechen, wässrige Diarrhoe 3-4 Tage 3 x Stuhl Hepatitis A-Virus Weltweit, v. a. Mittelmeerraum, Nordafrika Inappetenz, Schwäche, unspezifische abdominelle Beschwerden, Völlegefühl, Ikterus, entfärbter Stuhl 2-6 Wochen Antikörpernachweis Noroviren Weltweit Fieber, Erbrechen, wässrige Diarrhoe 10-50 Stunden 3 x Stuhl Rotaviren Weltweit Fieber, Erbrechen, wässrige Diarrhoe (überwiegend Kleinkinder betroffen) 1-3 Tage 3 x Stuhl Bakterien Rezidivierende wässrige fieberfreie Diarrhoe, abdominelle Beschwerden, Völlegefühl Viren Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 58 Tropen-/Reisemedizin II Leitsymptom Fieber Erkrankung Erreger Afrikanische Schlafkrankheit Trypanosoma brucei gambiense (Westafrika) Trypanosoma brucei rhodesiense (Ostafrika) Vorkommen Vektor/Übertragung Klinik Afrika zwischen 15° nördlicher und 20° südlicher Breite Tse-tse (bedeutet: Fliege) Trypanosomenschanker an der Einstichstelle, danach hämolymphatisches Stadium mit intermittierenden Fieberschüben, Lymphadenopathie (v.a. im Nackenbereich), Splenomegalie, Anämie, Thrombozytopenie, Tachykardie, Hypotonie; später Übergang in ein meningoenzephalitisches Stadium Inkubationszeit T. gambiense: 1 – 2 Wochen (auch Wochen – Jahre möglich) T. rhodesiense: 15 – 21 Tage Diagnostik Mikroskopischer Erregernachweis im Stadium I im Dicken Tropfen, im Biopsiematerial oder im Lymphknotenpunktat; Nachweis im EDTA-Blut nach QBCAnreicherung oder mittels PCR, später auch Antikörpernachweis möglich. Nachweis (Mikroskopie, PCR) im Liquor bei Meningoenzephalitis. Amöben, intestinale Leberabszess Entamoeba histolytica Weltweit Fäkal-orale Übertragung Undulierendes Fieber (38-40°C), rechtsseitige Oberbauchbeschwerden, Fernreise meist mehrere Monate zurückliegend Amöben, freilebende Keratitis, Konjunktivitis; Meningitis Acanthamoeba ssp., Balamthia mandrillaris, Naegleria fowleri Weltweit Keratitis/Konjunktivitis (Kontaktlinsen), Meningitis / Enzephalitis (bei [lokaler] Abwehrschwäche) Keratitis/Konjunktivitis meist ohne Fieber (u. U. dramatische Lokalsymptomatik); Meningitis/Enzephalitis: häufig tödlich (Ursache nicht erkannt) Brucellose Brucella abortus, B. melitensis, B. suis Mittelmeer, Arabische Halbinsel, Afrika, Asien, Mittel- u. Südamerika; Kontaktinfektion, Milchprodukte (nicht pasteurisiert), Fleischverarbeitung - Laborinfektion Septikämische Allgemeininfektion mit multiplen Organmanifestationen (z.B. Hepatitis, Endokarditis, Nephritis) chronische Verläufe mit unterschiedlichsten Symptomen möglich Mittel- und Südamerika Raubwanzen (rezent erste Berichte aus Nordamerika) Akute Phase: unspezifische Symptome, Schwellung an der biss-Stelle, Anämie, Lymphknotenschwellung, Hepatosplenomegalie, Myokarditis (Dauer 1-2 Mon.) wenn unbehandelt (nach 10 - 30 Jahren): chronische Infektion mit Myokarditis, seltener: Megacolon, Megaösophagus 5 – 14 Tage SO-Asien, Afrika, Inseln im indischen Ozean, Karibik, S-Amerika Aedes aegypti u. albopictus (Zika: ebenfalls Aedes ssp.) Akuter Fieberanstieg, Muskel-/ Gelenkbeschwerden, Rückenschmerzen (!), selten: Konjunktivitis, Enzephalitis (Zika: ähnliche Symptomatik) 3 – 12 Tage Während der ersten 3-5 Krankheitstage PCR (nur in Speziallaboren) EDTA-Blut, Liquor), ab 8. – 10. Tag Antikörpernachweis (Zika: ebenso) Tropen und Subtropen, v. a. Indien, Südostasien, Mittel- und Südamerika Aedes aegypti u. albopictus Akutes hohes Fieber, Kopfschmerzen, Übelkeit,Muskel-/ Gelenks-/ Knochenschmerzen, kleinfleckiges Exanthem; Hämorrhagien (DHF) / Schock (DSS) bei Reinfketionen mit anderem Typ 4 – 14 Tage Antikörpernachweis ab 8. Krankheitstag (Tag 3 bis 7: PCR) Weltweit Ausscheidungen von Nagern: Kontaktinfektion, orale und respiratorische Aufnahme Europa/Asien: hämorrhagisches Fieber mit Nierenversagen (HFRS); höhere Letalität in Asien, in Europa meist milder USA/ Südamerika: Hantavirus Pulmonales Syndrom (HPS) mit ARDS, hohe Letalität 5 – 60 Tage Antikörpernachweis, PCR (EDTA-Blut, Urin) Hepatitis A Hepatitis A-Virus (HAV) Weltweit außer W-Europa, USA, Kanada und Australien Fäkal-orale Übertragung Inappetenz, Schwäche, unspezifische abdominelle Beschwerden, Völlegefühl, Ikterus, entfärbter Stuhl Japanische Enzephalitis Japan Enzephalitis Virus (JEV) Süd-, Südost-, Ostasien Stechmücken (Culex spp.) Fieber, Kopfschmerzen, Erbrechen, Meningoenzephalitis, hohe Letalität Kala-Azar (viszerale Leishmaniose) Leishmania donovani, L. infantum, L. chagasi Mittelmeer, Asien (Indien!), Afrika, Abgeschlagenheit, Fieber, Nachtschweiß, Mittel- und Südamerika Gewichtsverlust, Hepatosplenomegalie, Sandmücken (Phlebotomus ssp.) Panzytopenie > 30 Tage bis Monate Antikörpernachweis, Mikroskopie / PCR (Knochenmarkausstrich, Milz- und Lymphknotenbioptat) Bei Pancytopenie/Hypalbuminäie an Leishman. denken! Katayama-Fieber/-Syndrom (akute Schistosomiasis) Schistosoma spp. Afrika, Asien, Südamerika Binnengewässer (Süßwasser) Eosinophilie, Fieber, Schüttelfrost, Kopf-/ Gelenk, unproduktiver Husten, evtl. Hepatosplenomegalie 10 – 40 Tage Antikörpernachweis und Nachweis der Eier frühestens nach 4 – 10 Wochen aus Urin oder Schleimhautbiopsie (evtl. auch Stuhl z. Zp. des K.-Fiebers evtl. noch negativ) Weltweit ( Peru, Ecuador, Indien Malaysia) Kontakt mit Wasser, das mit Harn von Tieren (v. a. Ratten und Mäusen) kontaminiert ist Septischer Beginn: Fieber, Schüttelfrost, Gelenk- u. Muskelschmerzen; Hepatosplenomegalie, Erythem; nach kurzem Intervall ikterische Phase mit Hepatitis, Nephritis, Meningitis möglich (M. Weil) 4 – 19 Tage Bei Krankheitsbeginn: Anzucht (spezielle Bedingungen) oder PCR aus Blut, Liquor, Punktaten und Urin Antikörpernachweis ab ca. 6. bis 10. Tag nach Krankheitsbeginn positiv Malaria tertiana und quartana Plasmodium ovale, vivax und malariae Tropen und Subtropen Anopheles spp. Akut einsetzendes Fieber mit Kopf- und Rückenschmerzen, Schüttelfrost, gelegentlich Diarrhoe, Fieberzyklen mit fieberfreien Tagen 12 Tage – 1 Jahr Erregernachweis: Dicker Tropfen / Blutausstrich, Antigentest (Schnelltest), QBC-Anreicherung aus EDTA-Blut, antikörpernachweis für Akuterkrankung ohne Wert, zum Ausschluss (Blutspender) ggf. sinnvoll; PCR: nicht für Routinediagnostik Malaria tropica „KnowlesiMalaria“ Plasmodium falciparum, P knowlesi P. falciparum: Tropen, v. a. Afrika südlich der Sahara, Südostasien, Südamerika P. knowlesi: Malaysia und Umgebung Anopheles spp. Akut einsetzendes tägliches Fieber mit Kopf- und Rückenschmerzen, Schüttelfrost, gelegentlich Diarrhoe, dunkler Harn; Achtung: rapide Verschlechterung mit Bewusstseinstrübung möglich 8 – 30 Tage Erregernachweis: Dicker Tropfen / Blutausstrich, Antigentest (Schnelltest), QBC-Anreicherung aus EDTA-Blut, antikörpernachweis für Akuterkrankung ohne Wert, zum Ausschluss (Blutspender) ggf. sinnvoll; PCR: nicht für Routinediagnostik Rickettsiose (mediterrane Form) Rickettsia conori, R. africae Südliches Afrika, Mittelmeer Zecken Nekrotisches Exanthem (Eschar noir) im Bereich der Einstichstelle, Kopfschmerzen, z.T. hohes Fieber 5 – 18 Tage Antikörpernachweis Salmonellose (typhöse Verlaufsform) Salmonella typhi / Paratyphi A, B, C Weltweit in Ländern mit geringem Hygienestandard v.a. SO-Asien (Indien, Pakistan, Nepal), Thailand, Indonesien; Ägypten, Marokko Fäkal-orale Übertragung Obstipation, Bradykardie, treppenartiger Fieberanstieg, evtl. Roseolen, Panzytopenie, Bewusstseinstrübung West-Nil-Fieber West-Nil-Virus (WNV) Afrika, Naher u. Mittlerer Osten, Indien, Südostasien, Nordamerika, Südeuropa Aedes spp., Culex spp., Ochlerotatus spp. Bei ca. 20% der Infizierten plötzliches Fieber mit Schüttelfrost, Kopf- u. Rückenschmerzen, evtl. makulopapulöses Ekzem, selten Meningoenzephalitis; Schweregrad nimmt im Alter zu Chagas-Krankheit Trypanosoma cruzi Chikungunya Chikungunya-Virus (ähnlich: Zika-Virus) Dengue-Fieber Dengue-Virus Typ1-4 Hanta-Virus-Erkrankungen Leptospirose Leptospira interrogans Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Monate bis Jahre Antikörpernachweis, Mikroskopie im Punktat Tage bis Wochen Amöbennachweis auf gezielte Anfrage nur in Speziallabors möglich 14 – 21 Tage evtl. Monate 2 – 6 Wochen 5 – 15 Tage Wiederholte Blutkulturen (spezielle Anzuchtbedingungen, evtl. längere Bebrütungsdauer nötig!), Antikörpernachweis Akute Phase: Dicker Tropfen, QBC-Anreicherung, PCR (EDTA-Blut), Latenz und chronische Phase: Antikörpernachweis Antikörpernachweis (bei Symptombeginn in der Regel IgG und IgM positiv) PCR (EDTA-Blut, Liquor) in der Akutphase, ab Tag 10 Antikörpernachweis möglich 3 – 60 Tage In den ersten Tagen ausschließlich über Blutkultur (Typhus meist 4 – 25 nachweisbar Tage) 3 – 12 Tage PCR (EDTA-Blut, Liquor), Antikörpernachweis Stand 07 2014 Laborinformation Nr. 59 Tropen-/Reisemedizin III Atemwegs-/Hauterkrankungen Atemwegserkrankungen Erreger Coccidioidomykose Coccidioides immitis Histoplasmose Histoplasma capsulatum Legionella Legionella pneumophila Tuberkulose Mycobacterium tuberculosis Akute virale respiratorische Erkrankungen Vorkommen Klinik USA (Death Valley, Trockengebiete), Lateinamerika Fieber, Schüttelfrost und Husten, Pneumonie, häufiger asymptomatisch USA, Lateinamerika, Karibik, Afrika, Vorderasien, Indonesien, Australien Weltweit Infektionsquelle meist lauwarmes Leitungs- oder Brauchwasser in stehenden Reservoiren (Einatmen von Aerosolen z. B. beim Duschen, über Klimaanlagen oder in Whirlpools) Mikroskopischer Erregernachweis, Antikörpernachweis Husten, Fieber, allgemeines Krankheitsgefühl und Brustschmerzen, oft inapparent 7-21 Tage Mikroskopischer Erregernachweis, Antikörpernachweis ab 2. bis 3. Woche Kopf-, Gliederschmerzen, Kurzatmigkeit, Reizhusten, Bronchopneumonie, Fieber, auch Übelkeit und Diarrhoe möglich Risikogruppen: Immunsupprimierte, ältere Patienten 2-10 Tage Antigennachweis aus dem Urin PCR aus Sputum, Lavage, Urin Wochen bis Monate Nachweis von säurefesten Stäbchen, TBC-Kultur, PCR aus tiefexpektoriertem Sputum, Magennüchternsekret Weltweit, v. a. Nachfolgestaaten der Anfänglich Nachtschweiß, Müdigkeit, Schwäche, Fieber, Sowjetunion, Südostasien, Afrika evtl. Husten, Thoraxschmerzen, Atemnot, (Subsahara), Lateinamerika Gewichtsabnahme variabel (aktuelle epidemiologidsche Influenza-like-Illness, schwere Verlaufsformen mit Situation beachten!) Lungenentzündung und ARDS Infektionsquelle/ Erregerreservoir oft nicht bekannt , Geflügelmärkte bei Vogelgrippe Hauterkrankungen Erreger Vorkommen Vektor/Übertragung Klinik Weltweit Hautinfektionen v. a. in warmen Ländern (Afrika) Impetigoähnliche Hautläsionen und Geschwüre, Bindehautdiphtherie mit blutig-wässriger Sekretion, häufig Hornhautbeteiligung Corynebacterium diphtheriae (meist nicht Exotoxin bildend) Diagnostik 1-4 Wochen Coronaviren (SARS, MERS), Vogelgrippe (H5N1, H9N2, H7N9, H10/N8 …) Hautdiphtherie Inkubationszeit Reaktivierung latenter Infektionen unter Immunsuppression wenige Tage Inkubationszeit 2-6 Tage Sputum, Aspirat, Lavage (Verdacht auf Anforderung vermerken - Sonderbehandlung) Diagnostik Bakteriologischer Wundabstrich Schmierinfektion Hautleishmaniose Leishmania spp. Asien, vorderer Orient, Mittelmeerraum, Ost-Westafrika, Lateinamerika Schmetterlingsmücken (Europa/Asien Phlebotmus; Amerika Lutzomyia) Lepra Mycobacterium leprae Indien, Brasilien, Indonesien, Myanmar, Zentralafrika Tröpfcheninfektion mit geringer Kontagiosität, enger Kontakt zu Erkrankten notwendig Loiasis (Kamerunbeule oder Calabar-Schwellung) Loa Loa Lymphatische Filariose Wucheria bancrofti, Brugia malayi, Brugia timori Hautmilzbrand Bacillus anthracis Onchocerkose (Flussblindheit) Onchocerca volvulus West- und Zentralafrika (Kongobecken) Bremsen der Arten Chrysops dimitiata und Chrysops silacea L. der alten Welt: ulcerierende und nekrotisierende Hauterkrankungen (beginnend an der Einstichstelle), nach Monaten narbige Abheilung: Orientbeule L. der neuen Welt: verschiedenste Hautläsionen (L. mexicana komplex: kutane Form); Schleimhautbefall möglich (L. brasiliensis: mukokutane Form) Tuberkuloide Lepra: asymmetrische Hautflecken und knotige Verdickungen peripherer Nerven. Später sensorische und motorische Ausfälle mit Verstümmelungen und Lähmungen. Lepromatöse Lepra: schwerste generalisierte Form bei fehlender T-Zell-Antwort durch ungehemmte Vermehrung der Bakterien. Hellrote bis braune Knoten und Flecken (Leprome), „Löwengesicht“ (Facies leonina), fortschreitender Befall von Haut, Schleimhäuten, Nerven und innerer Organe mit geschwürigem Zerfall. Übergangsformen zwischen Tuberkuloider und Lepromatöser Form (Borderline-Lepra). Allergisch verursachte Hautschwellung mit starkem Juckreiz (Durchmesser bis von 10 cm). Abklingen nach einigen Tagen und Wiederauftreten an anderer Stelle durch Wanderung des Wurmes unter der Haut. Gelegentlich wird der Wurm unter der Bindehaut sichtbar, wenn er über den Augapfel wandert. Eosinophilie. Br. timori: Kleine Sundainseln (Indonesien), Br. malayi: Süd- und Südostasien W. bancrofti: Tropische Gebiete Asiens, Afrikas, des Pazifik, Zentralund Südamerika Frühzeichen: akute fieberhafte deszendierende Lymphangitis der Extremitäten. Gelegentlich passageres Lungeninfiltrat mit Fieber und Husten, Orchitis und Epididymitis. Komplikation: Chylurie mit hochgradigen Eiweißverlusten. Chronische Phase: chronisch rezidivierende Lymphangitis mit narbiger Abflussstörung und Elephantiasis der Stechmücken (Aedes, Anopheles, betroffenen Gebiete. Culex, Mansonia) Tropisches pulmonales Eosinophiliesyndrom: chronisch interstitielle Lungenerkrankung mit rezidivierenden Fieberschüben, nächtlichen Asthmaanfällen und ausgeprägter Eosinophilie. Die Lebensdauer der adulten Würmer beträgt bis zu 10 Jahre. weltweit lokale Hautnekrose: hämorrhagisch-schwarz belegtes Risikogruppen: i.v.-DrogenabhänUlkus mit umliegendem Ödem (Milzbrandkarbunkel), gige, Fernreisende mit Kontakt zu hohes Fieber, schweres Krankheitsbild infizierten Tieren, und Tierprodukten Tropisches Afrika, Jemen, Saudi-Arabien, Südamerika Subkutane Knoten (Onchocerkome), Dermatitiden, Augenläsionen, Erblindung Kriebelmücken der Gattung Simulium Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. 1 Woche bis 3 Monate Erregernachweis in Biopsie vom Ulcusrand (Objektträgerabklatsch von Reizserum nach Skarifikation) (Antikörpernachweis) Wenige Monate bis Jahrzehnte > 3 Monate bis Jahre Mikroskopie (Nachweis säurefester Stäbchen) und PCR aus Biopsiematerial ab 5. Monat Mikrofilariennachweis im Blutausstrich/ Dicken Tropfen (Blutentnahme mittags zw. 11 und 13 Uhr) Antikörpernachweis Br. timori ca. 1-1½ Jahre Br. malayi ca. 1 Monat W. bancrofti ca. 15 Monate Nachweis der Mikrofilarien im EDTA-Blut (QBCMethode) oder im Blutausstrich/ Dicken Tropfen (Blutentnahme zwischen 21 und 2 Uhr, da Mikrofilarien praktisch nur nachts im Blut nachweisbar sind) Antikörpernachweis 1-7 Tage Monate bis Jahre Abstrich (Verdacht auf Anforderung vermerken Sonderbehandlung) Nachweis der Mikrofilarien ab 1. Jahr später auch der Würmer aus Hautbiopsien, Augenuntersuchung Antikörpernachweis Stand 07 2014 Laborinformation Nr. 60 Immunphänotypisierung 1 Immundefekte Erkrankungen des Immunsystems, die durch eine vorübergehende oder irreversible Schädigung der Abwehrfunktion gekennzeichnet sind, werden als Immundefekt bzw. Immundefizienz bezeichnet. Entsprechend der im Vordergrund stehenden Störung wird zwischen Defekten der angeborenen (unspezifischen) und der adaptiven (spezifischen) Immunität bzw. zwischen zellulären und humoralen Immundefekten (Mangel an Antikörpern, Komplement und anderen abwehraktiven Proteinen) unterschieden. Ursächlich differenziert man zwischen primären (genetisch bedingten) und sekundären (erworbenen) Immundefekten. Die primären Immundefekte (PID) sind angeborene Störungen des Immunsystems. Die Prävalenz klinisch relevanter Immundefekte liegt zwischen 1:1200 und 1:2000. Schwere PID manifestieren sich meist im frühen Kindesalter. Leichtere Defekte können aber auch erst im Jugendlichen- oder Erwachsenenalter oder im Zusammenhang mit einer spezifischen Infektion manifest werden. Insgesamt sind mehr als 200 genetisch bedingte PID bekannt. Der häufigste angeborene Immundefekt ist das Antikörpermangelsyndrom (50-60%) und ist oft mit einer erniedrigten Zahl von B-Lymphozyten verbunden. Gemischte B- und T-Zelldefekte liegen in 25-35% der Fälle vor. Isolierte T-Zell-, Phagozytose- und Komplementdefekte sind noch seltener. Tabelle 1 gibt eine Übersicht über die im Routinelabor sinnvolle Diagnostik von Immundefekten. Die weiterführende Diagnostik bei V.a. einen primären Immundefekt im Kindesalter sollte immer in einem darauf spezialisierten Immundefektzentrum erfolgen. Warnzeichen primärer Immundefekte 1. Pathologische Infektanfälligkeit "ELVIS" (opportunistische Erreger, untypische Lokalisation, protrahierter bzw. therapieresistenter Verlauf, besondere Intensität/ Schweregrad und Summe der Infektionen) 2. Immundysregulation "GARFIELD": (Granulome, Autoimmunität, rezidivierendes Fieber, Ekzeme, Lymphoproliferation, chronische Darmentzündung) 3. Gedeihstörung (Säuglinge und Kleinkinder), Gewichtsverlust - meist mit Diarrhoe (Jugendliche/Erwachsene) 4. Auffällige Familienanamnese (z.B. Konsanguinität, Immundefekt, pathologische Infektanfälligkeit) 5. Labor: Lymphopenie, Neutropenie, Hypogammaglobulinämie Die sekundären Immundefekte manifestieren sich überwiegend im Erwachsenenalter und können sich auf der Basis verschiedenster Ursachen entwickeln. Dazu zählen u.a. Infektionen, Autoimmunerkrankungen, maligne Tumore, metabolische Syndrome (z.B. Diabetes), Mangelerkrankungen sowie iatrogen induzierte Störungen (z.B. immunsuppressive, zytostatische und Strahlentherapie). Klassisches Beispiel für einen sekundären Immundefekt ist die HIV-Infektion, bei der die CD4-T-Helferzellen infiziert und ausgeschaltet werden. Tabelle 1: Labordiagnostik bei V.a. Immundefekt Basisdiagnostik (Parameter / Material) weiterführende Diagnostik (Parameter / Material) Großes Blutbild (ggf. Blutausstrich) EDTA-Blut IgG-Subklassen Serum Immunglobuline (IgG, IgA, IgM, IgE) Serum sekretorisches IgA Speichel Zellulärer Immunstatus EDTA-Blut Komplement CH50 Serum gefroren Entzündungsparameter (CRP, BSG) Serum Komplement C3, C4 Serum Immunfixation Serum Impfantikörper Serum TD, MMR, Pneumokokken Eiweißelektrophorese Serum HIV-Antikörper Serum Ggf. HbA1c EDTA-Blut Ggf. Autoantikörper( ANA, AMA, Serum RF, CCP-AK) Geeignetes Ggf. Neopterin Serum lichtgeschützt Material Ggf. Erregerdiagnostik Ggf. Spurenelemente (Mg, Se, Zn) Serum (z.B. AbGgf. IL2-Rezeptor, löslich Serum gefroren strich) Lymphozytentypisierung / Immunstatus Obwohl die Lymphozyten des peripheren Blutes lichtmikroskopisch nicht zu unterscheiden sind, stellen sie eine sehr heterogene Zellgruppe mit verschiedenen Aufgaben der Immunabwehr dar. Man unterscheidet 3 große Differenzierungslinien (T-, Bund NK-Zellen), die sich wiederum aus funktionell unterschiedlichen Subpopulationen zusammensetzen. B-Lymphozyten sinddie Vorstufen der Antikörper-produzierenden Plasmazellen. T-Lymphozyten erfüllen als T-Helfer-Zellen eine Steuerungsfunktion in der spezifischen Immunantwort und zerstören als zytotoxische T-Zellen durch Mikroorganismen infizierte Zellen. NKZellen wiederum spielen eine Rolle bei der unspezifischen Abwehr von Virusinfektionen und der Zerstörung von Tumorzellen. Ferner unterscheiden sich Lymphozyten derselben Subpopulation im Differenzierungsgrad und Aktivierungszustand. Die zur Erfüllung der jeweiligen Funktion notwendige unterschiedliche Ausstattung der Lymphozyten (CD-Antigene der Zelloberfläche, intrazelluläre Marker) kann mit Hilfe Fluoreszenz-markierter monoklonaler Antikörper durchflusszytometrisch auf Einzelzellniveau nachgewiesen werden. Die Lymphozytentypisierung gibt keine Auskunft über die Funktionsfähigkeit der Zellpopulationen, da normale Zellzahlen einen funktionellen Immundefekt nicht ausschließen können. Anforderung Markerpanel Untersuchte Zellpopulationen Kleiner zellulärer Immunstatus CD3, CD4, CD8 CD4- und CD8-T-Lymphozyten z.B. bei HIV-Infektion, Tumoren Immunstatus CD3, CD4, CD8, CD19, CD16, CD56 Abs./rel. Anteile der T-Helfer- (CD3+/CD4+), zytotoxischen T(CD3+/CD8+), NK-Zellen (CD16+/CD56+) und der BLymphozyten (CD19+) Großer zellulärer Immunstatus* CD3, CD4, CD8, CD19, CD16, CD56, CD38, HLA-DR Abs. / rel. Anteile der T-Helfer- (CD3+/CD4+), zytotoxischen T(CD3+/CD8+), aktivierten T- (CD38+, HLA-DR+) und NK-Zellen (CD16+/CD56+) sowie der B-Lymphozyten (CD19+) *weitere Oberflächenmarker / Subpopulationen auf Anforderung möglich. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 03 2013 Laborinformation Nr. 61 Immunphänotypisierung 2 Hämatoonkologie Die durchflusszytometrische Immunphänotypisierung hat sich schon vor Jahren als eine zuverlässige Technik in der hämatologischen Diagnostik etabliert. Die lasergestützte Messung einer großen Zahl einzelner Blutzellen mit Bestimmung der Parameter Zellgröße, Granularität, Art und Dichte von Oberflächenmolekülen (CDMoleküle) ermöglicht die Zuordnung der Zellen des peripheren Blutes zu den verschiedenen morphologischen und funktionellen Entwicklungs- und Differenzierungslinien sowie die Erkennung maligner Veränderungen. Das Prinzip der Analyse ist in den folgenden Abbildungen illustriert. Klassifizierung der Zellen nach Größe, Granularität und Oberflächenmarkerexpression Stufendiagnostik in der Hämatoonkologie An erster Stelle der hämatologischen Stufendiagnostik steht weiterhin die zytomorphologische Beurteilung. Das mikroskopische Blutbild gibt die ersten Hinweise auf eine hämatologische Grunderkrankung. Zur weiteren Differenzierung, wie z. B. bei Nachweis von Blasten oder atypischen Lymphozyten, wird die Immunphänotypisierung angeschlossen. Die Auswahl des Antikörperpanels erfolgt unter Berücksichtigung des mikroskopischen Bildes. Die simultane Erfassung mehrerer Oberflächen- und intrazytoplasmatischer Antigene erhöht die Sensitivität und Spezifität der Analyse. Die Immunphänotypisierung ermöglicht somit einerseits die Festlegung der Linienspezifität (lymphatisch oder myeloisch), andererseits die Subtypisierung von malignen Zellen (CLL-Zellen, Haarzellen, Mantelzellen) sowie den Klonalitätsnachweis. So werden bei mikroskopischem Nachweis von vermutlich neoplastischen atypischen Lymphozyten die Marker des B-NHL-Panels angesetzt und die Kombination von verschiedenen Antigenexpressionsmustern bewertet. So weist z. B. die B-CLL einen typischen Immunphänotyp auf, der von einem von Matutes et al. entwickelten Score erfasst wird. Charakteristika der B-CLL • CD5+ • CD23+ • FMC7• sIgM (+) • sCD22 (+) oder CD79b (+) Die Expression von CD38 und die zytoplasmatische Expression von ZAP 70 können zusätzlich als Prognoseparameter verwendet werden. Ein weiteres Anwendungsgebiet der Immunphänotypisierung ist die PNH-Diagnostik. Die Analyse der GPIverankerten Proteine ist heute die empfindlichste und aussagekräftigste Methode und damit Goldstandard in der PNH-Diagnostik. Des Weiteren ist die Abklärung einer Sphärozytose mit dem EMA-Test (Eosin-Maleimid) möglich. Ein ZNS-Befall durch verschiedene Leukämien oder Lymphome kann auch mittels Immunphänotypisierung der Zellen im Liquor diagnostiziert werden. Außerdem können quantitative Verschiebungen der Zellpopulationen in der broncho-alveolären Lavage als Hinweis auf chronische Lungenerkrankungen (Sarkoidose) identifiziert werden. Für die Lymphozytentypisierung werden 2 ml frisches EDTA-Blut benötigt. Nach der Abnahme bitte die Monovette durch leichtes Schwenken gründlich mischen. Lagerung bei Raumtemperatur. Anforderung B-NHL T-NHL Akute Leukämie PNH Sphärozytose Antikörperpanel CD3, CD5, CD10, CD11c, CD19, CD20, CD22, CD23, CD25, CD38, CD43, CD79b, CD103, IgM, FMC7, kappa/ lambda Leichtketten, ZAP-70 CD1a, CD2, CD3, CD4, CD5, CD7, CD8, CD19, CD20, CD56, CD57, TCR αß, TCR γδ variabel Erythrozyten: CD58, CD59 Monozyten: CD14, CD48, CD55, FLAER Granulozyten: CD16, CD24, CD55, FLAER EMA (Eosin-Maleimid) Indikation Diagnose und Klassifikation von B-Non-HodgkinLymphomen Diagnose und Klassifikation von T-Non-HodgkinLymphomen Diagnose und Klassifikation akuter Leukämien Diagnose einer Paroxysmalen Nächtlichen Hämoglobinurie (Fehlen der GPI-verankerten Oberflächenmoleküle) Abklärung einer Sphärozytose (Kugelzellanämie) Weitere Oberflächenmarker / Subpopulationen auf Anforderung möglich. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 07 2014 Laborinformation Nr. 62 Allergie 1 IgE vermittelte Reaktionen Auswahl der Allergene Indikation Die häufigsten Allergien werden mit ca. 50 Allergenen erfaßt. Für Ekzem darüber hinausgehende Fälle – typische Anamnese, schwere Reaktion – kann die Übersicht aller verfügbaren Allergene und Atemwege Allergenkomponenten herangezogen werden. Zum Nachweis Asthma/Rhinitis IgE-vermittelter Allergien bieten wir über 1800 Allergentests. Frühblüher Kreuzallergie-Syndrome Sensibilisierungen gegen unterschiedlichste Allergen lassen sich oft auf sogenannte Kreuzallergie-Syndrome zurückführen (siehe Spätblüher nebenstehende Tabelle). ganzjährig Mögliches Vorgehen 1. Erfassung der häufigsten Sensibilisierungen Allergenprofile nach Symptom, Allergenquelle, Kreuzreaktivität, Saison. (Siehe bitte Anforderungsscheine Allergie 1, 2, 3, ...) 2. Gezielte Diagnostik auf einzelne Allergene Typische Anamnese, schwerwiegende Reaktion, vermutete Kreuzallergie 3. Allergenkomponenten-Test Bei positivem Voll-Allergenextrakt-Test (z. B. Erdnuss, Haselnuss, Soja, Milch, Garnele, Kabeljau, Birkenpollen, Hausstaubmilbe, Lieschgras) ist es sinnvoll zur Einschätzung z. B. des Risikos für schwere Reaktionen oder persistierende Allergie bzw. vor Immuntherapie, die einzelnen Allergenkomponenten zu bestimmen. Allergen-Komponenten sind die immunogenen Bestandteile der Voll-Allergenextrakte. Allergen-Komponenten werden in Proteinfamilien mit ähnlichen Eigenschaften eingeteilt. Mit ihnen kann z. B. die Schwere der klinischen Erscheinungen eingeschätzt oder die zugrundeliegende Allergisierung bzw. Kreuzallergien erkannt werden. (Siehe Allergie 2). Anforderungsbogen Haustier Fell Gastrointestinal Kinder Erwachsene Parameter spez. IgE Hühner-, Milcheiweiß, Erd-, Haselnuss, Weizenmehl, Soja, Kabeljau, Milbe d1 Milbe d1, Katze e1, Hund e5, mx1, Lieschgras, Birke, Ambrosie, Beifuß Hundszahn-, Lieschgras, Birke, Ulme, Pappel, Esche, Löwenzahn, Spitzwegerich Lolch, Schilfgras, Roggen, Ahorn, Eiche, Ambrosie w1, Beifuß, Gänsefuß w10 Milbe d1, Milbe d2, Katze e1, Hund e5, Schabe i6, Penicillium m1, Cladosp. m2, Alternaria m6 Katze e1, Pferd e3, Hund e5, Maus e71, Meerschwein e6, Kaninchen e82, Hamster e84 Hühner-, Milcheiweiß, Erd-, Haselnuss, Weizenmehl, Soja, Karotte, Sellerie Kabeljau, Weizenmehl, Erd-, Haselnuss, Soja, Garnele f24, Kiwi, Sellerie f85 Kreuzallergie-Syndrome Proteinfamilie Latex-Frucht Latex, Banane, Avocado, Kiwi, Papaya, Mango, diverse Feige, Esskastanie, Melone, Tomate diverse Sellerie-Beifuß-Gewürz Sellerie, Beifuß, Art v1, Anis, Pfeffer, Petersilie, Senf, Muskat, Melone , Sonnenblumenkerne Birke-Obst Birke, Apfel, Kirsche, Pfirsich, Karotte, Kiwi PR10 Pflaume, Sellerie, Soja, Feige Birke-Hülsenfrüchte Birke, Bet v1, Erdnuss, Ara h8, Soja, Gly m4 PR10 Ficus-Frucht Ficus RK81, Feige, Kiwi, Banane, Papaya, diverse Ananas, Avocado Gräser-Getreide Erdnuss, Soja, Erbse, Lupinenmehl, Pistazie Milbe-Meeresfrüchte Garnele, Muschel, Der p10, Pen a1, Pen m2 Tropomyosin Parvalbumin Fische Dorsch, Gad c1, Cyp c1, Karpfen Fleisch, Gelatine Fleisch, Gelatine, α-Gal Die Allergie-Anforderungsbögen enthalten - die häufigsten Allergene pro Altersgruppe als Einzelteste in Gruppen - umfassende Auswahl relevanter Allergene zur schnellen Orientierung Allergenkomponenten bei Kreuzreaktionen CCD o214, MUXf3 - Allergenkomponenten-Teste Die Übersicht aller verfügbaren Allergie IgE-Teste bitte anfordern. Altersgruppe Säuglinge häufig sensibilisiert gegen Nahrungsmittel (Milch, Eier, Soja, Weizen, Erdnuss). Rückbildung in 40-50 %, selten bei Erdnuss, Fisch. Kinder <3 Jahre Nahrungsmittel (Milch, Eier, Soja, Weizen, Erdnuss). Inhalationsallergene im Verlauf Tolerierung von Nahrungsmitteln mit Überwiegen der Inhalationsallergie. Erwachsene siehe Tabelle unten Sensibilisierung (in %) nach Altersgruppen gegen 50 häufige Allergene Alter (J.) SX1 Nahrung Gräserpollen Baumpollen Hausst.milben Kräuterpollen Tierepithelien Schimmelpilze Latex 18-29 30-39 40-49 50-59 60-69 70-79 45 43 36 29 23 19 29 30 28 22 20 20 31 28 21 13 10 9 23 23 23 16 13 10 25 21 17 12 10 7 18 14 13 7 5 7 15 13 12 7 5 4 7 4 5 4 4 3 5 7 5 3 2 3 (Studie zur Gesundheit Erwachsener in Deutschland (DEGS1) ) Versteckte Nahrungsmittel-Allergene (Anlage 3 LMKV)*1 Gluten, Ei, Erdnuss, Sojabohne, Milch, Sellerie, Senf, Sesam, Lupinen, Krebstiere, Weichtiere Mandel, Hasel-, Wal-, Cashew-, Pekan-, Paranuß, Pistazie, Macadamia (Schwefeldioxid, Sulfit sind Unverträglichkeiten) *1 Bundesgesundheitsblatt März 2013, Bd. 55, Heft3, 385 ff; LMKV Lebensmittelkennzeichnungsverordnung Profiline Polcalcine Bet v2, Phl p12, Hev b8 Phl p7, Bet v4 ISAC Biochip IgE 112 Allergenkomponenten Hinweise zu Laborparametern Allergenspezifisches IgE 1. Testsystem ImmunoCAP FEIA CAP (Capacity), FEIA (Fluoreszenz Enzym Immunoassay) ist eine Weiterentwicklung des RAST (Radio-Allergo-Sorbent-Test). Kalibrierung am WHO IgE-Standard, Angabe der Ergebnisse in KU/l und semiquantitativ in CAP-Klassen (1-6). Einsatz von hochreinen Nativ-Allergenen und Allergenkomponenten. Gilt seit Jahren international als Goldstandard der serologischen Allergietestung. Allergenkomponenten spez. IgE sind Kassenleistung. 2. ISAC Biochip IgE (ISAC = Immuno-Solidphase-Allergo-Biochip) 112 Allergenkomponenten werden simultan in 3-fach Bestimmung getestet, mit detaillierter Ergebnisangabe und individueller Befundung. Indikation: multiple Sensibilisierung, Erfassung von Primärsensibilisierung, Kreuzallergien, Risikoabschätzung für schwere Reaktionen etc. Derzeit keine Kassenleistung. 3. CCD-Ak (CCD = Kohlehydratseitenketten) Unspezifisch positive Ergebnisse bei Antikörpern gegen CCD. Oft CAP-Klasse 2-3 positiv bei vielen verschiedenen Allergene und Mischungen bei einem Patienten. CCD-Ak sind kein Hinweis auf klinisch bedeutsame Sensibilisierung. Anforderung und Material allergenspez. IgE (siehe Anforderungsscheine Allergie)1 ml Serum ISAC IgE Biochip 0,5 ml Serum allergenspez. IgG4 Bienengift, Wespengift, D. pteron., D. farinae, Lieschgras 1 ml Serum Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 11 2014 Laborinformation Nr. 63 Allergie 2 Allergen-Komponenten Allergene Labordiagnostik Bewertung Allergene sind Antigene, gegen die sich die Immunantwort richtet. Vollallergen Allergenkomponente In Laborverfahren werden in der Regel wässrige oder alkoholische Eignung für SIT*1 Vollallergenextrakte verwendet. Bei Vollallergenextrakten ist unbekannt, gegen welche Komponente die spez. IgE gerichtet sind, z. Lieschgraspollen B. gegen ein „gefährliches“ Lipidtransferprotein (LTP) bzw. SpeiPhl p1 p5 p7 p12 cherprotein oder eine harmlosere Kohlehydratseitenkette (CCD). + + - sehr gut Allergen-Komponenten sind die immunogenen Bestandteile der + + + + gut Voll-Allergenextrakte. Allergen-Komponenten werden in Protein+ gering Polcalcin familien eingeteilt, die ähnliche Eigenschaften haben. Mit ihnen + gering Profilin kann z. B. die Schwere der assoziierten klinischen Erscheinungen eingeschätzt werden oder die zugrundeliegende Allergisierung bzw. Kreuzallergien erkannt werden. Das Allergenkomponenten- Birkenpollen Bet v1 v2 v4 Testpanel wird laufend weiterentwickelt. + sehr gut PR10 Siehe den aktuellen RAST-Anforderungsbogen, bitte ggf. im Labor nachfragen. Wir informieren Sie über Neuentwicklungen. + + + gut + gering Profilin Proteinfamilie assoziierte Klinik + gering Procalcin orales Allergie S. schwere Reaktion Risiko schwerer Reaktion Speicherproteine + + Erdnuss Ara h1,2,3 h9 h8 Lipid-Transfer-Proteine + + + erhöht SP*4 Parvalbumine + + + erhöht LTP*4 Tropomyosine + + 2 + eher OAS* PR10 PR10-Proteine + weniger häufig Profiline CCD selten selten Vorteile der Allergen-Komponenten definiertes Allergen Risiko-Abschätzung für schwere Reaktionen Erkennung von zugrundeliegender Allergisierung „Kreuz-Allergien“ weniger bedeutsamen Sensibilisierungen Eignung für spez. Immuntherapie (SIT) - Soja Beispiel LTP, Speicherprotein Lieschgras, Birke PR-10 (Birke) CCD-Ak, Profiline Lieschgras, Milbe ... Birkenpollen-Allergie Bet v1 Marker für Primärsensibilisierung gegen Birkenpollen Bis zu 80% der Birkenpollen-Allergiker hat über PR10-Kreuz-Allergie gegen: Bäume Erle, Buche, Kastanie, Hasel, Hainbuche, Eiche. Obst Apfel, Birne, Pfirsich, Kirsche, Kiwi, Aprikose, Stachelbeere, Nüsse Haselnuss, Walnuss, Mandel, Erdnuss, Soja, Erbse Gemüse Karotte, Sellerie, Petersilie, Spargel, Tomate Allergenkomponenten und erhöhtes Risiko schwerer Reaktion Phadia- Komponente Allergenquelle Code Speicherproteine (SP) f354 Ber e1 Paranuss f422 Ara h1 Erdnuss f423 Ara h2 Erdnuss f424 Ara h3 Erdnuss f431 Gly m5 Soja f432 Gly m6 Soja Lipid Transfer Proteine (LTP) w233 nArt v3 Beifuß w211 rPar j2 Glaskraut f420 rPru p3 Pfirsich f425 rCor a8 Haselnuss f427 rAra h9 Erdnuss f433 Tri a14 Weizen Parvalbumine f355 Cyp c1 Karpfen f426 Gad c1 Kabeljau Tropomyosin f351 Pen m1 Shrimps weitere wichtige Allergene f233 Gal d1 Ei f416 Tri a19 Weizen Asthma-Risiko m229 Alt a1 Alternaria Gly Name lateinisch Abk. Bertholletia excelsa Arachis hypogaea Ber e Ara h Glycine max Gly m Artemisia vulgaris Parietaria judiaica Prunus persica Corylus avellana Arachis hypogaea Triticum aestivum Art v Par j Pru p Cor a Ara h Tri a Cyprinus carpio Gadus morhua Cyp c Gad c Penaeus aztecus Pen m Galina domestica Triticum aestivum Gal d Tri a Alternaria alternata Alt a Apfel Mal Haselnuss Cor Pfirsich Pru m4 + m 5 + - m 6 + - d1 d3 + - + - Phl p12 a1 + p1 + a8 + p3 + Tri a14 a19 + + Kuhmilch Bos d4 d5 erhöht eher OAS*2 + a9 a14 + + p4 + Weizen Hühnereiweiß Gal Fleisch Fisch d6 erhöht gering gering LTP*4 PR10 Profilin OAS*2 erhöht erhöht PR10 LTP*4 SP*4 OAS*2 erhöht selten PR10 LTP*4 Profilin WDEIA*3 erhöht LTP*4 d8 + hitzestabil, Allergie-Persistenz hitzelabil + + + d1 + d2 d3 d4 + + + α-Gal Gad c1 Cyp c1 SP*4 PR10 hitzestabil, Allergie-Persistenz hochallergen hitzelabil generelle Fleischallergie generelle Fischallergie generelle Fischallergie Bei Anforderung der Allergenkomponenten immer vollständige lateinische Abkürzung der Allergenkomponente angeben z. B. Phl p1, Phl p5, oder Ara h8, Ara h9 (s. nebenstehende Tabelle) Legende: *1 SIT spezifische Immuntherapie, Desensibilisierung *2 OAS orales Allergie-Syndrom *3 WDEIAWeizen-abh. anstrengungs-induzierte Anaphylaxie *4 SP (Speicherproteine) und LTP sind hitzeresistent. Anforderung Allergenkomponente explizit angeben (siehe Anforderungsbogen) ISAC Biochip Bitte Unterlagen im Labor anfordern. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Material Serum 0,5 ml Serum Stand 11 2014 Laborinformation Nr. 64 Allergie 3 Unverträglichkeiten (Nicht-IgE) Nicht IgE-vermittelte Reaktionen Labordiagnostik Indikation ASS-Unverträglichkeit ASS-Intoxikation, -Dosis ASS-Resistenz Hinweise zu Laborparametern Als Allergie werden neben IgE-vermittelten Typ 1 Reaktionen auch Nicht-IgE vermittelte „Unverträglichkeiten" bezeichnet, denen u. a. Enzymmangel, Intoleranzen, Mastozytose, C1-INHMangel, Leaky Gut Syndrom oder willkürliche Definitionen (Wasser-Allergie) zugrundeliegen können. Enzymmangel (Lactose-, Fruktose-, Sorbitintoleranz) ist gut über Atemgasanalyse erfassbar. Spezifisches IgE hier nicht sinnvoll. Nahrungsmittel und Nahrungsmittelzusatzstoffe, ebenso wie Medikamente, soweit nicht IgE-vermittelt, sind im CAST (Zellulärer Antigen-Stimulationstest) untersuchbar. Indikation Parameter Material Gastrointestinaltrakt Zöliakie Gliadin-, Endomysium-Ak Serum TTG-Ak, ggf. IgA gesamt Morbus Crohn Pankreas exokrin-Ak, ASCA Serum Colitis ulcerosa x-ANCA, Becherzell-Ak Serum Gastritis atrophisch PCA, Intrinsic-Faktor-Ak Serum Pankreas-Insuff. exokrin Elastase Stuhl Kuhmilch-Intoleranz Kuhmilch-Ak Serum Mastozytose Tryptase Serum Enzym-Mangel Lactasemangel Lactose-H2-Atemgastest Testset 901 Klinik nach Organsystemen – Differentialdiagnose Fruktose-Intoleranz Fructose-H2-Atemgastest Testset 900 (siehe auch nebenstehende Tabelle) Sorbit-Intoleranz Fructose-Sorbit-Atemgastest Testset 917 Gastrointestinaltrakt erfaßt wird Additiva-Intoleranz siehe CAST Anfo-Bogen *2 3 ml EDTA Zoeliakie Gluten-Unverträglichkeit Sulfit-Intoleranz Sulfit CAST (K-Metabisulfit) 3 ml EDTA Lactase-Mangel verminderter Abbau von Laktose Glutamat CAST*2 3 ml EDTA Fruktose-Intoleranz verminderte Resorption von Fruktose Glutamat Lebensmittel-Farbst. siehe CAST Anfo-Bogen *2 3 ml EDTA Additiva-Intoleranz Farbstoff-, Benzoat-, Nitrit-, Sulfit-, 3 ml EDTA Salicylat-, Glutamat-Unverträglichkeit Konservierungsstoffe siehe CAST Anfo-Bogen *2 Serum Sulfit-Intoleranz in Wein, Chips, Trockenfrüchten uvm. Histamin-Intoleranz*1 Diaminooxidase Histamin EDTA-Plasma gefr Kuhmilch-Intoleranz Kuhmilch-Unverträglichkeit Leaky Gut Syndrom Zonulin Stuhl Histaminunverträglichkeit verminderter Abbau von Histamin? Mastozytose vermehrte Gefäßmediatoren Atemwege Atemwege exogen-allerg. Alveolitis Typ III Reaktion über spez. IgG exogen-all. Alveolitis siehe Anfo-Bogen EAA Angioödeme Farmerlunge Serum Vogelhalterlunge Serum Labordiagnostik zur Acetylsalicylsäure (ASS) Asthma entz. Aktivität ECP Serum Nicht steroidale antiinflammatorische Salicylate und andere NSAID ( Salicylat-Unverträglichkeit ASS CAST*2 3 ml EDTA Medikamente) inhibieren die Zyklooxygenase (COX) mit infolge NSAID Ibuprofen CAST*2 3 ml EDTA verminderter Synthese der Prostaglandine. Indometacin CAST*2 3 ml EDTA Bei intoleranten Personen kommt es zur Aktivierung von Basophilen, Acetaminophen CAST*2 3 ml EDTA Eosinophilen, Makrophagen, Mastzellen, Thrombozyten und Lymphozyten mit Symptomen an Haut, Schleimhaut und Darm. Angioödem C1-INH Aktivität, Citratpl. gefr. ASS-Unverträglichkeit C1-INH Konzentration, C4 Symptome: Rhinitis, Asthma, Polypen in der Nase, Urtikaria, bei Kollagenose ANA, ANCA Serum Darmentzündung mit Diarrhoe. bei ACE-Hemmer Ursache: Reaktion auf COX-hemmende Substanzen in Schmerzmitteln, Kosmetika, Pflanzen. Medikamente siehe RAST-, CAST-Anforderungsbogen Derzeitige Empfehlung zur Diagnostik ist der AspirinBitte telefonische Rücksprache mit Labor. Provokationstest. Die Diagnose einer ASS-Unverträglichkeit sollte nicht nur auf 1 Labortest gegründet werden, da es keinen wirklich unumstrittenen Laborparameter gibt. Bei Kontraindikation eines Implantat-Unverträglichkeit*2 Titan-, Silber-, Kupfer-Melisa*2 CPDA ASS-Provokationstestes kann der CAST ASS durchgeführt werden. Chrom-, Nickel-, Gold-Melisa*2 CPDA Die ASS-Unverträglichkeit bitte nicht mit ASS-Intoxikation (Bitte vor Anforderung mit Labor Kontakt aufnehmen!) oder ASS-Resistenz vermengen. Anforderung Material ASS CAST*2 3 ml EDTA Salicylat im Serum 1 ml Serum ThrombozytenXIPLA-Blut** funktionstest auf ASS **(Bitte unbedingt mit Labor Kontakt aufnehmen 0821-4201-900) Medikamente CAST (Zellulärer Antigen Stimulationstest)*2 Basophile Granulozyten des Patienten werden mit dem Allergen inkubiert und die zelluläre Reaktion über die Expressionszunahme von CD63 gemessen. CD63 ist ein Aktivierungsmarker. Derzeit sind ca. 20 Lebensmittelzusatzstoffe (Sulfit, Glutamat, Nitrit, Farben) und ca. 40 Medikamente testbar. Jedes Medikament kann jeden Reaktionstyp auslösen, der Melisa*2 Pathomechanismus ist oft unbekannt, die relevanten Epitope Modifizierter Lymphozytentransformationstest, Erfassung von nicht bekannt. Siehe CAST und RAST-Anforderungsbögen. Metallsensibilisierung. Siehe Unterlage "Melisa-Test". Bitte telefonische Rücksprache mit Labor. Testzeitpunkt: 6 Wochen bis 6 Monate nach Ereignis. Legende Implantate (Zahn, Gelenk) *1 Parameter vor und nach Auslassversuch histaminhaltiger Nahrungsmittel. Es kann vor Implantation per Lymphozyten-Transformationstest *2 Keine Kassenleistung. auf Bestandteile des Implantates getestet werden. Dazu z. B. beim Hersteller Bestandteile der verwendeten Legierung erfragen. Auf metallische Bestandteile kann getestet werden. Für Zemente und Kleber kann ggf. das fragliche Material mitgeschickt werden. Bitte vorher mit Labor Kontakt aufnehmen. Urheberrechtlich geschützt. Vervielfältigung und Nachdruck nur mit ausdrücklicher Genehmigung zulässig. Stand 11 2014