Nervenphysiologie 3.4.3
Werbung

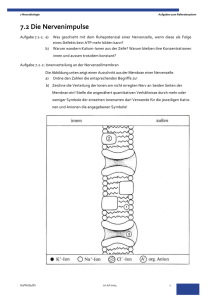
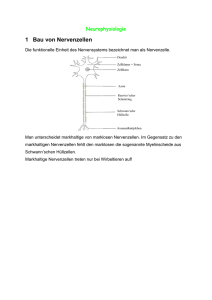
Bewegungssystem Nervenphysiologie 3. 4. 3 Bau und Einteilung der Neurone präsynaptische Endigung Dendriten Zellkörper Axonhügel Axon Neurone bestehen aus einem Zellkörper und Nervenfortsätzen und sind zur Erregungsbildung sowie zur Erregungsleitung fähig. Sie lassen sich anhand der Anzahl ihrer Fortsätze einteilen. Die meisten Nervenzellen haben ein Axon, welches elektro­ nische Impulse zu anderen Neuronen oder zu Muskelzellen weiterleitet, und mehrere Dendriten, die Impulse aus anderen Zellen aufnehmen. Diese Form wird multipolar genannt. Nervenzellen haben kein eigenes Stützgewebe sowie keine eigene Abwehrfunktion und können sich nicht alleine ernähren. Diese Aufgaben übernehmen die Gliazellen (Stützzellen). Gliazellen isolieren die Nervenzellen auch elektrisch voneinander, was für die Reizweiterleitung von enormer Bedeutung ist. Nervenfasern bestehen aus dem Axon und den sie umhüllenden Gliazellen, diese bilden die Nervenscheide oder Markscheide [Abb. 1]. In der Peripherie werden diese um­ hüllenden Zellen Schwann`sche Zellen genannt. Sie umwickeln die Axone mehrfach. Aber nicht alle Axone sind umwickelt. Dementsprechend unterscheidet man Nerven­ zellen in markscheidenhaltig und markscheidenfrei. Weiterhin werden Nervenfasern hinsichtlich ihrer Länge, Dicke, Funktion und Leitungsgeschwindigkeit eingeteilt [Tab. 1]. Die Länge von Nervenfasern variiert zwischen wenigen Millimetern (im ZNS) und einem Meter (z. B. vom Rückenmark zum Fuß im PNS). Die Reizleitungsgeschwindig­ keit der einzelnen Nervenfasern ist sehr unterschiedlich. Sie ist höher bei myelinisier­ ten Nervenfasern (mit Markscheide) und bei dickeren Nervenfasern. Schmerzfasern sind oft nicht umhüllt und können deshalb manchmal sehr langsam, dafür lang anhal­ tend leiten. Name Durchmesser der Nervenfaser Vorkommen (Beispiele) Aa 10 – 20 μm Motoneurone, die die Skelettmuskulatur inner­ vieren 60 – 120 m/s Ab 7 – 15 μm afferente Fasern von Hautrezeptoren für Berüh­ rung und Druck 40 – 90 m/s Schwann`sche Zellen Ad 2 – 6 μm afferente Fasern von Rezeptoren für Tempera­ tur, Schmerz und Druck 15 – 25 m/s Ranvier`scher Schnürring B 1 – 3 μm efferente Fasern, sympathisch, präganglionär 3 – 15 m/s C 0,5 – 2 μm, markscheidefrei afferente Fasern von Rezeptoren für Eingewei­ deschmerz, grobe Berührungen 0,5 – 2 m/s präsynaptische Endigung [1] Schema eines typischen ­Neurons 200 [Tab. 1] Einteilung der Nervenfasern Leitungs­ geschwindigkeit 3 Nervensystem Schnittstelle zwischen Nerven- und Bewegungssystem Die Skelettmuskulatur wird durch motorische Nervenfasern des PNS erregt. Dies Tiefensensibilität | 199 löst die eigentliche Muskelkontraktion und damit die Bewegung (Motorik) aus [Abb. 2]. Vestibularorgan | 196 Das ZNS erhält Informationen über die Muskulatur durch sensorische Nervenfasern. Synapse | 25 Die sensorischen Nervenfasern leiten Informationen über den Spannungszustand Aktin und Myosin | 22 und damit über die Lage und die Stellung der einzelnen Muskeln an das ZNS. Diese Informationen stammen Axon von den Propriorezeptoren in den Muskeln. Sie geben Informationen über die |Tiefensensibilität. Endknöpfchen Weitere Informationen über die Stellung des gesam­ ten Körpers in Bezug zum Schwerkraftfeld der Erde wer­ synaptischer Spalt den mit Hilfe des |Vestibularorgans im Innenohr ermit­ telt. Die neuromuskuläre Übertragung, die Übertragung der Erregungen von der Nervenzelle auf einen Muskel, Muskelzellen Rezeptor erfolgt an der motorischen Endplatte [Abb. 3]. Sie ist eine für Erregungssto¤ Sonderform der |Synapse. Soll ein Muskel erregt werden, Transmitter wird an der motorischen Endplatte der Transmitter Aze­ tylcholin ausgeschüttet. Daraufhin wird innerhalb der [2] Erregungsübertragung am Muskel Myofibrille Kalzium ausgeschüttet. Dieses ermöglicht sensorische die Bindung zwischen |Aktin und Myosin. Rückenmark Nervenfaser Reflexbogen Reflexe sind unwillkürliche, sehr schnelle motorische Reaktionen auf äußere Reize, welche eine umgehende Reaktion zur Gefahrenabwehr brauchen. Dies kann z. B. bei Schmerzreizen der Fall sein, die zu einem sofortigen Zurückziehen der Hand führen, bevor der Schmerz be­ wusst vom Gehirn wahrgenommen wird. Über reflexar­ tige Zellverbände regelt das Rückenmark die Anspannung der Muskulatur und übernimmt so wichtige Halte- und Stellfunktionen. Ein Reflexbogen [Abb. 4] besteht aus dem π Wahrnehmungsorgan (Rezeptor), das den Reiz aufnimmt (z. B. Schmerz), π sensiblen Nerv, der den Reiz zum Rückenmark leitet, π Reflexzentrum im Rückenmark, das den sensiblen Reiz auf eine motorische Zelle umschaltet, die ihrerseits erregt wird, π motorischen Nerv, der den neuen Bewegungs­ impuls zum Muskel leitet, sowie π dem Erfolgsorgan (i. d. R. ein Muskel). Me ld Scapula un g M. biceps brachii Propriorezeptoren l feh Be weiße Substanz motorische Endplatte motorische Nervenfaser graue Substanz [3] Innervation der Muskeln am Bewegungsapparat nm e ck Rü sensibler Nerv ventral graue Substanz motorischer Nerv [4] Reflexbogen 201 k ar dorsal weiße Substanz Bewegungssystem Man unterscheidet Eigen- und Fremdreflexe. Beim Auslösen eines Eigenreflexes sind Wahrnehmungs- und Erfolgsorgan identisch. So führt eine plötzliche Dehnung der Patellarsehne, z. B. durch einen Schlag mit dem Reflexhammer, zu einer reflekto­ rischen Kontraktion der Muskelsehne des M. quadriceps, wodurch das Knie gestreckt wird. Dieser Reflex dient der schnellen Gefahrenabwehr, z. B. beim Stolpern. Beim Fremdreflex unterscheiden sich Wahrnehmungs- und Erfolgsorgan. Ein ty­ pischer Fremdreflex entsteht, wenn die Bauchhaut von außen nach innen bestrichen wird und sich reflektorisch die Bauchwandmuskulatur zusammenzieht. Grundlagen der Bioelektrizität Ion positiv oder negativ elektrisch geladenes Atom oder Mole­ kül Kathode negative Elektrode Anode positive Elektrode Permeabilität permeabilis, lat. = durchlässig Jede menschliche Zelle – ob es sich um eine Darmzelle oder ein Neuron handelt – ist gegenüber dem Umgebungsmedium elektrisch geladen. Sinnes-, Muskel- und Ner­ venzellen sind sogar darauf spezialisiert, auf elektrische Erregung zu reagieren bzw. selbst elektrische Signale zu erzeugen. Im Mensch wird Elektrizität allerdings völlig anders erzeugt und weitergeleitet, als dies aus der Technik bekannt ist. Der Mensch besteht, je nach Geschlecht und Alter, zu 50 –75 % aus Wasser. Daher fließen die Ströme hier in einer wässrigen Lösung. Anders als in einem Leiter aus Metall, durch den Elektronen fließen, wird der Strom in wässrigen Lösungen durch |Ionen getragen. Reines Wasser enthält kaum Ionen und leitet den elektrischen Strom schlecht. Löst man aber Salze im Wasser, dann erhöhen die gelösten Ionen die elek­ trische Leitfähigkeit der Lösung. Die positiv geladenen Kationen wandern zur |Katho­ de, die negativ geladenen Anionen zur Anode. Auch die mit Flüssigkeit gefüllten Räu­ me in den Lebewesen enthalten gelöste Salze. Als Folge der selektiven |Ionenpermeabilität von Biomembranen ergibt sich bei ­allen menschlichen Zellen im Zellinnern eine andere Ionenkonzentration als in der Flüssigkeit außerhalb der Zelle. Das Zellinnere ist arm an Natrium- (Na+) und Chlo­ ridionen, dafür aber reich an Kaliumionen (K+) und organischen Anionen, während auf der Außenseite der Zelle genau das Gegenteil zutrifft. Diese Ungleichverteilung von Ionen ist der Grund dafür, dass sich eine Potenzialdifferenz über der Zellmembran ausbildet. Das geschieht automatisch allein auf Grund der unterschiedlichen Ionen­ konzentrationen auf beiden Seiten der Membran. Ruhepotenzial Sticht man mit Mikroelektroden in eine beliebige Körperzelle ein, ist immer eine Potenzialdifferenz gegenüber dem Umgebungsmedium messbar. Fast immer ist das Zellinnere gegenüber der Außenseite negativ geladen. Bei dieser Potenzialdifferenz, die allen menschlichen Zellen eigen ist, spricht man vom Ruhepotenzial. K+ und Na+ bestimmen das Ruhepotenzial. Das Gleichgewichtspotenzial stellt sich nur im hypo­ thetischen Modell ein, bei dem die trennende Membran nur für eine Ionenart perme­ abel ist. Die Zellmembran der Zelle ist aber für verschiedene Ionen durchlässig. Alle vorkommenden Ionen zusammen bestimmen das Ruhepotenzial der Zelle. Jedes Membranpotenzial kommt durch Ionen zu Stande, die Ladungen von der ei­ nen Seite der Membran auf die andere transportieren. Weil die Membran für einige der Ionen nicht permeabel ist, entsteht eine Ladungstrennung. Daraus lässt sich weiter folgern, dass der Beitrag einer Ionenart zum Membranpotenzial umso kleiner sein wird, je geringer die Permeabilität für diese Ionenart ist. Daher wird die Ionenart, die am leichtesten die Membran durchdringt, den größten Beitrag zum Ruhepotenzial leisten. Das Ruhepotenzial eines menschlichen Neurons liegt typischerweise zwischen – 40 und – 75 mV. Dieser Wert ist positiver als das Gleichgewichtspotenzial von K+, aber weit negativer als das Gleichgewichtspotenzial von Na+. Das hat seinen Grund darin, dass die Zellmembran in Ruhe wesentlich besser für K+ als für Na+ permeabel ist. 202 3 Nervensystem Das Ruhepotenzial von Neuronen wird demnach hauptsächlich durch K+ bestimmt. Weil aber immer etwas Na+ in die Zelle einsickert, leistet auch dieses Ion seinen Beitrag. Auch wenn Na+-Ionen im Ruhezustand wenig zum Membranpotenzial einer Nerven­ zelle beitragen, lohnt es sich zu fragen, was passieren würde, wenn die Membran für Na+-Ionen permeabel wäre: Für Na+-Ionen ist das Konzentrationsgefälle ins Zellinnere gerichtet. Gleichzeitig werden diese Ionen vom elektrisch negativen Zellinnern ange­ zogen [Abb. 1]. Es besteht also eine sehr starke Tendenz für Na+-Ionen, ins Zellinnere einzudringen. Das Ruhepotenzial stellt also eine Form von gespeicherter elektroche­ mischer Energie dar. Diese Energie kann sich in einen Stromfluss verwandeln, sobald die Membran für Natriumionen durchlässig wird. Da im Ruhezustand ständig einige Natriumionen in die Zelle einsickern, müsste das Ruhepotenzial eigentlich immer kleiner werden und allmählich verschwinden. Das ist nicht der Fall, da ein Transportprotein in der Zellmembran ständig die eindrin­ genden Na+-Ionen entfernt. Diese sogenannte Natrium/Kalium-Pumpe nimmt auf der Zellinnenseite Natriumionen auf und transportiert sie auf die Zellaußenseite. Im Ge­ genzug befördert dieser Transporter Kaliumionen unter ATP-Verbrauch ins Zellinnere. In Nervenzellen werden 50 – 70 % des gesamten Energieumsatzes für die Natrium/ Kalium-Pumpe aufgewendet. Die elektrochemische Energie, die das Ruhepotenzial darstellt, dient hier zur Erzeugung von elektrischen Signalen, den Aktionspotenzialen. Da Aktionspotenziale mit einem Einstrom von Na+ in die Zelle verbunden sind, muss die Natrium/Kalium-Pumpe verstärkt aktiv werden, um immer wieder das Ruhepoten­ zial zu regenerieren. Elektrisch inaktive Zellen, die kein Aktionspotenzial erzeugen, wenden dagegen nur 30 % ihres Energieumsatzes für die Natrium/Kalium-Pumpe auf. extrazelluläre Flüssigkeit Kaliumkanal: o¤en, dynamisches Gleichgewicht Natriumkanal: geschlossen Na+ K+ K+ elektromotorische Kraft [K+] elektromotorische Kraft Na+ [Na+] Natrium/Kalium-Pumpe: transportiert Natriumionen im Austausch gegen Kaliumionen unter Energieaufwand nach außen Na+ Na+ + + + + + + Na+ Konzentrationsgefälle [Na+] Na+ Na+ Na+ Zellmembran Konzentrationsgefälle [K+] K+ K+ K+ K+ K+ K+ – – – – – – Zellinneres negativ geladen Na+ Na+ ATP ADP + K+ K+ Zellinneres [1] Vorgänge, die zur Entstehung und Erhaltung des Ruhepotenzials beitragen 203 K+ P Bewegungssystem Aktionspotenzial Membranpotenzial in mV 40 Aktionspotenzial 0 2 Überschuss 4 6 8 Zeit in ms Schwellenpotenzial –40 Depolarisation Ruhepotenzial –80 Hyperpolarisation Reizstrom in nA 20 0 2 –20 4 6 8 Zeit in ms 2 ms [1] Die Membran eines Neurons kann passiv auf Reizströme reagieren oder mit einem Aktionspotenzial. Wird die Zellmembran eines Neurons im Versuch mit einem kurzen Strompuls gereizt, lassen sich zwei grund­ sätzlich verschiedene Reaktionen beobachten [Abb. 1]: π Das Membranpotenzial kann passiv dem Reizstrom folgen und dann langsam zum Ruhepotenzial zu­ rückkehren; passiv, weil die Membran wie ein Kon­ densator elektrische Ladung aufnimmt und dann ableitet. Diese Reaktion tritt auf, wenn der Strom­ puls eine Hyperpolarisation der Membran bewirkt, das Membranpotenzial also zunimmt (negativer wird), oder bei einer schwachen |Depolarisation, wenn das Membranpotenzial etwas abnimmt (po­ sitiver wird). π Wird die Membran des Neurons dagegen bis zu einem bestimmten ­Schwellenwert depolarisiert, erfolgt keine passive Antwort [Abb. 1, gestrichelte rote ­Linie], sondern es wird aktiv ein elektrisches Signal erzeugt [Abb. 1, durchgezogene rote Linie], das Aktionspo­ tenzial, auch Nervenimpuls genannt. Eigenschaften des Aktionspotenzials Zu den Eigenschaften von Aktionspotenzialen gehört es, dass sie nach dem Allesoder-nichts-Prinzip ausgelöst werden. Die Höhe des Aktionspotenzials hängt nicht mit der Stärke des Reizstroms zusammen. Entweder wird das Schwellenpotenzial er­ reicht, dann entsteht ein voll ausgebildetes Aktionspotenzial, oder das Aktionspoten­ zial kommt gar nicht zu Stande. Stellt man Ableitungen von Aktionspotenzialen auf Oszilloskop einem |Oszilloskop dar, fällt ihre charakteristische Form auf. Nach einem eher lang­ elektronisches Messgerät zur samen Anstieg der Membrandepolarisierung bis zum Schwellenwert erfolgt eine blitz­ schnelle Depolarisation, die das Membranpotenzial über den Nullwert hinaus in positive optischen Darstellung elek­ trischer Spannungen und de­ Werte hinein verschiebt. Fast ebenso schnell wird die Membran dann aber repo­larisiert, d. h., sie wird gegenüber der Außenseite wieder negativ. Oft wird das Ruhepotenzial ren Verlauf dabei sogar kurzzeitig unterschritten (Hyperpolarisation). Aktionspotenziale dauern meist nur 1 – 2 ms. Entsteht an einer Stelle der Zellmembran ein Impuls, absolute relative dann kann dort für eine gewisse Zeit kein zweiter Impuls Refraktärzeit Refraktärzeit gebildet werden. Offenbar ist die Membran direkt nach einem Aktionspotenzial nicht erregbar. Diese Zeitspan­ ne, in der kein Impuls erzeugt werden kann, wird als Refraktärzeit bezeichnet. Aus der Abbildung wird ersicht­ lich, dass es eine absolute Refraktärzeit gibt, in der die Erregbarkeit der Membran auf null absinkt [Abb. 2]. Ihr Reiz schließt sich eine relative Refraktärzeit an, in der die Membranerregbarkeit vermindert ist. Das Schwellenpo­ tenzial ist dann höher als normal, die Amplitude der Im­ pulse kleiner. Das Vorhandensein einer Refraktärzeit hat v. a. zwei Konsequenzen: Aktionspotenziale können nicht zu einer Art Dauererregung verschmelzen und es Zeit nach dem wirksamen Reiz gibt eine maximale Impulsfrequenz für jede Nervenzelle, [2] Direkt nach einem Aktionspotenzial ist die Membran eine Zeit die von der Länge der Refraktärzeit abhängt. Membranerregbarkeit Amplitude der Erregung Depolarisation Umkehrung des Ruhepoten­ zials; durch Na+-Einstrom wird das Zellinnere positiv lang nicht oder nur vermindert erregbar. 204 3 Nervensystem Entstehung des Aktionspotenzials Im Ruhezustand ist das Zellinnere des Neurons gegenüber der Außenseite negativ geladen. Na+-Ionen haben daher – und weil sie auf der Zellaußenseite etwa 10-fach höher konzentriert sind – eine starke Tendenz, ins Zellinnere einzudringen, doch ist die Zellmembran des Neurons für Na+-Ionen fast undurchlässig. In der Membran gibt es zwar Ionenkanäle, die spezifisch für Na+-Ionen sind, sie sind aber normalerweise verschlossen [Abb. 3, links oben]. Die herausragende Besonderheit dieser Natriumkanäle liegt in ihrer Spannungsabhängigkeit: Als Antwort auf eine Membrandepolarisation können sich die Natriumkanäle öffnen. Somit kommt ein Aktionspotenzial folgender­ maßen zu Stande: 1 Wird die Zellmembran des Neurons bis zum Schwellenwert depolarisiert, ­beginnen sich einige Natriumkanäle zu öffnen [Abb. 3, links unten]. Nun können Na+-Ionen in die Zelle eindringen. Dadurch wird das Membranpotenzial positiver. 2 Je positiver das Membranpotenzial wird, desto mehr Natriumkanäle öffnen sich. Folglich dringen auch mehr Na+-Ionen in die Zelle ein und umso schneller verschiebt sich das Membranpotenzial zum Positiven. Dieses Verhalten der ­Natriumkanäle ist eines der wenigen Beispiele für einen durch positive Rück­ kopplung gesteuerten Vorgang im menschlichen Körper. Es erklärt, warum die Depolarisation so „explosionsartig“ erfolgt. 3 Wenn sich das Membranpotenzial dem Natrium-Gleichgewichtspotenzial von etwa +50 mV nähert, schließen sich die Natriumkanäle wieder, denn ein zweites „Tor“ in den Kanälen sorgt dafür, dass sie immer nur kurzzeitig geöff­ net bleiben [Abb. 3, rechts unten]. Der Natriumeinstrom versiegt. Jetzt ist das Zellin­ nere im Vergleich zur Außenseite positiv geladen. Das hat Auswirkungen auf die K+-Ionen: Für sie zeigt das Konzentrationsgefälle von innen nach außen und durch den Natriumeinstrom ist das Zellinnere jetzt positiv ge­ laden. Wenn also – mit leichter Verzögerung gegenüber den Natriumkanälen – span­ nungsabhängige Kaliumkanäle in der Zellmembran öffnen, werden K+-Ionen mit gro­ ßer Kraft aus der Zelle getrieben, sodass das Zellinnere wieder negativ wird, es wird repolarisiert [Abb. 3, rechts oben]. Das Ruhepotenzial stellt sich wieder ein. Na+ Natriumkanal geschlossen außen Na+ außen K+ Natriumkanal inaktiviert Na + Refraktärzeit Na+ Depolarisierung bis zum Schwellenpotenzial innen Na+ K+ innen K+ außen Na+ Natriumkanal o¤en Depolarisierung, bis das Membranpotenzial positiv wird (Überschuss) Na+ innen K+ K+ außen K+ K + Repolarisierung durch Ausstrom von K+ Natriumkanal inaktiviert Na+ innen K+ [3] Vorgänge in der Zellmembran während eines Aktionspotenzials: Spannungsabhängige Natriumkanäle ermöglichen die Depolarisation; die vier Teilbilder zeigen den Zustand der Ionenkanäle in den rot markierten Phasen des Aktionspotenzials. 205