Vermessung der Zellmembran - Öffentlichkeitsarbeit und
Werbung

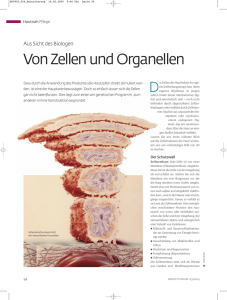
Albert-Ludwigs-Universität Freiburg Forschen am Immunsystem Die Vermessung der Zellmembran Wie groß sind eigentlich 10 Nanometer? Und wie viel größer sind 10 Mikrometer? Nur wer die Größenverhältnisse auf der Zelle richtig einschätzt, kann die Signalprozesse begreifen, die im Körper ablaufen. Prof. Dr. Michael Reth erforscht die Membran der Immunzellen, um zu verstehen, wie der menschliche Körper auf Fremdstoffe reagiert. Die Kartierung der Zellmembran ist der erste Schritt, um herauszufinden, wie die Zelle funktioniert. Ob mit dem Ziel, wirksame Impfstoffe zu entwickeln oder Immunerkrankungen zu bekämpfen: Die Zellen, die im Blut und im Gewebe auf Fremdstoffe reagieren und Antikörper ausschütten, stehen im Mittelpunkt der Immunforschung. Diese B-Zellen produzieren Antikörper, wenn sogenannte Antigene – Moleküle, die das Immunsystem als Fremdstoffe erkennt – diese Zellen anregen. Nach einem Schlüssel-Schloss-Prinzip binden diese Antigene an Rezeptoren auf der Außenmembran der B-Zellen. Wie diese Antigenrezeptoren die fremden Moleküle erkennen und dadurch die Zelle aktivieren, versucht Prof. Dr. Michael Reth vom Institut für Biologie III und Sprecher des Exzellenzclusters BIOSS Centre for Biological Signalling Studies der Universität Freiburg herauszufinden. Dafür braucht er ein Gefühl für die Dimension, in der er sich bewegt. Rezeptoren, die Fremdstoffe erkennen Sein Untersuchungsobjekt, der Antigenrezeptor der B-Zelle, ist nur 10 Nanometer groß und befindet sich auf der Zellmembran. Die Membran besteht aus Lipiden, die eine Fetthülle um die Zelle bilden. Da die B-Zelle im Durchmesser circa sieben Mikrometer groß ist – 700-mal die Größe eines Rezeptors –, passen sehr viele Antigenrezeptoren auf eine B-Zelloberfläche. Es können bis zu 120.000 sein. Im Team auf der Membran Lange dachten Forscher, die Rezeptoren schwimmen einzeln und zufällig verteilt in der Lipidschicht der Zellmembran herum. Doch in einer Studie, die im Jahr 2010 erschien, zeigte Reth, dass die Antigenrezeptoren sogenannte Oligomere bilden: Sie lagern sich in einem Abstand von 10 bis 20 Nanometer nebeneinander an und bilden circa 100 Nanometer große Rezeptorinseln auf der Oberfläche der Zelle. Reth wies jetzt nach, dass diese Gruppen von Antigenrezeptoren, deren Grundstruktur er in den 1980er Jahren mit entschlüsselte, nach Bindung eines Antigens auseinanderfallen und dann erst die Zelle aktivieren. Doch wie formen die Rezeptoren Oligomere? Wie organisieren sich die Rezeptoren in der Membran mit anderen Membranproteinen? Wie viele verschiedene Rezeptorinseln bilden sie? Diese Kartierung der Membran geht Reth im Rahmen seiner Forschung, die der Europäische Forschungsrat (ERC) 2013 mit einem Advanced Grant auszeichnete, nun an. Auflösungsgrenzen überwinden und Moleküle nachbauen Dafür fehlten lange Zeit die richtigen Techniken: Erst die Superresolution-Mikroskopie, bei der die Auflösungsgrenze des sichtbaren Lichts, die bei 250 Nanometer liegt, durch technische Tricks überwunden wird, ermöglichen es, in die Nanowelt der Zellmembran einzutauchen. Reth und sein Team benutzen auch die 2 Techniken der Synthetischen Biologie, um die Antigenrezeptoren in Fruchtfliegenzellen oder synthetische Membranen zusammenzubauen und dadurch besser zu verstehen. Auf diese Weise können sie im Detail beobachten, wie das Auseinanderfallen der Rezeptorcluster funktioniert. Das Schwerpunktprogramm BiNEP (BIOSS Nanoscale Exploration Program) am BIOSS Centre for Biological Signalling Studies dient als Forum für die Forscherinnen und Forscher des Exzellenzclusters, die weitere Rezeptoren, aber auch die Lipide in der Membran erkunden. Kontakt Surprising Science Annette K. Persch Redaktion und Projektkoordination Albert-Ludwigs-Universität Freiburg Stabsstelle Öffentlichkeitsarbeit und Beziehungsmanagement Tel. 0761 / 203 - 8909 [email protected] II www.surprising-science.de