Enzyme
Werbung

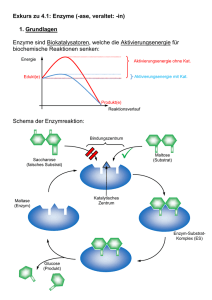
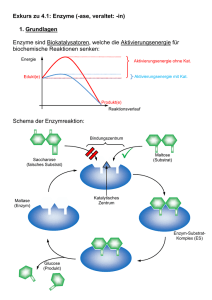
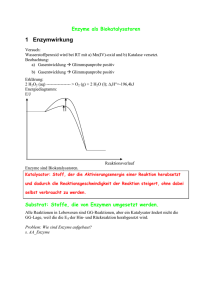
Stoffwechselphysiologie Nahrung- und Flüssigkeitsaufnahme in 40 Jahren: 3m 3m 6000 kg Nahrungsmittel 9m 36000 l Wasser Aufgaben des Stoffwechsels • Gewinnung von chemischer Energie aus anorganischen und organischen Vorstufen (Assimilation), herstellen von Grundbausteinen für zelluläre Makromoleküle Aufgaben des Stoffwechsels • Synthese von Lipiden, Proteinen Nukleinsäuren und Polysacchariden aus diesen Grundbausteinen als Strukturelement, Energiespeicher, usw. (Anabolismus) Aufgaben des Stoffwechsels • Energiegewinnung durch den Abbau von Kohlehydraten, Lipiden und Proteinen (Katabolismus) Was ist ein Enzym? • Enzyme sind spezifische Biokatalysatoren, die biochemische Abläufe in Organismen unter physiologischen Bedingungen ermöglichen. • Enzyme sind fast immer Proteine Chemische vs. enzymkatalytische Reaktion: z.B. Proteinabbau • Chemische Spaltung: 6 M Salzsäure, 110°C, 24h • Enzymatische Spaltung z.B. im Magen : 0,1 M Salzsäure, 37°C, einige Stunden Grundlagen enzymatischer Reaktionen • Jede enzymatische Reaktion beginnt mit einer reversiblen Bindung des Substrats • Enzyme beschleunigen die Einstellung von Reaktionsgleichgewichten (bis zu 106 fach!), nicht die Richtung der chemischen Reaktion Enzym + Substrat Enzym + Produkt • Enzyme Beschleunigen Reaktionen durch Erniedrigung der Aktivierungsenergie ‚Rasante‘ Enzyme • Die Wechselzahl eines Enzyms beschreibt die Anzahl an Substratmolekülen, die bei vollständiger Sättigung des Enzyms mit Substrat pro Zeiteinheit in das Produkt umgewandelt werden können Enzyme enthalten aktive Zentren, an denen die katalytische Umsetzung des Substrats abläuft Und wozu ist der Rest des Moleküls? Substrat „passt“ in das aktive Zentrum Substrat „passt“ NICHT in das aktive Zentrum aktives Zentrum Detaturiertes Enzym Natives Enzym Das aktive Zentrum ist eine dreidimensionale Einheit, die von vielen Gruppen aus verschiedenen Abschnitten der linearen Aminosäuresequenz gebildet wird Mechanismus einer enzymatischen Reaktion Interaktion Substrat-Enzym: • Schlüssel-Schloss Modell Interaktion Substrat-Enzym: • ‚Induced fit‘ Modell Enzyme: • Substrat-spezifisch • Reaktions-spezifisch • IUB-Nomenklatur: (Substrat)(Reaktion)ase z.B. Hexokinase = ATP:D-Hexose-6-Phosphotransferase Coenzyme: • Sind Kofaktoren, die für viele enzymatische Reaktionen benötigt werden (Co-Substrate) • Niedriges Molekulargewicht, thermostabil • Können vom Enzym abgetrennt werden (nicht-kovalente Interaktion) • Enthalten als aktive Komponenten meist Moleküle, die der Mensch nicht selbst synthetisieren kann, z.B. die Vitamine Thiamin, Flavin, Nicotinamid • Werden während der Reaktion verändert, sind also keine Katalysatoren Holoenzym = Apoenzym + Coenzym Beispiele für Enzyme, die Coenzyme und/oder Metallionen enthalten: Enzym Metallion Coenzym Alkohol-Dehydrogenase Zn NAD Carboanhydrase Zn Cytochrom-Oxidase Cu, Zn Cytochrom b Fe2+/Fe3+ Katalase Fe Succinat-Dehydrogenase Fe Tyrosinase Cu Pyruvat-Carboxylase Zn, Mn FAD Biotin Pyruvat-Dehydrogenase NAD, FAD, Thiaminpyrophosphat, Liponsäure Transaminasen Pyridoxalphosphat Decarboxylasen Pyridoxalphosphat Transferase Pyridoxalphosphat Beispiele für Coenzyme: • Adenosintriphosphat (ATP): Die universelle Energiewährung der Zelle Beispiele für Wirkungsweise: • Hexokinase + Adenosintriphosphat (ATP) Vitamine als Coenzyme: • Thiamin (Vitamin B1): Coenzym der oxydativen Decarboxylierung durch die Pyruvatcarboxylase • Riboflavin (Vitamin B2 Komplex): In Form eines Flavoproteins gebunden, enthält Nicotinamid • Panthothensäure: Bestandteil des Coenzym A, ein zentrales Coenzym des Fettstoffwechsels • Cobalamin (Vitamin B12 ): In bestimmter Form ein Coenzym von Isomerasen • Ascorbinsäure (Vitamin C): Bildet ein wichtiges biochemisches Redoxsystem (durch reversible Umwandlung in Dehydroascorbinsäure) • Biotin (Vitamin H): Cofactor für die Übertragung von COO Gruppen Beispiele für Coenzyme: • Nicotinamidadenindinucleotid (NAD+) (oxidiert) (reduziert) Beispiele für Wirkungsweise: • Nicotinamidadenindinucleotid (NAD+) Glyzerinaldehyd3-phosphat 1-3-BiphosphoGlyzerat Lactat Pyruvat Prosthetische Gruppen: • Wirkungsweise wie Coenzyme, sind jedoch fest an das Enzym gebunden • Können vom Enzym nicht abgetrennt werden • Das Holoenzym reagiert nacheinander mit zwei verschiedenen Substraten • Werden während der Reaktion verändert, sind also keine Katalysatoren Beispiele für prosthetische Gruppen: • Flavin-adenin-dinucleotid (FAD+) Beispiele für Wirkungsweise: • Aminosäureoxidation Isoenzyme: • Katalysieren dieselbe enzymatische Reaktion, haben jedoch einen unterschiedlichen molekularen Aufbau • Besitzen unterschiedlich Substrataffinitäten • Können innerhalb eines Organismus und sogar innerhalb einer Zelle in unterschiedlicher Ausprägung vorkommen Lactatdehydrogenase: Aus: Stryer, Biochemie, Spektrum der Wissenschaft Verlagsgesellschaft mbH Heidelberg 1990 M4 M3H M2H2 MH3 H4 Aus 4 Ketten (M oder H) Zusammengesetzt, Isoformen können elektrophoretisch aufgetrennt und charakterisiert werden Multienzyme: • Katalysieren die Umsetzung von Substraten über eine Abfolge von Reaktionen, ohne die Freisetzung von Zwischenprodukten zu ermöglichen Lösliches, dissoziiertes Enzymsystem, z.B. Glykolyse in Cytosol Multienzymkomplex, Zwischenprodukte sind fest in den Komplex eingebunden, z.B. Fettsäuresynthese Multienzyme: • Katalysieren die Umsetzung von Substraten über eine Abfolge von Reaktionen, ohne die Freisetzung von Zwischenprodukten zu ermöglichen Membrangebundenes Multienzymsystem, z.B. Atmungskette an der Mitochondrienmembran Lokalisation von Enzymsystemem innerhalb der Zelle: • Cytoplasma: Glykolyse • Mitochondrien (membrangebunden): Elektronentransportkette, Fettsäureabbau, Atmungskette, Citratzyklus • Endoplasmatische Reticulum (membrangebunden): Fettsäuresynthese, Steroidsynthese, hydroxylierende Enzymsysteme (wichtig beim Arzneimittelabbau) • Diese Kompartimentierung ermöglicht die räumliche und zeitliche Koordination von Stoffwechselabläufen Enzyme: 6 Hauptklassen (1) Oxidoreduktasen: Enzyme der biologischen Oxidation und Reduktion • • • H-Überträger: Mit NAD, FAD als Akzeptor, z.B. LaktatDehydrogenase; mit O2 als Akzeptor: Glukose-Oxidase Gekoppelte Redox-Reaktionen: Z.B. unter Abspaltung von CO2, Pyruvat → Acetyl-CoA Elektronen übertragende Enzyme (Oxidasen): Einbringen von O2, Bildung von Wasser oder H2O2; z.B. Dioxygenasen, Monooxygenasen (2) Transferasen: Gruppenübertragende Enzyme (z.B. Phosphorylase; Acyl, Glycosyl-reste; Methyltransferasen) (3) Hydrolasen: Enzyme, die hydrolytische Spaltungen katalysieren (z.B. Proteasen, Esterasen [Lipidspaltung], Glykosidasen; Nukleasen) Enzyme: 6 Hauptklassen (4) Lyasen: Katalysieren u.a. Eliminierungsreaktionen unter Ausbildung einer Doppelbindung (z.B. Aldolase, Fumarase; nicht-hydrolytisch) (5) Isomerasen: Katalysieren Umlagerungen innerhalb eines Moleküls (z.B. Glycerinaldehyd-3-Phosphat → Dihydroxyacetonphosphat [Triosephosphatisomerase], Glukose →Galaktose [Glukoseisomerase] (6) Ligasen: Knüpfen Bindungen unter gleichzeitiger Spaltung von ATP (z.B. Fixierung von CO2 durch die Pyruvatcarboxylase, Fixierung von Ammoniak durch die Glutaminsynthetase; energieabhängige Bindungsknüpfung) Kinetik von Enzymreaktionen: • Verringerte Aktivierungsenergie Kinetik von Enzymreaktionen: • Die Michaelis-Menten-Konstante Bei vielen Enzymen variiert die Katalysegeschwindigkeit V mit der Substratkonzentration [S] Ist [S] klein (konstante Enzymkonzentration), verhält sich V annähernd linear zu [S] Ist [S] hoch, so verhält sich V Annähernd unabhängig zu [S] KM (Michaelis-Menten Konstante) Gibt die Substratkonzentration bei halbmaximaler Reaktionsgeschwindigkeit an Kinetik von Enzymreaktionen: • Die Michaelis-Menten-Konstante • • • • Hat die Einheit Mol/Liter Ist unabhängig von der im Versuchsansatz vorliegenden Menge an Enzym Hat eine charakteristische Größe für ein Enzym-Substrat Paar Ein niedriger KM Wert zeigt an, dass die Affinität vom Enzym zum Substrat hoch ist V= Vmax • [S] KM + [S] Kinetik von Enzymreaktionen: • Darstellung nach Lineweaver-Burk 1 V = KM Vmax x 1 [S] + 1 Vmax Kinetik von Enzymreaktionen: • Messung optimaler Reaktionsbedingungen Kinetik von Enzymreaktionen: • Messung optimaler Reaktionsbedingungen pH Optimum 3 4 5 6 7 pH Wert 8 9 Hemmung von Enzymen: • Hemmung durch Stoffwechselzwischen- oder Endprodukte (Metaboliten) ist ein wichtiger Faktor bei der Regulation des Intermediärstoffwechsels Hemmung von Enzymen: • Hemmung durch zellfremde Substanzen (z.B. Pharmaka) • Irreversible Hemmung: Permanente chemische Veränderung der funktionellen Gruppen des Enzyms • Reversible Hemmung: • Kompetitive Hemmung (durch ein dem Substrat strukturähnliches Molekül) • Nicht kompetitive Hemmung (Hemmsubstanz lagert sich außerhalb des aktiven Zentrums an) Kinetik von Enzymreaktionen: • Kompetitive und nicht-kompetitive Inhibierung Kinetische Unterscheidung: Kompetitive Hemmung Nicht-kompetitive Hemmung Kompetitive Inhibierung • Kann durch ausreichend hohe Substratkonzentration ausgeschaltet werden • Da sich Vmax nicht ändert, ist KM höher (höhere Substratkonzentration für die gleiche Reaktionsgeschwindigkeit notwendig) Nicht-kompetitive Inhibierung • Kann durch hohe Substratkonzentration nicht ausgeschaltet werden • Vmax ist verringert, KM (Substratkonzentration bei halbmaximaler Vmax) verändert sich nicht • Enzym-Substratbindung muss nicht beeinträchtigt sein, aber katalytische Umsetzung des Substrates wird beeinflusst Praktische Anwendung der kompetitiven Inhibierung: Glycolvergiftung (Frostschutzmittel) Allosterische Enzyme • Sind nicht mit dem Michaelis-Menten Modell beschreibbar • Besitzen zusätzlich zum katalytischen Zentrum Bindungsstellen für reversible Bindung von Effektor-oder Modulatormolekülen • Haben mindestens zwei Bindungsstellen • Hemmung durch Endprodukte einer Biosynthesekette möglich • Allosterische Hemmung oder Aktivierung ist immer reversibel Enzyme, Zusammenfassung • • • • Biokatalysatoren, katalysieren Hin-und Rückreaktion Einstellung eines Gleichgewichtes beschleunigt Aktivierungsenergie wird erniedrigt Enzymkinetik durch biomathematische Modelle beschreibbar • Coenzyme als Co-Faktoren • Regulation der Enzymaktivität