Isomerie organischer Verbindungen
Werbung

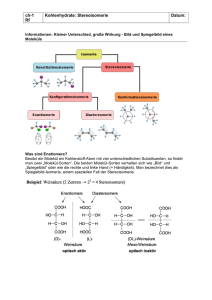
15 Isomerie organischer Verbindungen Organische Verbindungen können, bei gleicher Summenformel, sehr unterschiedliche Strukturen besitzen. Moleküle mit gleicher Summenformel aber unterschiedlicher Struktur nennt man Isomere. Arten der Isomerie Konstitutionsisomere (K1) Stellungsisomere Strukturisomere Bei Strukturisomeren sind unterschiedliche funktionelle Gruppen ausgebildet. Die gleichen funktionellen Gruppen sind an unterschiedliche Atome des Kohlenstoffgerüsts gebunden. Beispiel: Ethanol - Dimethylether Beispiel: -Alanin - -Alanin Die Stereochemie spielt in der Biochemie eine wichtige Rolle. Aminosäuren und Zucker sind chiral, sie besitzen asymmetrische Kohlenstoffatome. Die belebte Natur ist chiral (asymmetrisch)! Enantiomere besitzen gleiche physikalische und chemische Eigenschaften, sie sind jedoch optisch aktiv. Treten zwei chirale Verbindungen miteinander in Wechselwirkung, z.B. Enzym und Substrat, laufen unterschiedliche Reaktionen ab, je nachdem welches Enantiomer des Substrats angeboten wurde: Enzyme sind stereoselektiv.. Stereoisomerie cis(Z)-trans(E)-Isomere Enantiomere - Diastereomere D-L-Konfiguration (K2) Benachbarte Substituenten an Doppelbindungen oder Ringen können zwei verschiedene Anordnungen aufweisen. Besitzt das Molekül ein Chiralitätszentrum, ergeben sich zwei verschiedene Konfigurationen, die sich wie Bild und Spiegelbild verhalten (= Enantiomere). Sind mehrere Chiralitätszentren vorhanden, kommen noch Diastereomere dazu. Beispiel: Maleinsäure - Fumarsäure Beispiel: D- / L-Alanin (Enantiomere) Srereoisomerie: Konformation (K3) Konformere können durch Rotation um C-C-Einfachbindungen ineinander umgewandelt werden. A A B B 16 Strukturisomerie Beide abgebildeten Verbindungen besitzen die Summenformel C 2H6 O. Die Atome lassen sich zu diesen zwei Strukturen anordnen. Beide Substanzen weisen zwar das gleiche Molekulargewicht auf, unterscheiden sich aber erheblich in ihrem chemischen Verhalten und ihren physikalischen Eigenschaften: Dimethylether “Ether“ Ethanol “Alkohol“ Siedepunkt: - 23°C 78,5°C Aggregatzustand (StB): gasförmig flüssig Löslichkeit in Wasser: gering unbegrenzt Stellungsisomerie Stellungsisomerie kann bei Kohlenstoffketten, die aus mindestens zwei Atomen bestehen, und bei Ringen auftreten. Funktionelle Gruppen sind an unterschiedlichen Atomen des Kohlenstoffgerüstes gebunden. Als Beispiel sei hier die Aminobuttersäure genannt, von der es drei Isomere gibt: Die Benennung kann, wie im vorliegenden Fall, durch Voranstellen eines griechischen Buchstaben vor den Trivialnamen oder durch die systematische Bezeichnung erfolgen: -Aminobuttersäure = 2-Amino-butansäure; -Aminobuttersäure = 3-Amino-butansäure -Aminobuttersäure = 4-Amino-butansäure Bei aromatischen Systemen mit 2 Substituenten werden meist die Präfixe ortho- (o), meta- (m) und para- (p) verwendet: o(rtho)-Xylol = 1,2-Dimethylbenzen m(eta)-Xylol = 1,3-Dimethylbenzen p(ara)-Xylol = 1,4-Dimethylbenzen 17 Stereoisomerie Im Gegensatz zu Strukturisomeren sind bei Stereoisomeren die Bindungsverhältnisse identisch. Die Isomere unterscheiden sich durch die Lage der Baugruppen am selben C-Atom. cis-trans-Isomerie (geometrische Isomerie) Während um C-C-Einfachbindungen eine freie Drehbarkeit gegeben ist, ist dies bei C=CDoppelbindungen nicht der Fall. Für Substituenten an den beiden C-Atomen gibt es daher zwei verschiedene Anordnungsmöglichkeiten, die mit cis und trans bzw. Z (für zusammen) und E (für entgegen) bezeichnet werden. cis-trans-Isomerie bei Ring-Systemen Auch bei Ringen wird die relative Stellung benachbarter Substituenten durch die Präfixe cis und trans bezeichnet. Da der Ring gewinkelt ist (bei Cyclohexan vorzugsweise in der SesselKonformation vorliegt), steht bei der cis-Konfiguration stets ein Substituent axial und einer äquatorial. Bei der trans-Konfiguration stehen entweder beide axial oder beide äquatorial. Chiralität - optische Isomerie 3 Beim sp -hybridisierten Kohlenstoffatom weisen die vier Bindungen in die Ecken eines Tetraeders. Sind vier verschiedene Atome bzw. Gruppen an ein C-Atom gebunden, gibt es zwei Konfigurationen, d.h. zwei unterschiedliche Möglichkeiten, diese Gruppen anzuordnen. Man nennt ein solches C-Atom ein asymmetrisches C-Atom (da sich durch das Atom keine Spiegelebene legen lässt) oder Chiralitäts-Zentrum. (Chiralität von grch. "Händigkeit"). 18 Besitzt ein Molekül ein solches chirales C-Atom, existieren zwei Konfigurations-Isomere, die sich wie Bild und Spiegelbild verhalten: die zwei Enantiomere. Enantiomere unterscheiden sich nicht in ihrem chemischen Verhalten und, mit Ausnahme ihrer optischen Aktivität, auch nicht in physikalischen Eigenschaften. Unterschiede gibt es jedoch in ihrem biochemischen Verhalten, denn im Organismus kommt es zu Wechselwirkungen mit anderen chiralen Molekülen, bei denen die Konfiguration einen wesentlichen Einfluss hat. Befinden sich in einem Molekül mehrere asymmetrische C-Atome, gibt es zu jedem dieser Chiralitätszentren zwei Anordnungsmöglichkeiten. Es ergeben sich dadurch 2n Stereoisomere (n = Zahl der chiralen C-Atome im Molekül). Man unterscheidet nun Enantiomere (die sich wie Bild und Spiegelbild verhalten) und Diastereomere. Enantiomere: Bild - Spiegelbild Enantiomere verhalten sich wie Bild und Spiegelbild. Die isomeren Moleküle können durch Drehung nicht zur Deckung gebracht werden. http://www2.chemie.uni-erlangen.de/projects/vsc/chemie-mediziner-neu/isomerie/enantiomere.html Die Enantiomere sind optisch aktiv: Sie drehen die Polarisationsebene linear polarisierten Lichtes (bei gleicher Konzentration) um den gleichen Wert aber in entgegengesetzte Richtung. 19 Eigenschaften von Enantiomeren Die beiden Enantiomere unterscheiden sich in den meisten physikalischen und chemischen Eigenschaften nicht. Sie besitzen gleiche Schmelz- und Siedepunkte, die gleiche Dichte und gehen (mit nicht-chiralen Reaktionspartnern) die gleichen chemischen Reaktionen ein. Die einzige physikalische Eigenschaft, in der sich die Enantiomere unterscheiden, ist die optische Aktivität. Unterschiede gibt es aber in der Reaktivität mit anderen chiralen Verbindungen. Besonders deutlich wird dies bei enzymkatalysierten Reaktionen. Die meisten Enzyme setzen nur eines der Enantiomere um, das andere Isomer bleibt unverändert. Enantiomere unterscheiden sich in den Reaktionen mit anderen chiralen Verbindungen, insbesondere in ihrem Verhalten gegenüber Enzymen Optische Aktivität Elektromagnetische Wellen, zu denen auch das sichtbare Licht gehört, sind Transversalwellen, d.h. sie schwingen senkrecht zur Ausbreitungsrichtung. In einem "normalen" Lichtstrahl kommen alle Schwingungsrichtungen vor. Durch einen Polarisationsfilter können bis auf eine alle Schwingungsrichtungen absorbiert werden, wodurch man linear polarisiertes Licht erhält. Leitet man linear polarisiertes Licht durch die Lösung einer chiralen Substanz, wird die Polarisationsebene gedreht. Diese Eigenschaft nennt man optische Aktivität. Ein Enantiomer dreht die Ebene nach rechts - dies wird mit (+) bezeichnet - das andere Enantiomer um den gleichen Wert nach links: (-). Beispielsweise ist die D-Glucose rechtsdrehend (+), die L-Glucose entsprechend linksdrehend (-). Bei der Fructose ist die D-Form dagegen linksdrehend! Der Drehwinkel ( ) hängt dabei von der eingesetzten Verbindung, der Konzentration (c) und der Schichtdicke (d) ab. Als substanzspezifischer Wert wird die "Spezifische Drehung" definiert: Drehwinkel bei bei c = 1 g/ml und d = 10 cm. Bei einem 1:1-Gemisch beider Enantiomere hebt sich die Drehung auf, ein solches Gemisch nennt man racemisches Gemisch oder Racemat. http://www.quarks.de/dyn/10437.phtml http://www.physik.fu-berlin.de/physlab/Skripte/Polarimetrie.pdf 20 Projektion & Nomenklatur Um die dreidimensionalen chiralen Moleküle abbilden zu können, müssen für die Darstellung einige Regeln festgelegt werden, damit aus dem zweidimensionalen Bild die Konfiguration abgelesen werden kann. Meist bedient man sich dabei der FISCHER-Projektion. D-Glycerinaldehyd Bei der F ISCHER-Projektion wird die längste Kohlenstoffkette senkrecht angeordnet, wobei das höchstoxidierte C-Atom oben steht. (COOH > CHO > CH2OH > CH 3) Die Kette wird nun so gedreht, dass vom betrachteten chiralen C-Atom aus die Atome der Kette (d.h. hier -CHO und CH2 OH) hinter die Zeichenebene weisen. Die seitlichen Substituenten (in unserem Fall -H und -OH) zeigen nach vorn. Nun wird das Molekül "flachgedrückt". Steht der Substituent rechts, bezeichnet man die Konfiguration mit D, steht er links mit L. Abgebildet ist der D-Glycerinaldehyd, er gehört zur "D-Reihe" der Aldosen. Für Aminosäuren und Zucker ist bis heute die D-/L-Nomenklatur nach E. FISCHER üblich. Bei Aminosäuren richtet sich die Einteilung nach der Stellung der Aminogruppe, bei den Zuckern nach der Stellung der OH-Gruppe am „untersten“ chiralen (asymmetrischen) C-Atom.. R,S-Nomenklatur Die FISCHER-Projektion mit der D,L-Nomenklatur wird insbesondere bei Aminosäuren und Zuckern angewandt und ist hier auch zweckmäßig. Bei vielen Substanzen, insbesondere dann, wenn mehrere Heteroatome (d.h. nicht C oder H) an ein Kohlenstoffatom gebunden sind, ist die D,L-Nomenklatur nicht anwendbar. Für diese Fälle wurde von CAHN, INGOLD und PRELOG die R,S-Nomenklatur für die absolute Konfiguration eingeführt. 21 Zunächst wird für die Substituenten eine "Rangordnung" aufgestellt, deren Grundlage die Ordnungszahl liefert. Je höher die Ordnungszahl, desto höher die Priorität. In unserem Fall: O = 8 = höchste Priorität (1), H = 1 = niedrigste Priorität (4), C = 6 kommt 2x vor. Die beiden C-Atome werden nun nach deren Bindungspartnern unterschieden. Gibt es hier Unterschiede in der Ordnungszahl, hat wiederum die höhere Ordnungszahl Priorität. Sind in beiden Gruppen die gleichen Atome enthalten, wird die Summe gebildet, wobei doppelt gebundene Atome doppelt zählen: -CHO = 2 x 8 + 1 = 17, -CH2 OH = 8 + 2 x 1 = 10. Die Aldehydgruppe ist somit höherrangig als die CH2 OH-Gruppe. -CHO = (2), -CH2 OH = (3). Nun wird das Molekül so gedreht, dass der Substituent mit der niedrigsten Priorität (4) - in unserem Beispiel der Wasserstoff - nach hinten weist, die drei übrigen Substituenten zeigen dann nach vorn. Beschreibt man nun einen Kreis, ausgehend von (1) über (2) nach (3), so kann dieser rechts = in Uhrzeigerrichtung oder links herum = gegen den Uhrzeigersinn verlaufen. Läuft er im Uhzeigersinn, bezeichnet man die Konfiguration mit R (von lat. rectus = rechts), im anderen Fall mit S (lat. sinister = links). D-Glycerinaldehyd besitzt R-Konfiguration. Aufgrund der unterschiedlichen Konventionen müssen sich D- und R-Formen nicht grundsätzlich entsprechen! In der R,S-Nomenklatur muss jedes Chiralitätszentrum extra angegeben werden. Milchsäure In der Natur treten beide Enantiomere der Milchsäure auf. Milchsäure (Lactat) wird insbesondere aus Brenztraubensäure (Pyruvat) gebildet, wenn der anaerobe Weg der Glycolyse beschritten wird. Pyruvat wird dabei von Oxidoreduktasen (also Enzymen, die Redox-Reaktionen katalysieren) zu Lactat reduziert, wobei NADH zu NAD + oxidiert wird. D-Milchsäure L-Milchsäure COOH H C OH CH3 linksdrehend (-) COOH HO C H CH3 rechtsdrehend (+) 22 In den meisten Milchsäurebakterien (solche Bakterien sind beispielsweise an der Herstellung von Sauerkraut, sauren Gurken und Sauermilch-Produkten beteiligt) entsteht in der Regel die D(-)Milchsäure. Im Muskelgewebe der Säuger (also auch beim Menschen) wird bei mangelnder Sauerstoffzufuhr L(+)-Milchsäure erzeugt. Diese kann, sobald ausreichend Sauerstoff zur Verfügung steht, wieder zu Pyruvat oxidiert und weiter aerob abgebaut werden. Bestimmte Joghurt-Kulturen liefern ebenfalls L(+)-Milchsäure. Diese werden teilweise als bekömmlicher angesehen, eindeutige Beweise hierfür stehen aber noch aus. Im Organismus können beide Formen der Milchsäure resorbiert und weiter verarbeitet werden. Diastereomere Diastereomere treten auf, wenn in einem Molekül mehrere chirale Kohlenstoffatome vorhanden sind. Da für jedes C-Atom zwei Konfigurationen möglich sind, ergibt sich als Gesamtzahl an Stereoisomeren bei n chiralen C-Atomen: 2n. Zu jeder Verbindung gibt es jedoch nur ein Isomer, das genau dem Spiegelbild entspricht, das Enantiomer. Von den gezeigten Stereoisomeren kommt nur L-Threonin in der Natur vor. 23 Während sich - mit Ausnahme der optischen Aktivität - die physikalischen und chemischen Eigenschaften der Enantiomere nicht unterscheiden, gibt es bei den Eigenschaften der Diastereomere zum Teil deutliche Abweichungen. Ein analoges Beispiel für Stereoisomere mit zwei Chiralitätszentren sind die Tetrosen (siehe Kohlenhydrate!). Während sich das D/L-System immer auf das ganze Molekül bezieht, hier also L-Threonin abgebildet ist, müssen R bzw. S für jedes chirale C-Atom getrennt angegeben werden. Dies wird hier für L-Threonin gezeigt. Am zweiten und am dritten C-Atom befinden sich jeweils vier verschiedene Substituenten, eine OH- oder NH2 -Gruppe, zwei weitere C-Atome und jeweils ein HAtom. Diesen werden jeweils die verschiedenen Prioritäten (abhängig von der Ordnungszahl) zugeordnet. Danach wird das Molekül wieder so gedreht, daß der Substituent mit niedrigster Priorität (in beiden Fällen der Wasserstoff) nach hinten weist. An C2 verläuft der Weg (1) -(2)-(3) nun gegen den Uhrzeigersinn, hier liegt also S-Konfiguration vor, an C3 geht es im Uhrzeigersinn, also liegt dort R-Konfiguration vor. L-Threonin kann somit auch als 2S,3R-Threonin bezeichnet werden. Diastereomere unterscheiden sich in ihren physikalischen und chemischen Eigenschaften, Enantiomere nur in der Drehrichtung des polarisierten Lichts. D-Threonin L-Threonin D-Allothreonin L-Allothreonin Schmelzpunkt: Zers.: 250°C Zers.: 250°C 276°C 276°C []D20: + 33,9° - 33,9° - 9,0° + 9,0° 24 Stereoisomere der Glucose Glucose besitzt vier chirale Kohlenstoffatome. Sie gehört zur Gruppe der Aldohexosen (Zucker mit einer Aldehydgruppe und insgesamt sechs C-Atomen). Bei vier Chiralitätszentren ergeben sich 24 = 16 Stereoisomere, es gibt also 16 verschiedene Aldohexosen. Eines dieser Isomeren ist die D-Glucose. Zur D-Glucose gibt es ein Enantiomer, die L-Glucose. D-Glucose und L-Glucose verhalten sich wie Bild und Spiegelbild. Die anderen 14 Aldohexosen sind zur D-Glucose (und somit auch zur L-Glucose) Diastereomere. Die D-Fructose ist kein Stereoisomer zur Glucose. Die Fructose gehört zu den Ketosen, besitzt also eine Keto-Gruppe im Molekül. Sie ist somit eine strukturisomere Verbindung zur Glucose. Weinsäure Obwohl die Weinsäure zwei asymmetrische Kohlenstoffatome besitzt, existieren nur drei Stereoisomere: R,R-Weinsäure = (+)-Weinsäure; S,S-Weinsäure = (-)-Weinsäure ; R,S-Weinsäure = meso-Weinsäure 25 Bei der Weinsäure tragen beide chiralen C-Atome die gleichen Substituenten. Liegt an C2 RKonfiguration und an C3 S-Konfiguration vor, besitzt das Molekül eine Spiegelebene. D.h. die 2R,3S- und die 3R,2S-Konfiguration sind äquivalent. Bei der Fischer-Projektion können die beiden Formen durch eine 180°-Drehung zur Deckung gebracht werden. Solche Moleküle nennt man meso-Formen. Sie sind insgesamt gesehen nicht chiral und daher auch nicht optisch aktiv. R,R(+)- und S,S(-)-Weinsäure sind Enantiomere, die meso-Weinsäure zu ihnen ein Diastereomer Geruch & Geschmack Auch die Rezeptoren für die verschiedenen Aromastoffe sind aus Proteinen aufgebaut und somit chiral. Es wundert daher nicht, dass bei chiralen Molekülen die beiden Enantiomere sich im Geruch unterscheiden. Das gleiche gilt für die Rezeptoren der Geschmackseindrücke "süß" und "bitter". "Sauer" und "salzig" werden dagegen durch Ionen hervorgerufen. Beispiel: L-Phenylalanin ist eine essentielle proteinogene Aminosäure. Nur dieses Enantiomer kommt im Organismus vor L-Phenylalanin Geschmack: bitter D-Phenylalanin Geschmack: süß Konformationsisomerie Konformere lassen sich durch Drehung um C-C-Einfachbindungen ineinander überführen. Diese Drehung wird jedoch durch die Abstoßung der Elektronenhüllen der Substituenten gehemmt, zur Überwindung wird Energie benötigt. Bei Raumtemperatur besitzen die meisten Moleküle genügend Energie, um Drehungen um C-C-Bindungen auszuführen. Zur Darstellung der Konformere bedient man sich oft der NEWMANProjektion. Das Molekül wird entlang der zu beschreibenden Bindung betrachtet. Das zum Betrachter weisende C-Atom wird durch einen Kreis dargestellt, von dessen Zentrum die drei Bindungen zu den Substituenten ausgehen. Das hintere C-Atom wird vom vorderen verdeckt, seine Bindungen sind nur außerhalb des Kreises sichtbar. In der gestaffelten (staggered) Konformation sind die Substituenten bzw. H-Atome am weitesten voneinander entfernt. Dies ist die energieärmste, stabilste Anordnung, am energier eichsten ist die ekliptische (verdeckte). 26 Konformationsisomerie: Cyclohexan Beim Cyclohexan ist durch den Ringschluss die Drehbarkeit um die C-C-Bindungen zusätzlich erschwert. Am stabilsten = energieärmsten ist die Sessel-Konformation, bei der an allen sechs Bindungen eine gestaffelte Anordnung erreicht ist. Als metastabile Konformationen kommen Twist-Formen vor. Ist das Cyclohexan substituiert, sind auch die Sesselkonformationen energetisch unterscheidbar. Die Konformation ist dann energieärmer und damit stabiler, wenn sich große Substituenten in äquatorialer Position befinden: Cyclohexandiol wurde bereits als Beispiel für cis-trans-Isomerie vorgestellt. Beim cis-Isomeren befindet sich in beiden möglichen Konformationen eine OH-Gruppe in äquatorialer und die andere in axialer Position. Beide Formen sind energetisch gleichwertig. Bei den trans-Isomeren sind entweder beide in axialer (= ungünstig) oder beide in äquatorialer Position (= günstiger).