Themenheft
Werbung

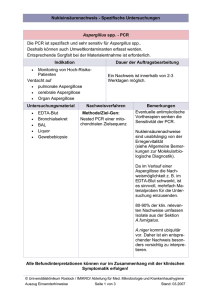
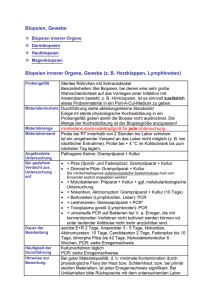
e h T t f e h n e m Molekularbiologische Diagnostik 111838 b Laborärztliche Arbeitsgemeinschaft für Diagnostik und Rationalisierung e.V. Lauenburger Straße 67 • 21502 Geesthacht • Telefon 04152 / 803 0 • Telefax 04152 / 848 490 LADR Fachlabore Ihr Vor-Ort-Labor berät Sie gern! Seit 1945 Erfahrung in der Diagnostik In unserem Verbund stehen Ihnen mehr als 40 renommierte Ärzte und Naturwissenschaftler täglich mit ihrem Fachwissen zur Verfügung. Dieses kompakte Wissen, kombiniert mit modernster Technologie, und unser einsenderorientierter, regionaler Service machen unseren guten Ruf aus. Laborärztliche Arbeitsgemeinschaft für Diagnostik und Rationalisierung e. V. Lauenburger Straße 67 • 21502 Geesthacht • Telefon 04152 / 848 190 • Telefax 04152 / 848 490 E-Mail: [email protected] • Internet: www.ladr.de Inhaltsverzeichnis Seite Molekularbiologische Untersuchungsmethoden 4 Polymerase-Kettenreaktion (PCR) 4 PCR-Untersuchungen Humangenetische Analysen Infektionsdiagnostik 5 5 6 Probenentnahme, Lagerung und Transport 7 Glossar 8 Fachlaboratorien der LADR 12 Titelfoto: DNA. J. Li, Modelling Simul. Mater. Sci. Eng. 11 (2003) 173 www.LADR.de 3 Molekularbiologische Untersuchungsmethoden Kaum ein Gebiet der Wissenschaft hat sich in den letzten 20 Jahren so rasant entwickelt wie die Molekularbiologie. Neben eindrucksvollen wissenschaftlichen Spitzenleistungen, wie z.B. der Entschlüsselung des menschlichen Genoms, haben viele molekularbiologische Untersuchungsmethoden Einzug in die Routine der modernen Labordiagnostik gefunden. Polymerase-Kettenreaktion (PCR) Die PCR, 1984 von Kary Mullis entwickelt, ist eine molekularbiologische Methode, mit der ein bestimmter DNA-Abschnitt hoch sensitiv und spezifisch amplifiziert werden kann. Dies wird durch die zyklische Wiederholung folgender Einzelschritte erreicht: Aufschmelzen des DNA-Doppelstranges in zwei Einzelstränge, Anlagern der DNA-Startermoleküle (Primer) und das Ergänzen des DNA-Einzelstranges durch eine thermostabile DNA-Polymerase. Die Spezifität der PCR und die Länge des zu amplifizierenden Fragments wird durch die ausgewählten Primersequenzen bestimmt. Durch die exponentielle Vermehrung - je Zyklus eine Verdopplung - des DNA-Fragments ist es möglich, selbst geringe DNA-Mengen im Ausgangsmaterial nachzuweisen. Wenn in einer Probe z. B. nur ein Virus-DNA-Molekül vorliegt, erhält man durch die PCR bei 30 Zyklen theoretisch 230 DNA-Fragmentmoleküle, die dann mit verschiedenen Methoden nachgewiesen werden können. Durch die Gelelektrophorese mit anschließender Färbung kann das Produkt sichtbar gemacht und in seiner Länge bestimmt werden. Zur weiteren Bestätigung kann das amplifizierte Fragment mittels einer Restriktionsendonuklease sequenzspezifisch gespalten werden und anhand der Größe der Subfragmente erkannt werden (Restriktions-Fragmentlängen-Polymorphismus). Das PCR-Produkt kann aber auch mit einem DNA-Sequenziergerät sequenziert werden (d. h. die genaue Reihenfolge der DNA-Bausteine wird bestimmt) und die Spezifität kann dann durch den Vergleich mit Sequenzen in einer Gen-Datenbank festgestellt werden. Schliesslich kann das amplifizierte Fragment durch die Hybridisierung mit einem spezifischen Oligonukleotid (Sonde) identifiziert werden. Ende der 90‘er Jahre gab es eine weitere Verbesserung der Nukleinsäure Analytik, die Real-Time (Echtzeit) PCR. Mit dieser neuartigen Technologie können spezifische DNA-Sequenzen amplifiziert und online durch eine fluorometrische Detektion der PCR-Produkte gleichzeitig nachgewiesen werden. Somit können DNA-Abschnitte noch rascher und sicherer detektiert werden. Durch die Möglichkeit einer Software gesteuerten Schmelzpunktanalyse (Tm-Analyse) nach der Amplifikation kann eine höhere Spezifität der Reaktion erreicht oder auch eine Genotypisierung z.B. die Differenzierung zwischen HSV-1 und HSV-2 vorgenommen werden. 4 Themenheft informiert Mit Hilfe einer reversen Transkriptase kann in einer RT-PCR auch RNA (z.B. HAV) amplifiziert werden. Bei der so genannten multiplex PCR kann in einem Ansatz mit mehreren Primerpaaren nach verschiedenen DNAs gesucht werden. Neben dem qualitativen Nachweis eines Krankheitserregers (z.B. HIV) kann die PCR für die quantitative bzw. Viruslast Bestimmung eingesetzt werden. Darüber hinaus können Subtypen von Viren (z.B. HCV) differenziert werden, um den Therapieerfolg abschätzen zu können. Die in neuester Zeit eingeführte Bestimmung von Resistenzgen Mutationen öffnet weitere Möglichkeiten der verbesserten Therapie, insbesondere bei HIV-Infektionen. Neben dem Einsatz in der Infektionsdiagnostik kann die PCR auch dazu benutzt werden, Mutationsanalysen im Bereich der humangenetischen Fragestellungen durchzuführen. So können z.B. bei Erbkrankheiten vorkommende Punktmutationen (z.B. bei der Hämochromatose) nachgewiesen werden. Hierbei werden die Primer so gewählt, dass ihr 3´-Ende genau mit der Punktmutation zusammenfällt. Kann das 3´-Ende des Primers sich nicht an seinen Gegenstrang anlagern (Mutation), so ist die DNA-Polymerase nicht in der Lage, den Strang zu verlängern. Auch Mehrfachmutationen innerhalb eines Genes (z.B. bei der cystischen Fibrose) oder Gendeletionen (z.B. bei den Glutathion-S-Transferasen) lassen sich mit molekularbiologischen Methoden nachweisen. PCR Untersuchungen Humangenetische Analysen Parameter Nachweis Methode Material APO E Genotypisierung Typ 2, 3, 4 PCR (Line Probe Assay) EDTA-Blut Beta-Thalassämie Beta-Globingen Mutationen Sequenzierung EDTA-Blut Cystische Fibrose 85% aller westeuropäische Mutationen PCR (Line Probe Assay) EDTA-Blut DPD Mutation G165A Sequenzierung EDTA-Blut Faktor V Leiden Mutation G1691A Sequenzierung EDTA-Blut Faktor II Prothrombin Mutation G20210A Sequenzierung EDTA-Blut GST-T1/-M1 Deletionen PCR EDTA-Blut Hämochromatose Mutationen C282Y und H63D Sequenzierung EDTA-Blut HLA Klasse I (A,B,C) siehe Themenheft: HLA-Diagnostik HLA-Klasse II (DR,DQ) siehe Themenheft: HLA-Diagnostik MTHFR Mutation C677T Sequenzierung EDTA-Blut www.LADR.de 5 Infektionsdiagnostik Parameter Nachweis Methode Material Bordetela pertussis / qualitativ PCR Nasopharyngealabstrich (trocken) qualitativ PCR Zecke, Urin, Punktat, Liquor, parapertussis Borrelia burgdorferi (sensu lato) Chlamydia Biopsie, EDTA-Plasma qualitativ trachomatis PCR (Cobas Amplicor)/ Tupfer (Roche Transportmedium), Real-Time PCR Urin, Sperma CMV qualitativ PCR EDTA-Blut, Urin EHEC (VTEC1/STX1) qualitativ PCR Bestätigung aus Kolonien/Bouillon EHEC (VTEC2/STX2) qualitativ PCR Bestätigung aus Kolonien/Bouillon EPEC (EAF-Plasmid) qualitativ PCR Bestätigung aus Kolonien HAV qualitativ RT-PCR Stuhl, EDTA-Plasma HBV quantitativ Real-Time PCR EDTA-Plasma HCV qualitativ RT-PCR (Cobas Amplicor) EDTA-Plasma quantitativ Real-Time PCR EDTA-Plasma Subtypisierung RT-PCR (Line Probe Assay) EDTA-Plasma HSV-1 qualitativ PCR Tupfer (trocken), Liquor HSV-2 qualitativ PCR Tupfer (trocken), Liquor HIV qualitativ RT-PCR (Cobas Amplicor) EDTA-Plasma quantitativ Real-Time PCR EDTA-Plasma Resistenz- RT-PCR (Sequenzierung) EDTA-Plasma PCR Tupfer (trocken), Biopsie bestimmung HPV MRSA Screening Typisierung (High- Hybridisierung Tupfer (Transportmedium), Risk, Low-Risk) Biopsie Methicillin Resis- Real-Time PCR Bestätigung aus Kolonien PCR Sputum, Bronchiallavage, Liquor, tenzbestimmung Mycobacterium tuber- qualitativ culose-Komplex Mycoplasma hominis Urin, Biopsie, Punktat qualitativ Mycoplasma pneumoniae qualitativ Real-Time PCR Urogenitalabstrich (trocken), Urin PCR Nasopharyngealabstrich, Bronchiallavage, Sputum Neisseria gonorrhoeae qualitativ PCR (Cobas Amplicor) Tupfer (Roche Transportmedium), Urin, Sperma Parodontopathogene qualitativ PCR Bakterien Papierspitzen (Probenmaterial anfordern) Ureaplasma urealyticum qualitativ PCR Urogenitalabstrich (trocken), Urin VZV PCR Rachenabstrich (trocken), qualitativ Bläschenflüssigkeit, Liquor 6 Themenheft informiert Probenentnahme, Lagerung und Transport Abstriche: Nasopharyngeal, Rachen, Urogenital, Bläschenflüssigkeit, Augen: entweder trocken (Tupfer in einem sterilen Röhrchen ohne Transportmedium) oder in einem Spezialröhrchen mit Transportmedium (Siehe Bestellschein: „Entnahme und Versandmaterial“ Ihres LADR Labors) bei Raumtemperatur einschicken. Biopsie: Steril entnehmen und in Kochsalzlösung geben. Bronchiallavage: Ca. 2 mL in einem sterilen Röhrchen. EDTA-Plasma: Blut abnehmen (≥ 2 mL), das Röhrchen nicht zentrifugieren und nicht öffnen. Cave: Kein Heparin-Plasma, da Heparin die PCR inhibiert. EDTA-Blut: Blut abnehmen (≥ 2 mL), das Röhrchen nicht zentrifugieren und nicht öffnen. Cave: Kein Heparin-Blut, da Heparin die PCR inhibiert. Liquor: Ca. 2 mL in einem sterilen Röhrchen schnell einsenden. Punktat: Ca. 2 mL in einem sterilen Röhrchen. Serum: Ca. 2 mL in einem sterilem Röhrchen. Sperma: Ca. 2 mL in einem sterilen Röhrchen. Sputum: Ca. 2 mL in einem sterilen Röhrchen. Stuhl: Ca. 1 g in einem sterilen Gefäß. Urin: Ca. 10 mL morgendlichen Erststrahlurin auffangen. Papierspitzen: Zahnärztliche Probenentnahme-Papierspitzen nach Sondierung subgingivaler Zahntaschen (Art.-Nr.: 203060). Zecken: Im Röhrchen mit Laubblatt oder feuchtem Zellstoff sofort ins Labor schicken. www.LADR.de 7 Glossar Amplifikation: Vervielfältigung von DNA-Gensequenzen APO E: Apolipoprotein E Polymorphismen: Risikomarker für Atheriosklerose sowie Alzheimer Erkrankung Beta-Globingen: erfasst alle Mutationen, die für eine Beta-Thalassämie ursächlich sein können CMV: Cytomegalie-Virus Cystische Fibrose: auch Mukoviszidose genannt, die häufigste letal verlaufende Erbkrankheit der kaukasischen Population; in Westeuropa ist ca. jede 20. Person Träger eines defekten CF-Gens DPD: Dihydropyrimidindihydrogenase: bei Vorliegen der Mutation G165A in dem Gen für das Enzym Dihydropyrimidindihydrogenase wird das Tumormedikament 5‘-Fluorouracil verlangsamt abgebaut, so dass es zu starken toxischen Nebenwirkungen kommt EHEC: enterohämorrhagische E. coli EPEC: enteropathogene E. coli Faktor V Leiden: Risikomarker für Thrombosen, insbesondere bei Vorliegen weiterer Risikofaktoren (Rauchen, Einnahme oraler Kontrazeptiva usw.) und/oder positiver Familienanamnese Faktor II Prothrombin: Risikomarker für Thrombosen, insbesondere bei Vorliegen weiterer Risikofaktoren (Rauchen, Einnahme oraler Kontrazeptiva usw.) und/oder positiver Familienanamnese 8 Gelelektrophorese: Nachweisverfahren, bei dem DNA-Fragmente in Agarosegel ihrer Länge nach elektrophoretisch aufgetrennt werden Genotypisierung: Bestimmung unterschiedlicher Formen eines Genes anhand deren unterschiedlicher Nukleotidenreihenfolge Themenheft informiert GST-T1/-M1: Glutathion-S-Transferase: Verdacht auf herabgesetzte Entgiftungskapazität insbesondere bei Belastung mit Umweltschadstoffen (Styrole, Glykole, PCP, PCBs, Aflatoxine, Formaldehyd, Alkohole usw.) oder Umgang mit Methylbromid, Ethylenoxid oder Dichlormethan am Arbeitsplatz Hämochromatose: Früherkennung einer primären Hämochromatose; Differenzierung zwischen primärer und sekundärer Hämochromatose; erhöhte Therapie-Resistenz bei Patienten mit einer HCV-Infektion HAV: Hepatitis A Virus HBV: Hepatitis B Virus Hybridisierung: Zusammenlagerung einzelsträngiger, auch nicht zusammengehöriger Nukleinsäuremoleküle (z.B. DNA/RNA) über Wasserstoffbrücken zwischen den komplementären Nukleotiden (Adenin mit Thymin / Uracil, Guanin mit Cytosin) HCV: Hepatitis C Virus HIV: humanes Immunodefizienzvirus HPV: humanes Papillomvirus HSV: Herpes Simplex Virus MRSA: Methicillin resistenter Staphylococcus aureus MTHFR: Methylentetrahydrofolatreduktase Polymorphismen: Erkennung des Homocysteinspiegels als signifikanten und unabhängigen Risikofaktor für koronare Herzerkrankungen, Schlaganfälle und venöse Thrombosen; Beeinflussung des Abbaus von Methotrexat Parodontopathogene Bakterien: Actinobacillus actinomycetemcomitans, Bacteroides forsythus, Porphyromonas gingivalis, Prevotella intermedia www.LADR.de 9 PCR: Polymerase-Kettenreaktion: die exponetielle Vermehrung von spezifischen DNA-Gensequenzen mit Hilfe des Enzyms DNA-Polymerase Restriktions-Fragmentlängen-Polymorphismus:Verfahren, bei dem PCR-Produkte identifiziert werden können anhand der Länge der Fragmente, die nach Behandlung mit einem Restriktionsenzym (Enzym, das bestimmte Nukleotidfolgen erkennt und zerschneidet) entstehen RT-PCR: Reverse-Transkriptase PCR: die exponetielle Vermehrung von spezifischen RNA-Gensequenzen nach einer vorherigen Umschreibung der RNA in DNA mit Hilfe des Enzyms Reverse-Transkriptase Schmelzpunktanalyse: Bestimmung der Zusammensetzung eines Genbereiches anhand der Temperatur (Tm = melting temperature), bei der die zwei DNA Stränge des Genbereiches auseinanderfallen („schmelzen“); wird u.a. bei der Genotypisierung angewandt Viruslast-Bestimmung: quantitative Bestimmung der Menge eines Virus im Blut („Viral Load Monitoring“) 10 VTEC: verotoxinproduzierende E.coli bzw. STX = Shiga Toxin VZV: Varizella Zoster Virus Themenheft informiert Notizen www.LADR.de 11 Baden-Baden Laborärztliche Gemeinschaftspraxis Dres. med. Renate Röck, Dietmar Löbel, Doina Ionescu Lange Straße 65, 76530 Baden-Baden Telefon (07221) 21 17 0, Telefax (07221) 21 17 77 Berlin Laborärztliche Praxis Dr. med. Anton Waldherr Landgrafenstraße 16, 10787 Berlin Telefon (030) 30 11 88 0, Telefax (030) 30 11 88 50 Braunschweig / Salzgitter Laborärztliche Praxis Peter John Campestraße 7, 38102 Braunschweig Telefon (0531) 22 08 80, Telefax (0531) 22 08 88 8 Bremen-Mitte Gemeinschaftspraxis für Laboratoriumsmedizin Priv.-Doz. Dr. med. Mariam Klouche, Priv.-Doz. Dr. med. Gregor Rothe St.-Jürgen-Straße 1, 28205 Bremen Telefon (0421) 22 27 00, Telefax (0421) 22 27 02 7 Bremen-Süd Laborärztliche Gemeinschaftspraxis Dr. med. Martin Sandkamp, Bernhard Köster, Dr. med. Ruth Hiller Norderoog 2, 28259 Bremen Telefon (0421) 57 25 0, Telefax (0421) 57 12 49 Dortmund Laborärztliche Praxis Dr. med. Bernd F. Becker-Kreutz Rosental 23, 44135 Dortmund Telefon (0231) 55 72 12 0, Telefax (0231) 55 72 12 21 Geesthacht Laborärztliche Gemeinschaftspraxis Dr. Kramer & Kollegen Dres. med. Detlef Kramer, Ivo Mucha, Adel Rahmann, Olaf Bätz, Priv.-Doz. Dietger Mathias, Prof. Gottfried Mauff (priv.), Annelie Weichsel, Jürgen Kunz, Peter Wollenberg, Siegfried Krell Lauenburger Straße 67, 21502 Geesthacht Telefon (04152) 803 0, Telefax (04152) 76 73 1 Hannover LADR GmbH, Labormedizinisches Versorgungszentrum Hannover Ärztliche Leitung: Prof. Dr. med. Günter Hellthaler, Dr. med. Norbert Sloot Oldenburger Allee 6, 30659 Hannover-Lahe Telefon (0511) 90 13 61 1, Telefax (0511) 90 13 61 9 Köln Laborärztliche Praxis Dr. med. Christiane Boogen Kirchstraße 2, 50996 Köln Telefon (0221) 93 55 56 0, Telefax (0221) 93 55 56 99 Kyritz Medizinisches Laboratorium Dr. Manfred Haßfeld Perleberger Straße 31 A, 16866 Kyritz Telefon (033971) 895 0, Telefax (033971) 895 20 Plön Laborärztliche Gemeinschaftspraxis Dr. med. Annegret Krenz-Weinreich, Dr. med. Wigbert Schulze Krögen 6, 24306 Plön Telefon (04522) 50 40, Telefax (04522) 50 48 2 Rendsburg Laborärztliche Praxis Dr. med. Peter Wrigge Hollerstraße 47, 24782 Büdelsdorf Telefon (04331) 708 20 20, Telefax (04331) 708 20 22 Laborärztliche Arbeitsgemeinschaft für Diagnostik und Rationalisierung e. V. Lauenburger Straße 67 • 21502 Geesthacht • Telefon 04152 / 848 190 • Telefax 04152 / 848 490 E-Mail: [email protected] • Internet: www.ladr.de DDL 31.12.2004 Fachlaboratorien der LADR