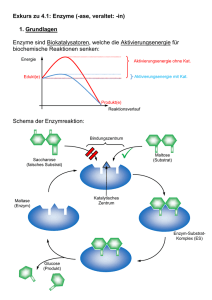
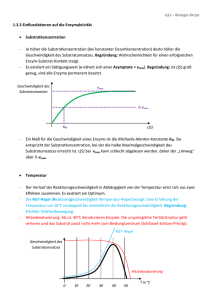
Enzyme: Grundlegende Konzepte und Kinetik
Werbung

Enzyme: Grundlegende Konzepte und Kinetik • Enzyme sind Katalysatoren biologischer Systeme • Wichtigste Eigenschaften: katalytische Stärke und Spezifität • Nahezu alle bekannten Enzyme sind Proteine, es gibt aber auch RNA-Moleküle die katalytische Aktivität haben • Im Prinzip katalysieren Enzyme Reaktionen durch Stabilisierung des jeweiligen Übergangszustands, dem energiereichsten Spezies im Reaktionsmechanismus 1 Enzyme sind leistungsstarke und (hoch)spezifische Katalysatoren 2 Carboanhydrasereaktion Selbst eine so einfache Reaktion wie die Hydratisierung von CO2 wird durch ein Enzym katalysiert. Tatsächlich ist die Carboanhydrase eines der schnellsten aller bekannten Enzyme; jedes Enzymmolekül kann pro Sekunde 106 Moleküle CO2 hydratisieren; d.h. die katalysierte Reaktion ist ca. 107-mal schneller als die unkatalysierte 3 Beispiel: proteolytische Enzyme • Subtilisin (aus Bakterien) unterscheidet fast gar nicht zwischen den Seitenketten (R1, R2) 4 Beispiel: proteolytische Enzyme • Trypsin (Verdauungsenzym) spaltet nur Peptidbindungen auf der Carboxylseite von Lysin- oder Argininresten • Thrombin (Blutgerinnung) katalysiert nur die Hydrolyse von Arg-GlyBindungen in ganz spezifischen Peptidsequenzen 5 Viele Enzyme benötigen Cofaktoren Apoenzym + Cofaktor Holoenzym • Zwei Gruppen: kleine organische Moleküle und Metalle • Cofaktoren, die kleine organische Moleküle sind, werden als Coenzyme bezeichnet. Sie leiten sich oft von Vitaminen ab und können entweder fest oder lose an das Enzym gebunden sein • Sind sie fest gebunden, nennt man sie prosthetische Gruppe • Lose gebundene Cofaktoren verhalten sich eher wie Cosubstrate, da sie sich genauso wie Substrate und Produkte an das Enzym binden und freigesetzt werden 6 Wozu Cofaktoren? Enzyme sind meist Proteine Proteine enthalten: • Saure Gruppen (COOH) • Basische Gruppen (NH2) • Hydroxylgruppen (OH) Redoxvorgänge können von Proteinen praktisch nicht katalysiert werden. 7 Wozu Cofaktoren? • Redoxvorgänge Redoxcofaktoren • Fixieren von Hxdroxyl- und Carboxylgruppen Metallkationen 8 Cofaktoren R R R R R (R) R R 9 Vitamine und Cofaktoren 10 Strukturen einiger wasserlöslicher Vitamine 11 Klassifizierung von Enzymen • Viele Enzyme haben allgemeine Namen, die keine Information über die Reaktion liefern, die sie katalysieren (z.B. Trypsin) • Die meisten Enzyme werden nach den Substraten und Reaktionen genannt, die sie katalysieren • 1964 wurde die Enzyme Commission gegründet, um eine einheitliche Nomenklatur zu entwickeln • Sie unterteilten die Reaktionen in 6 Hauptklassen, die von 1 bis 6 durchnummeriert sind. • Diese Gruppen untergliederten sie immer weiter, so dass eine vierstellige Zahl, der die Buchstaben EC vorangestellt sind, alle Enzyme genau identifiziert 12 Klassifizierung von Enzymen Siehe auch: http://www.chem.qmul.ac.uk/iubmb/enzyme/ 13 Thermodynamik der Katalyse • Die Gibbs-Energie (G) (ab und zu noch freie Enthalpie genannt) ist eine wichtige thermodynamische Funktion zum Verständnis von Enzymreaktionen. Zu beachten: rG K J J (T ) J=A K G J J (T ) J=A K Voraussetzung: B J A J J K G J f J (T ) J=A 0 14 Kinetik der Katalyse • Die Aktivierungs-Gibbsenergie rG°‡ (oft als G‡ bezeichnet) ist meist nicht direkt zugänglich. • Messbar sind die Arrhenius-Aktivierungsenergien (Ea) via Temperaturabhängigkeit der Geschwindigkeitskonstante. 15 REP Thermodynamik der Katalyse • rG liefert Informationen über die Spontaneität einer Reaktion. • Eine Reaktion ist spontan, falls rG < 0 (exergonisch). • Ein System ist im Gleichgewicht, wenn rG = 0. • Eine Reaktion mit rG > 0 nennt man endergonisch. Damit eine solche Reaktion vollständig abläuft, muss Energie zugeführt werden. 16 REP Thermodynamik der Katalyse • Die G-Funktion ist eine Zustandsfunktion. Der numerische Wert von rG hängt nicht vom Reaktionsweg ab (d.h. ist vom molekularen Reaktionsmechanismus unabhängig!). • rG sagt nichts über die Geschwindigkeit einer Reaktion aus! • Die Reaktionsgeschwindigkeit ist von rG‡ (bzw. Ea) abhängig. Es gibt keine Korrelationen zwischen rG und rG‡ (ausser in gewissen Modellen!). 17 REP Thermodynamik der Katalyse aA bB cC nN oO pP rG rG RT ln Q a a a Q a a a n N A a o O B b p P C c 18 Thermodynamik der Katalyse cJ aJ J c J c J Bei gelösten Stoffen: a a a Q a a a n N o O a A p P b B c C c c c c c c Q (alle = 1) c c c cN A n cO a N A B n a o cP b O B C o b p n N c A P C a o O p P b B c C p c J 19 Thermodynamik der Katalyse Konvention: d.h. c H ' rG : rG (pH 7) 7 10 M alle übrigen c° sind 1 M 20 2 H + + 2 e = H 2 Beispiel Eo´ := ? V Eo := 0 V R T 0.0592 V EE ln Q E log Q zF z Q pH 2 aH 2 a a 2 H e 2 1 1 14 10 2 14 7 2 10 cH 1 10 1 R T E E ln10 log Q zF 0.0592 V 0 14 0.414 V 2 ' 21 Thermodynamik der Katalyse rG ' RT ln K ' 2.303 RT log K ' K'e rG ' RT 10 (pH = 7) rG ' RT ln10 Bei Raumtemperatur (298.16 K) gilt: K ' 10 rG ' kJ mol1 5.71 kJ mol1 22 Thermodynamik der Katalyse Eine Änderung von K‘ um einen Faktor 10 entspricht einer Änderung von rG‘ um 5.71 kJ mol-1 23 Enzyme können nur die Reaktionsgeschwindigkeit, aber nicht das Reaktionsgleichgewicht verschieben • Ein Enzym kann die Gesetze der Thermodynamik nicht verändern und folglich auch nicht das Gleichgewicht einer Reaktion verschieben. Das heisst, ein Enzym beschleunigt die Hin- und die Rückreaktion um genau denselben Faktor. • Enzyme beschleunigen die Einstellung des Gleichgewichts, verschieben es jedoch nicht nach irgendeiner Seite. 24 Übergangszustand Eine chemische Umwandlung des Substrats S in das Produkt P verläuft über den Übergangszustand S‡, der eine höhere Gibbs-Energie besitzt als das Substrat. G 25 Übergangszustand • Es besteht ein Gleichgewicht zwischen Grundzustand und Übergangszustand. • Alle Übergangszustände zerfallen bei gleicher Temperatur gleich schnell. K‡ kx S S P ‡ ‡ K c ‡ S cS 26 Übergangszustand K‡ kx S S‡ P ‡ K dc P v kx cS dt kB T kx h c ‡ S cS rG ‡ e RT rG ‡ e RT Bei 25°C: kx = 6.61012 s-1 27 Übergangszustand ‡ Annahmen: rG 28.5 kJ mol cS 1M, T 298 K cS‡ cS 105 1 v = 6.6107 Ms-1 ‡ K c ‡ S cS rG ‡ e RT 28 Übergangszustand • Enzyme beschleunigen Reaktionen durch Erniedrigung von rG‡, der Aktivierungs-Gibbsenergie. • Die Verbindung von Substrat und Enzym schafft einen neuen Reaktionsweg, dessen Übergangszustand eine niedrigere Energie aufweist als der ohne Enzym ablaufenden Reaktion • Die Erniedrigung der Aktivierungsenergie hat zur Folge, dass mehr Moleküle die erforderliche Energie besitzen, um den Übergangszustand zu erreichen • Das Wesen der Katalyse besteht in der spezifischen Bindung und Stabilisierung des Übergangszustands 29 Enzym Substratkomplexe • Die Substrate werden in günstiger räumlicher Ausrichtung zu Enzym-SubstratKomplexen zusammengeführt. Dabei werden die Substrate an eine spezifische Region des Enzyms gebunden, die man als aktives Zentrum bezeichnet • Indirekter Beweis durch Sättigungskinetik: Bei genügend hohen Substratkonzentrationen sind alle katalytischen Zentren besetzt 30 Struktur eines Enzym-SubstratKomplexes Cytochrom-P450-Oxidase ist mit seinem gebundenen Substrat Campher 31 dargestellt Aktive Zentren haben gemeinsame Eigenschaften 1. Das aktive Zentrum ist eine dreidimensionale Spalte, die von vielen Gruppen aus verschiedenen Abschnitten der Aminosäuresequenz gebildet wird 2. Das aktive Zentrum stellt nur einen relativ kleinen Teil des Gesamtenzyms dar 3. Aktive Zentren sind höhlen- oder spaltenförmig 4. Substrate werden durch viele schwache Kräfte an das Enzym gebunden 5. Die Bindungsaffinität ist von der definierten Anordnung der Atome im aktiven Zentrum abhängig 32 Aktive Zentren können weit voneinander entfernte Reste enthalten 33 Wasserstoffbrücken zwischen einem Enzym und einem Substrat 34 Schloss-Schlüssel-Modell der Enzym-Substrat-Bindung 35 Modell des induced fit der EnzymSubstrat-Bindung 36 Übergangszustand 37 Michaelis-Menten-Kinetik 38 Bestimmung der Anfangsgeschwindigkeit 39 Steady state Bedingungen k1 k2 E S ES E P k 1 Annahme: dcES 0 dt cES konstant 40 Steady state Bedingungen 41 Michaelis-Menten-Gleichung k1 k2 E S ES E P k 1 k1 k2 KM k1 S V0 k2 E T S K M Die Maximalgeschwindigkeit Vmax wird erreicht, wenn alle Bindungsstellen am Enzym mit Substrat gesättigt sind – wenn also [ES] = [E]T ist Vmax k2 E T S V0 Vmax S K M 42 KM-Werte 43 Übung Enzyme A) In zwei verschiedenen Zellextrakten, Extrakt A und Extrakt B, wird die Aktivität des Enzyms Aldolase mit gleichen Enzymassays gemessen. Die Aktivität der Aldolase (ausgedrückt als Mol umgesetztes Substrat pro Gramm Extrakt) ist unter verschiedenen Bedingungen im Extrakt A immer 5 mal höher als im Extrakt B. Was ist die einfachste Erklärung für diese Beobachtung? B) Sie messen nun in einem der Extrakte die Aktivität der Aldolase in Abhängigkeite der Substratkonzentration. Bei einer Substratkonzentration von 0.04 mM messen Sie eine Aktivität, die 80% von Vmax entspricht. 44 Wie gross ist KM für diese Aldolase? KM-Werte V0 Vmax S K M S 0.8 Vmax Vmax 0.04 K M 0.04 K M 0.01mM 45 Wechselzahl, turnover number Aus Vmax ergibt sich die Wechselzahl eines Enzyms, d.h. die Anzahl Substratmoleküle, die – bei vollständige Sättigung des Enzyms mit Substrat – pro Zeiteinheit in das Produkt umgewandelt werden Die Wechselzahl entspricht der kinetischen Konstante k2, die auch als kkat bezeichnet wird Vmax k2 E T Vmax k2 E T 46 Das kinetische Optimum der enzymatischen Katalyse: das kkat/KM-Kriterium • Unter physiologischen Bedingungen liegt das Verhältnis [S]/KM meistens zwischen 0.01 und 1, d.h die enzymatische Geschwindigkeit liegt weit unter kkat, weil die meisten aktiven Zentren bei [S] << KM unbesetzt sind • Geeigneter Parameter zur Charakterisierung der Enzymkinetik unter diesen Bedingungen: V0 kkat S E KM kkat V0 S E T KM (folgt aus steady state Annahme) Für [S] << KM 47 k1 k2 E S ES E P k 1 d ES k1 E S (k1 k2 ) ES dt d ES 0 Steady state: dt d ES k1 E S (k1 k2 ) ES 0 dt k1 1 ES E S E S k1 k2 KM d P k2 V0 k2 ES E S dt KM 48 Substratpräferenzen von Chymotrypsin 49 Wie effizient kann ein Enzym sein? Gibt es physikalische Grenzen für den Wert von kkat/KM? kkat kkat kkat k1 k1 K M k1 kkat k1 kkat k1 • Der Wert von kkat/KM wird letztlich von k1 begrenzt, der Bildungsgeschwindigkeit des Enzym-Substrat-Komplexes. • Diese Geschwindigkeit kann nicht grösser werden als die Geschwindigkeit der diffusionsbedingten Begegnung von Enzym und Substrat • Die Diffusion beschränkt den Wert so dass er 108 bis 109 s-1 M-1 nicht übersteigen kann 50 Kinetische Perfektion Die Katalysegeschwindigkeit von kinetisch perfekten Enzymen wird nur durch die Geschwindigkeit begrenzt, mit der sie in Lösung ihrem Substrat 51 begegnen. REP Michaelis-Menten-Gleichung k1 k2 E S ES E P k 1 k1 k2 KM k1 S V0 k2 E T S K M Die Maximalgeschwindigkeit Vmax wird erreicht, wenn alle Bindungsstellen am Enzym mit Substrat gesättigt sind – wenn also [ES] = [E]T ist Vmax k2 E T S V0 Vmax S K M 52 Lineweaver-Burk-Diagramm 1 KM 1 1 V0 Vmax S Vmax 53 Reversible Enzym-Hemmung 54 Kompetitive Hemmung Ein kompetitiver Inhibitor vermindert die Katalysegeschwindigkeit, indem er den Anteil der Enzymmoleküle mit gebundenem Substrat verringert. Das Kennzeichen der kompetitiven Hemmung besteht darin, dass sie durch eine ausreichend hohe Substratkonzentration überwunden werden kann. In Gegenwart eines kompetitiven Inhibitors ist Vmax unverändert, dafür K app M KM I ) (1 Ki 55 Kompetitive Hemmung 1 1 KM V0 Vmax Vmax 1/ KM I 1 1 K i S 1/Vmax 56 Nichtkompetitive Hemmung Bei nichtkompetitiver Hemmung kann das Substrat immer noch an den Enzym-Inhibitor-Komplex binden, aus dem EnzymSubstrat-Inhibitor-Komplex kann aber kein Produkt gebildet werden. Vmax nimmt ab, KM bleibt unverändert, weil sich das verbleibende Enzym wie eine verdünnte Lösung verhält. Lässt sich nicht durch eine Erhöhung der Substratkonzentration ausschalten 57 Nichtkompetitive Hemmung app max V Vmax I 1 Ki 58 Nichtkompetitive Hemmung 1 1 1 KM 1 V0 Vmax I S 1 K i 1/ KM 1/Vmax 59 Analoga des Übergangszustandes sind starke Enzyminhibitoren Isomerisierung von L- zu D-Prolin verläuft über einen planaren Übergangszustand 60