Allergien und Autoimmunität
Werbung

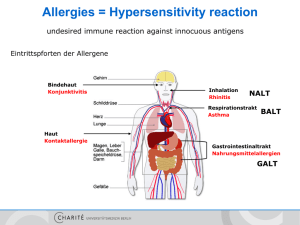
Allergies = Hypersensitivity reaction undesired immune reaction against innocuous antigens Eintrittspforten der Allergene Bindehaut Konjunktivitis Inhalation Rhinitis NALT Respirationstrakt Asthma Haut Kontaktallergie BALT Gastrointestinaltrakt Nahrungsmittelallergien GALT Klassifizierung nach Gell und Coombs Typ-I-Reaktion - IgE vermittelte Soforttyp-Reaktion Typ-II-Reaktion - Zell- oder Matrix-assoziierte Antigene - IgG vermittelt a) Fc-Rezeptor b) verändertes Signalling Typ-III-Reaktion - lösliches Antigen - Immunkomplex-vermittelt Typ-IV-Reaktion - T-Zell-vermittelt (verzögert) Typ-I-Reaktion Effektoren: Antigen: Effektormechanismen: Reaktionszeit: Klinische Beispiele: - Allergische Rhinitis - Allergische Konjunktivitis - Allergisches Asthma IgE Antikörper lösliche Antigene Mastzellaktivierung Sofort-Typ (<30 Minuten) Mast cell + IgE - spezialisierte Zellen in Mukosa / Epithel, in der Nähe von kleinen Gefäßen - oder im Bindegewebe an größeren Gefäßen - Granula enthalten saure Proteoglycane - exprimieren hochaffinen FcεRI - reifen über SCF im Gewebe (Granula) Typ1 Hypersensitivität – 1. Phase = Sensibilisierung 6. Bindung der IgE Antikörper an lokale FcεRI+ Effektorzellen (vor allem Mastzellen) 2. Diffusion in Mukosa Mastzelle 5. Diff. in TH2 3. Aufnahme durch APCs IL-5/9 IL-4 1. Allergenaufnahme TH2/9 IL-4 IL-13 APC CD4+ eosinophiler G. 4. Präsentation der CD4+ B-Zelle 5. Hilfe / Diff. von IgE+ Plasmazellen basophiler G. Typ1 Hypersensitivität – 2. Phase = Effektorphase 2. Diffusion in Mukosa 1. Allergenaufnahme B-Zelle CD4+ 3. Bindung des Allergens an IgE - FcεRI+ -Komplex auf Mastzellen 4. Degranulation der Mastzellen 5. Mediatoren bewirken Rekrutierung weiterer Effektorzellen Effektorfunktionen nach IgE-vermittelter Degranulation und Aktivierung von Mastzellen Exozytose der Granula Histamin Proteasen Dilatation der Gefäße, Kontraktion d. glatten Musk., toxisch Gewebeschädigung Modifikation von Arachidonsäure Prostaglandine Leukotriene Dilatation der Gefäße Sofortreaktion nach Minuten Kontraktion d. glatten Musk. Transkription von Zytokinen und Chemokinen TNF-α CCL11 (Eotaxin) Entzündung, TH2Polarisation, Neubildung von Zellen Leukozytenr ekrutierung, z.B. Eosinophils Spätreaktion nach 3-8 Stunden Mediators of TH2 (TH9) cells Th9 Was macht ein Allergen zum Allergen??? Eigenschaften: - kleine, stabile, stark lösliche Proteine „Carrier“ trockene Partikel transmukosale Aufnahme durch Diffusion geringe Mengen enzymatisch aktiv (Proteasen) Bindegewebsmastzellen bewirken anaphylaktischen Schock Auslöser: - Medikamente: Penicillin - Insektengift - Inhalation - Nahrungsmittel Klassische und neue Therapieansätze symptomatisch - Hemmung Wirkung Mastzellmediatoren (Histaminrezeptorantagonisten, LT-Antagonisten) - Hemmung Freisetzung Mastzellmediatoren (Steroide) - Hemmung Veränderungen der Zielzellen (ß-adrenerge Stimulation) - Hemmung T/B-Zellen (Calcineurinhemmer, Phosphodiesterasehemmer) kausal - Allergenkarrenz - Desensibilisierung - „Reprogramming of tolerance“ Ozdemir et. al. „Specific immunotherapy and turning off the T cell: how does it work?“ Ann Allergy Asthma Immunol 2011 Typ-II-Reaktion - gerichtet gegen Zell- oder Matrixproteine - IgG vermittelt - Pathomechanismen: 1. Komplementlyse und –fixierung 2. Phagozytose über Fc- und Komplementrezeptoren 3. Antikörper-abhängige, zellvermittelte Zytotoxizität durch NK-Zellen oder Eosinophile 4. Veränderung einer Rezeptorfunktion - Beispiele: AB0 Inkompatibilität Rhesus Inkompatibilität … Typ-II-Reaktion Rhesusinkompatibilität anti-D Prophylaxe (anti-Rh+ Serum nach Geburt eines Rh+ Kindes neutralisiert + eliminiert übergetretene väterliche RBCs und verhindert Aktivierung Rhspezifischer B-Zellen in der Mutter Typ-II-Reaktion Antikörper modifizieren Rezeptorfunktion 1. antagonistische Acetylcholinrezeptoren = myasthenia gravis Typ-II-Reaktion Antikörper modifizieren Rezeptorfunktion 1. agonistische TSH-rezeptor AK‘s = Morbus Basedow / Grave‘s disease Typ-III-Reaktion Immunkomplexerkrankung lösliche Antigene in Komplex mit IgG oder IgM z.B. Serumkrankheit Fc-Rezeptoren auf Thrombozyten bewirken Fixierung der Immunkomplexe auf Gefäßwand Typ-IV-Reaktion T-Zellvermittelte Reaktion verzögertem Typs (DTH) z.B. Kontaktdermatitis (Nickel) Typ-IV-Reaktion T-Zellvermittelte Reaktion verzögertem Typs (DTH) Effektorzellen - verzögerter Typ (24-72h) - antigen-spezifische TH1, TH2 oder CD8+ zytotoxische Zellen - zellvermittelte Lyse - Aktivierung und Rekrutierung von Granulozyten und Makrophagen Typ-IV-Reaktion DTH-Reaktion: Ausschüttung von z.B. IFN-γ bewirkt Aktivierung der Keratinozyten, die wiederum Zytokine und Chemokine produzieren und damit weitere Leukozyten rekrutieren. Erstkontakt bewirkt Bildung von memory T-Zellen, die sofort nach wiederholtem Kontakt ins Gewebe einwandern können und dort durch Präsentation von prozessiertem Ag reaktiviert werden. Induktoren einer Type IV Hypersensivität Allergie - Zusammenfassung • Typ I - IgE - Heuschnupfen, Asthma, Anaphylaxie • Typ II/III - IgG - Urtikaria, best. Medikamente • Typ IV - T-Zellen - Kontaktdermatitis • Unterdrückung der Immunantwort durch Hemmung der Mastzellen, Antihistaminika, Steroide, Desensibilisierung Prävention: ausschließl. Stillen in den ersten 4 Monaten, Lactobazillen Autoimmunity Autoimmunität = spezifische, adaptive Immunantwort gegen Selbstantigene Autoimmunerkrankung = Zerstörung oder Schädigung von körpereigenem Gewebe durch einen Autoantigengetriggerten Prozess Diskussion Autoimmunerkrankungen Autoantigen löst chronischen entzündliche Immunantwort aus, z.B. Myasthenia gravis autoentzündliche Erkrankungen Immunantwort gegen Selbstantigene Folge eines chronischen entzündlichen Prozesses, z.B. Rheumatoide Arthritis Autoimmunity Autoimmunerkrankung = chronisch entzündlich, schubweiser Verlauf lokal oder systemisch, familiäre Häufung jedes Organ / Organsystem kann Ziel sein Figure 13-1 Einteilung der Autoimmunerkrankungen - gerichtet gegen organspezifische Antigene (anti-TSH, anti-GAD) - Zerstörung definierter Zielorgane - gerichtet gegen ubiquitär exprimierte Antigene (antinukleäre AK‘s) - Zerstörung vieler Organe Pathogenese der Autoimmunität Suszeptibilitäts-Gene Epigenetik Umweltfaktoren (z.B. Infektionen, Gewebeschädigung) Verlust der „Selbst“-Toleranz Persistenz von funktionell selbst-reaktiven Lymphozyten Aktivierung von selbst-reaktiven Lymphozyten Immunantworten gegen Eigengewebe Genetik der Autoimmunität • Die meisten Autoimmunerkrankungen haben komplexe polygenetische Charakteristika – identifiziert durch breites Mapping genomischer Assoziationen (GWAS) – Untersuchung einzelner Gen-Mutationen sind für die Analyse von pathologischen Mechanismen nützlich • Einige Polymorphismen sind mit verschiedenen Erkrankungen assoziiert – Kontrolle allgemeiner Mechanismen für Toleranz und Immunregulation? • Andere genetische Verbindungen sind erkrankungsspezifisch – Einfluss auf den finalen Organschaden (z.B. PAD bei ACPA+ RA oder Tg/TSH-R bei Thyrioditis) Balance zwischen Immunaktivierung und Regulation Immunaktivierung 1. Entstehung von T- und B-Zellen in primären lymphatischen Organen Regulation 1. Deletion von selbstreaktiven T- und B-Zellen im Thymus und Knochenmark 2. Erkennung von Pathogenen und Aktivierung des angeborenen Immunsystems 3. Antigenpräsentation und Aktivierung von Tund B-Zellen 3. Inhibition durch z.B. CD25+ regulatorische T-Zellen 4. Differenzierung von Effektor-T-Zellen und Plasmazellen und langlebigen GedächtnisZellen 4. Apoptoseinduktion Aktivierung der angeborenen Immunantwort 1. Erkennung der pathogenen Strukturen mittels PRR‘s, z.B. TLR7/8 und NOD2 Viruses Bacteria Self Ag DNA TLR4 Bacteria Endosome ssRNA DNA Autophagosome 2. Signalweiterleitung in der Zelle, z.B. A20 RIG-I MDA5 TLR7/8 Peptidoglycan TLR9 NOD2 3. Aktivierung von Transkriptionsfaktoren, Produktion von anti-mikrobiellen Produkten und Zytokinen, z.B. IRF4 TRAF3 IRFs Nucleus NFkB A20 Zytokine Rai et. al. „Genetic predisposition to autoimmunity – What have we learned?“ Seminars in Immunology 2011 Aktivierung der erworbenen Immunantwort PTPN22 1. Antigenpräsentation durch MHC dem T-Zell-Rezeptor, z.B. HLA-DR B-Zelle NFkB 2. Signalbeeinflussung über KoRezeptoren, z.B. CD40, CTLA4 CD40 3. Signalweiterleitung in die Zelle, z.B. PKC, PTPN22 MHCI I CD40L TZR CD80/86 CTLA4/ CD28 4. Aktivierung von Transkriptionsfaktoren, z.B. NFkB PTPN22 Calcineur in NFkB MAPK T-Zelle Genetik der Autoimmunität Assoziation mit HLA Serotype mit Suszeptibilität zu Autoimmunerkrankungen Erkrankung HLA Allel Relatives Risiko • häufige Assoziation mit HLA-Allelen • veränderte AgPräsentation im Thymus und/oder Peripherie Geschlechterverteilu ng (Frauen/Männer) Morbus Bechterew (ankylosierende Spondylitis) B27 87,4 0,3 Multiple Sklerose DR2 4,8 10 Morbus Basedow (Grave‘s disease) DR3 3,7 4,5 Systemischer Lupus DR3 5,8 10-20 Type I Diabetes DR3/ DR4 25 1 Rheumatoide Arthritis DR4 4,2 3 Hashimoto Thyrioditis DR5 3,2 4-5 Celiac disease Perfect presentation of deamidated gluten through HLA-DQ2/8 alleles DQ expressed by B cells which are not present within Thymus + no transport of deamidated gluten to the thymus Aktivierung der erworbenen Immunantwort PTPN22 1. Antigenpräsentation durch MHC dem T-Zell-Rezeptor, z.B. HLA-DR B-Zelle NFkB 2. Signalbeeinflussung über KoRezeptoren, z.B. CD40, CTLA4 CD40 3. Signalweiterleitung in die Zelle, z.B. PKC, PTPN22 MHCI I CD40L TZR CD80/86 CTLA4/ CD28 4. Aktivierung von Transkriptionsfaktoren, z.B. NFkB PTPN22 Calcineur in NFkB MAPK T-Zelle Differenzierung (Art) der Immunantwort 1. Ausschüttung polarisierender Zytokine, z.B. IL-12 TH0 IL-2 IL-2RA IL-12 IL-18 2. Expression von Zytokinrezeptoren, z.B. IL2RA=CD25, IL23R 3. Aktivierung von Transkriptionsfaktoren, z.B. STAT3 IL-6 IL-23 Treg Periphere Toleranz, z.B. SLE IL-18RA TH 1 IL-23R IL-4 IL-4R TH2 STAT1,3/4 Intrazelluläre Pathogene, z.B. Hashimoto, T1D Parasiten, z.B. Allergien TH17 STAT3 Extrazelluläre Pathogene, z.B. MS, Psoriasis Gene und Autoimmunität Eine Mutation in einem Gen führt nur sehr selten zur Entstehung von Autoimmunerkrankungen Ausnahmen Erkrankung Gen APECED AIRE (Autoimmune polyendocrinopathy candidiasis ectodermal dystrophy IPEX FOXP3 (Immunodysregulation, polyendocrinopathy, enteropathy, X-linked) ALPS (autoimmune lymphoproliferative syndrome) FAS, FASL Mechanismus defekte Expression der Selbstantigene im Thymus defekte Differenzierung von regulatorischen T-Zellen defekte Deletion von selbstreaktiven T- und B-Zellen Mutationsbedingte Störungen der Regulation? Immunaktivierung 1. Entstehung von T- und B-Zellen in primären lymphatischen Organen Regulation 1. Deletion von selbstreaktiven T- und B-Zellen im Thymus (AIRE=APECD) und Knochenmark 2. Erkennung von Pathogenen und Aktivierung des angeborenen Immunsystems 2. Modulation der TLRSignaltransduktion (NOD2) 3. Antigenpräsentation (HLA-DR) und Aktivierung von T- und B-Zellen 3. Inhibition durch z.B. CD25+ regulatorische T-Zellen (CD25, Foxp3=IPEX) oder negativ regul. Moleküle (CTLA4, PTPN22) 4. Differenzierung von Effektor-T-Zellen und Plasmazellen und langlebigen GedächtnisZellen Bsp. für monogenetische bedingte Autoimmunerkrankungen 4. Apoptoseinduktion (FasL=ALPS) Bsp. für SNPs/Assoziationen polygenetisch bedingter Autoimmunerkrankungen Autoimmunität und Umwelt Beispiele von Umwelteinflüssen (exogene Faktoren) Medikamente / Schadstoffe Rauchen Erreger UV-Strahlung Trigger Aktivierung von TLRs, Modifikation von Autoantigenen, Induktion von Enzymen Aktivierung von TLRs, Expression von modifizierenden Enzymen, molekulares Mimikry Aktivierung von TLRs, Induktion von Enzymen, erhöhte Empfänglichkeit gegenüber Infektionen Zelluntergang, Freisetzung von Selbstantigenen (DNAProtein-komplexe), BZellaktivierung Suszeptibilitäten verstärken Wirkung TLR-Bindung: TLR-Signaltransduktion: z.B. TLR7/8 z.B. A20 TLR-Signaltransduktion: z.B. A20 TLR-Signaltransduktion: z.B. A20 Ag-Präsentation: z.B. HLA-DR4 B-Zelle: z.B. PTPN22 Kreation neuer Selbstantigene durch modifizierender Enyzme Citrullination + Erreger, Medikamente, Rauchen Carbamylation Rauchen, Inflammation (Neutrophile) Kreation neuer Selbstantigene durch post-translationale Modifikation (PMT) + Erreger, Medikamente, Rauchen Autoimmunity: role of infections Downloaded from: StudentConsult (on 15 January 2008 02:43 PM) © 2005 Elsevier Autoimmunity: role of infections Figure 13-26 Sfriso P et al. J Leukoc Biol 2010;87:385-395 Molecular mimicry = Ähnlichkeiten (Nachahmen) in der Sequenz oder Struktur zwischen Selbst- und Fremdpeptiden ist ausreichend, um selbstreaktive T- und B-Zellen zu aktivieren Pathogenese der Autoimmunität -Zusammenspiel von diversen Faktoren- Pathogenese RA- exogene Faktoren Umwelteinflüsse § städtische Umgebung erhöht Prävalenz („Life style“ Faktoren) § Rauchen erhöht Prävalenz (z.B. erhöhte Anzahl citrullinierter Peptide in der Lunge) § Exposition mit Siliziumdioxid (Quarz)- häufiger bei Männern; Neurohumorale Einflüsse § Frauen häufiger betroffen § erhöhte Prävalenz bei komplikationsreicher Schwangerschaft (Hyperemesis; Hypertension; Präeklampsie) § Besserung in der Schwangerschaft, Rezidiv postpartum § bei Apoplex oder Nervenläsion Besserung in der betroffenen Extremität Infektionen § EBV, Parvovirus § Proteobakterien; Mycoplasmen Bakterien § vermehrte Bildung citrullinierter Peptide unter Entzündung Pathogenese RA- exogene Faktoren Klareskog et. al. „Smoking, citrullination and genetic variability in the pathogenesis of rheumatoid arthritis?“ Seminars in Immunology 2011 Pathogenese RA- exogene Faktoren Klareskog et. al. „Smoking, citrullination and genetic variability in the pathogenesis of rheumatoid arthritis?“ Seminars in Immunology 2011 Ursachen von Autoimmunerkrankungen 1. Versagen der zentralen Toleranz 2. Unterbrechung der klonalen Anergie (Ko-stimulation in Peripherie) 3. Langlebigkeit reaktiver T-Zellen (kein AICD) 4. Verlust von regulatorischen Zellen 5. Kreuzreaktivität (Molekulares Mimikry) 6. Freisetzung von Selbstantigenen nach Gewebezerstörung z.B. DNA 7. Demaskierung kryptischer Selbstantigene durch z.B. Medikamente 8. Modifikation von Selbstantigenen (z.B. Citrullinierung) 9. Deregulierte MHC-Expression z.B. verringerte Expression im Thymus bewirkt verhindert negative Selektion 10. Mutationen / Polymorphismen 11. veränderte Zytokinbalance 12. Infektionen Einteilung der Autoimmunerkrankungen nach den Hypersensibilitätstypen