1999-25 Das Magenkarzinoid - Pathogenese und Therapie (Gastric
Werbung

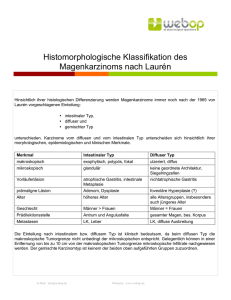
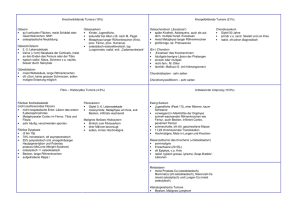
Übersicht Schweiz Med Wochenschr 1999;129:945–50 Peer reviewed article R. Bründler, J.-O. Gebbers a, D. Criblez b a Pathologisches Institut; Gastroenterologische Abteilung, Medizinische Klinik; Kantonsspital Luzern Das Magenkarzinoid – Pathogenese und Therapie b Summary Gastric carcinoid tumours: pathogenesis and treatment Gastric carcinoid tumours are rare neoplasms of neuroendocrine origin. They are believed to grow from enterochrommaffin-like (ECL) cells. Three different types of tumours can be distinguished: type I: hypergastrinaemic, induced by achlorhydria in chronic atrophic gastritis; type II: hypergastrinaemic, associated with Zollinger-Ellison syndrome and multiple endocrine neoplasia syndrome type 1; type III: sporadic. The trophic effect of gastrin on ECL cells is of crucial importance in the pathogenesis and treatment of hypergastrinaemic carcinoids. In these patients, hypergastrinaemia leads to ECL-hyperplasia, -dysplasia and -neoplasia. Hypergastrinaemic carcinoids often follow a very benign course, which makes it possible to avoid surgery, at least in patients at high surgical risk. The management of these three types is discussed. Keywords: gastric carcinoid; neuroendocrine tumours; achlorhydria; atrophic gastritis; enterochromaffin-like cells Zusammenfassung Das Magenkarzinoid ist eine seltene neuroendokrine Neoplasie, die meist von sogenannten enterochromaffinähnlichen Zellen (ECL-Zellen) ausgeht. Für das Vorgehen bei Magenkarzinoiden ist es wichtig, zwischen 3 Typen (Typ I: hypergastrinämisch infolge Achlorhydrie bei chronisch atropher Gastritis; Typ II: hypergastrinämisch bei Zollinger-Ellison-Syndrom und multiplem endokrinem NeoplasieSyndrom Typ 1; Typ III: sporadisch) zu unterscheiden. In der Entstehung der hypergastrinämisch induzierten Karzinoide ist die trophische Wirkung des Gastrins auf die ECL-Zellen we- Abkürzungen CAG chronisch-atrophe Gastritis EC Enterochromaffin ECL Enterochromaffin-like ZES-MEN-1 Zollinger-Ellison-Syndrom bei multipler endokriner Neoplasie vom Typ 1 sentlich mitbeteiligt und führt über die Sequenz Hyperplasie-Dysplasie-Neoplasma zur malignen Transformation. Für die Therapie der hypergastrinämischen Karzinoide ist zu berücksichtigen, dass der Verlauf ausgesprochen gutartig sein kann, so dass zumindest in Fällen mit erhöhtem chirurgischem Risiko auf operative Eingriffe verzichtet werden darf. Die Abklärung und Behandlung dieser 3 Magenkarzinoid-Typen werden besprochen. Keywords: Magenkarzinoid; neuroendokrine Tumoren; Achlorhydrie; atrophe Gastritis; enterochromaffinähnliche Zellen Korrespondenz: Dr. R. Bründler Medizinische Abteilung Spital Schwyz CH-6430 Schwyz 945 Übersicht Schweiz Med Wochenschr 1999;129: Nr 25 Einleitung Karzinoidtumoren wurden erstmals 1888 von Lubarsch beschrieben [1]. Er fand bei einer Autopsie multiple Tumoren im distalen Ileum. Der Begriff «Karzinoid» wurde 1907 von Oberndorfer geprägt, um Tumoren zu beschreiben, welche sich weniger aggressiv zu verhalten schienen als Adenokarzinome [2]. Der hohe Gehalt dieser Tumoren an argentaffinen Granula führte zu der Erkenntnis, dass es sich um (neuro)endokrine Tumoren handeln müsse [3]. Die erste Beschreibung eines Karzinoids des Magens datiert aus dem Jahr 1923 [4]. Neuere Untersuchungen haben gezeigt, dass das Magenkarzinoid je nach klinischem Hintergrund in 3 verschiedene Typen eingeteilt werden kann [5]. Im folgenden werden die verschiedenen Typen des Magenkarzinoids vorgestellt und Therapien unter spezieller Berücksichtigung der unterschiedlichen Tumortypen vorgeschlagen. Histo-Pathogenese des Magenkarzinoids Magenkarzinoide gehen von neuroendokrinen Zellen aus, die 1–2% aller Epithelzellen des Magens ausmachen [6] und in verschiedene Subtypen aufgeteilt werden (Tab. 1). 80% der Magenkarzinoide stammen von ECL-Zellen als den häufigsten neuroendokrinen Zellen des Magens ab [5, 7, 8]. Sie liegen unmittelbar neben den Parietalzellen an der Basis der Magendrüsen [9]. Immunhistochemisch lassen sie sich mit Antikörpern gegen Chromogranin A und Histamin darstellen und zeigen in der Grimelius-Reaktion ein argyrophiles Färbeverhalten [10]. Die ECL-Zelle spielt eine Schlüsselrolle in der Magensäuresekretion. Gastrin stimuliert die ECL-Zellen zur Ausschüttung von Histamin, das die benachbarten Parietalzellen zur Säuresekretion anregt [11–13]. Umgekehrt bewirkt eine CAG-induzierte Achlorhydrie eine reaktive Hypergastrinämie. Da Gastrin aber auch einen starken trophischen Effekt auf die ECLZelle ausübt, kann die Hypergastrinämie zur ECL-Proliferation führen mit der experimentell nachgewiesenen Sequenz ECL-Hyperplasie – Dysplasie – Neoplasma [14, 15]. Entsprechend wird angenommen, dass ECL-Karzinoide beim hypergastrinämischen Patienten über eine solche Sequenz entstehen [7, 16]. Tabelle 1 neuroendokrine Zelle Neuroendokrine Zellen des Magens [9, 16]. ECL Fundus-Korpus Histamin 30–50 EC Antrum Serotonin 10 D Antrum Somatostatin 20 A Fundus-Korpus Glukagon X Fundus-Korpus Endothelin G Antrum Gastrin Vorkommen sekretorisches Hauptprodukt Häufigkeit (%) 30–50 Einteilung der Magenkarzinoide Wegweisend für Abklärung und Therapie der Magenkarzinoide ist die Einteilung nach klinischen Gesichtspunkten. Das Vorliegen oder Fehlen einer Hypergastrinämie und die Tumorgrösse sind hierbei entscheidend [5, 9]. Vor diesem Hintergrund ist die Einteilung der Magenkarzinoide in 3 Typen üblich [17], nämlich in einen normogastrinämischen d.h. sporadischen (Typ III) und in hypergastrinämische (Typ I und II; vgl. Tab. 2). Bei den hypergastrinämischen Karzinoiden unterscheidet man einen Typ I auf dem Boden einer CAG und einen Typ II bei ZES-MEN-1. Eine neuere, mehr histopathologisch orientierte Einteilung der Magenkarzinoide verlässt 946 den Begriff «Karzinoid» zugunsten des Terminus «neuroendokrine Tumoren» und berücksichtigt zusätzlich den Differenzierungsgrad des Neoplasmas, dem möglicherweise eine prognostische Bedeutung zukommt (Tab. 3). Das Typ-I-Karzinoid bei chronisch-atropher Gastritis Die Mehrzahl (62–83%) der Magenkarzinoide sind vom Typ I, der nur mit moderater Hypergastrinämie einhergeht [5, 20]. Das Erkrankungsalter liegt typischerweise im 6.–7. Lebensjahrzehnt, die Erkrankung ist häufiger bei Übersicht Schweiz Med Wochenschr 1999;129: Nr 25 Tabelle 2 Einteilung des Magenkarzinoids (modifiziert nach [9, 17]). Karzinoidtyp mit Hypergastrinämie Normogastrinämie Typ I Typ II Typ III klinischer Hintergrund CAG ZES bei MEN-1 – Tumorcharakteristika klein, multipel klein, multipel solitär; oft >1 cm Schleimhaut atroph hypertroph normal ECL-Proliferation (+) ++ – biologisches Verhalten langsames Wachstum langsames Wachstum rasches Wachstum Metastasierungsrate sehr selten Metastasierung (7,6%) [5] Metastasierung häufiger als beim Typ I (12%) [5] Mestastasierung häufig (65,4%) [5] Ursprung ECL-Zellen ECL-Zellen ECL-, EC- oder X-Zellen Tabelle 3 benigne Tumore Neuroendokrine Tumore des Magens [18]. endokrin nicht aktive, gut differenzierte, kleine (<1 cm) Tumore innerhalb der Mukosa-Submukosa ohne Gefässeinbrüche – in der Regel ECL-Zellen-Tumore der Magenfundusschleimhaut, assoziiert mit CAG und Hypergastrinämie benigne oder niedrigmaligne Tumore endokrin nicht aktive, gut differenzierte Tumore innerhalb der Mukosa-Submukosa mittlerer Grösse (zwischen 1 cm und 2 cm) ohne Gefässeinbrüche oder kleine bis mittlere Tumore (bis 2 cm) mit Gefässeinbrüchen – in der Regel ECL-Tumore der Magenfundusschleimhaut, assoziiert mit CAG und Hypergastrinämie – selten ZES-MEN-1 assoziiert oder sporadische ECL-Tumore * Wenn Metastasen oder ein organüberschreitendes Wachstum vorliegen, sollte der Tumor als «niedrigmalignes neuroendokrines Karzinom» bezeichnet werden. ** auch als «EC-Tumor» bezeichnet niedrig maligne Tumore* endokrin nicht aktive, gut differenzierte, grosse (>2 cm) oder die Submukosa überschreitende Tumore – in der Regel sporadische ECL-Tumore; selten serotoninproduzierende** oder andere Tumore – selten ZES-MEN-1 oder CAG-assoziierte ECL-Zell-Tumore endokrin aktive Tumore jeder Grösse und Ausdehnung – sporadisches Gastrinom, serotoninproduzierende Tumore oder andere hoch maligne Tumore endokrin aktives oder nicht aktives, wenig differenziertes intermediäres oder kleinzelliges Karzinom Frauen als bei Männern [19, 20]. Dieser Typ verhält sich entweder klinisch stumm oder verursacht uncharakteristische Abdominalbeschwerden [19]. Als Rarität können diese Neoplasien ein Karzinoidsyndrom hervorrufen [21]. Die Häufigkeit des Typ-I-Karzinoids bei CAG ist nicht bekannt. Bei Patienten mit perniziöser Anämie beträgt sie 4–9% [22, 23]. ECL-Magenkarzinoide bei CAG sind meist polypös, multitop und klein (<1 cm), typischerweise mit Erosionen [24]. Sie finden sich vorwiegend in Magenkorpus und -fundus. Der Verlauf ist vergleichsweise gutartig. Wie Langzeitbeobachtungen zeigen, können sich Magenkarzinoide vom Typ I über Jahre stabil verhalten (Tab. 4). Es sind auch spontane Rückbildungen beschrieben worden [25]. Eine Metastasierung wurde in weniger als 10% beobachtet [5]. Rückbildungen können über eine Elimination des Gastrinstimulus mittels Antrektomie erreicht werden [26–28]. Tabelle 4 Autor Stationäre Verläufe von Typ-I-Magenkarzinoiden [25, 44]. Harvey [25] Stolte [44] n Das Typ-II-Karzinoid bei Zollinger-Ellison-Syndrom mit MEN-1 Zwischen 5% und 10% der Magenkarzinoide sind mit dem Zollinger-Ellison-Syndrom mit MEN-1 assoziiert [20]. Klinisch stehen in solchen Fällen die typischen Symptome des ZES im Vordergrund; die Hypergastrinämie ist exzessiv. Endoskopisch handelt es sich um kleine, polypöse Korpus-Fundus-Karzinoide. Die Magenschleimhaut ist histologisch typischerweise hypertroph. Metastasen wurden bei 12% der Patienten beobachtet. Da beim sporadischen ZES (im Gegensatz zum genetisch determinierten ZES-MEN-1) nur sehr selten Magenkarzinoide entstehen, wird vermutet, dass nebst dem Gastrinstimulus auch genetische Faktoren an der neoplastischen Transformation beteiligt sind [9, 11]. mittlere Beobachtungszeit nach Diagnose (Jahre) Bemerkungen 5 3,6 4 von 5 Patienten mit Perniziosa 27 3,6 9 nachkontrollierte Patienten 7–13 Jahre nach Diagnose beschwerdefrei 947 Übersicht Das sporadische Typ-III-Karzinoid Zwischen 15% und 25% der Magenkarzinoide sind sporadisch [20]. Dieser Karzinoidtyp kann von verschiedenen Ursprungszellen ausgehen (ECL, EC, X) [5]. Im Unterschied zum Typ-I-Karzinoid sind diese Tumoren häufiger bei Männern als bei Frauen [20]. Das sporadische Magenkarzinoid kann sich als obere Gastrointestinalblutung [29, 30] oder als Magenausgangsstenose [31] präsentieren. Ein Schweiz Med Wochenschr 1999;129: Nr 25 Karzinoidsyndrom wurde in 28% beobachtet, meist von Histamin verursacht [5]. Metastasen fanden sich bei 65% der Patienten [5]. Diese in normaler Schleimhaut und bei Normogastrinämie entstehenden Neoplasmen sind grösser (0,5–5 cm) als die Typ-I- und Typ-II-Karzinoide und meist solitär [5]. Das aggressive biologische Verhalten dieser Neoplasmen korreliert mit Tumorgrösse sowie histologischen Befunden (Gefässeinbrüche, proliferative Aktivität) und erklärt die hohe Letalität [32, 33]. Diagnostik Magenkarzinoide werden endoskopisch-bioptisch diagnostiziert. Endoskopisch erscheinen sie als submuköse, gelbliche, knotige Vorwölbungen variabler Grösse. Je nach Tumordurchmesser kann die Schleimhaut an der Kuppe glatt, erodiert oder ulzeriert sein. Zur Sensitivität der Biopsie in Fällen mit intakter Schleimhaut gibt es keine Untersuchungen. Magenkarzinoide zeigen die typische Histologie der Vorderdarm-Karzinoide: Bänder oder Trabekel, gelegentlich Nester und Rosetten. Die Zellen sind schlecht abgrenzbar, rund oder polygonal mit uniformen runden, zentralen Kernen mit feinem Chromatin, kleinen Nukleolen und nur seltenen Mitosefiguren. Das Zytoplasma kann hell eosinophil oder, vor allem am Rand der Zellnester, granuliert dunkel eosinophil sein. Gelegentlich kommen aber auch ganz andere Zellformen wie plasmazytoide, spindelige, rhabdoide oder geringe Differenzierungen vor, wobei die Abgrenzung zu Karzinomen oder Lymphomen schwierig sein kann. Hierbei sind auch kleinzellige Neoplasmen (oat cell tumor) bekannt. Histochemisch sind diese Karzinoide argyrophil, selten argentaffin. Immunhistochemisch können im Zytoplasma neuroendokrine Granula, wie Chromogranin A nachgewiesen werden, selten Chromogranin B, in 50% Synaptophysin und weitere Sekretionsprodukte wie Serotonin, pankreatisches Polypeptid, Histamin, Gastrin und selten ACTH, B-MSH, Epinephrin und Parathormon-verwandtes Protein. Die Karzinoide besitzen reichlich Somatostatin-Rezeptoren. Elektronenmikroskopisch besitzen die Zellen meist Merkmale der ECL-Zellen. Die Bestimmung des Serumgastrins erlaubt die Unterscheidung zwischen sporadischen und hypergastrinämischen Karzinoiden. Bei Hypergastrinämie, entsprechender Klinik und fehlendem Nachweis einer CAG muss mit einem Sekretin-Provokationstest und weiteren Untersuchungen nach einem ZES oder MEN-1 gesucht werden. Die Endosonographie erfasst die Tiefeninfiltation in bis zu 90% und perigastrische Lymphknotenmetastasen in bis zu 75% [34, 35]. Da die Somatostatinrezeptoren der Karzinoide, vor allem der Subtyp 2 (SSTR2), eine hohe Affinität zu Octreotid besitzen, wird die Octreotidszintigraphie zunehmend im Staging zum Nachweis von lokoregionären oder von Fernmetastasen eingesetzt [36–42]. Mit anderen bildgebenden Verfahren, wie CT und MRI, werden vor allem grössere Metastasen nachgewiesen. Die Therapie der Magenkarzinoide beruht noch weitgehend auf vorläufigen Erkenntnissen aus unkontrollierten Studien, die kleine Serien umfassen. Trotzdem können aufgrund des unterschiedlichen biologischen Verhaltens der 3 Karzinoidtypen bereits jetzt für die normogastrinämisch-sporadischen und die hypergastrinämischen Karzinoide unterschiedliche Behandlungswege empfohlen werden, wie sie in Abbildung 1 dargestellt sind. Beim sporadischen Magenkarzinoid wird im Frühstadium wegen der relativ hohen Metastasierungspotenz eine totale oder partielle Gastrektomie mit Lymphknotendissektion empfohlen [17, 43]. Bei den hypergastrinämischen Magenkarzinoiden (Typ I bei CAGA und Typ II bei ZES-MEN1) hängt das therapeutische Vorgehen in erster Linie von Grösse und Anzahl der Tumoren ab [17]. Bei geringer Grösse (<1 cm) und Anzahl (<5) ist eine endoskopische Entfernung als wenig invasives Vorgehen angezeigt [17, 20, 42, 43]. Entsprechend verschiedenen Beobachtungen einer Rückbildung von Magenkarzinoiden nach Elimination des Gastrinstimulus mittels Antrektomie [21–23] kann dieser Ein- Therapie 948 Schweiz Med Wochenschr 1999;129: Nr 25 Übersicht Abbildung 1 Algorithmus zur Abklärung und Therapie des Magenkarzinoids, modifiziert nach Gilligan und Modlin [17]. griff beim gut operablen Patienten mit multiplen und grösseren Tumoren erwogen werden, kombiniert mit einer Lokalexzision der grösseren Karzinoide. Bei einem hypergastrinämischen Patienten wurde Octreotid verabreicht, wobei sich die Magenkarzinoide zurückzubilden schienen [45]; in 4 Fallbeobachtungen mit Typ-II-Magenkarzinoiden bildeten sich die morphome- trisch bestimmten Volumina der ECL-Zellen unter Octreotid zurück [46]. Zurzeit kann eine Octreotid-Langzeittherapie allerdings für diese Indikation nicht empfohlen werden, zumal der Langzeiteffekt nicht untersucht ist, die Kosten beträchtlich sind und wenig invasive Alternativen zur Verfügung stehen. 1 Lubarsch O. Über den primären Krebs des Ileum nebst Bemerkungen über das gleichzeitige Vorkommen von Krebs und Tuberkulose. Virchow Arch 1888;3:280–317. 2 Oberndorfer S. Karzinoide Tumoren des Dünndarms. Frankf Z Pathol 1907;1:425–9. 3 Gosset A, Masson P. Tumeurs endocrines de l’appendice. Presse Med 1914;1:237–40. 4 Von Askanazy M. Zur Pathogenese der Magenkarzinoide und über ihren gelegentlichen Ursprung aus angeborenen epithelialen Keimen in der Magenwand. Dtsch Med Wochenschr 1923;49:49–53. 5 Rindi G, Luinetti O, Cornaggia M, Capella C, Solcia E. Three subtypes of gastric argyrophil carcinoid and the gastric neuroendocrine carcinoma: a clinicopathologic study. Gastroenterology 1993;104:994–1006. 6 D’Adda T, Bordi C. Quantitative electron microscopy of endocrine cells in oxyntic mucosa of normal human stomach. Cell Tissue Res (Germany, West) 1989;255:41–8. 7 Bordi C, Yu JY, Baggi MT, Davoli C, Pilato FP, et al. Gastric carcinoids and their precursor lesions. Cancer 1991;67: 663–72. Literatur 949 Übersicht 8 Solcia E, Bordi C, Creutzfeldt W, Dayal Y, Dayan AD, et al. Histopathological classification of nonatral gastric endocrine growths in man. Digestion 1988;41:185–200. 9 Solcia E, Rindi G, Silini E, Villani L. Enterochromaffin-like (ECL) cells and their growths: relationships to gastrin, reduced acid secretion and gastritis. Baillière’s Clin Gastroenterol 1993;7:149–65. 10 Sundler F, Håkanson R. Gastric endocrine cell typing at the light microscopic level. In: Håkanson R, Sundler F, Hrsg. The stomach as an endocrine organ. Amsterdam: Elsevier Science Publishers; 1991. p. 9–26. 11 Modlin IM, Nangia AK. The pathobiology of the human enterochromaffin-like cell. Yale J Biol Med 1992;65:775–92. 12 Walsh JH, Wu V. Transcriptional regulation of gastrin and somatostatin synthesis in rats. In: Håkanson R, Sundler F, eds. The stomach as an endocrine organ. Amsterdam: Elsevier Science Publishers; 1991. p. 223–31. 13 Prinz C, Kajimura M, Scott D, Mercier F, Helander HF, et al. Histamine secretion from rat enterochromaffin-like cells. Gastroenterology 1993;105:449–61. 14 Bilchik AJ, Nilsson O, Modlin IM, Sussman J, Zucker KA, et al. H2-receptor blockade induces peptide YY and anteroglucagon-secreting gastric carcinoids in mastomys. Surgery 1989;106:1119–26. 15 Betton GR, Dormer CS, Wells T, Pert P, Price CA. Gastric ECL-cell hyperplasia and carcinoids in rodents following chronic administration of H2-antagonists SK&F 93479 and oxmetidine and omeprazole. Toxicol Pathol 1988;16: 288–98. 16 Solcia E, Fiocca R, Villani L, Gianatti A, Cornaggia M, et al. Morphology and pathogenesis of endocrine hyperplasias, precarcinoid lesions, and carcinoids arising in chronic atrophic gastritis. Scand J Gastroenterol 1991;26(Suppl 180): 146–59. 17 Gilligan CJ, Lawton GP, Tang LH, West AB, Modlin IM. Gastric carcinoid tumors: the biology and therapy of an enigmatic and controversial lesion. Am J Gastroenterol 1995;90: 338–52. 18 Capella C, Heitz PU, Höfler H, Solcia E, Klöppel G. Revised classification of neuroendocrine tumours of the lung, pancreas and gut. Virchows Arch 1995;425:547–60. 19 Thomas RM, Baybick JH, Elsayed AM, Sobin LH. Gastric carcinoids. An immunohistochemical and clinicopathological study of 104 patients. Cancer 1994;73:2053–8. 20 Rindi G, Bordi C, Rappel S, La Rosa S, Stolte M, Solcia E. Gastric carcinoids and neuroendocrine carcinomas: pathogenesis, pathology, and behavior. World J Surg 1996;20: 168–72. 21 Nosaka T, Habu H, Endo M, Okayasu I. Multiple carcinoid tumors of the stomach with hypergastrinemia. Am J Gastroenterol 1992;87:766–70. 22 Borch K, Renvall H, Liedberg G. Gastric endocrine cell hyperplasia and carcinoid tumors in pernicious anemia. Gastroenterology 1985:88;638–48. 23 Borch K, Renvall H, Kullmann E, Wilander E. Gastric carcinoid associated with the syndrome of hypergastrinemic atrophic gastritis: a prospective analysis of 11 cases. Am J Surg Pathol 1987;11:435–44. 24 Carney JA, Go VLW, Fairbanks VF, Moore SB, Alport EC, et al. The syndrome of gastric argyrophil carcinoid tumors and nonantral gastric atrophy. Ann Intern Med 1983;99:761–6. 25 Harvey RF. Spontaneous Resolution of multifocal gastric enterochromaffin-like cell carcinoid tumours. Lancet 1988/I: 821. 26 Hirschowitz BI, Griffith J, Pellegrin D, Cummings OW. Rapid regression of enterochromaffin-like cell gastric carcinoids in pernicious anemia after antrectomy. Gastroenterology 1992;102:1409–18. 950 Schweiz Med Wochenschr 1999;129: Nr 25 27 Richards AT, Hinder RA, Harrison AC. Gastric carcinoid tumours associated with hypergastrinaemia and pernicious anaemia – regression of tumours by antrectomy. A case report. S Afr Med J 1987;72:51–5. 28 Eckhauser FE, Lloyd RV, Thompson NW, Raoer SE, Vinik AI. Antrectomy for multicentric, argyrophil gastric carcinoids: A preliminary report. Surgery 1988;104:1046–53. 29 Purcell R, Singh I, Lewis E, Muzac A. Gastric carcinoid presenting with massive upper gastrointestinal bleeding. N Y State J Med 1988;88:80–1. 30 Roncoroni L, Costi R, Canavese G, Violi V, Bordi C. Carcinoid tumor associated with vascular malformation as a cause of massive gastric bleeding. Am J Gastroenterol 1997;92: 2119–20. 31 Green ST, Drury JK, Mc Callion J, Erwin L. Carcinoid tumour presenting as recurrent gastric outlet obstruction: A case of long-term survival. Scott Med J 1987;31:54–5. 32 Mizuma K, Shibuya H, Totsuka M Hayasaka H. Carcinoid of the stomach: a case report and review of 100 cases reported in Japan. Ann Chir Gynaecol 1983;72:23–7. 33 Wilander E, El-Salhy M, Pitkanen P. Histopathology of gastric carcinoids: a survey of 42 cases. Histopathology 1984;8:182–93. 34 Yoshikane H, Tsukamoto Y, Niwa Y, Goto H, Hase S, et al. Carcinoid tumors of the gastrointestinal tract: evaluation with endoscopic ultrasonography. Gastrointest Endosc 1993; 39:375–83. 35 Zimmer T, Ziegler K, Bäder M, Fett U, Hamm B, et al. Localisation of neuroendocrine tumours of the upper gastrointestinal tract. Gut 1994;35:471–5. 36 Anthony LB, Martin W, Delbeke D, Sandler M. Somatostatin receptor imaging:predictive and prognostic considerations. Digestion 1996;57(Suppl 1):50–3. 37 Wängberg B, Forssell-Aronsson E, Tisell LE, Nilsson O, Fjälling M, et al. Intraoperative detection of somatostatin receptor-postitive neuroendocrine tumours using indium-labelled DTPA-D-Phe-octreotide. Br J Cancer 1996;73:770–5. 38 Lamberts SWJ, Bakker WH, Reubi JC, Krenning EP. Somatostatin-receptor imaging in the localization of endocrine tumors. N Engl J Med 1990,323:1246–9. 39 Krenning EP, Kwekkebom DJ, Oei HY, de Jong RJB, Dop FJ, et al. Somatostatin receptor scintigraphy in carcinoids, gastrinomas and Cushing’s syndrome. Digestion 1994;55(Suppl 3):53–9. 40 Krenning EP, Kooij PPM, Pauwels S, Breeman WAP, Postema PTE. Somatostatin receptor: Scintigraphy and radionuclide therapy. Digestion 1996;57(Suppl 1):57–61. 41 Le Guludec D, Cadiot G, Lebtahi R, Mignon M. Détection des tumeurs endocrines du tube digestif. Intérets et limites de la scintigraphie des récepeteurs de la somatostatine. Presse Méd 1996;25:677–82. 42 Meko JB, Doherty GM, Siegel BA, Norton JA. Evaluation of somatostatin-receptor scintigraphy for detecting neuroendocrine tumors. Surgery 1996;120:975–83. 43 Davies MG, O’Dowd G, McEntee GP, Hennessy TPJ. Primary gastric carcinoids: A view of management. Br J Surg 1990;77:1013–4. 44 Stolte M, Ebert D, Seifert E, Schulte F, Rode J. Zur Prognose der Karzinoidtumoren des Magens. Leber Magen Darm 1988;18:246–50. 45 Caggiano AV, Adams DB, Metcalf JS, Anderson MC. Neuroendocrine tumor of the pancreas in a patient with pernicious anemia. Am Surg 1990;6:347–51. 46 D’Adda T, Annibale B, Delle Fave G, Bordi C. Oxyntic endocrine cells of hypergastrinaemic patients. Differential response to antrectomy or octreotide. Gut 1996,38:668–74.