Struktur eines Homoborirens
Werbung

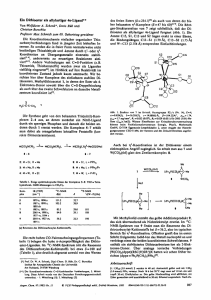
Struktur eines Homoborirens Structure of a Homoborirene Christine Pues, Gerhard Baum, Werner Massa und Armin Berndt* Fachbereich Chemie der Philipps-Universität Marburg, Hans-Meerwein-Straße, D-3550 Marburg Herrn Prof. Dr. Klaus Hafner zum 60. Geburtstag gewidmet Z. Naturforsch. 43b, 275—279 (1988); eingegangen am 6. November/8. Dezember 1987 Stable 1,2-Dihydroborete, Crystal Structure Trapping of methyleneborane 7a with 3-hexine yields the stable 1,2-dihydroborete l a . Strong folding (148.8°) along the 1,3-diagonal. the short 1.3-distance (191.5 pm), a lengthened 3,4- and a shortened 1,4-bond prove the homoborirene nature of l a . ionische, 1 der einfachste und einzige [4] neutrale Homoaromat. Während die 1,3-Wechselwirkung in Homocyclopropenylium-Ionen sowohl NMR-spektroskopisch [2, 3] als auch röntgenographisch [5, 6] bewiesen ist, konnten an Homoborirenen bisher nur NMR-Untersuchungen durchgeführt werden. Die beschriebenen Homoborirene des Typs 5 [1] sind — wohl wegen der starken Spannung durch den spirocyclisch ange- 1,2-Dihydroborete (1) [1] sind isoelektronisch mit Cyclobutenylium-Ionen (2) [2, 3]. Beide zeichnen sich durch starke 1,3-Wechselwirkung entsprechend den Grenzformeln C aus. Die Ähnlichkeit der Elektronenstrukturen von 2 bzw. 1 mit Cyclopropenylium-Ionen (4) bzw. Borirenen (3) wird durch die Bezeichnungen Homocyclopropenylium-Ion [3] für 2 bzw. Homoboriren [1] für 1 zum Ausdruck gebracht. 2 ist der einfachste kat- — C I I C — — " C—B^ I II =C C—C A B ~ —C—B6 l / l £ C — A / — I / —c—C I II / g - c \ B \ —B I I C=C / \ 5 Ä /C^C C 1 I / —c—c® I I /c==c\ B — I / —Ic—-c l / l / c " g x 3 I c /©\ c knüpften Dreiring — thermisch sehr instabil. Sie konnten nicht in Form von Einkristallen erhalten werden, die für eine Röntgenstrukturanalyse geeignet sind. Wir berichten hier über die Synthese des stabilen Homoborirens l a und seine Kristallstruktur. Synthese * Sonderdruckanforderungen an Prof. Dr. A. Berndt. Verlag der Zeitschrift für Naturforschung, D-7400 Tübingen 0932 - 0776/88/0300 - 0261 /$ 01.00/0 1,2-Dihydroborete sind durch [2+2]-Cycloaddition von Methylenboranen an Alkine zugänglich [1, 7]. Die im folgenden beschriebene Erzeugung des Dieses Werk wurde im Jahr 2013 vom Verlag Zeitschrift für Naturforschung in Zusammenarbeit mit der Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. digitalisiert und unter folgender Lizenz veröffentlicht: Creative Commons Namensnennung-Keine Bearbeitung 3.0 Deutschland Lizenz. This work has been digitalized and published in 2013 by Verlag Zeitschrift für Naturforschung in cooperation with the Max Planck Society for the Advancement of Science under a Creative Commons Attribution-NoDerivs 3.0 Germany License. Zum 01.01.2015 ist eine Anpassung der Lizenzbedingungen (Entfall der Creative Commons Lizenzbedingung „Keine Bearbeitung“) beabsichtigt, um eine Nachnutzung auch im Rahmen zukünftiger wissenschaftlicher Nutzungsformen zu ermöglichen. On 01.01.2015 it is planned to change the License Conditions (the removal of the Creative Commons License condition “no derivative works”). This is to allow reuse in the area of future scientific usage. 276 Ch. Pues et al. • Struktur eines Homoborirens OA O H j e . Tab. I. Ausgewählte Bindungslängen in pm und Bindungswinkel in Grad (mit Standardabweichung). Cl LiX - Li Cl HX ,C=B-R 6a 7a,b Et-CEC-Et / —B 8a Et 1a B - C2 B - C4 C2 — C3 C3 — C4 C3 - B 163.6(4) 152.7(4) 153.1(5) 137.4(5) 191.5(4) B-C10 C2-C21 C2-C212 C3-C31 C4-C41 C2 - B - C 4 B - C2-C3 C2 - C 3 - C 4 B - C4-C3 C2 - B - C 1 0 C4 - B - C 1 0 B - C10—C15 B - C10-C11 B - C2-C212 B - C2-C21 91.1(4) 74,3(4) 102.0(5) 82,5(5) 132.2(4) 135.0(5) 122,8(4) 120.0(4) 121,1(4) 121.1(4) C2-C3-C31 125,1(5) C31-C3-C4 132.9(6) B-C4-C41 143.8(7) C3-C4-C41 130,4(7) Winkel Ebene/Bindung: B . C3. C4/C4--C41 13,0 C2.C3.C4/C3 -C31 2.0 C2. B, C4/B- C10 9.9 Faltungswinkel C3.C4.B/C3.C2.B 148.8 154,9(4) 148.3(4) 150,6(5) 147,8(5) 149,6(6) Et a: R — Mesityl: b: R = 2,2.6.6-Tetramethylpiperidinyl. Methylenborans 7 a entspricht der Nöthschen Synthese des stabilen Methylenborans 7b [8]. Fluorenylnatrium [9] reagiert mit Mesityldichlorboran in Pentan bei 0 °C zum Fluorenylmesitylchlorboran 6 a, das in Toluol bei —78 °C in Gegenwart von 3-Hexin mit der äquivalenten Menge Lithium-ter/-butyl(trimethylsilyl)amid das 1,2-Dihydroboret l a ergibt. Das als Primärprodukt zu erwartende Methylenboran 7 a konnten wir spektroskopisch auch bei —40 °C nicht nachweisen; in Abwesenheit von 3-Hexin reagiert es mit dem bei seiner Bildung entstehenden tert-Butyl(trimethylsilyl)amin zum Addukt 8a. Die Struktur der Produkte l a , 6a und 8a folgt aus l U-, 13C- und n B-NMR-Spektren. Wie in den gespannten Homoborirenen 5 gibt sich die 1,3-Wechselwirkung auch in 1 a in der Abschirmung des Boratoms ((3"B = 44 ppm) und der Entschirmung des C4-Atoms (<3I3C = 179,5 ppm) zu erkennen. Kristallstruktur Die wichtigsten Bindungslängen und -winkel finden sich in Tab. I. Die Projektion eines Moleküls ist in Abb. 1 gezeichnet. Der Faltungswinkel des 1.2-Dihydroboretrings in l a an der B--C3-Achse ähnelt mit 148.8° dem der Abb. 1. ORTEP-Zeichnung [13] eines Moleküls von l a im Kristall. Die Schwingungsellipsoide geben 50% Aufenthaltswahrscheinlichkeit wieder. Projektion etwa auf die Ebene C2. C4, CIO. Homocyclopropenyliumionen 2a (148.5°) [4], 2b (142,7°) [5] und 2c (143,6°) [5], Eindrucksvoll ist ein Vergleich der Abstände in l a mit entsprechenden in Sieberts [14] planarem 1,2Dihydro-l,2-diboret 9 ohne 1,3-Wechselwirkung. Der C3 —C4-Abstand in l a ist mit 137,4 pm gegenüber dem der C=C-Doppelbindung in 9 (131 pm) um 6,4 pm verlängert, der B —C4-Abstand mit 152,7 pm gegenüber dem einer B —C-Einfachbindung (158 pm in 9) um 5,3 pm verkürzt. Dies sind die entsprechend Grenzformel B zu erwartenden Abstandsänderungen. Der B1 —C3-Diagonalab- 277 Ch. Pues et al. • Struktur eines Homoborirens (s, 3 H , p-CH,), 2,01 (s, 6 H , o-CH,). - 13 C-NMR ( - 3 6 °C): ö = 142,7, 141,1, 139,2 (s, arom. C), 137,8 (br. s, I C , BC (sp 2 )), 137,1 (s, arom. C), 127,7, 126,5, 125,2, 119,9 (d, arom. C), 52,0 (br. d, I C . BCH), 22,1 (q, 2 C , o-CH,), 21,2 (q, l C , / ? - C H , ) . " B - N M R : ö = 77. tBu-—<<iit\l tBu 2a 2b R:H 2c R:OH \ 2. Darstellung von l-Mesityl-2,2-(9-ßuorenyliden)3,4-diethyl-l,2-dihydroboret (la) / "N(i Pr)- 1a stand, auf den sich die 1,3-Wechselwirkung (Grenzformel C) naturgemäß am stärksten auswirkt, ist in l a mit 191,5 pm um 27,5 pm kürzer als in 9. Der Diagonalabstand C2---C4 in l a beträgt dagegen 225,9(6) pm, der Faltungswinkel an dieser Achse ist 143.4°. Auch in den Homocyclopropenyliumionen 2a bis 2c ist der 1,3-Abstand erheblich (19,9 bis 25,7 pm) kürzer als in einem Cyclobutenyliumion ohne 1,3-Wechselwirkung [15]. Die Geometrie von 1 a bestätigt also die Homoborirenstruktur von 1,2-Dihydroboreten. Die gute Übereinstimmung der Winkel und Abstände mit den für das unsubstituierte 1,2-Dihydroboret berechneten [16] Daten (Faltungswinkel an der B 1--C3-Achse 152°, C 3 - C 4 : 135 pm, C 4 - B : 151 pm, B 1 - C 3 : 190 pm) demonstriert die heute erreichte Qualität der Ergebnisse quantenmechanischer Rechnungen. Experimentelles 1. Darstellung von 9-Fluorenyl-mesitylchlorboran (6a) Zu einer Suspension von 2,16 g (12 mmol) Fluorenylnatrium in 20 ml Pentan werden bei 0 °C unter Rühren 3,3 g (12 mmol) Mesityldichlorboran getropft. Nach dem Erwärmen auf R.T. wird ca. 14 h gerührt, NaCl mittels einer Umkehrfritte D 4 abgetrennt und das LM im Vakuum abgezogen. Fraktionierung des hellgelben, öligen Rückstands im Vakuum ergibt 6a als gelbes Öl mit Kp. = 180-200 °C/0,001 Torr, Ausbeute 2,0 g (53%). 'H-NMR (CDC1 3 ): <3 = 7,76-7,15 (m, 8 H , Fluorenyl), 6,71 (s, 2 H . m-H), 4,60 (s, 1H, BCH), 2,20 Zu einer Lösung von 1,89 g (5,73 mmol) 6a und 1,8 g (21,4 mmol) 3-Hexin in 5 ml Toluol tropft man bei —78 °C innerhalb von 20 min eine Lösung von 5,73 mmol Lithium-rm-butyl(trimethylsilyl)arnid in 5 ml Toluol. Nach 14 h bei - 4 0 °C und 3 h Rühren bei R.T. werden alle flüchtigen Bestandteile im Vakuum abgezogen. Der gelb-orange, ölige Rückstand wird aus 2 ml Toluol bei —40 °C umkristallisiert. Hellgelbe Kristalle, Fp. = 114 °C, Ausb. 1,23 g (57%). 'H-NMR (CDC1,): = 7 , 8 0 - 7 , 0 0 (m, 8 H , Fluorenyl), 6,54 (s, 2 H , m-H), 2,65, 2,26 (q, je 2 H , CH 2 ), 2,06 (s, 3 H , p-CH,), 1,75 (s, 6 H , o-CH,), 1,22, 0,54 (t, je 3 H , CH?—CH,). - 13 C-NMR ( - 3 2 °C): (3 = 179,5 (br. s, I C , C = C - B ) , 155,6 (s, I C , C = C - B ) , 149,0, 141,3, 139,1, 138,2 (s, arom. C), 131,7 (br. s, I C , BC(sp 2 )), 127,1, 126,1, 125,2, 121,7, 119,7 (d, arom. C), 63,7 (br. s, I C , BC(sp 3 )), 22,6 (q, 2C, o-CH,), 22,1 (t, 2C, CH 2 ), 21,2 (q, I C , p-CU?), 14,9, 11,6 (q, je 1C, C H 2 - C H , ) ; bei R.T. findet man für die C-Atome der CH 2 -Gruppen 2 Signale (22,3 und 22,0). - " B - N M R : ö = 44. - MS (28 eV): m/z 376 (M + , 100%), 294 (M + -82, 34%), 256 (M + -120, 66%). 9-Fluorenyl-tert-butyl3. Darstellung des (trimethylsilyl)aminomesitylborans (8a) Zu einer Lösung von 2 g (6,06 mmol) 6a in 5 ml Toluol tropft man bei R.T. eine Lösung von 6,06 mmol Lithium-rerr-butyl(trimethylsilyl)amid in ca. 1 ml Toluol, wobei sofort Rotfärbung auftritt. Nach 14 h Rühren wird das LM im Vakuum abgezogen. Nach Abdestillieren flüchtiger Bestandteile bei 140-160 °C/0,001 Torr bleibt ein rotes, viskoses Öl zurück, aus dem aus Toluol/Pentan orangefarbenes 8a kristallisiert. Fp. = 114 °C, Ausb. 1,1 g (41%). 'H-NMR (CDC1,): ö = 7 , 8 2 - 7 , 1 1 (m, 8 H , Fluorenyl), 6,50 (s, 2 H , Mesityl), 5,31 (s, 1H, BCH), 2,14 (s, 3 H , ^-CH 3 ), 1,68 (s, 6 H , o-CH 3 ), 1,08 (s, 9 H , rBu), - 0 , 2 0 (s, 9 H , SiMe 3 ). - 13 C-NMR ( - 4 0 °C): <3 = 148,4, 139,2, 137,8, 135,5, 126,4, 125,2, 124,3, 123,7, 119,2 (arom. C), 51,9 (s, I C , NC), 51,8 (br., I C , BCH), 31,9 (3C, rBu), 23,1 (2C, o-CH,), 21,1 ( l C , p - C H 3 ) , - 1 , 6 (3C, SiMe 3 ). - " B - N M R : ( 3 - 4 5 (in Toluol). Ch. Pues et al. • Struktur eines Homoborirens 278 Röntgenstrukturanalyse von la (C28H29B) bei —50 °C Ein gelber Kristall, ca. 0 . 4 x 0 , 4 x 0 . 3 mm, wurde auf einem Vierkreis-Diffraktometer ( C A D 4, EnrafNonius) vermessen (MoKa-Strahlung. Graphitmonochromator). Die gefundenen Auslöschungen für hkl: h+k =t= 2n und für hOl: l 4= 2n sind vereinbar mit den Raumgruppen C2/c und Cc, von denen sich letztere als richtig erwies. Die Gitterkonstanten wurden anhand der Beugungswinkel von 25 starken Reflexen mit hohem 0 zu a = 1065,6(3), b = 2230,7(6), c = 9417,7(2) Ä . ß = 93,98(15)° verfeinert; Z = 4, d c = 1,119 gern - 3 . Die Intensitäten von insgesamt 4268 Reflexen (0: 1 - 2 5 ° , Oktanten h, k, ±1 und wurden mit eu-scans über —h, —k, ± l ) (1,1+0,35 tg0)° - und jeweils zusätzlich 25% vor und nach einem Reflex zur Untergrundbestimmung — vermessen. Die variable Meßzeit betrug max. 20 s/Reflex. Nach Mittelung symmetrieäquivalenter Reflexe blieben 3929 unabhängige, von denen 3400 mit F 0 > 3 a ( F 0 ) verwandt wurden. Die Rechnungen erfolgten auf einer Sperry-1100/62-Anlage des H R Z Marburg im System STRUX [10], wobei die Lösung mit direkten Methoden (SHELXS-86 [11]) gelang. Die Verfeinerung erfolgte im Block-DiagonalmatrixVerfahren ( S H E L X 7 6 [12]). Für die schwereren Atome wurden anisotrope, für die B-Atome isotrope Temperaturfaktoren verwendet (277 Parameter). Obwohl alle H-Atome aufgrund einer Differenzfouriersynthese lokalisiert werden konnten, wurden sie. um die Zahl der Parameter zu verringern, auf ihren Bindungspartnern „reitend" mit einbezogen ( d ( C - H ) = 0,95 Ä). Unter Verwendung von Gewichten w = 1/O 2 (F 0 ) resultierten schließlich die Zuverlässigkeitsfaktoren R = 0,064 bzw. Rw = 0,063. Die größte Parameterverschiebung im letzten Zyklus betrug das 0,03-fache der Standardabweichung. Die Restmaxima bzw. -minima einer abschließend gerechneten Differenzfouriersynthese waren 0,42 bzw. - 0 , 4 7 e/Ä 3 . Die resultierenden Atomparameter sind in Tab. II zusammengestellt*. Tab. II. Atomkoordinaten und äquivalente isotrope Temperaturfaktoren für l a (B i q = 8.-r/3 11 i : B,,i a*a* a, • a.). i Atom B C10 Cll c m C12 C13 C131 C14 C15 C151 C2 C21 C22 C23 C24 C25 C26 C27 C28 C29 C210 C211 C212 C3 C31 C32 C4 C41 C42 X .2022 .3148(3) .3922(3) .3567(4) .5006(3) .5364(3) .6559(4) .4577(3) .3598(3) .2684(4) .0744(3) .0616(3) .0964(3) .0752(4) .0204(4) -.0156(3) .0040(3) -.0267(3) -.0877(4) -.1036(4) -.0603(4) -.0002(3) .0157(3) .0357(3) -.0921(4) -.1911(4) .1478(3) .1751(4) .1835(5) y .1331(2) .0977(1) .1242(1) .1844(2) .0970(2) .4090(2) .0121(2) .0139(2) .0401(1) .0058(2) .1602(1) .2252(1) .2752(2) .3317(2) .3400(2) .2910(2) .2337(1) .1751(1) .1582(2) .0991(2) .0553(2) .0710(2) .1309(1) .1394(1) .1199(2) .1659(2) .1420(2) .1351(2) .1962(3) 2 .2601 .2066(3) .1087(3) .0425(4) .0739(4) .1272(4) .0850(6) .2177(4) .2585(3) .3568(5) .1776(3) .1465(3) .2274(4) .1738(4) .0366(5) -.0461(4) .0074(3) -.0515(3) -.1826(4) -.2127(4) -.1168(4) .0138(4) .0451(3) .3232(3) -.3542(4) .3203(7) .4044(3) .5615(4) .6338(5) B ä q [Ä 2 ] 3.3(2) 3.1(1) 3.3(2) 4.3(2) 3.8(2) 4.1(2) 6.7(3) 4.2(2) 3.5(2) 5.6(2) 3.0(1) 3.1(1) 3,9(2) 4.6(2) 4,9(2) 4.2(2) 3,2(1) 3,3(2) 4.3(2) 4.8(2) 4.8(2) 3.9(2) 3.2(2) 3.4(1) 4.8(2) 8.1(3) 4.1(2) 5.7(2) 7,7(3) Diese Arbeit wurde von der Deutschen Forschungsgemeinschaft und vom Fonds der Chemischen Industrie unterstützt. * Weitere Einzelheiten zur Kristallstrukturuntersuchung können beim Fachinformationszentrum Energie, Physik. Mathematik GmbH, D-7514 Eggenstein-Leopoldshafen 2, unter Angabe der Hinterlegungsnummer CSD 52745, der Autoren und des Zeitschriftenzitats angefordert werden. [1] R. Wehrmann, H. Klusik und A. Berndt. Angew. Chem. 96, 369 (1984); Angew. Chem.. Int. Ed. Engl. 23, 369 (1984). [2] A. E. Lodder. J. W. Haan. L. J. M. Ven und H. M. Buck. Ree. Trav. Chim. Pays-Bas 92, 1040 (1973). [3] G. A. Olah. J. S. Staval. R. J. Spear und G. Liang. J. Am. Chem. Soc. 97, 5489 (1975): G. A. Olah. G. Liang. L. A. Paquette und W. P. Melega. J. Am. Chem. Soc. 98, 4327 (1976). [4] Eine Übersicht über cyclische Homokonjugation in neutralen organischen Molekülen gibt L. T. Scott. Pure Appl. Chem. 58, 105 (1982). [5] C. Krüger. P. J. Roberts, Y.-H. Tsay und J. B. Koster. J. Organomet. Chem. 78, 69 (1974). [6] G. Maier. R. Emrich. K.-D. Malsch. K.-A. Schneider, M. Nixdorf und H. Irngartinger. Chem. Ber. 118, 2798 (1985). [7] B. Glaser. P. E. Mayer. H. Nöth. W. Rattay und 279 Ch. Pues et al. • Struktur eines Homoborirens U. Wietelmann, Z. Naturforsch., im Druck. Wir danken Herrn Prof. Nöth für diese Vorabinformation. [8] B. Glaser und H. Nöth. Angew. Chem. 97, 424 (1985); Angew. Chem.. Int. Ed. Engl. 24, 416 (1985); B. Glaser und H. Nöth. Chem. Ber. 120, 345 (1987). [9] P. Binger, G. Benedikt, G. W. Rotermund und R. Köster, Liebigs Ann. Chem. 717, 21 (1968). [10] R. E. Schmidt, M. Birkhahn und W. Massa, S T R U X , Programmsystem zur Verarbeitung von Röntgendaten, Marburg (1980). [11] G. M. Sheldrick. SHELXS-86, Program for Crystal Structure Solution, Göttingen (1986). [12] G. M. Sheldrick, S H E L X 7 6 , Program for Crystal Structure Determination, Cambridge (1976). [13] C. K. Johnson. O R T E P , A Fortran Thermal Ellipsoid Plot Program for Crystal Structure Illustrations, Report ORNL-3794, Oak Ridge, Tennessee (1965). [14] M. Hildenbrand. H. Pritzkow und W. Siebert. Angew. Chem. 97, 769 (1985); Angew. Chem., Int. Ed. Engl. 24, 759 (1985). [15] E . Hey. F. Weller und K. Dehnicke. Z. Anorg. Allg. Chem." 502, 45 (1983). [16] D. Cremer, J. Gauß. P. v. R. Schleyer und P. H. M. Budzelaar, Angew. Chem. 96, 370 (1984); Angew. Chem., Int. Ed. Engl. 23, 370 (1984).