introduction and intended use
Werbung

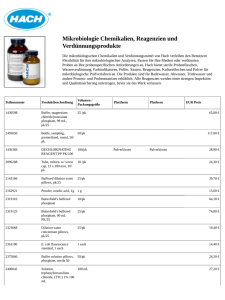
IMMUTREP TPHA Ref OD221/ OD071/ OD081 Treponema pallidum Hämagglutinationstest zur Serodiagnostik von Syphilis. Bei 2°C bis 8°C lagern. NICHT EINFRIEREN. Nur zur Verwendung für In-vitro-Diagnostik. EINLEITUNG UND VORGESEHENE VERWENDUNG Syphilis ist eine komplexe Erkrankung, die normalerweise sexuell übertragen wird. Der verursachende Organismus Treponema pallidum kann in konventionellem Labor-Kulturmedium oder in der Gewebekultur nicht gezüchtet werden. Eine Infektion wird normalerweise mittels Detektion von Antikörpern spezifisch für T. pallidum im Serum oder Liquor cerebrospinalis des Patienten diagnostiziert. Der Antikörper wird ungefähr 3 bis 4 Wochen nach Exposition detektierbar und kann lange Perioden nach der Behandlung auf detektierbarem Level verbleiben. 2 Gruppen von Antikörpern werden gebildet: Eine, welche mit den nichttreponemalen Antikörpern reagiert die in den VDRL/Carbon Antigen und RPR Tests verwendet werden, und die andere welche mit den spezifischen Antigenen von T. pallidum reagiert. Antikörper gegen nichttreponemale Antigene findet man (normalerweise) bei aktiver Erkrankung und die Spiegel sinken nach erfolgreicher Behandlung ab. Spezifische Antikörper bestehen lange nach erfolgreicher Behandlung weiter. Es ist notwendig auf beide Antikörpergruppen zu testen, weil die nichttreponemalen Antikörper sich auch aus anderen Gründen als einer Syphilis-Infektion erhöhen können. IMMUTREP TPHA ist ein spezifischer, sensitiver, passiver Hämagglutinationstest zur Detektion von Antikörpern gegen Treponema pallidum im Serum oder Liquor cerebrospinalis. Nur zum professionellen Gebrauch. TESTPRINZIP IMMUTREP TPHA beinhaltet T. pallidum sensitisierte, formolisierte Geflügel-Erythrozyten; unsensitisierte, formolisierte Geflügel-Erythrozyten, Verdünnungsmittel und Kontrollsera. Nach der Verdünnung werden positive Proben mit sensitisierten Erythrozyten gemischt, Antikörper gegen das sensitisierende Antigen verursachen eine Agglutination der Zellen. Die Zellen formen ein charakteristisches Zellmuster am Boden des Mikrotiterplatten-Näpfchens. Bei Abwesenheit von Antikörpern bilden Sie ein kompaktes Klümpchen in den Näpfchen. Dieser Test wurde kalibriert mit dem WHOReferenzserum für Serodiagnostiktests für treponemale Infektionen – REF 3-1980 +/- eine doppelte Verdünnung, um die korrekte Sensitivität sicherzustellen. INHALT Ref OD081 Ref OD071 Ref OD221 850 Test Cells 8.5ml 2x8.5ml 2x33ml T. pallidum Antigen beschichtete konservierte GeflügelErythrozyten (ca. 0.36% w/v) in Puffer. Arbeitskonzentration. Control Cells 8.5ml 2x8.5ml 2x33ml Konservierte Geflügel-Erythrozyten (ca. 0.36% w/v) in Puffer. Arbeitskonzentration. DIL 20ml 2x20ml 3x57ml Verdünnungsmittel. Ausgewähltes Hasenserum (ca. 0.4%) in Puffer. Arbeitskonzentration. Control + 1ml 1ml 9ml Positivkontrolle. Serum vorverdünnt (1/20) in Puffer mit Antikörpern gegen T. pallidum. Arbeitskonzentration. Control – 1ml 1ml 9ml Negativkontrolle. Serum vorverdünnt (1/20) in Puffer ohne Antikörper gegen T. pallidum. Arbeitskonzentration. ZELLTROPFER 2 2 2 GEBRAUCHSANWEISUNG 1 1 1 BENÖTIGTE, NICHT BEREITGESTELLTE MATERIALIEN Dynex M24A U-Well Mikrotiterplatten werden empfohlen. Mikrotitrationstropfer zur Abgabe von 25µl oder Mikropipetten zur Abgabe von 10, 25, 75, 100 und 190 µl-Volumen. Merke: 75 µl-Tropfer passen nicht und werden nicht bereitgestellt für Flaschen im 850 Test Kit. VORSICHTSMAßNAHMEN IMMUTREP TPHA Reagenzien enthalten Material menschlichen Ursprungs und wurden getestet und als negativ bestätigt für HCV-, HIV I- und HIV II-Antikörper und HBsAg mittels anerkannter Methoden auf Einzelspenderlevel. Da kein Test vollständige Sicherheit bieten kann, dass Produkte aus humaner Quelle keine infektiösen Agenzien übertragen, wird empfohlen, dass die Reagenzien dieses Kits mit gebotener Vorsicht und Aufmerksamkeit während Verwendung und Entsorgung gehandhabt werden. Alle Reagenzien sollten trotz allem als potentielle Biogefahren bei Verwendung und Entsorgung behandelt werden. Nicht einnehmen. IMMUTREP TPHA Reagenzien enthalten keine gefährlichen Substanzen gemäß Definition der gültigen UK-Chemikalienverordnungen (Gefahreninformation und Lieferverpackung). Alle Reagenzien sollen dennoch als potentielle Biogefahren bei Verwendung und Entsorgung behandelt werden. Die endgültige Entsorgung muss der lokalen Gesetzgebung entsprechen. IMMUTREP TPHA Reagenzien enthalten 0,095% Natriumazid als Konservierungsmittel welches bei Einnahme toxisch sein kann. Natriumazid kann mit Blei und Kupferrohren unter Bildung hochexplosiver Salze reagieren. Bei der Entsorgung mit großen Wassermengen spülen. LAGERUNG Die Reagenzien müssen aufrecht bei Temperaturen zwischen 2°C und 8°C gelagert werden. Der Kit funktioniert gemäß Spezifizierung bis zum angegebenen Ablaufdatum wie vom Produktionsdatum bestimmt und am Kit und den Komponenten angegeben. Das Ablaufdatum ist der letzte Tag des Monats der auf der Flasche und der Kit-Etikette angegeben ist. Reagenzien nach dem Ablaufdatum nicht mehr verwenden. Es sollte vermieden werden, die Reagenzien übermäßigen Temperaturen auszusetzen. Nicht direktem Sonnenlicht aussetzen. KEINES DER REAGENZIEN EINFRIEREN, da dies irreversiblen Schaden verursacht. PROBENSAMMLUNG UND VORBEREITUNG Dem Patienten eine Probe venösen Blutes entnehmen, Gerinnselbildung und Zusammenziehen ermöglichen. Geronnene Blutprobe zentrifugieren und klares Serum entnehmen. Es werden frische Serumproben benötigt. Liquor cerebrospinalis wird dem Patienten entnommen. Keine hämolysierten, kontaminierten oder lipämischen Proben zur Testung verwenden, da dies die Ergebnisse nachteilig beeinflusst. Die Proben können bei 2°C bis 8°C für bis zu 48 Stunden vor der Testung gelagert werden. Wenn eine längere Lagerung notwendig ist, bei -20°C bis zu 1 Jahr lagern. Aufgetaute Proben müssen vor der Testung gemischt werden. Die Proben nicht wiederholt einfrieren und auftauen, da dies falsche Ergebnisse bedingt. REAGENZIENVORBEREITUNG Alle Reagenzien sollen vor Gebrauch auf Raumtemperatur (20°C bis 25°C) gebracht und völlig resuspendiert werden. Kein Schäumen verursachen. Die Zelltropfer werden zur Verwendung mit den Testund Kontrollzellsuspensionen bereitgestellt. Diese Tropfer geben 75µl Tropfen ab und sollten auf die entsprechenden Verdünnungen wie folgt platziert werden: Roter Tropfer – Testzellen Weißer Tropfer – Kontrollzellen VERWENDUNGSEINSCHRÄNKUNGEN Die Verwendung anderer Proben als Serum oder Liquor cerebrospinalis wurde in diesem Test nicht validiert. Kein serologischer Hämagglutinationstest kann unterscheiden zwischen Antikörpern, die durch eine T. pallidum Infektion hervorgerufen werden, und Antikörpern, die durch eine Infektion mit anderen pathogenen Treponemas, z. B. T. pertenue und T. carateum hervorgerufen werden. Es wurden keine anderen beeinflussenden Faktoren spezifisch identifiziert; dennoch sollten positive Ergebnisse z. B. mittels FTA-Antikörper bestätigt und durch klinische Beobachtungen vervollständigt werden. Es gibt kein Wiederverwendungsprotokoll für dieses Produkt. Ein schwaches oder verdächtig positives Resultat sollte nochmals beurteilt werden. Die Diagnose sollte nicht nur auf Basis von Beobachtungen eines klinischen Tests gestellt werden. Es wird angeraten bei der Interpretation des Tests alle klinischen Daten miteinzubeziehen. Der Test kann auch bei früher aktiver Syphilis oder später latenter Syphilis negativ sein. Um das Profil der Resultate zur Unterstützung des Arztes zu komplettieren, wird auch empfohlen, den VDRL/Carbon Antigen oder RPR Test bei der Patientenprobe anzuwenden, da diese Tests eine aktive Syphilis detektieren. OMEGA’s IMMUTREP VDRL, IMMUTREP CARBON ANTIGEN and IMMUTREP RPR sind für diesen Zweck erhältlich. TESTPROZEDUR Proben und Reagenzien vor der Verwendung auf Raumtemperatur bringen und sicherstellen, dass die Proben und alle Reagenzien gänzlich resuspendiert sind. Die Proben benötigen keine Vorbehandlung. ERGEBNISSE UND INTERPRETATION Kit Kontrollen oder Proben mit bekannten Levels sollten bei jedem Test getestet werden. Die Kit Negativkontrolle sollte nach 45 Minuten ein negatives Ergebnis zeigen. Die Kit Positivkontrolle sollte nach 45 Minuten ein positives Ergebnis zeigen. Wenn die Levels der Kontrollen oder bekannter Proben nicht die erwarteten Ergebnisse zeigen, müssen die Testresultate als ungültig angesehen werden. SCREENINGPROZEDUR Agglutinierte Zellen bilden einen gleichmäßigen Belag auf dem Boden des Näpfchens. Nichtagglutinierte Zellen formen ein kompaktes Klümpchen in der Mitte des Näpfchens. Schwach agglutinierte Zellen bilden ein charakteristisches Ringmuster. Agglutination der Testzellen aber nicht der Kontrollzellen zeigt die Anwesenheit von spezifischen Antikörpern gegen T. pallidum an. Abwesenheit einer Agglutination zeigt, dass der Level der Antikörper unter dem Detektionslimit des Systems liegt. Das Kontrollzellmuster nicht als ein Anzeichen für ein negatives Ergebnis ansehen, da diese ein kompakteres Zellklümpchen bilden. Agglutination sowohl der Kontrollzellen als auch der Testzellen zeigt die Anwesenheit von Anti-Zell-Antikörpern an. In diesem Fall ist der Test nicht gültig und sollte wiederholt werden. Sollte der Test ungültig sein, sollte der Test wiederholt werden nachdem davor eine Absorption des Testserums durchgeführt wurde. Um dies zu erreichen, das Testserum 1/4 mit Kontrollzellen verdünnen und bei Raumtemperatur 45-60 Minuten stehen lassen. Nach Zentrifugation der Probe (10000rpm/5 min) den Überstand 1/5 in Verdünnungsmittel verdünnen. Diese Verdünnung direkt ohne weitere Verdünnung testen unter Verwendung von Test- und Kontrollzellsuspensionen. Ein bestätigender FTA ABS Test wird ebenfalls empfohlen. Quantitative Prozedur: QUALITATIVE (SCREENING) PROZEDUR Der Titer entspricht der höchsten Verdünnung die Agglutination zeigt. Das reaktive Für jeden Test werden 4 Näpfchen einer Mikrotiterplatte benötigt. Kontrollserum sollte einen Titer innerhalb einer Verdoppelungsverdünnung von 1. Verdünnungsmittel wie folgt in die Mikrotiterplatte verteilen: 1/2560 zeigen. Die Anfangsverdünnung der quantitativen Prozedur ist 1/80. Titer von 1/164000 wurden mit IMMUTREP TPHA detektiert ohne Prozone- (Hook-) 25l in die Reihen 1,3 & 4 und 100l in die Reihe 2. Effekt. 2. 25l jeder Probe in ein Näpfchen in Reihe 1 verteilen. FINDEN UND BESEITIGEN VON STÖRUNGEN ODER PROBLEMEN Gut mischen und 25l aus Reihe 1 in Reihe 2 transferieren. Hämagglutinationstests sind empfindlich gegenüber den Auswirkungen von Hitz, Gut mischen und 25l aus Reihe 2 in Reihe 3 transferieren. direktem Sonnenlicht und Vibration. Von entsprechenden Quellen fernhalten Gut mischen und 25l aus Reihe 3 verwerfen. während der Testinkubationsperioden. 25µl von Reihe 2 in Reihe 4 transferieren. Proben oder Reagenzien dürfen nicht mit Speichel kontaminiert werden, da dies Gut mischen und 25µl von Reihe 4 verwerfen. fehlerhafte Ergebnisse verursacht. 3. 75l gut gemischter Kontrollzellen zu Reihe 3 hinzufügen. Für jede Probe eine eigene Wegwerfspitze verwenden, um Kreuzkontamination zu 4. 75l gut gemischter Testzellen zu Reihe 4 hinzufügen. vermeiden. Zum Mischen behutsam auf die Platte klopfen. Alle Reagenzien sofort nach Verwendung wieder verschließen. Die endgültige Verdünnung in Reihe 3 und 4 ist 1/80. Das Reagenz nicht an der Seite des Näpfchens herunter rinnen lassen. Vor Beginn 5. Zudecken und bei Raumtemperatur 45 bis 60 Minuten stehen lassen der Untersuchung alle Reagenzien auf Raumtemperatur bringen (20°C bis 25°C). (alternativ können die Platten über Nacht stehen gelassen werden). Alle Reagenzien behutsam mischen durch vorsichtiges Umdrehen oder 6. Auf Agglutinationsmuster untersuchen. Umherwirbeln. Merke: Die Kitkontrollen sind vorverdünnt und sollen direkt in einzelne Näpfchen der Zur Verwendung durch Personen mit zumindest einem Minimum an grundlegender Reihe 3 und 4 gefügt werden (kein Verdünnungsmittel notwendig). Laborausbildung. Beschädigte oder kontaminierte Komponenten des Kits nicht verwenden. ALTERNATIVES EIN-NÄPFCHEN VERDÜNNUNGSPROTOKOLL ZUM SCREENING Komponenten des Kits passen zueinander und sollten nicht ausgetauscht werden. 1. 190l des Verdünnungsmittels in Reihe 1 verteilen. 2. 10l der Probe zu Reihe 1 fügen und mischen. EVALUIERUNGSDATEN 3. 150l aus Reihe 1 verwerfen. Proben wurden an einem Europäischen Referenzzentrum getestet. Diese Proben 4. 25l von Reihe 1 zu Reihe 2 hinzufügen. stammen von Pränatalkliniken und öffentlichen Gesundheitslabors. 5. 75l gut gemischter Testzellen zu Reihe 1 hinzufügen. Positive Negative gesamt 75l gut gemischte Kontrollzellen zu Reihe 2 hinzufügen. Proben Proben Zum Mischen behutsam auf die Platte klopfen. Syphilis 203 3 206 Die endgültige Verdünnung in den Näpfchen der Reihen 1und 2 ist 1/80. positiv 6. Zudecken und bei Raumtemperatur 45 bis 60 Minuten stehen lassen Syphilis 3 669 672 (alternativ können die Platten über Nacht stehen gelassen werden). negativ 7. Auf Agglutinationsmuster untersuchen 206 672 878 Diese Studie zeigt:: Eine Sensitivität von 98,5% QUANTITATIVE PROZEDUR Eine Spezifität von 99,6% Wenn beabsichtigt wird positive Ergebnisse routinemäßig zu quantifizieren, kann die Die Reproduzierbarkeit vom IMMUTREP TPHA ist 100% (+/- eine verdoppelte Screening Prozedur durch Weglassen der Kontrollzellen und Bereitung nur einer Verdünnung) endgültigen Verdünnung modifiziert werden. REFERENZLISTE 1. Verdünnungen in einer Mikrotiterplatte wie folgt bereiten: 1. Tomizawa, T.and Kasamatsu, S. Jap. J. Med. Sci. Biol. 19,305 (1966). Für jede Probe 25l Verdünnungsmittel in jedes Näpfchen einer Säule der Platte 2. Rathlev, T., Brit. J. Vener. Dis., 43,181 (1967). verteilen. Zur Titration der Kontrollen sollte die Verteilung ab Reihe 3 beginnen. 3. Tringali, G., Ann. Sc. Pav., 12,311 (1970). 25l von Reihe 2 der ursprünglichen Screeningplatte zur Reihe 1 der 4. Uete, T., Fukazawa., S., Ogi. K. and Takeuchi, Y., Brit., J. Vener. Dis., Quantifizierungsplatte transferieren. 47,73 (1971) Mischen und 25l verwerfen. 5. Garner, M.F., Backhouse, J. L, Daskalopoulos, G. and Walsh, J.L., 25l von Reihe 2 der ursprünglichen Screeningplatte zur Reihe 2 der 48,474 (1972) Quantifizierungsplatte transferieren. 6. Johnston, N.A., Brit. J. Vener. Dis. 1972, 48,474 (1972) 25l verdoppelnde Verdünnungen von Reihe 2 bis Reihe 8 bereiten (für die 7. Sequeira, P.J.L. and Eldridge, A. E., Brit. J. Vener. Dis. 43,242 (1973 ) Kontrollen sollen die Verdoppelungsverdünnungen ab Reihe 3 beginnen). 8. Lensinski, J., Krach, J. and Kadziewics, E., Brit. J. Vener. Dis. 50, 33 2. 75l gut gemischter Kontrollzellen zu Reihe 1 hinzufügen. (1974) 9. O’Neill, P., Warner, R.W. and Nicol, C.S., Brit. J.Vener. Dis. 49,427 (1973) 3. 75l gut gemischter Testzellen zu den Reihen 2 bis 8 hinzufügen. 4. Zum Mischen behutsam auf die Platte klopfen. 10. Young, H., Henrischen, C. and Robertson, D.H.H., Brit. J. Vener. Dis. Die endgültige Verdünnung in Reihe 1 und Reihe 2 ist 1/80. 50,341 (1975) 5. Zudecken und bei Raumtemperatur 45 bis 60 Minuten stehen lassen 8010 ISSUE 5A Revised May 2015. GERMAN (oder über Nacht). Omega Diagnostics Ltd 2015. Merke: Die Kit Kontrollen sind vorverdünnt und 25l sollten direkt in einzelne Näpfchen in den Reihen 1, 2 und 3 gefügt werden mit verdoppelnden Verdünnungen beginnend ab Reihe 3 (kein Verdünnungsmittel notwendig in Reihe 1 und Reihe 2). OMEGA DIAGNOSTICS LTD Omega House, Hillfoots Business Village Alva, FK12 5DQ, Scotland, United Kingdom [email protected] www.omegadiagnostics.com AN ISO 9001 & 13485 CERTIFIED COMPANY