Metallkomplexe mit biologisch wichtigen Liganden, LXXIV [1
Werbung

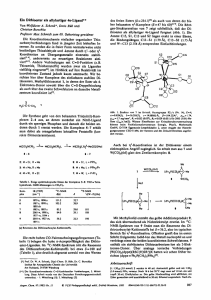
Metallkomplexe mit biologisch wichtigen Liganden, LXXIV [1] Metallorganische Verbindungen von 2-(3-Thienyl)glycin und dessen Derivaten M etal C om plexes with Biologically Im portant Ligands, LX X IV [1] O rganom etallic C om pounds of 2-(3-Thienyl)glycine and D erivatives th ereo f E lfriede Schuhm ann, C hristian Robl [2], Wolfgang Beck* Institut für Anorganische Chemie der Ludwig-Maximilians-Universität, Meiserstraße 1, D-80333 München Herrn Professor Dr. H elmut Schönenberger zum 70. Geburtstag gewidmet Z. Naturforsch. 49b, 1569-1579 (1994) eingegangen am 10. Juni 1994 2-(3-Thienyl)glycine, Titanocene, Molybdenum, Ruthenium, Rhodium N,0-Chelate complexes of R,S-2-(3-thienyl)glycinate (L) have been obtained: ML2 (M = Ni, Cu), (rt-Bu3P)(Cl)M(L) (M = Pd, Pt), (//3-C3Hs)Pd(L), C6H4CH2NMe2Pd(L), (?76-p-cymene)(Cl)Ru(L), (^ -C 5Me5)(Cl)M(L) (M = Rh, Ir) and (//5-C5H3)(OC)2Mo(L). The methyl ester of R,S-2-(3-thienyl)glycine (L') forms the complexes trans-CUPdL'2, cisCl2Pt(L')2, (n-Bu3P)(Cl2)M(L') (M = Pd. Pt) and (?/5-C5Me5)(Cl)2M(L') (M = Rh, Ir) in which the ligand L' is coordinated through the amino group. The structures of (?73-C3H5)Pd(L) and of (^:’-C5Me5)(Cl2)Ir(L') have been determined by X-ray diffraction. NBenzoyl-2-(3-thienylglycine methyl ester reacts with Cr(CO)6 to yield a tricarbonyl complex with an >/6-coordinated phenyl group. N-Benzoyl-R,S-2-(3-thienyl)glycinate (L") and (^5C5H5)2TiCl2 give the diastereoisomers [(/;5-C5H 5)2Ti(R-L'')(R-L")2/(?;5-C5H5)2Ti(S-L") (S-L")] and (?75-C5H5)2Ti(R-L")(S-L") with Ti-O-bonds. Einleitung M etallorganische V erbindungen finden als M ar­ ker von B iom olekülen zunehm endes Interesse [3], da sie gute spektroskopische S onden besitzen (z. B. C O -IR -A b s o rp tio n e n von M etallcarbonylfragm enten). M etallorganische K om plexe von a-A m inosäuren und P eptiden w urden in d e r letzten Z eit von Sheldrick [4], O ro [5], W erner et al. [6 a], G rotjahn [6 b] und von uns [7] untersucht. In F ortführung u n serer A rb e ite n [1, 7] setzten wir auch D ,L-2-(3-Thienyl)glycin 1 ein. Die nicht proteinogene a-A m in o säu re 1 w urde in Penicilline und C ephalosporine eingeführt [8]. D erivate von 1 w irken kram pflösend [9] und ein dem Süßstoff A spartam analoges D ipeptid m it 1 besitzt eb en ­ falls eine hohe Süßkraft [10]. Ergebnisse und Diskussion 1. C helatkom plexe Die U m setzung w äßriger N i(II)- und Cu(II)-hydroxid-Suspensionen m it 1 führt zu den N ,0-C he- * Sonderdruckanforderungen an Prof. W. Beck. 0932-0776/94/1100-1569 $06.00 lat-K om plexen 2 und 3. Bei d er U m setzung von 1 m it Pd(II)- und Platin(II)-Salzen scheidet sich nach kurzer Z eit Pd- bzw. Pt-M etall ab. Die Komplexe 4 - 1 1 sind in bew ährter Weise aus den chlorverbrückten K om plexen (h-B u3P)(C1)M(^-C1)2M (/i-Bu,P)(C1) (M = Pd, Pt), ( ^ - C 3H 5) P d ^ -C l)2P d ( ^ - C 3H 5), (C 6H 4C H 2N M e2)Pd(/i-C l)2P d(N M e2C6H 4), (?76-p-C ym ol)(C l)R u(//-C l)2Ru(?/6-/?-Cymol)(Cl) bzw. (/75-C5M e5)(C l)M (//-C l)2M(Cl)(?75-C5M e5) (M = Rh, Ir) und 1 u n ter B asenzusatz (K O H oder N aO M e) zugänglich. U n ter Substitution von C hlorid und C O en tsteh t aus (?75-C5H 5)M o (C O )3C1 und dem A nion von 1 der K om plex 11. Z u 4, 5 [11], 6 [12], 7 [12a, 13], 8 [7a, 14], 9, 10 [4, 5, 7 a] und 11 [15] analoge K om plexe sind mit an deren a-A m inosäuren bekannt. In den IR -Spektren (vgl. exp. Teil) von 1 - 1 1 ist die C arbonyl-A bsorption bei 1600-1640 cm ” 1 charakteristisch für N .O -gebundenes A m inocarboxylat. Die 31P- und I3C -N M R -Spektren von 4 und 5 belegen das Vorliegen von cis-trans-Isom eren. Bei 7 ist keine ds-rra/is-Isom erie zu erkennen. In den Kom plexen 8 - 1 1 ist das M etallatom stereogen; von 8 -1 1 entstehen daher jew eils zwei D iastereo- © 1994 Verlag der Zeitschrift für Naturforschung. All rights reserved. Dieses Werk wurde im Jahr 2013 vom Verlag Zeitschrift für Naturforschung in Zusammenarbeit mit der Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. digitalisiert und unter folgender Lizenz veröffentlicht: Creative Commons Namensnennung-Keine Bearbeitung 3.0 Deutschland Lizenz. This work has been digitalized and published in 2013 by Verlag Zeitschrift für Naturforschung in cooperation with the Max Planck Society for the Advancement of Science under a Creative Commons Attribution-NoDerivs 3.0 Germany License. Zum 01.01.2015 ist eine Anpassung der Lizenzbedingungen (Entfall der Creative Commons Lizenzbedingung „Keine Bearbeitung“) beabsichtigt, um eine Nachnutzung auch im Rahmen zukünftiger wissenschaftlicher Nutzungsformen zu ermöglichen. On 01.01.2015 it is planned to change the License Conditions (the removal of the Creative Commons License condition “no derivative works”). This is to allow reuse in the area of future scientific usage. 1570 E. Schuhmann et al. ■ M etallkomplexe mit biologisch wichtigen Liganden 2 M = Ni 3 M =C u n-Bu 3 P n -B u 3 P ^ (V S? \ / + e /V '- 'L M c / V \ . 4 M = Pd 5 M = Pt 1 0 M = Ir 11 m ere (als E n an tio m eren p aare). Das aus den In­ ten sitäten d er Cymol- o d er C^M es-'H -N M R-Signalen erm ittelte D iastereoisom eren-V erhältnis ist in Tab. I aufgeführt. Auch in den 13C-NM RS pektren von 8 - 1 1 wird ein d o p p elter Signalsatz b eobachtet. M öglicherw eise führt d er /?-Phenyleffekt [16] (O rien tieru n g des T hiophenrests zum Cymol- bzw. C5M e5-L iganden) zu einer A n reiche­ rung des E nan tio m eren p aares S m S c /R m R c - D as bei A llylkom plexen b ek an n te [12 a, 12 c] dynam i­ sche V erhalten w urde für 6 nicht näh er untersucht. Im Kristall von 6 liegen nach d er R öntgenstruk­ turanalyse beide E n an tio m ere im V erhältnis 1:1 vor. D er Allyl-Ligand steht ann äh ern d senkrecht E. Schuhmann et al. • Metallkomplexe mit biologisch wichtigen Liganden 1571 2. K om plexe m it N H 2-koordiniertem 2-(3-Thienyl)glycinm ethylester 02 Abb. 1. Struktur von 6 im Kristall. Ausgewählte Bin­ dungsabstände (pm) und -winkel (°): P d -O (l) 210,9(4), P d -N 213,9(6), P d -C (l) 207,1(9), Pd-C (2) 210,2(9), P d-C (3) 211,7(9). 0 ( 1 ) - P d - N 78,8(2), N -C (5 )-C (7 ) 111,7(5), 0 ( 1 ) - P d - C ( l) 170,5(3), 0 (1 )-P d -C (2 ) 137,1(3), N -P d -C (3 ) 172,6(3). zur O - P d - N - E b e n e . Die P d - O und P d -N -B in dungslängen [210,9(4) und 213,9(6) pm] stim m en m it den A b stän d en in vergleichbaren K om plexen [7 a] gut überein. nBu^ ^ C‘ Die V erbindungen 1 2 -1 7 entstehen durch U m ­ setzung des a-A m in o säu reesters mit PdCl42~, P tC l42- bzw. m it den chloroverbrückten K om ple­ xen («-Bu,P)(C1)M (^-C1),M (a7-Bu3P)(C1) (M = Pd, Pt), (^ 5-C5M e5)(C l)M (//-C l)2M (7 5-C5M e5)(Cl) (M = Rh, Ir). M it an d eren a-A m inosäureestern w urde eine R eihe solcher K om plexe beschrieben [7 b, 17], D ie K oordination der A m inogruppe wird durch die scharfen N H 2-B anden im IR -Spektrum belegt. Im IR -Spektrum von 12 w ird eine P d -C l-A b so rp tion (entsprechend einer ftwzs-Struktur, wie z. B. auch in rrans-Cl2P d (G ly O E t)2 [17b]), bei 13 w er­ den zw ei v P t-C l-B a n d e n (d s-S tru k tu r) beobach­ tet. D as d s-Iso m e re 13 en tsteh t wie m it anderen a-A m in o sä u re estern aus PtC l42- [17c,d] aufgrund des rrans-Effekts (C l“> A m in ). 'H 2 C O jC H 3 14 M = Pd 15 M = Pt 16 M = Rh 17 M = lr 1572 E. Schuhmann et al. ■ M etallkomplexe mit biologisch wichtigen Liganden 3. M etallorganische Komplexe m it N-geschiitztem 2-(3- Thienyl)glycin A rom atische a-A m inosäuren (z. B. P henylala­ nin) m it geschützten Carboxyl- und A m inogrup­ pen reagieren mit H exacarbonylchrom zu Tricarbonyl-K om plexen des Typs (O C )3Cr(776-C6H 5R ) [18]. D erivate des 2-(3-Thienyl)glycins sollten sich ü b er ihr heteroarom atisches ^-System ebenfalls an M etallcarbonylfragm ente koordinieren lassen (vgl. z. B. T ricarbonylthiophenchrom [19]). D ie U m setzung von N-Benzoyl-2-(3-thienyl)glycinm ethylester mit C r(C O )6 liefert den Komplex 18. D as IR -Spektrum von 18 zeigt im C arbonylbereich das zu erw artende M uster für ein neutrales C r(C O )3-Fragm ent. In den 1 3 C- und 1 H -N M R Spektren weisen die R esonanzsignale der Benzoylg ruppe eine große negative K oordinationsverAbb. 2. Struktur von 17 im Kristall. Ausgewählte Bin­ dungsabstände (pm) und -winkel (°): Ir -C l(l) 241,7(2), Ir-C l(2) 242,8(2), Ir-N 217,5(5), Ir -C (l) 214,1(6), Ir-C (2) 215,8(6), Ir-C (3) 215,2(7), Ir-C (4) 215,2(6), Ir-C (5) 214,6(7), C l(l)-Ir -C l(2 ) 87,2(1), C l( l)- I r -N 83,7(1), I r - N - C ( ll) 129,2(5). Cr(CO), 18 Tab. I. Diastomerenverhältnis der Verbindungen 9 -1 1 . Verb. DiastereoisomerenVerhältnis 8 9 10 11 60/40 75/25 55/45 74/26 Lösemittel CDC13 d6-DMSO d6-DMSO d6-DMSO D a d er a-A m in o säu reester als R acem at einge­ setzt wurde, erhält m an für 12 und 13 zwei D iastereoisom ere (Sc Sc /R c R c ur*d Sc R c /R c S o m eso-Form ). Im ' H -N M R -S p ektru m von 12 ist für alle R esonanzen ein d o p p elter Signalsatz zu erkennen. Die Röntgenstrukturanalyse von 17 zeigt eine O rientierung des T hiophenfragm ents zum C5M e5L iganden (/3-Phenyleffekt? [16]). Die I r -C l-A b stände in 17 en tsprechen d en B indungslängen in vergleichbaren Kom plexen. D ie Ir-N -B in d u n g [217,5(5) pm] ist im Vergleich zu a-A m in o carboxylat-C helatkom plexen etw as länger [7 a]. cp cD cp /°v. | c o II cp | ^ cp Enintiomarenpaar <?p c*— ^ccp 19b meso o„ E. Schuhmann et al. ■M etallkomplexe mit biologisch wichtigen Liganden 1573 Schiebung (H ochfeldverschiebung) auf; die Signale des T hiophenrestes bleiben nahezu u n verändert. D ie C r(C O )3-G ruppe ist folglich am Phenyl- und nicht am T hiophenrest gebunden. A ufrund d er cytostatischen E igenschaften von T itanocendichlorid [20] w urden zahlreiche M etallocene auf ihre A ntitu m o rak tiv ität untersucht. Es liegt nahe, T itanocendichlorid m it C arrier-L iganden wie A m inosäuren um zusetzen. Von B rintzinger [21 a] und C ardin et al. [21 b] w urden einige T itanocen-K om plexe m it zwei NA cyl-a-am inocarboxylat-L iganden beschrieben. C a rrah e r et al. b erichteten über Polym ere aus Ti­ tanocendichlorid, a-A m in o säu ren und P eptiden [26], [M e2N C H 2C6H 4PdCl]2 [27], (rj3C 3H 5)2Pd2Cl2 [28], (>75-C5H 5)M o (C O )3C1 [29] w urden wie in d er L iteratu r beschrieben erhalten. D ,L-2-(3-Thienyl)glycinm ethylester [30], N-Benzoyl-D ,L-2(3-Thienyl)glycin [31] und dessen M e­ thylester [32] w urden in A nlehnung an L iteratu r­ vorschriften hergestellt. D ie übrigen A usgangsver­ bindungen w urden im H andel bezogen. [21c]*. N -B enzoyl-D ,L-2-(3-thienyl)glycinm ethylester N -Benzoyl-D ,L-2-(3-thienyl)glycin setzt sich mit (775-C5H 5)2TiCl2 u n ter Z usatz von N E t3 zum K om ­ plex 19 um. Die K oordination der beiden C arbox ylat-G ruppen an das T itan-A tom wird durch die b reite v C 0 2-B ande bei 1642 cm -1 im IR -S p ektru m von 19 belegt [21a,b, 22]. Im 13C -N M R -Spektrum wird für alle R eso n an ­ zen ein d o p p elter Signalsatz gefunden. W ie zu e r­ w arten, liegen also die beiden D iastereoisom eren 19a (E nan tio m eren p aar) und 19b (M esoform ) vor. Im 'H -N M R -S p ek tru m von 19 erscheinen drei C 5H 5-Signale im Intensitätsverhältnis 1 :2 :1 . Die chiralen M oleküle des E n an tio m eren p aares besit­ zen eine C2-Achse, w odurch die beiden C5H 5G ru p p en hom otop w erden, d. h. sie besitzen die gleiche chem ische V erschiebung (6,28 ppm ). Die beiden C 5H 5-Liganden d er M esoform können durch keine Sym m etrieoperation in ein an d er ü b e r­ geführt w erden; sie sind dah er d iastereo to p und führen zu zwei R esonanzsignalen (6,20 und 6,37 ppm ). D ie Z uord n u n g der Signale w urde durch ein ’H -’3C -N M R -korreliertes Spektrum gesichert. A naloge stereochem ische B efunde wie für 19 w urden von L äp p ert [23 a], Szeimies und Tassoni [23 b] bei D icyclopentadienyl-M etallkom plexen m it zwei w eiteren chiralen L iganden gefunden. G old-K om plexe Ph3P A u 0 2C C H 2N H C 0 R m it k o ­ o rd in ierter C arboxylatgruppe w urden von Jones beschrieben [24]. IR (N ujol, c m - 1): 3305 (vN H ), 1740 ( v C 0 2), 1640 (vC O ). - 13C -N M R (67,9 M Hz, d6-DM SO, ppm ): 52,9 (a-C H , 171,2 ( C 0 2), 52,7 (C H 3), 136,5, 127,8, 126,9, 124,5 (C 4H 3S), 167,1 (C O ), 133,7, 132,0, 128,6, 128,0 (C 6H 5). - ‘H -N M R (270 M Hz, d6-DM SO, ppm ): 5,81 (d, a-C H ), 9,22 (d, N H , / h c n h = 7,32 H z), 7 ,2 -7 ,9 (C4H 3S, C6H 5), 3,71 (O C H 3). Spektroskopische Daten der Liganden D ,L-2-(3-Thienyl)glycin. 13C-N M R (67,9 MHz, D M SO, ppm ): 179,7 ( C 0 2), 58,0 (a-C H ), 145,0, 128,1, 127,1, 122,0 (C 4H 3S). - ’H -N M R (270 MHz, N a 0 D /D 20 , ppm ): 4,50 s. N -Benzoyl-D ,L-2-(3-thienyl)glycin IR (N ujol, c m - 1): 3354 (vN H ), 1730 ( v C 0 2), 1614 (vC O ), 1577 (ÖNH2). - 13C -N M R (67,9 M Hz, d6-A ceton, ppm ): 53,02 (a-C H ), 171,48 ( C 0 2), 137,65, 127,71, 126,61, 123,97 (C 4H 3S), 166,92 (C O ), 134,57, 131,95, 128,75, 127,96 (C 6H ,). - ’H -N M R (270 M Hz, d6-DM SO, ppm): 5,74 (d, a -C H ), 9,08 (d, N H , / H c n h = 7,81 Hz). N ,0-B is[D ,L-2-(3-thienyl)glycinato]nickel(II) (2) 0,50 m m ol (141 mg) N iS 0 4-7 H 20 w erden in 5 ml W asser gelöst und m it 1,00 mmol einer I N N a O H (1,0 ml) versetzt. D er en tstandene Nickel(II)hydroxid-N iederschlag wird abzentrifugiert und alkalifrei gew aschen. Nach Z ugabe von 1,00 m m ol (156 mg) D,L-2-(3-Thienyl)glycin wird 1 h bei 40 °C gerührt. B ereits nach kurzer Z eit läßt sich ein Farbum schlag von G rün nach Blau e rk en ­ nen. D er blaue N iederschlag wird abzentrifugiert und m it W asser, E th an o l und E th er gewaschen. IR (N ujol, cm “ ’): 3360, 3240, 3150 (vN H 2), 1595 ( v C 0 2). N ,0-B is[D ,L -2-(3-thienyl)glycinato]kupfer (II) (3) Experimenteller Teil Die A usgangsverbindungen (n B u 3P )2M 7Cl4 (M = Pd, Pt) [25], (775-C5M e5)2M 2Cl4 (M = _Rh~ Ir) E ine frisch hergestellte w äßrige Suspension von 0,50 m m ol (49 mg) K upfer(II)hydroxid wird mit 1,00 m m ol (156 mg) D,L-2-(3-Thienyl)glycin ver­ setzt. N ach 2 h R ü h ren bei 40 °C wird wie bei 2 1574 E. Schuhmann et al. ■ M etallkomplexe mit biologisch wichtigen Liganden M H z, d6-DM SO, ppm ): 178,9 ( C 0 2), 57,0 (a-C H ), 141,3, 127,3, 125,7, 122,0 (C 4H 3S), 111,8, 30,7 (allyl). - ’H -N M R (270 M Hz, C D 3OD. ppm): 4,71 (s, a -C H ), 5,49 (1 H , m, allyl), 3,96 (2 H. br, allyl), 2,90 (2 H. m, allyl). (Tributylphosphan)chloro[D ,L-2-(3-thienyl)7: IR (N ujol, c m " 1): 3230, 3120, 3095 (vN H 2), glycinato]palladium (Il) (4) und 1625 (vC O z), 1580 (ÖNH2). - 13C-N M R (67,9 ( Tributylphosphan)chloro [ D, L -2 M H z, d6-DM SO, ppm ): 176,9 ( C 0 2), 59,4 (a-C H ), (thienyl)glycinatoJplatin (II) (5) 141,0, 127,3, 125,4, 122,5 (C 4H 3S), 148,7, 145,7, 2,10 m m ol (328 mg) D ,L-2-(3-Thienyl)glycin 133,5, 124,2, 123,7, 121,5 (A rom at), 51,3, 51,2 und 2,42 m mol (136 mg) fein zerrieb en es K O H (N (C H 3)2), 27,5 (C H 2). - 'H -N M R (270 M Hz, d6w erden in 3 ml M ethanol gelöst und langsam zu D M SO ): 4,44 (dd, a-C H ), 4,55, 5,42 (br, N H ), 2,73, einer Lösung von 1,05 mmol M 2Cl4( P n - B u 3)2 2,74 (N (C H 3)2, 3,90 (C H 2). (M = Pd, Pt) in 10 ml D ichlorm ethan pipettiert. Es erfolgt sofort ein Farbum schlag. N ach 2 h R ü h ­ ren bei R.T. wird abzentrifugiert und das L ösungs­ Chlor o (rf-p-cym ol)[D , L-2-(3-thienyl)glycinato ]m ittel vollständig abgezogen. D er R ü ckstand wird anschließend m ehrm als mit E th er o d er P en tan di­ ruthenium (II) (8), Chloro(r]5-pentamethylcyclopentadienyl)[D ,L-2-(3-thienyl)glycinato]geriert. rh o d iu m (III) (9) und C hlo ro (rf -pentamethyl4: IR (Nujol, cm “ 1): 3250, 3200, 3110 (v N H 2), cyclopentadienyl)[D ,L-2-(3-thienyl)1635 ( v C 0 2), 1590 (<5NH2), 330, 310 (vPdC l). glycinato] iridium (III) (10) 31P-N M R (109,3 M H z, CDC13, ppm ): 28,90 ( P - N aufgearbeitet. - IR (Nujol, cm '): 3340. 3220, 3100 (vNH?), 1620 ( v C 0 2) 1565 (ÖNH2). cis), 27,78 ( P - N trans), cis/trans = 56/44. - 13CN M R (67,9 M Hz, CDC13, ppm ): 181,2 (d, C 0 2, cis, Jc p = 2,1 H z), 179,9 (s, C 0 2, trans), 57,5 (d, a -CH , trans, J Cp = 2,1 H 2), 59,7 (s, a -C H , cis), 1 3 8-122 (C 4H 3S). 5: IR (Nujol, cm “ 1: 3250, 3210, 3130 (v N H 2), 1645 ( v C 0 2), 1585 (<3NH2), 345 (vPtC l). - 31PN M R (109,3 M H z, C H 2C12, ppm ): -1 ,0 3 (7PtP = 3550 Hz, P - N cis), -5 ,8 9 ( P - N trans, 7 PtP = 3682 H z), cis/trans = 88/12). - 13C -N M R (67,9 M Hz, CDC13, ppm ): 183,2 (d, C 0 2, trans, J c p = 3,7 H z), 56,1 (d, a-C H , trans, JCP = 2,6 H z), 1 3 8-122 ( c 4h 3s ). (rj3-Allyl) [D ,L-2-(3-thienyl) glycinato]p a lladium (II) (6) u nd (N ,N -D im ethylbenzylam in2-C ,N )[D ,L-2-(3-thienyl)glycinato]palladium (II) (7) 0,55 mmol der ch lorverbrückten K om plexe (rj3A llyl)2P d2Cl2 bzw. (N ,N -D im ethylbenzylam in-2C ,N )2Pd2Cl2 w erden in 5 ml D ichlorm ethan gelöst. D azu wird langsam eine m ethanolische Lösung von 1,10 mmol (172 mg) D,L-2-(3-Thienyl)glycin und 1,30 mmol (72 mg) K O H getropft. N ach 2 h R ühren bei R.T. wird das L ösungsm ittelgem isch im V akuum en tfern t und der R ückstand zur E n t­ fernung des entstan d en en KCl m it W asser gew a­ schen. 6 kristallisiert in M ethanol m it farblosen L eisten aus; 7 wird m ehrm als m it M ethanol und E th e r gewaschen. 6: IR (Nujol. c m - 1): 3230, 3125, 3090 (vN H 2), 1620 (vC O z), 1570 (<5NH2). - 13C -N M R (67,9 E ine m ethanolische Lösung von 0,65 m m ol (102 mg) D,L-2-(3-Thienyl)glycin und 0,76 mm ol (42 mg) K O H wird zu 0,32 mmol der entsprechenden chlorverbrückten V erbindung in D ichlorm ethan getropft. M an läßt 3 h bei R.T. rühren und zen tri­ fugiert das en tstandene KCl ab. D as L ösungsm it­ telgem isch wird im V akuum abgezogen und der R ückstand m ehrm als m it E th er digeriert. 8: IR (N ujol, cm “ 1): 3280, 3213 (vN H 2), 1628 ( v C 0 2), 291, 280 (vR uC l). - 13C -N M R (67,9 M Hz, d6-D M SO , ppm ): 180,0/180,9 ( C 0 2), 56,2/55,7 (aC H ), 141,2/139,5, 128,0/127,9, 126,5/126,6, 124,5/ 124,0 (C 4H 3S), 18,5/18,4 (p-C H 3), 22,3/22,4, 22,9/ 22,8 (C H (C H 3)2), 31,3/31,2 (C H (C H 3)2). - ]HN M R (270 M Hz, CDC13, ppm): 4,43/4,30 (s, aC H ), 1,24/1,26, 1,25/1,27 (d, C H (C H 3)2), 2,08/2,13 (s, p -C H 3), 2,78 (m, C H ^ H ^ ) . 9: IR (K B r, cm “ 1): 3260, 3220, 3100 (vN H 2), 1635 (vC Ö 2), 1580 (ÖNH2), 280 (vRhCl). - 13CN M R (67,9 M Hz, d6-DM SO, ppm ): 177,1/176,8 ( C 0 2), 55,5/56,2 (a -C H ), 141,6/141,9, 128,4/127,6, 125.1/125,7, 123,2/122,9 (C 4H 3S), 92,1/92,4 (C 5), 8,4/8,6 ((C H 3)5). - 'H -N M R (270 M Hz, d6D M SO , ppm ): 4,22/4,36 (dd, a-C H ), 4,96/6,14, 5,37/3,28 (br, N H ), 1,61/1,64 (s, (C H 3)5). 10: IR (N ujol, cm “ 1): 3275, 3220, 3120 (vN H ,), 1645 ( v C 0 2), 1580 ( ÖNH2), 280 (vlrC l). - 13CN M R (67,9 M Hz, d6-DM SO, ppm): 179,0/180,4 ( C 0 2), 54,1/55,1 (a -C H ), 140,2/138,7, 126,5/126,8, 125,4/125,2, 123,1/123,3 (C 4H 3S), 83,1/83,4 (C 5), 8,3/8,1 ((C H 3)5). - ’H -N M R (270 M Hz, d6D M SO, ppm ): 4,41/4,70 (dd, a-C H ), 4,35/3,75, 4.45/3,70 (br, N H ), 1,73/1,74 (s, (C H 3)5). E. Schuhmann et al. • M etallkomplexe mit biologisch wichtigen Liganden D iccirbonyl(rf-cyclopentadienyl)[D ,L-2(3-thienyl)glycinatoJm olybdän (II) (11) 0,24 mm ol (70 mg) D,L-2-(3-Thienyl)glycin w er­ den in 5 ml absolutem M ethanol suspendiert und m it 0,24 mmol (124 /d) N atriu m m eth an o lat in 1 ml M ethanol versetzt. A nschließend w erden 0,24 mmol (38 mg) (775-C5H 5)M o (C O )3C1 zur klaren Lösung gegeben, wobei sich die ro te Farbe v er­ tieft. Nach 24 h R ühren bei R.T. wird das M eth a­ nol im V akuum entfernt und der R ückstand mit Wasser, M ethanol und E th e r gew aschen. - IR (N ujol, c m " 1) 3320, 3210 (vN H 2), 1960, 1830 (vC O ), 1630 ( v C 0 2), 1585 (6 N H 2). - 13C-N M R (67,9 M Hz, d6-DM SO, ppm ): 175,98/176,03 ( D 0 2), 55,57/55,51 (a-C H ), 97,17/97,13 (C 5H 5), 140,97/ 139,70, 128,06, 125,16/125,70, 123,12 (C 4H 3S). ‘H -N M R (270 M Hz, d6-DM SO, ppm ): 5,80/5,63 (s, C5H 5), 4,20/4,00 (dd, a -C H ), 7 ,1 -7 ,5 (C 4H 3S). trans-Dichlorobis[D ,L-2-(3-thienyl)glycinmethylester]palladium (II) (12) 0,25 m m ol (74 mg) N atriu m tetrach lo ro p allad at und 0,5 m m ol (104 mg) D,L-2-(3-Thienyl)glycinm ethylesterhydrochlorid w erden in 5 ml absolu­ tem T H F suspendiert und mit 0,5 m m ol (69,3 /d) N E t3 versetzt. Die Farbe v erändert sich sofort nach Gelb. D as Lösungsm ittel wird nach 3 h R ü h ­ ren bei R.T. im Vakuum entfern t und d er R ück­ stand mit Eisw asser gewaschen. A nschließend wird im Ö lpum penvakuum über Sicapent g etrock­ net. - IR (N ujol, cm “ 1): 3270, 3230, 3145 (vN H 2), 1740 (v C 0 2), 1588 (<5NH2), 340 (vPdC l). - l3CN M R (67,9 M Hz, d 6-DM SO, ppm ): 170,1 (C O ,), 55,4 (a-C H ), 136,2, 126,9, 126,7, 124,64/124,60 (C4H 3S), 52,5 (O C H 3). - 'H -N M R (270 M H z, d 6DM SO, ppm ): 4,98/5,00 (dd, a-C H ), 4,26/3,76 (2H , N H 2), 3,72/3,71 (O C H 3). cis-Dichlorobis[D ,L-2-(3-thienyl)glycinm ethylesterjplatin (II) (13) Z u einer Suspension von 0,25 m m ol (104 mg) T etrachloroplatinat und 0,5 m mol (104 mg) D,L-2(3-Thienyl)glycinm ethylesterhydrochlorid in 5 ml W asser w erden langsam 0,5 mmol (0,5 ml) 1 N N aO H getropft. Nach 5 h R ühren bei R.T. wird d er hellgelbe N iederschlag abzentrifugiert, mit Eisw asser gewaschen und im Vakuum ü b er Sica­ pent getrocknet. - IR (Nujol, cm -1): 3240, 3190 (vN H 2), 1732 (v C 0 2), 1565 (d N H 2), 355, 325 (vPtCl). W egen d er raschen Z ersetzung von 13 in verschiedenen L ösem itteln konnte kein N M R S pektrum erhalten w erden. 1575 (Tributylphosphan)dichloro[D ,L-2-(3-thienyl)glycinm ethylesterJpalladium (II) (14) und (Tributylphosphan)dichloro[D ,L-2-(3-thienyl)glycinm ethylesterjplatin (II) (15) 0,5 mmol («-B u3P )2M2C14 (M = Pd für 14 und M = Pt für 15) und 1,00 mmol (208 mg) D,L-2-(3T hienyl)glycinm ethylesterhydrochlorid w erden in 10 ml absolutem T H F suspendiert. A nschließend tro p ft m an langsam 1,00 m m ol (192 /d) N E t3 in 1 ml T H F zu und erhitzt das R eaktionsgem enge 4 h u n te r R ückfluß. N ach dem E rk alten wird vom e n t­ standenen N E t3H +Q - abzentrifugiert und das L ö­ sungsm ittel im V akuum entfernt. D as zurückblei­ bende Öl wird m ehrm als m it P entan digeriert. 14: IR (N ujol, c m - 1): 3315, 3225, 3150 (vN H 2), 1750 (vC O ), 1590 (dN H 2), 320 (vPdCl). - 31PN M R (109,3 M H z, CDC13, ppm ): 28,61. - 13CN M R (67,9 M H z, CDC13, ppm ): 171,9 (d, C o2, 7PC = 3,1 H z), 53,9 (d, a-C H , J PC = 2,1 H z), 136,7, 126,6, 126,3, 124,5 (C 4H 3S), 52,9 (O C H 3). - ‘HN M R (270 M H z, CDC13, ppm ): 5,21 (dd, a-C H ), 3,30 (1 H , N H 2), 3,03 (1 H, N H 2), 3,75 (O C H 3). 15: IR (N ujol, cm -1): 3290, 3210, 3140 (vN H 2), 1745 ( v C 0 2), 1585 (ÖNH-,), 328 (vPtCI). - 31PN M R (109,3 M H z, CDC13, ppm ): -4,95 ( / PtP = 3488 Hz). - 13C -N M R (67,9 M Hz, CDC13, ppm): 171,8 (d, C 0 2, J PC = 3,1 Hz), 54,3 (d, a-C H , J PC = 1,6 Hz), 136,1, 126,7, 126,3, 124,9 (C 4H 3S). - 'H N M R (270 M Hz, CDC13, ppm ): 5,33 (dd, a-C H ), 3,67 (1 H, N H 2), 3,84 (1 H, N H 2), 3,75 (O C H 3). D ichloro(rj5-pentam ethylcyclopentadienyl) [D ,L-2(3-thienyl)glycinm ethylester]rhodium (III) (16) Z u 0,24 m m ol (150 mg) der chlorverbrückten V erbindung C p*2R h 2Cl4 in 10 ml absolutem D i­ chlorm ethan w erden 0,48 m m ol (100 mg) D,L-2(3-T hienyl)glycinm ethylesterhydrochlorid gege­ ben. Nach Z u tro p fe n von 0,48 mmol (68 /d) N E t3 in 1 ml D ichlorm ethan wird 3 h u n ter R ückfluß erhitzt. D as L ösungsm ittelgem isch wird im Va­ kuum en tfern t und der R ückstand m ehrm als mit W asser, E th an o l und E th e r gewaschen. - IR (N u­ jol, cm -1): 3300, 3240 (vN H 2), 1750 (vC O ,), 1570 ( vN H 2), 265, 245 (vR hC l). - 13C -N M R (67,9 M Hz, CDC13, ppm ): 172,7 ( C 0 2), 54,7 (a-C H ), 137,9, 127,1, 125,9, 124,7 (C4H 3S), 52,9 (O C H 3), 93,7 (d, C 5), 9,1 (s, (C H 3)5). - ‘H -N M R (270 M Hz, CDC13, ppm ): 5,27 (a -C H ), 3,75 (O C H 3), 1,64 ((C H 3)5). D ichlor o ( r]5-pentam ethylcyclopentadienyl) [D ,L-2(3-thienyl)glycinm ethylester]iridium (III) (17) 0,25 m m ol (200 mg) Cp*2Ir2Cl4 und 0,5 mmol (104 mg) D ,L-2-(3-Thienyl)glycinm ethylesterhy­ 1576 E. Schuhmann et al. • M etallkomplexe mit biologisch wichtigen Liganden Tab. II. Analytische Daten der Verbindungen 2 -1 9 . Verb. 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 Summenformel (Molmasse) Schmp. [°C] Farbe Ausb. C12H 12N ,N i0 4S2 (371,05) CI2H 12CuN70 4S? " (375,90) C18H33C lN 02PPdS (532,40) C18H33C lN 02PPtS (589.04) C9H „ N 0 2PdS (303,65) C15H 18N20 2PdS •MeOH (428,82) C16H2üC1NO,R uS (426,91) C16H21ClNO->RhS (429,77) C16H21ClIrNO,S (519,08) C13H n N M o04S (373,22) C14H 18Cl2N20 4PdS2 (519,74) C14H 18ClN20 4PtS2 (608,43) C19H36C12N 0 2PPdS (550,84) C19H36Cl2N 0 2PPtS (639,53) C17H34Cl2NO,RhS (480.16) C17H ,4CLIrNO,S (569,55) C17H 13C rN 06S (411.33) C36H30N2O6S2Ti (698,67) >260 Zers. >255 Zers. 152 Zers. 91 blau 88% blau 90% gelb 49% gelb 40% farbl. 87% gelb 82% orange 81% orange 70% orange 67% rot 74% gelb 92% gelb 80% orange 63% gelb 72% orange 45% gelb 78% gelb 60% gelb 71% 110 Zers. 175 Zers. 213 Zers. 195 Zers. 215 Zers. 203 Zers. 170 Zers. 122 Zers. 188 Zers. 61 178 Zers. 169 120 190 Zers. drochlorid w erden in 20 ml absolutem T H F sus­ p en d iert und tropfenw eise m it 0,50 m m ol (69 /Ä) N E t3 in 1 ml T H F versetzt. N ach 3 h R ü h ren bei R.T. wird vom en tstan d en en N E t3H +C L ab zen tri­ fugiert und das Lösungsm ittel im V akuum e n t­ fernt. D er R ückstand wird anschließend m it W as­ ser, M ethanol und E th er gewaschen. - IR (Nujol, cm ’): 3260, 3190, 3120 (vN H 2), 1745 (vC O ), 1575 (vN H 2), 275, 250 (vlrC l). - 13C-N M R (67,9 M Hz, CDC13, ppm ): 172,0 ( C 0 2), 55,3 (a -C H ), 137,1, 127,3, 125,8, 125,0 (C4H 3S), 85,1 (C 5), 53,0 (O C H 3), 8,9 ((C H 3)5). - 'H -N M R (270 M Hz. CDC13, ppm ): 5,42 (a -C H ), 3,71 (O C H 3), 1,55 ((C H 3)5). Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. Ber. Gef. C Analyse [% H N S 38,84 38.16 38,34 37,77 42,86 42,08 36,70 35,97 35.60 35,40 44.81 44,38 45,01 45,31 44,72 44.84 37,02 36.52 41.83 40,08 32,35 32,35 27,64 28.04 41.43 41,76 35,68 35,78 42,52 42,02 35.85 35,80 49,64 49,09 61,89 61,34 3,26 3,25 3,22 3,03 7,01 7,02 5,65 5,45 3,65 3,74 5,17 5,27 4,72 4,73 4,93 5,03 4,08 4,02 2,97 2,97 3,49 3,41 2,98 3.00 6.59 6.82 5,67 5,71 5.04 5.02 4.25 4,43 3,19 3,55 4,33 4,40 7,55 7,30 7,45 7.31 2.63 2.68 2.38 2,34 4,61 4,65 6,53 6,45 3,28 3,66 3,26 3,28 2,70 2,76 3,75 3,60 5,39 5,43 4,60 4,71 2.54 2,60 2,19 2,36 2,91 2,97 2,46 2,65 3,41 3,41 4.01 3,88 17,28 17,05 17,06 17,29 6,02 6,42 5.44 5,47 10,56 10,21 7,48 7,43 7,51 7,51 7.46 7.32 6.18 6,11 8,59 8.52 12.34 12,33 10,54 10,71 5,81 5,83 5,01 5.68 6,66 6,65 5,63 5,62 7,79 7,86 9,18 9,08 [N -B en zo yl-D ,L -2 -(3 -th ien y l)g lyc in m eth y lester](tric a rb o n yl)c h ro m (18) 1,10 mmol (150 mg) (N -Benzoyl)-D ,L-2-(3-thienyl)glycinm ethylester und 5,40 mmol (600 mg) C hrom hexacarbonyl w erden in einem Lösungs­ m ittelgem isch von 8 ml absolutem D ibutylether und 2 ml T H F suspendiert. Das R eaktionsge­ m enge wird anschließend 24 h auf 130 °C erhitzt. Nach dem E rk alten wird das Lösungsm ittel voll­ ständig im V akuum entfernt und der grünschwarze R ückstand in E th e r aufgenom m en. Die Filtration ü b er ausgeheiztes Hyflo Super Cel führt zu einer tiefgelben etherischen Lösung. D er E th er wird vollständig im V akuum abgezogen und der ölige E. Schuhmann et al. ■M etallkom plexe mit biologisch wichtigen Liganden Tab. III. Röntgenographische Daten von 6 und 17 [33]. 17 Kristall-Parameter Summenformel Molmasse (g/mol) Farbe, Habitus Kristallgröße (mm) Kristallsystem Raumgruppe a (pm) b (pm) c (pm) a (°) C9H n N 0 2PdS 303,6 farblos: Leiste C 17H ,4Cl2IrNO,S 569,5 gelb: Prisma 0,26x0,22x0,03 0,12x0.14x0,08 monoklin triklin Pi P 2 j/n 613.61(15) 848.5(2) 2031.7(5) ß( ° ) 96.61(2) Volumen ( n m ) Z Dichte (Mg/m3) Absorp. Koeffizient (m m -1) 1.0508(4) 4 1,919 1.907 837.7(2) 951,3(2) 1322,4(3) 91,21(2) 107.65(2) 94,20(2) 1,0005(4) 2 1,891 7,026 Siem ens R 3 m /V M oK a Siem ens R 3m /V M oKa y (°) Meßparameter Diffraktometer Strahlung (Ä ) Meßtemperatur (K) M eßbereich 2 6 (°) Scan-Geschw. (°/min) Scan-Breite (°) gem essene Reflexe sym.-unabh. Reflexe beobachtete Reflexe (A = 0,71073) 295 5,0-50,0 2,02-14,65 1.10 2242 1860 1197 Strukturanalyse und Verfeinerung Strukturlösung SH ELXTL PLUS D irekte M ethode Verfeinerung Full-Matrix Least-Squares R( %) 3.80 R„ (%) 1.92 Extrema der letzten + 0 ,64/-0,46 Differenz-FourierSynthese ( e l 0 _ 6 pm -3) (A = 0,71073) 295 5,0-50,0 2,02-14,65 1,60 3851 3513 3189 SH ELXTL PLUS Direkte M ethode Full-Matrix Least-Squares 2,95 2,42 +1.21/-0.90 R ückstand m ehrm als m it P entan digeriert. - IR (Nujol, cm “ 1): 3320 (vN H ), 1747 ( v C 0 2), 1641 O C O ), 1972, 1900 b r (vC O ). - 13C -N M R (67,9 M Hz, d6-A ceton, ppm ): 53,8 (cc-CH), 171,1 ( C 0 2), 52,7 (C H 3), 136,9, 128,0, 127,2, 124,6 (C 4H 3S), 164.8 (C O ), 97,3, 96,6, 94,9, 94,6, 92,4, 92,3 (C 6H 5), 232.9 (C rC O ). - 'H -N M R (270 M H z, d 6-A ceton, ppm): 3,73 (s, O C H 3), 7 ,2 -7 ,5 (C 4H 3S), 5 ,5 -6 ,4 (C 6H 5). Bis[N -benzoyl-D ,L-2-(3-thienyl)glycinato]b is (r f-cyclopentadienyl)-titan(lV ) (19) 0,38 mm ol (95 mg) T itanocendichlorid und 0,77 mmol (200 mg) N -B enzoyl-D ,L-2-(3-thienyl)glycin w erden in 5 ml absolutem Toluol su spendiert und tropfenw eise mit 0,92 m m ol (129 /u\) N E t3 in 1 ml Toluol versetzt. Das R eaktionsgem enge w ird 3 h bei 70 °C gerührt. B ereits nach k u rzer Z eit bildet sich ein gelber N iederschlag. D ieser wird abzentri- 1577 Tab. IV. Atomkoordinaten (xlO4) und äquivalente iso­ trope thermische Parameter (pirrxlCL1) von 6. Atom Pd S 0 (1 ) 0 (2 ) N C (l) C(2) 0(3) 0(4) 0(5) 0(6) 0(7) 0(8) 0(9) X 1886(1) 2534(5) -1297(7) -3114(8) 2606(9) 4808(16) 3314(16) 1333(18) -1407(11) 740(11) 2830(13) 1002(11) -679(13) -32(17) y z U(eq)* 2465(1) 530(3) 3128(5) 4327(6) 4132(7) 1840(11) 657(11) 1037(11) 3857(7) 4085(8) 1907(9) 2752(10) 2296(12) 1085(10) 5163(1) 2752(1) 4754(2) 3887(2) 4428(3) 5714(4) 5775(4) 5982(4) 4201(3) 3888(3) 3380(4) 3398(3) 2897(3) 2515(3) 32(1) 72(1) 35(2) 43(2) 29(2) 53(3) 61(4) 60(4) 29(2) 26(2) 45(3) 32(2) 44(3) 54(3) * Äquivalente isotrope U berechnet als ein Drittel der Spur des orthogonalen Ujj-Tensors. Tab. V. Atomkoordinaten (xlO4) und äquivalente iso­ trope thermische Parameter (pm2x l0 _1) von 17. Atom X Ir 01(1) 01(2) S N 0 (1 ) 0 (2 ) 0(1) 0(2) 0(3) 0(4) 0(5) 0(6) 0(7) 0(8) 0(9) 0(10) 0(11) 0(12) 0(13) 0(14) 0(15) 0(16) 0(17) 3558(1) 596(2) 3855(2) -383(3) 2876(7) 1034(7) 3110(7) 3956(8) 3914(8) 5236(8) 6140(7) 5354(8) 2882(10) 2705(9) 5673(9) 7646(8) 5992(10) 2880(11) 1799(9) 2197(10) 1100(9) 429(9) 2387(10) 340(9) y 5254(1) 4479(2) 3551(2) 9392(2) 6490(5) 7747(5) 9426(6) 6309(7) 4823(7) 4297(6) 5453(7) 6686(7) 7304(8) 3966(7) 2773(7) 5355(8) 8174(7) 7951(7) 8686(7) 10129(7) 10663(6) 8159(7) 8454(7) 8243(8) z 7629(1) 7031(1) 9002(1) 6328(2) 8814(3) 9981(3) 10446(4) 6301(5) 6106(4) 6921(4) 7643(4) 7231(5) 5577(5) 5190(5) 7032(5) 8583(5) 7683(6) 8935(5) 7978(5) 7860(6) 6985(5) 7201(5) 9904(5) 10794(6) U(eq)* 34(1) 48(1) 48(1) 78(1) 53(2) 67(2) 88(3) 49(3) 45(2) 46(2) 45(2) 53(3) 84(4) 69(3) 70(3) 74(3) 88(4) 74(3) 53(3) 65(3) 62(3) 60(3) 53(3) 73(3) * Äquivalente isotrope U berechnet als ein Drittel der Spur des orthogonalen Ujj-Tensors. fugiert und zur E ntfernung des en tstandenen N E t3H +C l“ m it W asser gewaschen. - IR (N ujol, cm “ 1): 3304 (vN H ), 1642 C aC 02), 1579 (<5NH2). 13C -N M R (67,9 M H z, CDC13, ppm): 54,83/54,88 (a -C H ), 174,38/174,36 ( C 0 2), 138,42/138,39, 126,50, 126,45/126,30, 122,51/122,42 (C 4H 3S), 166,65/166,60 (C O ), 133,95/134,03, 131,64/131,69, 1578 E. Schuhmann et a l • M etallkom plexe mit biologisch wichtigen Liganden 128,52/128,47, 127,21/127,19 (C 6H 5), 118,96/118,94 (C 3H 5). - 'H -N M R (270 M Hz, CDC13, ppm ): 5,75 (d, a -C H ), 7,58 (d, N H ), 6,28 (10H , E nantiom eren p aar), 6,37 (5 H , M esoform ), 6,20 (5 H , M eso­ form ). D er D eutschen Forschungsgem einschaft, dem Fonds d er C hem ischen Industrie und der W acker C hem ie, M ünchen, gilt unser herzlicher D ank für großzügige F örderung. [1] 73. Mitteilung: Y. Zhou, B. Wagner, K. Polborn, K. Sünkel, W. Beck, Z. Naturforsch. 49b, 1193 (1994). [2] Röntgenstrukturanalyse. [3] Vgl. z. B. G. Jaouen. A. Vessieres, I. S. Butler, Acc. Chem. Res. 26, 361 (1993); D. P. Smith. M. T. Grif­ fin, M. M. Olmstead, M. F. Maestre. R. H. Fish. Inorg. Chem. 32, 4677 (1993); F. V. Sloop. G. M. Brown, R. A. Sachleben. M. L. Garrity, J. E. Elbert, K. B. Jacobson, New J. Chem. 18, 317 (1994). [4] W. S. Sheldrick, E. Hauck, S. Korn, J. Organomet. Chem. 467, 283 (1994) und dort zitierte Literatur. [5] D. Carmona, A. Mendoza, F. J. Cahoz, L. A. Oro, M. P. Lamata, E. San Jose, J. Organomet. Chem. 396, C17 (1990); D. Carmona, F. J. Lahoz, R. Atencio, L. A. Oro, M. P. Lamata, E. San Jose, Tetrahe­ dron: Asymmetry 4, 1425 (1993). [6] a) H. Werner, T. Daniel, O. Niembug, W. Knaup, U. Meyer, J. Organomet. Chem. 445, 229 (1993); b) D. B. Grotjahn, T. L. Groy, J. Am. Chem. Soc. 116, 6969 (1994). [7] a) R. Krämer, K. Polborn. H. Wanjek, I. Zahn, W. Beck, Chem. Ber. 123, 767 (1990); b) R. Krämer, M. Maurus, R. Bergs, K. Polborn. K. Sünkel, B. Wagner, W. Beck. ibid. 126, 1969 (1993) und dort zitierte Literatur. [8] H. Breuer, U. D. Treuner, H. J. Schneider, M. G. Young, H. I. Basch. J. Antibiot. 31, 546 (1978). Vgl. auch Ch. Döbler, H.-J. Kreuzfeld. H. W. Krause. M. Michalik. Tetrahedron: Asymmetry 4, 1833 (1993). [9] H. Kohn, K. N. Sawhney, P. LeGall, J. D. Conley, D. W. Robertson, J. D. Leander, J. Med. Chem. 33, 919 (1990). [10] J. M. Janusz, P. A. Young, R. B. Blum, C. M. Riley, J Med. Chem. 33, 1676 (1990). [11] L. Olgemöller, W. Beck, Chem. Ber. 117, 1241 (1984). Zu 4 und 5 analoge Komplexe wurden auch mit Serin, Threonin, 3,4-Dehydroprolin und 4-Hydroxyprolin erhalten: E. Schuhmann, Dissertation, Universität München (1992). [12] a) Y. Nakagawara, K. Kikukawa, M. Takagi, T. Matsuda, Chem. Lett. 1972, 611; Bull. Chem. Soc. Jpn. 50, 2748 (1977); b) E. Benedetti, G. Maglio, R. Palumbo, C. Pedone, J. Organomet. Chem. 60, 189 (1973); c) P. M. Maitlis. P. Espinet, M. J. H. Russel, in G. Wilkinson. F. G. A. Stone. E. W. Abel (eds): „Com­ prehensive Organometallic Chemistry Vol. 6, p. 411, Pergamon Press. Oxford (1982). [13] E. Ämbach. W. Beck. Chem. Ber. 118, 2722 (1985). [14] D. F. Dersnah. M. C. Baird. J. Organomet. Chem. 127, C55 (1977); W. S. Sheldrick/S. Heeb. Inorg. Chim. Acta 168, 93 (1990); J. Organomet. Chem. 377, 357 (1989). [15] W. Petri, J. Meder, M. Girnth-Weller, K. Bartel, V. Bejenke, G. Hüttner, W. Beck, Chem. Ber. 115, 846 (1982). [16] H. Brunner, Angew. Chem. 95, 921 (1983); Angew. Chem., Int. Ed. Engl. 22, 897 (1983); H. Brunner. D. K. Rastogi, Inorg. Chem. 19, 891 (1980). [17] a) M. P. Springer, C. Curran, Inorg. Chem. 2, 1270 (1963); S. Mylonas, A. Valavanidis, V. Voukouvalidis, P. Polyssiou, Inorg. Chim. Acta 55, 125 (1981); b) U. Taubald, U. Nagel, W. Beck, Chem. Ber. 117, 1003 (1984); N. Steiner, U. Nagel, W. Beck, Z. Na­ turforsch. 43b, 1453 (1988); c) W. Beck, H. Bissinger, M. Girnth-Weller, B. Pu­ rucker, G. Thiel. H. Zippel, H. Seidenberger, B. Wappes, H. Schönenberger, Chem. Ber. 115, 2256 (1982); B. Wappes, H. Schönenberger, H. Bissinger, W. Beck, Arch. Pharm. (Weinheim) 316, 854 (1983); d) W. Tang, K. Yan, A. Dai, Huaxue Xuebao 4 1 ,111 (1983); Q. Yang, Y. Tang, W. Tang, K. Yan, Wuli Xuebao 31, 1558 (1982); X. Xu, G. Zhou, Y. Tang, W. Tang, K. Yan, A. Dai, Sei. Sin., Ser. B. (Engl. Ed.) 26, 689 (1983); W. Beck. Pure and Appl. Chem. 60, 1357 (1988) und dort zitierte Literatur. [18] C. Sergheraert, J. C. Brunet, A. Tartar, J. Chem. Soc. Chem. Commun. 1982, 1417; C. Sergheraert, A. Tar­ tar. J Organomet. Chem. 240, 163 (1982). Vgl. auch W. S. Sheldrick, A. Gleichmann. J. Organomet. Chem. 470, 183 (1994). [19] E. O. Fischer. K. Öfele, Chem. Ber. 91, 2395 (1958); R. J. Angelici, Coord. Chem. Rev. 105, 61 (1990). [20] P. Köpf-Maier, in B. Keppler (ed.) „Metal Comple­ xes in Cancer Chemotherapy“, VC20 Weinheim (1993). [21] a) A. Schäfer, E. Karl, L. Zsolnai, G. Hüttner, H. H. Brintzinger, J. Organomet. Chem. 328, 87 (1987); b) C. J. Cardin, A. Roy, Inorg. Chim. Acta 107, L 3 3 -L 3 5 (1985); c) C. E. Carraher, L. G. Tisinger, W. H. Tisinger, Polym. Mater. Sei. Eng. 52, 177 (1985); Polym. Sei. Technol. (Plenum) 33, 225 (1986); C. E. Carraher, Jr, L. G. Tisinger. Polym. Mater. Sei. Eng. 65, 29 (1991). [22] D. M. Hoffman. N. D. Chester, R. G. Fay. Organo­ metallics 2, 48 (1983). [23] a) M. F. Läppert, C. L. Raston. J. Chem. Soc., Chem. Commun. 1981, 173; M. F. Läppert, C. L. Raston, B. W. Skelton, A. H. White, J. Chem. Soc. Dalton Trans. 1984, 893; R. Tassoni, Dissertation Universi­ tät München (1992). [24] P. G. Jones, R. Schelbach, J. Chem. Soc. Chem. Commun. 1988, 1338. [25] F. R. Hartley, Organomet. Chem. Rev. A. 6, 119 (1970). D ank E. Schuhmann et al. ■ M etallkomplexe mit biologisch wichtigen Liganden [26] B. L. Booth. R. N. Haszeldine. M. Hill, J. A. Chem. Soc. A 1969,1299; R. G. Ball, W. A. G. Grahan, D. M. Heinekey, J. K. Hoyano, A. D. McMaster, B. M. Mattson, S. T. Michel, Inorg. Chem. 29, 2023 (1990); J. W. Kang, K. Moseley, P. M. Maitlis, J. Am. Chem. Soc. 91, 5970 (1969); P. M. Maitlis, Acc. Chem. Res. 11,301 (1978); Chem. Soc. Rev. 1 0 ,1 (1981). [27] A. C. Cope, E. C. Friedrich, J. Am. Chem. Soc. 90, 909 (1968). [28] Y. Tatsümo, T. Yoshida, Seiotsuka, Inorg. Synth. 19, 220 (1979). [29] G. Brauer, Handbuch der Präparativen Anorgani­ schen Chemie, Band III, S. 1947, F. Enke, Stuttgart (1981). [30] M. Brenner, H. R. Müller, W. Pfister, Helv. Chim. Acta 33, 568 (1950); M. Brenner und W. Huber, Helv. Chim. Acta 36, 1109 (1953); Methoden der Organischen Chemie (Houben-Weyl), Synthese von Peptiden I, 317, G. Thieme, Stuttgart (1974); W. E. Bissinger, F. E. Kung, J. Am. Chem. Soc. 69, 2158 (1947); F. C. Whitmore, H. S. Rothrock, J. Am. Chem. Soc. 54, 3431 (1932); P. D. Bartlett, H. P. Herbrandson, J. Am. Chem. Soc. 74, 5971 (1952). 1579 [31] J. P. Greenstein, M. Winitz: Chemistry of the Amino Acids Band 2, 1266, John Wiley & Sons, Inc., New York (1961); Nishimura et al., Bl. Univ. Osaka Pre­ fect. (A) 6, 127 (1958). [32] In Anlehnung an: G. E. Hein, C. Nieman, J. Am. Chem. Soc. 84, 4495 (1962). [33] Weitere Einzelheiten zur Kristallstruktur-Untersuchung können beim Fachinformationszentrum Karlsruhe, Gesellschaft für wissenschaftlich-techni­ sche Information mbH, D-76344 Eggenstein-Leopoldshafen, unter Angabe der Hinterlegungsnum­ mer CSD 58268, der Autorennamen und des Zeit­ schriftenzitats angefordert werden. A n m e r k u n g b ei der K orrektur: Kürzlich wurden Aminsosäure-Titan-Komplexe [Cp2Ti(aa)]2+ beschrieben: Th. M. Klapötke, H. Köpf, I. C. Tornieporth-Oetting, P. S. White, Angew. Chem. 106, 1587 (1994); Angew. Chem., Int. Ed. Engl. 33, 1518 (1994); Organometallics 13, 3628 (1994).