Urologisches Skript - Urologische Universitätsklinik Göttingen
Werbung

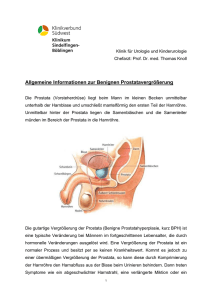
Urologisches Skript der Urologischen Klinik und Poliklinik, Universitätsmedizin Göttingen für Studenten der Humanmedizin (verfasst von Herrn F . Kessel und Herrn Dr. A. Strauß), letzte Änderungen Mai 2011 Inhaltsverzeichnis I. Seite Anatomie und Physiologie des Urogenitalsystems a. Niere und obere Harnwege 3 b. Untere Harnwege 5 c. Genitaltrakt 8 II. Urologische Erkrankungen a. Benigne Prostatahyperplasie 10 b. Harnröhrenstrikturen 14 c. Harninkontinenz 16 d. Akutes Skrotum/Hodentorsion 22 e. Phimose/Präputialverklebungen 24 f. Paraphimose 25 g. Urolithiasis 26 h. Erektile Dysfunktion 30 i. Prostatakarzinom 32 j. met. Prostatakarzinom 38 k. Nierenzellkarzinom 39 l. met. Nierenzellkarzinom 42 m. Hodentumoren 44 n. Harnblasenkarzinom 46 2 Anatomie und Physiologie des Urogenitalsystems Niere und obere H arnwege Niere Die Nieren (Größe etwa 6 * 12 cm) liegen retroperitoneal in Höhe des 12. Brust- und 1.-3. Lendenwirbelkörpers. Sie lagern sich beiderseits der oberen Lendenwirbelsäule in die Rinne zwischen M. quadratus lumborum, M. psoas major und Zwerchfell. Lateral und ventral sind sie durch die 11. und 12. Rippe geschützt. Die linke N steht etwa ½ Wirbelkörperhöhe höher als die rechte. Die Längsachsen der Nieren konvergieren nach kranial, so dass die oberen Pole etwa 7 cm, die unteren 11 cm auseinanderliegen. Der obere N erreicht das lumbokostale Dreieck des Zwerchfells (Bochdalek) und wird hier nur durch eine dünne Bindegewebsplatte vom Pleuraraum getrennt, weshalb beispielsweise paraneprhritische Abszesse auf die Pleura übergreifen können. Aufgrund des unmittelbaren Kontaktes zum Peritoneum und benachbarten Bauchorganen sind abdominelle Symptome bei krankhaften Veränderungen der Nieren häufig. So können Steinkoliken, Entzündungen und Blutungen in das Nierenlager sämtliche Störungsgrade der normalen Darmperistalt bis zum paralytischen Ileus hervorrufen. Daher müssen Nierenerkrankungen bei einigen Abdominalerkrankungen in Betracht gezogen werden. Funktion der Niere Pro Minute fließen ungefähr 1,2 l Blut durch die Nieren, was etwa 25 % des Herzzeitvolumens entspricht. Bei Schwankungen des systemischen Mitteldrucks im Bereich von ca. 80 – 170 mmHg bleibt die Nierendurchblutung aufgrund der renalen Autoregulation der intrarenalen Strömungswiderstände weitgehend konstant. Folglich bleibt auch die glomeruläre Filtrationsrate (GFR) konstant. Die GFR steht für das Flüssigkeitsvolumen welches von allen Glomeruli beider Nieren zusammen pro Zeiteinheit filtriert wird. Dies beträgt ca. 125 ml pro Minute oder ca. 170 Liter am Tag. 99 % dieser Primärharnmenge werden von den Nieren wieder ins Blut rückresorbiert. den Aufgaben der Niere gehören die Filtration, die Sekretion körpereigener und körperfremder Substanzen, wie z.B. Harnsäure, 3 Penicillin oder Paraaminohippursäure (PAH), die Resorption sowie die Harnkonzentrierung. Die Niere hat auch eine endokrine Funktion, folgende Hormone werden hier synthetisiert: Renin: eine Proteinase, gebildet in Zellen des juxtaglomerulären Apparates, wandelt Angiotensinogen aus der Leber zu Angiotensin I um. Erythropoetin: EPO, ein Glykoprotein, Hypoxie des Blutes triggert seine Synthese, EPO stimuliert die Erythropoese im Knochenmark, bei verminderter EPO – Bildung z.B. aufgrund einer chronischen Niereninsuffizienz kann eine renale Anämie (normochrom, normozytär) auftreten. Calcitriol (1,25-Dihydroxycholecalciferol): steigert u.a. die Calcium - und Phosphatresorption im Dünndarm und ist wichtig für die Einlagerung des Calciums in die Knochenmatrix. Ureter Die Ureteren befördern den Harn durch peristaltische Kontraktionswellen (sog. Spindelperistaltik) bis zum Blasenfundus. Sie sind durchschnittlich 28 cm lang, verlaufen senkrecht neben der Wirbelsäule ventral auf dem M. psoas major und projizieren sich im Röntgenbild auf die Querfortsätze der Lendenwirbel und die Sakroiliakalgelenke. Man unterscheidet am Ureter drei physiologische Engen, an beispielsweise Steine leichter hängen bleiben oder sich entzündliche Prozesse häufige lokalisieren: 1. Am Nierenbeckenabgang, dem sog. Ureterhals 2. An der Kreuzungsstelle mit den Iliakalgefäßen 3. An der Durchtrittsstelle durch die Harnblasenwandung (juxtavesikulärer Ureterteil) Faustregel: Der Ureter unterkreuzt die Vasa testicularia (bzw. ovarica) über kreuzt die Vasa iliacae unterkreuzt den Ductus deferens (bzw. die A. uterina). 4 Untere Harnwege Harnblase Die Blase ist ein schleimhautausgekleideter Hohlmuskel, dessen Fasern einen scherengitterartigen Bau zeigen. Sie hat die Funktion, den Harn zu sammeln und ihn unter willkürlicher Kontrolle auszustoßen. Das normale harndrangauslösende Fassungsvermögen der Blase beträgt 300 – 500 ml, beim Mann können regelhaft auch größere Blasenvolumina (bis 700 ml) auftreten, während die Blasenkapazität bei Frauen häufig etwas geringere Volumina aufweist. Bei einer Abflussbehinderung (subvesikale Obstruktion . beim benignen Prostatasyndrom) kann die Blase bis zu 1500 ml aufnehmen und sich dabei so weit ausdehnen, dass sie oberhalb des Nabels tastbar wird. Die Blase liegt extraperitoneal, nur die oberen Flächen des Blasenkörpers werden vom Peritoneum überzogen. Bei stark gefüllter Blase wird oberhalb der Symphyse ein breiter Streifen von Blasenwand frei, so dass hier ohne Gefahr einer Peritonealverletzung eine Punktion oder die Anlage einer suprapubischen Blasendrainage möglich ist. Die Muskulatur der Harnblase, auch als M. detrusor vesicae bezeichnet, besteht aus einem dreischichtigen Geflecht glatter Muskelzellen: einer inneren und äußeren Längsmuskelschicht und einer mittleren Ringmuskelschicht. Das Trigonum vesicae ist der Raum zwischen beiden Uretermündungen und dem Ostium urethrea internum und ist muskelfrei. Der Verschluss der Harnblase wird unwillkürlichen durch zwei (Sphincter Schließmuskel urethrea internus) gewährleistet: und einen einen inneren, glatten, äußeren, quergestreiften, Innervation: Die parasympathischen Nn. pelvici splanchnici stammen dem 2.-4. willkürlichen (Sphincter urethrea externus). Sakralsegment und aktivieren den M. detrusor vesicae. Die sympathischen Nn. hypogastrici entspringen im Thorakolumbalmark und führen einerseits zu einer Erschlaffung des oben genannten M. detrusor und damit zu einer Hemmung der Blasenentleerung. Außerdem aktivieren sie den Sphincter urethrea internus. Die somatorischen Nn. pudendi stammen aus dem 2.-4. Sakralsegment und innervieren den 5 willkürlich kontrollierbaren Sphincter urethrea externus und die übrige Beckenbodenmuskulatur. Der Sympathikus unterstützt den Verschluss und die Füllung der Harnblase, der Parasympathikus sorgt über eine Erregung des M. detrusor vesicae für eine Blasenentleerung. Urethra Die männliche Harnröhre ist etwa 25 cm lang und hat eine Weite von durchschnittlich 7 – 9 mm (27 Charr = Charrière, 1 Charrière entspricht 1/3 mm). Man unterscheidet drei Abschnitte: • Pars prostatica: Sie wird im klinischen Sprachgebrauch auch als hintere Harnröhre bezeichnet und durchsetzt die Prostata in einer Länge 3 cm. An ihrer Dorsalfläche befindet sich der Samenhügel (Colliculus seminalis) mit den Ausführungsgängen der Ductus ejaculatorii und der Drüsen der Prostata. • Pars membranacea: In ihrem Bereich liegt der willkürlich (N. pudendus) innervierte, quergestreifte M. sphincter urethrae, auch als Sphincter urethrae externus (s.o.) bezeichnet. • Pars penilis: Dieser Harnröhrenabschnitt ist vom Schwellkörper (Corpus spongiosum) umgeben und S – förmig gekrümmt. In seinem beweglichen Teil wird sie auch als Pars liber oder Pars pendulans bezeichnet. Die Pars penilis beginnt unterhalb des M. sphincter urethrae mit einer Erweiterung, der Fossa bulbi. Die Glans penis enthält die etwa 2 cm lange Fossa navicularis, die sich am Meatus urethrae externum verengt. Die männliche Harnröhre weist drei physiologische Engen auf: 1. Ostium urethrae externum = Meatus urethrae 2. Pars membranacea und des M. sphincter urethrae 3. M. sphincter vesicae = Blasenhals Bei der Katheterisierung der Blase kann die präpubische Kurvatur durch Hebung des Penis ausgeglichen werden, die infrapubische nicht, weshalb Katheter in der Regel eine 6 gekrümmte Form aufweisen (Tiemann -Spitze) hat. Die wichtigste Enge bei der Einführung eines Katheters liegt im Bereich des Diaphragma urogenitale mit dem Sphincter urethrae externus (2. Enge). Die weibliche Harnröhre ist 3 – 4 cm lang bei einem durchschnittlichen Durchmesser von ungefähr 8 mm (24 Charr). Sie hat einen leicht bogenförmigen Verlauf zwischen Symphyse und vorderer Scheidenwand und endet stern – oder schlitzförmig 2 – 3 cm hinter der Klitoris. Die beiden Sphinkteren sind bei der Frau in die Beckenbodenmuskulatur integriert. 7 Genitaltrakt Prostata Die Prostata, in ihrer Form und Größe etwa einer dicken Esskastanie ähnlich, umschließt die Urethra am Blasengrund. Sie lagert unmittelbar auf dem Diaphragma urogenitale, bleibt aber 2 – 3 cm vom Symphysenrand entfernt. Dorsal grenzt sie an das Rektum und ist von dort aus tastbar, wobei die mediane Furche, der Sulcus, sowie die beiden Seitenlappen palpatorisch beurteilt werden können. Eine sehr derbe bindegewebige Organkapsel umgibt die Prostata. Die Prostata besteht aus 30 – 50 tubuloalveolären Einzeldrüsen, die von Bindegewebe d glatten Muskelzellen (Stroma) ungeben sind. Die Drüsen münden in die Pars prostaticae urethrae seitlich des Colliculis seminalis. Nach McNeal wird die Prostata in 4 Zonen unterteilt: Unterschieden werden die periphere Zone, die konische Zentralzone, die Transitionszone un die anteriore fibromuskuläre Zone. Die periphere Zone enthält den größten Anteil des Drüsengewebes. Die konische Zone beginnt am Colliculus seminalis und führt bis zum Blasenhals (ca. 25% des Drüsengewebes). Die periphere Zone und die konische Zone entsprechen der Außenzone. Die Transitionszone besteht aus Drüsen lateral des Colliculus seminalis und entspricht der inneren Zone. Ein Drüsengewebsanteil von 5-10% findet sich in dieser Zone. Zur Beschreibung der präprostatischen Region fasst man die Transitionszone d die periurethralen Gänge zusammen. Die anteriore fibromuskuläre Region reicht vom Sphincter internus am Blasenhals bis zum Sphincter externus an der Prostataspitze. Dieses Areal ist fast drüsenfrei. Prostatakarzinome entwickeln sich bevorzugt in der peripheren Zone, die benigne Prostatahyperplasie entsteht hingegen in erster Linie Transitionszone. Samenblasen (Bläschendrüsen) Die 6 – 7 cm langen Drüsenkörper liegen cranial der Prostata, nach lateral aufsteigend lagern sie sich dem Blasenboden jeweils seitlich an. Der Ausführungsgang des Samenbläschens, der Ductus excretorius, vereinigt sich innerhalb der Prostata mit dem Ductus deferens zum Ductus ejaculatorius, der beidseits auf dem Colliculus seminalis im Bereich der Pars prostatica urethrae mündet. Der Begriff „Samenblase“ ist irreführend, da die Samenblasen keine Samen, sondern ein alkalisches Begle et des Ejakulats bilden. Das 8 Ejakulat besteht neben den Spermien aus Begleitsekreten der Samenblasen (70%), der Prostata und der periurethralen Drüsen (ca. 30%). Hoden und Nebenhoden Hoden (Testis) und Nebenhoden (Epididymis) liegen im Hodensack (Skrotum), umgeben von mehreren Hüllen, die eine Fortsetzung der Bauchwandschichten darstellen. Der eiförmige Hoden hat ein durchschnittliches Volumen von 18 ml, dieser schwankt aber individuell zwischen 12 und 30 ml. Der Hodenkörper ist von der derben Tunica albuginea umschlossen und hat eine prall – elastische Konsistenz. Der Nebenhoden lagert sich dem n dorsolateral auf und ist durch eine tastbare Furche vom Hodenkörper getrennt. Er besteht aus einem etwas verdickten oberen Kopf, einem im Querschnitt nahezu dreieckigen dünnen Körper und einem kräftigen Schwanz der hinten – unten in den Samenstrang übergeht. Hoden und Nebenhoden bilden eine funktionelle Einheit und sind daher bei Erkrankungen oft gemeinsam betroffen. 9 Urologische Erkrankungen Benigne Prostatahyperplasie (BPH) Die benigne Prostatahyperplasie ist definiert als Vergrößerung der Prostata durch numerische Zunahme der Zellen des Stromas. Die BPH ist die häufigste Ursache der männlichen Blasenentleerungsstörung. Bei Männern, die aus Gründen, die nicht mit der Prostata in Zusammenhang stehen, frühzeitig gestorben sind, konnte gezeigt werden, dass bereits ab dem 30. Lebensjahr eine Zunahme der Gewebevergrößerung der Prostata zu verzeichnen ist. Etwa die Hälfte der Männer über 60 Jahre weist eine gutartige Vergrößerung der Prostata auf, die aber allein noch nicht als krankhaft zu werten ist. Nur bei Beschwerden, die durch die benigne Prostatahyperplasie entstehen können, ist von einer behandlungsbedürftigen Erkrankung, dem so genannten benignen Prostatasyndrom (BPS) auszugehen. Etwa ¼ der Männer im Alter zwischen 50 und 60 Jahren und ca. 40 % der über 70 – jährigen leiden unter Miktionsbeschwerden (lower urinary tract symptoms - LUTS). In Deutschland sind schätzungsweise 5 Mio. Männer betroffen. Ätiologie Die Ätiopathogenese ist nicht eindeutig geklärt, es werden verschiedene Theorien diskutiert: 1. Wachstumsreize v.a. des Hormons 5 a – Dihydrotestosteron (DHT), Akkumulation in den Zellen der Prostata. Verschiebung im Östrogen - / Androgenstoffwechsel zugunsten der Östrogene 2. und eine erhöhte Konzentration des sexualhormonbindenden Globulins (SHBG). 3. Einfluss peptidaler stromaler Wachstumsfaktoren. 4. Stammzellen – Theorie: Hyperplasie der prostatischen Zellen ohne Hormoneinfluss. 5. Verminderter Zelltod von Prostatazellen. Pathologie: Bei der BPH hypertrophieren insbesondere die periurethralen Drüsenanteile der Transitionalzone (Syn: Übergangszone), während gleichzeitig die periphere Zone mit zunehmendem Alter atrophiert. 10 Das infravesikale Abflusshindernis ist somit dem periurethralen Wachstum geschuldet und führt zur Abschwächung des Harnstrahls, ggf. zur Restharnbildung bis hin zum Harnverhalt. Bei chronischer infravesikaler Widerstandserhöhung kommt es zur reaktiven Hypertrophie der Blasenwandmuskulatur bis hin zur Ausbildung einer die subvesikalen Verschlussdrücke weiterhin Balkenblase. Bleiben erhöht, können (Schleimhautausstülpungen durch die Muskelschicht der sich Pseudodivertikel bilden. Weiterhin besteht die Gefahr der Ausbildung eines vesikoureteralen bzw. -renalem Reflux oder auch einer Obstruktion am ureterovesikalen Übergang mit der möglichen Folge einer Nephropathie/Niereninsuffizienz Klinik: Man unterscheidet bei der BPH folgende Miktionsbeschwerden (LUTS = lower urinary tract symptoms): - Reizerscheinungen (irritative Symptome): erhöhte Miktionsfrequenz (Pollakisurie > 3 – stündlich am Tag), Nykturie, imperativer Harndrang bis hin zur Dranginkontinenz, Restharngefühl. - Zeichen von Entleerungsstörungen (obstruktive Symptome): verzögerter Miktionsbeginn, Harnstottern, verlängerte Miktionszeit (> 30 sek.), Nachträufeln. Erst bei Harnwegsinfekten wird das Wasserlassen schmerzhaft. Im Endstadium kann es zum akuten Harnverhalt kommen sowie zum postrenalen Nierenversagen und terminaler Niereninsuffizienz. Einteilung: Stadium I: „Reizstadium“, abgeschwächter Harnstrahl, erschwerte Miktionsinitiierung, aber insg. kompensiert, kein Restharn. Stadium II: „Restharnstadium“, Beginn der Dekompensation des Entleerungsmechanismus, Restharn 100 – 150 ml. Stadium III: „Dekompensationsstadium“, Überlaufblase, Harnstauungsniere bis zum postrenalen Nierenversagen (Hydronephrose) od. akuter Harnverhalt. Diagnostik: Von einem internationalen Konsensus – Komitee wurde ein standardisierter Fragebogen entworfen, in dem 7 Symptome von den Patienten bewertet werden können. 11 IPSS: Internationaler Prostata Symptomen Score. Mittels dieses Scores können Patienten in drei Gruppen eingeteilt werden: 0 – 7 Punkte: gering symptomatisch 8 – 19 Punkte: mäßig symptomatisch 20 – 35 Punkte: ausgeprägt symptomatisch Bei einem IPSS-Score von > 7 liegt in der Regel ein behandlungsbedürftiges BPS (benignes Prostata Syndrom) vor. In diesem Fall sollte ein Urologe aufgesucht werden. Digitale rektale Untersuchung: Größe, Kontur mit Sulkus (verstrichener Sulkus??), Konsistenz, Druckschmerz. Labor: Urinstatus und Sediment, Serum – Krea, PSA (kann bei BPH erhöht sein, bei Werten > 4 ng/ml Biopsie zum Ausschluss eines Karzinoms). Sonographie: abdominal oder besser transrektal, genaue Größenbestimmung, Strukturveränderungen, Restharnbestimmung (> 50 ml). Uroflowmetrie: Normalwert für max. Harnflussvolumen liegt > 15 ml/s, reduzierter Harnfluss??, verlängerte Miktion?? Weitere urodynamische Untersuchungen und evtl. ein Urethrozystogramm oder eine Urethrozystoskopie müssen in Abhängigkeit von Anamnese und Beschwerdebild angeschlossen werden. Therapie: Medikamentös: - a1 – Rezeptorenblocker: Relaxation der glatten Muskulatur des Prostatastromas und Blasenausgangs, Besserung der irritativen Symptomatik. Präp: Tamsulosin, Alfuzosin, Doxazosin od. Terazosin. - 5a – Reduktasehemmer: Hemmung der Umwandlung von Testostero zu Dihydrotestosteron führt zur Drüsenvolumenreduktion, insb. bei sehr großer Prostata > 40 ml. Die PSA – Werte werden durch die Hormontherapie um bis zu 50 % 12 reduziert, so dass bei der Vorsorge Normalwerte vorgetäuscht werden können. Wirkung erst nach 3 – 6 Mon. Präp: Finasterid, Dutasterid - Phytotherapeutika: antiphlogistische und dekongestive irkung, bisher kein wissenschaftlicher Wirkungsnachweis. Aus Erfahrung kann aber bei einigen Patienten im Frühstadium der Erkrankung eine Besserung unter Therapie mit pflanzlichen Präparaten beobachtet werden. Zur Anwendung kommen Kür parate, Sägepalmextrakte, Brenesselwurzelextrakte. Operativ: Eine Operationsindikation ist gegeben bei rezidivierendem oder chronischem Harnverhalt, hohen Restharnwerten, stauungsbedingten Nierenschäden, rezidivierender Makrohämaturie, Harnblasenstein. Fast alle operativen Eingriffe (> 90 %) erfolgen endoskopisch transurethral. Die Operationsmortalität liegt deutlich unter 1 %. - Transurethrale Resektion der Prostata (TUR – P): Abtragung der benignen Prostatahyperplasie mit der Hochfrequenzschlinge, heute Standardeingriff bei 90 % d.F. (Geweberesektion mittels Hochfrequenzstrom mit einer U – förmigen Schlingenelektrode) - Alternative Resektionsverfahren sind die Laservaporisation (KTP – Laser), die Laserkoagulation (Nd:YAG – Laser), die Laserenukleation oder-resektion (Holmium Laser), die transurethrale Mikrowellenthermotherapie oder die transurethrale Nadelablation der Prostata. - offene Prostataadenomektomie, transvesikal oder retropubisch, erzielen sehr gute Ergebnisse bzgl. der postoperativen Miktion, werden aber wegen der größeren Operationsbelastung auf große Drüsenvolumina (> 80 g) beschränkt. 13 Strikturen der Harnröhre Von einer Harnröhrenenge sind in der Mehrzahl Männer betroffen, wobei die Enge in allen Bereichen der Harnröhre auftreten kann. Unbehandelt stellt eine Harnröhrenenge ein infravesikales Abflusshindernis dar und kann bei Restharnbildung als Folge einer unvollständigen Blasenentleerung zu rezidivierenden Harnwegsinfekten führen. Weitere Komplikationen sind der vesikoureterale Reflux und die Detrusorhypertrophie bei länger bestehender Obstruktion bis hin zur beidseitigen obstruktiven Nephropathie. Ätiologie: Meistens sind perioperative/iatrogene Verletzungen der Harnröhre (gewaltsame Katheterisierung, Dauerkatheter, transurethrale Eingriffe, etc.) Ursache der Strikturen, aber auch Verletzungen der Harnröhre durch ein stumpfes Beckentrauma oder direkt durch Beckenfrakturen können im Verlauf zur Ausbildung einer Harnröhrenenge führen. Ebenso können unspezifische Entzündungen der Urethra (Urethritis) oder eine Urotuberkulose eine Harnröhrenenge verursachen. Auch bindegewebige Veränderungen wie z. B. ein Lichen oder eine Balanitis xerotica obliterans können Harnröhrenengen verursachen. Bis zur Antibiotikatherapie der Gonorrhoe waren ca. 70 % aller Harnröhrenstrikturen postgonorrhoischer Natur. Heute wird sie nur noch gelegentlich angetroffen. Etwa 10 % der Fälle einer Harnröhrenstriktur sind angeboren. Klinik: - Abgeschwächter oder sistierender Harnstrahl (obstruktive Miktion), bei Meatusstenose streuender oder geteilter Harnstrahl, terminales Nachträufeln - Dysurie, Pollakisurie - Rezidivierende Harnwegsinfekte bei Restharnbildung Diagnostik: 1. Anamnese und klinische Untersuchung 2. Sonographie: Blase vor und nach Miktion (Restharn) 3. Uroflowmetrie: verminderter Fluss 14 4. Röntgen: retrograde Urethrographie und Miktionszystourethrographie: genaue Stenosenlokalisation 5. Urethroskopie Therapie: - Bougierung (Dehnung): ambulant möglich, allerdings mit hoher Rezidivrate behaftet, was häufig eine Wiederholung des Verfahrens im Verlauf notwendig macht. - kurze Stenose: endoskopische Urethrotomia interna: Schlitzung der Harnröhre bei 12 Uhr unter Sicht (Sachse – Urethrotom) oder blind (Otis – Urethrotom) mit einem kleinen Messer an der Spitze des Endoskopes. Rezidivrate ca. 50 %. Bei wiederholter Enge ggf. offene End -zu-End-Anastomose der Harnröhre. - lange Stenose > 2 cm: offene plastische Rekonstruktion der Urethra - mit Hautlappen (Vorhaut, Mundschleimhaut) in Onlaytechnik, ggf. auch zweizeitig. Jedwede Therapie der Harnröhrenenge geht mit einer erneuten Narbenbildung einher und birgt somit die Gefahr eines Rezidivs. Die Wahrscheinl it der Ausbildung eines Rezidivs ist abhängig vom gewählten therapeutischen Verfahren. 15 Harninkontinenz Nach der Internationalen Kontinenzgesellschaft (ICS) w rd Harninkontinenz als unwillkürlicher, objektivierbarer Urinverlust definiert, der ein soziales und hygienisches Problem darstellt. Unwillkürlicher Harnabgang ist ein verschiedener Störungen des Sphinktersystems und/oder des Detrusors der Harnblase. Das breite Spektrum der Inkontinenzformen und – grade reicht vom häufigen, oft überfallartigem (imperativen) Urinverlust, über gelegentlichen, insbesondere bei körperlicher Belastung auftretenden Urinverlust bis hin zu hochgradigen Inkontinenzformen, die eine permanente Versorgung erforderlich machen. Harninkontinenz ist ein weltweit verbreitetes Leiden und kann bei beiden Geschlechtern in jedem Lebensalter auftreten. In Deutschland leiden zurzeit etwa 4 -5 Mio. Menschen unter Harninkontinenz. Für die Betroffenen stellt sie oft eine schwere körperliche und seelische Belastung dar, die zur Beeinträchtigung der Bewegungsfreiheit und zu sozialem Rückzug führt sowie mit einer deutlichen Einbuße an Lebensqualität einhergeht. Aus Scham wird das Leiden häufig sehr lange – auch dem Arzt gegenüber – verschwiegen. Nach dem Vorschlag der ICS werden folgenden Formen der Harninkontinenz unterschieden: • Belastungsinkontinenz (Stressinkontinenz) • Dranginkontinenz (Urgeinkontinenz) • Mischinkontinenz (aus den beiden oberen) • Inkontinenz bei chronischer Harnretention (alt: Überlaufinkontinenz) • Inkontinenz bei neurogener Detrusorhyperaktivität (alt: Reflexinkontinenz) • extraurethrale Harninkontinenz Aufgrund der unterschiedlichen Formen und Ursachen von ungewolltem Urinverlust ist es für Betroffene ganz entscheidend, sich an einen erfahrenen Arzt bzw. an ein spezialisiertes Zentrum, insbesondere an einen Urologen, zu wenden. Nur in einem kompetenten Behandlungs- und Beratungszentrum erhält der Betroffene durch gezielte Fragestellungen und Untersuchungen eine individuell angepasste Therapie. Durch die 16 verschiedenen konservativen und operativen Behandlungsmöglichkeiten kann die Inkontinenz heute in sehr vielen Fällen geheilt oder zumindest deutlich gebessert werden. Belastungsinkontinenz Durch Steigerung des intravesikalen Druckes, z.B. beim Husten, Niesen, Lachen, Heben, Hüpfen oder beim Geschlechtsverkehr, kommt es zu einem unwillkürlichen Harnabgang. Eine Detrusoraktivität bleibt aus. Typischerweise verspüren die Betroffen vorher keinen Harndrang. Ursache sind eine Verminderung des Urethraldruckes und eine Erschlaffung der Beckenbodenmuskulatur mit oder ohne Deszensus der Urogenitalorgane. Nach Ingelmann – Sundberg und Stamey werden folgende Schweregrade unterschieden. Grad I: Harnverlust beim Husten, Niesen, Lachen. Grad II: Harnverlust beim Gehen, Aufstehen, Treppensteigen. Grad III: Harnverlust beim Liegen. Dranginkontinenz Leitsymptom der Dranginkontinenz (Urgeinkontinenz) ist der unwillkürliche Harnverlust bei sog. imperativem, nicht unterdrückbarem Harndrang. Dabei kann es zur vollständigen Blasenentleerung oder zum Verlust kleiner Urinmengen zwischen einzelnen Miktionen kommen. Im Gegensatz zur Belastungsinkontinenz ist der unwillkürliche Urinabgang bei Dranginkontinenz die Folge einer Detrusorkontraktion o einer sensiblen Reizüberflutung, die zu einer reflektorischen Erschlaffung des Beckenbodens und damit zum Harnabgang führt. Eine Detrusorinstabilität in Folge rezidivierender Harnwegsinfekte kommt ebenso als Ursache in Frage. Der Sphinktermechanismus ist nicht gestört. Mischinkontinenz Unter Mischinkontinenz Belastungsinkontinenz. versteht Diagnostisch man eine bestehen Kombination hier von verständlicherweise Drangnicht und selten Schwierigkeiten. Werden sowohl das Vorliegen einer Sphinkterschwäche als auch eine Detrusorüberaktivität nachgewiesen, kann die Diagnose Mischinkontinenz gestellt werden. Inkontinenz bei chronischer Harnretention Die chronische Harnretention mit Harninkontinenz ersetzt den früheren Begriff der Überlaufinkontinenz. Es kommt zu Urinverlust, der mit Überdehnung der Blase bei 17 intaktem Harnröhrenverschlussmechanismus einhergeht. Beispielsweise kann eine länger bestehende infravesika e Obstruktion, oder eine Detrusorhypokontraktilität ursächlich sein. Die Inkontinenz bei chronischer Harnretention kann sich akut oder chronisch entwickeln. Ätiologisch liegt eine Blasenentleerungsstörung zugrunde. Inkontinenz bei neurogener Detrusorhyperaktivität Patienten die unter dieser Inkontinenzform leiden haben die willkürliche Kontrolle des Miktionsreflexes verloren. Die Inkontinenz entsteht durch eine neurogene Störung wie sie durch Bandscheibenvorfälle, Rückenmarksläsionen aber auch Fehlbildungen im Sinne einer Myelomeningocele oder Spina bifida ausgelöst werden können. Der Miktionsreflex kann bereits durch äußere taktile Reize ausgelöst werden. Früher wurde die Inkontinenz bei neurogener Detrusorhyperaktivität auch als Reflexinkontinenz bezeichnet. Neurogene Blasenentleerungsstörungen treten bei vielen Erkrankungen des Nervensystems oder Erkrankungen mit Auswirkungen auf das Nervensystem auf (Morbus Parkinson, Multiple Sklerose, Diabetes mellitus etc.). Extraurethrale Inkontinenz Die extraurethrale Inkontinez kennzeichnet einen typischerweise kontinuierlichen Urinabgang unter Umgehung der Harnröhre bzw. des Urethralsphinkters. Ursächlich können Fisteln, z.B. Blasen – Scheiden – Fisteln oder extravesikal mündende Harnleiter sein. Diagnostik: Basisdiagnostik: 1. Anamnese, insbesondere Miktionsanamnese (Frequenz, Nykturie, Trinkmenge, Dysurie, Harndrang, Vorlagenzahl/Tag, ggf. Miktionsprotokoll für 3 – 4 Tage führen lassen). Menge und Situation des unwillkür chen Urinabgangs, gynäkologische Anamnese (Zahl der Geburten, Uterusprolaps etc.), neurologische Erkrankungen, Medikamente? 2. Inspektion und klinische Untersuchung 3. Urindiagnostik: Ausschluss eines HWI, Vorlagentest (Vorlagengewicht vor und nach einem Standard – Belastungsprogramm bestimmen = Pad -Test) 18 4. Sonographie: Sonographie Restharnbestimmung, zur Erkennung von transvaginale/transrektale Harnröhrendivertikeln, oder perineale Bestimmung von Urethralänge und Urethrablasenwinkel Spezialisierte Diagnostik 1. Urodynamik: Uroflowmetrie (graphische Darstellung des ? Harnflusses Blasenentleerung), Zystomanometrie, Urethradruckprofil 2. Röntgendiagnostik: Urethrozystographie, Ausscheidungsurographie, Refluxprüfung 3. Endoskopie: Urethrozystoskopie, Harnröhrenkalibrierung, Biopsie, Spülzytologie, ggf. Rektoskopie Therapie: Für die Behandlung der Harninkontinenz existieren je nach Form und Schweregrad verschiedene Behandlungsoptionen, die sich in konservative (physiotherapeutische und medikamentöse Behandlung) und operative Maßnahmen einteilen lassen. Indiziert ist eine Behandlung immer dann, wenn die Inkontinenz als störend empfu n wird. Im Folgenden sollen die Therapioptionen für die jeweilige Inkontinenzform aufgezeigt werden. Belastungsinkontinenz konservativ: Beckenbodentraining; Biofeedback – Training; Magnetstimulationstherapie (stimuliert die Beckenbodenmuskulatur); Verhaltensmodifikation durch Trinkmengenregulation und Toiletten - /Miktionstraining (z.B. Miktion nach der Uhr alle 2 – 3 Std.) medikamentös: Duloxetin (SSRI) 2 x 40 mg/d, steigert die M. sphincter urethrae Aktivität a – Sympathomimetika, z.B. Midodrin, Sympathomimetika, verstärkt Tonuserhöhung Kontraktionen des der glatten quergestreiften Muskulatur Sphincter ß – externus Östrogensubstitution operativ: 19 periurethrale Kollageninjektion: initial > 80 % erfolgreich, auf Dauer (5 J.) nur ca. 20 % Harnröhrenschlingensuspension (TVT – OP, tension free vaginal tape): minimalinvasives Verfahren mit ca. 90 % Erfolg, daher heute Methode der Wahl. Bei diesem Verfahren wird ein Kunststoffband spannungsfrei unter die Harnröhre eingelegt und oberhalb des Schambeinknochens (in der Bikinizone) oder durch das F obturatorium ausgeleitet. Retropubische Suspensionsplastik: Bei der retropubischen Suspensionsplastik wird über einen kleinen Unterbauchschnitt in der Nähe von Blasenhals die Harnröhre mit Hilfe von Fäden an einem Beckenknochen oder benachbarten Stützgeweben befestigt, um die Harnblase/Harnröhre in der richtigen Position zu halten. Diese Technik kann auch laparoskopisch durchgeführt werden. Artefizieller Sphinkter (künstlicher Schliessmuskel): Hauptindikation für dieses Verfahren besteht bei einer Belastungsinkontinenz nach operativen Maßnahmen an der Prostata, insbesondere nach radikaler Prostatektomie beim Prostatakarzinom. Der Sphinkter besteht aus einem druckregulierenden Ballon, einer Manschette, die um die Urethra plat ert wird und einer Pumpe, die im Skrotum platziert wird und manuell bedient und deaktiviert wird. Dranginkontinenz konservativ: Primärtherapie der auslösenden Ursache, z.B. Infektsanierung, Entfernung eines Blasensteins, Blasentraining, sakrale Reizstromtherapie, lokale Östrogengabe medikamentös: Parasympatholytika (Anticholinergika, Muskarinrezeptorenblocker) z.B. Tolterodin, Propiverin, Trospiumchlorid; neu sind M³ – Muskarinrezeptorantagonisten (selektiv am Detrusor wirksam), z.B. Solifenacin, Darifenacin Botulinum – Toxin Injektion in die Harnblasenwand (wirkt für 3 – 6 Monate) Inkontinenz bei neurogener Detrusorhyperaktivität Anticholinergika zur Erhöhung der Blasenkapazität Inkontinenz bei chronischer Harnretention medikamentös: 20 Bei Blasendenervierung (neurologische Störung) können versucht werden (Betanechol, Carbachol). Blasenentleerung Parasympathomimetika durch Selbst – oder Fremdkatheterismus. operativ: Beseitigung des subvesikalen Hindernisses (Resektion einer Harnröhrenstriktur, transurethrale Prostataresektion oder transvesikale Prostatektomie). lten diese Maßnahmen nicht möglich sein oder keinen Erfolg zeigen, erfolgt eine dauerhafte Harnableitung über einen transurethralen oder suprapubischen Katheter. Extraurethrale Inkontinenz operativ: Sanierung der Ursache, z.B. Fistel 21 Akutes Skrotum Definiert ist das akute Skrotum als schmerzhafte Schwellung des Hodensacks, die eine sofortige Abklärung erfordert. Das akute Skrotum kann verschiedene Ursachen haben: eingeklemmte Leistenhernie - Epididymitis/Orchitis - Hydatidentorsion - Skrotaltrauma - Hodentumor (z.B. bei Einblutung) - Hodentorsion Hodentorsion Die Hodentorsion ist die häufigste auslösende Ursache Symptoms „geschwollener Hoden“ bei Kindern. Sie ist definiert als partielle oder totale Stieldrehung des Hodens. Neben dem Samenleiter verlaufen innerhalb des Samenstranges arterielle und venöse Gefäße, die den Hoden versorgen. Durch die Torsion des Samenstranges werden die Blutgefäße abgeschnürt. Der arterielle Druck reicht meistens aus, um weiter Blut zu liefern, der venöse Rückfluss ist jedoch nicht mehr gewährleistet was zu einer Blut – und Lymphstauung und damit massiven Schwellung führt. Bleibt die Torsion länger bestehen wird auch die arterielle Blutzufuhr beeinträchtigt. Klinik: Meistens heftige, akut einsetzende Schmerzen im Skrotum und in der Leistengegend die charakteristischerweise spontan (50 % nachts), aber auch während Spiel und Sport einsetzen. Vegetative Begleitsymptomatik wie Übelkeit und Erbrechen. Diagnostik: 22 Anamnese und körperliche Untersuchung: Wegen der Samenstrangrotation besteht in der Regel ein einseitiger Hodenhochstand (BRUNZEL – Zeichen). Schmerzzunahme beim Anheben des Hodens, im Gegensatz zur Epididymitis. Dieses sogenannte PREHN – Zeichen gilt allerdings als unsicher. Sonographie: Die Dopplersonographie zur Darstellung der Hodenperfusion über die A. testicularis ist bei der Differentialdiagnostik hilfre Dabei müssen intraparenchymatöse Perfusionssignale nachgewiesen werden. Sonographisch können eine Hydrozele, eine Varikozele oder auch eine Leistenhernie als mögliche Ursache der Beschwerden ausgeschlossen werden. Eine zuverlässige Diagnose ist mittels MRT oder Perfusionsszintigraphie möglich, wird aber aufgrund des Zeitfaktors sowie der Kosten in der Regel nicht durchgeführt. Im Zweifelsfall immer operative Freilegung!!! Therapie: Als urologischer Notfall erfordert die Hodentorsion eine sofortige Behandlung. Eine Operation sollte innerhalb von 6 Stunden erfolgen, da onst eine irreversible Nekrose droht. Operativ wird das Skrotum eröffnet, der Hoden detorquiert und eine Orchidopexie vorgenommen (= Befestigung mittels Naht am tiefsten Punkt des Skrotums, prophylaktisch auch kontralateral, entweder Einpunktfixation oder besser Dreipunktfixation). Bei Nekrose sind eine Orchiektomie und eine kontralaterale Orchidopexie indiziert. 23 Phimose/Präputialverklebungen Die Phimose oder Vorhautenge ist definiert als ein Missverhältnis zwischen Größe der Glans penis und Weite des Präputiums (Vorhaut). Bis zum 3. Lebensjahr ist die Verengung der Vorhaut durch Verklebung mit der Glans penis physiolog allerdings ist zu berücksichtigen, dass sich eine Phimose bzw. Präputialverklebungen noch bis etwa zum 12. Lebensjahr vollständig zurückbilden bzw. lösen können, ohne das eine Therapie notwendig ist. Die Prävalenz beträgt 5 – 7 % bei 6 – 7 – jährigen und 1 % bei 16 – jährigen Jungen. Diagnostik: Anamnese und körperliche Untersuchung: Bei der Anamneseerhebung ist darauf zu achten, ob bereits Entzündungen der Vorhaut (Balanitiden) aufgetreten sind. Weiterhin sollte erfragt werden, ob bei der Miktion eine Ballonierung der Vorhaut auftritt. Dieses wären Zeichen, die die Einleitung einer Therapie notwendig erscheinen lassen. Bei der lichen Untersuchung zeigen sich möglicherweise entzündliche Veränderungen an der Vorhaut (Rötung), weiterhin kann der Lokalbefund beurteilt werden Bei einer rüsselförmigen oder auch narbigen Phimose sollte eine Therapie eingeleitet werden. Ein forciertes Zurückziehen der Vorhaut über den Sulcus coronarius sollte vermieden werden, um keine Paraphimose zu verursachen. Therapie: Die Therapie der Phimose richtet sich nach dem Ausmaß Verengung. Bei relativen Phimosen oder Präputialverklebungen kann primär ein Therapieversuch mit der lokalen Anwendung einer östrogenhaltigen Salbe (Betnesol® 0,1%) unternommen werden. Ansonsten wird die kindliche Vorhautverengung wird durch operative Zirkumzision therapiert. Je nach Wunsch der Eltern ist eine totale oder vorhauterhaltende Resektion möglich. Als Zeitpunkt der Therapie wird heute ein Alter ab dem 2. Lebensjahr bis zum Kindergarten – oder Schuleintritt empfohlen. Aktuell bestehende lokale Infektionen und Penisanomalien, z. B. die Hypospadie, da hier die Vorhaut für die Harnröhrenrekonstruktion bevorzugt wird, sind Kontraindikationen der Zirkumzision. 24 Paraphimose Die Paraphimose (sog. spanischer Kragen) ist ein urologischer Notfall. Es kommt durch das Zurückziehen einer zu engen Vorhaut in den Sulcus coro hinter der Eichel zu einer Minderperfusion des Präputialanteils distal vom Schnürring sowie evtl. der Glans. Es resultiert eine ödematöse Schwellung von Präputium und Glans bei unauffälligem proximalem Penis. Im schlimmsten Fall kann die Minderperfusion zur Nekrose der Glans führen. Auffällig werden die betroffenen Patienten durch die o. g. Schwellung sowie eine ausgeprägte Schmerzsymptomatik. Diagnostik: Körperliche Untersuchung Therapie: Lokalanästhesie in Form eines Penisblocks, manuelle Kompression des ödematöden Gewebes und manuelle Reposition. Gelingt dies nicht, wird der chnürring in Narkose dorsal inzidiert. Eine Zirkumzision erfolgt nach Abklingen des Ödems bzw. der entzündlichen Veränderungen. 25 Urolithiasis Eine Harnsteinbildung in der Niere und / oder den ableitenden Harnwegen wird als Urolithiasis bezeichnet. Harnsteine setzten sich vorwiegend aus kristallinen und amorphen organischen und / oder anorganischen Substanzen zusammen und können von einer nicht kristallinen Matrix durchsetzt sein. Ihre Entstehung resultiert aus einer Störung des physikalisch – chemischen Gleichgewichts des Harns. Die Symptomatik w durch Bildungsort, Größe und Verhalten der Steine und deren Folgeerscheinungen wie Harnstauung und Nierenschädigung bestimmt. Epidemiologie: Die Häufigkeit der Harnsteinbildung (Prävalenz) liegt Deutschland bei 5 %. Mit zunehmendem Wohlstand hat die Prävalenz in den letzten Jahrzehnten kontinuierlich zugenommen und erreicht in den USA noch höhere Werte als in Deutschland. Männer sind doppelt so häufig betroffen wie Frauen. Das prädisponierende Alter liegt zwischen dem 35. und 65. Lebensjahr. Ätiologie: Ursache und Ablauf der Steinbildung sind bei bis zu 80 % der Patienten ungeklärt (idiopathisch). Man weiß jedoch, dass eine Überschreitung des Löslichkeitsprodukts steinbildender Substanzen zu Kristallbildung, Kristallwachstum und – aggregation und somit zum Stein führt. Prädisponierend sind: - Hyperkalzämie: vermehrte Ca-Resorption im Darm, Hyperparathyreodismus, renaler Ca-Verlust ? PTH? (sek. Hyperparathyreodismus). - Hyperurikämie: erhöhte Harnsäuren z.B. durch zu hohen m od. bei Leukosen, Tumorzerfall, massive Reduktionsdiät. - Infekte des Harntrakts: Hemmung der Ureterperistaltik bei Infektionen führen zur Stase, was eine Steinbildung begünstigt. - Abflussbehinderungen: Stenosen, BPH, Blasendivertikel, Urethradivertikel, neurogene Blasenentleerungsstörung. Klinik: akute Nierensteinkolik: 26 - anfallsartige, krampfartige, stechende Schmerzen - der Schmerz wandert („der Stein wandert, der Schmerz wandert, der Patient wandert auch“) - Flankenschmerz, evtl. Ausstrahlung in den Rücken oder ins Genitale. - imperativer Harndrang bei verminderter Harnmenge. - Harnstottern od. „Stakkatomiktion“ - Mikro – oder Makrohämaturie. Unbehandelt kann ein Harnsteinleiden über eine bakteri le Infektion, z.B. eine obstruktive Pyelonephritis, bis zur Urosepsis führen! Diagnostik: Anamnese und klin. Untersuchung (typische Klinik? Familiäre Disposition?) Urin: Sediment, pH, Kultur, 24 Std. Sammelurin. Sonographie: echoreicher Bezirk (Steindurchmesser > 2 – 3 mm) mit typischem dorsalen Schallschatten. Im Ureter sind Steine schlecht sonographisch nachweisbar. Harnstauungsniere ? aufgeweitetes Nierenbeckenkelchsystem mit Schallverstärkung hinter dem Nierenbecken. Röntgen-Leeraufnahme: Ca-haltige Steine sind röntgendicht, Harnsäuresteine nicht!! Ausscheidungsurographie: Nachweis der nicht sichtbaren Steine durch KM-Aussparung oder Abbruch der KM-Säule im Ureter. CAVE1: In der gestauten Niere kann es zu verzögerter KM Ausscheidung kommen, Spätaufnahme bis zu 24 h nach KM-Gabe erforderlich. CAVE2: Keine Kontrastmitteluntersuchung in der akuten Nierenkolik, da ein Abflusshindernis besteht und durch die Kontrastmittelgabe eine vermehrte Urinausscheidung erfolgt (diuretischer Effekt des KM), Folge können zunehmende Schmerzen und Fornix -Ruptur (Einriss des Nierenbeckens) sein. Computertomographie nativ: Sensitivste Methode zum Nachweis auch nicht röntgendichter Konkremente (Harnsäuresteine); höhere Strahlenbelastung und höhere Kosten als Ausscheidungsurographie Labor: Harnsäure (Norm 3 -6mg/dl) u. Kalzium (2,25-2,75 mmol/l), evtl. PTH. Therapie: 27 Bei einer akuten Nierenkolik steht die Therapie der Schmerzen im Vordergrund. Hierzu erfolgt eine symptomatische Infusionstherapie mit spas und analgetischer Medikation (Spasmoanalgesie). Z. B. Buscopan + Tramal od. Novalgin od. potente Opioide (z.B. Dipidolor). Erst bei Schmerzfreiheit sollte sich eine entsprechende Diagnostik anschließen (siehe oben). Meist kommt es bei Steinen mit einem Durchmesser < 6 mm im Verlauf zu spontanem Steinabgang. Hierbei ist eine erhöhte Flüssigkeitszufuhr sowie Bewegung dem spontanen Steinabgang förderlich („Saufen und Laufen“). Wenn ein Patient unter der Schmerzmedikation nicht oder nicht dauerhaft beschwerdefrei wird, ist es zur Schmerzbeseitigung notwendig, den Abfluss des Urins aus der Niere zu gewährleisten. Dieses erfolgt durch die transurethrale, zystoskopiegesteuerte Anlage einer Harnleiterschiene (DJ-Schiene, Pigtail), wobei gleichzeitig eine retrograde Diagnosesicherung erfolgen kann, oder die Anlage einer zur Nierenfistel (perkutane, ultraschallgesteuerte Punktion des aufgeweiteten Nierenbeckenkelchsystems, in der Regel über die untere Kelchgruppe). Urolitholyse: Bei kalziumfreien Harnsäure – und Cystinsteinen durch Harnalkalisierung (Ziel pH: 6,2 -6,8) mit Alkalizitraten möglich. Bei Hyperurikämie zusätzlich Urikostatika (Allopurinol, Zyloric). Stoßwellentherapie: Bis zu 90 % der nicht spontan abgehenden Steine sind damit behandelbar. ESWL (extrakorporale Stoßwellenlithotripsie): Über ein Gelk werden von außen 500 – 2500 fokussierte Stoßwellen abgegeben, wodurch der Stein in kleinere Konkremente zerfällt die dann spontan abgehen können. Bis zu 2 cm große Steine können auf diese Art behandelt werden. KI: Schwangerschaft, Gerinnungsstörungen. PCNL (perkutane Nephrolitholapaxie): Über eine perkutan nephroskopisch eingeführte Sonde werden Stoßwellen angewandt. Option bei Nierenbecken – oder Kelchausgusssteinen. Endourethrale Stoßwellenlithotripsie. Bei Blasensteinen können unter endoskopischer Kontrolle die Konkremente transurethral lithotripsiert und mittels Zange die Steinfragmente entfernt werden. Ureterorenoskopie (Harnleiterspiegelung) 28 Bei der Ureterorenoskopie wird transurethral mit einem semiregiden oder flexiblen optischem Instrument in den Harnleiter bzw. das Nierenbeckenkelchsystem eingegangen. Das Konkrement wird über das Instrument aufgesucht, mittels eines Körbchens eingefangen und anschließend entfernt. Ist eine Entfernung aufgrund der Größe primär nicht möglich, besteht die Möglichkeit, über das Instrument eine Laserfaser oder eine Sonotrode an den Stein heranzuführen und hierüber den Stein unter visueller Kontrolle zu zertrümmern und die Steinreste zu entfernen. Diese Methode kann sowohl bei Harnleitersteinen als auch bei Nierensteinen Anwendung finden, da durch die semiregiden und flexiblen Instrumente eine Ortung der meisten Konkremente möglich ist. Offen chirurgische Steinsanierung Die offene Steinchirurgie wird heute nur noch in weniger als 1 % der Fälle angewandt, kann aber zum Beispiel bei Versagen der oben genannten minimal invasiven Verfahren indiziert sein. Anwendung findet dieses Verfahren in erster Linie bei sehr großen Konkrementen oder anatomischen Verhältnissen, die ein anderes operatives Verfahren nicht möglich machen. Prognose: ¾ der Steine gehen spontan (mit konservativer Therapie) ab. Ohne Rezidivprophylaxe ist die Rezidivrate sehr hoch, 50 – 100 %. Rezidivprophylaxe: - aussreichende Trinkmenge (Harnfluss 2,5 – 3 l/Tag) - körperliche Aktivität, Gewichtsreduktion, Salzrestrikt Eine adäquate Empfehlung zur Risikominimierung basiert laststoffreiche Kost auf Laborwerten, der Zusammensetzung des Steines, und ggf. bekannten Begleiterkrankungen. 29 Erektile Dysfunktion (ED) Die erektile Dysfunktion, oder Erektionsstörung, ist definiert als die Unfähigkeit eine Erektion, die zum Geschlechtsverkehr ausreicht, zu erzielen bzw. zu halten. Ätiologisch spielen sowohl psychologische (oft Versagensängste, Depression) als auch organische Ursachen eine Rolle. Mögliche organische Veränderungen bzw. Grunderkrankungen die zu einer ED führen können sind unter anderem Diabetes mellitus, Hypertonie, Gefäßerkrankungen, Verletzungsfolgen oder operative Zustände. Ebenso können Nervenerkrankungen, z.B. Multiple Sklerose oder Spinalerkrankungen eine ED bedingen. In Deutschland haben insgesamt 20 % aller Männer, und ca. 40 % der Männer > 40 Jahre zeitweilig Probleme mit ihrer Erektion. Diagnostik: - Körperliche Untersuchung: Penis, Hoden, Nebenhoden, digital rektal, Leistenregion. - Medikamentenanamnese ( ß – Blocker?, TZA, SSRI, Lipidsenker...) und Sozialanamnese, am besten unter Einbeziehung der Partnerin. - Frage nach Alkohol -, Drogen - , Nikotinabusus. - Hormonbestimmungen (Testosteron, FSH, LH, Prolaktin) - Vorerkrankungen, neurologischer Status. - Labor: Schilddrüse, Leber- und Nierenwerte, Blutfette, Blutbild Therapie: An erster Stelle der Therapie steht die Beseitigung möglicher Risikofaktoren oder eine Umstellung der bisherigen medikamentösen Therapie (z.B. Wechsel des Antihypertensivums). Nach Ausschluss organischer Ursachen kann eine psychotherapeutische Intervention, z.B. als Paartherapie, hilfreich sein. Hierbei kann eine Kombination mit Medikamenten erfolgen. lokal: Vakuumerektionshilfen: Saugzylinder erzeugt Erektion, dann mittels komprimierbarem Ring gehalten wird, relativ gut wirksam (ca. 70 %) aber geringe Akzeptanz. medikamentös 30 oral: Phosphodiesterasehemmer (PDE), Kontraindikation KHK Patienten, die mit Nitraten behandelt werden. - Sildenafil (Viagra): 25 – 100 mg, 1 Std. vor Verkehr einnehmen. - Tadalafil (Cialis): 5 – 20 mg, wirkt bis zu 36 Std. - Vardenafil (Levitra): bei Bed. 10 – 20 mg, schneller Wirkungseintritt. intraurethral: Prostaglandin E1 Applikation od. MUSE = „medicaled urethral system for erection“ Alprostadil: initial 250 µg, Titrierung bis max. 1000 Max. 2 Anwendungen/Tag od. 7/Woche, UAW: häufig Penisschmerzen (30 %), Brennen beim Wasserlassen, vaginale Schmerzen bei der Partnerin. intrakavernös: SKAT = „Schwellkörper – Autoinjektionstherapie - Alprostadil (Caverject, Viridal): Selbstinjektion nach individueller Dosistitration verdünnt in ein Corpus cavernosum, Gerinnungsstatus vor der ersten Anwendung überprüfen. Bei allen medikamentösen Therapien ist auf die Gefahr ines Priapismus (Dauererektion mit Gefahr der Schwellkörperschädigung) hinzuweisen. operativ Schwellkörperprothese: Implantation einer flexiblen oder hydraulischen Prothese in den Penis. flexible Prothese: Nebenwirkungsarm (keine „mechanische“ Defekte) hydraulische Prothese: Pumpe im Skrotum, manuell von außen bedienbar, realitätsnah, häufiger Infekt ionen. 31 Prostatakarzinom Das Prostatakarzinom ist mit 19 % der Krebserkrankungen das häufigste nachgewiesene Karzinom des Mannes (gefolgt vom Bronchialkarzinom). In Deutschland werden jährlich ca. 40000 Neuerkrankungen registriert. Insgesamt betrachtet kommt das Prostatakarzinom noch häufiger vor, was Obduktionsbefunde zeigen: Bei 1/3 der 60 – jährigen und bis zu 90 % der 90 – jährigen findet sich ein latentes Prostatakarzinom, das keine Beschwerden verursacht und auch nicht zum Tod geführt hat. Das „Life – time – risk“ an einem klinisch manifesten Prostatakarzinom zu erkranken beträgt 10 %. Ätiologie: Über die Entstehung des Prostatakarzinoms herrscht noch weitgehend Ungewissheit. Da bei Eunuchen Prostatakarzinom so gut wie nicht vorkommen, heint eine androgene Stimulation zur Entstehung beizutragen. Verschiedene Gen – Mutationen werden diskutiert, z.B. im BRCA – 1 – Gen (verursacht bei Frauen Mammakarzinome), HPC1, HPC2, oder im HPCx Gen. Das Prostatakarzinom tritt familiär gehäuft auf, von Patienten erkranken dreimal häufiger. Eine fettreiche Ernährung, Sonneneinstrahlung und die damit verbundene Vitamin D Bildung sowie die Einnahme von Calcium scheinen das Entstehungsrisiko zu erhöhen. Pathologie: In 97 % der Fälle handelt es sich um ein Adenokarzinom, ausgehend von Epithelzellen der Prostatadrüsen. Makroskopisch zeigen sich gelbe oder grau – weißliche, derbe, unscharf begrenzte Herde. Mehrheitlich geht das Karzinom von den Epithelien der peripheren Drüsenanteile aus, zu etwa 85 % in den hinteren (rektalen) Anteilen der Vorsteherdrüse, und breitet sich in den äußeren Zonen des Organs aus. Zur Verlegung der Harnröhre mit des Harnlassens kommt es daher erst spät, meist nachdem die Organkapsel schon durchbrochen wurde. Per continuitatem breitet es sich auf die Bläschendrüsen, M. levator ani aus, selten werden auch Rektum, Urethra oder die Harnblase infiltr Metastasierung: hämatogen v.a. in Knochen, seltener Leber oder Lunge; lymphogen in iliakale LK, fortgeschritten auch in paraaortale und parakavale LK. 32 Einteilung: Adenokarzinome der Prostata werden nach TNM klassifiziert. Folgende Tabelle soll eine Übersicht geben, Unterstadien (z.B. T1a, T1b, etc.) werden hier nicht aufgeführt. T1: klinisch nicht erkennbarer Tumor, nicht tastbar, nicht bildgebend sichtbar T2: Tumor auf die Prostata begrenzt T3: Tumor durchbricht die Prostatakapsel T4: Infiltration von Nachbarorganen / - strukturen: Blasenhals, M. sphincter urethrae, Rektum... regionäre LK – Metastasen N1: M1a: nichtregionäre LK – Metastasen M1b: Knochenmetastasen M1c: andere Fernmetastasen, bzw. multiple Metastasen Grading, Gleason -Score Lange wurde zur Einstufung das sogenannte Grading-System der Weltgesundheitsorganisation WHO verwendet, abgekürzt mit dem Buchstaben G: Es beschreibt, wie stark sich die Tumorzellen mikroskopisch von normalen "ausgereiften" Zellen unterscheiden. Nach bestimmten Merkmalen teilt man in ier Grade von G1 bis G4 ein. Tumorzellen von Grad 1 (G1) sind gut differenziert, sie sind den normalen Zellen noch vergleichsweise ähnlich. Schlecht differenzierte Tumoren (G4) unterscheiden sich dagegen stark von normalen Zellen, sie wachsen besonders schnell und sind aggressiver als bei Grad 1. G2 und G3 liegen entsprechend dazwischen. International gebräuchlicher und heute auch in Deutschland Standard ist der sogenannte Gleason-Score, benannt nach dem amerikanischen Arzt Donald Gleason. Er beschreibt ebenfalls das Ausmaß der Abweichung der Tumorzellen Wachstumsmusters vom gesunden Gewebe. Dazu werden die beziehungsweise ihres einer Probe sichtbaren Zellen nach ihrem Aussehen in fünf verschiedene Gruppen eingeteilt und nach dem Grad ihrer Differenzierung mit einem Wert von 1 bis 5 belegt: • 1 steht für gut ausdifferenziert und damit einer gesunden Zelle bzw. gesundem Gewebe noch weitgehend ähnlich. • 5 steht für sehr wenig differenziert. 33 Für die klinische Bedeutung ist dabei der Punktwert, der bei einer großen Gruppe von Zellproben vorliegt, wichtiger als ein einzelner, auffallend abweichender Wert, der nur für wenige Zellen zutrifft. Daher werden nur die beiden größten Gruppen (die mit den meisten Zellen) für den Gleason -Score herangezogen. Zählt man ihre beiden Werte zusammen, erhält man den Score. Er kann also mindestens 2 und maximal 10 betragen, dabei ist 10 der ungünstigste Wert. Auch die beiden größten Gruppen werden noch gewichtet: Die Punktwerte erhalten eine Reihenfolge, die häufigere Wertung steht vor der selteneren. 4 plus 3 ist demnach ungünstiger als 3 plus 4 - bei der ersten Angabe wurde der Wert "4" in mehr Zellen gefunden als bei der zweiten Angabe, obwohl beide Male die Summe einen Gleason -Score von 7 ergibt. Klinik: Im Frühstadium verursacht das Prostatakarzinom keine Symptome, da es fast usschließlich in den urethrafernen peripheren Zonen entsteht. Das Zeitfenster, in dem ein Prostatakarzinom ohne Symptome besteht, wird auf 10 – 15 Jahre geschätzt. Symptome wie Blasenentleerungsstörungen, wie man sie von der BPH kennt, treten erst im fortgeschrittenen Stadium auf, ebenso wie Makrohämaturie oder Hämatospermie. In fortgeschrittenen Stadien können durch die lymphogene Metastasierung eine Harnabflussbehinderung der Nieren auftreten, was zu Schmerzen im Nierenbereich und einem postrenalem Nierenversagen führen kann. Weiterhin können durch ossäre Metastasen Rücken – oder Beckenschmerzen auftreten. Diagnostik: Da das Prostatakarzinom lediglich im Frühstadium auf Dauer geheilt werden kann, ist eine Früherkennung äußerst sinnvoll, wofür zudem ein exzellentes Instrumentarium zur Verfügung steht. Bei Männern sollte ab dem 45. Lj eine regelmässige dig l rektale Untersuchung und die Bestimmung des Serum PSA (prostataspezifisches Antigen) alle 2 Jahre erfolgen. PSA ist ein Glykoprotein das zur Verflüssigung des Samens beiträgt und in den Ductuli prostatae gebildet wird. Von der Kasse wird lediglich die digitale Untersuchung, nicht aber die PSA – Bestimmung übernommen. Der PSA-Wert ist nicht als Tumormarker anzusehen, sondern als Prostatamarker. Das bedeutet, dass neben dem prostatakarzinom auch andere Erkrankungen oder Ereignisse zu einer PSA-Erhöhung führen können (benigne Prostatahyperplasie, Prostatitis, digitale rektale Untersuchung, Harnwegsinfekt etc.). 34 Als oberer Normwert des PSA wird allgemein eine Wert von > 4 ng/ml angegeben, hierbei ist jedoch zu berücksichtigen, dass es auch altersspezifische Normwerte gibt, so dass bei jungen Männern bereits geringere Werte als auffällig angesehen werden müssen. Besteht aufgrund des PSA-Wertes, der digitorektalen Untersuchung oder anderweitigen diagnostischen Methoden der Verdacht auf das Vorliegen eines Prostatakarzinoms sollte eine Biopsie erfolgen. Prostatabiopsie: > 10 Stanzbiopsien transrektal od. perineal. Sonographie: Insbesondere transrektal (Tumor echoarm oder - reich möglich), heute auch endorektales MRT möglich. Bei PSA-Werten > 10 ng/ml und histologischen Nachweis eines Prostatakarzinoms sollte vor der Entscheidung über weitere therapeutische Massnahmen eine Skelettszintigraphie zum Ausschluss einer ossären Metastasierung durchgeführt werden. Therapie: Die Therapie richtet sich nach dem Tumorstadium, Diffe rungsgrad, Allgemeinzustand sowie Begleiterkrankungen des Patienten. Auch das Alter der Patienten ist entscheidend, bei über 70 – jährigen Patienten und histologisch gut differenziertem Tumor ist auch eine aktives Zuwarten gerechtfertigt (active surveillance), da das iko in den nächsten 10 Jahre an diesem Prostatakarzinom zu versterben lediglich 10 % beträgt. Für die Patienten bedeutet dies regelmässige PSA-Kontrollen sowie eine Re-Biopsie der Prostata im Verlauf, um eine Veränderung des Karzinoms in eine agressivere Form frühzeitig zu erkennen. Für jüngere Patienten gilt in der Regel: lokal begrenztes Karzinom: lokale Therapie (operative Strahlentherapie). fortgeschrittenes Karzinom: systemische Therapie (meist antiandrogene Behandlung). Operativ Radikale Prostatektomie: Vollständig Resektion der Prostata inklusive Kapsel und Samenbläschen = Prostatavesikulektomie inkl. regionärer Lymphadenektomie. Ist indiziert, wenn Lymphknoten – und Fernmetastasen bildgebend ausgeschlossen sind und der Tumor die Organgrenzen noch nicht überschritten hat. Die OP kann retropubisch, perineal oder laparoskopisch durchgeführt werden. In Abhängigkeit vom Tumorstadium kann bei den operativen Eingriffen das periprostatisch verlaufende Gefäß -Nerven -Bündel (Walshe´ Bündel) einseitig oder doppelseitig erhalten 35 werden, was einen positiven Einfluss auf die postoperative Erektionsfähigkeit vermutlich auch Kontinenzfähigkeit hat. Strahlentherapie: Die Strahlentherapie kann als externe Strahlentherapie oder als interstitielle Strahlentherapie (Brachytherapie) durchgeführt werden. Die perkutane Strahlentherapie stellt das klassische Bestrahlungsverfahren beim Prostatakarzinom dar und kann ambulant durchgeführt werden. Es wird über einen Zeitraum von etwa 7 – 8 Wochen fünf Mal wöchentlich bestrahlt. Low – dose – Brachytherapie: kleine Strahlenkörper (radioaktive Seeds) werden ultraschallgesteuert dauerhaft in die Prostata implantiert. Ind: Prostatakarzinom auf einen Seitenlappen begrenzt, Prostatavolumen > 20 ml und < 50 ml, PSA < 10, Gleasonscore = 7 High – dose Brachytherapie: Über perineal in die Prostata eingestochene Hohlnadeln wird eine Strahlenquelle in die Prostata eingeführt und nac vorgegebener Bestrahlungszeit wieder entfernt, d. h. dass in einer kurzen Zeit eine hohe Strahlendosis an der Prostata appliziert wird. Die HDR- Brachytherapie wird ggf. mit einer perkutanen Bestrahlung kombiniert. Ind: T3 – Prostatakarzinome. Hormontherapie: Ziel der Hormontherapie ist die Suppression der androgenen Stimuli. 1941 hat der Nobelpreisträger Huggins gezeigt, dass der Entzug androgener Substanzen zu einer Rückbildung sowohl der gesunden Prostata als auch des ostatakarzinoms führt. Im Gegenzug kann Testosteron zu einem Wachstumsschub bei dem Prostatakarzinom führen. - GnRH – Analoga: Zunächst Anstieg des Serum – Testosteron – Spiegels (Flare-upPhänomen, kann durch eine passagere parallele Gabe von Antiandrogenen supprimiert werden), dann Abfall des Testosterons in den Kastrationsbereich. Präp: Goserelin, Buserelin, Leuprorelin. - GnRH-Antagonisten: zügiger Abfall des Testosterons in den Kastrationsbereich (kein Flare -up-Phänomen) - Antiandrogene: nichtsteroidale Antiandrogene hemmen die Aufnahme bzw. die Bindung von Testosteron oder DHT an Zellrezeptoren. Serum – Testosteron – Spiegel wird nicht gesenkt. Präp: Flutamid, Nilutamid, Bicalutamid. 36 - Cyproteronacetat ist ein Gestagen und hemmt die Testosteronbildung in den Leydig – Zellen der Hoden. - Plastische Orchiektomie beidseits: Unter Belassung der Hodenhüllen und der Nebenhoden wird das androgenproduzierende Hodengewebe ausgeschält. Senkung des Testosteron – Spiegels auf Kastrationsniveau, d.h. 10 % des Normwertes. - Orchiektomie beidseits Die Hormontherapie kommt in aller Regel bei Patienten Anwendung, bei denen ein metastasiertes Prostatakarzinom vorliegt oder bei denen nach Durchführung einer primär kurativen Therapie (radikale Prostatovesikolektomie/Strahlentherapie) Hinweise auf einen Progress der Erkrankung bestehen (PSA-Rezidiv, biochemisches Rezidiv). Nebenwirkungen der Hormontherapie: Libido -/Potenzverlust, Osteoporose, Anämie, Hitzewallungen Prognose: 5 – JÜR aller Prostatakarzinome 70 %. (T1 – T2 90 %, T3 – M1 40 %) perioperative Letalität 0,3 % Nachsorge: Bestimmung des PSA als Rezidivparameter, nach rad. Prostatektomie sollte der PSA unter der Nachweisgrenze liegen. Ein Wiederanstieg des PSA auf Werte > 0,1 ng/ml ist ein Hinweis auf Rezidiv od. Metastasierung. Nichtrauchen. Raucher haben ein 3,2 % höheres Risiko an einem Prostatakarzinom zu versterben. 37 Metastasiertes Prostatakarzinom Metastasierung: hämatogen v.a. in Knochen, seltener Leber oder Lunge; lymphogen in iliakale LK, fortgeschritten auch in paraaortale und parakavale LK. Ein metastasiertes Prostatakarzinom ist in aller Regel nicht kurativ therapierbar. Wenn bei einem Patienten Metastasen nachgewiesen wurden, ist die Therapie der Wahl eine Hormontherapie. Hierdurch kann ein Fortschreiten der Erkrankung teilweise mehrere Jahre verhindert werden. Unter der Hormontherapie sind regelmässige PSA- und Testosteron(Überprüfung der chemischen Kastration) –kontrollen notwendig. Sollte unter der Hormontherapie ein weiterer Progress der Erkrankung (castrationsresistentes Prostatakarzinom) zu verzeichnen sein, ist eine komplette Androgenblockade (z. B. Goserelin + Bicalutamid) angezeigt, um neben einer Blockade der Androgenrezeptoren auch die testikulären und adrenalen Androgene zu hemmen. Bei einem weiteren Progress des Tumorleidens unter maximaler Androgenblockade kommen sekundäre Hormonmanipulationen (anderes Antiandrogen gleicher Klasse, Östrogene, Korticosteroide etc.), eine Chemotherapie oder palliative Maßnahmen zur Anwendung. Chemotherapie: Den aktuellen Standard in der Chemotherapie des metastasierten Prostatakarzinoms stellt die Medikation mit Docetaxel und Prednisolon in einem 3-Wochen-Schema dar. Palliative Therapie • Schmerztherapie • Externe Strahlentherapie • Bisphophonate • Radionuklidtherapie 38 Nierenzellkarzinom Das Nierenzellkarzinom ist ein Adenokarzinom und geht den Tubuluszellen aus. Es macht 3 % aller bösartigen Tumoren bei Erwachsenen aus und wird bei etwa 9 von 100000 Einwohnern jährlich diagnostiziert. Betroffen sind vorwiegend Menschen im 5. und 6. Lebensjahrzehnt, Männer erkranken 3 mal häufiger als Frauen. Das Nierenzellkarzinom macht 85 % aller Nierentumoren beim Erwachsenen aus. Im Kindesalter ist der WILMS – Tumor häufigster Nierentumor und macht 6 – 8 % aller Tumoren im Kindesalter aus. Ätiologie: Das Nierenzellkarzinom tritt am häufigsten sporadisch Patienten mit einer chronischen Niereninsuffizienz haben ein erhöhtes Risiko. Als Risikofaktoren werden Nikotin (> 20 py), arterielle Hypertonie, fettreiche Kost, Übergewicht (bei Frauen( und hormonelle Einflüsse (bei Männern) diskutiert. Ca. 5 % der Fälle sind hereditär. Pathologie: Das Nierenzellkarzinom entsteht meistens in einem Nierenpol. Auf hämatogenem Weg metastasiert es bevorzugt in die Lunge, das Skelett, die Leber und das Gehirn. Per continuitatem ist eine Ausbreitung auf umliegende Organe wie Leber, Milz, Pankreas oder Kolon möglich, sowie eine Gefäßinfiltration, z.B. V. renalis oder V. cava inf. Das Nierenzellkarzinom wird nach TNM unterteilt: TNM für Nierenzellkarzinome nach UICC 2002 TX Primärtumor kann nicht beurteilt werden T0 Kein Anhalt für Primärtumor T1 Tumor <= 7 cm in größter Ausdehnung, begrenzt auf die Niere T1a Tumor 4 cm oder weniger in größter Ausdehnung T1b Tumor mehr als 4 cm, aber nicht mehr als 7 cm in größter Ausdehnung T2 Tumor > 7 cm in größter Ausdehnung, begrenzt auf die Niere T3a Tumor infiltriert Nebenniere oder perirenale Fettkapsel, aber nicht Gerota’sche Faszie T3b Tumorausbreitung in Nierenvenen oder Hohlvene unterhalb des Zwerchfells T3c Tumorausdehnung in Hohlvene oberhalb des Zwerchfells 39 T4 Tumorausdehnung über Gerota’sche Faszie hinaus NX Benachbarte (regionäre) Lymphknoten sind nicht beurteilbar N0 Kein Anhalt für benachbarte Lymphknotenmetastasen N1 Metastase in einem benachbarten Lymphknoten N2 Metastase in mehr als einem benachbarten Lymphknoten Mx Vorliegen von Fernmetastasen kann nicht beurteilt werden M0 Kein Anhalt für Fernmetastasen M1 Fernmetastasen treten am häufigsten in der Lunge, im Skelett und in den Lymphknoten, eher selten im Gehirn und in der Leber auf. Im klinischen Alltag ist inzwischen auch die Stadieneinteilung nach UICC gebräuchlich I: T1 N0 M0 II: T2 N0 M0 III: T3 N0 M0 – T1-3 N1 M0 IV: alle T4, alle N2, alle M1 Klinik: Da das Frühstadium asymptomatisch ist, sind über die Hälfte der Nierenzellkarzinome Zufallsbefunde (Sonographie, CT). Ein alarmierendes Krankheitszeichen ist eine klinisch asymptomatische schmerzlose Hämaturie, was jedoch auch kein Frühsymptom mehr darstellt. Weitere Symptome wie Flankenschmerz, Gewichtsverlust und Temperaturerhöhung sind unspezifisch. In Abhängigkeit von den T – Stadien sind in bis zu 5 % der Fälle paraneoplastische Veränderungen nachweisbar: metabolisch: sog. Stauffer – Syndrom (erhöhte AP, Verlängerung der Prothrombinzeit, Dysproteinämie) hämatologisch: Polyglobulie (1 – 5 %) endokrin: Hypertonie (Renin), Hyperkaliämie (ACTH), Hyperkalzämie (PTH). neuromuskulär. Diagnostik: Neben der körperlichen Untersuchung und einer Blut- und Urinuntersuchung sind bildgebende Verfahren wie z.B. die Ultraschalluntersuchung zur Darstellung oder zum Ausschluss des Tumors notwendig. In der Bildgebung können weiterhin die Infiltration 40 umgebender Organe oder eine bereits vorhandene Absiedlung (Metastasen) des Tumors festgestellt werden. Bestätigt sich der Verdacht auf einen Nierentumor, erfolgen weitere bildgebende Untersuchungen wie eine Computertomographie (CT) des Bauches und Beckens, eine Skelettszintigraphie, eine Röntgenuntersuchung oder CT des Brustkorbes sowie eine Kernspintomographie (MRT) oder ein CT des Schädels. In seltenen Fällen kann eine Angiographie oder ein Ausscheidungsurogramm zur Diagnosestellung durchgeführt werden. Therapie: Therapie der Wahl beim Nierentumor ist die operative Therapie. • Radikale Tumornephrektomie bei großen Tumoren > 4 cm: Fettkapsel mit der Fascia renalis + ggf. Nebenniere. D iere + perirenale radikale Nephrektomie kann transperitoneal, retroperitoneal, oder laparoskopisch, seltener thorakoabdominal durchgeführt werden. • Nierentumorresektion/-enukleation: Bei Tumoren < 4 cm und/oder peripher gelegenen Tumoren < 7cm ist diese Operation Therapie der Wahl. Nichtoperative Therapie: Die adjuvante Strahlentherapie hat zu keiner Verbesserung der Überlebensraten geführt. Das Nierenzellkarzinom ist nicht chemotherapiesensibel; Immuntherapiekonzepte und „target spezifische Methoden es werden derzeit im Rahmen von Studien überprüft. Prognose: Bis T2 ohne Metastasen: 5 – JÜR 65 %; bei V. cava Infiltration 35 %; bei T4 15 %. 41 metastasiertes Nierenzellkarzinom Das metastasierte Nierenzellkarzinom hatte bis vor einigen Jahren eine sehr schlechte Prognose, da dieser maligne Tumor als strahlen - und zytostatikaresistent angesehen werden muss. Die Überlebensrate korrelierte hierbei mit verschiedenen Faktoren, die von Motzer 1999 publiziert wurden: 1. Niedriger Karnofsky Index (Performance Status < 80%) 2. Hohe Laktatdehydrogenase-Spiegel (> 1,5 x OGN) 3. Niedrige Hämoglobin -Serumspiegel (< UGN) 4. Hohe korrigierte Serum Calciumkonzentrationen (> 10 mg/dl) 5. Zeitraum < 1 Jahr zwischen Diagnose und syst. Therapie (6. > 2 Organe metastasiert (zusätzlich zur Beurteilung von „poor prognosis“ -Patienten) 0 1 oder 2 3 bis 5 niedrig mittel hoch Mediane Überlebenszeit 20 Monate 10 Monate 4 Monate Patientenverteilung 25% 53% 22% Anzahl der prognostischen Faktoren Diese Faktoren werden auch heute noch in der Beurteilung der Prognose eingesetzt, wobei sich die Prognose inzwischen seit Einführung neuer Therapieformen, die zum größten Teil über eine Hemmung der Gefäßneubildung wirken, deutlich verbessert hat. - Tyrosinkinaseinhibitoren (Sunitinib, Sorafenib, Pazopanib) - VEGF-Antikörper (Bevacizumab) - mTOR-Inhibitoren (Everolimus, Temsirolimus) Nebenwirkungen dieser Präparate sind je nach Substanzgruppe insbesondere: 42 Hypertonus, Hypothyreose, Hand -Fuss-Syndrom, Mukositis, Fatigue, Diarrhoe, Wundheilungsstörungen, Pneumonitis Trotz der deutlichen Verbesserung der Prognose durch diese Präparate ist eine Heilun g durch diese Medikation in aller Regel nicht möglich. Daher ist bei solitären Metastasen weiterhin Therapie der Wahl die Metastasenresektion. Weiterhin g lt, dass auch im metastasierten Stadium die Durchführung einer Tumornephrektomie prinzipiell indiziert ist, da hierdurch eine Verbesserung des Gesamtüberlebens erreicht werden kann. Nach Literatur kann es bei bis zu 5% der Patienten nach Durchführung einer Nephrektomie zur Spontanremission der Metastasen auch ohne weitere Therapie kommen. 43 Hodentumoren Hodentumoren machen etwa 1 % aller Tumoren des Mannes us. 3500 Männer erkranken jährlich in Deutschland, davon versterben 180 – 300. Der Hodentumor ist noch vor den Leukämien und Hodgkin – Lymphomen der häufigste maligne Tumor bei jüngeren Männern. Der Häufigkeitsgipfel liegt zwischen dem 20. und 40. LJ, im Zeitraum der maximalen sexuellen Aktivität. Ätiologie: Die Ursache ist häufig unbekannt. Ein wichtiger bekannter Risikofaktor ist der Kryptorchismus (Hodenhochstand = Maldescensus testis) Erkrankungsrisiko als bei normotopen Hoden. Auch nach einem 4 – 30 fach höheren Orchidopexie bleibt ein erhöhtes Risiko bestehen. Eine X – chromosomal mütterlicherseits vererbte Mutation im Gen TGCT1 bringt sogar ein 50fach höheres Erkrankungsrisiko mit sich. Weitere Risikofaktoren sind kalorienreiche Ernährung im Kindesalter, mütterlicher Nikotinkonsum vor/während der Schwangerschaft, Hodentraumata. Pathologie: In 95 % der Fälle sind die Tumoren maligne, maligne Vorstufe ist die TIN (testikuläre intraepitheliale Neoplasie) mit einer fast 100 %igen Entartungswahrscheinlichkeit. Wiederum 95 % der malignen Tumoren gehen von den Keimzellen aus, sogenannte germinative Hodentumoren. Diese lassen sich in Seminome (50 % d. F.) und Nichtseminome (Teratokarzinome, embryonale Karzinome, Chorionkarzinome) unterteilen. Die nicht germinativen Hodentumoren (= gonadale Stromatumoren) machen 4 % der malignen Hodentumoren aus. Hierzu zählen LEYDIG – Zelltumor, SERTOLI – Zelltumoren, Granulosazelltumoren. Sie sind oft nur niedrig maligne. Die Metastasierung erfolgt fast ausschließlich lymphogen in die paracavalen, paraaorta retroperitonealen Lymphknoten. Die erste LK – Station liegt am Abgang der Nierengefäße. Eine Ausnahme hinsichtlich der Metastasierung stellen die Chorionkarzinome dar, die primär hämatogen in Lunge und Gehirn metastasieren. Klinik: - schmerzlose einseitige Hodenvergrößerung 44 - Schweregefühl im Skrotum - ziehende Schmerzen im Samenstrang durch die Gewichtszunahme des Hodens - Rückenschmerzen bei mögl. retroperitonealen Metastasierung - Gynäkomastie Diagnostik: Klinische Untersuchung mit der Frage einer Verhärtung am Hoden. Sonographie: Tumor meist echoärmer als Hodengewebe, oder gemischt echoreich/echoarm. Mikrokalzifikationen. Laborchemisch, zur Prognose und Verlaufskontrolle, sollten präoperativ bestimmt werden: ß – HCG (HWZ 24h), AFP (HWZ 5 – 7 d), LDH. Staging und Metastasenausschluss mittels CT od. MRT von Thorax und Abdomen. Therapie: Jeder solide Tumor mit Malignitätsverdacht sollte operiert werden. - Orchiektomie (Semikastration, Ablatio testis), inguinaler Zugang, Samenstrang + Hodenentfernung. CAVE: bei skrotalem Zugang Eröffnung eines anderweitigen Lymphabflussgebietes, so dass dann im Verlauf auch inguinale LK-Metastasen auftreten können. - Bei CIS und Tumoren < 2 cm ist eine reine Tumorexzision vertretbar. (postop. Radiatio) - Zum Ausschluss einer TIN der Gegenseite grundsätzlich kontralaterale Hodenbiopsie Abhängig vom Tumortyp und Stadium sind postoperativ we re Maßnahmen wie Nachbestrahlung und Polychemotherapie sowie ggf. eine operati Entfernung von Metastasen indiziert. Prognose: Seit Einführung der cisplatinbasierten Polychemotherapie sehr gut. Die 5 JÜR aller Hodentumoren liegt bei 93 % 45 Harnblasenkarzinom Harnblasenkarzinome sind in 95 % der Fälle Urothelkarz überwiegend mit papillärem Wachstumsmuster mit mehr als 8 übereinander liegenden ellschichten. Selten treten Plattenepithelkarzinome und Adenokarzinome z. B. Urachuskarzinome auf (5 %). Häufigkeitsgipfel liegt im 5. - 6. 3 % aller bösartigen Tumore sind Harnblasenkarzinome, Lebensjahrzehnt, Männer sind 3mal häufiger betroffen als Frauen. Ätiologie: Größter Risikofaktor ist das Rauchen mit einem bis zu höheren Risiko. Zwischen Einwirkung der Kanzerogene und Tumorentstehung wird eine Latenzzeit von > 10 – 20 Jahre angenommen. Bestimmte Berufsgruppen, z.B. aus der chemischen, gummiverarbeitenden, Farb-/Druck-/Textilindustrie u.a., mit Kontakt zu aromatischen Aminen, haben ein teilweise 200fach höheres Risiko. Weitere Risikofaktoren sind chronische Zystitiden, Bilharziose, Cyclophosphamid und vorangegangene Radiatio im kleinen Becken (insb. bei Zervixkarzinom). TNM-Klassifikation T/pT Beschreibung des P rimärtumors T0 Kein Anhalt für Primärtumor Tis Carcinoma in situ: "flacher Tumor", d.h. nicht exophytisch, nicht infiltrativ Ta exophytisch, nicht infiltrativ T1 Invasion in die Lamina propria T2 Tumor infiltriert Muskulatur T2a Tumor infiltriert oberflächliche Muskulatur (innere Hälfte) T2b Tumor infiltriert tiefe Muskulatur (äußere Hälfte) T3 Tumor infiltriert perivesikales Gewebe T3a mikroskopisch T3b makroskopisch T4 Invasion in Nachbarorgane T4a Prostata, Uterus, Vagina T4b Bauch- oder Beckenwand TX Angaben zur Infiltration können nicht gemacht werden 46 Regionäre Lymphknoten sind die iliakalen und pelvinen Lymphknoten unter der Bifurkation der A. ilica communis. N Regionäre Lymphknoten NX Regionäre LK können nicht beurteilt werden N0 Kein Anhalt für regionäre LK N2 Metastase in solitären KK >2 cm, aber <5 cm in größter Ausdehnung oder multiple LKn, keiner mehr als 5 cm N3 Metastasen in LK's >5 cm in größter Ausdehnung Fernmetastasen finden sich vor allem in Lunge, Leber und Knochen Klinik: - schmerzlose Hämaturie ist das typische Erstsymptom - zystitische und dysurische Beschwerden können ein Karzinom maskieren - später Flankenschmerz, Gewichtsabnahme, Anämie Diagnostik: - Anamnese und klinische Untersuchung (seit wann Blut im in? Bimanuelle Tastuntersuchung) - Urin: Blutnachweis. Jede Makrohämaturie ist tumorverdächtig!!, aber auch jede Mikrohämaturie sollte kontrolliert und ggf. weiter abgeklärt werden - Sonographie bei gefüllter Blase - Zystoskopie: obligat bei jeder schmerzlosen Hämaturie - Ausscheidungsurogramm zum Ausschluss einer tumorbedingten Harnabflussverzögerung und eines Primär-bzw. eines Zweittumors im oberen Harntrakt - CT / MRT Therapie: Bei Verdacht auf einen Blasentumor ist prinzipiell primär die Zystoskopie und Resektion des Tumors inkl. Proben der Randbereiche und des Tumorgrun rt. 47 Je nach histologischem Befund muss dann über das weitere Vorgehen entschieden werden. Hierzu kommen Chemotherapeutika neben und der Nachsorge Instillationstherapien Immuntherapeutika zur mit Rezidivprophylaxe lokal wirksamen sowie operative Maßnahmen in Betracht. pTa, G1 Erstbefund: Nachsorge pTa, G1 Rezidiv: Mitomycininstillation pTa, G2: transurethrale Nachresektion und nachfolgend Mitomycininstillation pT1, G1 -2: transurethrale Nachresektion und nachfolgend Mitomycininstillation pTa/pT1, G3: Nachresektion und n achfolgend BCG-Instillation pT2: Zystektomie lokale Instillation von Chemotherapeutika (Mitomycin, Adriamycin, Epirubicin) lokale Instillation von BCG (Bacille-Calmette-Guérin) = Lebend -Impfstoff gegen TBC Mehrfache Wiederholung der Instillationen über 6 Mon. bei Chemotherapie und lebenslang bei BCG. 46 Radikale Zystektomie, Harnblase + distale Ureteren, Prostata und Samenbläschen bzw. Uterus und 2/3 der Urethra. Lymphadenektomie. Im Anschluss an die radikale Zystektomie erfolgt noch eine Harnableitungs – OP: kontinente Harnableitung: - Harnleiterdarmimplantation - Neoblase (Darmblasenanschluss an die Harnröhre) - Pouch: Darmblasenanschluss an die Haut mit zu katheter ierendem Stoma inkontinente Harnableitung: - Harnleiter – Haut – Fistel - Ileum Conduit: ständig Urinbeutel erforderlich Eine Radiatio verbessert die Prognose nicht! Prognose: 5 JÜR aller Harnblasenkarzinome bei Männern 78 % und bei Frauen 63 %. 48