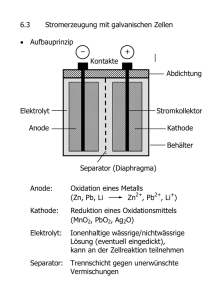
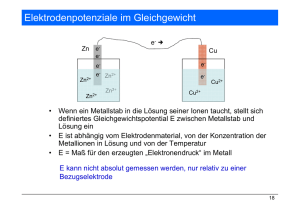
Elektrodenpotentiale
Werbung

Elektrodenpotentiale Das Zustandekommen von Elektrodenpotentialen Elektrischer Strom (= Transport von Ladungen ) kann nur erfolgen, wenn ein elektrischer Potentialunterschied (Gradient) vorhanden ist. Analog: Stofftransport kann nur erfolgen, wenn ein Gradient eines Potentials vorhanden ist, das man chemisches Potential µ nennt: Def.: µi = µ0i + RTlnai Erläuterung: µi ist die Energie, die benötigt wird, um 1 Mol der Komponente i aus dem wechselwirkungsfreien Unendlichen in das Innere einer Mischphase (= Lösung ) zu bringen. ( z. B. Cu2+-Ionen in eine CuSO4-Lösung ) Bsp.: 2 Lösungen, die Cu2+-Ionen in unterschiedlicher Konzentration enthalten, grenzen aneinander Cu2+ Cu2+ c1 c2 c2 > c1 => a2 > a1 µ2 > µ1 Stofftransport von links nach rechts Irgendwann gilt: µ1 = µ2 = chemisches Gleichgewicht aber Bsp. 2: Cu-Stab taucht in eine Cu2+-Lösung ein ( Metallionen-Elektrode, Elektrode 1. Art ) im Moment des Eintauchens gilt: µ Cu2+ (Metall) = µ Cu2+ (Lösung) =>Stofftransport setzt ein ( Metallauflösung oder Metallabscheidung ) aber Chem. Gleichgewicht kann nicht erreicht werden, da sich zwischen Stab und Lösung eine elektrische Potentialdifferenz einstellt. Erläuterung zur Ausbildung der Potentialdifferenz Fallunterscheidung a): µ Cu2+ (Metall) > µ Cu2+ (Lösung) => Metallauflösung ( Me Mez+ + z e- ) Ergebnis: + + + + - - + + + + Lösungsgrenzschicht wird positiviert, Stab negativiert = elektrolytische Doppelschicht eine weitere Auflösung wird wegen der elektrostatischen Rückhaltekräfte verhindert a): µ Cu2+ (Metall) < µ Cu2+ (Lösung) => Metallabscheidung aus der Lösung ( Mez+ + z e- Me) Ergebnis: - - + + + + + + + + - Lösungsgrenzschicht wird negativiert, Stab positiviert = elektrolytische Doppelschicht eine weitere Auflösung wird wegen der elektrostatischen Rückhaltekräfte verhindert => das chemische Gleichgewicht kann in beiden Fällen nicht erreicht werden Dennoch wird ein Gleichgewichtszustand erreicht = das elektrochemische Gleichgewicht ( GalvaniPotential ) Bei einem elektrochemischen Gleichgewicht sind zusätzlich zum chemischen Potential auch die elektrischen Potentiale zu berücksichtigen => µ*Cu2+ (Stab) = µ Cu2+ (Stab) + z*F*ϕ chem. elektrochem. Potential mit z = Ladungszahl des Ion ; F=Faraday-Konstante ( 96485,33 C/mol ) ϕ = elektrischen Potential = µ0 Cu2+ (Stab) + RTlnaCu2+ + z*F*ϕ = η = elektrochem. Potential Allgemein: ηi=µi +zi*F*ηi Gleichgewichtsbedingung für das elektrochem. Potential η Cu2+ (Metall) = η Cu2+ (Lösung) allgemein η1 = η2 η ι (Ι) = η i (II) Allgemeiner Fall: Metall-Stab taucht in die Lösung seiner Ionen. Im elektrochemischen Gleichgewicht gilt: η ι (Ι) = η i (II) bzw. η Mez+ (Metall) = η Mez+ (Lösung) η Mez+ (Metall) = µ Mez+ (Me) + z*F*ϕ (Me) η Mez+ (Lsg) = µ Mez+ (Lsg) + z*F*ϕ (Lsg) im Gleichgewicht: µ Mez+ (Me) + z*F*ϕ (Me) = µ Mez+ (Lsg) + z*F*ϕ (Lsg) => z*F*ϕ (Me) - z*F*ϕ (Lsg) = µ Mez+ (Lsg) - µ Mez+ (Me) => z*F (ϕ (Me) - ϕ (Lsg)) = µ0Mez+ (Lsg) - µ0Mez+ (Me) + RT*ln aMez+ (Lsg)/a Mez+ (Me) => ϕ (Me) - ϕ (L) = (µ0Mez+ (L) - µ0Mez+ (Me))/ z*F + RT/z*F*ln aMez+ (L)/a Mez+ (Me) Übereinkunft: a Mez+ (Me) =1 => ϕ (Me)- ϕ (L) = (µ0Mez+ (L)-µ0Mez+ (Me))/ z*F+RTln aMez+ (L) =∆ϕ00 =∆ϕ0 => ∆ϕ0 = ∆ϕ00 +RT/zF*ln aMez+ (L) mit : ∆ϕ0 = Gleichgewichtspotential ∆ϕ00 = Standardpotential, Normalpotential Nernst´sche Gleichung für Redoxelektroden Redoxelektrode Pt oder anderes inertes Metall Redox-System Sox + e- Sred im Gegensatz zur Metallionenelektrode werden hier Elektronen zwischen beiden Phasen ausgetauscht. In diesem Fall ist das chem. Potential der Elektronen zu beachten Im Moment des Eintauchens gilt:, analog zur Metallionen elektrode: µ e- (Metall) = µ e- (Lösung) => Ausgleichsreaktionen setzen ein - Ausbildung einer elektrolytischen Doppelschicht Ausbildung eines elektrochemischen Gleichgewichts η e- (Me) = η e- (Lsg) η e- (Me) = µ0e- (Me) + RT*lnae-, Me+ z*F*ϕ (Me) η e- (Lsg) = µ0e- (Lsg) + RT*lnae-, Lsg + z*F*ϕ (Lsg) Nach Gleichsetzen und Differenzbildung (s.o.) ergibt sich: axox RT ∆ϕ0 = ∆ϕ00 + *ln zF ayred Nernst´sche Gleichung Redox-Elektroden mit aox = Aktivität der oxidierten Komponente ared = Aktivität der reduzierten Komponente Gaselektroden ( spezielle Redoxelektroden): Allgemein: z.B. Chlorelektrode: Cl2 + 2 e- 2 Cl- Inerte Metallelektrode taucht in eine Lösung mit ChloridIonen und wird gleichzeitig permanent von Chlorgas umspült. Ergebnis ( s.o.) RT ∆ϕ0 = ∆ϕ00 + aCl2 *ln zF a2Cl- da a (Gas) proportional p ( Gas) RT ∆ϕ0 = ∆ϕ00 + ∆ϕ0 = ∆ϕ00 + pCl2 *ln zF a2Cl- RT p1/2Cl2 oder *ln zF aCl- d.h. Gleichgewichts-Galvanispannung kann über den Gasdruck gesteuert werden Wasserstoff-Elektrode (Wasserstoff-Normalelektrode) Wie oben: Pt-Elektrode in saurer Lösung ( H3O+) wird von Wasserstoff ( H2 )umspült Redox-Vorgang: 2 H3O+ + 2e- H2 + 2 H2O Ergebnis: RT ∆ϕ0 = ∆ϕ00 + a H3O+ *ln zF p1/2H2 Normierung: a H3O+ = 1 mol/l p1/2H2 = 1 atm => ln 1 = 0 RT ∆ϕ0 = ∆ϕ00 + *ln 1 => zF ∆ϕ0 = ∆ϕ00 mit ∆ϕ00 = 0 ( Definition ) ∆ϕ0 = 0 V (Standard-Wasserstoffelektrode ) Elektroden 2. Art (Bezugselektroden ) Metallionen-Elektroden, die in eine Lösung eintaucht, die ein schwerlösliches Salz des Elektrodenmetalls enthält ^ Agl KCl AgCl Für eine Silberelektrode gilt: Ag RT => ∆ϕ0(AgIAgClICl-) = ∆ϕ00(AgIAgCl) + Ag+ + e*ln a Ag+ F Ist ein AgCl-Bodenkörper vorhanden, gilt für das Löslichkeitsprodukt L (AgCl) = cAg+* cCl- ( c ungefähr = a) => aAg+ = L(AgCl)/ aCloben eingesetzt RT ∆ϕ0(AgIAgClICl-) = ∆ϕ00(AgIAgCl) + F RT *ln L(AgCl) - F *ln a Cl- RT ∆ϕ00(AgIAgCl) + *ln L(AgCl) F = const. RT ∆ϕ0(AgIAgClICl-) = ∆ϕ00(AgIAgClICl-) - F *ln a Cl- Potential einer Bezugselektrode kann durch Zugabe von z. B. KCl gesteuert werden Messung von Potentialen Galvani-Potential zwischen Metall und Lösung kann messtechnisch nicht erfasst werden Potentialdifferenz zwischen zwei Elektroden kann jedoch bestimmt werden Potentialverteilung im System Me1IElektrolytIMe2 Me1 Elektrolyt Me2 Phasengrenzen ϕ (Me1) ϕ1−∆ϕ2=ϕ (Me1)- ϕ (Me2) ∆ϕ1 ϕ (Me2) ∆ϕ2 ϕ (Elektrolyt) Durchführung der Messung von (ϕ (Me1)- ϕ (Me2)) Hochohmiges Voltmeter ( damit ist Stromlosigkeit gegeben (i=0 )) Stromlose Messung erfasst Potentialdifferenz zwischen zwei Elektroden, an denen elektrochemisches Gleichgewichte bestehen ( nur im Gleichgewicht gilt Nernst´sche Gleichung ) Dann gilt : Differenz zweier Galvani-Spannungen = Klemmenspannung = elektromotorische Kraft EMK ϕ (Me1)- ϕ (Me2) = UKl = EMK solche Konstruktion ist eine galvanische Zelle/ ein galvanisches Element EMK = ϕ (Me1)- ϕ (Me2) - RT/yF*ln aMe2 = ∆ϕ00(Me1)−∆ϕ00(Me2) +RT/zF*ln aMe1 Galvanische Zellen Ionenbrücke: z. B. poröse Trennwand ( Fritte ): verhindert eine schnelle Drchmischung, erlaubt aber Ionenwanderung Beispiel: Cu-Zn-Element: Zink-Elektrode ( unedleres Metall) in 1M ZnSO4 I Kupfer-Elektrode ( edleres Metall) in 1M CuSO4 Darstellung des Zellensymbols Zn I Zn2+ (1M ) I Cu2+ (1M ) I Cu Symbol für die Phasengrenzen EMK = ϕ (rechts)- ϕ (links) = ∆ϕ = ∆ϕ00(Cu/CU2+)−∆ϕ00(Zn/Zn2+) +RT/2F*ln acu2+ - RT/2F*ln aZn2+ = ∆ϕ00(Cu/CU2+)−∆ϕ00(Zn/Zn2+) +RT/2F*ln acu2+ - RT/2F*ln aZn2+ = ∆ϕ00(Cu/CU2+)−∆ϕ00(Zn/Zn2+) +RT/2F*ln aCu2+/ aZn2+ = ∆ϕ00(Cu/CU2+)−∆ϕ00(Zn/Zn2+) +RT/2F*ln 1 EMK = ∆ϕ00(Cu/CU2+)−∆ϕ00(Zn/Zn2+) Tabellenwerte EMK = +0,34V-(-0,76V) = +1,1 V Zentrale Frage : Wie werden ∆ϕ00-Werte bestimmt? ( Normal-, StandardPotentiale) 1. Aufbau eines galvanischen Elements 2. Eine Elektrode ist hierbei die Normal-WasserstoffElektrode ( p=1atm; C(H3O+) = 1M, T= 298,15 K) = Bezugselektrode, Referenzelektrode 3. Messelektrode wird unter Standard-Bedingungen betrieben, z. B. Cu I Cu2+ (1mol/l ) EMK = ∆ϕ00(Cu/CU2+)−∆ϕ00(H2/H3O+) +RT/2F*ln acu2+ lna=0 ( 1M) H3O+ 1/2 /p H2 ln aH3O+ =0 - RT/F*ln a EMK = = ∆ϕ00(Cu/CU2+) => Damit man Elektrodenpotentiale vergleichen und tabellieren kann, misst man alle Elektroden gegen eine willkürlich ausgewählte Bezugselektrode, deren Galvani-Potential willkürlich = 0 gesetzt wird = Normal-Wasserstoff-Elektrode (NHE) oder. = Standard-Wasserstoff-Elektrode (SHE) daraus: Elektrochemische Spannungsreihe (Standardpotentiale bei 25 °C; 101,3 kPa; pH=0; Ionenaktivtäten= 1) oxidierte Form + z e− reduzierte Form Standardpotential E ° + 2 e− 2 F− Fluor (F) F2 Schwefel (S) S2O82− Sauerstoff (O) H2O2 + 2 H3O + Gold (Au) Au Gold (Au) Au3+ Gold (Au) 2+ Chlor (Cl) Chrom (Cr) Au Platin (Pt) Pt2+ Br2 Silber (Ag) Ag+ Eisen (Fe) 3+ I2 Eisen (Fe) [Fe(CN)6]3− 2+ Kupfer (Cu) Cu Kupfer (Cu) Cu2+ Sn 4+ + Wasserstoff (H2) 2 H Blei (Pb) +1,69 V + 3 e− Au +1,42 V + 2 e 2 Cl +1,36 V - +1,33 V 3+ + 3 e Cr + 3+ Pb 2+ +2,00 V +1,40 V − − + 4 e 6 H2O +1,23 V + 2 e− Pt +1,20 V − + 2 e 2 Br +1,07 V + 2 e− Hg +0,85 V +e − +e − Ag +e − + e− +0,80 V 2+ +0,77 V − +0,53 V Fe +2e 2I + Cu Fe Au − Kupfer (Cu) Eisen (Fe) +1,78 V − Quecksilber (Hg) Hg2+ Zinn (Sn) 4 H2O − + 2 e Au Cr O2 + 4 H3O Iod (I) +2e − 6+ Fe 2 − +e Cl2 +2,87 V +2e − Sauerstoff (O) Brom (Br) + SO42− − Cu +0,52 V [Fe(CN)6]4− +0,361 V − + 2 e Cu +0,34 V + e− +0,16 V Cu+ − + 2 e Sn 2+ 0 − −0,04 V + 2 e H2 + 3 e Fe +2e +0,15 V − − Pb −0,13 V Zinn (Sn) Nickel (Ni) Cadmium (Cd) Eisen (Fe) Schwefel (S) Sn2+ 2+ Ni Cd Fe 2+ 2+ S + 2 e− Sn −0,14 V − Ni −0,23 V + 2 e Cd −0,40 V +2e − +2e − Fe − 2− +2e S − NiO2 + 2 H2O +2e Zink (Zn) Zn2+ + 2 e− Zn Chrom (Cr) Niob (Nb) Vanadium (V) Mangan (Mn) 2 H2O 2+ Cr Nb V 3+ 2+ Mn 2+ −0,48 V − Nickel (Ni) Wasser −0,41 V Ni(OH)2 + 2 OH −0,49 V − −0,76 V − + 2 e H2 + 2 OH −0,91 V − −1,099 V − −1,17 V + 2 e Cr + 3 e Nb +2e V +2e −0,83 V − − Mn Titan (Ti) Ti + 3 e Ti −1,21 V Aluminium (Al) Al3+ + 3 e− Al −1,66 V Titan (Ti) Beryllium (Be) 2+ Ti Be 2+ 2+ Magnesium (Mg) Mg Cer (Ce) Lanthan (La) Ce La 3+ 3+ + Natrium (Na) Na Calcium (Ca) Ca2+ Barium (Ba) Kalium (K) Lithium (Li) Ba K + + Li 2+ − −1,18 V 3+ − −1,77 V − −1,85 V − −2,38 V − −2,483 V − −2,522 V + 2 e Ti + 2 e Be + 2 e Mg + 3 e Ce + 3 e La +e − Na −2,71 V + 2 e− Ca −2,76 V − + 2 e Ba −2,90 V +e − K −2,92 V +e − Li −3,05 V Energiegewinnung aus galvanischen Elementen z. B. Daniell-Element Zn I Zn2+ (1M ) I Cu2+ (1M ) I Cu Symbol für die Phasengrenzen Chemie: Kathode: Anode: Cu2+ + 2 eCu 2+ Zn Zn + 2eCu2+ + Zn Zn2+ + Cu EMK = ϕ (rechts)- ϕ (links) = ∆ϕ EMK = +0,34V-(-0,76V) = +1,1 V In der Elektrochemie gilt: ∆G = -z*F*∆E0 = -z*F*∆ϕ00 mit z = Ladungszahl F = Faraday-Konstante = 96485 C/mol ∆E0 = Zellspannung = V C*V= J ∆G0 = -2x96485x1,1J/mol ∆G0 = -212,3kJ/mol Verknüpfung mit anderen thermodynamischen Größen ∆G0 = -RTlnK ∆G0 lnK = =+212,3x1000/8,3143x298,15 RT lnK = 85,64 K =1,56x1037 Berechnung von ∆E0 des galvanischen Elements Mg I 1 M Mg2+ I 1 M Sn2+ I Sn ∆E = E rechts – E links da Standard-Bedingungen, wird lna =0 => ∆E =∆E0 = E0 rechts – E0 links = - 0,136 V –(-2,363 V) ∆E0 = 2,227 V Anwendungen der Elektrochemie • • • • • Herstellung chemischer Substanzen o Reduktion von Metallsalzen zur Herstellung unedler Metalle, vor allem durch Schmelzelektrolyse, z.B. zur Herstellung von Lithium, Natrium, Kalium, Calcium, Magnesium und Aluminium Die elektrolytische Metallabscheidung wird auch in der Galvanotechnik genutzt. o Oxidation von Anionen, z.B. von Halogeniden, etwa zur Herstellung von Fluor und Chlor o Der elektrische Strom erlaubt Redoxreaktionen ohne die Zugabe von Reduktions- oder Oxidationsmitteln. o Herstellung von Ozon Galvanotechnik Bereitstellung einer elektrischen Spannung, vor allem für mobile Anwendungen, in o Galvanische Zellen (Monozellen) o Batterie o Akkumulatoren o Brennstoffzellen Verwendung des elektrischen Stroms zur Durchführung von chemischen Analysen und Untersuchungen: Elektroanalyse, vor allem o Voltammetrie/Polarographie o Amperometrie o Potentiometrie o Coulometrie o Elektrogravimetrie o Elektrochemische Impedanzspektroskopie Untersuchungen zur Thermodynamik und zum Mechanismus von Reaktionen, wichtig auch für die Korrosionsforschung Elektrochemische Anwendungen Zwei grundsätzlich verschiedene Typen: 1. Energie-Lieferung: durch die Ausnutzung der Energie bei zwei gekoppelten Prozessen ( Typus Galvani-Element ). Es erfolgt immer gleichzeitig eine Reduktions-Reaktion und eine OxidationsReaktion 2. durch die Nutzung von elektrischem Strom (Elektrolyse ). Hier laufen auch immer eine Reduktionsreaktion und eine Oxidations-Reaktion ab, genutzt wird aber häufig nur ein Reaktionsprodukt. Biochemische Prozesse Wichtigster Prozess: oxidative Phosphorylierung Liefert formell 26 der 30 ATP-Moleküle, die bei der vollständigen Oxidation von Glucose zu CO2 und H2O entstehen => der Energie-liefernde Prozess in jedem aeroben Organismus OxPhos beruht auf zwei Prozessen, die in der inneren Mitochondrien-Membran statt finden: 1. Elektronen-Transfer von NADH aus dem CitratCyclus auf O2 2. Phosphorylierung von ADP zu ATP Schritt 1 lässt sich energetisch folgendermaßen darstellen: 1. NAD+ + H+ + 2e- NADH ∆E´0= -0,32 V 2. ½ O2 + 2 H+ + 2e- H2O ∆E´0= +0,82 V Die Gesamt-Redox-Reaktion läuft freiwillig ( negatives ∆G´0 ) , der Elektronenfluss läuft vom NADH zum O2 ½ O2 + NADH + H+ H2O + NAD+ ∆E´0= +1,14 V ( 0,82 V + 0,32 V ) mit ∆G´0= -z*F*∆E´0 ergibt sich hieraus ein Energiegewinn für die Zelle von ∆G´0= -2x96,5x1,32 kJ/mol =-220 kJ/mol In Wahrheit: stark aufgespaltenes Reaktionsschema: 1. Elektronen vom NADH werden auf FMN der NADHDehydrogenase übertragen 2. Elektronen werden innerhalb der NADHDehydrogenase vom FMNH2 auf Fe übertragen 3. Elektronen werden vom Fe der NADHDehydrogenase auf freies Ubichinon ( Coenzym Q, Q10) übertragen 4. Elektronen werden von Ubichinon auf das HämEisen des Cytochrom b/c1 übertragen 5. Elektronen werden intramolekular auf Fe-S-Cluster des Cytochrom b/c1 übertragen 6. Elektronen werden vom Cytochrom b/c1 auf Cytochrom c übertragen 7. Elektronen werden vom Cytochrom c auf elementaren O2 übertragen Treibende Kraft für diesen Weg: zunehmendes ∆E´0 1. NAD+ + H+ + 2e- NADH 2. Cyt b/c1(3+) + e- Cytb/c1(2+) ∆E´0= +0,07 V 3. Cyt c(3+) + e4. ½ O2 + 2 H+ + 2e- ∆E´0= -0,32 V Cyt c(2+) ∆E´0= +0,22 V H2O ∆E´0= +0,82 V energetisch wird die Reaktion dadurch ebenfalls in mehrere Teilschritte zerlegt, z. B. NADH + 2 Cyt b/c1(3+) NAD+ + 2Cyt b/c1(2+) + H+ ∆E´0= ( 2x0,07 V + 0,32 V) = 0,46 V ∆G´0= -2*96,5*0,46 kJ/mol= - 88,78 kJ/mol Cyt c(3+) + Cyt b/c1(2+) Cyt c(2+) + Cyt b/c1 (3+) ∆E´0= ( 0,22 V - 0,07 V) = 0,15 V ∆G´0= -1*96,5*0,15 kJ/mol= - 14,34 kJ/mol (1-Elektron) 2 Cyt c(2+) + ½ O2 + 2 H+ 2 Cyt c(3+) + H2O ∆E´0= ( 0,82 V – 2*0,22 V) = 0,38 V ∆G´0= -2*96,5*0,38 kJ/mol= - 73,34 kJ/mol energetisch läuft die Reaktion bei Anwesenheit von NADH bis zur Reduktion des Sauerstoff. Dabei werden je NADH 2 Elektronen von der Innenseite der Membran zur Außenseite transportiert Bewirkt für die Zelle keinen Energiegewinn, es wird lediglich sichergestellt, dass Reaktion in der gewünschten Richtung abläuft. Wie erfolgt die Gewinnung von chemischer Energie für die Zelle? Parallel zum Elektronentransport transportieren die Reduktase-Komplexe Protonen in den Intermembranraum ∆pH zwischen der Intermembran-Seite und der Inneren Membranseite elektrisches Potential über die Membran Membranpotential Protonenmotorische Kraft ∆p 2,3*R*T ∆p = Em - F ∆pH = Em – 0,06∆pH Em = Membranpotential = 0,14 V ∆pH = -1,4 ∆p = 0,14 – 0,06* (-1,4) = 0,224 V ∆G´0= -21,75kJ/mol H+ Vollständige stoffliche Entkopplung von den RedoxReaktionen bei der Substrat-Oxidation von NADH durch Sauerstoff und der dadurch gewonnenen protonenmotiven Kraft zur Synthese von ATP Mitochondriale ATP-Synthese immer, wenn ein Protonengradient auf die Mitochondrien-Membran wirkt. Unabhängig vom Ursprung des Gradienten: Ursache für ATP-Synthese: Membranpotential, Führt zur Konformationsänderung der F1-F0 –ATPase ( mitochondriale ATP-Synthase ). Parallel zur ATP-Synthese Protonen-Rückfluss in die Mitochondrien ATP-Ausbeute pro Elektron: da nicht stofflich gekoppelt, nur Näherungswerte ( nicht streng stöchiometrisch) Etwa 2,5 ATP je NADH, davon 1 ATP pro extramitochondrialem NADH ( Glycolyse) Etwa 1,5 ATP je FADH2 ATP-Ausbeute bei der vollständigen Glucose-Oxidation Substraterzeugung bei den Teilschritten der Oxidation Glycolyse: 2 ATP 2 NADH Pyruvat zu Acetyl-CoA Citrat-Cyclus 2 NADH 2 GTP 6 NADH, 2FADH2 Oxidative Phosphorylierung 2 NADH aus der Glycolyse 3 ATP 2 NADH aus Decarboxylierung 2 FADH2 6 NADH 5 ATP 3 ATP 15 ATP Nettoausbeute je Glucose 30 ATP Davon aus der oxid. Phosphorylierung 26 ATP Respiratorischer Faktor 6,5 Batterien, Akkumulatoren Bei jedem Galvanischen Element baut sich zwischen den Elektroden ein elektrisches Potential auf. Da bei dem Kontakt des Elektroden-Metalls mit seiner Lösung Spuren des Elektroden-Metalls in Lösung gehen, sind beide Elektroden negativiert. Durch die elektrischen Rückhaltekräfte kommt es zu einem Stopp der Auflösung. Werden diese beiden Elektroden leitend miteinander verbunden, kommt es zum Elektronenfluss, die Elektronen fließen von der Elektrode niedrigeren Potentials zur Elektrode höheren Potentials. Elektronenfluß = elektrischer Strom Elektrischer Strom kann zur Energieerzeugung genutzt werden. Alle Galvani-Elemente können so elektrische Energie erzeugen. Die Potentialdifferenz ist verantwortlich für die Spannung Die Menge an Elektrodenmaterial ( Anode ) sowie Elektrolyt ( Kathode ) bestimmt die Energie-Ausbeute Beispiel: Daniell-Element Cu I CuSO4 I ZnSO4 I Zn : geladener Zustand Cu I ZnSO4 : vollständig entladen Als Prozess: CuSO4 + Zn Cu + ZnSO4 Jede Batterie nutzt die chemische Energie, die in Batterien gespeichert ist, um auf elektrochemischem Weg elektrische Energie zu erzeugen. Differenzierung: Batterie: ist nicht wieder aufladbar ( z. B., weil Elektrodenmaterial zerstört wird ) Akku(mulator): kann durch Umkehrung des Entladevorgangs wieder geladen werden. Dazu ist mehr Energie notwendig, als gewonnen wurde Beispiele: Zink-Kohle-Batterie (Leclanch´e-Element, 1865) Kathode: Graphit-Stab ( Graphit ist elektrisch leitfähig und chemisch inert gegen nicht-oxidierende Substanzen Anode: Zink-Becher Elektrolyt 1: NH4Cl-Lösung Elektrolyt 2: MnO2-Pressling Nominalspannung: 1,5 V Weiterentwicklung: Alkali-Zellen ( Leclanche-Element mit KOH als erstem Elektrolyten ) Anodenreaktion Wenn der Elektrolyt mit Zinkat übersättigt ist, beginnt Zinkoxid ZnO) auszufallen. Bei fortschreitender Entladung, das heißt bei niedrigerer OH--Konzentration, wird dann Zinkhydroxid (Zn(OH)2) gebildet. Aus diesem entsteht unter Abgabe von Wasser angsam wiederum Zinkoxid (ZnO). Kathodenreaktion Gesamtreaktion Baugröße Mignon Energiedichte in Wh/l Kapazität in Ah (Entladung bis 0,8 V) Innenwiderstand in Ohm Selbstentladung in % pro Monat bei 20 °C Kapazität bei konst. Selbstentl. nach 3 J. in % Kapazität bei konst. Selbstentl. nach 5 J. in % Minimale Betriebstemperatur (in °C) Auslaufsicherheit Alkali-Mangan 350 2,8 Zink-Kohle 150 1,5 0,15 0,2 0,5 7 92 10 85 1 < -20 -10 hoch Linearität der Strom/ZeitCharakteristik typ. Kosten pro entnommener Ladung siehe Diagramm ausreichend bis schlecht (insb. bei billigen Zellen) siehe Diagramm 8–45 Cent/Ah 17–80 Cent/Ah Akkumulatoren • • • • • • • • • • Pb – Bleiakku (2V NS/Zelle) NiCd - Nickel-Cadmium-Akku (1,2 V N/Zelle) NiH2 - Nickel-Wasserstoff-Akkumulator (1,5 V NS/Zelle) NiMH - Nickel-Metallhydrid-Akkumulator (1,2 V NS/Zelle) Li-Ion - Lithium-Ionen-Akku (3,62 V NS/Zelle) LiPo - Lithium-Polymer-Akku (3,7 V NS/Zelle) LiFePO4 - Lithium-Eisen-Phosphat-Akku (3,2 V NS/Zelle) LiTi - Lithium-Titanat-Akku RAM - Rechargeable Alkaline Manganese (1,5 V NS/Zelle) Ni-Fe - Nickel-Eisen-Akku (1,2 V - 1,9 V NS/Zelle) Blei-Akkumulator 1801/1854 erste Entwürfe 1859: Entwicklung des bis heute verwendeten Konzepts Besondere Eigenschaft: sehr hohe Stromentnahmeleistung: ideal für Starter/Anlasser Prinzip Kathode: geladen: Bleischwamm, Anode Blei-IV-oxid Elektrolyt: 27 %ige Schwefelsäure Reaktionen E0 = -0,36 V E0 = +1,68 V ∆ E0 = +2,04 V je Zelle Nennspannung = 2 V 12 V: 6 Zellen in Reihe Tatsächliche Spannung zw. 1,75 V u. 2,4 V, abhängig vom Ladungszustand Ladungszustand an der Dichte der Schwefelsäure zu erkennen ρ= 1,10 -1,28 g/ml, je nach Ladungszustand Viele Probleme der alten Generation sind im neuen, geschlossenen Blei –Vlies-Akku vermieden: Schwefelsäure ist im Glasfaservlies fixiert: kein Säureauslaufen Gasen: es bilden sich Gas-durchlässige Gänge: O2 und H2 können zu den entgegengesetzten Elektroden wandern und rekombinieren Verwendung: Starterbatterie USV-Anlagen, Notbeleuchtung Elektrofahrzeuge ( Gabelstapler, Rollstühle ) Nickel-Metallhydrid-Akkus Anode: Metall-Legierung, die Wasserstoff speichern kann, indem sie ihn als Hydrid ins Kristallgitter einbaut ( z. B. La0,8Nd0,2Ni2,5Co2,4Si0,1) Elektrolyt: 20 %ige KOH Kathode: NiOOH Elektrochemie 2 Metall-H + 2 OH− → 2 Metall + 2 H2O + 2 e− −0,83 V 2 NiOOH + 2 H2O + 2 e− → 2 Ni(OH)2 + 2 OH− +0,49 V 2 Metall-H + 2 NiOOH → 2 Metall + 2 Ni(OH) +1,32 V bis heue fast nur als Ersatz für Alkali-Batterien erhältlich (baugleich mit handelsüblichen Alkali-Batterien) doppelte Energiedichte im Vergleich zu Ni-Cd-Akkus ( fast identisch mit Alkali-Batterien bei vergleichbarer Spannung) irreversible Schäden bei Überhitzung, Überladung und falscher Polung Lebensdauer etwa 500 Ladezyklen NiMH-Akkus arbeiten nur bis 0°C, ab –20 °C völlig unbrauchbar Kein Memory-Effekt, aber Batterie-Trägheitseffekt bei häufiger Teilentladung Lithium-Ionen-Akku und seine Weiterentwicklungen Lithium-Ionen-Akkus sind thermisch stabil, ohne memory Effekt und mit sehr hoher Energiedichte Anode: Graphit Kathode: Li-Metall-oxid ( z. B. LiCoO2; LiNiO2) Akku muss komplett wasserfrei sein ( < 20 ppm, Lösungsmittel z. B. Ethylencarbonat ) Elektrolyt z.B LiPF6 Elektrochemie: Anode Kathode Es treten nur Li-Ionen auf, Li- Metall ist nicht vorhanden, dadurch sehr betriebssicher Li-Ionen-Akkus kennen keinen Memory-Effekt, Wirkungsgrad (Entlademenge/Lademenge ) bei 96 % ( üblicherweise nur 80 % bei anderen Akkus) Lebensdauer ca. 500 Ladezyklen Nennspannung 3,6 V ( abhängig von Kathode ) Konstante Spannung über ganzen Entladezyklus Entladeschlussspannung 2,5 V ( Entladung unter 2,4 V zerstört den Akku ) Energiedichte 120 Wh/kg bei Akkus für Fahrzeuge ( Bleiakku: 30 Wh/kg) Aufladen ist sehr genau zu kontrollieren ( normale Ladegeräte nicht geeignet ) : Ladespannung 4,2 V; Ladestrom = Kapazität ( z. B. 500mAh Kapazität: Ladestrom 500 mA ) Weiterentwicklungen: Li-Titanat-Akku Prinzip: Li-Ionen-Akku, aber Anode: Li-Titanat (mikrostrukturiert ) Temperaturbereich –35 °C - 75 °C Ladezeit: 80 % der Kapazität in 1 Minute 15000 Ladezyklen bei 85 % Anfangskapazität sehr hohe Leistungsdichte ( 4000 W/kg ), Energiedichte 70-90 Wh/kg Hersteller: Altair Nanotechnologies Einsatz: in Elektroautos ( z. B. Lightning GT; 652 PS, 209 km/h, Batterie-Kapazität 35 kWh, Reichweite 300 km ) Experimente: Stromerzeuger zur Herstellung von 3 MWAkkublöcken zur Stabilisierung des Stromnetzes Li-Eisen-Phosphat-Akku Kathode: LiFePO4 Bei normale Li-Ionen-Akkus werden nur 50 % des Li ausgenutzt, da sonst Struktur der Kathode instabil wird Bei LiFePO4 können 100 % ausgenutzt werden => Sehr hohe Entladeströme ( bis zum 100-fachen der Nennkapazität, Dauerlast beim 35-fachen ) Kapazität : 2 Ah => Entladung bis 2000 A Schnellladefähig 90% in 5 Minuten Sehr hohe Leistungsdichte ( 3000 W/kg ) Nachteil: Zellspannung 3,3 V (Li-Ionen: 3,7 V) Vergleich einzelner Akkumulatoren-Typen Akkumulatortyp Energiedichte [Wh/kg] Besonderheit Bleiakkumulator Nickel-Metallhydrid-Akkumulator Nickel-Cadmium-Akkumulator Lithium-Ionen-Akkumulator Lithium-Titanat-Akkumulator Lithium-Polymer-Akkumulator Natrium-Schwefel-Akkumulator 30 60-80 40-60 EU-weit verboten 120-140 80 schnell-ladefähig 140 120 350 °C, keine Selbstentladung Verwendung Lithium-(Nano)-Titanat-Akku: Antrieb von Elektro-Autos, große Reichweiten. Bleiakku: Starter-Batterien für Fahrzeuge mit Verbrennungs-Motoren, Stationärbetrieb in Notbeleuchtungsanlagen und Insel-FotovoltaikAnlagen NiMH-Akku: portable elektronische Geräte mit konstanter Stromaufnahme, Antriebe Li-Ion-Akku: portable elektronische Geräte mit kleinen Abmessungen und langer Betriebszeit (Mobiltelefone, Kameras) Li-Fe-Akku: Antriebe im Modellbau, neue Profiklasse von Elektrowerkzeugen, Fahrzeugakku für extreme Reichweiten Alkalimangan-Zellen bei Anwendungen mit geringerem Energieverbrauch als 0,01 Wh/Tag, wie Uhren, Fernbedienungen, Thermometer, Feuermelder, selten benutzte Waagen. Brennstoffzellen Eine Brennstoffzelle ist eine galvanische Zelle, die die chemische Reaktionsenergie eines kontinuierlich zugeführten Brennstoffes und eines Oxidationsmittels in elektrische Energie wandelt. Brennstoff: beliebig, allerdings heute synonym für Wasserstoff Oxidationsmittel: Sauerstoff Prinzip wurde 1838 entdeckt Schönbein ließ zwei Elektroden von H2 und O2 umspülen und fand eine Spannung zwischen den Elektroden Jules Verne (1870): „das Wasser ist die Kohle der Zukunft“ Danach bis Mitte 1950 vergessen Heute: Island wird die Brennstoffzelle bald flächendeckend einführen Prinzip: Elektrochemische Reaktionen Im Sauren: Anode: 2 H2 4 H+ + 4 e- Kathode: O2 + 4 H+ + 4 e- 2 H2O Gesamtreaktion: 2 H2 + O2 2 H2O Im Alkalischen: Anode: 2 H2 + 4 OH- 4 H2O + 4 e- Kathode: O2 + 4 H2O + 4 e- 4 OH- Gesamtreaktion: 2 H2 + O2 2 H2O Brennstoffzellentypen Verschiedene Typen der Brennstoffzelle Bezeichnung Alkalische Brennstoffzelle (AFC) Elektrolyt el. Mobiles Gas der Gas der Leistung Temperatur WirkungsIon (°C) Anode Kathode (kW) grad (%) Stand OH- H2 O2 10 – 100 < 80 60-70 % kommerzie Entwicklun PolymerelektrolytPolymerbrennstoffzelle Membran (PEMFC) H+ H2 O2 0,1 - 500 10 – 120 35 kommerzie Entwicklun Direktmethanolbrennstoffzelle (DMFC) PolymerMembran H+ CH3OH O2 < 0,001 90 – 120 100 40 kommerzie Entwicklun Phosphorsäurebrennstoffzelle (PAFC) H3PO4 H3O+ H2 O2 < 10.000 200 38 kommerzie Entwicklun Schmelzkarbonat- Alkalibrennstoffzelle Carbonat- CO32(MCFC) Schmelzen H2, CH4, O Kohlegas 2 100.000 650 48 kommerzie Entwicklun Festoxidbrennstoffzelle (SOFC) H2, CH4, < O (Luft) 800 – 1000 47 Kohlegas 2 100.000 Entwicklun KOH oxidkeramischer O2Elektrolyt Alkalische Brennstoffzelle Elektrolyt: Kalium-Hydroxid AFC hat einen besseren Wirkungsgrad, aber schlechtere Energie-Dichte. Temperaturführung durch ElektrolytLösung Nachteil: Luft muss absolut CO2-frei sein, niedrige Lebenserwartung wegen des korrosiven Elektrolyten Anwendung: Raumfahrt nicht mehr ( Energiedichte ) U-Boote: ideal, geräusch-arm, moderate TemperaturEntwicklung Polymerelektrolyt-Brennstoffzelle (engl. PEMFC: polymer exchange membrane fuel cell) Elektrolyt ist eine feste Polymer-Membran, durchlässig für Protonen und Wasser, Elektroden auf beiden Seiten der Membran, bestehen aus Graphit und Pt (oder Pt/Ru)-Katalysator ( verantwortlich für die Spaltung von H2 in 2 H ) Mobiler Einsatz in U-Booten, BrennstoffzellenFahrzeugen. Einsatz durch Zusammenschaltung von bis zu 100 Zellen im „stack“. Eigener Kühlkreislauf nötig. Problem: CO Pt ist anfällig gegen CO ( Toleranz max. 10 ppm ) und H2S Vorteile: fester Elektrolyt, hohe Stromdichte, CO2beständig, Luft als Oxidationsgas Nachteil: Kühlung, Wirkungsgrad relativ niedrig, hochreiner Wasserstoff Phosphorsäurebrennstoffzelle (engl. Phosphoric acid fuel cell, PAFC) Elektrolyt: 80 %ige Phosphorsäure, eingebettet in PTFEFaserstruktur ( optimal 3D-Struktur ), Betriebstemperatur 135 –200 °C, dadurch nur Graphit-Elektroden möglich. PAFCs sind relativ unempfindlich gegen Verunreinigungen im Brenngas Vorteile Robust Kathode: Luft möglich, CO2-tolerant Nachteile: Geringe Leistungsdichte Niedrige Lebensdauer CO als Katalysatorgift Pt-Katalysator notwendig Schmelzcarbonat-Brennstoffzelle (engl. Molten Carbonate Fuel Cell MCFC) Anodeseite: Gemisch aus H2 und CO (aus Methan: Erdgas oder Biogas ) Kathodenseite: Gemisch aus O2 und CO2 (aus dem Anodenabgas ) Elektrolyt: Schmelze aus K2CO3 und Li2CO3 Elektrochemie: Reformierung: CH4 + H2O CO + H2O CO + 3H2 CO2 + H2 Anode: 2 H2 + 2 CO3- 2 H2O + 2 CO2 + 4 e- Kathode: O2 + 2 CO2 + 4 e- 2 CO3- Betriebstemperatur: ca. 650 °C Wegen der Temperatur: Materialien: Ni-Katalysator, aber keine Hochtemperatur-Werkstoffe Verwendung als Blockheizkraftwerk, GesamtWirkungsgrad bis 90 % Festoxidbrennstoffzelle (engl. Solid oxide fuel cell, SOFC) Hochtemperatur-Brennstoffzelle Elektrolyt: Keramik, z. B: yttriumdotiertes ZrO2 leitet Sauerstoff, isoliert gegen Elektronen Kathode: Keramik:Sr-dotiertes La-Manganat, leitfähig für Ionen und Elektronen Anode: Ni + Yttriumdotiertes Zirkonoxid ( Cermet ) Besonderheiten der SOFC : Kathode und Anode sind Gasdurchlässig und gute Leiter, Elektrolyt muss sehr gut isolieren und gleichzeitig besonders dünn sein => möglichst wenig Fehlstellen Betrieb: mit z.B. Propan, thermisch zersetzt in H2 und CO Elektrochemische Reaktionen: Anode: H2 + O2CO + O2- H2O + 2eCO2 + 2e- Kathode: O2 + 4e- 2 O2- Innerer Ladungstransport über O2Betriebstemperatur 500°C-800°C Einsatz stationäre in dezentralen MikroBlockheizkraftwerken Elektrischer Wirkungsgrad 55-60 %, eine Zelle ( ca. 6,5 cm lang) liefert 350 mW Logistik für den Brennstoff existiert bereits, alternativ Erdgas Elektrolyse Umkehr einer elektrochemischen Reaktion unter Aufwendung von elektrischem Strom (Ladungstransport) =Reaktionsumkehr eines Galvani-Elements =Laden eines Akkumulators Beispiel: Blei-Akkumulator Entladen: Reaktionen Laden: Reaktionen PbSO4 + 2 ePbSO4 + 6H2O Pb + SO42PbO2 + SO42- +4H3O++2e- Prinzip einer Elektrolyse: Durch zwei Elektroden wird ein Gleichstrom in einen Elektrolyten geleitet. Dadurch entsteht ein ElektronenMangel an der Anode und ein Elektronenüberschuss an der Kathode : es laufen parallel Oxidationsreaktionen an der Kathode und Reduktionsreaktionen an der Anode ab. Elektrischer Strom ist das stärkste Oxidations- und Reduktionsmittel der Chemie Fluor und Lithium lassen sich nur elektrolytisch herstellen ! Die Mindestspannung zur Durchführung einer Elektrolyse ( Zersetzungsspannung Ez) muss mindestens so groß sein wie die Differenz der Normalpotentiale z. B. 2 H3O+ + 2e3 H2O H2 + 2H2O ½ O2 + 2e- +2H3O+ Eo=0,0V E0=1,23 V ∆E0=1,23V diese Spannung ist durchaus üblich bei einer Elektrolyse in wässrigen Lösungen Nebenreaktion bei fast allen Elektrolysen in wässrigen Lösungen: Elektrolyse des Wassers Tatsächlich notwendige Spannung: deutlich höher Ursache: Überspannung Überspannung ist eine Spannung, die nötig wird, um neben der thermodynamischen Spannung eine kinetische Energiebarriere zu überwinden. Auftreten von Überspannung kann überwunden werden z. B. durch Spannungserhöhung Tats. Spannung > Zersetzungsspannung ( Ueff= ∆Ez + Uü = ∆E0 + Uü ) Ursachen für das Auftreten von Überspannung: Überspannungen treten auf, wenn mindestens ein Einzelschritt der Elektrolysereaktion kinetisch gehemmt ist. Dafür kommen alle Teilschritte in Frage: • • • • • Die Diffusion der Reaktanten zur Elektrode Eine eventuelle Reaktion des Reaktanten vor Erreichen der Elektrode Adsorption des Reaktanten Elektronenübergang vom Reaktanten zur Elektrode (Oxidation oder Reduktion des Reaktanten) Desorption des Produkts oder Suchen einer energiearmen Position auf der Oberfläche (bei Abscheidung von Metallen auf demselben Metall) oder Keimbildung (falls sich eine Schicht auf der Elektrode abscheidet) Überspannungen treten besonders häufig bei Gasbildung auf. Überspannungen sind Stoffabhängig ( Wahl der geeigneten Elektroden) Bsp: Elelktrolyse von wässriger HCl Überspannungsanteile einiger Gase an vers. Elektrodenmaterialien bei 25 °C O2 Cl2 Elektrodenmat. H2 Platin (platiniert) −0,07 V +0,77 V +0,08 V Palladium −0,07 V +0,93 V Gold −0,09 V +1,02 V Eisen −0,15 V +0,75 V Platin (glatt) −0,16 V +0,95 V +0,10 V Silber −0,22 V +0,91 V Nickel −0,28 V +0,56 V Graphit −0,62 V +0,95 V +0,12 V Blei −0,71 V +0,81 V Zink −0,77 V Quecksilber −0,85 V Bei der Elektrolyse von wässriger HCl an GraphitElektroden können folgende Schritte auftreten Anode: 1. 2. 4 Cl6 H2O 2 Cl2 + 4 eO2 + 4 H3O+ + 4 e- Eo=1,359 V Eo=1,229 V Kathode: 3. 4 H+ + 4 e- 2H2 Eo= 0,0 V würde die Überspannung nicht berücksichtigt, so würde die Elektrolyse von Wasser erfolgen wird die Überspannung berücksichtigt, dann läuft Reaktion 1 ab. Ueff = ∆E0 + Uü 1. U = 1,359 V + 0,12 V = 1,479 V 2. U = 1,229 V + 0,95 V = 2,179 V 3. U = 0,0 V – 0,62 V = - 0,62 V ∆U(1) = 2,099 V ∆U(2) = 2,799 V In wässriger Lösung an Graphit-Elektroden entsteht bei der Elektrolyse von HCl bei einer Spannung von mindestens 2,099 V Cl2 und H2 ! Technische Probleme bei der Elektrolyse Elektroden: Nur wenige Materialien sind als Elektroden geeignet ( bedingt durch die aggressiven Reaktionsbedingungen und eigene elektrochemische Veränderungen ) Im Sauren sollten die meisten preiswerten Metalle unter Kationen-Bildung und H2-Freisetzung reagieren ( s. Normalpotential ). Aber Passivierung durch die Bildung von unlöslichen Salzen an der Oberfläche => z. B. Blei in schwefelsaurer Lösung bildet Bleisulfat Metall Kathode Graphit (gebrannt) Graphit (gebrannt) Kohlenstoff (glatt) Platin Eisen Eisen Blei-Silberlegierung Blei Blei Aluminium Titan Quecksilber Zinn+Kupfer ++ -+ ++ + + + + Anode ++ ++ + + + + + ++ - Häufige Elektrolysen Schmelzelektrolyse(Na, Li, Ca) Aluminiumelektrolyse Fluorherstellung Perschwefelsäure Wasserelektrolyse Schmelzelektrolyse(Na, Li, Ca) Ger. O2-Übersp/Brennstoffzelle Elektrolyse in Schwefelsäure Perchlorsäure Zink, Cadmiumelektrolyse beständig bei NaCl-Elektrolyse Alkalielektrolyse Organische Verbindungen Zellwiderstand Jeder Stromfluss erfährt einen Widerstand, der die Leistung mindert. Der innere Widerstand der Zelle muss optimiert werden. Nach Ohm: R = U/I Bei konstantem U muss I größer werden, damit R überwunden werden kann => je kleiner R, desto größer kann I werden ( wichtig, da große Ladungsmengen bewegt werden müssen) Zellwiderstand R(z) = ( D/F) x 1/Leitfähigkeit mit D= Abstand F= Fläche der Elektroden 1. Leitfähigkeit Je höher die Leitfähigkeit, desto geringer ist der Zellwiderstand bei fast allen Elektrolysen werden Leitsalze zugesetzt ( fast immer sehr konzentrierte Lösungen, um den Widerstand klein zu halten) Leitfähigkeit einiger Lösungen: Stoff Leitfähigkeit (1/(Ohm·cm)) Dest. Wasser 0,00001 1 M KCl (wäss.) 0,1020 0,1 M KCl (wäss.) 0,0117 1 M HCl (wäss.) 0,3320 1 M NaOH (wäss.) 0,1840 4 M NaOH (wäss.) 0,3500 2 M H2SO4 (wäss.) 0,3700 überwiegend basische Elektrolysen, um anodische Auflösung und verzögerte Sauerstoff-Bildung zu nutzen 2. Abstand und Fläche müssen für jede Elektrolyse optimiert werden: möglichst große Fläche bei möglichst kleinem Abstand ergibt optimale Stromausnutzung z. B. SOFC-Zelle als Elektrolyse-Zelle für destilliertes Wasser: Elektrolyse möglich, da D/F sehr klein. Stromdichte Die Stromdichte, die erreicht werden kann, ist entscheidend für das Resultat der Elektrolyse 1 C = 1As 1 mol e- = 96485 C = 96485 As= 26,80 Ah => für die Gewinnung von 1 mol H2 sind 53,60 Ah notwendig parallel: 1 mol Na = 26,8 Ah 1 mol Al = 80,4 Ah Welche Energie wird für die Elektrolyse benötigt? Bsp: Wasser-Elektrolyse Moderne Anlage: 4,3-4,9 kWh für 1 m3 H2 4,6 kWh =16560 kWs = 16560 kJ für 1 m3 H2 es werden 371,3 kJ elektrischer Energie für die Bildung von 1 mol H2 benötigt. ∆H0f(H2O)= -286 kJ/mol durch die Verbrennung von Wasserstoff können max 80 % der Herstellungsenergie gewonnen werden Konsequenz des 2. HS Beispiele für Elektrolysen 1. Reinigung von edleren Metallen ( Elektrolyse in Lösung ) Ni, Zn, Cu, Ag und Au müssen nach ihrer Gewinnung weiter gereinigt werden, da sie noch viele Verunreinigungen enthalten, die ihre Verwendung einschränken Elektrolytische Reinigung! Prinzip ( gilt in dieser Form für alle Metalle ) Roh-Cu wird gewonnen durch Reduktion sulfidischer Erze mit CuO gewonnen 2 Cu2O + Cu2S 6 Cu + SO2 Rohkupfer wird zur Anode geschmolzen, der Elektrolyt ist H2SO4, die Kathode besteht aus Graphit Anoden-Reaktion: Cu Cu2+ + 2 e- U = 290 mV, I = 210 mA/cm2 Kathoden-Reaktion: Cu2+ + 2 e- Cu Elektrolyt-Cu hat eine Reinheit von > 99,5 % Reinheit ist nötig für Cu als elektrischem Leiter Bei der Elektrolyse gehen alle unedleren Metalle ( Normalpotnetial < als Cu ) , werden kathodisch nicht abgeschieden Alle edleren Metalle ionisieren nicht und fallen als Anodenschlamm an. Anodenschlamm ist eine wichtige Quelle für Au und Pt-Metalle ( besonders Ni-, Cu- und Ag-Raffination ) 2. Herstellung von unedlen Metallen (Schmelzflusselektrolyse, alle Alkali-, Erdalkalimetalle und Al ) Da diese Metalle kleinere Normalpotentiale als Wasserstoff haben, können sie aus wässriger Lösung nicht gewonnen werden, bei einer ausreichenden Abscheidungsspannung würde das entstehende Metall mit Wasser sofort zu Metall-Ion und Wasserstoff reagieren. Herstellung in wasserfreiem Elektrolyten Schmelze eines Metallsalzes ( Schmelzflusselektrolyse ) Bsp: Al ( Hall-Heroult-Prozess) Vorkommen von Al: in Alumosilikaten, daraus kann es nicht gewonnen werden. Einzig wichtiges Al-Erz: Bauxit Bayer-Verfahren: Al2O3 + 2 NaOH + 3 H2O NaAl(OH)4 + HCl 2 Al(OH)3 2 NaAl(OH)4 Al(OH)3 + NaCl + H2O Al2O3 + 3 H2O Al2O3 hat einen Schmelzpunkt von 2045 °C. Um ihn herabzusetzen, werden 80 –90 % Kryolith zugesetzt Tm = 950 °C Elektrolyse-Gefäß: Stahlwanne, ausgekleidet mit Graphit Kathode: Stahlwanne, ausgekleidet mit Graphit Anode: Graphit-Blöcke, die von oben in die Wanne tauchen Al(l) ist schwerer als Kryolith => Al sammelt sich am Boden der Wanne und kann abgezogen werden Sauerstoff ( atomar) reagiert mit der Anode unter Bildung von CO und CO2 Energeibedarf: Elektrolyse bei 4-5 V und 300.000 A Ca. 13-15 kWh pro kg Al F2 und Cl2-Gewinnung F2 kann ausschließlich durch Elektrolyse gewonnen werden, da es in der elektrochemischen Spannungsreihe an oberster Stelle steht => es gibt kein stärkeres Oxidationsmittel F2 muss in wasserfreiem Medium hergestellt werden, da es Wasser sofort oxidieren würde =>Schmelze von HF und KF Bsp. Chlorherstellung nach dem Membran-Verfahren ( heute das wichtigste Verfahren zur Herstellung von Cl2) bei beiden Gasen müssen Kathoden- und Anodenraum getrennt werden, da die Produkte sonst mit den Ausgangsstoffen reagieren Kathode : Eisen Anode: Titan Trennwand: chlorbeständige IonenaustauscherMembran ( Nafion, sulfonisiertes PTFE ) , Cl- kann die Membran nicht passieren, wohl aber Na+ Kathodenreaktion: H3O+ + 2 e- OH- + H2 wegen des höheren Normalpotentials entsteht Wasserstoff und nicht Na Anodenreaktion: 2 Cl- Cl2 + 2 e- durch die Überspannung des O2 an Titan entsteht Cl2 Gesamtreaktion: 2 NaCl + 2 H2O Cl2 + 2NaOH + H2 wichtigstes Verfahren zur Herstellung von Chlor und Natronlauge, läuft in beiden Räumen getrennt ab: Anodenraum enthält NaCl-Lösung, Kathode Wasser; durch die Elektrolyse entsteht im Anodenraum Cl2, im Kathodenraum bildet sich reine, etwa 35 %ige NaOH ( und H2). Bedarf weltweit etwa 55 Mio t Cl2 und 50 Mio t NaOH p.a. Galvanotechnik Verfahren zur Aufbringung metallischer Überzüge auf eine Matrix Dabei bildet der zu überziehende Gegenstand die Kathode, die Anode besteht meist aus dem Überzugsmetall ( oder einem elektropositiveren, wenn in Salzlösungen gearbeitet wird ). Kathoden aus Kunststoff werden vorbehandelt ( Beizen ) Ausnahme: Eloxieren ( elektrolytische Oxidation des Aluminiums ) Durch Galvanisieren können hochpräzise Überzüge definierter Dicke hergestellt werden. Es kann eine Formgebung durchgeführt werden ( Rundung statt harter Kanten )