Elektrodenpotenziale im Gleichgewicht
Werbung
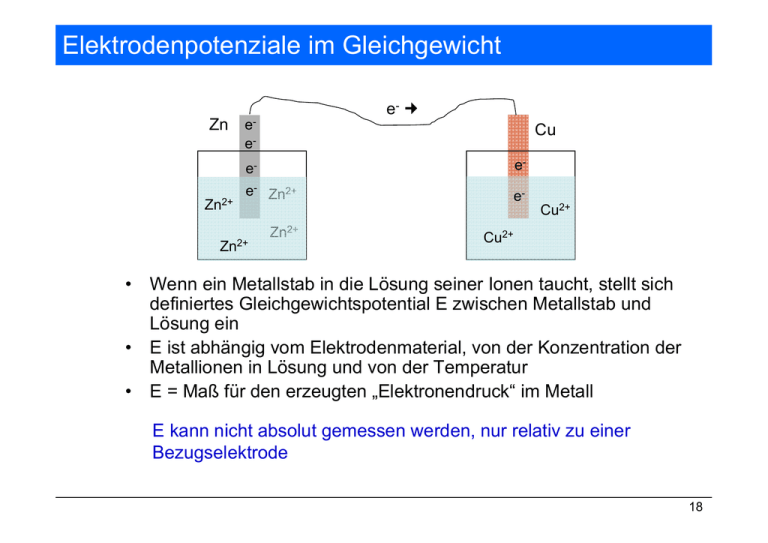
Elektrodenpotenziale im Gleichgewicht e- Zn e- Cu e- Zn2+ e- e- e- Zn2+ e- Zn2+ • • • Zn2+ Cu2+ Cu2+ Wenn ein Metallstab in die Lösung seiner Ionen taucht, stellt sich definiertes Gleichgewichtspotential E zwischen Metallstab und Lösung ein E ist abhängig vom Elektrodenmaterial, von der Konzentration der Metallionen in Lösung und von der Temperatur E = Maß für den erzeugten „Elektronendruck“ im Metall E kann nicht absolut gemessen werden, nur relativ zu einer Bezugselektrode 18 Die Normal-Wasserstoffelektrode Normalpotenzial (oder Standardpotenzial) Standardpotenziale anderer Elektroden werden auf die StandardWasserstoffelektrode bezogen 19 Die Normal-Wasserstoffelektrode als Bezugselektrode Kupfer ist edel, Zink ist unedel - + + - ECu0 = + 0.34 V EZn0 = - 0.76 V Cu2+ + 2 e- Cu H 2 2 H + + 2 e- Zn Zn2+ + 2 e2 H + + 2 e- H 2 positives Vorzeichen: Reduktion von Cu2+ bevorzugt negatives Vorzeichen Oxidation von Zn bevorzugt 20 Elektrochemische Spannungsreihe Ordnung der Redox-Paare nach steigendem Reduktionspotential Je positiver E0, desto stärker ist die Reduktion bevorzugt Bezugselektrode 21 Die Elektromotorische Kraft (EMK) EMK = elektrisches Potential einer galvanischen Zelle (in Volt) • Je stärker die Tendenz zum Ablaufen der Redox-Reaktion, desto größer ist EMK • Die EMK einer beliebigen galvanischen Zelle lässt sich aus den Standardreduktionspotentialen errechnen: EMK = ΔE0 = E0 (Kathode) – E0 (Anode) Anode Kathode EMK = ΔE0 = 0,35 V – (-0,76 V) = 1,11 V Redoxreaktionen laufen nur dann freiwillig ab, wenn EMK = ΔE0 > 0 22 Freie Reaktionsenthalpie und EMK (Standardpotential) Die freie molare Standardreaktionsenthalpie ist ein Maß für die maximale elektrische Energie, die ein galvanisches Element unter Standard-Bedingungen abgeben kann: ΔG0 = -z x F x ΔE0 z…. Anzahl der ausgetauschten Elektronen F….Faraday-Konstante (elektrische Ladung von 1 mol Elektronen 96485 C/mol) ΔE..EMK (Zellpotenzial, Zellspannung) Standardbedingungen: 25 °C (oder 298 K), effektive Konzentration (Aktivität) von gelösten Stoffen = 1mol/l, von reinen Stoffen = 1, Partialdruck von Gasen = 1,013 bar Berechnung von Gleichgewichtskonstanten bei Redoxreaktionen: ΔG0 = -z x F x ΔE0 ΔE0 = 2,303 RT zxF lgK oder ΔG0 = - RT lnK = - 2,303 RT lgK ΔE0 = 0,059 V z lg K Zusammenhang von Gleichgewichtskonstante und EMK im Standardzustand Freiwilliger Ablauf einer Reaktion ΔG negativ, ΔE positiv 23 Verschiedene Einheiten für R 24 Konzentrationsabhängigkeit des Potenzials Wenn nicht alle beteiligten Stoffe die Standardkonzentration von 1 mo/l aufweisen, gilt für eine beliebige Reaktion: aA+bBcC+dD ΔG = ΔG0 + RT lnK a…Aktivität (≈ Konzentration) mit K = MWG = ac(C) x ad(D) aa(A) x ab(B) ΔG = -z x F x ΔE NERNST´sche Gleichung ΔE = ΔE0 - RT zxF lnK ΔE = ΔE0 - 0,059V lgK zxF Δ Δ z 25 NERNST´sche Gleichung für Halbzellen Wenn die Nernstsche Gleichung für Halbzellen verwendet wird, ist das Vorzeichen zu beachten!! E = E0 - 2,303 RT zxF lgK allgemeine Form 0,059 [OX ] E=E + lg [RED] z 0 + 0,059 E = E0 - z lgK für 25 °C 0,059 [RED ] E=E − lg [OX ] z 0 - Achtung ! Vorzeichen Für Gase gilt [Red] = pGas/1,013 bar 26 Übung • Wie groß ist das Potential des Redoxsystems Zn2+/Zn, wenn die Konzentration der Lösung 0,1 mol/l bzw. 0,01 mol/l beträgt? E0 = -0,76 V • Welches Potential hat die folgende Zelle Sn | Sn2+ (1,0 mol/l) || Pb2+ (0,001 mol/l) | Pb Sn e- Pb Sn2+ Sn2+ E0 = -0,136 V Pb2+ Pb2+ E0 = -0,126 V 27 pH-Abhängigkeit von Reduktionspotentialen • Wenn H+ oder OH- Ionen an der Reaktion beteiligt sind, ist das Reduktionspotential vom pH-Wert abhängig. • Häufig gilt: Oxidationsmittel sind in saurer Lösung stärker wirksam Reduktionsmittel sind in basischer Lösung stärker wirksam Beispiel: Wie groß ist das Reduktionspotential einer Permanganatlösung mit c(MnO4-) = 0,1 mol/l, die Mn2+ Ionen mit c(Mn2+) = 0,001 mo/l enthält, bei pH = 1 und pH = 5 ? 28 Quantitative Beschreibung von Redoxgleichgewichten Im Gleichgewicht gilt: E1 = = E1 = E2 Umrechnen auf dekadischen Logarithmus, T = 298 K: = E2 (E20 – E10) 31 Beispiel Cu2+ | Cu || Zn | Zn2+ Zn + Cu2+ Cu E10 (Zn2+/Zn) = -0,76 V + Zn2+ E20 (Cu2+/Cu) = + 0,34 V 2 [ Zn 2+ ] (0,34 + 0,76) = lg = lg K = 37 2+ 0,059 V [Cu ] K = 1037 32 Redoxtitrationen – Permanganometrie I Verfahren, z. B. zur quantitativen Bestimmung von Oxalsäure, Ca2+ (nach vorheriger Umsetzung zu Calciumoxalat) oder Fe2+ Die Titration erfolgt im sauren Medium: MnO4- + 8 H+ + 5 e- Mn2+ + 4 H2O 1 1 c( KMnO4 ) = c( KMnO4 ) 5 5 KMnO4-Lösungen sind nicht titerbeständig (Titer = Äquivalentkonzentration) Genaue Ermittlung der Äquivalentkonzentration (Faktorbestimmung) durch Titration gegen NaC2O4 oder Oxalsäure nötig beständig, „Urtiter“ 1 c ( KMnO4 ) = 0,1 mol /l Man titriert mit einer Lösung der Äquivalentkonzentration 5 33 Redoxtitrationen – Permanganometrie II Titration einer Lösung von Na2C2O4 mit der KMnO4-Lösung: Ermittlung des Titers der KMnO4-Lösung: 1 c( KMnO4 ) = 0,102 mol ⋅ l −1 5 Äquivalenzpunkt: beginnende Eigenfärbung der Lösung (rosa) Bestimmung von Ca2+ • Fällung von Ca2+ als (NH4)C2O4 aus ammoniakalischer Lösung • Filtrieren, waschen, in verdünnter H2SO4 auflösen • mit KMnO4 titrieren 34 Praktikumsrelevante Themen Komplexgleichgewichte • • • Definitionen Nomenklatur Komplexometrie 37 Aufbau von Komplexverbindungen Komplex = Koordinationszentrum Metallatom oder –ion + Ligandenhülle Ionen oder Moleküle Koordinationszahl (KZ) = Anzahl der vom Koordinationszentrum chemisch gebundenen Liganden Koordinationszentrum Ligand Komplex KZ Al3+ F- [AlF6]3- 6 Fe3+ H 2O [Fe(H2O)6]3+ 6 Ni0 CO Ni(CO)4 4 Ag+ CN- [Ag(CN)2]- 2 38 Besondere Eigenschaften von Komplexen (Chelateffekt) 39 Wichtige Koordinationszahlen KZ 2 bei einwertigen Kationen (Ag+, Cu+, Au+) und Hg2+, linear [NC – Ag – CN]- KZ 4 [H3N – Ag – NH3]+ [Cl – Ag – CN]- Hauptgruppenelemente AlCl4-, BeF4-, BH4d0 und d10 [VO4]3- [MnO4]- [ZnCl4]- [Cu(CN)4]3d-Elemente mit wenigen d-Elektronen [MnO4]2- [FeO4]2 [FeCl4]- KZ 6 alle Übergangsmetalle bilden oktaedrische Komplexe H3 N NH3 Cu2+ NH3 NH3 40 Liganden Einzähnige Liganden Ffluoro Clchloro CNcyano OHhydroxo H 2O aqua NH3 ammin CO carbonyl Mehrzähnige (Chelat-)Liganden Ethylendiamin (en, 2-zähnig) Ethylendiamintetraessigsäure (EDTA, 6-zähnig) Porphyrin (4-zähnig) 41 Benennung von Komplexen I Erst das Kation, dann das Anion Schema für kationische Komplexe: [Cr(H2O)6]Cl3 Hexa aqua chrom (III) Anzahl der Liganden Ligand Koordinationszentrum - chlorid Oxidationszahl Anion Anzahl der Liganden durch griech. Vorsilben angegeben (mono, di, tri, tetra, penta hexa....) wenn der Ligandenname selbst Zahlworte enthält (z. B. ethylendiammin) werden die Vorsilben „bis“, „tris“, „tetrakis“.... verwendet Eine römische Ziffer oder 0 in runden Klammern nach dem Zentralion gibt dessen Oxidationsstufe an Anionische Liganden enden auf „o“ Bei verschiedenen Liganden ist die Reihenfolge: negativ – neutral – positiv [Pt(en)2Cl2]Br2 Dichloro-bis(ethylendiamin)-platin(IV)-bromid 42 Benennung von Komplexen II Schema für anionische Komplexe: K4[Fe(CN)6] Hexa Kalium cyano ferr Kation Anzahl der Liganden Ligand Koordinationszentrum at (III) at Oxidationszahl Beispiele K2[PtCl4] Kalium-tetrachloroplatinat(II) Na[Al(OH)4] Natrium-tetrahydroxoaluminat(III) (NH4)[Cu(CN)4] Ammonium-tetracyanocuprat(II) Kationische Komplexe [Cu(NH3)4]SO4 Tetraamminkupfer(II)-sulfat [Pt(NH3)3Cl3]Cl Trichlorotriamminplatin-(IV)-chlorid [Ni(CO)4] Tetracarbonylnickel(0) 43 Stabilität von Komplexen Beschreibung durch das MWG: Je größer K, desto stabiler der Komplex 44 Der Chelateffekt 4 Teilchen 7 Teilchen Ni2+ [Ni(NH3)6]2+ + 3 en x Κ = 108.6 l6 mol-6 + 6 NH3 Κ = 1018.3 l3 mol-3 Gibbs-Helmholtz-Gleichung ΔRG = ΔRH - Tx ΔRS ΔRG freie Reaktionsenthalpie ΔS >>>>> 0 ΔRH Reaktionsenthalpie ΔRS Reaktionsentropie (Maß für die Unordnung) Chelateffekt = Entropieeffekt. ΔRG < 0 wenn ΔRS >> 0 45 Komplexometrie • Quantitative Bestimmung von Metallkationen durch Komplexbildung mit Chelate Wichtige Chelatbildner: (oder –acetat EDTA) bilden sehr stabile, wasserlösliche Komplexe mit fast allen Kationen Grundlage für die Bestimmung der Wasserhärte 46 Metallindikator Farbwechsel durch pH-Änderung und Komplexbildung 1) Zugabe des Indikators, Komplex mit Ca2+ und Mg2+ entsteht weinrot/purpur 2) Verdrängung des Indikators durch EDTA (= H2Y2-) blau 47 Komplexometrische Bestimmung der Wasserhärte I 48 Bestimmung der Gesamtwasserhärte Gesamthärte = Calciumhärte + Magnesiumhärte Da bei der Reaktion Protonen freigesetzt werden, muß der pH-Wert der Lösung durch Zusatz einer Pufferlösung (NH4+/NH3-Puffer) bei pH 10 konstant gehalten werden. Bei pH > 12 fällt Mg2+ als Mg(OH)2 aus. 1 ml EDTA-Lösung (c = 0,01 mol/l) = 0,01 mmol Ca2+ = 0,56 mg CaO Bei Titration mit EDTA-Lösung der Konzentration c = 0,02 mol/l errechnet sich die Gesamthärte wie folgt: 49 Bestimmung der Kalkhärte 50










![ÜBERGANGSMETALLKOMPLEXE Na2[Fe(CN)5NO] ⋅ 2H2O](http://s1.studylibde.com/store/data/002682926_1-4994fab9e6ff9a7ce3deb92323ee5953-300x300.png)
