Krebs - Schulbuchzentrum Online
Werbung
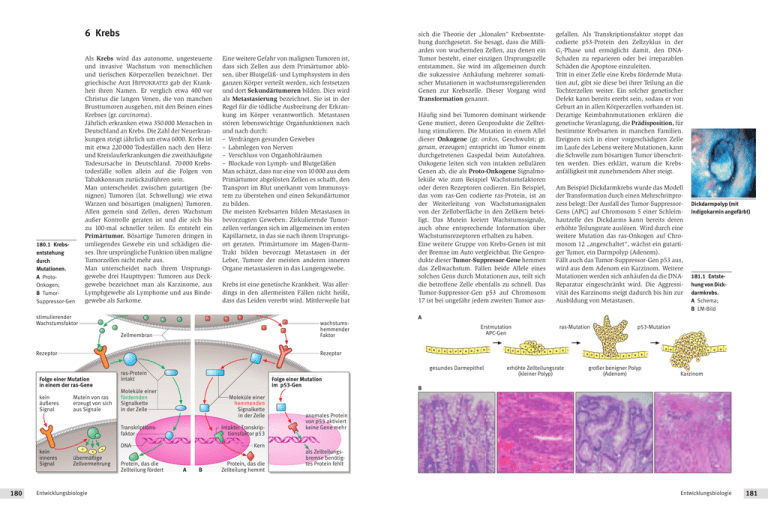
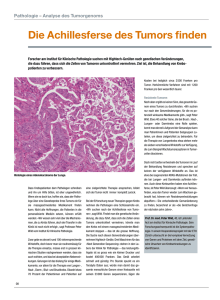
6 Krebs 180.1 Krebsentstehung durch Mutationen. A ProtoOnkogen; B TumorSuppressor-Gen Als Krebs wird das autonome, ungesteuerte und invasive Wachstum von menschlichen und tierischen Körperzellen bezeichnet. Der griechische Arzt HIPPOKRATES gab der Krankheit ihren Namen. Er verglich etwa 400 vor Christus die langen Venen, die von manchen Brusttumoren ausgehen, mit den Beinen eines Krebses (gr. carcinoma). Jährlich erkranken etwa 350 000 Menschen in Deutschland an Krebs. Die Zahl der Neuerkrankungen steigt jährlich um etwa 6000. Krebs ist mit etwa 220 000 Todesfällen nach den Herzund Kreislauferkrankungen die zweithäufigste Todesursache in Deutschland. 70 000 Krebstodesfälle sollen allein auf die Folgen von Tabakkonsum zurückzuführen sein. Man unterscheidet zwischen gutartigen (benignen) Tumoren (lat. Schwellung) wie etwa Warzen und bösartigen (malignen) Tumoren. Allen gemein sind Zellen, deren Wachstum außer Kontrolle geraten ist und die sich bis zu 100-mal schneller teilen. Es entsteht ein Primärtumor. Bösartige Tumoren dringen in umliegendes Gewebe ein und schädigen dieses. Ihre ursprüngliche Funktion üben maligne Tumorzellen nicht mehr aus. Man unterscheidet nach ihrem Ursprungsgewebe drei Haupttypen: Tumoren aus Deckgewebe bezeichnet man als Karzinome, aus Lymphgewebe als Lymphome und aus Bindegewebe als Sarkome. Eine weitere Gefahr von malignen Tumoren ist, dass sich Zellen aus dem Primärtumor ablösen, über Blutgefäß- und Lymphsystem in den ganzen Körper verteilt werden, sich festsetzen und dort Sekundärtumoren bilden. Dies wird als Metastasierung bezeichnet. Sie ist in der Regel für die tödliche Ausbreitung der Erkrankung im Körper verantwortlich. Metastasen stören lebenswichtige Organfunktionen nach und nach durch: – Verdrängen gesunden Gewebes – Lahmlegen von Nerven – Verschluss von Organhohlräumen – Blockade von Lymph- und Blutgefäßen Man schätzt, dass nur eine von 10 000 aus dem Primärtumor abgelösten Zellen es schafft, den Transport im Blut unerkannt vom Immunsystem zu überstehen und einen Sekundärtumor zu bilden. Die meisten Krebsarten bilden Metastasen in bevorzugten Geweben: Zirkulierende Tumorzellen verfangen sich im allgemeinen im ersten Kapillarnetz, in das sie nach ihrem Ursprungsort geraten. Primärtumore im Magen-DarmTrakt bilden bevorzugt Metastasen in der Leber, Tumore der meisten anderen inneren Organe metastasieren in das Lungengewebe. Krebs ist eine genetische Krankheit. Was allerdings in den allermeisten Fällen nicht heißt, dass das Leiden vererbt wird. Mittlerweile hat stimulierender Wachstumsfaktor Am Beispiel Dickdarmkrebs wurde das Modell der Transformation durch einen Mehrschrittprozess belegt: Der Ausfall des Tumor-SuppressorGens (APC) auf Chromosom 5 einer Schleimhautzelle des Dickdarms kann bereits deren erhöhte Teilungsrate auslösen. Wird durch eine weitere Mutation das ras-Onkogen auf Chromosom 12 „angeschaltet“, wächst ein gutartiger Tumor, ein Darmpolyp (Adenom). Fällt auch das Tumor-Suppressor-Gen p53 aus, wird aus dem Adenom ein Karzinom. Weitere Mutationen werden sich anhäufen da die DNAReparatur eingeschränkt wird. Die Aggressivität des Karzinoms steigt dadurch bis hin zur Ausbildung von Metastasen. Dickdarmpolyp (mit Indigokarmin angefärbt) 181.1 Entstehung von Dickdarmkrebs. A Schema; B LM-Bild Erstmutation APC-Gen ras-Mutation p53-Mutation Rezeptor Folge einer Mutation in einem der ras-Gene Mutein von ras erzeugt von sich aus Signale gesundes Darmepithel ras-Protein intakt Folge einer Mutation im p53-Gen Moleküle einer fördernden Signalkette in der Zelle Moleküle einer hemmenden Signalkette in der Zelle Transkriptionsfaktor intakter Transkriptionsfaktor p53 DNA 180 gefallen. Als Transkriptionsfaktor stoppt das codierte p53-Protein den Zellzyklus in der G1-Phase und ermöglicht damit, den DNASchaden zu reparieren oder bei irreparablen Schäden die Apoptose einzuleiten. Tritt in einer Zelle eine Krebs fördernde Mutation auf, gibt sie diese bei ihrer Teilung an die Tochterzellen weiter. Ein solcher genetischer Defekt kann bereits ererbt sein, sodass er von Geburt an in allen Körperzellen vorhanden ist. Derartige Keimbahnmutationen erklären die genetische Veranlagung, die Prädisposition, für bestimmte Krebsarten in manchen Familien. Ereignen sich in einer vorgeschädigten Zelle im Laufe des Lebens weitere Mutationen, kann die Schwelle zum bösartigen Tumor überschritten werden. Dies erklärt, warum die Krebsanfälligkeit mit zunehmendem Alter steigt. A Rezeptor kein inneres Signal Häufig sind bei Tumoren dominant wirkende Gene mutiert, deren Genprodukte die Zellteilung stimulieren. Die Mutation in einem Allel dieser Onkogene (gr. onkos, Geschwulst; gr. genan, erzeugen) entspricht im Tumor einem durchgetretenen Gaspedal beim Autofahren. Onkogene leiten sich von intakten zellulären Genen ab, die als Proto-Onkogene Signalmoleküle wie zum Beispiel Wachstumsfaktoren oder deren Rezeptoren codieren. Ein Beispiel, das vom ras-Gen codierte ras-Protein, ist an der Weiterleitung von Wachstumssignalen von der Zelloberfläche in den Zellkern beteiligt. Das Mutein kreiert Wachstumssignale, auch ohne entsprechende Information über Wachstumsrezeptoren erhalten zu haben. Eine weitere Gruppe von Krebs-Genen ist mit der Bremse im Auto vergleichbar. Die Genprodukte dieser Tumor-Suppressor-Gene hemmen das Zellwachstum. Fallen beide Allele eines solchen Gens durch Mutationen aus, teilt sich die betroffene Zelle ebenfalls zu schnell. Das Tumor-Suppressor-Gen p53 auf Chromosom 17 ist bei ungefähr jedem zweiten Tumor aus- wachstumshemmender Faktor Zellmembran kein äußeres Signal sich die Theorie der „klonalen“ Krebsentstehung durchgesetzt. Sie besagt, dass die Milliarden von wuchernden Zellen, aus denen ein Tumor besteht, einer einzigen Ursprungszelle entstammen. Sie wird im allgemeinen durch die sukzessive Anhäufung mehrerer somatischer Mutationen in wachstumsregulierenden Genen zur Krebszelle. Dieser Vorgang wird Transformation genannt. übermäßige Zellvermehrung Entwicklungsbiologie Protein, das die Zellteilung fördert erhöhte Zellteilungsrate (kleiner Polyp) großer benigner Polyp (Adenom) Karzinom B anomales Protein von p53 aktiviert keine Gene mehr Kern A B Protein, das die Zellteilung hemmt als Zellteilungsbremse benötigtes Protein fehlt Entwicklungsbiologie 181