Mit STED die Logistik der Zelle erforschen
Werbung

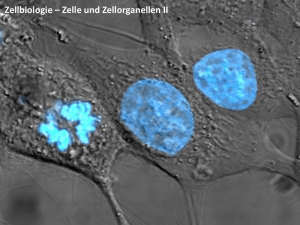
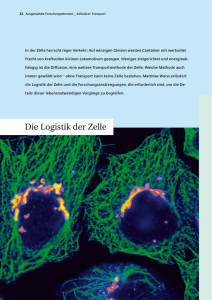
659_708_BIOsp_0609.qxd 17.09.2009 14:06 Uhr Seite 665 Höchstauflösende Lichtmikroskopie Mit STED die Logistik der Zelle erforschen ANJA SCHUÉ 1 , TANJEF SZELLAS 2 1 LEICA MICROSYSTEMS GMBH, WETZLAR 2 LEICA MICROSYSTEMS CMS GMBH, MANNHEIM Die STED-Mikroskopie kann molekulare Prozesse und subzelluläre Strukturen im intakten Gewebe sichtbar machen. Dies hilft der Wissenschaft, die molekularen Grundlagen der Signalübertragung in Nervenzellen sowie des intrazellulären Stofftransports und Sortiermechanismus besser zu verstehen. STED microscopy can visualize molecular processes and subcellular structures in intact tissue. This helps scientists to gain a better understanding of the molecular basis of signal transmission in neurons, the cellular transport, and sorting process. ó In den vergangenen 50 Jahren erzielte die Wissenschaft dramatische Fortschritte in ihren Versuchen, die Funktionsweise des Gehirns auf molekularer Ebene zu verstehen. Ein Großteil der am Aufbau und an der Signalübermittlung beteiligten Strukturen ist außerordentlich klein, das heißt unter 200 nm. Dies begrenzt den Einsatz weitverbreiteter lichtmikroskopischer Methoden. Wie Ernst Abbe bereits im 19. Jahrhundert entdeckte [1], können solch kleine Strukturen mit einem „normalen“ Lichtmikroskop nicht in ihre Details aufgelöst werden. Schärferer Fokus dank Photophysik Mit der Erfindung der STED(Stimulated Emission Depletion)-Mikroskopie ist es nun möglich, subzelluläre Strukturen deutlich kleiner als 100 nm aufzulösen und somit beispielsweise den Aufbau von Synapsen oder die Bewegungen einzelner Vesikel, die Stoffe innerhalb der Zelle transportieren und freisetzen, direkt mit optischen Methoden zu studieren. STED-Erfinder Prof. Dr. Stefan Hell, heute Direktor am Max-PlanckInstitut Göttingen, gelang ein genialer Trick, um Fluoreszenzsignale noch genauer auszulesen [2, 3]. In Laboraufbauten konnte Hell sogar schon in den 10 nm-Bereich vordringen [4]. Erste kommerzielle STED-Systeme (Abb. 1) werden eingesetzt um z. B. die Signalübertragung in den Nervenzellen zu erforschen. ˚ Abb. 1: Das Leica TCS STED wird von Leica Microsystems in Exklusivlizenz hergestellt. BIOspektrum | 06.09 | 15. Jahrgang 659_708_BIOsp_0609.qxd 666 17.09.2009 10:24 Uhr Seite 666 MET H ODE N & AN WE N DU NGEN A B C ¯ Abb. 2: Die Bilder zeigen verschiedene Bereiche in Axonen von Neuronen in Zellkultur. Die Zellen stammen aus dem Hippocampus der Ratte (Rattus norvegicus). Das synaptische Protein Synaptotagmin 1 wurde mit einem primären monoklonalen MausAntikörper und dann mit einem sekundären Antikörper markiert, der den Fluoreszenzfarbstoff trägt (Atto 647N). Im STED-Modus (jeweils rechts) sind die synaptischen Vesikel deutlich als einzelne Punkte zu erkennen, im Gegensatz zum Konfokalmodus (Bilder: Dr. Silvio Rizzoli, European Neuroscience Institute (ENI), Göttingen). ¯ Abb. 3: Beim zellulären Stofftransport werden Substanzen, die über Vesikel in die Zelle gelangen, in den frühen Endosomen sortiert und dann über neue Vesikel weitertransportiert. Mit der STED-Mikroskopie konnte dieser Schritt in vivo und in vitro visualisiert werden. A, links: in vivo-Zellen mit markierten Endosomen (Atto647N-markiertes, in Endosomen gebundenes Transferrin). Rechts: Nach fünf Minuten haben sich von den größeren Endosomen viele kleine Vesikel abgelöst. B, links: isolierte, inaktive Endosomen auf Eis. Rechts: Bei 37 °C ist auch bei in vitro-Endosomen das Ergebnis des Sortierprozesses erkennbar. Maßstabsbalken: 1 μm (aus [11]). Vesikel im Videoclip Dr. Silvio Rizzoli, der als Nachwuchsgruppenleiter am European Neuroscience Institute, Göttingen, arbeitet und auch dem Exzellenzcluster Mikroskopie im Nanobereich am DFG-Forschungszentrum Molekularphysiologie des Gehirns (CMPB) angehört, nutzt die STED-Technologie für seine neurowissenschaftliche Forschung. Sein Interesse gilt den Vesikeln, die an der Signalübertragung beteiligt sind. Sie treten meist in Gruppen von 100 bis 300 auf, gehören aber mit 40 bis 50 nm zu den kleinsten Organellen der Nervenzelle [5]. In Abbildung 2 ist der Auflösungsgewinn bei STED gegenüber der herkömmlichen Konfokaltechnik deutlich erkennbar. Mithilfe der höchstauflösenden Mikroskopie lassen sich einzelne Vesikel unterscheiden. Vergleichbare Auflösungen erreichen sonst nur Elektronenmikroskope, doch damit können keine lebenden Proben untersucht werden. Im Gegensatz zu anderen Höchstauflösungsmethoden ermöglicht die STED-Mikroskopie auch die Verfolgung schneller, dynamischer Prozesse. So können kleinere Areale mit Aufnahmegeschwindigkeiten von mehr als 15 Bildern pro Sekunde untersucht werden. In Laboraufbauten wurden sogar schon Raten von bis zu 30 Bildern pro Sekunde erzielt. Rizzoli und sein Team konnten die Belichtungszeit für einzelne Aufnahmen so drastisch verkürzen, dass sie Bewegungsvorgänge einzelner Vesikel mit einer Rate von 28 Bildern pro Sekunde in Echtzeit einfingen [6]. Zum ersten Mal verfolgten Wissenschaftler live, wie sich die mit Neurotransmittern gefüllten Vesikel über die gesamte Länge der Nervenendigungen bewegen, wie sie zwischendurch an Zellstrukturen binden und sich wieder davon lösen. Bisher war man davon ausgegangen, dass sich Vesikel nur wenig bewegen. Aber das Gegenteil ist der Fall. Sie bewegen sich ständig, sehr schnell und wie zufällig hin und her. Dies war für die Forscher eine große Überraschung, denn die Signalübertragung ist ein hochkomplexer, kontrollierter Prozess. Auch die Erkenntnisse über den Prozess des Vesikel-Recyclings an der Zellmembran haben sich mithilfe von STED grundlegend verändert. Die Göttinger Forscher konnten beispielsweise zeigen, dass Vesikelmoleküle nach Verschmelzen mit der Zellmembran wie ein Öltröpfchen in Wasser zusammenhängen – was das Recycling der Vesikel erleichtert. Die Sortiermaschine der Zelle Vesikel und ihre größeren Geschwister, die Endosomen, spielen in jeder Zelle eine zentrale Rolle beim Stofftransport in die Zelle hinein und aus der Zelle heraus. Wie Substanzen – über die Endozytose und das Abschnüren von Vesikeln aus der Zellmembran – in die Zelle gelangen, ist bereits bekannt. Auch das Andocken der Vesikel an frühe Endosomen und die anschließende Fusion beider sind erforscht. Noch weitgehend ungeklärt ist der Prozess, wie die gemischte Fracht der Vesikel im frühen Endosom sortiert wird und einzelne Substanzen BIOspektrum | 06.09 | 15. Jahrgang 659_708_BIOsp_0609.qxd 17.09.2009 10:24 Uhr in neuen Vesikeln zum Weitertransport abgelöst werden. Hierbei vollbringt die Zelle eine gewaltige logistische Leistung. Endosomen sind mit etwa 200 nm über konventionelle Lichtmikroskope zwar noch zu sehen, aber nicht mehr das Abschnüren neuer Vesikel. Mit STED konnte Rizzoli diesen Schritt des zellulären Sortiermechanismus sowohl in vivo also auch in vitro visualisieren (Abb. 3). Außerdem gelang es Rizzolis Arbeitsgruppe mit STED, diesen Sortiermechanismus noch genauer zu untersuchen, indem sie die beiden fluoreszenzmarkierten Proteine Transferrin und LDL (low density protein) auf ihrem Weg durch die Zelle beobachteten. Transferrin ist ein bekanntes Transportprotein zur Aufnahme von Eisen aus der Nahrung, das von frühen Endosomen aus wieder an die Zellmembran recycelt wird. LDL ist ein Cholesterin-haltiger Lipoproteinkomplex aus der Nahrung, der zur Energiegewinnung abgebaut wird. Über diese Vorgehensweise war es möglich, beide Transportwege zu beobachten. Um Moleküle zu identifizieren, die das Sortieren im frühen Endosom und das nachfolgende Ablösen der Vesikel steuern, wurden zunächst zwei Proteine blockiert, die aus den Andock- und Fusionsprozessen bekannt sind: EEA1 (early endosome autoantigen 1) und NSF (N-ethylmaleimide sensitive factor). Die Experimente brachten Überraschendes zutage. Sind diese Faktoren ausgeschaltet, funktioniert auch das Sortieren und anschließende Ablösen der Vesikel nicht mehr. EEA1 und NSF können anscheinend mehrere Aufgaben übernehmen. Damit entdeckten Rizzoli und sein Team eine bisher unbekannte Verbindung zwischen unterschiedlichen Prozessschritten im zellulären Stofftransport. Potenzial für die Lichtmikroskopie Über Jahrzehnte hat sich an den Grenzen der Lichtmikroskopie wenig getan [7]. Mit der Entwicklung höchstauflösender Methoden wie STED, aber auch lokalisationsbasierter Techniken wie PALM (photo-activated localization microscopy) [8] oder STORM (stochastic optical reconstruction microscopy) [9] haben sich für die Biowissenschaften ganz neue Möglichkeiten ergeben. Ein Endpunkt der Weiterentwicklung der höchstauflösenden Lichtmikroskopie ist noch lange nicht abzusehen. Dabei sind Wissenschaftler zunehmend bestrebt, mit höchster räumlicher Auflösung dynamische Prozesse sichtbar zu machen, ohne hierfür BIOspektrum | 06.09 | 15. Jahrgang Seite 667 Optikexperten werden zu müssen. Diese Anforderung wird auch die Entwicklung neuer Mikroskopieverfahren und -systeme bestimmen. Doch eines ist inzwischen schon sehr deutlich geworden: Die höchstauflösende Mikroskopie bringt die Wissenschaft dem von „Neuro-Papst“ Eric Kandel formulierten Ziel („last frontier“) ein gutes Stück näher, nämlich die biologischmolekulare Grundlage des Bewusstseins, der Denkprozesse und Lernprozesse im Gehirn vollständig zu verstehen [10]. ó Literatur [1] Abbe E (1873) Beiträge zur Theorie des Mikroskops und der mikroskopischen Wahrnehmung. Arch Mikrosk Anat 9:413–420 [2] Hell SW, Wichmann J (1994) Breaking the diffraction resolution limit by stimulated emission. Opt Lett 19:780– 782 [3] Hell SW, Willing KI, Westphal V (2006) Fluoreszenzmikroskopie ohne Beugungsgrenze. BIOspektrum 5:492–494 [4] Rittweger E, Han KY, Irvine SE et al. (2009) STED microscopy reveals crystal colour centres with nanometric resolution. Nature Photonics 3:144–147 [5] Willig KI, Rizzoli SO, Westphal V et al. (2006) STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature 440:935–939 [6] Westphal V, Rizzoli SO, Lauterbach MA et al. (2008) Video-rate far-field optical nanoscopy dissects synaptic vesicle movement. Science 320:246–249 [7] Hell SW (2007) Far-field optical nanoscopy. Science 316:1153–1158 [8] Betzig E, Patterson GH, Sougrat R et al. (2006) Imaging intracellular fluorescent proteins at nanometer resolution. Science 313:1642–1645 [9] Rust MJ, Bates M, Zhuang X (2006) Sub-diffractionlimit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods 3:793–795 [10] Kandel ER, Schwartz JH, Jessell TM (2000) Principles of Neural Science. Mcgraw-Hill Professional, Dubuque, USA. [11] Barysch SV, Aggarwal S, Jahn R et al. (2009) Sorting in early endosomes reveals connections to docking- and fusion-associated factors. PNAS 106:9697–9702 Korrespondenzadressen: Anja Schué Leica Microsystems GmbH Ernst-Leitz-Straße 17–37 D-35578 Wetzlar Tel.: 06641-29-2201 Fax: 06641-29-2527 [email protected] Dr. Tanjef Szellas Leica Microsystems CMS GmbH Am Friedensplatz 3 D-68165 Mannheim Tel.: 0621-7028-2702 Fax: 0621-7028-1028 [email protected]