genetik in der kardiologie zhl - Zentrum für Humangenetik und
Werbung

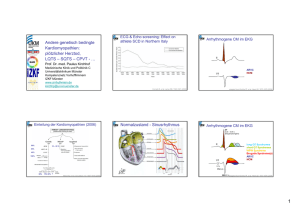
Zytogenetik Reproduktionsgenetik Immungenetik Immunbiologie/Klinische Chemie Pharmakogenetik/Nutrigenetik Stoffwechselgenetik Neurogenetik Molekulare Onkologie Molekulare Mikrobiologie/Virologie Abstammungsgutachten Arrhythmogene rechtsventrikuläre Dysplasie (ARVD) (PKP2-, DSP-, DSG2-Gen) Mutationssuche in diesen Genen (Sensitivität ca. 50 - 60%) Catecholaminerge polymorphe ventrikulär Tachykardie (CPVT) Stufendiagnostik (RYR2-, CASQ2-Gen) Stufe I: Mutationssuche von 7 häufig betroffenen Exons im RYR2-Gen Stufe II: Mutationssuche in den restlichen 98 Exons des RYR2-Gens, Deletion von Exon 3 Stufe III: Mutationssuche im CASQ2-Gen Next Generation Sequencing (NGS) - Paneldiagnostik (40 Gene) # Bei schwieriger Differenzialdiagnostik (z.B. plötzlicher Herztod ohne strukturelle Ursache) ist nach Rücksprache die parallele Analyse von insgesamt 40 Genen mittels NGS möglich, wodurch sich die Aussagekraft der molekulargenetischen Diagnostik verbessern kann. Folgende Gene werden derzeit bei HCM/DCM, ARVD und SID mittels NGS zusätzlich untersucht: OLFML2B, TPM1, MYL3, MYL2, ACTC1, CSRP3, TNNC1, PLN, PRKAG2, MYLK2, TCAP, DES, JUP, DSC2. # nicht akkreditiertes Verfahren Untersuchungsmaterial 1 ml EDTA-Blut, normaler Postweg oder kostenlose Probenabholung Dauer der Untersuchung Stufe I: ca. 3 Wochen; Stufen II und III: ca. 6–12 Wochen G ENETIK IN DER K ARDIOLOGIE Herzrhythmusstörungen | Kardiomyopat hien Angeborene Herzfehler | Systemerkrankungen Akkreditiert nach DIN EN ISO/ IEC 17025, DIN EN ISO 15189, EFI-Akkreditierung www.medizinische-genetik.de Z ENTRUM FÜR H UMANGENETIK UND L ABORATORIUMSMEDIZIN Dr. Klein, Dr. Rost und Kollegen Medizinisches Versorgungszentrum Lochhamer Str. 29 82152 Martinsried Tel.: +49.89.895578-0 Fax: +49.89.895578-780 www.medizinische-genetik.de [email protected] Version 06.3/24.04.2012 Hypertrophe Kardiomyopathie (HCM) - Stufendiagnostik (MYH7-, TNNT2-, MYBPC3-, TNNI3-Gen) Stufe I (Sensitivität ca. 30%): Mutationssuche in 16 Exons des MYH7- und MYBPC3-Gens Stufe II (zusätzliche Sensitivität ca. 25%): Mutationssuche in allen verbleibenden 79 Exons der Gene MYH7, MYBPC3, TNNT2, TNNI3 Molekulargenetik Dr. Klein, Dr. Rost und Kollegen Brugada-Syndrom (BrS) - Stufendiagnostik (SCN5A-, GPD1L-, CACNA1C-, CACNB2-, SCN1B-, KCNE3-, SCN3B-Gen) Stufe I (Sensitivität ca. 25%): Mutationssuche SCN5A-Gen Stufe II (zusätzliche Sensitivität ca. 5%): Mutationssuche in den Genen GPD1L, CACNA1C, CACNB2, SCN1B, KCNE3, SCN3B Stufe III (zusätzliche Sensitivität ca. 1%): Deletions-/Duplikationsdiagnostik SCN5A-Gen Klinische Genetik Z ENTRUM FÜR H UMANGENETIK UND L ABORATORIUMSMEDIZIN Long QT-Syndrom (LQTS) - Stufendiagnostik (KCNQ1-, KCNH2-, SCN5A-, KCNE1-, KCNE2- ANK2-, KCNJ2-, CAV3-, SCN4B-, KCNE3-, SNTA1-Gen) Stufe I (Sensitivität ca. 40%): Mutationssuche in 10 Exons des KCNQ1- und KCNH2-Gens Stufe II (Sensitivität inkl. Stufe I ca. 70%): Mutationssuche in allen verbleibenden 51 Exons der Gene KCNQ1, KCNH2, SCN5A, KCNE1, KCNE2 Stufe III (zusätzliche Sensitivität ca. 2%): Deletions-/Duplikationsdiagnostik der Gene KCNQ1, KCNH2, KCNE1, KCNE2 Stufe IV (zusätzliche Sensitivität ca. 1%): Mutationssuche in weiteren Genen, die seltener ursächlich für LQTS sind (Rücksprache erforderlich): ANK2, KCNJ2, CAV3, SCN4B, KCNE3, SNTA1 Long QT-Syndrom (LQTS), familiäre Form Brugada-Syndrom (BrS) LQTS ist eine klinisch und genetisch heterogene Erkrankung des Herzreizleitungssystems, die durch eine verlängerte ventrikuläre Repolarisation gekennzeichnet ist. Im Langzeit - EKG lässt sich in der Regel eine verlängerte frequenzkorrigierte QT - Zeit (QTc) von 440 bis > 500 ms nachweisen. In Abhängigkeit von der QTc kommt es zu Arrhythmien, die zu Bewusstlosigkeit und plötzlichem Herztod führen können. Die Prävalenz des LQTS wird in der kaukasischen Bevölkerung mit ca. 1:5.000 angegeben. In ca. 70% der klinisch gesicherten Fälle können Mutationen in einem von 5 myokardialen Ionenkanal-Genen nachgewiesen werden: BrS ist eine der häufigsten Ursachen für plötzlichen Herztod und ursächlich für ca. 20-30% der Todesfälle mit strukturell unauffälligem Herzen. Es handelt sich um eine autosomal-dominant vererbte Erkrankung (Häufigkeit ca. 1:2.000), 90% der Betroffenen sind männlichen Geschlechts. Charakteristisch für BrS ist eine persistierende ST-SegmentHebung im EKG (rechts präkordiale Ableitung), die in manchen Fällen nur mittels Antiarrhythmika wie Ajmalin oder Flecainid demaskiert werden kann. Beim BrS besteht eine Neigung zu schnellen polymorphen ventrikulären Tachykardien und Kammerflimmern. Die Symptome treten oft nachts auf und führen häufig zum plötzlichen Herztod. KCNQ1 (LQTS Typ 1; 47 % der Mutationen, eigene Daten) kodiert für einen spannungsabhängigen kardialen K+-Kanal. Mutationen mit dominanter oder rezessiver Ausprägung (Romano-Ward [RW]- und Jervell-Lange-Nielsen-Form [JLN]-Form) sind beschrieben. Es besteht ein hohes Risiko für kardiale Ereignisse. Brugada-Syndrom KCNH2 (LQTS Typ 2; 31 % der Mutationen, eigene Daten) kodiert für einen weiteren K+-Kanal (HERG). Mutationen sind ursächlich für RWFormen. Es besteht ein hohes Risiko für kardiale Ereignisse. SCN5A (LQTS Typ 3; 18 % der Mutationen, eigene Daten) kodiert für einen kardialen Na+- Kanal. Kardiale Ereignisse sind seltener, die Letalität ist jedoch deutlich höher. KCNE1 (LQTS Typ 5; 3 % der Mutationen, eigene Daten) kodiert für die regulatorische ß-Untereinheit des KCNQ1-Kanals. Mutationen können zur RW- oder JLN-Form führen. KCNE2 (LQTS Typ 6; 1% der Mutationen, eigene Daten) kodiert für MIRP1, eine Untereinheit des HERG-Kanals. Typ1-EKG Typ2-EKG Typ3-EKG BrS Typ 1 (links): schulterförmige ST-Hebung ≥ 2mm, negative T-Welle in mindestens 2 der Ableitungen V1-V3 BrS Typ 2 (Mitte): sattelförmige ST-Hebung, erhöhter ST-Abgang ≥ 2 mm, ST-Hebung ≥ 1 mm BrS Typ 3-EKG (rechts): sattel- oder schulterförmige ST-Hebung < 1mm mod. n. Beckmann et al., Dt. Ärtzeblatt 2011 Hypertrophe Kardiomyopathie (HCM) Bei der HCM handelt es sich um eine autosomal-dominant vererbte, strukturelle Erkrankung des Herzmuskels (Häufigkeit ca. 1:500), die in der Regel mit einer asymmetrisch erhöhten Muskelmasse des linken Ventrikels unter Beteiligung des interventrikulären Septums assoziiert ist. Hierdurch kommt es zu charakteristischen Veränderungen im EKG, insbesondere der Q-Welle, der ST-Strecke und der P-Welle. Der Phänotyp variiert von benignen, unvollständig penetranten bis hin zu malignen Formen mit hohem Risiko für plötzlichen Herztod bereits im Kindesalter. Bislang wurden im Zusammenhang mit HCM Mutationen in 15 verschiedenen Genen identifiziert, die bis auf zwei Gene ausschließlich für kardiale Proteine der Sarkomere kodieren. Über 85% der bisher beschriebenen Mutationen befinden sich in den Genen für die schwere Kette des ß-Myosins (MYH7), das Myosinbindeprotein-C (MYBPC3), Troponin T (TNNT2) und Troponin I (TNNI3). Arrhythmogene rechtsventrikuläre Dysplasie/ Kardiomyopathie (ARVD) Long QT-Syndrom LQTS Typ 1-EKG: charakteristisch sind breitbasige T-Wellen und verlängerte QTc Die ARVD ist eine meist autosomal-dominant vererbte, progredient verlaufende Erkrankung des Herzmuskels (Häufigkeit ca. 1:5.000), bei der das Myokard vorwiegend des rechten Ventrikels durch Fett- und Bindegewebe ersetzt wird. Es kommt zu Störungen der Reizleitung (ventrikuläre Arrhythmien mit Linksschenkelblock), Palpitationen oder Synkopen, die durch körperliche Anstrengungen ausgelöst werden und zu plötzlichem Herztod führen können. Im EKG zeigt sich bei rechts präkordialer Ableitung eine invertierte T-Welle mit verbreitertem QRS-Komplex. Die häufigsten Formen der ARVD sind in ca. 5060% der Fälle mit Mutationen in Genen assoziiert, die für Bestandteile der Desmosomen kodieren (Desmoplakin [DSP], Plakophilin-2 [PKP2] oder Desmoglein-2 [DSG2]). Catecholaminerge polymorphe ventrikuläre Tachykardie (CPVT) Die CPVT ist eine autosomal-dominant vererbte Erkrankung des strukturell gesunden Herzmuskels (Häufigkeit ca. 1:10.000). Die Arrhythmien sind adrenerg induziert und manifestieren sich im Kindes- und Jugendalter. Unbehandelt führt die CPVT oft zu Synkopen und in 30-50% der Fälle zu plötzlichem Herztod vor dem 30. Lebensjahr. Je früher Synkopen auftreten, desto schlechter ist die Prognose. Unter Therapie mit ßBlockern bleiben jedoch ca. 30% der Patienten symptomatisch und benötigen eventuell einen implantierbaren Defibrillator. Bei ca. 50% der CPVT-Patienten können ursächliche Mutationen im Ryanodin Typ 2-Rezeptor-Gen (RYR2) nachgewiesen werden, welches für den wichtigsten Ca++-freisetzende Kanal des sarkoplasmatischen Retikulums kodiert, der eine zentrale Rolle bei der Aktivierung der Kardiomyozyten spielt. Seltener sind Mutationen im Calsequestrin-Gen (CASQ2), die bei ca. 7% der Patienten nachweisbar sind und zu einer rezessiv CPVT - EKG: ventrikuläre ES vererbten Form der CPVT führen. Angeborene Herzfehler/Systemerkrankungen Noonan-Syndrom (PTPN11-, KRAS-, SOS1-Gen): meist Pulmonalstenose, seltener hypertrophe Kardiomyopathie. CHARGE-Syndrom (CHD7-Gen): verschiedene, angeborene Herzfehler Williams-Beuren-Syndrom (Mikrodel. 7q11.23): supravalvuläre Aortenstenose und/oder (supravalvuläre und/oder periphere) Pulmonalstenose. Mikrodeletion 22q11.2 (z.B. DiGeorge- oder Shprintzen-S.): konotrunkale Herzfehler (z.B. Transposition der großen Arterien, Fallotsche Tetralogie). Oft mit Aortenbogenanomalien. Marfan-Syndrom (FBN1-Gen): Erweiterung der Aortenwurzel, Aortenaneurysma und -dissektion; ähnliche Veränderungen auch bei MarfanSyndrom Typ II und Loeys-Dietz-Syndrom (TGFBR1- und 2-Gen).