Wirkungsmechanismen Wirkungsmechanismen regulatorischer
Werbung

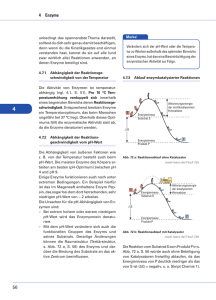
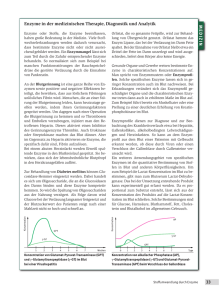
Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches Enzym ist das geschwindigkeitsbesimmende (langsamst fungierende) Enzym in einem Multienzymsystem. Ein Modulator ist eine chemische Verbindung, die die Aktivität eines regulierenden Enzyms erhöht oder erniedrigt. Dadurch kann eine lebende Zelle auf wechselnden Bedarf ihrer Funktionen optimal reagieren. Allosterische Modulatoren binden sich durch schwache Wechselwirkungen reversibel an solche regulatorische Enzyme, die meistens zum Leben der Zelle kontinuierlich aber auf unterschiedlichem Niveau benötigte chemische Prozesse regulieren. Nicht-allosterische Modulatoren binden sich über kovalente Bindungen reversibel an solche regulatorische Enzyme, die meistens Alles-oder-Nichts Reaktionen regulieren. Für Modulatoren befinden sich spezifiseche Bindungsstellen (modulatorische Zentren) in regulatorischen Enzymen weit entfernt von ihren aktiven Zentren. Allosterische Modulatoren bewirken eine Änderung in Konformation der regulatorischen Enzyme Allosterische Modulatoren können sowohl aktivierend als auch hemmend sein. Homotrope Modulation: Modulator und Substrat sind gleich. Heterotorope Modulation: Modulator und Substrat sind unterschiedlich. Aktives Zentrum und Substrat sind nicht Komplementär. C ~ katalytische Einheit R ~ regulatorische Einheit regulatorisch regulatorisch katalytisch katalytisch Zwei Ansichten der Quartärstruktur von Aspartat-Transcarbamoylase, die mit 12 Protein-Untereinheiten die Nukleotid-Polymerisation reguliert. Rückkopplungs(„feedback”) Inhibition bei allosterisch, heterotrop und inhibierend modulierter Enzym-Regulation Das Endprodukt eines Multienzymsystems (das Produkt seines letzten Enzyms) ist ein inhibierender Modulator des regulatorischen Enzyms (seines ersten Enzyms). ⇐ Regulation der Konzentration von L-Isoleucin in Bakterien: Nimmt die Konzentration von L-Isoleucin in dem Bakterium zu, so wird die Aktivität der ThreoninDehydratase inhibierend moduliert, und dadurch die Aktivität des Multienzymsystems und letztendlich die Entstehung des als inhibierender Modulator wirkenden L-Isoleucins unterdruckt; und umgekehrt. Die kinetischen Eigenschaften allosterisch modulierten regulatorischen Enzyme hyperbolische Sättigungskurve der nichtreguliatorischen Enzyme (MichaelisMenten-Kinetik) zwei Klassen der allosterisch und heterotrop modulierten, regulatorischen Enzyme Die sigmoide Form der Sättigungskurve bei der allosterisch modulierten regulatorischen Enzyme ist durch das kooperative Verhalten ihrer Protein-Untereinheiten bewirkt. Allosterisch und heterotrop modulierte, regulatorische Enzyme können Bindungsstellen für sowohl aktivierende als auch hemmende Modulatoren haben. Reversible, kovalente Modulation regulatorischer Enzyme Phosphorylierung ist mittels ProteinKinasen, Dephosphorylierung mittels ProteinPhosphatasen katalysiert. Phosphorylierung mittels ATP und Proteinkinasen wird in lebenden Zellen auch für andere Zwecke verwendet. Infolgedessen sind über die Hälfte der Proteine von eukaryotischen Zellen in mehr als einer Stelle phosphoryliert. Phosphorylierung kann die Aktivität regulatorischer Enzyme auf untershiedlichen Wegen modulieren. Isocitrat-Dehydrogenase regulierte Reaktion Isocitrat3 - + NAD+ ↔ α-Ketoglutarat2 - + NADH + CO2 Glycogen-Phosphorylase regulierte Reaktion (Glucose)n + Pi GlycogenKette ↔ (Glucose)n-1 + Glucose-1-phosphat verkürzte Glycogenkette ⇑ Glycogen-Phosphorylase Die Aktivität von Glycogen-Phosphorylase ist auf unterschiedlichen Wegen moduliert Serin-Phosphorylierungsstellen (kovalente Modulation) Bindungsstellen für AMP (allosterische Modulation) Bindungsstellen für PyridoxalPhosphat (Cofaktor) Aktive Zentren Molekulargerüst von Glycogen–Phosphorylase-a Einheit-1 Einheit-2 Beeinflussende Faktoren der Protein-Phosphorylierung S ~ Serin Sp ~ Serin-Pi T ~ Threonin Tp ~ Threonin-Pi Y ~ Tyrosin Yp ~ Tyrosin-Pi X ~ beliebiger Aminosäurerest B ~ beliebiger aromatischer Aminosäurerest R ~ Arginin K ~ Lysin Q ~ Glutamin I ~ Isoleucin V ~ Valin P ~ Prolin E ~ Glutamat D ~ Aspartat M ~ Methionin G ~ Glycin L ~ Leucin A ~ Alanin N ~ Asparagin Bestimmte Aminosäurereste, die in der Primärstruktur weit von der Consensus-sequenz liegen aber in der dreidimensionalen Struktur benachbart sind, können den Zutritt einer Proteinkinase zu ihrer spezifischen Consensus-Sequenz verhindern. Mehrfache Phosphorylierung regulatorischer Enzyme Hierarchische Phosphorylierung: Eine Bindungsstelle lässt sich mittels ihrer spezifischen Proteinkinase nur in dem Fall phosphorylieren, wenn eine andere Bindungsstelle mit einer anderen Proteinkinase schon phosphoryliert ist. Mittels mehrfacher Phosphorylierung lässt sich die Aktivität einiger regulatorischen Enzyme auf eine fein abgestimmte Weise regulieren. Proteolytische Spaltung inaktiver Enzymvorstufen (Zymogenen) als ein Regulationsmechanismus Diese Art Entstehung regulatorischer Enzyme ist irreversibel. Daher ist eine Inaktivierungsmöglichkeit, wie irreversible Inhibition, immer bereitgestellt. Was ist der Vorteil der dargestellten Komplexität der Regulation enzymatischer Prozesse? Würden in einer Zelle alle möglichen Reaktionen gleichzeitig und unkontrolliert verlaufen, würde die Zelle durch enzymatischen Abbau der Makromoleküle rasch getötet. Es ist die Regulierung der enzymatischen Katalyse, die ermöglicht, dass immer nur solche Reaktionen gefördert werden, die für die Zelle zu einem gegebenen Zeitpunkt wichtig sind. Kann die Zelle auf umfangreiche Vorräte extrazellulärer chemischer Bausteine und chemischer Energie zugreifen, wird sie intrazelluläre Vorräte von für sie wichtigen Stoffen speichern. Herrscht dagegen Mangel an extrazellulären chemischen Bausteinen oder chemischer Energie, können die gespeicherten Vorräte zum Betrieb des zellulären Stoffwechsels eingesetzt werden. Sowohl die ökonomische Aufnahme und Verarbeitung extrazellulärer chemischer Verbindungen, als auch der ökonomische Verbrauch intrazellulärer Vorräte wird durch das Regulationssystem der enzymatischen Katalyse verwirklicht, je nach Bedarf der Zelle.