Vorlesung Neuropharmakologie WS 2006/07
Werbung
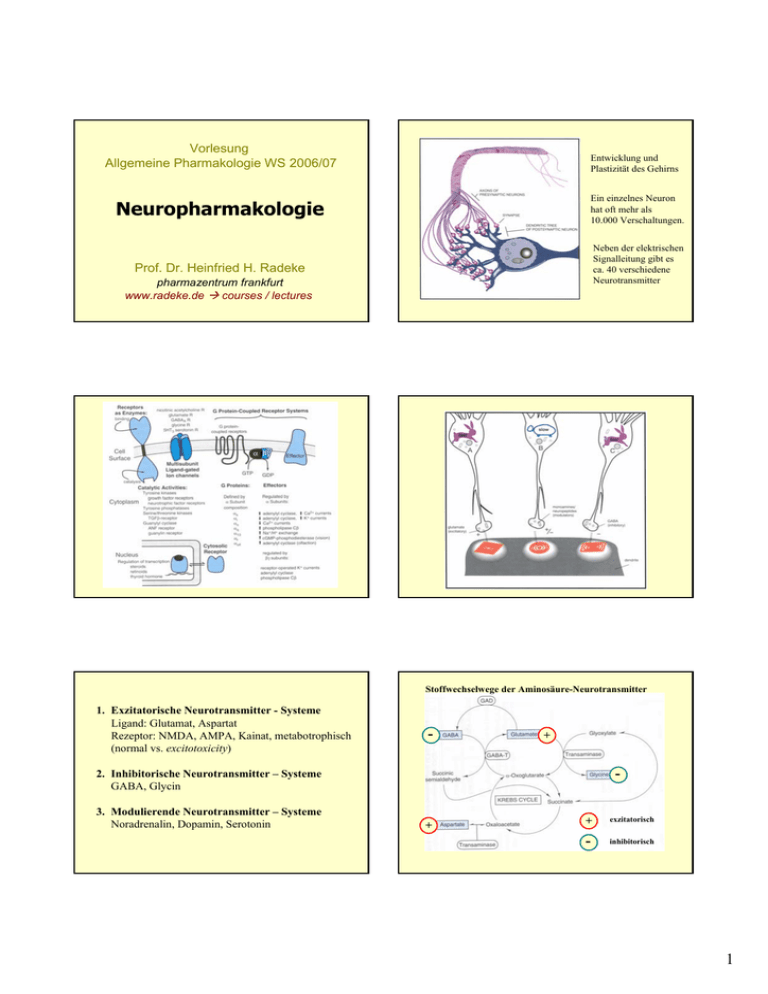
Vorlesung Allgemeine Pharmakologie WS 2006/07 Entwicklung und Plastizität des Gehirns Neuropharmakologie Ein einzelnes Neuron hat oft mehr als 10.000 Verschaltungen. Prof. Dr. Heinfried H. Radeke Neben der elektrischen Signalleitung gibt es ca. 40 verschiedene Neurotransmitter pharmazentrum frankfurt www.radeke.de Æ courses / lectures Stoffwechselwege der Aminosäure-Neurotransmitter 1. Exzitatorische Neurotransmitter - Systeme Ligand: Glutamat, Aspartat Rezeptor: NMDA, AMPA, Kainat, metabotrophisch (normal vs. excitotoxicity) - + - 2. Inhibitorische Neurotransmitter – Systeme GABA, Glycin 3. Modulierende Neurotransmitter – Systeme Noradrenalin, Dopamin, Serotonin + + exzitatorisch - inhibitorisch 1 Neuronale Grundaktivität wird reguliert durch einfache Moleküle Modulierende Neurotransmitter - Noradrenalin Mangel = Depression aber siehe auch Serotonin Modulierende Neurotransmitter - Dopamin Zuviel = Schizophrenie Modulierende Neurotransmitter - Serotonin 5-HT agonists Clozapin 5-HT2+3 antagonist schizophrenia Tranquilizer, Depression, Schizophrenie 2 Wirkungen von Pharmaka an der Synapse Synthese Metabolisierung Wirkungen von Neuropharmaka an der Synapse Synthese: Levodopa- Morbus Parkinson Speicherung: Reserpin Speicherung Wiederaufnahme: Trizyklische Antidepressiva Wiederaufnahme Freisetzung Abbau Rezeptor Postsynaptischer Rezeptor: Morphin- Analgesie, Haloperidol- Schizophrenie Ionenkanäle: Phenytoin- Epilepsie, Benzodiazepine- Angst, Unruhe, Schlaflosigkeit Ionenkanäle Second messenger: Lithium- Cyclothymie Second messengers 2 1 2 4 3 Neuroleptika (Antipsychotika) - Phenothiazine - Butyrophenone - Clozapin LEITLINIEN 2005: http://www.uni-duesseldorf.de/WWW/AWMF/ll/038-009.htm Deutsche Gesellschaft für Psychiatrie, Psychotherapie und Nervenheilkunde DGPPN (Hrsg.). S3 Praxisleitlinien in Psychiatrie und Psychotherapie. Band 1 – Behandlungsleitlinie Schizophrenie. Steinkopff-Verlag, Darmstadt, November 2005 An der Schizophrenie beteiligte dopaminerge Bahnen Dopamin-Rezeptorsubtypen - D1: ? - D2: Schizophrenie? - D4: gehäuft im mesolimbischen System - Schizophrenie? Ätiopathogenetisches Grundkonzept: „Vulnerabilitäts-Stress-Coping-Modell“ Neurobiochemisch: u. a. Überaktivität des mesolimbischen dopaminergen Systems (D2/D4) 3 Serotonin-Rezeptorsubtypen - HT1A: Angst, Depression Schizophrenien sind eine Gruppe endogener Psychosen, denen eine vielschichtige Persönlichkeitsstörung mit - HT1C: Migräne Veränderung des Denkens - HT2A: Migräne, Angst, Hunger Fühlens und - HT3 : Nausea, Angst, Psychosen der Beziehung zur Umwelt zugrunde liegt Epidemiologie 0.5 -1.6 % Prävalenz 0.06% Inzidenz Altersmedian 25 Jahre Männer, 33 Jahre Frauen gleich Geschlechtsverteilung untere Klassen häufiger, “Abwärtsdriften” Winter häufiger Sozioökonomischer Status Jahreszeit Kultur 50/50 verschiedene Länder und Kulturen gleich Schizophrenie Leitsymptome (nach ICD-10) 1. Gedankenlautwerden, -eingebung, -entzug, -ausbreitung 2. Kontroll- oder Beeinflussungswahn; Gefühl des Gemachten bzgl. Körperbewegungen, Gedanken, Tätigkeiten oder Empfindungen; Wahnwahrnehmungen. 3. Kommentierende oder dialogische Stimmen. 4. Anhaltender, kulturell unangemessener oder völlig unrealistischer „ bizarrer“ Wahn Subgruppen schizophrener Störungen Typ I Plussymptomatik Æ spricht gut auf Neuroleptika an. Basisstörung ist vermutlich Hypersensitivität von D2Rezeptoren Beteiligung von Monoaminen, Acetylcholin und GABA Æ Verschiebung des Transmittergleichgewichtes zu Dopamin 5. Anhaltende Halluzinationen jeder Sinnesmodalität. 6. Gedankenabreißen oder -einschiebungen in den Gedankenfluss. 7. Katatone Symptome wie Erregung, Haltungsstereotypien, Negativismus oder Stupor. 8. Negative Symptome wie auffällige Apathie, Sprachverarmung, verflachter oder inadäquater Affekte Typ II Minussymptomatik Æ chronischer Verlauf, spricht schlecht auf Neuroleptika an Hirnorganische Veränderungen mit Ventrikelerweiterung und Hirnatrophie > ein eindeutiges Symptom der Gruppen 1–4 ODER > zwei Symptome der Gruppen 5–8; fast ständig einen Monat oder länger 4 “Typische” Neuroleptika Neuroleptika /Antipsychotika I. Phenothiazine/ Thioxanthene sind Substanzen, die eine antipsychotische Wirkung besitzen ohne Bewußtsein und intellektuelle Fähigkeiten zu beeinflussen Hemmung psychischer Erregbarkeit relative Indifferenz zur Umwelt Distanzierung von der Psychose Beispiel: Chlorpromazin S N Cl CH H2 H2 3 CH2 C C N CH3 II. Butyrophenone O sedierende und vegetativ dämpfende Wirkung rezidivprophylaktisch Beispiel: Haloperidol bei Ersterkrankung: atypische Neuroleptika zuerst !* *aber nicht Clozapin “Atypische” Neuroleptika Einteilung der Neuroleptika nach neuroleptischer Potenz neuroleptische Potenz III. Dibenzodiazepine N N Beispiel: Clozapin Cl N H N CH3 N O O N Beispiel: Risperidon Beispiel eines typischen Neuroleptikums Blockade von: Schwach Promazin Sulpirid Chlorprothixen 0.5 0.5 0.7 Mittelstark Chlorpromazin Clopenthixol Perazin 1.0 2-3 5 extrapyramidale Nebenwirkungen sedierende Wirkung vegetative Wirkung F IV. Benzisoxazole N Cl hohe „Evidenz“: Haloperidol, Flupentixol, Fluphenazin, Perazin CH3 N OH C CH2 CH2 CH2 N F H1-Histamin Stark Perphenazin Trifluperazin 10 10-20 Sehr stark Reserpin Haloperidol Benperidol 20-50 50 200 Dopaminerge Bahnen und Symptome bei Blockade extrapyramidale Symptome verminderte schizophrene Symptomatik alpha-1-adrenerg Minussymptome M1-cholinerg D2-dopaminerg Laktation 5 Wirkungen von typischen Neuroleptika Gewichtszunahme Schwindel Blockade von: α1 H1 Benommenheit Atypische Neuroleptika trockener Mund erniedrigter Blutdruck D2 M1 verschwommene Sicht Obstipation antipsychotisch + erniedrigen Krampfschwelle (!), verursachen allergische Reaktionen Spektrum der Neuroleptika Atypika zur Erstbehandlung: Risperidon oder Olanzapin Neuroleptika: Wirkungen und UAW M1 H1 α-1 α-1 5HT2 Präferenzielle D2 Antagonisten D2 D2 D2 D4 z.B. Chlorpromazin Erwünschte Wirkungen : (D2, D4, 5HT2 (Clozapin)) Fluphenazin, etc. Unerwünschte Wirkungen: Konventionelle : Neuroleptika Atypische Neuroleptika: Multiple therapeutische Mechanismen = verbesserte Wirkung = verbesserte Rezidivprophylaxe Multiple Mechanismen und UAW Haloperidol Hypothetisch, episodischer Verlauf einer Schizophrenie (D2, α-1, H1, M1): • • • • z.B. Clozapin antips ychotische W. (weniger Plussymptome) anxiolytische Wirkung Seda tion (weniger bei Clozapin) geringe antidepressiv e W. • motorische Wirkungen (D2) • extra pyramidale Störungen (nic ht bei Clozapin) • chore atisc he Be wegung, Tremor, Se nkung der Krampfschwelle • Hyperprolactinä mie (D2) • weniger starke vegeta tive Wirkungen im V ergle ich zu TCA: • Mundtrock enheit , Obs tipation, Gewichts zuna hme, Hypotonie (M1, H1, α-1) • vers tärkte Nega tivsy mptome (nicht bei atypische n Ne uroleptika) • Agra nulozytose (0.5-2% be i Clozapin!!) • Wec hselwirkung mit anderen zentral-wirk enden Pharmaka, u.a . an CYP450 Extrapyramidale Komplikationen der neuroleptischen Therapie Frühdyskinesien akut Hyperkinesie der mimischen Muskulatur, Augen, Zunge, Parkinson-Syndrom abhängig von der Dosierung, Behandlung mit Anticholinergika Akathesie nach Parkinsonsyndrom, Unruhe, Patient kann nicht “sitzen bleiben”, Verminderung der Anticholinergika, Benzodiazepine residual prodromal Spätdyskinesien Patienten über 50 mit organischer Hirnschädigung, hyperkinetisches Syndrom, Verminderung der Neuroleptikadosis, Clozapin. malignes, neuroleptisches Syndrom + - Symptomatik Mortalität bis zu 20%, schwere extrapyramidal-motorische Störungen (Rigor, Stupor), Bewußtseinstörung, Kreislaufstörung, hohes Fieber, Absetzen der Neuroleptika, Behandlung mit Dantrolen, Bromocriptin 6 Pharmakokinetik variable orale Bioverfügbarkeit hohes Verteilungsvolumen, gute Verteilung ins ZNS hohe Plasmaproteinbindung Oxidation durch Cytochrom P450-Enzyme in der Leber Klinische Verwendung von Neuroleptika Schizophrenie Schwindel und Erbrechen Tranquilizer Butyrophenone werden Phase II-metabolisiert: Glucuronidierung Angstsyndrome Halbwertszeiten in der Regel zwischen 20-40h Kinder elimieren Pharmaka schneller als Erwachsene in Kombination mit Analgetika in der Schmerztherapie hauptsächlich hepatische Elimination Neuroleptanästhesie Bewegungssyndrome (z.B. Chorea Huntington) “Slow Release” Formulierungen Vernetzung von Neuronen bei Schizophrenie Beispiele Haloperidoldecanoat, Fluphenazindecanoat, Depot-Risperidon i.m.-Gabe, terminale Halbwertszeit: 7-10 Tage bei Patienten mit schlechter Compliance Problem: 30% der Patienten entwickeln bei typischen Antipsychotika extrapyramidale Symptome Toleranzentwicklung: ja, aber klinisch weniger bedeutend, hauptsächlich sedativer Effekt betroffen Abhängigkeit: nein normale DNA 3 abnormale DNA Antidepressiva (affektive Erkrankung uni- / bipolar) - Trizyklische Antidepressiva - Monoaminooxidase-Hemmer - alpha-2-Antagonisten - Selektive SerotoninrücknahmeInhibitoren (SSRI) Stiftung Warentest 07/2004 7 Depressives Syndrom Symptomgruppen: 1. Stimmung und Verhalten - Verlust von Freude, Motivation und Interesse 2. Kognitive Funktionen - Verlust von Konzentration - niedrige Frustrationstoleranz - vermindertes Erinnerungsvermögen 3. Vegetative Funktionen - Schlafstörungen - verminderte Libido - Gewichtsverlust - Obstipation 4. Antriebsverminderung 5. Somatisierung - Kopfschmerz - Muskelspannung Stiftung Warentest 07/2004 Gesamtbehandlungsplan der Depression Internistische Internistische Therapie Therapie Pharmakotherapie Pharmakotherapie mit mitAntidepressiva Antidepressiva Psychotherapie Psychotherapie Prognose der unbehandelten Depression Normalzustand 40% komplette Erholung 20% Dysthymie 40% Depression Depression Körperlich Körperlich begründbare begründbare Depression Depression Endogene Endogene Depression Depression Neurotische Neurotischeund und reaktive reaktiveDepression Depression 1 Jahr Vergleich des Therapieerfolges nach Behandlung mit Placebo und Antidepressiva Therapie mit Placebo für 8 Wochen normal 33% Responder 67% Non-Responder Depression 8 Wochen normal 67% Responder 33% Non-Responder Therapie mit Antidepressiva für 8 Wochen Wichtige Substanzen, die Depressionen auslösen können - Drogen: Alkohol, Amphetamine, Cocain, und Opiate - verschiedene Antiparkinsonmittel - verschiedene antineoplastische Pharmaka, IFNß - verschiedene Antihypertonika: β-Blocker, Methyldopa - Steroide - orale Kontrazeptiva - Digitalis (Toxizität) - Sulfonamide - verschiedene Tranquilizer - Östrogene - Indomethacin Depression 8 Wochen 8 Risikofaktoren für die Entwicklung einer Depression Negative “life events”, Stress früher Tod eines Elternteils Ehestatus postpartum Alter (20- 40 Jahre) Persönlichkeitsstruktur Konfliktverarbeitung Die Monoaminohypothese der Depression äußere Faktoren Filter Neurotransmitter - Noradrenalin Pharmaka andere Erkrankungen - Serotonin - Dopamin Familiäre Häufung: 1.5-3 x Geschlecht: Frauen 2x Verordnungshäufigkeit von Antidepressiva in Deutschland 1997 Einteilung der Antidepressiva Mio. verordnete Änderung Tagesdosen gegenüber 1996 Substanz 1. Nichtselektive Monoamin-Rücknahme-Inhibitoren (NSMRI) - Amitriptylin, Doxepin, Trimipramin, Maprotilin, Imipramin 2. Selektive Serotonin-Rücknahme- Inhibitoren (SSRI) - Fluoxetin, Paroxetin, Fluvoxamin 3. Alpha2- Antagonisten - Mirtazapin, Mianserin 4. Monoaminoxidasehemmer (reversible MAO-A-Hemmer) - Moclobemid 5. Lithium Chemische Struktur trizyklischer Antidepressiva Monoaminorücknahme-Inhibitoren Amitriptylin Doxepin Trimipramin 218.7 69.5 48.3 27.3 + 0.7% Selektive Serotoninrücknahme-Inh. Fluoxetin Paroxetin Fluvoxamin 39.6 15.0 10.5 5.8 + 34,2% Alpha2- Antagonisten 9.9 + 35,4% MAO- Inhibitoren 9.9 + 0,5% Lithiumsalze 17.8 - 2,5% Antidepressiva und Rezeptoren Baumuster der Antipsychotika vom Phenothiazintyp NSMRI Baumuster der trizyklischen Antidepressiva 9 M1-Rezeptor-vermittelte Nebenwirkungen von trizyklischen Antidepressiva Obstipation Akkomodationsstörung M1-Rezeptor Mundtrockenheit H1-Rezeptor-vermittelte Nebenwirkungen von trizyklischen Antidepressiva Somnolenz Alpha-Rezeptor-vermittelte Nebenwirkungen von trizyklischen Antidepressiva Gewichtszunahme Benommenheit, Verwirrtheit H1- Rezeptor AlphaRezeptor Hypotonie Somnolenz Antidepressiva und Rezeptoren Selektive Serotonin-Rücknahmehemmer 10 Wichtige schwere Nebenwirkungen und Kontraindikationen von Antidepressiva Vergiftung mit Antidepressiva Kontraindikation/ UAW Substanz Grund - Koma mit Schock Harnverhalten Glaukom NSMRI anticholinerge Wirkung - Atemdepression Coronarinsuffizienz Cerebrovaskuläre Insuffizienz MAO, NSMRI Hypertonie (MAO) Hypotonie (NSMRI) - Fieber Cardiale Arrythmie NSMRI, SSRI Hypertonie Herzinsuffizienz MAO, NSMRI Wirkungen auf Reizleitungssysytem Hypertone Krise(MAO) Myokardwirkung (NSMRI) Epilepsie NSMRI, SSRI Krampfschwelle erniedrigt Schwangerschaft alle teratogene Wirkung (?) - Delirium, neuromuskuläre Erregbarkeit - Epileptische Anfälle - Herzleitungsstörungen und Arrythmien Irreversible und reversible MAO-Inhibitoren Bipolare Störungen – Manisch-Depressive Erkr. Indikation für Lithium: Prophylaxe der Depression und Therapie der Manischen Phasen Tranylcypromin Moclobemid Lithium- Wirkmechanismus – Ersatz von Na+ Effektiv in 40-50% 2° messenger: G-Proteine, InositolMonophosphatase Pharmakokinetik der Antidepressiva Therapie mit Lithium Geringe therapeutische Breite therapeutisches Drug monitoring: - 0,6 - 0,8 mmol/L bei Prophylaxe - 1,0 - 1,2 mmol/L bei antimanischer Therapie Nebenwirkungen: - Magenirritation - feinschlägiger Tremor - Polyurie - Gewichtszunahme - Hypothyreose Lithiumvergiftung: - grobschlächtiger Tremor - Erbrechen, Durchfälle - Koma, Krampfanfälle Ausscheidung: Amitriptylin T1/2 [h] Metabolismus Orale Bioverfügbarkeit [%] Aktive Metabolite 10-30 CYP1A2, 2D6 30-60% Nortryptilin Doxepin 8-25 ? 60-70% Desmethyl Imipramin 10-25 CYP1A2, 2C9, 2D6 30-75% Desipramin Fluoxetin 24-72 CYP 2D6 >60% Norfluoxetin Moclobemid 1-3 2C9, Azetylierung >80% -- Lithium 8-40 95% renal 100% -- - renal - Na+-Ausscheidung , Li+-Ausscheidung - circulus vitiosus: verringerte Salzzufuhr, Saluretika, Diclofenac, Ibuprofen,Indometacin, nicht ASS 11 Rückfälle von Respondern bei Weiterbehandlung mit Placebo oder Antidepressiva Behandlung mit Placebo für 1 Jahr Normalzustand 50 % 8 Wochen 6-12 Monate Normalzustand 85% 8 Wochen 15% Behandlung mit Antidepressiva für 1 Jahr Toleranz vor allem gegen vegetativ-autonome und sedative Wirkungen. Symptome bei abruptem Absetzen von Monoamin-Rücknahme-Inhibitoren: - Schüttelfrost - Krankheitsgefühl und Übelkeit - Muskelschmerz - Vorübergehendes Wiederauftreten von Depression 50 % Depression Toleranz und Entzug SSRI-Entzugssyndrom - Kopfschmerz, Lethargie - Parästhesien, “elektrischer Schock” Empfindungen - Angst, Unruhe - Tremor, Schweißausbrüche - Schlaflosigkeit - Übelkeit - Diarrhoe Depression 1 Jahr 12