AbbVie Biologic Biosimilar
Werbung
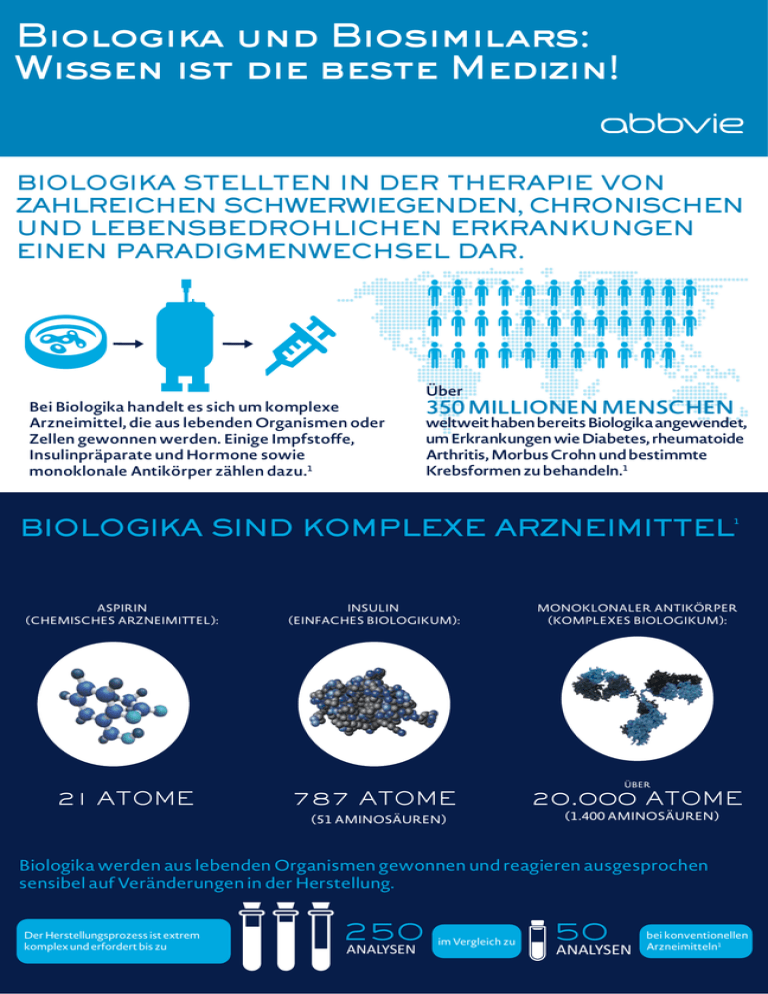
Biologika und Biosimilars: Wissen ist die beste Medizin! BIOLOGIKA STELLTEN IN DER THERAPIE VON ZAHLREICHEN SCHWERWIEGENDEN, CHRONISCHEN UND LEBENSBEDROHLICHEN ERKRANKUNGEN EINEN PARADIGMENWECHSEL DAR. Bei Biologika handelt es sich um komplexe Arzneimittel, die aus lebenden Organismen oder Zellen gewonnen werden. Einige Impfstoffe, Insulinpräparate und Hormone sowie monoklonale Antikörper zählen dazu.1 Über 350 MILLIONEN MENSCHEN weltweit haben bereits Biologika angewendet, um Erkrankungen wie Diabetes, rheumatoide Arthritis, Morbus Crohn und bestimmte Krebsformen zu behandeln.1 BIOLOGIKA SIND KOMPLEXE ARZNEIMITTEL 1 ASPIRIN (CHEMISCHES ARZNEIMITTEL): 21 ATOME INSULIN (EINFACHES BIOLOGIKUM): 787 ATOME (51 AMINOSÄUREN) MONOKLONALER ANTIKÖRPER (KOMPLEXES BIOLOGIKUM): ÜBER 20.000 ATOME (1.400 AMINOSÄUREN) Biologika werden aus lebenden Organismen gewonnen und reagieren ausgesprochen sensibel auf Veränderungen in der Herstellung. Der Herstellungsprozess ist extrem komplex und erfordert bis zu 250 ANALYSEN im Vergleich zu 50 ANALYSEN bei konventionellen Arzneimitteln1 KOMPLEXITÄT IN ZAHLEN: 700 BIOSIMILARS SIND KEINE GENERISCHEN VERSIONEN VON ORIGINAL-BIOLOGIKA BIOSIMILAR ORIGINAL Es ist nicht möglich, eine identische Kopie eines Original-Biologikums herzustellen.3 biologische Arzneimittel, darunter Biosimilars, sind auf dem Markt erhältlich oder befinden sich in der klinischen Entwicklung.2 BIOSIMILAR 240 Über Unternehmen weltweit entwickeln Biosimilars.2 ORIGINAL Biosimilars, die von unterschiedlichen Herstellern produziert werden, unterscheiden sich sowohl vom Original-Biologikum als auch voneinander. Schon die kleinste Abweichung bei den Ausgangsstoffen und im Herstellungsprozess kann zu Unterschieden in der komplexen Struktur und damit der Wirkung führen.4 IMMUNOGENITÄT: ASPEKTE ZUR SICHERHEIT UND 5 WIRKSAMKEIT VON BIOLOGIKA Immunogenität bezeichnet die unerwünschte Immunantwort auf ein therapeutisches Protein, sei es ein originales Biologikum oder ein Biosimilar.6 Immunogenität kann die Wirksamkeit des Biologikums beeinträchtigen, wenn der Körper die monoklonalen Antikörper durch eigene Antikörper neutralisiert.7 Ein Biosimilar kann ein anderes Immunogenitätsprofil aufweisen als das Referenzpräparat.8 Nur durch klinische Studien ist es möglich, angemessen Rückschlüsse auf die Immunogenität zu ziehen. Diese sollten mit Patientengruppen durchgeführt werden, die die höchste Sensitivität für jedwede Veränderung im Immunogenitätsprofil aufweisen.5 WECHSEL ZWISCHEN BIOLOGIKA EINSCHLIESSLICH BIOSIMILARS: BIOSIMILAR NICHT VORHANDEN BIOLOGIKUM ABC BIOLOGIKUM XYZ BIOSIMILAR ORIGINAL BIOSIMILAR Daten zu Patienten mit Morbus Crohn und anderen entzündlichen Autoimmunerkrankungen weisen darauf hin, dass sich bei gut eingestellten Patienten der Wechsel von einem Biologikum zu einem anderen ungünstig auf das klinische Ansprechen auswirken kann.10-12 Es liegen keine Langzeitdaten zu Studien vor, in denen Patienten aus nicht medizinischen Gründen auf ein Biosimilar umgestellt wurden.13,14 Ein Wechsel zwischen einem originalen Fachgesellschaften und Biologikum und einem oder mehreren Patientenorganisationen raten Biosimilars kann die Immunogenität erhöhen davon ab, einen Patienten, dessen und somit möglicherweise negative Erkrankung sich mit einem Auswirkungen auf den Patienten haben.5 Biologikum gut kontrollieren lässt, auf ein anderes biologisches Arzneimittel, auch Biosimilar, umzustellen.15-17 Mehr Informationen: www.biologika-info.de QUELLEN EuropaBio: Guide to Biological Medicines - A Focus on Biosimilar Medicines, 2011 BioWorld Today: Biosimilars: A Global Perspective of a New Market Opportunities, Threats and Critical Strategies 2014 3 Sekhon B.P., Saluja V. Biosimilars: an overview. Biosimilars. 2011 4 Schellekens H. Bioequivalence and the immunogenicity of biopharmaceuticals. Nat Rev Drug Discov. 2002 5 FDA Guidance for Industry, Scientic Considerations in Demonstrating Biosimilarity to a Reference Product. April 2015. 6 European Commission. What You Need to Know about Biosimilar Medicinal Products. 2013 7 Schellekens H. et al. The therapeutic equivalence of complex drugs.Regul Toxicol Pharmacol. 2010 8 Emery P. et al. A phase III randomised, double-blind, parallel-group study comparing SB4 with etanercept reference product in patients with active rheumatoid arthritis despite methotrexate therapy. Ann Rheum Dis. 2015 9 Weise M. et al. Biosimilars: what clinicians should know. Blood 2012 10 Van Assche G. et al. Switch to adalimumab in patients with Crohn's disease controlled by maintenance infliximab: prospective randomised SWITCH trial. Gut 2012 11 Wolf D. et al. Clinical outcomes associated with switching or discontinuation of anti-TNF inhibitors for non-medical reasons. ECCO 2015 12 Rubin D.T. et al. Analysis of outcomes after non-medical switching of anti-tumor necrosis factor agents. ECCO 2015 13 Sokka T and Kautiainen H. SAT0174 Clinical Experience with Infliximab Biosimilar – Switch from Remicade. EULAR 2015 14 Kang H.W. et al. Efficacy and safety of infliximab's biosimilar (REMSIMA) for IBD. ECCO 2014 15 Danese S. et al. ECCO position statement: The use of biosimilar medicines in the treatment of inflammatory bowel disease (IBD). Journal of Crohn’s and Colitis 2013 16 American College of Rheumatology Positioning Paper on Biosimilars. 2015 17 Positionierung der Deutschen Rheuma-Liga Bundesverband e.V. zur Einführung von Biosimilars in Deutschland. 2014 1 2











