Embryonale Tumoren
Werbung

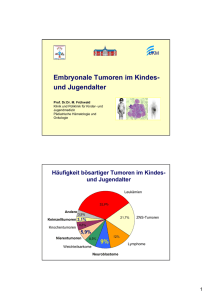
Embryonale Tumoren H.Jürgens Krebserkrankungen bei Kindern und Jugendlichen - Inzidenz Systemerkrankungen 48 % Solide Tumoren 52 % Solide Tumoren im Kindesalter Solide Tumoren 52% • 19 % ZNS-Tumoren – – – Astrozytom Ependymom Sonstige 8% 2% 9% • • Neuroblastom Nephroblastom (Wilms-Tumor) 9% 6% • Weichteilsarkome 6% – – • Rhabdomyosarkom Sonstige 4% 2% Knochentumoren 5% – – – Osteosarkom Ewing-Sarkom Sonstige 3% 2% <1 % • • • Keimzelltumoren Retinoblastom Lebertumoren 3% 2% 1% • Karzinome / Sonstige 1% (1,4 / 100.000 / J) (0,9 / 100.000 / J) ~ 15% der pädiatrischen Malignome ~2,3/100.000/J Embryonale Tumoren Embryonale Tumoren Solide Tumoren Diagnostik Primärtumor Tastbefund Erstbefund ! Sonographie Echogenität Ausdehnung Röntgen Artdiagnose Knochendestruktion Computertomographie Abdomen Cortikalis Magnetresonanztomographie Retroperitoneum Weichteilausdehnung Embryonale Tumoren Wichtigste Entitäten Neuroblastom Neuroblastom Präsentation (1) • 0-3(-5) Jahre • m : w = 1,4 : 1 • Häufigster solider Tumor im Kindesalter • Stadieneinteilung - 1-3 (lokalisiert): 55 % - 4 (disseminiert): 45 % - 4s (Alter <1 J, Metastasen in KM, Leber und/oder Haut): selten Neuroblastom Präsentation (2) • Lokalisation - Nebenniere (50%) - Sympathicus-Grenzstrang thorakal 20%, abdominell 30% - oft Ausdehnung nach intraspinal - Metastasen (45%) KM, Knochen, LK, Leber, ZNS, Haut (Stad. 4s) • Katecholamine im Urin/Serum! • MIBG-Szintigraphie positiv • Selten: -Brillenhämatom (Stad. 4) - Querschnitt - Horner - Opsomyoklonus-Syndrom - Hypertonie, Durchfall, ….. aus: Hero B, Berthold F Monatsschr Kinderheilkd 2002 Embryonale Tumoren Embryonale Tumoren Embryonale Tumoren Embryonale Tumoren Embryonale Tumoren Embryonale Tumoren Embryonale Tumoren Embryonale Tumoren Embryonale Tumoren Neuroblastom Stadien 1 Lokalisierter Tumor, komplett resektabel 2 Lokalisierter Tumor, nur inkomplett resektabel A – Lymphknoten negativ B – Lymphknoten positiv 3 Lokalisierter Tumor, nicht resektabel 4 Disseminierter Tumor (Lymphknoten, Knochen, Knochenmark, Leber, Haut) 4S Disseminierter Tumor (Leber, Haut, Knochenmark) bei Kindern < 1 Jahr Neuroblastom Risikogruppen I Nmyc normal, Säuglinge Stad. 1-3, 4s >1J Stad. 1,2r = Beobachtungspatienten II Nmyc normal, Säuglinge Stad. 1-3 + Sympt. >1J Stad. 2nr, 3 = Standardrisiko-Patienten III Nmyc amplifiziert und/oder Stadium 4 (jedes Alter) = Hochrisiko-Patienten Neuroblastom Therapie – NB 2004 Observation Group (OG) OP B E O B A C H T U N G Stadium 1, Alter 0-21 J, Nmyc nicht amplifiziert Stadium 2, Alter 0-21 J, keine 1p-Aberration, Nmyc nicht amplifiziert Stadium 3, Alter 0-3 J, keine 1p-Aberration, Nmyc nicht amplifiziert Stadium 4s, Alter 0-1 J, Nmyc nicht amplifiziert Kein Progress, keine Symptome: Keine weitere Therapie Lokaler Progress oder schwerwiegende Symptome CR: Weiterbeobachtung Beobachtung über 12 Monate (Alter >1J) oder bis Ende des 2. Lebensjahres (Säuglinge) Keine CR: OP ist zu erwägen Stable Disease/Regredienz: keine weitere Chemotherapie N4 PROG N4 N4 N4 Maximal 4 x N4, weiterhin/erneuter Progress ? Dann Fortführung mit MRG Progress zu Stadium 4 Weiterführung mit HRG bei Kindern > 1 J (und MRG bei Säuglingen <1 J) Neuroblastom Therapie – NB 2004 Medium Risk Group (MRG) Stadium 3, Alter > J, Nmyc nicht amplifiziert Stadium 3, Alter 0-21 J, 1p-Aberration, Nmyc nicht amplifiziert Stadium 2, Alter 0-21 J, 1p-Aberration, Nmyc nicht amplifiziert Stadium 4, Alter <1 J, Nmyc nicht amplifiziert N4 statt N5/N6 bei Säuglingen < 6 Monaten Externe Strahlentherapie OP N5 N6 N5 N6 N5 N6 N7 N7 N7 N7 OP? OP? 13-cis-RA 13-cis-RA Neuroblastom Therapie – NB 2004 High Risk Group (HR) Stadium 4, Alter >1-21 J alle Stadien, Alter 0-21 J, Nmyc amplifiziert N4 statt N5/N6 bei MIBG Externe Strahlentherapie ASCT 13-cis-RA Säuglingen < 6 Monaten N5 N6 N5 N6 N5 N6 OP Randomisation OP? OP? N8 N8 N5 N6 N5 N6 N5 N6 13-cis-RA MIBG Externe Strahlentherapie ASCT 13-cis-RA 13-cis-RA Neuroblastom Prognose Stadium 1 2 3 4 4s % Patienten 20 15 20 45 (selten) % Überleben (5J) 98 95 75 33 76 100 65 (Daten der NB 90 Studie, Hero B, Berthold F, MonatsschrKinderheilkd 2002 ) Neuroblastom Fragen • Downstaging durch Screening (wahrscheinlich) nicht möglich! Schilling N Engl J Med 2002 • Rolle der Hochdosistherapie (wahrscheinlich) effektiv Matthay N Engl J Med 1999 ? Rolle von Radiotherapie Retinsäuretherapie MIBG-Therapie Embryonale Tumoren Wichtigste Entitäten Nephroblastom (Wilms-Tumor) Embryonale Tumoren Nephroblastom (Wilms-Tumor) Präsentation (1) • • • • 0-5 Jahre m : w = 0,9 : 1 0,9/100.000/J WT1 (11p13), WT2 (11p15.5) • • Lokalisation - Niere (in 5% bilateral) - Metastasen: Lunge, LK, Leber ZNS - selten Ausdehnung intraspinal oft Zufallsbefund bei Palpation • Katecholamine im Urin/Serum negativ! Nephroblastom (Wilms-Tumor) Präsentation (2) • • • Asymptomatischer Tumor sichtbar Hämaturie Routine-Untersuchung (U3, U4) • • • • • • Obstipation Gewichtsverlust Urogenital-Infekt Diarrhoe Diagnose bei Trauma Nausea, Erbrechen, Schmerzen, Hernie, Pleuraeffusion, Bluthochdruck • 61,6 % 15,1 % 9,2 % 4,3 % 3,8 % 3,2 % 3,2 % 2,7 % selten Assoziation mit Syndromen Hemihypertrophie/Aniridie, Neurofibromatose, WAGR, Beckwith-Wiedemann, Drash, Perlman, …. Quelle: N. Graf, SIOP/GPOH-Wilmstumorstudie, http://www.med-rz.uni-sb.de/med_fak/kinderklinik/Review/review.htm Nephroblastom (Wilms-Tumor) Klinische Daten zeitgleich an Referenzradiologie Diagnostische Strategie Anamnese Klinischer Befund Labordiagnostik (Serum, Urin) Messung der Katecholamine Ultraschalluntersuchung Native Röntgenuntersuchung des Thorax Diagnose gesichert Bildversand an Referenzradiologie MRT oder CT Diagnose gesichert MIBG Diagnose gesichert Feinnadelbiopsie Beginn der präoperativen Chemotherapie Diagnose über Referenzradiologie gesichert N. Graf, SIOP2001/GPOH-Wilmstumorstudie Nephroblastom Stadien I Lokalisierter Tumor, auf die Niere begrenzt, komplett reseziert II Lokalisierter Tumor, Nierenkapsel durchbrochen, komplett reseziert III Lokalisierter Tumor, Lymphknotenmetastasen, inkomplett reseziert IV Metastasierter Tumor (Lunge, Leber, Knochen, Gehirn) V Bilateraler Tumor Nephroblastom (Wilms-Tumor) Präoperative Therapie N. Graf, SIOP 2001/GPOH-Wilmstumorstudie Nephroblastom (Wilms-Tumor) Postoperative Therapie Histologie (> 10 Subtypen): Low Risk Tumours Intermediate Risk Tumours High Risk Tumours Klinisches Stadium: I-III lokalisiert IV Metstasen V bilateral N. Graf, SIOP 2001/GPOH-Wilmstumorstudie Nephroblastom (Wilms-Tumor) Prognose: Überleben 1,00 ,90 ,80 ,70 ,60 ,50 ,40 ,30 ,20 Stadium I-III Stadium IV ,10 n = 622, n = 109, verstorben = 28 verstorben = 18 p = 0.91 p = 0.77 0,00 0 1 2 3 4 5 6 7 N. Graf, SIOP 1993/GPOH-Wilmstumorstudie Nephroblastom (Wilms-Tumor) Fragen • Referenzradiologie, Referenzpathologie • Asservierung von Tumormaterial zur Molekulargenetik • Suche nach Prognosefaktoren • Kardiotoxizität Embryonale Tumoren Merke: • Neuroblastom, Nephroblastom Hepatoblastom, Retinoblastom, Keimzelltumoren • Häufigster solider Tumor im Kindesalter: - Neuroblastom • DD Neuroblastom – Nephroblastom - Katecholamine im Urin, MIBG-Szintigraphie - Bildgebung • Therapie: GPOH-Therapieprotokolle • Prognose: heilbar - Neuroblastom: - Nephroblastom: 30 – 90 % je nach Stadium 60 – 90 % je nach Histologie und Stadium Solide Tumoren Diagnostik Primärtumor Tastbefund Erstbefund ! Sonographie Echogenität Ausdehnung Röntgen Artdiagnose Knochendestruktion Computertomographie Abdomen Cortikalis Magnetresonanztomographie Retroperitoneum Weichteilausdehnung Solide Tumoren Diagnostik Metastasensuche Sonographie Lymphknoten Röntgen Lunge Computertomographie Lunge Lymphknoten Leber Magnetresonanztomographie Retroperitoneum Knochen(mark) Szintigraphie Knochen Neuroblastom – Technetium – MIBG Positronenemissionstomographie Glukose-Utilisation Solide Tumoren Therapiekonzept Lokaltherapie Operation Radiotherapie Systemische Therapie Zytostatika Heilungsrate 60-70% Heilungsrate 10-15% Embryonale Tumoren Überlebensraten im Vergleich 3-, 5-, 10- und 15-Jahres-Überlebenswahrscheinlichkeit und Wahrscheinlichkeit rezidivfreien Überlebens für die häufigsten Diagnosen (1980-2000) Jahresbericht Deutsches Kinderkrebsregister 2000, http://www.kinderkrebsregister.de/ Malignomtherapie im Kindesalter Rationale für Kooperation Komplexität der Behandlung Ö interdisziplinäre Kooperation Seltenheit der Erkrankungen Ö multizentrische Kooperation Malignomtherapie im Kindesalter GPOH-Studien Kontrollierte klinische Studien >95 % aller Kinder mit Malignomen eingeschlossen Ö "Qualitätssicherung" Ö wissenschaftlicher Erkenntnisgewinn Ö weltweit beste Therapieergebnisse GPOH-Studien Qualitätssicherung Interdisziplinäre Therapieprotokolle (lokale & systemische Tumortherapie; Supportivtherapie) Zentrale Beurteilung Pathologie Radiologie Konsiliarische Beratung Lokaltherapie (OP; RT) Chemotherapie Nachsorgekonzept Rezidiverkennung Spätfolgenmonitoring GPOH-Studien Erkenntnisgewinn • Prospektive, randomisierte Studien exakt definierter Patientengruppen • Registerähnliche Erfassung und Auswertung aller Patienten • Möglichkeit studienübergreifender Analysen • Langzeitnachbeobachtung