CTD Format
Werbung

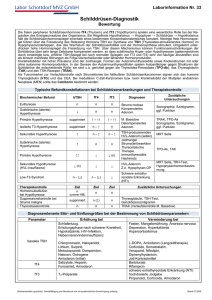
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Amiodaron HCl Hikma 50 mg/ml Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Ampulle mit 3 ml Injektionslösung enthält das Äquivalent von 150 mg Amiodaronhydrochlorid. 1 ml enthält 50 mg Amiodaronhydrochlorid. Sonstige Bestandteile mit bekannter Wirkung: Eine Ampulle mit 3 ml enthält 60,6 mg Benzylalkohol. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. 3. DARREICHUNGSFORM Injektionslösung Klare, blassgelbe Lösung in einer durchsichtigen und farblosen Glasampulle pH: 3,7–4,3 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Amiodaron HCl Hikma ist für die Prophylaxe und Behandlung schwerwiegender Herzrhythmusstörungen indiziert, wenn andere Behandlungen nicht wirksam oder kontraindiziert sind: - Vorhofarrhythmien wie Vorhofflimmern oder Vorhofflattern; AV-Knoten-Arrhythmien und AV-Reentry-Tachykardien, z. B. im Rahmen eines WolffParkinson-White-Syndroms; Lebensbedrohliche ventrikuläre Arrhythmien, einschließlich persistierende oder nicht persistierende ventrikuläre Tachykardien oder Episoden von Kammerflimmern. Amiodaron HCl Hikma wird bei Patienten verwendet, bei denen ein schnelles Ansprechen auf die Behandlung erwünscht oder eine orale Verabreichung nicht möglich ist. 4.2 Dosierung und Art der Anwendung Amiodaron darf nur verwendet werden, wenn die Möglichkeiten für eine Überwachung der Herztätigkeit, eine Defibrillation und ein kardiales Pacing gegeben sind. Als Infusion: Zur Verdünnung mit Glukose 5 % siehe auch Abschnitt 6.6. Aufsättigungsdosis: 5 mg/kg KG in 250 ml Glukose-Lösung 5 % über 20 Minuten bis 2 Stunden verabreichen und diese Dosis 2- bis 3-mal pro 24 Stunden wiederholen. Die Infusionsgeschwindigkeit ist der Wirkung anzupassen. Die Wirkung tritt innerhalb weniger Minuten ein und lässt dann allmählich nach, so dass anschließend eine Erhaltungsdosis zugeführt werden muss. Seite 1 von 13 Erhaltungsdosis/Prophylaxe: 10–20 mg je kg KG in Glukose-Lösung 5 % alle 24 Stunden (durchschnittlich 600 bis 800 mg/24 Stunden bis maximal 1.200 mg/24 Stunden, entsprechend 4–5 Ampullen, maximal 8 Ampullen) über einige Tage. Aus Gründen der Stabilität der Lösung keine Konzentrationen unter 300 mg pro 500 ml verwenden und der Infusionsflüssigkeit keine weiteren Arzneimittel hinzufügen. Um lokale Reaktionen (Phlebitis) zu vermeiden, keine Konzentrationen über 3 mg/ml anwenden. Es ist ratsam, am ersten Infusionstag eine orale Erhaltungstherapie einzuleiten. Wiederholte Infusionen oder eine Dauerinfusion können, wenn sie über periphere Venen erfolgen, lokale Reaktionen (Entzündungen) zur Folge haben. Wenn wiederholte Infusionen oder eine Dauerinfusion beabsichtigt sind, wird die Verabreichung über einen zentralen Venenkatheter empfohlen. Achtung: Amiodaron kann die Tropfengröße verkleinern, wenn es mittels Infusion verabreicht wird. Falls erforderlich, ist die Infusionsgeschwindigkeit anzupassen. Direkte intravenöse Injektion („Bolus“): In äußersten klinischen Notfallsituationen kann das Arzneimittel nach Ermessen des Arztes langsam injiziert werden. Dabei sind 5 mg je kg KG über mindestens 3 Minuten zu verabreichen. Außer im Fall einer kardiopulmonalen Reanimation bei defibrillationsresistentem Kammerflimmern darf die Injektionsdauer 3 Minuten nicht unterschreiten. Eine zweite Bolus-Injektion darf nicht vor Ablauf von 15 Minuten nach der ersten Injektion verabreicht werden. Dies gilt auch, wenn die erste Injektion nur aus einer Ampulle bestanden hat (Risiko eines irreversiblen Schockzustands). Patienten, die in dieser Form behandelt werden, müssen sorgfältig überwacht werden, zum Beispiel auf einer Intensivstation. Verabreichen Sie Bolusinjektionen nur in Notfallsituationen und verwenden Sie keine weiteren Arzneimittel in der gleichen Spritze. Die angegebene Dosis von 5 mg/kg darf bei Verabreichung als direkte Injektion nicht überschritten werden. Kardiopulmonale Reanimation bei defibrillationsresistentem Kammerflimmern: Die Anfangsdosis beträgt 300 mg (oder 5 mg/kg Körpergewicht), verdünnt in 20 ml Dextrose 5 %, und sollte als schnelle Injektion verabreicht werden. Wenn das Kammerflimmern fortbesteht, kann eine weitere Dosis von 150 mg (oder 2,5 mg/kg Körpergewicht) in Erwägung gezogen werden. Kinder und Jugendliche: Die Unbedenklichkeit und Wirksamkeit von Amiodaron bei Kindern ist nicht nachgewiesen. Zurzeit vorliegende Daten sind in Abschnitt 5.1 und 5.2 beschrieben. Amiodaron HCl Hikma Injektionslösung darf wegen des Gehaltes an Benzylalkohol nicht bei Frühgeborenen, Neugeborenen, Säuglingen und Kindern bis zu 3 Jahren angewendet werden. Wechsel von der intravenösen auf eine orale Therapie: Beginnen Sie mit einer oralen Amiodaron-Erhaltungstherapie, sobald Sie eine ausreichende Wirkung erzielt haben. Anschließend sollte die intravenöse Amiodaron-Gabe ausschleichend beendet werden. Bei Patienten, die gleichzeitig Amiodaron und Simvastatin erhalten, sollte die Simvastatin-Dosis 20 mg/Tag nicht überschreiten. Art der Anwendung Hinweise zur Verdünnung des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6. 4.3 Gegenanzeigen - Sinusbradykardie, sinoatrialer Block (Risiko eines Sinusstillstands) Seite 2 von 13 - Sick-Sinus-Syndrom bei Patienten ohne Schrittmacher AV-Block zweiten oder dritten Grades bei Patienten ohne Schrittmacher. In diesen Fällen darf Amiodaron in Spezialabteilungen und nur in Verbindung mit einem Schrittmacher injiziert werden. Schilddrüsenfunktionsstörungen Gleichzeitige Anwendung von Arzneimitteln, die das QT-Intervall verlängern (siehe Abschnitt 4.5) Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile Amiodaron Injektionslösung darf wegen des Gehaltes an Benzylalkohol nicht bei Frühgeborenen, Neugeborenen, Säuglingen und Kindern bis zu 3 Jahren angewendet werden. Die genannten Gegenanzeigen gelten nicht für die Anwendung von Amiodaron im Rahmen einer kardiopulmonalen Reanimation bei defibrillationsresistentem Kammerflimmern. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Amiodaron darf nur durch einen sachkundigen Facharzt verordnet werden. Die Anwendung des Arzneimittels erfordert eine sorgfältige und regelmäßige Überwachung der Leberwerte, der Schilddrüsenfunktion und des EKGs sowie eine radiologische Untersuchung des Thorax. Von einer Verabreichung als direkte i.v. Injektion (Bolus-Injektion) wird wegen des Risikos hämodynamischer Wirkungen wie z.B. schwerwiegende Hypotonie oder kardiovaskulärer Kollaps abgeraten. Derartige Injektionen sollten nur in Notfällen – auf einer kardiologischen Intensivstation und unter EKG-Überwachung – erfolgen, wenn therapeutische Alternativen nicht zum Erfolg geführt haben. Amiodaron HCl Hikma sollte nur unter kontinuierlicher Überwachung von EKG und arteriellem Blutdruck verwendet werden. Bei Patienten mit stark eingeschränkter Lungenfunktion, arterieller Hypotonie oder stabiler Herzinsuffizienz muss die Anwendung mit äußerster Vorsicht – und unter hämodynamischer Überwachung – erfolgen. Diese Patienten dürfen keine Bolusinjektionen erhalten (Risiko einer Exazerbation). Die angegebene Dosis von 5 mg/kg darf bei Verabreichung als direkte Injektion nicht überschritten werden. Wenn die Wirkung dieses Präparats zu stark ist (z.B. schwere Bradykardie), müssen geeignete Maßnahmen ergriffen werden, wie z.B. die Anwendung eines Schrittmachers oder eine BetaStimulation. Die Anwendung von Amiodaron HCl Hikma ist keine Kontraindikation für eine spätere externe Defibrillation. Herzerkrankungen (siehe Abschnitt 4.8) Amiodaron kann das Auftreten neuer Herzrhythmusstörungen oder eine Verschlechterung bestehender Herzrhythmusstörungen verursachen, manchmal mit tödlichem Verlauf. Allerdings scheint die Inzidenz dieser Wirkungen im Vergleich zu einigen anderen Antiarrhythmika niedriger zu sein. Insbesondere bei Patienten mit Herzinsuffizienz oder AV-Block ersten Grades ist Vorsicht geboten. Darüber hinaus wurde eine polymorphe Form der ventrikulären Tachykardie beschrieben, die im Zusammenhang mit einer QT-Verlängerung auftritt und als Torsade de Pointes bezeichnet wird. Diese besondere Arrhythmieform tritt insbesondere bei Patienten mit stark verlängertem QT-Intervall und/oder bei Kombination mit Hypokaliämie-induzierenden Arzneimitteln, bestimmten Seite 3 von 13 Antiarrhythmika und bestimmten anderen die Repolarisation beeinflussenden Substanzen auf (siehe auch Abschnitt 4.5 ). Im EKG kommt es durch eine Verlängerung der Repolarisationsphase durch Amiodaron zu Veränderungen der T-Wellen und möglicherweise zum Auftreten von U-Wellen. Wie auch bei einigen anderen Antiarrhythmika kann dieses Phänomen in Ausnahmefällen zu atypischen ventrikulären Tachykardien („Torsade de Pointes“) führen. Endokrine Erkrankungen (siehe Abschnitt 4.8) Intravenöses Amiodaron Injektionslösungen können eine Hyperthyreose hervorrufen, besonders in Patienten mit Schilddrüsenerkrankungen in der Vorgeschichte, Patienten aus einer Bevölkerungsgruppe mit Jodmangel oder Patienten, die jetzt oder früher orales Amiodarone nehmen bzw. nahmen. Der ultrasensitive TSH Spiegel im Serum sollte bei Verdacht auf eine Fehlfunktion der Schilddrüse gemessen werden. In Fällen von bestätigter Hyperthyreose muss die Therapie mit Amiodaron abgebrochen werden. In schweren Fällen (einige tödlich verlaufend) muss eine individuelle Notfallbehandlung mit Thyreostatika und/oder Kortikosteroiden begonnen werden. Die Anwendung von Amiodaron führt zu einer Verminderung der peripheren Umwandlung von Thyroxin (T4) in Trijodthyronin (T3) und kann zu erhöhten T4-Werten sowie zu leicht verminderten T3-Werten und einer Steigerung der reversiblen T3 Konzentrationen führen. Die Konzentration des basalen Serum TSH Spiegels (thyreoidstimulierendes Hormon) steigt während der ersten Monate der Behandlung vorrübergehend an. Gelegentlich tritt bei Patienten eine Hypo- oder Hyperthyreose auf, deren Prävalenz mit der ernährungsbedingten Jodaufnahme zusammenzuhängen scheint. Die Beurteilung der Schildrüsenfunktion wird bei Patienten vor dem Start der Behandlung mit Amiodaron und in regelmäßigen Abständen während der Behandlung empfohlen. Lungenerkrankungen (siehe Abschnitt 4.8) Bei Anwendung von intravenösem Amiodaron wurden Fälle von Lungentoxizität (interstitielle Pneumonie) beschrieben, die manchmal tödlich verliefen. Bei Auftreten einer Dyspnoe (unter Belastung) sollte der Thorax geröntgt und ein Lungenfunktionstest durchgeführt werden, und zwar unabhängig davon, ob die Dyspnoe mit einer Änderung des Allgemeinzustands des Patienten (Müdigkeit, Gewichtsverlust, Fieber) verbunden ist. Pulmonale Nebenwirkungen sind in der Regel reversibel und klingen nach Absetzen der Behandlung schnell ab. Gegebenenfalls kann eine Kortikosteroid-Therapie in Erwägung gezogen werden. In den meisten Fällen bilden sich die klinischen Symptome innerhalb von 3 bis 4 Wochen zurück; anschließend ist eine langsamere Normalisierung der radiologischen Befunde und der Lungenfunktion zu beobachten (bis zu einigen Monaten). Lebererkrankungen (siehe Abschnitt 4.8) Innerhalb der ersten 24 Stunden nach intravenöser Verabreichung von Amiodaron kann es zu einem schweren Leberversagen kommen, manchmal mit tödlichem Verlauf. Aus diesem Grund wird von Therapiebeginn an eine engmaschige Überwachung der Transaminasen empfohlen. Arzneimittelwechselwirkungen (siehe Abschnitt 4.5) Die Anwendung von Amiodaron in Kombination mit den folgenden Arzneimitteln wird nicht empfohlen: Betablocker, Antihypertonika aus der Gruppe der Kalziumantagonisten (Verapamil, Diltiazem), Kontaktlaxantien, die eine Hypokaliämie verursachen können. Nach wiederholter intravenöser Verabreichung können wegen der langen Halbwertzeit von Amiodaron nach Beendigung der Therapie noch über mehrere Wochen wirksame AmiodaronKonzentrationen im Blutserum vorliegen. Wenn der Amiodaron-Spiegel weiter absinkt, können erneut Arrhythmien auftreten. Die Patienten müssen nach Beendigung der Therapie regelmäßig überwacht werden. Seite 4 von 13 Benzylalkohol: Amiodaron HCl Hikma enthält 20 mg/ml Benzylalkohol. Benzylalkohol kann bei Säuglingen und Kindern bis zu 3 Jahren toxische und anaphylaktoide Reaktionen hervorrufen. Unerwünschte Wirkungen: Unerwünschte Wirkungen sind in den meisten Fällen auf überhöhte Dosen zurückzuführen. Aus diesem Grund ist es ratsam, die niedrigstmögliche Dosis zu verabreichen, um Ausmaß und Schweregrad unerwünschter Wirkungen auf ein Minimum zu begrenzen. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Die gleichzeitige Anwendung von Arzneimitteln, die das QT-Intervall verlängern und damit das Risiko einer potentiell tödlich verlaufenden Torsade de Pointes erhöhen, ist kontraindiziert: Bestimmte Antiarrhythmika wie Klasse-Ia-Antiarrhythmika (z.B. Chinidin, Procainamid und Disopyramid) und Sotalol. Andere Arzneimittel, wie z.B. Vincamin, bestimmte Neuroleptika (Sultoprid, Sulpirid), Cisaprid, intravenöses Erythromycin, parenteral verabreichtes Pentamidin wegen des erhöhten Risikos einer potentiell tödlich verlaufenden Torsade de Pointes, trizyklische Antidepressiva und andere das QT-Intervall verlängernde Substanzen wie einige Antipsychotika (Pimozid, Thioridazin, einige Phenothiazine), bestimmte tetrazyklische Antidepressiva (z.B. Maprotilin), einige Antihistaminika (z.B. Terfenadin) und Halofantrin. - - - Die gleichzeitige Anwendung der folgenden Arzneimittel wird nicht empfohlen: Betablocker oder Antihypertonika aus der Gruppe der Kalziumantagonisten (Verapamil, Diltiazem). Bei gemeinsamer Verabreichung können Störungen des Herzautomatismus (schwere Bradykardie) auftreten. Bei gleichzeitiger Anwendung der folgenden Arzneimittel ist Vorsicht geboten: Kontaktlaxantien: Diese können eine Hypokaliämie verursachen und dadurch das Risiko für eine Torsade de Pointes erhöhen. Es sollte ein anderer Laxantien-Typ verwendet werden. Andere Arzneimittel, die eine Hypokaliämie verursachen können, wie Diuretika, allein oder als Begleitmedikation; systemische Glukokortikoide und Mineralokortikoide, Tetracosactid; Amphotericin B (i.v.). Eine Hypokaliämie ist zu vermeiden und muss, falls erforderlich, korrigiert werden. Das QT-Intervall ist zu überwachen. Bei Auftreten einer Torsade de Pointes dürfen keine Antiarrhythmika verabreicht werden (es sollte ein ventrikuläres Pacing erfolgen, Magnesium kann intravenös gegeben werden). Orale Antikoagulantien Amiodaron hemmt das Cytochrom-P450-Enzym 2C9 und erhöht auf diese Weise die WarfarinKonzentration. Damit kann Amiodaron die Wirkung von Kumarin-Derivaten verstärken und das Blutungsrisiko steigern. Entsprechend müssen bei Patienten unter Antikoagulantien-Therapie sowohl während als auch nach einer Amiodaron-Behandlung die Prothrombinzeit häufig kontrolliert und die Antikoagulantien-Dosis entsprechend angepasst werden. Digitalis Es kann zu einer Störung des Herzautomatismus (schwere Bradykardie) und der atrioventrikulären Überleitung (synergistische Wirkung) kommen. Seite 5 von 13 Wegen der verminderten Digoxin-Clearance können die Digoxin-Serumspiegel ansteigen. DigoxinSpiegel und EKG müssen daher überwacht und die Patienten auf klinische Zeichen einer DigitalisIntoxikation beobachtet werden. Möglicherweise muss die Digoxin-Dosis verringert werden. Phenytoin Amiodaron hemmt das Cytochrom-P450-Enzym 2C9 und bewirkt dadurch eine Zunahme des Phenytoin-Plasmaspiegels. Dieser kann daher bei gleichzeitiger Anwendung von Amiodaron und Phenytoin ansteigen (Auftreten neurologischer Störungen). Eine Überwachung ist erforderlich. Bei Auftreten von Symptomen einer Phenytoin-Überdosierung muss die Phenytoin-Dosis reduziert werden. Die Phenytoin-Plasmaspiegel sollten bestimmt werden. Allgemeinanästhesie/Sauerstofftherapie Bei mit Amiodaron behandelten Patienten, bei denen eine Allgemeinanästhesie durchgeführt wurde, wurden (unter anderem) die folgenden Komplikationen beschrieben: Bradykardie (gegenüber Atropin refraktär), Hypotonie, Erregungsleitungsstörungen und Verringerung des Herzzeitvolumens. Es wurden einige Fälle von postoperativen respiratorischen Komplikationen beschrieben, manchmal mit tödlichem Verlauf. Diese Fälle könnten auf einer Wechselwirkung mit hohen Sauerstoffkonzentrationen im Blut beruhen. Es ist wichtig, dass im Falle eines operativen Eingriffs der Anästhesist darüber informiert wird, dass der Patient Amiodaron erhält. Flecainid Amiodaron hemmt das Cytochrom-P450-Enzym 2D6 und bewirkt dadurch einen Anstieg des Flecainid-Plasmaspiegels. Falls erforderlich, ist die Flecainid-Dosis anzupassen. Arzneimittel, die durch das Cytochrom-P450-Enzym 3A4 abgebaut werden: Amiodaron hemmt das Cytochrom-P450-Enzym 3A4. Wenn gleichzeitig mit Amiodaron Arzneimittel verabreicht werden, deren Metabolismus von diesem Enzym abhängt, können erhöhte Plasmakonzentrationen dieser Präparate auftreten; dies verstärkt die potentielle Toxizität. - Die Kombination von Ciclosporin mit Amiodaron ist mit dem Risiko eines Anstiegs der Ciclosporin-Plasmaspiegel verbunden. Falls erforderlich, ist die Ciclosporin-Dosis anzupassen. - Bei Kombination von Fentanyl mit Amiodaron kann die Wirkung von Fentanyl verstärkt werden und das Toxizitätsrisiko zunehmen. - Auch die folgenden Arzneimittel werden durch CYP3A4 metabolisiert: Statine (z.B. Simvastatin), Tacrolimus, Lidocain, Sildenafil, Midazolam, Triazolam, Dihydroergotamin, Ergotamin sowie von den bereits an anderer Stelle erwähnten Arzneimitteln Cisaprid, Kalziumantagonisten, Ciclosporin, Chinidin, Terfenadin, Pimozid und Erythromycin. 4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft Es liegen nur unzureichend Erfahrungen in Bezug auf die Sicherheit von Amiodaron bei Verabreichung während der Schwangerschaft vor. Amiodaron und N-Desmethylamiodaron passieren die Plazentaschranke und erreichen beim Kind Konzentrationen in Höhe von 10–25 % der mütterlichen Plasmakonzentration. Zu den häufigsten Komplikationen gehören Wachstumsstörungen, Frühgeburtlichkeit und Schilddrüsenfunktionsstörungen bei den Neugeborenen. Auch Hypothyreose, Bradykardie und Verlängerung des QT-Intervalls wurden bei den Neugeborenen beschrieben. In Einzelfällen wurden Schilddrüsenvergrößerung oder Herzgeräusche festgestellt. Die Missbildungsrate scheint nicht erhöht zu sein. Allerdings sollte an das Risiko von Herzfehlern gedacht werden. Daher darf Amiodaron HCl Hikma während der Schwangerschaft nur bei strenger Indikationsstellung angewendet werden. Seite 6 von 13 Frauen im gebärfähigen Alter sollten, um eine Exposition des Kindes in der Frühschwangerschaft zu vermeiden, frühestens ein halbes Jahr nach Behandlungsende eine Schwangerschaft planen. Stillzeit Es ist nachgewiesen, dass der Wirkstoff und die aktiven Metaboliten in die Muttermilch ausgeschieden werden. Wenn in der Stillzeit eine Behandlung notwendig wird oder Amiodaron während der Schwangerschaft eingenommen wurde, sollte abgestillt werden. Fertilität Bei männlichen Patienten wurden nach einer Langzeittherapie erhöhte LH- und FSH-Serumspiegel beobachtet; dies weist auf eine Störung der Hodenfunktion hin. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Hierzu sind keine Daten bekannt. Da es zu Verschwommen-Sehen und/oder zu einer Beeinträchtigung des Sehvermögens kommen kann, ist an einen möglichen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen zu denken. 4.8 Nebenwirkungen Die am häufigsten unter intravenösem Amiodaron beschriebenen Arzneimittelwirkungen sind Infusionsphlebitis, Bradykardie und Hypotonie. unerwünschten Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt: Sehr häufig (≥ 1/10); Häufig (≥ 1/100 bis < 1/10); Gelegentlich (≥ 1/1.000 bis <1/100); Selten (≥ 1/10.000 bis <1/1.000); Sehr selten (< 1/10.000), nicht bekannt (auf Grundlage der verfügbaren Daten nicht abschätzbar). Erkrankungen des Immunsystems Sehr selten - Anaphylaktischer Schock. Häufigkeit nicht bekannt: - Hämolytische oder aplastische Anämie Psychiatrische Erkrankungen Häufigkeit nicht bekannt: - Delirium (einschließlich Verwirrtheit) Erkrankungen des Nervensystems Sehr selten - Benigne intrakranielle Hypertonie (Pseudotumor cerebri). - Kopfschmerzen. Häufigkeit nicht bekannt: - periphere Neuropathie - Parästhesie, Ataxie, Tremor Herzerkrankungen Häufig - Dosisabhängige Bradykardie. Sehr selten - Schwere Bradykardie (in Fällen mit Sinusknotendysfunktion und bei älteren Patienten) oder (noch Seite 7 von 13 seltener) Sinusstillstand: Dies kann ein Absetzen der Behandlung erforderlich machen. - Auftreten neuer – und Verstärkung bestehender – Arrhythmien, einschließlich atypischer ventrikulärer Tachykardien (Torsade de Pointes) (siehe auch Abschnitt 4.4 und Abschnitt 4.5). - Erregungsleitungsstörungen (sinuatrialer Block, AV-Block). Gefäßerkrankungen Häufig - Hypotonie und Anstieg der Herzfrequenz unmittelbar nach der Injektion. Diese Wirkungen sind in der Regel mittelgradig ausgeprägt und vorübergehender Natur. Nach Überdosierung oder zu schneller Verabreichung (Bolus-Injektion) wurden Fälle von schwerer Hypotonie oder Schock beschrieben. Sehr selten - Flushing. Erkrankungen der Atemwege, des Brustraums und Mediastinums Sehr selten - Interstitielle Pneumonie (siehe Abschnitt 4.4). - Akutes ARDS (Adult Respiratory Distress Syndrome), manchmal mit tödlichem Verlauf. - Bronchospasmus bei Patienten mit schwerwiegenden Atemproblemen, insbesondere solchen mit Asthma bronchiale. Erkrankungen des Gastrointestinaltrakts Sehr selten - Übelkeit. Häufigkeit nicht bekannt: - Erbrechen - Metallischer Geschmack - Pankreatitis (akut) Leber- und Gallenerkrankungen Sehr selten - Zu Beginn der Therapie leichter bis mäßiger Anstieg der Transaminasen (auf das 1,5- bis 3-fache der oberen Normgrenze), der häufig vorübergehender Natur ist und sich nach einer Dosisreduktion spontan zurückbildet. - Akute Leberfunktionsstörung mit Anstieg der Transaminasen-Serumspiegel und/oder Ikterus, bis hin zum Leberversagen, manchmal mit tödlichem Ausgang (siehe Abschnitt 4.4). Erkrankungen der Haut und des Unterhautzellgewebes Häufig - Ekzem. Sehr selten - Schwitzen. Häufigkeit nicht bekannt: - Photosensibilisierung, die über mehrere Monate nach Beendigung anhalten kann. - Schwere Hautreaktionen wie toxische epidermale Nekrolyse (TEN), Stevens-Johnson-Syndrom (SJS), bullöse Dermatitis, Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS). Endokrine Erkrankungen Sehr selten - Syndrom der inadäquaten Sekretion des antidiuretischen Hormons (SIADH) Häufigkeit nicht bekannt: - Hyperthyreose, manchmal tödlich verlaufend (siehe Abschnitt 4.4) - Hypothyreose (siehe Abschnitt 4.4) Seite 8 von 13 Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Häufigkeit nicht bekannt: - Myopathie Augenerkrankungen Häufigkeit nicht bekannt: - Korneale Mikroablagerungen manchmal mit einem farbigen Lichthof, die nach Absetzen der Behandlung reversibel sind. - Optische Neuropathie Erkrankungen der Geschlechtsorgane und der Brustdrüse Häufigkeit nicht bekannt: - Epididymitis Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Häufig - An der Injektions- oder Infusionsstelle: Schmerzen, Erythem, Ödem, Nekrose, Extravasation, Infiltration, Entzündung, Induration, Thrombophlebitis, Phlebitis, Zellgewebsentzündung, Infektion, Pigmentveränderungen. Häufigkeit nicht bekannt: - Schlaflosigkeit, Albträume In seltenen Fällen wurden verschiedene klinische Symptome beschrieben, die auf Überempfindlichkeitsreaktionen hinweisen: Vaskulitis, Nierenfunktionsstörung mit Anstieg der Kreatinin-Spiegel, Thrombopenie, Anaphylaxie. Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesamt für Sicherheit im Gesundheitswesen, Traisengasse 5, 1200 WIEN, ÖSTERREICH, Fax: + 43 (0) 50 555 36207. Website: http://www.basg.gv.at/ anzuzeigen. 4.9 Überdosierung Bei akuter Überdosierung oder zu schneller intravenöser Verabreichung können die folgenden Symptome auftreten: Übelkeit, Erbrechen, Obstipation, Schwitzen, Bradykardie und Verlängerung des QT-Intervalls. Nach deutlicher Überdosierung sollte auch mit Hypotonie, Herzblock und Torsade de Pointes gerechnet werden. In Ausnahmefällen kann eine Hyperthyreose auftreten. Nach deutlicher Überdosierung ist eine längerfristige EKG-Überwachung durchzuführen. Eine Verlegung auf die Intensivstation ist zu erwägen. Eine Hypotonie lässt sich durch Infusion von Flüssigkeit oder Gabe von Vasopressoren behandeln. Möglicherweise sind Alpha- oder Betaadrenergika oder ein vorübergehendes Pacing indiziert. Antiarrhythmika der Klassen Ia und III sind zu vermeiden, da sie mit einer Verlängerung des QT-Intervalls und mit der Induktion einer Torsade de Pointes einhergehen. Die weitere Behandlung sollte supportiv und symptomatisch sein. Amiodaron und seine Metaboliten sind nicht dialysierbar. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Seite 9 von 13 Pharmakotherapeutische Gruppe: Antiarrhythmika, Klasse III ATC-Code: C01B D01 Wirkmechanismus Amiodaron ist ein di-iodiertes Benzofuran-Derivat und wird, da es durch eine Blockade der K+Kanäle im Herzen (hauptsächlich der schnellen Komponente des Delayed-Rectifier-K+-Stroms, IKr) die Dauer des kardialen Aktionspotentials in atrialen und ventrikulären Myozyten verlängert, zu den Antiarrhythmika der Klasse III gezählt. Amiodaron verlängert durch seinen Wirkmechanismus die Refraktärphase des Aktionspotentials; dies führt zu einer Suppression von Ektopien und Re-EntryArrhythmien und zur Verlängerung des QT-Intervalls im EKG. Darüber hinaus blockiert Amiodaron auch die Na+-Ströme (Klasse-I-Effekt) und die Ca2+-Ströme im Herzen (Klasse-IV-Effekt). Letzteres kann eine Verlangsamung der Erregungsleitung durch den Sinuatrial- und den Atrioventrikularknoten zur Folge haben. Amiodaron scheint bei Langzeitanwendung außerdem in den Myozyten des Herzens das Trafficking von Ionenkanälen vom endoplasmatischen Retikulum zur Plasmamembran zu hemmen; dies könnte zu seinen elektrophysiologischen Wirkungen am Herzen bei chronischer Verabreichung beitragen. Pharmakodynamische Wirkungen Darüber hinaus ist Amiodaron ein nicht-kompetitiver Antagonist sowohl an den - als auch an den Adrenozeptoren und weist dadurch hämodynamische Wirkungen auf: Dilatation von Koronararterien und peripheren Gefäßen mit der Folge einer Senkung des systemischen Blutdrucks. Einige Wirkungen von Amiodaron sind mit einer Hypothyreose vergleichbar; dies könnte auf einer Hemmung der Schilddrüsenhormon-Synthese beruhen. Amiodaron ist ein starker Inhibitor der Iodothyronin-5'-Monodeiodinase (des wichtigsten T4-T3-konvertierenden Enzyms). Bei Ratten wurde ein Anstieg der Serumkonzentrationen von Thyroidea-stimulierendem Hormon (TSH), Thyroxin (T4) und reversem Triiodthyronin (rT3) sowie eine Abnahme der Serumkonzentration des durch Deiodierung von T4 entstehenden Triiodthyronin (T3) beobachtet. Diese antithyroidalen Wirkungen von Amiodaron könnten zu seinen elektrophysiologischen Wirkungen am Herzen beitragen. Der Hauptmetabolit N-Desethylamiodaron hat vergleichbare Wirkungen auf die Elektrophysiologie des Herzens wie die Muttersubstanz. Klinische Wirksamkeit und Sicherheit Die Sicherheit und Wirksamkeit von intravenösem Amiodaron bei Patienten mit außerhalb eines Krankenhauses auftretendem Herzstillstand im Zusammenhang mit einem defibrillationsresistenten Kammerflimmern wurde in zwei Doppelblindstudien untersucht: der ARREST-Studie, in der Amiodaron mit Placebo verglichen wurde, und der ALIVE-Studie, in der Amiodaron mit Lidocain verglichen wurde. Primärer Endpunkt beider Studien war der Anteil der Patienten, die bis zur Aufnahme in ein Krankenhaus überlebten. In der ARREST-Studie erhielten 504 Patienten mit außerhalb eines Krankenhauses auftretendem Herzstillstand im Zusammenhang mit Kammerflimmern oder mit einer pulslosen ventrikulären Tachykardie, die auf 3 oder mehr über einen Defibrillator applizierte Elektroschocks und Adrenalin nicht ansprachen, entweder 300 mg Amiodaron, aufgelöst in 20 ml Dextrose 5 %, als schnelle Injektion in eine periphere Vene (246 Patienten) oder Placebo (258 Patienten). Bei den 197 Patienten (39 %), die die Fahrt ins Krankenhaus überlebten, erhöhte Amiodaron signifikant die Chancen für eine erfolgreiche Reanimation und stationäre Aufnahme: 44 % der Patienten der Amiodaron-Gruppe versus 34 % der Patienten der Placebogruppe (p = 0,03). Nach Adjustierung für andere unabhängige Prädiktoren betrug die adjustierte Ratio für ein Überleben bis zur Aufnahme in ein Krankenhaus in der Amiodaron-Gruppe 1,6 im Vergleich zur Placebogruppe (95%-Konfidenzintervall: 1,1 bis 2,4; p = 0,02). Hypotonie (59 % versus 25 %; p = 0,04) und Bradykardie (41 % versus 25 %; p = 0,004) waren bei den mit Amiodaron behandelten Patienten häufiger als bei den Patienten der Placebogruppe. Seite 10 von 13 In der ALIVE-Studie erhielten 347 Patienten mit Kammerflimmern, das auf 3 oder mehr DefibrillatorSchocks, Adrenalin und einen weiteren Defibrillator-Schock nicht angesprochen hatte, oder mit rezidivierendem Kammerflimmern nach initial erfolgreicher Defibrillation entweder Amiodaron (5 mg/kg) oder Lidocain (1,5 mg/kg). Amiodaron bewirkte eine signifikante Zunahme der Chancen auf eine erfolgreiche Reanimation und Aufnahme in ein Krankenhaus: 22,8 % der mit Amiodaron behandelten (41 von 180 Patienten) versus 12 % der mit Lidocain behandelten Patienten (20 von 167 Patienten; p = 0,009). Nach Adjustierung für andere das Überleben beeinflussende Faktoren betrug die adjustierte Ratio für ein Überleben bis zur Aufnahme in das Krankenhaus in der Amiodaron-Gruppe 2,49 im Vergleich zur Lidocain-Gruppe (95%-Konfidenzintervall: 1,28 bis 4,85; p = 0,007). Der prozentuale Anteil der Patienten, bei denen es nach Defibrillation und anschließender Verabreichung der initialen Studienmedikation zu einem Herzstillstand kam, war in der Lidocain-Gruppe (28,9 %) signifikant höher als in der Amiodaron-Gruppe (18,4 %; p = 0,04). Kinder und Jugendliche Es wurden keine kontrollierten Studien bei Kindern durchgeführt. In den veröffentlichten Studien wurde die Unbedenklichkeit von Amiodaron bei 1118 pädiatrischen Patienten mit unterschiedlichen Arrhythmien untersucht. Die folgenden Dosierungen wurden bei klinischen Studien bei Kindern angewendet. Intravenös - Aufsättigungsdosis: 5 mg/kg Körpergewicht über 20 Minuten bis 2 Stunden - Erhaltungsdosis: 10-15 mg /kg/Tag über einige Stunden bis zu mehreren Tagen. Falls erforderlich, kann gleichzeitig eine orale Anwendung mit der üblichen Aufsättigungsdosis begonnen werden. 5.2 Pharmakokinetische Eigenschaften Amiodaron wird langsam eliminiert und besitzt eine hohe Gewebeaffinität. Intravenöse Verabreichung: Nach der Injektion kommt es durch die Verteilung in die Gewebe zu einer schnellen Abnahme der Plasmakonzentration. Die maximale Wirkung wird 15 Minuten nach der Verabreichung erzielt und nimmt in den darauf folgenden 4 Stunden allmählich ab. Nach wiederholter intravenöser Verabreichung oder kontinuierlicher oraler Verabreichung kommt es zu einer Sättigung der Gewebe. Kinder und Jugendliche Es wurden keine kontrollierten Studien bei Kindern durchgeführt. In den begrenzten, veröffentlichten Daten, die für pädiatrische Patienten verfügbar sind, wurde kein Unterschied zu Erwachsenen festgestellt. 5.3 Präklinische Daten zur Sicherheit In einer 2-Jahres- Karzinogenitätsstudie an Ratten verursachte Amiodaron einen Anstieg follikulärer Schilddrüsentumoren (Adenome und/oder Karzinome) bei beiden Geschlechtern in klinisch relevantem Ausmaß. Da die Befunde zur Mutagenität negativ waren, wird eher ein epigenetischer als ein genotoxischer Mechanismus für diese Art der Tumorinduktion angenommen. Bei Mäusen wurden keine Karzinome aber eine dosisabhängige follikuläre Schilddrüsenhyperplasie beobachtet. Diese Effekte auf die Schilddrüse von Ratten und Mäusen beruhen höchstwahrscheinlich auf der Wirkung von Amiodaron auf die Synthese und/oder Freisetzung von Schilddrüsenhormonen. Die Relevanz dieser Befunde für den Menschen ist gering. 6. PHARMAZEUTISCHE ANGABEN Seite 11 von 13 6.1 Liste der sonstigen Bestandteile Polysorbat 80 (E433) Benzylalkohol Wasser für Injektionszwecke 6.2 Inkompatibilitäten Amiodaron HCl Hikma ist mit physiologischer Kochsalzlösung nicht kompatibel und darf nur in Dextrose-Lösung 5% verabreicht werden. Die Anwendung von Infusions-/Injektionsbestecken aus Materialien, die Weichmacher wie DEHP (Di-2-Ethylhexylphthalat) enthalten, kann in Gegenwart von Amiodaron dazu führen, dass DEHP in die Lösung übertritt. Um eine Exposition des Patienten mit DEHP auf ein Minimum zu reduzieren, sollten zur Verabreichung verdünnter Amiodaron-Infusionslösungen Infusionsflaschen und -bestecke verwendet werden, die kein DEHP enthalten, z.B. solche aus Polyolefin (PE, PP) oder Glas. Der Amiodaron-Infusion dürfen keine weiteren Substanzen hinzugefügt werden. 6.3 Dauer der Haltbarkeit 2 Jahre. Das verdünnte Präparat ist bei Raumtemperatur 24 Stunden physikalisch und chemisch stabil. Allerdings sollte das Arzneimittel unter mikrobiologischen Gesichtspunkten unmittelbar nach der Verdünnung verwendet werden. Ausschließlich zur einmaligen Anwendung. Etwaige nicht verwendete Lösung muss verworfen werden. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 25°C lagern. Nicht im Kühlschrank lagern oder einfrieren. In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. Aufbewahrungsbedingungen nach Verdünnung des Arzneimittels, siehe Abschnitt 6.3. 6.5 Art und Inhalt des Behältnisses Eine Schachtel enthält 10 durchsichtige Glasampullen à 5 ml (mit 3 ml Lösung). 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Die Ampullen sind mit Glukose 5 % zu verdünnen. Für jede Ampulle dürfen maximal 250 ml Infusionslösung mit Glukose 5 % verwendet werden. Stärkere Verdünnungen sind instabil. Amiodaron HCl Hikma ist, wenn es in Dextrose-Lösung 5% auf eine Konzentration von <0,6 mg/ml verdünnt wird, nicht stabil. Lösungen, die weniger als 2 Amiodaron HCl Hikma-Ampullen in 500 ml Dextrose 5% enthalten, sind instabil und dürfen nicht verwendet werden. Siehe Abschnitt 4.2. Seite 12 von 13 7. INHABER DER ZULASSUNG Hikma Farmacêutica (Portugal), S.A. Estrada do Rio da Mó, 8, 8A e 8B - Fervença 2705-906 Terrugem SNT Portugal Mitvertrieb Hikma Pharma GmbH Lochhamer Str. 13 82152 Martinsried Deutschland 8. ZULASSUNGSNUMMER 1-27275 9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG 15.11.2007 / 10.09.2010 10. STAND DER INFORMATION Juni 2017 VERSCHREIBUNGSPFLICHT/APOTHEKENPFLICHT Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Seite 13 von 13