Hormonelle Regulation des Kohlenhydratstoffwechsels
Werbung

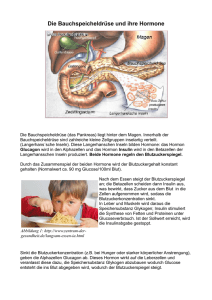
Hormonelle Regulation des Kohlenhydratstoffwechsels Insulin Glucagon Schematische Darstellung eines Querschnitts durch eine typische Langerhanssche Insel des Pankreas Die Ausschüttung von Insulin aus den Beta-Zellen der Langerhans-Inseln im Pankreas wird stimuliert durch • Substrate: Glucose, Aminosäuren (Valin, Isoleucin, Leucin), Ketonkörper (Acetacetat, Hydroxybutyrat), freie Fettsäuren (insbes. kurzkettige FS, z.B. im Milchfett) • Hormone: Glucagon, gastrointestinale Hormone wie Sekretin und GIP (GastroInhibitorisches Peptid) • Neurotransmitter: Acetylcholin (Parasympathikotonus) Kontrolle der Insulinsekretion Stimulation Glucose ↑ Aminosäuren Gastrointestinale Hormone (GIP, Sekretin) Parasympathikus Glucagon Hemmung ß-Zelle Sympathikus (Adrenalin) Somatostatin Die Ausschüttung von Insulin aus den BetaZellen der Langerhans-Inseln im Pankreas wird gehemmt durch • einen erhöhten Sympathikotonus: Adrenalin, Noradrenalin • Somatostatin Insulin Sezerniertes Insulin besitzt im Blut nur eine sehr kurze Halbwertszeit von ca. 20 Minuten. Es wird in der Leber proteolytisch inaktiviert. Insulin ist ein relativ stabiles Peptidhormon und enthält keine freien SH-Seitengruppen, die durch Glutathion vor Oxidation geschützt werden müssen. Insulin Like Growth Factor - IGF • • • Insulin like growth factors (IGF) sind einkettige Peptide von 67 (IGF I) bzw. 70 (IGF II) Aminosäuren, die eine 50 % Sequenzhomologie zum Insulin zeigen. Die Peptide werden unter dem Einfluß des Wachstumshormons (Somatotropin – einem Hypophysenhormon) in der Leber gebildet und von dort in die Blutbahn freigesetzt. Sie vermitteln am Knochen- und Knorpelgewebe, der Muskulatur und dem Fettgewebe die anabolen Effekte des Wachstumshormons. Biosynthese des Insulins Ausbildung von stabilisierenden Disulfidbrücken im Golgi Apparat Am rauen ER wird Präproinsulin synthetisiert A|F1 KTRR|E33 KR|G66 Ins B-chain Ins A-Chain C-peptide Abspaltung des Signalpeptids im Lumen des endoplasmatischen Retikulums Abspaltung des C-Peptids in den Sekretionsvesikeln 110aa Schematische Struktur von Proinsulin Das C-Peptid wird zusammen mit dem reifen Insulin in die Blutbahn sezerniert. Es besitzt diagnostische Relevanz für die Bestimmung der Restaktivität der ß-Zellen bei einem diabetischen Patienten unter Insulinbehandlung. Proteolytische Spaltung durch Endoproteasen Insulinwirkung Rezeptor Autophosphorylierung von Tyrosinseitenketten durch eine Kinaseaktivität der ßRezeptoruntereinheit Insulinwirkung Signalwege Insulin steigert die Glucoseaufnahme in Muskulatur und Fettgewebe (nicht Leber!) durch Translokation von GLUT4Glucosetransporter-Membranvesikeln in die Plasmamembran Insulinwirkung Signalwege • • • • • Insulin bindet an den Insulinrezeptor, einem tetrameren Plasmamembranrezeptor aus 2 α-Untereinheiten und 2 ß-Untereinheiten. Der Insulinrezeptor ist in hoher Dichte in der Leber, der Muskulatur und dem Fettgewebe vorhanden = insulinempfindliche Gewebe. Die Bindung des Insulins an die extrazelluläre Domäne des rezeptors löst über eine Konformationsänderung eine Autophosphorylierung an den Tyrosinresten der zytoplasmatischen Anteile der ß-Untereinheiten aus, die ATP verbraucht. Das autophosphorylierte Rezeptorprotein bewirkt die Phosphorylierung weiterer Proteinkinasen, wobei die Phosphorylierung des Insulin Receptor Substrate 1 (IRS-1) eine wichtige Rolle spielt. Die Signalwege des Insulins wie z.B. die Autophosphorylierung sind bei der Insulinresistenz gestört. Zielgewebe wie die Leber, die Muskulatur und das Fettgewebe sind dann unempfindlich gegenüber Insulin. Komplexität der Insulinsignalwege Was sollten Sie über die Insulinwirkungen wissen ? • • • Zielgewebe: Leber, Muskel, Fettgewebe = Gewebe, die Nähstoffe in Form von Glykogen, Protein und Triglyzeriden speichern (anaboles Prinzip der Insulinwirkung). Insulinrezeptor: Autophosphorylierung durch Tyrosinkinasen, Auslösung von komplexen Phosphorylierungskaskaden durch Proteinkinasen in den Zielzellen. Effekte: Kurzfristig (Minuten): - Erhöhung der Glucosetransportkapazität (GLUT4 Vesikel werden in die Plasmamembran transloziert) - Phosphorylierung und Dephosphorylierung der Schlüsselenzyme des Kohlenhydrat und Fettstoffwechsels (Glykolyse, Glykogensynthese, Fettsäuresynthese) Langfristig (Stunden/Tage): - Induktion/Repression von Genen der Schlüsselenzyme des Kohlenhydrat und Fettstoffwechsels. Induktion und Repression von Enzymen des Kohlenhydratstoffwechsels • • Es wird durch Regulation der Genexpression die Menge an Enzymprotein in der Zelle verändert. Die kinetischen Eigenschaften werden durch Induktion und Repression der Enzymproteinmenge nicht verändert. Dies geschieht durch allosterische Regulatoren und Enzymkonversion (Phosphorylierung/ Dephosphorylierung) Es werden 2 verschiedene Arten des Glucosetransports vom Extrazellulärraum in die Zelle unterschieden 1. 2. Erleichterte Diffusion (GLUT-Transporter) - Erythrozyten, Gehirn, Muskel, Fettgewebe - verbraucht keine Energie - wird vom Konzentrationsgradienten getrieben (sowohl ExtraIntrazellulär als auch Intra-Extrazellulär, d.h. der Transport kann in beide Richtungen erfolgen!) Sekundär aktiver Transport (SGLT-Transporter) - in Darm und Niere - Glucose wird zusammen mit einem Natrium-Ion in die Zelle transportiert - Natrium wird an der Gefäßseite energieabhängig unter ATP Verbrauch aus der Zelle transportiert. Hierdurch wird ein Gradient zum Extrazellulärraum aufgebaut, der den Na-Glucose Co-Transport erlaubt. Da der Aufbau des Na-Gradienten Energie erfordert und nicht der Glucosetransport selbst, wird er als sekundär aktiv bezeichnet. Glucosetransportproteine Km Besonderheiten Nomenklatur Gewebe GLUT1 erleichterte Diffusion Ubiquitär 1-2 mM besonders in Erythrozyten, Gehirn Grundversorgung der Zellen mit Glucose GLUT2 erleichterte Diffusion Leber ß-Zellen des Pankreas Niere Glucosetransport im millimolaren physiologischen Bereich GLUT4 erleichterte Diffusion Muskulatur 2-4 mM Fettgewebe insulinabhängige Gewebe! Glucosetransporterdichte wird durch Insulin reguliert SGLT Energieverbrauch! Darm Niere Na-Glucose Cotransport sekundär-aktiver Transport (Na-Gradient) 20 mM 4 mM SGLT = Sodium (Natrium) – GLucose-Transporter Merke: ATP wird zur Aufrechterhaltung des Natriumgradienten verbraucht Biosynthese des Glucagons Präproglucagon Q|R1 KR|H33 KR|H72 KR|N64 Glicentin RGRR|D111 R|H78 RK160 GRR|H125 Glucagon Oxyntomodulin GLP-1 GLP-2 GLP-1 (7-37amide) 1. Wo ? In den Alpha-Zellen der Pankreasinsel. 2. Wie ? Abspaltung des linearen Peptidhormons Glucagon (29 Aminosäuren) durch spezifische Endoproteasen aus dem Vorläuferprotein Präproglucagon (180 Aminosäuren). 3. Präproglucagon enthält auch andere Peptidhormone, die durch spezifische Endoproteasen in endokrinen Zellen z.B. im Darm aus diesem Vorläuferprotein freigesetzt werden (GLP Hormone). 180AS Kontrolle der Glucagonsekretion Stimulation Glucose ↓ Aminosäuren Hemmung α-Zelle Insulin Somatostatin Parasympathikus Glucagon Adrenalin Bindung an Rezeptoren der Zielzelle Erhöhung der cAMP Konzentration (Adenylatcylase) Erhöhung der cAMP Konzentration cAMP aktiviert die Proteinkinase A Die Proteinkinase A phosphoryliert spezifische Proteine, die Veränderungen von Enzymaktivitäten im Glucosemetabolismus zur Folge haben Glucagon und Adrenalin bewirken über die Aktivierung der Proteinkinase A die Phosphorylierung von Schlüsselenzymen des Kohlenhydrat und Lipidstoffwechsels • Phosphorylasekinase (Glykogen) • Glykogenphosphorylase und –synthase (Glykogen) • Phosphofructokinase Typ 2 (Glykolyse/Gluconeogenese) • Triacylglycerin-Lipase in Fettzellen (Mobilisierung der Energiereserven im Fettgewebe) Der Stoffwechsel von Glucose, Lipiden und Proteinen wird durch das Verhältnis der Hormone Insulin und Glucagon bestimmt EXOGENE SUBSTRATZUFUHR „Nahrungsaufnahme“ INSULIN GLUCAGON INSULIN SUBSTRATMANGEL „Fasten“ GLUCAGON Insulinmangel beim Diabetes mellitus GLUCOSEAUFNAHME (MUSKEL, FETTGEWEBE) GLYKOGENSYNTHESE LIPOGENESE PROTEINSYNTHESE GLYKOGENOLYSE GLUCONEOGENESE LIPOLYSE KETOGENESE ENDOGENE SUBSTRATPRODUKTION Der Stoffwechsel wird durch Glucagon dominiert ! Fakten zum Diabetes mellitus • Häufigste Stoffwechselerkrankung in den westlichen Industrieländern von der 3 – 5 % der Bevölkerung betroffen sind. • 90 % Typ 2 Diabetes (NIDDM) = zumeist nicht insulinpflichtig. • 10 % Typ 1 Diabetes (IDDM) = absolut abhängig von einer Insulinsubstitution. • Chronischer Verlauf über Jahrzehnte. • Trotz effizienter Therapie mit Insulin sind Spätschäden durch die chronische Hyperglykämie unausweichlich: Nierenversagen, Erblindung, Diabetische Fuß, Neuropathie, Myokardinfarkt und Schlaganfall. Diabetes mellitus Typ I Ätiologie: • Selektive Zerstörung der insulinproduzierenden β-Zellen des Pankreas durch Autoimmunprozesse Diabetes mellitus Typ II Ätiologie: • Insulinresistenz in Folge von genetischer Prädisposition und Übergewicht • keine Beteiligung von Autoimmunprozessen • Insulinsekretionsdefekte der ß-Zellen Diabetes Klassifikation Charakteristika Typ I (IDDM) Typ II (NIDDM) Symptome Polyurie, Plydipsie, Müdigkeit, Gewichtsverlust In der frühen Phase häufig asymptomatisch, im späteren Stadium identisch mit Typ I DM Alter < 35 Jahre > 35 Jahre Beginn Abrupt (Tage – Wochen) Schleichend (Monate – Jahre) Ernährungszustand schlank bis unterernährt übergewichtig Ketoazidose Häufig Selten Insulin Substitution erforderlich Substitution in < 30 % der Fälle Diät Im Kombination mit Insulingabe Ausreichend zur Therapie von 30 – 50 % d. Fälle ß-Zellen Kompletter Verlust Ausreichende ß-Zellmasse vorhanden Inselzellantikörper Ja Nein Häufung in Familien 10 % 30 % Eineiige Zwillinge 50 % Konkordanz 100 % Konkordanz Diagnostische Kriterien des Diabetes mellitus 1. Diabetessymptome + Serumglucosespiegel >180 mg/dl zu einem beliebigen Zeitpunkt des Tages (ohne Rücksicht auf den Zeitpunkt der letzten Mahlzeiteinnahme). 2. Nüchtern Serumglucose >110 mg/dl. Nüchtern bedeutet: Keine Kalorienzufuhr für wenigstens acht Stunden oder 3. Serumglucose nach 2 Stunden im Glucosebelastungstest >180 mg/dl. Testdurchführungen nach WHO-Richtlinien mit 75 g Glukose, aufgelöst in Wasser. Klinische Symptome des Diabetes mellitus • Hyperglykämie • Polydipsie • Gewichtsverlust • Glucosurie • Polyurie • Ketonurie Stoffwechselvorgänge beim Diabetes mellitus Muskelabbau Ketoazidose Hyperglykämie Polyurie, Polydipsie Die Ketonämie und Ketoazidose ist eine gefürchtete Symptomatik des Diabetes mellitus • • • • • • Ketonkörper werden in den Mitochondrien der Leber aus Abbauprodukten von Fettsäuren (Acetyl-CoA, Acetacetyl-CoA) gebildet. Hieraus entstehen die Ketonkörper (C4 Carbongerüst) Acetoacetat, ß-Hydroxybutyrat und Aceton (flüchtig, daher aromatischer Atemgeruch). Ketonkörper werden von der Muskulatur und dem Gehirn als Energielieferant verwertet (nicht von der Leber!) Die Leber kann Ketonkörper nicht verwerten, da ihr das Enzym ß-Ketoacyl-CoA-Transferase fehlt, das für die Aktivierung von Acetoacetat verantwortlich ist. Ketonkörper werden auch physiologisch bei nicht ausreichender Kalorienzufuhr gebildet. Sie sind ein diagnostisches Kriterium für die Einhaltung einer Nulldiät (Urinstix). Beim Diabetes mellitus verursacht die pathologische Ketonkörperbildung eine schwere metabolische (Keto)Azidose. Ketonkörperverwertung Oxidativer Abbau in peripheren Geweben (Muskel, ZNS) mit Ausnahme der Leber. Unter Hungerbedingungen kann das ZNS durch Ketonkörperoxidation Glucose einsparen. ß-Ketoacyl-CoATransferase ATP Citrat-Zyklus Atmungskette Immunpathogenese des Typ 1 Diabetes mellitus ß-Zell Toxine (Viren, Umweltgifte) Zytokine freigesetzt durch unspezifische Infektionen Umwelteinflüsse 2. Autoimmunität durch Beta-Zellzerstörung Beta-Zell Antigene Insulinabhängiger 1. Autoimmunität (MHC) Genetische Prädisposition Diabetes Mellitus Umweltfaktoren in der Pathogenese des Typ 1 Diabetes mellitus • Viren: Coxsackie B und Retroviren • Chemische Gifte (Streptozotocin, Vacor) • Nahrungsbestandteile (Kuhmilch) • Stress • Geschlechtshormone (Pubertät) Es müssen mehr als 80 % der ßZellmasse zerstört sein, bevor der Nüchtern Blutzuckerspiegel ansteigt. Zu diesem Zeitpunkt werden die meisten Patienten mit einem Typ 1 Diabetes mellitus in der Klinik diagnostiziert. BCM = ß-Zellmasse FBG = Nüchtern Blutzucker OGT = Oraler Glucosetoleranztest ICA/IAA = Autoantikörper gegen ß-Zell Proteine Selektive Zerstörung der ß-Zellen im Pankreas eines Patienten mit Typ 1 Diabetes mellitus (IDDM) Normal Typ 1 Diabetes In den Pankreasinseln von Typ 1 Diabetikern sind die ß-Zellen vollständig zerstört. Die glucagonsezernierenden α-Zellen bleiben jedoch intakt. Dies erklärt die Störung des hormonellen Gleichgewichts zugunsten des Glucagons. Typ 2 Diabetes mellitus Diabetische Komplikationen Unter der Therapie: • Diabetisches Koma - ketoazidotisch - hyperosmolar • Hypoglykämie (Überdosierung von Insulin!) • Schädigung des ZNS Spätschäden (10 – 30 Jahre nach Krankheitsbeginn • Nephropathie • Retinopathie • Neuropathie • Diabetische Fuß • Erhöhtes Risiko für - Myokardinfarkt - Schlaganfall • Potenzstörungen Nichtenzymatische Glykosylierung von Proteinen durch Glucose Diabetische Spätschäden Glykosylierte Proteine Advanced Glycosylated End Products AGE Der HbA1c Wert ist ein Maß für den Langzeitverlauf der Blutglucose und somit für den Therapieerfolg einer Diabetesbehandlung • Schlechte Diabetestherapie • Gute Diabetestherapie • 5 Wo 10 Wo Glucose glykiert nichtenzymatisch das Hämoglobin zum HbA1c. Dieses kann chromatographisch bestimmt werden und sollte bei einem gut eingestellten Diabetiker 7 % (bezogen auf das Gesamthämoglobin) nicht überschreiten. Die grünen Kurven geben den Blutzuckerverlauf (in mmol/l) wieder, die rote Linie den HbA1c Wert nach 10 Wochen (in %). Der HbA1c Wert ist bei Blutzuckerwerten, die nicht wesentlich höher als 7 mmol/l sind, mit 7 % deutlich niedriger als bei einer schlechteren Stoffwechseleinstellung. Der Normalwert des HbA1c beträgt beim Stoffwechselgesunden 4 – 6 %.