6 Thermodynamik..........................................................
Werbung

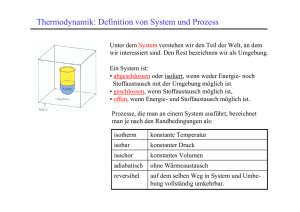
6. Thermodynamik 6 Thermodynamik..................................................................................................2 6.1 Isotherme Volumenänderung.......................................................................2 6.2 Adiabatische Volumenänderung ..................................................................3 6.3 Verflüssigung von Gasen .............................................................................4 6.4 Zusammensetzung der Luft..........................................................................5 6.5 Spontane Vermischung von zwei Gasen......................................................5 6.6 Entropie ........................................................................................................6 6.7 Wahrscheinlichkeit bei chemischen Reaktionen .........................................6 6.8 Freie Enthalpie .............................................................................................7 6.8.1 Entropieänderung bei chemischen Reaktionen .....................................7 6.8.2 Anzahl der Teilchen erhöht sich: ∆S > 0...............................................8 6.8.3 Anzahl der Teilchen erniedrigt sich: ∆S < 0 .........................................8 6.8.4 Zerfall bei hohen Temperaturen ............................................................8 6.9 Index...........................................................................................................10 1 6. Thermodynamik 6 Thermodynamik Als Thermodynamik bezeichnet man den Teil der Naturwissenschaft, der sich mit den Energieumsätzen bei der Veränderung von Systemen befasst. Thermodynamik ist eine sehr grundlegende Wissenschaft, die für die Chemie deswegen von grundlegender Bedeutung ist, weil Chemie die Wissenschaft von den stofflichen Veränderungen chemischer Systeme ist. Einige der Grundbegriffe der Thermodynamik lassen sich an dem einfachen Modellsystem idealer Gase besonders einfach klar machen. In diesem Abschnitt geht es darum, aufzuzeigen, unter welchen Bedingungen ein Vorgang energetisch erlaubt ist, d.h. von welchen energetischen Größen es abhängt, ob eine Reaktion ablaufen kann oder nicht. Volumenarbeit bei idealen Gasen: Bei der Kompression von Gasen wird ebenso wie bei ihrer Ausdehnung Arbeit geleistet. Das Produkt aus P und V hat die Dimension einer Energie (s.o.)! Für die Analyse der jeweiligen Energieumsätze kann man zwei Fälle unterscheiden: Fall 1) Die Temperatur des Gases wird gleich gehalten. „Isotherm“. Fall 2) Die Temperatur des Gases darf sich ändern. „Adiabatisch“. 6.1 Isotherme Volumenänderung In einem idealen Gas muss, bei seiner Ausdehnung, Wärme aufgebracht werden, um das Gas bei gleicher Temperatur zu halten. Bei einer solchen „isothermen“ Ausdehnung wird „Volumenarbeit“ geleistet. Das Produkt aus Druck und Volumen hat die Dimension einer Energie (s.o.). 2 6. Thermodynamik Wenn ein Gas sich vom Volumen V1 auf das Volumen V2 ausdehnt, leistet es Volumenarbeit. Wenn die Temperatur durch ein Wärmebad konstant gehalten wird, ändert sich dennoch während der Ausdehnung der Druck (P = f(V)), so dass integriert werden muss, um den Betrag der Arbeit zu berechnen. Mit PV = nRT folgt P = nRT/V und mit der Formel ³ 1 / xdx = ln( x) , die man in der Chemie immer wieder braucht, folgt für den Betrag der Volumenarbeit n R T ln(V2/V1). Arbeit die vom System geleistet wird, d.h. Energie, die vom System in Form von Arbeit abgegeben wird, erhält nach der Konvention ein negatives Vorzeichen: A = - n R T ln(V2/V1). Wenn das Gesamtsystem aus Wärmebad und Gaszylinder, wie durch die Zeichnung angedeutet, ein „abgeschlossenes System“ ist, d.h. ein System, das keinen Energieaustausch mit seiner Umgebung eingeht, dann muss seine Gesamtenergie konstant sein. Das „Wärmebad“ stellt man sich dabei als Wärmereservoir vor, das so groß ist, das die Entnahme oder Zufuhr von Wärme keine messbare Temperaturänderung in ihm erzeugt, das aber nach außen vollständig abgeschlossen ist und keinen Wärmeaustausch mit der Umgebung eingehen kann. Das, was vom Gas an Arbeit geleistet worden ist („Isotherme Expansion“), muss ihm als Wärmeenergie aus dem Wärmebad zufließen. Dem Gas ist folglich Wärmeenergie Q = + n R T ln(V2/V1) zugeflossen. Der Term R ln/(V2/V1) beschreibt die Zunahme der „Entropie“ des Gases bei der Ausdehnung. Wenn das Gas von einem größeren Volumen auf ein kleineres gebracht wird, so muss Arbeit geleistet werden (A>0). Wenn die Temperatur des Gases nach der Kompression gleich groß sein soll, wie die Ausgangstemperatur („Isotherme Kompression“), dann muss Wärme im Betrag von n R T ln(V2/V1) an das Wärmebad abgegeben werden: Q = - n R T ln(V2/V1), entsprechend der Tatsache, dass das Gas Wärmeenergie an das Reservoir abgegeben hat ist Q negativ (Standpunkt des Systems!). Wenn immer der Quotient aus Endvolumen und Ausgangsvolumen gebildet wird, folgt diese Vorzeichenumkehr von selbst: ln(V2/V1) = - ln(V1/V2) ! 6.2 Adiabatische Volumenänderung Wenn das Gas während der Ausdehnung oder Kompression keinen Wärmeaustausch mit der Umgebung (dem Wärmebad in der Skizze) eingehen kann, dann muss die Wärmeenergie, die bei der isothermen Volumenänderung aus dem Wärmebad kommt oder an dieses abgegeben wird, vom Gas selbst aufgebracht werden. Ein Gas, das sich unter solchen adiabatischen Bedingungen ausdehnt, wird kälter; ein Gas das komprimiert wird, wird wärmer. Der Begriff „adiabatisch“ bedeutet „so dass nichts hindurchgeht“ (aus dem Griechischen) und meint, dass das betrachtete System keinen Wärmeaustausch mit der Umgebung eingehen kann. Beispiele für die adiabatische Erwärmung kennt man aus dem täglichen Leben: Eine Luftpumpe wird warm, wenn man die Luft komprimiert, um sie in den Reifen zu drücken. Der Dieselmotor kommt ohne Zündkerze aus, weil er das Gas im Zylinder so stark komprimiert, dass die Zündtemperatur des Gasgemisches erreicht wird. Der Vorgang der 3 6. Thermodynamik Kompression ist annähernd adiabatisch, weil die Kompression so rasch erfolgt, dass die bei ihr entstehende Wärme nicht abgeführt werden kann! 6.3 Verflüssigung von Gasen Bei seiner adiabatischen Ausdehnung muss das Gas die Wärmemenge, die seiner Volumenarbeit entspricht, aus seinem eigenen Energievorrat entnehmen. Dieser Energievorrat besteht in der kinetischen Energie der Gasteilchen. Die Geschwindigkeit, mit der sie sich relativ zueinander bewegen, nimmt ab. Das Gas wird kälter. Bei realen Gasen kommt ein weiterer Faktor hinzu, der bewirkt, dass sie sich bei ihrer Ausdehnung zusätzlich abkühlen: In einem realen Gas ziehen die Teilchen einander an. Die Überwindung der Anziehungskräfte bei der Ausdehnung kostet zusätzlich Energie, so dass ein reales Gas sich noch stärker abkühlt. Die Ausdehnung von Gasen verwendet man dazu, ihre Temperatur zu erniedrigen. “Joule-Thomson-Effekt“, (J.P. Joule, 1818-1889, Brauereidirektor ; W. Thomson, geadelt als Lord Kelvin, 1824-1907, Physik, Glasgow). Wenn man die Temperatur ausreichend erniedrigt hat, so erreicht man bei jedem realen, d.h. wirklich vorkommenden Gas, dass die Energie, die durch die wechselseitige Anziehung der Teilchen bei deren Zusammentreten frei wird, größer ist, als die kinetische Energie der Gasteilchen. Die Teilchen treten schließlich zu einer Flüssigkeit zusammen, wenn deren Energie, trotz ihres höheren Ordnungsgrades, niedriger ist als die des Gases. Für jedes Gas gibt es jedoch eine Temperatur, oberhalb deren es, auch bei noch so hohem Druck, nicht mehr verflüssigt werden kann. Diese Temperatur nennt man die „kritische Temperatur“ des Gases. Der Druck, der bei dieser kritischen Temperatur nötig ist, um das Gas zu verflüssigen, heißt der „kritische Druck“. Die kritische Temperatur liegt, erwartungsgemäß, umso höher, je stärker die Anziehungskräfte zwischen den Teilchen sind: Substanz He H2 N2 CO2 H2O Kritische Temperatur (K) 5.3 33.3 126.1 304.2 647.2 4 6. Thermodynamik 6.4 Zusammensetzung der Luft Luft besteht im wesentlichen aus Stickstoff (ca. 4/5) und Sauerstoff (ca. 1/5). Für das Leben auf der Erde ist ihr Gehalt an Kohlendioxid entscheidend, da alle von Organismen neu synthetisierte organische Materie letztlich aus dem CO2 der Luft stammt, das bei der „Photosynthese“ zu Verbindungen reduziert wird („organischen Verbindungen“), in denen der Kohlenstoff eine niedrigere Oxidationsstufe hat als in CO2. Nahezu aller Kohlenstoff, welcher der Luft als CO2 entnommen wurde, um organisches Material aufzubauen, wird ihr letztlich wieder als CO2 zugeführt, wenn das organische Material durch biologische Prozesse oder durch Verbrennung abgebaut wird. Merke: Der Gehalt an CO2 ist nur 0.03 %. Substanz N2 O2 Ar CO2 Summe Volumenanteil (%) 78.09 20.95 0.93 0.03 ca. 100 % Substanz Ne He Kr Xe Summe Volumenanteil (%) 1.6 ⋅ 10-3 5 ⋅ 10-4 1 ⋅ 10-4 9 ⋅ 10-6 ca. 10-3 % Der Gehalt an Argon ist deswegen vergleichsweise groß, weil Argon aus Kalium durch KEinfang gebildet wird und fortlaufend entsteht. Der Gehalt an Helium müsste, wegen seiner fortlaufenden Bildung beim radioaktiven Zerfall eigentlich größer sein als er ist. Er ist deswegen so klein, weil Helium als leichtes Gas sehr leicht diffundiert und so die Erdatmosphäre verlassen kann. Nur dort, wo es gasdicht, durch undurchlässige Gesteinsschichten eingeschlossen ist, kommt es in größeren Lagerstätten vor. 6.5 Spontane Vermischung von zwei Gasen Werden zwei Behälter, in denen sich je verschiedene Gase bei jeweils gleichem Druck und gleicher Temperatur befinden, miteinander verbunden, so verteilen sich die Gase auf das gesamte Volumen der beiden Behälter, so dass beide Arten von Gasen nun den gleichen Raum zur Verfügung haben. Die Enthalpie des Systems hat sich nicht geändert, Gesamtdruck und Gesamtvolumen sind gleich geblieben. Dennoch hat sich ein neuer Zustand eingestellt. Die Einstellung dieses neuen Zustandes ist daher nicht durch die Absenkung der Enthalpie bewirkt worden. Welche Größe sorgt dann dafür, dass sich ein neuer Zustand im Gesamtsystem einstellt? Es ist das höhere Maß an Unordnung, das den neuen Zustand gegenüber dem Ausgangszustand stabiler macht. 5 6. Thermodynamik Die Enthalpie alleine ist also nicht dafür verantwortlich, dass eine Veränderung in einem System eintreten kann. Eine zweite Größe, die mit darüber entscheidet, ist das Maß der Unordnung in Ausgangs- und Endzustand. Von selbst stellt sich immer der Zustand größerer Unordnung ein. Der Zustand höherer Unordnung ist der wahrscheinlichere und das System geht von dem weniger wahrscheinlichen in den wahrscheinlicheren Zustand über. 6.6 Entropie Die Größe, die in physikalischen und physikalisch chemischen Gleichungen das Maß der jeweiligen Unordnung und damit die Wahrscheinlichkeit eines Zustandes quantitativ beschreibt, nennt man die Entropie, S. Die Entropie hat die Dimension Energie pro Stoffmenge und Kelvin, ihre übliche Einheit ist damit J mol-1 K-1. Sie hat die gleiche Dimension wie die allgemeine Gaskonstante R, die damit zugleich ein Maß für die Unordnung in einem idealen Gas ist. Entropie ist ein Maß für die Wahrscheinlichkeit eines Zustandes. Je weniger geordnet ein Zustand ist, desto wahrscheinlicher ist er. Das Gas hat die Tendenz sich auszudehnen und allen ihm zur Verfügung stehenden Raum gleichmäßig auszufüllen, weil dabei die Entropie zunimmt, d.h. weil die Ordnung abnimmt: je mehr Volumen das Gas ausfüllt, desto mehr Platz haben die Teilchen und desto weniger genau kann man sagen, wo die Teilchen jeweils sind. Bei vollständiger Ordnung, wie sie in einem Kristall vorliegt, kann man das dagegen sehr genau sagen. 6.7 Wahrscheinlichkeit bei chemischen Reaktionen Bei einer chemischen Reaktion wird ein System von einem Ausgangszustand in einen Endzustand übergeführt. Wenn die Energie der Ausgangsstoffe größer ist als die Energie der Endprodukte, dann wird die Energie des Systems abgesenkt. Die dabei frei werdende Energie, ∆H wird, zum Beispiel, als Wärmeenergie abgegeben. Mit dem Blick auf die tägliche Erfahrung könnte man zunächst annehmen, dass eine Reaktion schon dann ablaufen kann, wenn bei der Reaktion die potentielle Energie abgesenkt wird, so wie bei einer Kugel, die eine schiefe Ebene herunterrollt. Ein weiterer Blick auf die tägliche Erfahrung zeigt aber, dass der Unterschied in der potentiellen Energie nicht alleine über das Eintreten bestimmter Ereignisse entscheidet. So haben beim Losen mit „Wappen oder Zahl“ die Münzen, die aus gleicher Höhe gefallen sind, den gleichen Verlust an potentieller Energie erfahren und, wenn sie auf dem Tisch liegen, haben sie die gleiche potentielle Energie. 6 6. Thermodynamik Trotzdem tritt, bei häufigem Werfen, „das Ereignis“ Wappen und Zahl doppelt so häufig auf wie das Ereignis Wappen und Wappen oder Zahl und Zahl. Die Wahrscheinlichkeit entscheidet hier alleine über den Ausgang des Experiments. Die Entropie, S ,ist ein Maß für die Wahrscheinlichkeit. ∆S , der Entropieunterschied zwischen dem Ausgangs- und dem Endzustand entscheidet mit darüber, ob eine Reaktion ablaufen kann. Eine „exotherme Reaktion“ ( ∆H < 0 ), kann nicht schon alleine nur deswegen ablaufen, weil sie exotherm ist. Die Änderung der Wahrscheinlichkeit zwischen Ausgangsund Endzustand spielt eine mit entscheidende Rolle. Die „freie Enthalpie“, ∆G, ist diejenige thermodynamische Größe, die darüber entscheidet, ob eine Reaktion im Prinzip ablaufen kann oder nicht. Die freie Enthalpie setzt sich aus der Enthalpie ∆H und dem Ausdruck T∆S zusammen. ∆S ist die Änderung der Entropie des Reaktionssystems beim Übergang von den Ausgangsstoffen zu den Endprodukten. Die Gleichung: ∆G = ∆H – T∆S ist eine der wichtigsten thermodynamischen Gleichungen in der Chemie. 6.8 Freie Enthalpie Der Wert von ∆G entscheidet darüber, ob eine Reaktion im Prinzip überhaupt ablaufen kann oder nicht. Sie trägt auch die Bezeichnung „Gibbs-Helmholtz-Gleichung“ (J.W.Gibbs, 18391903, Yale; H.L.F. von Helmholtz, Professor für Anatomie! Berlin, Königsberg, Bonn, Heidelberg). Durch ∆G sind folgende Alternativen gegeben: ∆G < 0 Die Reaktion kann „freiwillig“ ablaufen ∆G > 0 Die Reaktion läuft nicht „freiwillig“ ab ∆G = 0 Das System befindet sich im Gleichgewicht Was heißt „freiwillig“ in diesem Zusammenhang? Es heißt nicht, dass die Reaktion sofort ablaufen müsste. Es heißt nur, dass sie ablaufen kann und, dass sie, wenn sie einmal in Gang gebracht ist, solange abläuft bis ein Zustand erreicht ist, in dem ∆G = 0 wird, in dem, wie man sagt, das System im Gleichgewicht ist. 6.8.1 Entropieänderung bei chemischen Reaktionen Wann kann eine Reaktion ablaufen? Wenn ∆G negativ ist! Damit ∆G negativ ist, muss die Summe aus ∆H und (– T∆S) negativ sein. ∆S bezeichnet ein Maß für die Wahrscheinlichkeit, mit der sich der neue Zustand des Systems einstellen wird. Wenn die Reaktionsentropie positiv ist, dann heißt das, dass der durch die Reaktion erreichte Zustand wahrscheinlicher ist, als der Ausgangszustand. Da T immer größer als Null ist, ist der Term (– T∆S) dann negativ und er trägt dazu bei, ∆G negativ werden zu lassen. 7 6. Thermodynamik 6.8.2 Anzahl der Teilchen erhöht sich: ∆S > 0 ∆S ist immer dann positiv, wenn die Wahrscheinlichkeit zunimmt, was gleichbedeutend damit ist, dass die Unordnung im System zunimmt. Wenn bei einer Reaktion aus einem Teilchen zwei entstehen, dann nimmt die Unordnung ganz sicher zu und man kann sicher sein, dass die Reaktionsentropie, ∆S, positiv ist, so dass die Reaktion an Wahrscheinlichkeit gewinnt und ∆G durch den Entropiebeitrag negativer wird Beispiel: N2O4 → 2 NO2 Distickstofftetroxid zerfällt schon oberhalb 0°C „merklich“ in zwei Moleküle NO2. Stickstoffdioxid ist eines der wenigen Moleküle aus der Chemie der Hauptgruppenelemente, das paramagnetisch ist. Der Energiegewinn, der beim Zusammentreten von zwei Stickstoffdioxid-Molekülen zu Distickstofftetroxid entsteht, ist so klein, dass die Zunahme der Entropie beim Zerfall des Dimeren Moleküls in zwei Monomere ausreicht, um ∆G = ∆H − T∆S schon bei T > 273 K den positiven Wert (man muss die Bindung brechen!) von ∆H für diese Reaktion kompensiert. 6.8.3 Anzahl der Teilchen erniedrigt sich: ∆S < 0 Bei tiefer Temperatur läuft die Reaktion dagegen in der Richtung: 2 NO2 → N2O4 „freiwillig“ ab. Für diesen Vorgang ist ∆H negativ, es entspricht der Bildungsenthalpie des Dimeren. Die Reaktionsentropie ist negativ, die Ordnung nimmt zu. Damit ist der Term T ∆S negativ und - T ∆S ist folglich positiv. Nur wenn T klein ist, kann daher ∆G < 0 sein! Analog verhält sich N2O3, das aus NO und NO2 entsteht. (Auch NO ist ein paramagnetisches Molekül). Wenn die Anzahl der Teilchen bei einer Reaktion abnimmt, dann ist die „Reaktionsentropie“ sicher negativ. Ein oft zitiertes Beispiel ist die Synthese von Ammoniak (Aus vier Teilchen werden zwei!) 3H2 + N2 → 2 NH3 Bei hoher Temperatur ist daher der Zerfall von Ammoniak, die Rückreaktion, bevorzugt. Die Schwierigkeit bei der Ammoniak-Synthese besteht darin, dass bei niedriger Temperatur seine Bildung zwar bevorzugt ist, aber – ohne Katalysator – praktisch unendlich langsam abläuft; bei hoher Temperatur, bei der sie rasch ablaufen könnte, ist der Zerfall bevorzugt. Das Dilemma lässt sich nur dadurch lösen, dass, durch einen Katalysator, die Bildungsgeschwindigkeit bei niedriger Temperatur erhöht wird . 6.8.4 Zerfall bei hohen Temperaturen Wenn die Temperatur T hoch ist, dann bestimmt immer mehr der Entropieterm über das Vorzeichen von ∆G. Bei hoher Temperatur ist daher der Zerfall von größeren Teilchen in kleinere der entscheidende Prozess. Eines der oft zitierten chemischen Beispiele hierfür ist das Verhalten von Cyclooktaschwefel, der zunächst bei 445°C als Gas vorliegt, in dem S8-Moleküle vorhanden sind. Bei Erhöhung 8 6. Thermodynamik der Temperatur brechen die S-S-Bindungen auf und es bilden sich kleinere Moleküle S6, S4 und schließlich S2: Erhöhung der Temperatur in der Gasphase: S8 S6 S4 S2 Die S2-Moleküle haben die gleiche Elektronenkonfiguration wie die O2-Moleküle (natürlich mit Valenzorbitalen der Hauptquantenzahl 3!), sie sind also wie O2 paramagnetisch mit zwei ungepaarten Elektronen. Oberhalb 1800 °C zerfallen dann auch die S2-Moleküle zu S-Atomen und, wenn man weiter heizt, verlieren die Atome Elektronen und werden ionisiert. Ein anderes Beispiel ist die Reaktion, die zum spektroskopischen Nachweis von Natrium dient. Bei ihr wird ein Tropfen einer wässrigen Lösung eines Natriumsalzes, z.B. NaCl, in der Flamme erwärmt, so dass das Wasser verdampft und zunächst NaCl-Kriställchen entstehen. Die NaCl-Kristalle zerfallen bei der hohen Temperatur der Flamme weiter, wobei sich Natriumatome und Chloratome bilden (Warum gehen die Natrium-Teilchen nicht als Na+Ionen in die Gasphase?). Die Natriumatome werden schließlich bei der Temperatur der Flamme angeregt und strahlen die Energie in Form von Licht der Natrium-D-Linie ab. Würde man die Temperatur noch weiter erhöhen, was mit einer Gasflamme nicht möglich ist, würden die Natriumatome schließlich ionisiert, d.h. aus einem Natriumatom würden zunächst zwei Teilchen, Na+ und e- entstehen. Bei noch höherer Temperatur... u.s.f... Völlig unabhängig von der Art des Systems, das man betrachtet, entstehen bei immer weiterer Erhöhung der Temperatur, d.h. bei Zuführung von immer mehr thermischer Energie, immer mehr weitere Teilchen. Auch die Vielzahl von Teilchen, die in einem Hochenergiebeschleuniger entstehen, verdankt sich dem Immer-Negativer-Werden von ∆G mit zunehmender Anzahl von Teilchen durch den Term – T∆S. 9 6. Thermodynamik 6.9 Index A abgeschlossenes System ........................... 3 Adiabatisch ............................................... 2 Ammoniak-Synthese ................................ 8 Arbeit ........................................................ 2 C Cyclooktaschwefel.................................... 8 E Energieumsätzen....................................... 2 Enthalpie................................................... 6 Entropie ................................................ 3, 6 exotherme Reaktion.................................. 7 F Joule-Thomson-Effekt ..............................4 K Katalysator ................................................8 Kompression .............................................2 kritische Druck..........................................4 kritische Temperatur .................................4 O organischen Verbindungen .......................5 P Photosynthese............................................5 potentiellen Energie ..................................6 R freie Enthalpie........................................... 7 Reaktionsentropie......................................8 realen Gasen..............................................4 G T Gibbs......................................................... 7 Gibbs-Helmholtz-Gleichung .................... 7 Thomson....................................................4 H Unordnung ................................................5 Helmholtz ................................................. 7 I idealen Gas ............................................... 6 Isotherm .................................................... 2 Isotherme Expansion ................................ 3 Isotherme Kompression............................ 3 J U V Volumenarbeit...........................................2 Volumenarbeit bei idealen Gasen:.........2 W Wahrscheinlichkeit....................................7 Wärmeenergie .......................................3, 6 Joule.......................................................... 4 10