10 DIE KINETISCHE GASTHEORIE 10.1 Vorbemerkungen 10.2
Werbung

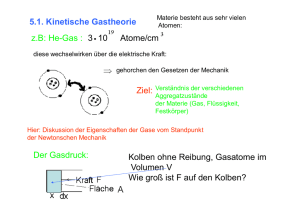
-1- 10 DIE KINETISCHE GASTHEORIE 10.1 Vorbemerkungen Die kinetische Gastheorie beschreibt mit einfachen Annahmen einen Zustand der Materie (nämlich den gasförmigen) in vielen Fällen verblüffend gut. Insofern ist die kinetische Gastheorie ein gutes Beispiel, wie mit einfachen Modellen der Zustand und das Verhalten von Materie mathematisch beschrieben werden kann. Es gibt noch zwei weitere Gründe, die kinetische Gastheorie in der Physikalischen Chemie zu behandeln. Erstens vermittelt das Ergebnis einen Eindruck, wie es in einem Gas auf molekularer Ebene zugeht. Wie schnell bewegen sich die Moleküle? Wie oft stoßen sie miteinander (wichtig für Reaktionskinetik)? Wie lang sind die Wege, die Moleküle zwischen zwei Stößen zurücklegen? Zweitens wird in dem Kapitel der Begriff der „Wahrscheinlichkeitsverteilung“ eingeführt. Wahrscheinlichkeitsverteilungen werden oft bei der Beschreibung von Viel-Teilchen-Systemen benutzt. Die kinetische Gastheorie wurde über eine lange Zeit bis zu dem heutigen Stand entwickelt. Daniel Bernoulli leitet 1738 die Druck-Volumen Beziehung her. Waterston 1843 (dessen Veröffentlichung leider ignoriert wurde) und Clausius 1857 entwickelten die detaillierte Form. Maxwell brachte die Theorie auf den Stand, der hier behandelt wird. Insbesondere berücksichtige er 1860-67 die Geschwindigkeitsverteilung und behandelte Transporterscheinungen. Voraussetzungen: • Das Gas besteht aus Molekülen der Masse m, die sich ungeordnet und zufällig verteilt bewegen. • Die Moleküle wechselwirken nicht miteinander, außer dass sie miteinander stoßen. Diese Stöße sollen rein elastisch sein. Rein elastisch bedeutet, dass die gesamte kinetische Energie von jeweils zwei Teilchen vor dem Stoß genau so groß ist, wie nach dem Stoß. Was sich ändern kann, ist die Verteilung der kinetischen Energie. Ein Teilchen kann Energie an das andere Teilchen abgeben. Wäre der Energieübertrag nicht möglich, dann würde sich jedes Teilchen mit der einmal vorhandenen Geschwindigkeit ewig weiterbewegen. • Die Moleküle stoßen rein elastisch mit den Wänden des Gefäßes. • Damit es selbst in Abwesenheit von langreichweitigen Kräften zu Stößen kommt, kann man sich die Teilchen räumlich ausgedehnt vorstellen. Die Ausdehnung soll jedoch vernachlässigbar klein gegenüber der mittleren freien Weglänge zwischen zwei Stößen sein. 10.2 Berechnung des Drucks In der kinetischen Gastheorie wird der Druck, den ein Gas auf die Wände eines Behälters ausübt, durch die Impulsüberträge erklärt, die bei Stößen der Moleküle mit den Wänden des Behälters auftreten. Dazu betrachten wir die Moleküle, die auf die Fläche A auftreffen. Angenommen wir könnten genau die Impulse messen, die die Moleküle bei ihren Stößen auf A übertragen. Eine typische Spur ist in der Abbildung gezeigt. In zufällig verteilten Zeitabständen treffen Moleküle auf A auf. In Wirklichkeit dauert ein Stoß größenordnungsmäßig 10-12 s. Die Moleküle übertragen unterschiedliche Impulse. Die Impulsüberträge sind unterschiedlich, weil (1) die Teilchen unterschiedlich schnell sind und (2) die Teilchen unter verschiedenen Winkeln auf die Fläche treffen. Bei PCIII-10 MASKOS/BUTT 28.05.2009 -2- einem Stoß des iten Teilchens wird der Impuls 2 ⋅ mv x übertragen. vx ist die Geschwindigkeit des Teilchens senkrecht zur Wandebene. Fläche A Impuls auf Fläche A Zeit Wie groß ist der Druck auf die Fläche? Druck ist Kraft pro Fläche. Kraft ist Impulsänderung pro Zeit. Wir müssen also überlegen, welcher Gesamtimpuls in einer bestimmten Zeit auf die Fläche übertragen wird. Dazu betrachten wir ein Zeitintervall Δt. Der gesamte übertragene Impuls ist 2mv xi . Der mittlere Druck ist damit ∑ PΔt = ∑ 2mv xi i Δt ⋅ A Dabei läuft die Summe über alle im Zeitintervall Δt auf die Fläche A treffenden Teilchen. Der Druck hat als Index „Δt“, um deutlich zu machen, dass der Wert abhängig davon ist, welches Zeitintervall ich wähle und wie lang es ist. Berücksichtigt man jeden einzelnen Stoß jedes Teilchens, können der Druck und andere Zustandsgrößen präzise mit den Gesetzen der Mechanik berechnet werden. Das wird in molekulardynamischen Rechnungen tatsächlich getan. Praktisch ist das oft schwierig oder unmöglich, da man nie die Impulse und Orte aller Teilchen wissen kann. Glücklicherweise ist das normalerweise auch nicht nötig, vorausgesetzt man hat es mit einer großen Zahl von Teilchen zu tun. Man kann dann statistische Methoden anwenden. Für die weitere Überlegung machen wir die Annahme, dass die N Moleküle, die sich im Behälter mit dem Volumen V befinden, gleichmäßig verteilt sind. Das bedeutet: In einem beliebig herausgegriffenen, kleinen Teilvolumen dV sollen sich N ⋅ dV V = n ⋅ dV Moleküle befinden. Dabei ist n die Teilchendichte (Zahl Moleküle pro Volumen). Diese Voraussetzung ist nur dann sinnvoll, wenn sich in jedem Volumenelement dV viele Moleküle befinden. Andernfalls hat man mit großen Schwankungen zu rechnen. Jetzt wollen wir die Moleküle nach ihren Geschwindigkeiten sortieren. Dabei muss man beachten, dass die Geschwindigkeit ein Vektor ist. Die Geschwindigkeit eines Teilchens ist also durch drei Geschwindigkeitskomponenten vx, vy und vz beschrieben. Aus allen n Teilchen (pro Volumen) wählen wir diejenigen aus, deren Geschwindigkeiten im Intervall vx bis vx+dvx vy bis vy+dvy vz bis vz+dvz liegen. Diese Zahl sei durch die Funktion f beschrieben: n ⋅ f ( v x , v y , v z ) dv x dv y dv z Der Faktor n wurde hinzugefügt, damit das Integral über alle Geschwindigkeiten Eins ist: PCIII-10 MASKOS/BUTT 28.05.2009 -3+∞ ∫ ∫ ∫ f ( v x , v y , v z ) dv x dv y dv z = 1 . −∞ Die Funktion f nennt man Geschwindigkeitsverteilung. Mit der Einführung der Verteilungsfunktion geht man von der präzisen Mechanik über zur Statistik. Die Verteilungsfunktion soll nämlich eine kontinuierliche Funktion sein und die Verteilung angeben, die bei einer unendlich großen Zahl von Teilchen vorläge. Mathematisch bedeutet dies den Übergang von der Summe zum Integral. Man kann sich die Bedeutung von f auch über den Begriff der Wahrscheinlichkeit klar machen: Greife ich aus n Molekülen willkürlich eins heraus, so besteht die Wahrscheinlichkeit f ( v x , v y , v z ) dv x dv y dv z dafür, dass die Geschwindigkeit des herausgegriffenen Moleküls gerade im Intervall vx…vx+dvx, vy…vy+dvy, vz…vz+dvz liegt. Achtung! Es ist völliger Unsinn zu sagen, f (v x , v y , vz ) sei die Wahrscheinlichkeit dafür, dass ein Molekül gerade die Geschwindigkeit vx, vy ,vz besitzt. Die Wahrscheinlichkeit für einen exakt vorgegebenen Zahlenwert ist immer Null. Nur für ein bestimmtes Intervall besteht eine endliche Wahrscheinlichkeit. Mit Hilfe der Geschwindigkeitsverteilung kann man die Mittelwerte verschiedener Funktionen berechnen. Mittelwerte deuten wir durch einen Querstrich über der Variablen an. Beispiel: Die mittlere kinetische Energie der Translation eines Teilchens beträgt +∞ Teilchen E kin = ∫ ∫ ∫ 2 (v x + v y + v z )⋅ f ⋅ dv x dv y dv z = 2 ⋅ v m 2 2 2 m 2 −∞ Zurück zur Berechnung des Drucks. Zunächst betrachte ich nur die Moleküle, deren Geschwindigkeiten im Intervall vx…vx+dvx, vy…vy+dvy, vz…vz+dvz liegen. Im Zeitraum 0…Δt treffen alle die Moleküle auf A, die höchstens eine Strecke v x Δt von A entfernt sind. Insgesamt treffen also n ⋅ A ⋅ v x ⋅ Δt ⋅ f (v x , v y , v z )dv x dv y dv z Moleküle auf die Fläche A. Jedes Molekül überträgt bei der Reflexion den Impuls 2 ⋅ mv x . Der Impulsübertrag der Moleküle aus dem genannten Geschwindigkeitsintervall ist also 2 ⋅ n ⋅ m ⋅ A ⋅ v x2 ⋅ Δt ⋅ f (v x , v y , v z )dv x dv y dv z Um den Druck zu erhalten, summieren wir nicht, sondern integrieren: +∞+∞+∞ 1 P= ⋅ ∫ ∫ ∫ 2nmA ⋅ v x2 ⋅ Δt ⋅ f (v x , v y , v z )dv x dv y dv z A ⋅ Δt −∞−∞ 0 +∞+∞+∞ = 2nm ⋅ ∫ ∫ ∫ v x ⋅ f (v x , v y , v z )dv x dv y dv z 2 −∞−∞ 0 Die Geschwindigkeitskomponenten in y und z Richtung werden von -∞ bis +∞ integriert. In x-Richtung zählen nur positive Geschwindigkeiten, denn die Teilchen die sich von der Fläche A entfernen, treffen dort sicher nicht auf. Ohne nähere Annahmen über die Geschwindigkeitsverteilung kommen wir hier nicht weiter. Glücklicherweise brauchen wir nur sehr allgemeine Annahmen: • f ist symmetrisch in vx. Nach rechts gerichtete Geschwindigkeiten kommen genauso oft vor wie nach links gerichtete, d.h. f ( − v x , v y , v z ) = f ( v x , v y , v z ) . Dann gilt PCIII-10 MASKOS/BUTT 28.05.2009 -4+∞ 2⋅ ∫ v x2 +∞ ⋅ f ⋅ dv x = ∫ v x ⋅ f ⋅ dv x 2 −∞ 0 Mit der oben beschriebenen Mittelwertsbildung kann man daher schreiben +∞+∞+∞ P = nm ⋅ ∫ ∫ ∫ v x ⋅ f (v x , v y , v z )dv x dv y dv z = nm⋅v x 2 2 −∞−∞−∞ • f sei kugelsymmetrisch. Die x-Richtung ist nicht vor der y- und z-Richtung ausgezeichnet. Dann gilt 1 v x2 = v 2y = v z2 = v 2 , 3 wobei v = v x2 + v 2y + v z2 der Betrag der Geschwindigkeit ist. Damit P= 1 nm⋅ v 2 3 Wir haben den Druck, eine makroskopische Zustandsfunktion, auf mikroskopische Parameter, nämlich das mittlere Geschwindigkeitsquadrat der Moleküle und deren Masse zurückgeführt! Bemerkung: Es ist ein großer Unterschied ob ich erst quadriere und dann mittele ( v 2 ), oder ob ich erst mittele und dann quadriere ( v 2 = 0 ). Den Druck kann man leicht zur kinetischen Energiedichte in Beziehung setzen. Oben hatten wir bereits gesehen, dass die mittlere Energie eines Teilchens durch m 2 ⋅v 2 gegeben ist. Die ganze in der Volumeneinheit enthaltene kinetische Energie der Translation beträgt also E kin V = P= nm 2 ⋅ v . Damit lässt sich der Druck schreiben als 2 2 E kin ⋅ 3 V Jetzt vergleichen wir den Ausdruck mit der Zustandsgleichung des idealen Gases. Beschreibt unser Modell ein ideales Gas, dann muss die vorletzte Gleichung identisch sein mit der Zustandsgleichung P = nk B T (Statt der Gaskonstanten R = N A k B verwendet man in der Statistik oft die BoltzmannKonstante, da wir von einem molekularen Bild ausgehen.) Das bedeutet: Zwischen der mittleren kinetischen Energie eines Moleküls und der Temperatur muss die Beziehung 1 2 3 mv = k B T 2 2 bestehen. Für jede Geschwindigkeitskomponente gilt 1 2 1 mv x = k B T 2 2 Falls die Beziehung stimmt, und das muss experimentell überprüft werden, hat man damit erstmalig eine der Wärmelehre eigentümliche Größe, nämlich die Temperatur, PCIII-10 MASKOS/BUTT 28.05.2009 -5- auf rein mechanische Größen zurückgeführt. Die Temperatur entspricht damit der mittleren kinetischen Translationsenergie der Moleküle. Gleichverteilungssatz Das eben abgeleitete Ergebnis lässt sich verallgemeinern zum sogenannten Gleichverteilungssatz. An dieser Stelle möchte ich den Gleichverteilungssatz noch etwas ungenau wiedergeben für den Fall, dass keine äußeren Kräfte auf die Teilchen wirken: Auf jeden Freiheitsgrad, den ein Teilchen hat, entfällt im Mittel die Energie ½kBT. Die Zahl der Freiheitsgrade ist die Zahl unabhängiger Koordinaten, die zur genauen Beschreibung der Lage des Teilchens notwendig sind. Für ein punktförmiges Teilchen im Behälter sind x, y und z zur Beschreibung seiner Position notwendig. Man hat also drei Freiheitsgrade. Experimentelle Prüfung Eine weitgehende Prüfung gelang mit Hilfe von Molekularstrahlen. Man lässt die Moleküle aus einem temperierten Behälter ins Hochvakuum treten und durch einen Geschwindigkeitsselektor laufen. Damit konnte nicht nur die mittlere Geschwindigkeit der Moleküle, sondern auch deren Geschwindigkeitsverteilung gemessen werden. Temperierter Behälter mit Gas und einem Loch durch das ein Molekularstrahl entweichen kann Detektor C6H6 CO2 He N2 284 379 1256 475 Einige mittlere Geschwindigkeitsbeträge bei 25°C in m/s. Lange vor dieser raffinierten Versuchsanordnung hatte man bereits eine rein thermische Methode: Aus der spezifischen Wärme sollte sich die mittlere Energie der Moleküle bestimmten lassen. Wenn die Moleküle keine andere Energie enthalten, als die kinetische Energie der Translation, dann wäre der gesamte Energieinhalt von einem mol gerade U = NA ⋅ 3 3 m 2 ⋅ v = N A ⋅ k B T = RT 2 2 2 Die spezifische Wärmekapazität wäre dann cV = ∂U ∂T = V 3 R 2 Dieser berechnete Wert war aber zur Zeit der Entwicklung der kinetische Gastheorie in krassem Widerspruch zu experimentellen Resultaten! Mit den damals übliche Gasen H2, O2, N2 erhielt man cV = 5 2 ⋅ R . Nur für einatomige Gase, wie den Edelgasen, kam PCIII-10 MASKOS/BUTT 28.05.2009 -6- der erwartete Wert heraus. Der Grund für die Abweichung liegt in der Annahme, dass die gesamte kinetische Energie in Form von Translation vorliegt. Rettungsversuch: Die Teilchen sind ausgedehnt. Das müssen sie auch sein damit ihr Stoßquerschnitt nicht unendlich klein ist. Um die Lage eines ausgedehnten Körpers zu beschreiben, brauche ich aber neben den drei Raumkoordinaten noch drei Winkel für die Orientierung. Man hat also drei Freiheitsgrade mehr zur Verfügung. Leider steigt damit die erwartete Wärmekapazität auf cV = 6 2 ⋅ R und nicht auf cV = 5 2 ⋅ R . Ein katastrophales Ergebnis! Eine Erklärung liefert erst die Quantenmechanik. Quantenmechanische Deutung Ein einatomiges Gasmolekül hat (ohne äußere Kräfte) drei Freitsgrade der Translation und keinen für die Rotation. Man könnte einwenden, dass selbst ein einatomiges Molekül, wie z.B. He, durch seine Elektronenwolke eine Ausdehnung besitzt und es deshalb drei weitere Freiheitsgrade der Rotation besitzen sollte. Die Quantenmechanik verneint dies. Um die Orientierung eines Körpers bestimmen zu können, müssen auf der Oberfläche des Körpers irgendwelche Markierungen sein. Auf einer Billiardkugel, auch wenn sie noch so gut poliert ist, ist dies beispielsweise der Fall. Auf einem Atom aber nicht, und es ist auch prinzipiell unmöglich. Ein Atom sieht aus allen Richtungen gleich aus. Deshalb gäbe es gar keine Möglichkeit eine Rotation zu messen. Damit beträgt die Wärmekapazität cV = 3 2 ⋅ R . Eine Möglichkeit eine Markierung auf dem Atom anzubringen wäre, ein anderes Atom daran zu binden. Es entsteht eine zweiatomiges Molekül. Bei einem zweiatomigen Molekül ist Rotation möglich und zwar um zwei aufeinander senkrecht stehende Achsen, die in einer Ebene senkrecht zur Verbindungslinie der beiden Atome liegen. Für die Rotation um die Verbindungslinie gilt das gleiche wie beim einatomigen Moleküle: Man kann sie nicht messen und sie trägt nichts zur Energie und zur Wärmekapazität bei. Insgesamt gibt es also drei Freiheitsgrade der Translation und zwei der Rotation. Die Wärmekapazität ist cV = 5 2 ⋅ R . Elektronenwolke Keine Rotationsenergie Kern Erst bei drei- und mehratomigen Molekülen (sofern sie nicht auf einer Linie liegen) gibt es drei Freiheitsgrade der Rotation. Damit beträgt die Wärmekapazität cV = 3R . 10.3 Die Maxwellsche Geschwindigkeitsverteilung 10.3.1 Beschreibung der Herleitung Um den Druck aus der Geschwindigkeitsverteilung zu berechnen, waren wir mit einfachen Annahmen ausgekommen und brauchten gar nicht explizit die Verteilungsfunktion f zu kennen. Im Allgemeinen muss man aber die Verteilungsfunktion kennen, um Mittelwerte von Zustandsgrößen berechnen zu können. Diese Herleitung ist nicht ganz einfach und ich möchte das wesentliche Teilergebnis einfach angeben. Der wesentliche Schritt in der Herleitung gelang Boltzmann mit dem sogenannten Stoßzahlenansatz (R. Becker, Theorie der Wärme, S. 78). Er fand, dass die Geschwindigkeitsverteilung die Form f (v x , v y , v z ) = A ⋅ e ( − B⋅ v x2 + v 2y + vz2 ) = A ⋅ e − Bv 2 PCIII-10 MASKOS/BUTT 28.05.2009 -7- haben muss. A und B sind positive noch zu bestimmende Konstanten, die nicht mehr von vx, vy und vz abhängen. Einschub: Integrale über Gaußsche Funktionen Im Folgenden kommen oft Integrale der Form ∞ ∫ x n e − Bx 2 dx 0 vor. Die Funktion für n = 2 ist in der Abbildung gezeigt. 1.0 2 x 0.8 2 exp(-x ) 0.6 0.4 2 2 x exp(-x ) 0.2 0.0 0.0 0.5 1.0 1.5 2.0 2.5 x Die Lösungen sind 1 π ⋅ , für n=0, 2 B 1 2B 2 1 π ⋅ , für n=2, 4 B3 1 , für n=1, 2B 3 π ⋅ , für n=4, 8 B5 , für n=3, +∞ ⇒ Für n= 0,2,4,... ist der Integrand symmetrisch ∫x e n − Bx 2 −∞ dx = 2 ⋅ ∫ x n e − Bx dx 2 0 +∞ ⇒ Für n= 1,3,... ist der Integrand unsymmetrisch ∞ ∫ x n e − Bx 2 dx = 0 −∞ Die Konstanten bestimmen wir mit Hilfe von zwei Bedingungen: +∞ +∞ +∞ ∫ ∫ ∫ f ⋅ dv x dv y dv z = 1 m 2 k BT vx = 2 2 und −∞ −∞ −∞ Beginnen wir mit der ersten, der Normalisierungsbedingung. Dabei machen wir uns f in drei Glieder zerlegen lässt gemäß zunutze, dass sich f (v x , v y , v z ) = f (v x ) f (v y ) f (v z ) . Damit zerfällt das Integral in drei gleichartige Integrale, die einzeln gelöst werden können: +∞ +∞ +∞ ∫ ∫ ∫ +∞ +∞ +∞ f ⋅ dv x dv y dv z = A ⋅ −∞ −∞ −∞ ∫ ∫ ∫ e ( − B vx2 + v 2y + vz2 )dv x dv y dv z −∞ −∞ −∞ +∞ = A⋅ ∫e −∞ − Bvx2 +∞ dv x ⋅ ∫e − Bv 2y +∞ dv y ⋅ −∞ PCIII-10 MASKOS/BUTT 28.05.2009 ∫e −∞ 3 − Bvz2 ⎛π ⎞2 dv z = A ⋅ ⎜ ⎟ ⎝B⎠ -8- Ähnlich kann man auch die zweite Bedingung verwenden: +∞ +∞ +∞ ∫ ∫ ∫ +∞ +∞ +∞ v x2 −∞ −∞ −∞ ⋅ f ⋅ dv x dv y dv z = A ⋅ = ∫ ∫ ∫ v x2 ⋅ e ( − B v x2 + v 2y + vz2 ) dv x dv y dv z −∞ −∞ −∞ +∞ 2 π A ⋅ ⋅ v x2 ⋅ e − Bv x dv x B −∞ = A⋅ ∫ π 1 ⋅ B 2 3 π A ⎛π⎞ 2 = ⋅⎜ ⎟ B 3 2B ⎝ B ⎠ Aus der zweiten Bedingung folgt 3 k T A ⎛π ⎞2 v x2 = B = ⋅⎜ ⎟ m 2B ⎝ B ⎠ Setzt man jetzt das Ergebnis der Normalitätsbedingung ein, erhält man k BT 1 m = ⇒B= m 2B 2k B T Einsetzen des Ergebnisses in die Normalisierungsbedingung ergibt: 3 3 ⎞2 3 ⎞2 ⎛ m ⎞2 ⎛ 2πk B T ⎛π ⎟⎟ 1 = A⋅⎜ ⎟ = A⋅⎜ ⎟ ⇒ A = ⎜⎜ k T 2 π ⎝ B⎠ ⎝ m ⎠ B ⎠ ⎝ Die Maxwellsche Geschwindigkeitsverteilung lautet also insgesamt: ⎛ m ⎞ 2 − 2 k BT (vx +v y +vz ) ⎟⎟ ⋅ e f (v x , v y , v z ) = ⎜⎜ ⎝ 2πk B T ⎠ 3 m 2 2 2 10.3.2 Interpretation Zur Veranschaulichung kann man sich die Geschwindigkeitsverteilung im „Geschwindigkeitsraum“ vorstellen. Die drei Koordinaten des Geschwindigkeitsraumes sind vx, vy, vz. Jedes Teilchen erhält gemäß seinen drei Geschwindigkeitskomponenten einen Punkt im Geschwindigkeitsraum. Punkte nahe am Ursprung entsprechen Teilchen mit kleinen Geschwindigkeiten. Punkte weit entfernt vom Ursprung entsprechen Teilchen mit hoher Geschwindigkeit. Betrachtet man die Wahrscheinlichkeit, in einem Ausschnitt des Geschwindigkeitsraumes dvxdvydvz ein Teilchen zu finden, so ist diese Wahrscheinlichkeit am Ursprung am größten. Die Wahrscheinlichkeit sinkt, durch die Exponentialfunktion, mit zunehmendem Abstand vom Ursprung. PCIII-10 MASKOS/BUTT 28.05.2009 -9- vz vy vx Verteilung einer Schar von Teilchen im Geschwindigkeitsraum. Bemerkungen: • Das charakteristische Merkmal der Geschwindigkeitsverteilung ist eine Exponentialfunktion, deren Exponent im Zähler die kinetische Energie, im Nenner dagegen so etwas wie die thermische Energie kBT enthält. • Die einzelnen Komponenten vx, vy, vz gehen unabhängig in die Geschwindigkeitsverteilung ein. Grund: Ich kann die Verteilungsfunktion in ein Produkt aus den drei Einzelverteilungsfunktionen zerlegen: f ( v x , v y , v z ) = f ( v x ) ⋅ f (v y ) ⋅ f ( v z ) . D.h. die Wahrscheinlichkeit eine Geschwindigkeit in x-Richtung im Intervall vx…vx+dvx zu finden, ist unabhängig davon, welche Geschwindigkeitskomponenten vy und vz ein Teilchen hat. Interessiere ich mich nur für den Mittelwert bezüglich einer Richtung, kann man die Verteilungsfunktion 1 mvx2 ⎛ m ⎞ 2 − 2 k BT ⎟⎟ ⋅ e f (v x ) = ⎜⎜ k T 2 π B ⎠ ⎝ verwenden. • Die Verteilungsfunktion hängt nur vom Betrag der Geschwindigkeit ab, nicht von den einzelnen Komponenten. Das ist natürlich sinnvoll. Wirken in dem Gas keine äußeren Kräfte, dann ist keine Raumrichtung ausgezeichnet. 10.3.3 Die Maxwellsche Verteilung der Geschwindigkeiten im engeren Sinne Ausgehend von der letzten Bemerkung könnte man jetzt fragen: Wie groß ist die Wahrscheinlichkeit f (v )dv dafür, ein Teilchen im Geschwindigkeitsintervall v…v+dv zu finden. Diesem Intervall entspricht im Geschwindigkeitsraum eine Kugelschale, welche von den beiden Kugeln mit den Radien v x2 + v 2y + v z2 = v und v + dv begrenzt wird. Deren Volumen ist 4πv 2 dv . Damit erhalten wir 3 mv 2 ⎛ m ⎞ 2 2 − 2 k BT ⎟⎟ ⋅ v ⋅ e f (v) = 4π ⋅ ⎜⎜ k T 2 π B ⎠ ⎝ PCIII-10 MASKOS/BUTT 28.05.2009 -10- vz Geschwindigkeitsvolumen 4πv2dv v vy vx dv Zusätzlich zur Exponentialfunktion kommt noch ein Faktor v2, der die Geschwindigkeitsverteilung bestimmt. Das hat eine auf den ersten Blick verblüffende Konsequenz. Die Wahrscheinlichkeit im Intervall dvxdvydvz ein Teilchen zu finden, war bei kleinen Geschwindigkeiten am größten. Die Wahrscheinlichkeit im Intervall dv ein Teilchen zu finden ist bei kleinen Geschwindigkeiten klein. Am Ursprung ist die Wahrscheinlichkeit sogar Null. Dies ist natürlich kein Widerspruch sondern trägt nur der Tatsache Rechnung, dass das Volumen der Kugelschalen im Geschwindigkeitsraum quadratisch mit v steigt. Wie sieht die Form der Geschwindigkeitsverteilung f(v) aus? Die Funktion beginnt bei Null mit der Steigung Null. Sie steigt monoton auf ein Maximum, fällt dann monoton (durch die Exponentialfunktion) ab und konvergiert gegen Null für große v. Maxwellsche Geschwindigkeitsverteilung für Stickstoff 0,0020 250 K -1 f(v) [(m/s) ] 0,0015 500 K 0,0010 0,0005 0,0000 0 200 400 600 800 1000 1200 Geschwindikeit [m/s] Wo liegt das Maximum von f(v)? Anders formuliert: Welches ist die wahrscheinlichste Geschwindigkeit vmax? Am Maximum ist die Ableitung von f(v) Null. Wahrscheinlichste Geschwindigkeit: mv 2 mv 2 ⎡ 3 − − ⎛ m df mv ⎟⎟ ⋅ ⎢⎢2v ⋅ e 2 k BT − = 4π ⋅ ⎜⎜ ⋅ e 2 k BT π dv 2 k T k T B B ⎠ ⎝ ⎢⎣ 3 ⎞2 0 = 2v max ⋅ e − 2 mvmax 2 k BT ⎤ ⎥ ⎥=0⇒ ⎥⎦ 2 mvmax − mv 2 mv 3 − max ⋅ e 2k BT ⇒ 2 − max = 0 ⇒ k BT k BT PCIII-10 MASKOS/BUTT 28.05.2009 -11- v max = 2k B T m Wie groß sind die mittlere Geschwindigkeit und die Wurzel aus der mittleren quadratischen Geschwindigkeit? Mittlerer Geschwindigkeitsbetrag: 3 mv 2 ⎛ m ⎞ 2 ∞ 3 − 2k BT ⎟⎟ ⋅ ∫ v ⋅ e v = 4π ⋅ ⎜⎜ dv = 4π 2 π k T B ⎠ ⎝ 0 3 2 ⎛ m ⎞ 2 1 ⎛ 2k B T ⎞ 8k B T ⎟⎟ ⋅ ⎜ ⋅ ⎜⎜ ⎟ = πm ⎝ 2πk B T ⎠ 2 ⎝ m ⎠ Die Integration geht nur von 0 bis ∞, da Geschwindigkeitsbeträge nur positiv sein können. Mittlere quadratische Geschwindigkeit: 3 ⎞2 ∞ 4 ⎛ m ⎟⎟ ⋅ ∫ v ⋅ e v 2 = 4π ⋅ ⎜⎜ ⎝ 2πk B T ⎠ 0 − mv 2 2 k BT 3 ⎞2 5 ⎛ m 3 ⎛ 2k T ⎞ 2 3k T ⎟⎟ ⋅ π ⎜ B ⎟ = B dv = 4π ⋅ ⎜⎜ m ⎝ m ⎠ ⎝ 2πk B T ⎠ 8 Dies stimmt mit dem Ergebnis aus dem letzten Kapitel 1 2 ⋅ mv 2 = 3 2 ⋅ k B T überein. Vergleicht man die beiden Werte miteinander und mit der wahrscheinlichsten Geschwindigkeit findet man, dass v max < v < v 2 da Beispiel: Wie groß sind vmax, v und 2k B T 8k B T 3k B T < < m πm m v 2 für He und N2 bei 25°C? Die Molmasse von He beträgt 4,00 g/mol, die von N2 28,02 g/mol. Anstatt der atomaren Massen m kann man auch die Molmasse M = N A m einsetzen, wenn man gleichzeitig kB durch R = N A k B ersetzt. NA kürzt sich raus. Für He (in Klammern dahinter N2) erhält man v max = v= 2 RT = M 2 ⋅ 8,314 J / Kmol ⋅ 298K m = 1113 0,004kg / mol s 8 RT m = 1256 πM s v2 = (420 m/s) (474 m/s) 3RT m = 1363 M s (514 m/s) Bemerkungen: v 2 beträgt 22%. • Der Unterschied zwischen vmax und • Leichte Moleküle bewegen sich schneller als schwere. • Die Geschwindigkeit wächst mit der Temperatur. Durch die Wurzel ist diese Abhängigkeit aber nicht drastisch. Um beispielsweise die Geschwindigkeit von Molekülen zu verdoppeln, muss man die Temperatur vervierfachen. PCIII-10 MASKOS/BUTT 28.05.2009 -12- 10.4 Stöße der Gasmoleküle Ein Stoß zwischen zwei Molekülen ist die Voraussetzung für eine chemische Reaktion. Die Zeitskala, mit der Vorgänge (z.B. chemische Reaktionen in Gasen) ablaufen, ist durch die Anzahl der Stöße pro Sekunde begrenzt. Die Stoßfrequenz mit anderen Molekülen, mit den Wänden des Behälters und die zwischen zwei Stößen im Mittel zurückgelegte Wegstrecke sind Inhalt dieses Unterkapitels. Historisch war die Einsicht wichtig, dass die Moleküle miteinander stoßen. Zur Zeit, als die kinetische Gastheorie entwickelt wurde, gab es nämlich einen massiven Einwand gegen die Theorie: Angenommen in einer Ecke des Raumes öffnet jemand eine Flasche mit einer stark riechenden Substanz. In der anderen Eckes nimmt man den Geruch erst nach Sekunden war. Wenn die Moleküle sich mit Geschwindigkeiten von einigen 100 m/s ausbreiten, sollte der Geruch praktisch sofort wahrnehmbar sein. Warum breiten sich Substanzen so langsam im Gas aus? Der Grund ist, dass sich die Moleküle durch Diffusion und nicht gradlinig ausbreiten. 10.4.1 Intermolekulare Stöße Bei der Beschreibung von Stößen zwischen Molekülen geht man davon aus, dass es genau dann zum Stoß kommt, wenn sich die Teilchen bis auf einen Abstand d annähern. Ist ihr Abstand größer, geschieht nichts. Man kann sich die Moleküle wie Kugeln mit Durchmesser d vorstellen, die rein elastisch stoßen, ansonsten aber nicht miteinander wechselwirken. Um die Stoßzahl zu berechnen, denkt man sich alle Moleküle eingefroren an einem Platz, den sie zu einem bestimmten Zeitpunkt einnehmen. Nur ein Molekül bewegt sich. Dieses Molekül stößt mit den „eingefrorenen“ Molekülen, deren Zentren innerhalb einer „Kollisions-Röhre“ mit Querschnittsfläche σ = πd 2 liegen. σ nennt man Stoß-Wirkungsquerschnitt (engl. collision cross-section). >d, keinStoß d <d, Stoß >d, keinStoß Man könnte einwenden, dass das Teilchen die gerade Bahn verlässt, sobald der erste Stoß erfolgt ist. Das stimmt. Es wird seine Bahn in einer neuen Kollisions-Röhre fortsetzen, bis es wieder von einem Teilchen aus der geraden Flugbahn geworfen wird. Das ändert aber nichts an der Stoßfrequenz und der mittleren freien Weglänge, da die eingefrorenen Teilchen zufällig verteilt sind. Die Wirkungsquerschnitte für ungeladene Gasmoleküle entsprechen etwa ihren geometrischen Abmessungen. PCIII-10 MASKOS/BUTT 28.05.2009 -13- σ / nm2 d / nm H2 0,06 0,28 CO2 0,17 0,47 He 0,04 0,22 N2 0,11 0,38 Stoß-Wirkungsquerschnitte und Durchmesser, die man durch Messung von TransportEigenschaften der Gase ermittelt hat. Die Stoßfrequenz (engl. collision frequency) kann man aus der Zahl der „eingefrorenen“ Moleküle innerhalb der Kollisions-Röhre berechnen. In einer bestimmten Zeit Δt legt das Teilchen mit einer mittleren Geschwindigkeit v die Strecke vΔt zurück. Das Volumen der Kollisions-Röhre beträgt also v ⋅ Δt ⋅ σ . Bei einer Moleküldichte n erwartet man eine Stoßfrequenz, d.h. eine Zahl Stöße pro Zeit, von z = v ⋅ n ⋅ σ . Jetzt muss man noch berücksichtigen, dass die Moleküle nicht „eingefroren“ sind, sondern sich bewegen. Das erreicht man, indem man die mittlere Geschwindigkeit des bewegten Teilchens (gemessen relativ zur Gefäßwand) durch die mittlere relative Geschwindigkeit zwischen zwei Teilchen (gemessen relativ zum gemeinsamen Schwerpunkt) ersetzt. Die mittlere relative Geschwindigkeit ist 8k B T v rel = mit der reduzierten Masse πμ μ= m A mB m A + mB mA und mB sind die Massen der bei dem Stoß beteiligten Teilchen. Haben beide Teilchen die gleiche Masse so ist μ = m / 2 und damit z = 2 ⋅ v ⋅ n ⋅σ = 2 ⋅ v ⋅ P ⋅σ k BT Beispiel: Wie hoch ist die Stoßfrequenz von Stickstoff bei 300 K und einem Druck von 1 bar? Wie groß ist die mittlere Zeit zwischen zwei Stößen? N2 hat eine Molmasse von 28 g/mol. Die mittlere Geschwindigkeit beträgt v= 8 ⋅ 8,314 J Kmol ⋅ 300 K 8RT = = 476 m/s πM 3,14 ⋅ 0,028kg / mol Damit z= 2 ⋅ 476m / s ⋅ 10 5 N / m 2 ⋅ 0,43 × 10 −18 m 2 1,38 × 10 − 23 J / K ⋅ 300 K = 7,0 × 10 9 s −1 Die mittlere Zeit zwischen zwei Stößen beträgt 1 z = 1,4 × 10 −10 s . Die Stoßfrequenz gibt an, wie oft ein einzelnes Teilchen stößt. Die Stoßzahl (engl. collision density) gibt die Zahl der Stöße aller Moleküle pro Zeit und pro Volumen an. Um die Stoßzahl zu erhalten, multiplizieren wir Stoßfrequenz mit n 2 . Die Division durch 2 ist nötig, um eine Kollision von A mit B und von B mit A nicht doppelt zu zählen. Die Stoßzahl ist also Z= 1 2 ⋅ v ⋅ n2 ⋅ σ PCIII-10 MASKOS/BUTT 28.05.2009 -14- Beispiel: Wie groß ist die Stoßzahl von Stickstoff bei 300 K und einem Druck von 1 bar? Dazu ersetzen wir in der Formel Z = nz 2 die Teilchendichte durch n = P k B T : Z= zP 7,0 × 10 9 / s ⋅ 10 5 N / m 2 = = 8,5 × 10 34 s −1m −3 − 23 2k B T 2 ⋅ 1,38 × 10 J / K ⋅ 300 K In einem 1 L großen Behälter ereignen sich also 0,001 ⋅ Z = 8,5 × 10 31 Stöße pro Sekunde. Die mittlere freie Weglänge λ (engl. mean free path), d.h. die mittlere Strecke die ein Molekül zwischen zwei Stößen zurücklegt, lässt sich aus der Stoßfrequenz berechnen. Die Zeit zwischen zwei Stößen beträgt 1/z. In dieser Zeit legt ein Molekül, welches sich mit v bewegt, die Strecke λ= v = z 1 2 ⋅ n ⋅σ zurück. Da z proportional mit dem Druck wächst, ist λ invers proportional zum Druck. Verdoppelt man den Druck, halbiert sich die freie Wegstrecke. Man kann die mittlere freie Weglänge auch durch die thermodynamischen Größen ausdrücken: λ= k BT 2 ⋅ P ⋅σ Beispiel: Wie groß ist die mittlere freie Weglänge von Stickstoffmolekülen bei 300 K und einem Druck von 1 bar? λ= 476m / s 7,0 × 10 9 / s = 68 nm 10.4.2 Stöße mit der Wand und anderen Oberflächen Dazu betrachten wir eine Wand mit der Fläche A senkrecht zur x-Achse. Jedes Molekül mit vx>0 wird innerhalb einer Zeit Δt gegen die Wand prallen, wenn es sich höchstens vxΔt von der Wand entfernt befindet. Moleküle mit vx<0 entfernen sich von der Wand. Anders ausgedrückt: Alle Moleküle im Volumen AvxΔt (und positiver Flugrichtung) treffen in Δt auf die Wand. Die Gesamtzahl der Stöße in Δt auf die Wand ist dann der Mittelwert dieser Größe multipliziert mit der Moleküldichte n: Anzahl Stöße = n ⋅ A ⋅ Δt ⋅ v x Der mittlere Geschwindigkeitsbetrag in x-Richtung beträgt ∞ v x = ∫ v x f (v x )dv x = 0 ∞ m ⋅ vx ⋅ e 2πk B T ∫0 − mvx2 2 k BT dv x = k T m ⋅ B = 2πk B T m Die Zahl der Stöße pro Zeit und pro Fläche ist folglich ZW = n⋅ v 4 Mit v = 8k B T πm und n = P k B T kann man schreiben: ZW = P 2πmk B T = Pv 4k B T PCIII-10 MASKOS/BUTT 28.05.2009 k BT v = 2πm 4 -15- Beispiel: Wie viele Stöße pro Sekunde und Quadratmeter erfährt die Wand eines Behälters der mit Stickstoff gefüllt ist bei 300 K und einem Druck von 1 bar? ZW = 10 5 N / m 2 ⋅ 476m / s 4 ⋅ 1,38 × 10 − 23 J / K ⋅ 300 K = 2,9 × 10 27 s −1m −2 Die Stoßzahl von Teilchen mit Oberflächen ist, wie wir später sehen werden, wesentlich für chemische Reaktionen an Festkörperoberflächen, z.B. bei der heterogenen Katalyse. Außerdem läßt sich sofort die Effusionsgeschwindigkeit aus einem kleinen Loch im Behälter angeben. Hat das Loch eine Querschnittsfläche A0, dann beträgt die Zahl der Moleküle, die pro Zeit durch das Loch austreten ZW A0 = PA0 2πmk B T Erwartungsgemäß wächst die Effusionsgeschwindigkeit linear mit dem Druck. Sie nimmt mit steigender Masse der Moleküle ab. Das kann man zur Molmassenbestimmung nutzen. Bestimmung der Molmasse mit Hilfe der Knutsen Methode Das interessierende Gas befindet sich ein einem Behälter mit einem kleinen Loch Damit die Methode zuverlässig ist, sollte der Lochdurchmesser wesentlich kleiner sein als die mittlere freie Weglänge der Moleküle. Dann ist gewährleistet, dass jedes Molekül, welches die Fläche A0 durchtritt, auch aus dem Behälter verschwindet und nicht durch Stöße mit anderen Molekülen zurück kommt. Man mißt die Druckabnahme in dem Behälter in Abhängigkeit von der Zeit bei konstanter Temperatur. Wie ist der zeitliche Verlauf des Drucks eines idealen Gases? Dazu stellt man eine Beziehung zur gesamten Teilchenzahl N her: dP d ( Nk B T / V ) k B T dN = = ⋅ dt dt V dt Die Teilchenzahl ändert sich dadurch, daß Moleküle durch das Loch mit der Querschnittsfläche A0 aus dem Behälter verschwinden. D.h. PA0 dN = − ZW A0 = − dt 2πmk B T Einsetzen k T A dP = − B ⋅ 0 ⋅P 2πm V dt Diese Differentialgleichung lässt sich leicht integrieren. Ergebnis: P = P0 ⋅ e −t τ mit τ= 2πm V ⋅ k B T A0 Der Druck nimmt exponentiell ab. Die Druckabnahme ist schnell bei hoher Temperatur und großem Loch. Sie nimmt mit wachsender Molmasse und steigendem Volumen ab. Kennt man T, V und A0, kann man aus der Zeitkonstante τ die Molekülmasse m berechnen. PCIII-10 MASKOS/BUTT 28.05.2009