3. Struktur der Moleküle
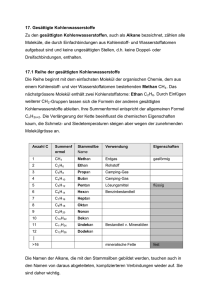
Werbung

Einführung in die Physikalische Chemie
K3-1 Struktur der Moleküle
3. Struktur der Moleküle
I Klassische Vorstellungen
VSEPR-Theorie
Morse-Potential
Born-Oppenheimer-Approximation
Kraftfeldrechnungen
II Quantenmechanische Vorstellungen
Dualität bei Photon und Elektron
Die stationäre Schrödingergleichung
Das Elektron im Kasten
Die Heisenbergsche Unschärferelation
Die chemische Bindung
Lit.: P.W. Atkins and J.A.Beran, “General Chemistry”, 2th ed., Sci.Amer.Books, N.Y., 1992, Kapitel
8.8, S. 305ff und Kapitel 8.9, S. 310ff.
P. Atkins, J. de Paula, “Atkins‘ Physical Chemistry”, Oxford Univ. Press, Oxford, 7th ed.,
2002, Teile der Kapitel 11 und 12.
I. Tinoco, K. Sauer, J.C. Wang, J.D. Puglisi “Physical Chemistry, Principles and applications in
biological sciences”, Prentice-Hall, New Jersey, 4th ed., 2002, Chapter 9
H.D. Försterling und H. Kuhn, “Moleküle und Molekülanhäufungen. Ein Einführung in die
physikalische Chemie”, Springer-Verlag, Berlin, 1983, Kapitel 1 bis 3.
Ergänzendes Material:
Blätter: K3-1 bis K3-15
Web: - VSEPR-Tutorial
- Tutorial „Potential“
- Molecular Mechanics Tutorial
Computerraum: Programm “MacSPARTAN”
so?
oder so?
oder so?
Einführung in die Physikalische Chemie
K3-2 Struktur der Moleküle
Räumliche Anordnung der Atome im Molekül
VSEPR - Regeln (Valence Shell Electron Pair Repulsion)
Valenzelektronen eines Atoms aufteilen in
- Bindungselektronen zu andern Atomen
- Einsame Elektronenpaare (“Lone Pairs” : LP's)
Definition : Zentren Z = Nachbaratome + LP's
1. Regel :
Die Zentren wollen möglichst weit voneinander weg sein
2. Regel :
LP's sind eher voluminöser als Kerne (nur negative Ladung!);
bei Z = 5 bevorzugen sie die äquatorialen Positionen,
bei Z = 6 die gegenüberliegenden.
Beispiele:
Z = 6 Oktahedral :
SF6 , BrF5
Z = 5 Trigonal Bipyramidal :
PF5
Z = 4 Tetrahedral (109.5°) :
CH4 , OH2
Z = 3 Trigonal planar (120°) :
BF3 , H2CO
Z = 2 Linear (180°) :
BeH2 , CO2
Anwendung am Beispiel SO2 :
1) Topologie :
O-S-O
(besser als S - O - O)
2) Valenzelektronenzahl : je 6, d.h. total 18 (aus der Stellung im Periodensystem)
3) Strichformel : 9 Striche (Elektronenpaare) :
- ++ |O - S - O| hohe Formalladung am S und kein Oktett am S (3.Periode zulässig)
+ O = S - O| ↔
- +
|O - S = O
↔
O=S=O
(kein Oktett am S)
..
4) Räumliche Anordnung : Z = 3 → 1. Regel : trigonal
S
O
O
Einführung in die Physikalische Chemie
K3-3 Struktur der Moleküle
Morse - Funktion
Empirische Potentialfunktion
{
V ( R) = De 1− e
[−
(k
2De ) ⋅ ( R −R e )
]
2
} −D
e
Re = Gleichgewichtsabstand (Minimum)
€
De = Dissoziationsenergie
k = Kraftkonstante (Krümmung bei Re)
Die Figur zeigt den typischen Verlauf eines
Morse-Potentials; der Energie-Nullpunkt ist
(entgegen der obigen Definition) auf der
Höhe des Potentialminimums gewählt. Die
Figur zeigt auch eine Parabel mit demselben
Minimum und derselben Krümmung.
Die
Parametrisierung
erlaubt
die
Konstruktion von V(R) nach Messung
dreier Grössen.
Die Morse-Funktion eignet sich vorzüglich
zur Modellierung des Potentialverlaufs in
chemischen Bindungen. Sie wird zur Be(Figur aus C.N. Banwell, Fundamentals of
schreibung von zweiatomigen, aber auch
Molecular Spectroscopy, McGraw-Hill 1972)
von mehratomigen Molekülen verwendet.
_______________________________________________________________________________
Parameter
für
die
Morse-Potentialfunktion
(Beispiele)
Gleichgewichtsabstände Re, Dissoziationsenergien De, Kraftkonstanten k zweiatomiger Moleküle.
R e /pm
De / eV
k /N m- 1
R e /pm
De / eV
k /N m- 1
H2
74.1
4.748
576
H2+
105.2
2.793
160
CH
112.0
3.642
448
H Cl
127.5
4.618
517
OH
097.0
4.624
782
N a2
307.9
0.730
17
CO
112.8
11.226
1905
S2
188.9
4.414
497
N2
109.8
9.905
2299
C l2
198.8
2.514
324
NO
115.1
6.615
1597
N a Cl
236.1
4.23
110
O2
120.8
5.214
1178
A g Cl
228.1
3.24
183
Ne 2
310.
0.0035
0.41
(N.B. 1eV = 96.4846 kJ/mol)
(Daten aus K.P. Huber, G. Herzberg, Constants of Diatomic Molecules, Van Nostrand 1979)
Einführung in die Physikalische Chemie
K3-4 Struktur der Moleküle
Innere und äussere Freiheitsgrade (FG) eines Moleküls
Hier werden Atome als Massenpunkte behandelt!
Der hier eingeführte Begriff der FG, erweist sich als nützlich, wenn es darum geht, die Anzahl
unabhängiger Koordinaten zur Beschreibung eines Moleküls herauszufinden, aber auch die Anzahl und
Art der unabhängigen Schwingungen, die das Molekül ausführen kann.
1 Atom kann sich im 3D-Raum unabhängig in 3 Richtungen bewegen, d.h. es besitzt
3 FG
1 Molekül aus N Atomen kann als Atom-Haufen aufgefasst werden und hat demnach 3N FG!
Diese können in innere und äussere FG unterteilt werden:
Das Molekül kann sich als Ganzes verschieben (Translation des starren Moleküls):
3 FG
Das Molekül kann als Ganzes rotieren (Rotation des starren Moleküls):
für ein nicht-lineares Molekül
3 FG
für ein lineares Molekül
2 FG
Buchhaltung: Es bleiben 3N - 3 - 3 (bzw. 2) = 3N - 6 bzw. 3N - 5 interne FG übrig.
Bemerkungen: - Man nennt die translatorischen und rotatorischen FG äussere FG, da sie das Molekül
als Ganzes betreffen und für die Beschreibung der Molekülstruktur nicht nötig sind (es
interessiert für die Struktur nicht, wo das Molekül ist und wie es orientiert ist!).
- Eine Drehung um die Achse eines linearen Moleküls ändert die Lage der
Massenpunkte nicht und zählt deshalb nicht als FG.
Wir halten fest:
Lineare Moleküle haben 3N - 5 interne FG
Nicht-lineare Moleküle haben 3N - 6 interne FG
Bsp.: HCN N = 3 ⇒
9 FG ⇒
9 - 5 = 4 innere FG
d.h. 4 Koordinaten reichen, um die Struktur des Moleküls zu beschreiben; es gibt 4
unabhängige Schwingungen! Es fallen einem sofort die 2 Streck-Schwingungen der
beiden Bindungen ein und eine Knick-Schwingung, aber welches ist die vierte?
Trick:
Dimension heruntersetzen:
Annahme: 1D-Raum: N Atome haben dann N FG, hier also 3 FG
Das Molekül kann nicht rotieren und sich nur in eine Richtung verschieben: 1 FG
Folglich muss es 3 - 1 = 2 innere FG haben: die beiden Streck-Schwingungen!
Annahme: 2D-Raum: N Atome haben dann 2N FG, hier also 6 FG
Das Molekül kann um 1 Achse rotieren und sich in 2 Richtungen verschieben: 1 + 2 FG
Folglich muss es 6 - 2 - 1 = 3 innere FG haben: die beiden Streck-Schwingungen und
eine Beuge-Schwingung in der Ebene. Die verbleibende Schwingung (FG) muss folglich
aus der Ebene heraus erfolgen: Beugeschwingung senkrecht zur Ebene!
Beachte:
Das Molekül kann 2 unabhängige Beuge-Schwingungen machen, eine in der
Ebene und eine aus der Ebene heraus. Diese haben aber die gleiche Frequenz.
Einführung in die Physikalische Chemie
K3-5 Struktur der Moleküle
Innere Rotation
Potential V(α) für die innere Rotation des Butans
α
Potential V(α) für die innere Rotation des Aethans
α
Einführung in die Physikalische Chemie
K3-6 Struktur der Moleküle
Energieterme eines Molekülmechanik-Programms (nach Allinger MM2)
Compression Energy :
für alle gebundenen Atompaare i - k
E Cik =
ks
2
2
(r - r o) (1+CS (r - r o))
Parameter : ks , ro , CS
Bending Energy :
für alle Valenzwinkel
EB =
kb
2
(Θ − Θo)2 (1+ SF (Θ − Θo)4 )
Parameter : kb , Θo , SF
Stretch Bend Energy :
für alle Valenzwinkel
ESB = k sb (Θabc- Θabc,o)((r ab- r ab,o)+(r bc-r bc,o))
Parameter : ks b, Θo , ro
Out-of-Plane-Bending : Spezialfall für sp2 -hybridisierte Atome
Torsional Energy :
für alle Dihedralwinkel
ET =
V1
V2
V3
(1 + cos ω) +
(1 - cos 2ω) +
(1 + cos 3ω)
2
2
2
Parameter : V1, V2, V3
Van der Waals Energy :
für alle Atompaare i - k, die nicht aneinander oder an ein
gemeinsames Nachbaratom gebunden sind
P = r*/r
P ≤ 3.311
P > 3.311
r* = ri + rk
- b/P
EVik = ∈* (a e
6
-c P )
∈* =
2
EVik = ∈* d P
a, b, c, d : univ. Konst.
Dipole Interaction Energy :
ri = VdW-Radius
Parameter : ri , ∈i
zwischen Bindungsdipolen
EUAB = DE µAµB (cos δ − 3 cos αA cos αΒ ) / R3
DE = Dielektrizitätskonst.
Parameter : µA , µB
∈ i∈ k
Einführung in die Physikalische Chemie
K3-7 Struktur der Moleküle
Molekülmechanik-Rechnung am Beispiel von Cyclopropan
(nach Allinger MM2)
Um zu zeigen, wie schnell schon für kleine Moleküle die Formeln sehr unhandlich werden, stellen wir
diese hier für Cyclopropan zusammen. Allerdings berücksichtigen wir die Wasserstoffatome nicht, da
das Beispiel sonst schon viel zu gross würde. Für 3 Atome kommen nur die ersten drei Terme des
Kraftfelds vor:
Etotal =
=
EC12 + EC13 + EC23 + EB123 + EB231 + EB312 + ESB123 + ESB231 + ESB312 =
k s,12
2
r12 − ro,12 ) 1+ CS12 (r12 − ro, 12 ) + k s,13 (r13 − ro,13 ) 2 1+ CS13 (r13 − ro,13 ) +
(
2
2
k s,23
2
k
2
4
r23 − ro,23 ) 1+ CS23 (r23 − ro, 23 ) + b,123 (Θ123 − Θo,123 ) 1+ SF123 (Θ123 − Θ o,123 ) +
(
2
2
k b, 231
2
4
k
2
4
Θ231 − Θo,231 ) 1+ SF231 (Θ231 − Θo,231 ) + b,312 (Θ 312 − Θo,312 ) 1+ SF312 (Θ312 − Θ o,312 ) +
(
2
2
(
(
)
(
)
(
)
(
)
)
(
)
(
)
(
(
)
)
k sb,123 (Θ123 − Θo,123 ) (r12 − ro,12 ) + (r23 − ro, 23 ) + k sb,231 (Θ 231 − Θ o,231 ) (r23 − ro,23 ) + (r31 − ro, 31 ) +
k sb,312 (Θ312 − Θ o, 312 ) (r31 − ro,31 ) + (r12 − ro,12 )
Die Energie scheint auf den ersten Blick eine Funktion der Variablen r12, r23, r13, Θ123, Θ231 und Θ312 zu
sein. Die 3 Winkel hängen aber von den 3 Abständen ab, sind also nicht frei wählbar, sodass die
Energie genau genommen nur eine Funktion der 3 Abstände ist. Man muss also das Minimum der
dreidimensionalen Energiehyperfläche finden, dann hat man die Struktur des stabilen Moleküls
bestimmt. Diese Rechnung ist schon in einfachen Fällen so aufwendig, dass man sie besser einem
Computer überlässt, der das Minimum mit numerischen Algorithmen sucht.
Dieses Blatt soll Ihnen einerseits zeigen, wie die Grundidee des mechanischen Modells (~Federmodell)
in ein mathematisches Modell umgesetzt wird, dessen Bearbeitung dann dem Computer überlassen
werden kann, andrerseits auch wie nötig es ist, die Hilfe des Rechners in Anspruch zu nehmen!
Einführung in die Physikalische Chemie
K3-8 Struktur der Moleküle
Dualität bei Photon und Elektron
Isaac Newton (1643 - 1727)
Lichtpartikel (verschiedene Farben = verschiedene Partikel)
Christian Huygens (1629 - 1695) Lichtwelle
(verschiedene Farben = verschiedene Frequenzen)
Wellentheorie setzt sich vorerst beim Licht durch
Um 1900:
Max Planck (1858 - 1947)
Quantelung (Wellenpaket = Photon)
E = hν
E = Energie; ν = Frequenz; h = Planksches Wirkungsquantum = 6.62608.10-34 Js
Albert Einstein (1879 - 1955)
E = mc2
Relativitätstheorie
m = Masse; c = Lichtgeschwindigkeit = 2.99792458.108m/s
Gleichsetzung der beiden Gleichungen
(N.B. h = h/2π)
€
hν = mc2
=>
und zusammen mit λ.ν = c (λ = Wellenlänge)erhalten wir:
hν =
hc
= mc 2
λ
⇒ λ=
h
h
=
mc p
Photon
Interpretation der Lichtwelle als Lichtpartikel (Photon) mit Impuls p.
€
Louis de Broglie (1892 - 1987) behauptet 1924, dass diese Gleichung analog auch für Materie
verwendet werden kann, d.h. auch Materie hat Wellencharakter mit der Wellenlänge:
λ=
h
h
=
p m⋅ v
Partikel
wobei m und v die Masse und Geschwindigkeit des Teilchens, z.B. des Elektrons, sind.
€
Beispiele:
6.62608 ⋅10-34 Js
−4
1) Ein Elektron mit der Geschwindigkeit 1 m/s: λ =
−31
−1 = 7.3⋅10 m = 0.73mm
9.10939 ⋅10 kg ⋅1ms
Beachte: Steht das Elektron still (v = 0), so wird seine Wellenlänge unendlich gross!
€
6.62608 ⋅10-34 Js
2) Ein 1 kg schwerer Ball fliegt mit 1 m/s: λ =
= 6.6⋅10−34 m
−1
1kg⋅1ms
Beachte: Der Fussball hat eine extrem kurze Wellenlänge; steht er aber still, wird sie auch unendlich!
€
Einführung in die Physikalische Chemie
K3-9 Struktur der Moleküle
Bohrsches Modell und de Broglie Beziehung
Aufgrund der spektroskopischen Beobachtung Ende des 19. Jahrhunderts, dass Atome nur bestimmte
Wellenlängen von Licht absorbieren oder aussenden, wurde das Bohrsche Modell des Atoms postuliert,
wonach die Elektronen nur diskrete Kreisbahnen einnehmen können (Quantelung der Bahnen). Die
mathematische Formulierung lautete, dass der Bahndrehimpuls L mit der Quantenzahl n gequantelt sei:
L= n⋅h
wo n = 1, 2, 3, …
Die de Broglie Beziehung liefert dafür nun eine Erklärung. Damit sich die Welle nicht selbst durch
Interferenz auslöscht, muss€sie in sich geschlossen sein, d.h. es muss
gelten:
nλ = 2πr
stehende Welle auf Kreisbahn
wo n eine ganze Zahl 1, 2, 3, … ist.
Einsetzen der de Broglie Beziehung für die Wellenlänge λ gibt :
nh
= 2πr
mev
wo me die Masse des Elektrons und r der Radius der Kreisbahn ist.
Umformen ergibt:
nh €
mevr =
= nh und mit L = mevr erhalten wir die Bohrsche Bedingung
2π
€
€
L= n⋅h
€
Elektronenstruktur von Molekülen
Die klassische Mechanik zur Beschreibung der Elektronenstruktur von Atomen oder Molekülen
versagt. Eine erste Verbesserung war das Bohrsche Modell für Atome, das zusätzlich die Quantenbedingung für den Drehimpuls einführte. Verallgemeinert gilt:
Zur Beschreibung von Molekülen müssen
- die Kerne fixiert werden (Born-Oppenheimer-Approximation)
- die Elektronen quantenmechanisch (wellenmechanisch) behandelt werden
Einführung in die Physikalische Chemie
K3-10 Struktur der Moleküle
Die stationäre Schrödingergleichung
Kurzrepetition zur Wellenlehre (s. Physik-Vorlesung Kap. 9.4):
Wellengleichung
∂2 y/∂t2 = v2 (∂2 y/∂x2 )
y = Funktion von Raum und Zeit
Eingespannte Saite
y(x,t) = A.sin(kx).sin(ωt)
Stehende Welle
räumliche zeitliche ω = Kreisfrequenz = 2πν
Abhängigkeit
k = Wellenzahl = 2π/λ
Ψ(x)
Φ(t)
A = Amplitude
Ortsfkt. Zeitfkt.
y
Saite bewegt sich nicht ⇒ “Knoten” : y
0
A
x
Anzahl Wellen ⇒ Wellenzahl
Wellengleichung
Geschwindigkeit der
Vibration ⇒ Kreisfrequenz
Ansatz
(∂2 y/∂x2 ) = v- 2 ∂2 y/∂t2
y(x,t) = Ψ(x).sin(ωt)
Wir interessieren uns für die Ortsfunktion Ψ(x)
Links einsetzen
∂y/∂x = dΨ(x)/dx.sin(ωt) ⇒ ∂2 y/∂x2 = d2 Ψ(x)/dx2 .sin(ωt)
Rechts einsetzen
v- 2 ∂y/∂t = v- 2 Ψ(x)cos(ωt)ω ⇒ v- 2 ∂2 y/∂t2 = -(ω2 /v2 )Ψ(x) sin(ωt)
Stehende Welle
Linke und rechte Seite gleich setzen und sin(ωt) wegkürzen:
d2 Ψ(x)/dx2 = -(ω2 /v2 ).Ψ(x) = -4π2 /λ2 .Ψ(x)
mit λ.ν = v ω = 2πν ⇒ ω/v = 2πν/(λν) = 2π/λ
oder
d2 Ψ(x)/dx2 + 4π2 /λ2 .Ψ(x) = 0
I
Energie eines Teilchens, das sich im 1-dimensionalen Raum auf x bewegt:
E = Ekin + Epot = mv2 /2 + V(x) = p2 /(2m) + V(x)
de Broglie einsetzen (p = h/λ)
λ 2 in I einsetzen
E = h2 /(2mλ2 ) + V(x) ⇒ λ2 = h2 /(2m(E-V(x)))
d2 Ψ(x)/dx2 + (4π2 .2m(E-V(x))/h2 ).Ψ(x) = 0
-h2 /(8π2 m).d2 Ψ(x)/dx2 + V(x).Ψ(x) = E.Ψ(x)
⇒⇒
HΨ = EΨ
mit
H = -h2/(8π2m)d2/dx2 + V(x)
Stationäre Schrödingergleichung
Hamilton-Operator
Die Schrödingergleichung wird normalerweise als Axiom der Quantenmechanik behandelt. Hier wurde
versucht einsichtig zu machen, wie man in einem einfachen Fall aus der de Broglie Beziehung und der
Wellengleichung die Schrödingergleichung erhält.
Einführung in die Physikalische Chemie
K3-11 Struktur der Moleküle
Eine Formulierung der Postulate der Quantenmechanik
(für stationäre Probleme mit reellen Funktionen)
I
Jeder stationäre Zustand eines Systems kann durch eine Zustandsfunktion Ψ(r) beschrieben
werden, mit der Eigenschaft, dass Ψ 2 (r)dr gerade die Wahrscheinlichkeit ist, das Teilchen
(System) im Bereich (Zustand) dr zu finden (Teilchendichte am Ort r; vgl. Amplitude bei
Wellen!). Daraus ergibt sich die Normierungsbedingung, dass über den ganzen Raum das
Integral ∫Ψ2 (r)dr = 1 sein muss.
II
Der Energie kann ein Operator H (Hamiltonoperator) zugeordnet werden, indem die klassische
Energie durch die Variablen x und p (Ort und Impuls) ausgedrückt und der Impuls p ([px , py , pz])
durch den Operator p ( h/i[∂/∂x,∂/∂y,∂/∂z]) ersetzt wird.
III Die Zustandsfunktion eines stationären Zustands erfüllt folgende Bedingung (Schrödingergleichung): €
HΨ = EΨ
d.h. ist eine Eigenfunktion des Hamiltonoperators mit dem Eigenwert E. Die Energie eines
stationären Systems hat also den exakten Wert E.
IV Die vollständige Zustandsfunktion (inkl. Spin) ist antisymmetrisch gegenüber jeder Vertauschung
von 2 Elektronen (Pauli-Prinzip).
Aus III ergibt sich durch Multiplikation mit Ψ von links und Integration über den ganzen Raum das
Rezept zur Berechnung der Observablen E (Erwartungswert der Energie) aus dem Operator und der
Zustandsfunktion:
∫ΨΗΨ dτ = ∫ ΨΕΨ dτ = E ∫ Ψ2 dτ = Ε
Atomare Einheiten:
|e| = 1
Umrechnungen:
Länge
me = 1
h/2π = 1
4πεo = 1
1 ao = 1 bohr = 52.91771 pm
Energie 1 Eh = 1 hartree = 2625.565 kJ/mol = 627.5252 kcal/mol =
= 27.21165 eV = 219'481.8 cm-1 = 315'790.4 K
Zeit
1 τo = 2.41888 10-17 s
Einführung in die Physikalische Chemie
K3-12 Struktur der Moleküle
Das Teilchen (Elektron) im eindimensionalen Kasten
Modell: Ein Teilchen bewege sich frei in einem eindimensionalen Kasten (Rohr der Länge L mit einem
Durchmesser gleich demjenigen des Teilchens). Der Kasten habe starre Wände.
V→∞
V→∞
Wenn x die Richtung der Bewegung ist, kann dieses Verhalten mit V(x)
nebenstehendem Topfpotential beschrieben werden.
Um das Teilchen durch die Gleichung einer stehenden Welle zu
beschreiben, wählen wir als Ansatz:
(
ψ ( x ) = A ⋅ sin( kx) = A ⋅ sin 2π λ ⋅ x
V=0
0
L
)
Die Randbedingung für eine stehende Welle, die bei 0 und L “eingespannt” ist, ist L = n ⋅ λ 2
2πn
πn
Einsetzen ergibt für die Wellenfunktion: ψ ( x ) = A ⋅ sin
x = A ⋅ sin x
2L
L
€
Die klassische Energie ergibt mit der de Broglie Beziehung und der Randbedingung:
€
E = E kin + E pot
mv 2 p 2
h2
h 2n 2
h2 2
= E kin + 0 =
=
=
=
=
n
2€ 2m 2mλ2 2m(2L) 2 8mL2
de Broglie p = h λ
€
λ = 2L n Randbedingung
Statistische (Kopenhagener) Interpretation der Wellenfunktion:
2
ψ ( x ) dx = Wahrscheinlichkeit,
dass sich das Elektron zwischen x und x+dx befindet
€
€
Damit diese Interpretation sinnvoll ist, müssen wir die unbestimmte Amplitude A sinnvoll wählen.
Wahrscheinlichkeit, dass das Elektron irgendwo ist:
€
∞
∫ ψ( x)
2
dx ≡ 1
Normierung der Wellenfunktion
−∞
L
πn
L
A 2 ∫ sin2 x dx = A 2 ≡ 1 ⇒
L
2
0
€
und damit ψ n ( x ) =
A=±
nπx
2
⋅ sin
n = 1, 2, 3, …
L
L
€
Wenn ψ eine Elektronen-Wellenfunktion ist,
€
nennt man sie auch Orbital!
€
2
L
x
Einführung in die Physikalische Chemie
K3-13 Struktur der Moleküle
Die Heisenbergsche Unschärferelation
Heuristische Herleitung
Klassisch ist ein mechanisches System durch Angabe des Ortes x und des Impulses p bestimmt. Wenn
diese genau angegeben werden können, kann man alle andern Grössen genau bestimmen.
Quantenmechanisch sind die Verhältnisse anders. Wenn ich beispielsweise für ein Teilchen im
eindimensionalen Kasten die Energie genau kenne, kann ich den Ort nur mit einer Wahrscheinlichkeit
innerhalb des Kastens angeben. Unter etwas vereinfachten Annahmen kann ich für ein Teilchen im
Kasten der Länge L auf dem untersten Energieniveau sagen, dass
0<x<L, d.h. Δx = L
sein muss (je kleiner der Kasten, desto genauer weiss ich, wo das Teilchen ist!). Ich weiss aber nicht, ob
das Teilchen nach links oder rechts fliegt, d.h.
-|p|<p<|p| oder Δp = 2p.
Damit erhalte ich nun eine Unschärfebeziehung:
Δx.Δp = 2pL
Die Randbedingung λ = 2L/n und die de Broglie Beziehung (p=h/λ) geben p = nh/(2L) (je kleiner der
Kasten, desto weniger genau kenne ich den Impuls!). Damit wird die Unschärfe:
Δx.Δp = nh bzw. Δx.Δp ≥ h
d.h. die Unschärfe muss immer mindestens gleich dem Planckschen Wirkungsquantum sein. Genauer
gilt:
Δx.Δp ≥ h/(4π)
Eine andere Formulierung, die die Energie und die Zeit als Variable benutzt, lautet:
ΔE.Δt ≥ h/(4π)
Nullpunktsenergie:
Sobald ein Teilchen “eingeengt” wird, d.h. Δx nicht ∞ ist, gilt , dass der Impuls und damit die
Geschwindigkeit nicht Null sein kann. D.h. das Teilchen muss sich selbst bei einer Temperatur von 0
K bewegen. Das Teilchen im Kasten hat beispielsweise eine Nullpunktsenergie von h2/8mL2.
Einführung in die Physikalische Chemie
K3-14 Struktur der Moleküle
Extrem vereinfachtes Modell für die chemische Bindung
Lz
2
h 2 n 2x n y n 2z
E=
+
+
8m L2x L2y L2z
+
→
Lx
Lx
Ly
Lx
€
+
+
H - Atom
H - Atom
Lx = 1
Ly = Lz = 1
+
H2 - Molekül
Lx = 1
Lx = 2
E
2
h 8m
3
€
+
1,1,1
1,1,1
2,1,1
€
1,1,1
21/4
h2
= „Bindungsenergie”
8m
1,(1,1)
2,(1,1)
Absenkung der Energie = 2 Elektronen .
1,(1,1)
WF in x-Richtung
ψ1
3
4
ψ1 - ψ2
ψ2
€
1,(1,1)
ψ1 + ψ2
Energieerniedrigung durch Bindung:
→ Überlappung des Bereichs, wo sich die Elektronen aufhalten
→ Delokalisation der Elektronen (Spezialfall: Konjugation von π-Systemen)
σ∗
Übliche Darstellung:
antibindendes Molekülorbital (MO)
s
s
σ
Atom
Molekül
bindendes Molekülorbital (MO)
Atom
Vernachlässigt z.B. Kern-Kern- und Elektron-Elektron-Abstossung.
Kern-Elektron-Anziehung nur als Box behandelt.
Atomorbital (AO)
Einführung in die Physikalische Chemie
K3-15 Struktur der Moleküle
Lernziele Kapitel 3
- Was sind die VSEPR-Regeln? Wie lauten sie? Ist MgH2 gewinkelt oder linear?
- Wie lang ist eine C-C, eine C-H bzw. eine C=C Bindung etwa?
- Wie lautet der einfachste energetische Ansatz, um ein zweiatomiges Molekül mechanisch zu
beschreiben? Wie gross ist dann die Kraft zwischen den Atomen als Funktion des Abstands?
- Nennen Sie zwei mögliche Verbesserungen dieses Ansatzes!
- Was ist die Bedeutung der Parameter De, Re und k in der Morse-Potentialkurve?
- Wieviele interne Freiheitsgrade haben SO2, CO2, bzw. Methanol?
- Wieviele unabhängige Schwingungen hat Ethen und wieviele davon aus der Ebene heraus?
- Welche Möglichkeiten kennen Sie, mehrdimensionale Potentialflächen wenigstens teilweise
graphisch darzustellen?
- Welcher Punkt der Potentialfläche entspricht der Gleichgewichtslage des stabilen Moleküls?
- Nennen Sie einen vernünftigen Ansatz für ein Rotationspotential!
- Was ist die Born Oppenheimer Approximation?
- Was ist eine Kraftfeldrechnung? Wie heisst sie auch noch? Was sind die englischen Namen?
- Aus welchen zwei Komponenten setzt sich ein Molekülmechanik-Programm zusammen?
- Wie können Sie den harmonischen Ansatz in einem Kraftfeld verbessern?
- Welche Erweiterungen brauchen Sie im Kraftfeld für mehratomige Moleküle?
- Welche Grössen können Sie mit einer Kraftfeldrechnung berechnen?
- Können Sie damit auch Partialladungen näherungsweise berechnen?
- Welche zwei Theorien (von wem) wurden mit der Quantenmechanik vereint?
- Welche zwei Formeln (von Planck bzw. Einstein) wurden von de Broglie vereint und erweitert
interpretiert? Was ist die erweiterte Interpretation davon?
- Wie hängt der Impuls eines Photons mit seiner Wellenlänge zusammen?
- Wo wird die Tatsache, dass Elektronen Wellencharakter haben, praktisch angewandt?
- Leiten Sie für das Teilchen im eindimensionalen Kasten die Energieniveaux her unter der Annahme,
dass die Wellenfunktionen stehende Sinuswellen sind!
- Was ist die Normierung der Wellenfunktion? Führen Sie diese für das Teilchen im Kasten aus!
- Was ist die statistische (Kopenhagener) Interpretation der Wellenfunktion?
- Was ist ein Orbital beim Teilchen im Kasten?
- Wie ändern sich die Abstände zwischen den Energieniveaux beim Teilchen im Kasten mit der Masse
des Teilchens bzw. der Länge des Kastens?
- Was ist ein Knoten? Was besagt die Knotenregel?
- Was besagt die Heisenbergsche Unschärferelation? Was ist die Nullpunktsenergie?
- Nennen Sie die Postulate der Quantenmechanik (wie wir sie formuliert haben)!
- Bilden Sie den Hamiltonoperator für ein Teilchen in einem Potential V(x,y,z)!
- Erklären Sie mit dem Modell für die chemische Bindung wie diese zustande kommt!