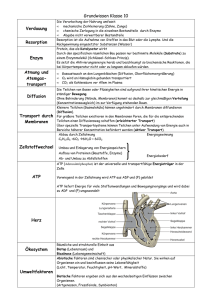
Die kinetische Energie der Moleküle
Werbung
Physik – Klasse 9 Avogadro Seite:1 I. - Teil Das Avogadrosche Gesetz Eine neue Wortliste: einen Vortrag hören einen Zusammenhang erkennen eine Theorie aufstellen die Voraussetzung erfüllen das Gesetz lautet eine Beobachtung tätigen einen Zusammenhang formulieren die Molekulartheorie ein Gesetz entdecken ein Gesetz nach seinem Entdecker nennen/ benennen/ bezeichnen die Stoffe verbinden sich die Anzahl der Moleküle experimentell ermitteln Verbindung von Chlormolekülen und die Chlorwasserstoffsäure- HCl Wasserstoffmolekülen zu Chlorwasserstoff: (gelesen ebenso), H2CL2 (gelesen H-zwei Cl-zwei), die Elektrolyse die Teilchen sind in ständiger Bewegung und lassen sich so nicht auszählen die Größe muss bestimmt werden die Anzahl lässt sich feststellen in einem (Mol) Gas befinden sich ..... Teilchen in 5 m**3 Sauerstoff befinden sich ...Teilchen Vergleich und Kontrolle der Aufgaben, bzw. lösen der Aufgaben: ÜA: S. 34 Nr. 1, 2 (falls nicht geschafft, vorherige Vorbereitung) HA: S. 34 Nr. 3, 4, 5 (3 + 4 schon in vorheriger Vorbereitung gelöst) Wer war Avogadro? Avogadro, wie wir es in einem Schülervortrag hören werden, war ein italienischer Chemiker. Er formuliert das nach ihm benannte Avogadrosche Gesetz. Es lautet: In Gasen mit gleichem Volumen, bei gleichem Druck und gleicher Temperatur, ist die Anzahl der Moleküle einander gleich. Für 1 kmol Gas ist die Anzahl Für 1 mol Gas beträgt dieser Wert 6,022 1026 Moleküle. 6,022 1023 Moleküle. Diese Zahl NA ist eine Naturkonstante und wird auch nach ihrem Entdecker als Avogadrosche Zahl bzw. als Avogradrosche Konstante bezeichnet. Ein anderer Naturforscher war der Österreicher Loschmidt. Die nach ihm benannte Größe wir als Loschmidt-Konstante NL bezeichnet und ist der Quotient aus der Anzahl der Moleküle und dem Volumen des idealen Gases. Sie gibt die Anzahl der Teilchen in einem Kubikmeter (1 m3) an. Wir sind in der Lage diese Größe zu berechnen und zwar auf der Basis von 1kmol Gas. Das Gas untersuchen wir unter Normalbedingungen (d.h. Temperatur 0C, Druck 1 105 Pa). 75927090.doc angefertigt Norbert Burmeister:1995 März 02, konvertiert: 2003.11.05 Physik – Klasse 9 NL Avogadro Seite:2 N A 6,022 10 26 1 2,68 10 25 3 3 VN 22,4m m Wir wollen den Stoff festigen und wiederholen deshalb: Frage: Welche Kenntnisse besitzen wir über die Anzahl der Moleküle? Welche Energie besitzt ein kmol ideales Gas und wie lautet die Formel zu ihrer Berechnung? Wodurch unterscheiden sich die Avogadrosche Konstante und die Lochschmidt Konstante? II. - Teil Die kinetische Energie der Moleküle Bestimmen wir die Energie eines Moleküls im idealen Gas: Wir stellen folgende Betrachtung an: Uns ist sowohl die kinetische Energie als auch die Anzahl der Teilchen für 1 kmol Gas bekannt. Aus diesem Zusammenhang erkennen wir, dass wir die schon berechnete Energie für 1kmol Gas nur noch durch die Anzahl der vorkommenden Teilchen zu dividieren brauchen, um die kinetische Energie eines einzelnen Moleküls zu bestimmen. E kin 3 p V 3360000 J 5,6 10 21 J 26 2 N A 6 10 Einige wichtige Bemerkungen: Die kinetische Energie ist für die Moleküle aller Gase gleich. Die Moleküle verschiedener Gase besitzen unterschiedliche Massen. Daraus ergibt sich, dass die Teilchen mit kleinerer Masse schneller sind, als die mit größerer. Wir schlussfolgern, dass Moleküle mit kleiner Masse schneller diffundieren, d.h. Gase breiten sich mit verschiedenen Geschwindigkeiten aus und die leichteren Gase sind schneller. Betrachtungen zu Masse und Anzahl: Berechne die Masse bzw. die Anzahl der Teilchen, wo es sich nicht um die Normgrößen handelt. Weiterhin wenden wir auf diesen Zustand das Boyle-Mariottesche Gesetz an. HA: S.38 Nr. 3; S.39 Nr. 3, 4 Vorbereitender Schülervortrag: Kelvin, Celsius ÜA: S.38 Nr. 1, 2; S.39 Nr. 1, 2 Allgemeine Auflösung: 75927090.doc angefertigt Norbert Burmeister:1995 März 02, konvertiert: 2003.11.05 Physik – Klasse 9 Avogadro Seite:3 Die Anzahl der Moleküle einer bestimmten Molmenge ist konstant: 1kmol = 61026 Avogadrosche Zahl, 3 p V Die Energiemenge und die Formel zu ihrer Berechnung lautet: 3360000 J 2 S.38 Nr. 1 Geg.: H2 Wasserstoffmolekül, M = 2Kg je kmol NA = 6 1026 Moleküle je kmol ges.: m je Molekül Lösung: 2kg M 3,667 10 27 kg 3,667 10 24 g 26 N A 6 10 Ein Wasserstoffmolekül hat die Masse von 3,667 10-27 kg m S.38 Nr. 2 Geg.: VLu = 1 dm3 Luft ges.: NLu 3 1 mol 29 g V = 22,4 dm NA = 6 1023 Lösung: Wir stellen ein Verhältnis auf: N A : V N N Lu : V Lu umgestellt nach N Lu N A V Lu 6 10 23 1dm 3 N Lu 2,68 10 22 3 VN 22,4dm 3 In 1 dm Luft sind 2,68 1022 Teilchen Gas enthalten. Dies entspricht der Lochschmidt Konstante für 1 dm3. S. 38 Nr. 3 Geg.: VEl = 80 cm3 = 0,08 dm3 ges.: NEl 1 mol 29 g V = 22,4 dm3 NA = 6 1023 Lösung: N A : V N N El : V El N El damit ist N A V El 6 10 23 0,08dm 3 2,14 10 22 3 VN 22,4dm N ER N El 9 2,14 1013 10 In der Elektronenröhre sind 2,14 1013 Teilchen enthalten. S. 39 Nr. 1 Geg.: v = 629 m/s E = 3 360 000 J / 6 1026 = 5,6 10-21 J ges.: m Lösung: 75927090.doc angefertigt Norbert Burmeister:1995 März 02, konvertiert: 2003.11.05 Physik – Klasse 9 Avogadro Seite:4 m v2 2 2 E 11,2 10 21 J m 2 2,83 10 26 kg m v (629 ) 2 s Die Masse dieses Gasteilchens beträgt 2,83 10-26 E S.39 Nr. 2 Geg.: V2 = 6 dm3 ges.: N 1 mol 29 g VN = 22,4 dm3 NA = 6 1023 p2 = 25 N/cm˛ = 2,5 105 Pa p1 = 1 105 Pa Lösung: a) Boyle- Mariotte p1 V1 p 2 V2 dann ist V1 p 2 V2 2,5 10 5 Pa 6dm 3 15dm 3 5 p1 1 10 Pa b) Teilchenzahl N A : V N n1 : V1 6 10 23 22,4dm 3 n1 : 15dm 3 6 10 23 15dm 3 n1 4,017 10 23 3 22,4dm Im Gefäß befinden sich 4,017 1023 Teilchen. S.39 Nr. 3 Geg.: v = 499 m/s p = 8 N/cm˛ = 0,8 105 Pa Lösung: 3p v ges.:ρ 3 p 3 0,8 10 5 Pa kg g 9,63 3 9,63 3 2 2 v m dm m 499 s Die Dichte des Gefäßes beträgt bei diesem Druck 9,63 kg/m3 S. 39 Nr. 4 Geg.: V1 = 1 cm3 VN = 22,4 cm3 NA = 6 1020 75927090.doc ges.: N1 und N1/6 N19 angefertigt Norbert Burmeister:1995 März 02, konvertiert: 2003.11.05 Physik – Klasse 9 Avogadro Seite:5 Lösung: V1 V N = , wird nach N 1 umgestellt. N1 N A 28 3 N A V 1 6 10 1 cm = = = 2,68 1019 Teilchen sind im gesamten Gefäß. N1 3 22,4 cm VN Für eine Seite des Würfels gilt damit 19 N1 10 = 2,68 = 4,46 1018 6 6 4,46 1018 Teilchen üben auf eine Seite des Würfels einen Druck aus. Nach Boyle-Mariotte können wir jetzt feststellen, dass p1 V1 = p2 V2, da sich hier aber nicht das Volumen, sondern die Masse verändert, ===> p1 = 1/ 1019 p2 Das bedeutet andersherum: p1 V 2 = p2 V 1 da mit dem konstanten Volumen sich nur der Druck ändert, wenn wir die Masse ändern, bedeutet dies für uns, dass sich damit die Dichte ändert. m2 2 m1 1 p1 1 = p2 2 = 75927090.doc Mit anderen Worten: Das Verhältnis der Drücke zueinander verhält sich wie das Verhältnis ihre Dichten. Wir beachten, dass eine direkte Proportionalität herrscht. Die Drücke verhalten sich proportional zu ihren Dichten. angefertigt Norbert Burmeister:1995 März 02, konvertiert: 2003.11.05