17. Gesättigte Kohlenwasserstoffe Zu den gesättigten
Werbung

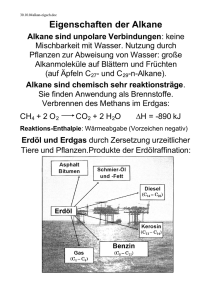
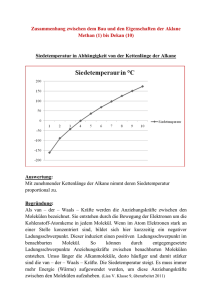
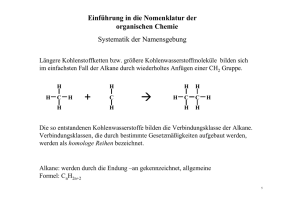
17. Gesättigte Kohlenwasserstoffe Zu den gesättigten Kohlenwasserstoffen, auch als Alkane bezeichnet, zählen alle Moleküle, die durch Einfachbindungen aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind und keine ungesättigten Stellen, d.h. keine Doppel- oder Dreifachbindungen, enthalten. 17.1 Reihe der gesättigten Kohlenwasserstoffe Die Reihe beginnt mit dem einfachsten Molekül der organischen Chemie, dem aus einem Kohlenstoff- und vier Wasserstoffatomen bestehenden Methan CH 4 . Das nächstgrössere Molekül enthält zwei Kohlenstoffatome: Ethan C 2 H 6 . Durch Einfügen weiterer CH 2 -Gruppen lassen sich die Formeln der anderen gesättigten Kohlenwasserstoffe ableiten. Ihre Summenformel entspricht der allgemeinen Formel C n H 2n+2 . Die Verlängerung der Kette beeinflusst die chemischen Eigenschaften kaum, die Schmelz- und Siedetemperaturen steigen aber wegen der zunehmenden Molekülgrösse an. Anzahl C Summenf ormel Stammsilbe Name Verwendung Eigenschaften 1 CH 4 Methan Erdgas gasförmig 2 C2H6 Ethan Rohstoff 3 C3H8 Propan Camping-Gas 4 C 4 H 10 Butan Camping-Gas 5 C 5 H 12 Pentan Lösungsmittel 6 C 6 H 14 Hexan Benzinbestandteil 7 C 7 H 16 Heptan 8 C 8 H 18 Oktan 9 C 9 H 20 Nonan 10 C 10 H 22 Dekan 11 C 11 H 24 Undekan 12 C 12 H 26 Dodekan flüssig Bestandteil v. Mineralölen | >16 mineralische Fette fest Die Namen der Alkane, die mit den Stammsilben gebildet werden, tauchen auch in den Namen von daraus abgeleiteten, komplizierteren Verbindungen wieder auf. Sie sind daher wichtig. 17.2 Formelschreibweise Um aber ein besseres Verständnis vom Aufbau organischer Stoffe zu haben, sind die Struktur- und oder auch Gruppenformeln, wie sie in der Folge benutzt werden, wichtiger. Um ein Molekül darzustellen, sind verschiedene Formelschreibweisen üblich. CH 2 a) CH 3 –CH 2 –CH 2 –CH 3 b) c) H3C CH 3 CH 2 d) ● Die Summenformel C 4 H 10 sagt nichts darüber aus, wie die Atome verbunden sind. ● Die Strukturformeln a) und b) zeigen dies. Allerdings wird der Bindungswinkel von 109.5° nicht richtig dargestellt, wie es bei den Schreibweisen c) und d) der Fall ist. ● Vereinfachend werden oft bei c) die an den Kohlenstoff gebundenen Wasserstoffatome weggelassen. ● Die Kurzschreibweise d) ist besonders bei grösseren Molekülen praktisch. Die Striche stellen das Kohlenstoff-Grundgerüst dar. An jedem End- und Eckpunkt befindet sich ein Kohlenstoffatom, die Wasserstoffatome werden nicht eingezeichnet. 17.3 Modelle Um die Gestalt der Moleküle anschaulich zeigen zu können, werden Modelle verwendet, wobei die Stäbchenmodelle deutlicher die Winkel zwischen den Atomen zeigen, die Kalottenmodelle (mit den Elektronenhüllen) stellen die Raumerfüllung und das tatsächliche Aussehen eines Moleküls besser dar. Stäbchenmodell des Methanmoleküls Kalottenmodell des Methanmoleküls 17.3 Reaktionsfähigkeit Da die gesättigten Kohlenwasserstoffe keine funktionellen Gruppen besitzen, sind sie, verglichen mit anderen organischen Verbindungen, bei niedrigen Temperaturen sehr reaktionsträge. Bei höheren Temperaturen reagieren ihre Dämpfe jedoch leicht mit Sauerstoff, es entsteht CO 2 und H 2 O. Die dabei frei werdende Reaktionswärme ist sehr hoch. Das erklärt den hohen Heizwert von Erdgas und von Erdölprodukten. Mit wachsender Zahl der Kohlenstoffatome wird die Verbrennung in Luft vollständiger – die Flamme russt und leuchtet. 17.4 Strukturisomerie Geht man von der Summenformel eines Alkans, z.B. C 4 H 10 aus, so zeigt sich, dass sie das Molekül nicht eindeutig beschreibt. Neben der normalen, geradkettigen Form ist auch eine zweite Struktur mit einer verzweigten Kohlenstoffkette möglich. Solche Moleküle, die sich bei gleicher Summenformel durch die Verknüpfung der Atome unterscheiden, nennt man Isomere. Beide Formen existieren, sie unterscheiden sich geringfügig in ihren Schmelz- und Siedetemperaturen. Formen, die sich durch Drehungen um C-C-Einfachbindungen ineinander überführen lassen, sind keine Isomere, sondern Konformere. Nur wenn die Kohlenstoffketten anders verzweigt sind, handelt es sich um Isomere. unverzweigt C–C–C–C–C C verzweigt C–C–C–C C Dagegen ist oder C–C–C C C–C–C–C C keine verzweigte Kette! 17.5 Benennung organischer Verbindungen Ganz früher waren die wenigen organischen Substanzen noch überschaubar und man bezeichnete sie mit Trivialnamen die auf die Herkunft des Stoffes (z.B. Traubenzucker, Citronensäure, Vanillin, …) oder auf seine Eigenschaften hinwiesen. Mit der rasch zunehmenden Zahl organischer Verbindungen wurden die Grenzen dieses Systems bald erreicht. Daher legte ein 1892 in Genf abgehaltener Kongress die Grundlagen zu einem eindeutigen System der Namensgebung. Diese Regeln werden heute von der IUPAC (International Union of Pure and Applied Chemistry) dem Fortschritt der Chemie entsprechend ergänzt. 17.5.1 Benennung der unverzweigten Alkane Die Namen der ersten vier unverzweigten Alkane sind historisch bedingt. Deshalb müssen sie auswendig gelernt werden. Die Namen der längerkettigen Vertreter basieren auf den Zahlwörtern un, do, tri, tetra, penta, hexa, hepta, octa, nona, deca. Man kann sie also leicht im Gedächtnis behalten. Man beachte, dass sich ein unverzweigtes Alkan durch die allgemeine Formel C H n 2n+2 darstellen lässt. Tabelle In der folgenden Tabelle sind die Namen, die Summenformeln und die Skelettformeln für die ersten sechszehn unverzweigten Alkane angegeben. 17.5.2 IUPAC-Regeln für das Benennen von verzweigten, gesättigten KW Die Namen der unverzweigten Kohlenwasserstoffe sind nun bekannt. Wir werden uns nun damit beschäftigen, wie die verzweigten Kohlenwasserstoffe benannt werden. Als Beispiel nehmen wir folgendes Molekül ● Die längste Kohlenstoffkette im Molekül ergibt den Stammnamen. ● Die Kohlenstoffatome dieser Kette werden fortlaufend nummeriert. Der Beginn der Nummerierung ist so zu wählen, dass man möglichst schnell zu einer Abzweigung gelangt. ● Die Lage einer Seitenkette wird durch die Nummer des C-Atoms angegeben, von dem sie abzweigt. ● Die Länge einer Seitenkette wird durch den Namen des entsprechenden Kohlenwasserstoffs angegeben, wobei dessen Namensendung –an auf –yl abgeändert wird. Eine solche Seitenkette wird daher auch als Alkylgruppe bezeichnet. Seitenkette mit 1 C-Atom: Methyl Seitenkette mit 2 C-Atomen: Ethyl Seitenkette mit 3 C-Atomen: Propyl usw. ● Enthält das Molekül mehrere gleiche Seitenketten, so wird dies durch die Silben Di-, Tri-, Tetra-, Penta- usw. ausgedrückt. ● Die Angabe der Seitenketten erfolgt in alphabetischer Reihenfolge. Es wird jeweils der erste Buchstabe gross geschrieben. Das Molekül heisst also: 2-Methylpentan Nochmals an einem anderen Molekül erklärt Beispiele: Bei folgenden Verbindungen handelt es sich um 3-Ethyl-2,4-Dimethylhexane 3-Ethyl-2,4-Dimethylpentan 17.5.3 Benennung von in sich geschlossenen Hauptketten Ist die Hauptkette in sich geschlossen, so wird ihrem Namen die Silbe cyclo vorangestellt. Beispiel: Cyclohexan 1,3-Dimethylcyclohexan 17.6 Eigenschaften einiger Vertreter der Alkane: • Methan ist Hauptbestandteil des Erdgases und Biogases. Es entsteht aus Zersetzungsprozessen. • Propan und Butan werden als Buta-Gas (Camping-Gas) verkauft. • Alkane mit 5 bis 9 C-Atomen sind Hauptbestandteile des Benzins. • Alkane mit 12 bis 18 C-Atomen bilden Öle (Heizöl, Diesel). • Alkane mit mehr als 20 C-Atomen bilden als Gemisch Vaseline und Paraffin. 17.7 Aufgaben 17.7.1 Skizzieren Sie alle Isomere von a) C 5 H 12 b) C 6 H 14 c) C 7 H 16 17.7.2 Benennen Sie die folgende Verbindung 17.7.3 Die Strukturformeln der folgenden Verbindungen sollen angegeben werden a) 2,2-Dimethylbutan b) 3-Ethyl-2-methylhexan 17.7.4 Welche Namen haben die Isomere von Übung 17.7.1) 17.7.5 Benennen Sie die folgenden Moleküle 17.7.6 Zeichnen Sie die Strukturen der folgenden Moleküle auf: a) 2,2,4-Trimethylpentan b) 3-Ethyl-2-methyl-4-propyloctan c) 2,2-Dimethylpropan 17.7.7 Benennen Sie die folgenden Moleküle 17.7.8 Zeichnen Sie die Strukturen der folgenden Moleküle auf: a) Methylcyclohexan b) 1-Ethyl-2-methylcyclopropan 17.7.9 Anbei sehen Sie sämtliche Kohlenwasserstoff-Atome, die zur Summenformel C 6 H 14 gezeichnet werden können. Wie lauten ihre Namen? 17.7.10 Die folgenden Moleküle sind falsch benannt. Warum? Ethylbutan 3-Ethyl-6-methylheptan 2-Methyl-4-ethyl-5-methyloctan 17.7.11 Gemäss der Theorie der kovalenten Bindungen herrscht um jede C-CEinfachbindung freie Drehbarkeit. Kohlenwasserstoff-Moleküle sind von daher sehr beweglich. Logischerweise kann man ein bestimmtes Kohlenwasserstoff-Molekül auf sehr viele Arten aufzeichnen. Die folgenden Skelettformeln stellen bis auf eine Ausnahme alle dasselbe Molekül dar. Welches Molekül ist hier fehl am Platz?