Tillzettel-3-Seminar-Verdauuung-Resorption-BlutI
Werbung

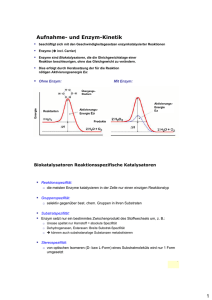
3. Biochemie Seminar HCl-Bereitstellung im Magen und Eiweißverdauung: Funktion des Magen-HCl - HCl übernimmt zwei wichtige Funktionen: o Denaturierung von Proteinen, hierdurch sind diese besser zugänglich für die Verdauungsenzyme. o Abtötung von Mikroorganismen, die mit der Nahrung in großen Mengen aufgenommen werden. Bestandteile des Magensaftes mit Eigenschaften sowie die verschiedenen Zelltypen - Es werden pro Tag ca. 3l Magensaft sezerniert, dieser hat einen pH-Wert von ca. 1,5. - Es gibt mehrere Zelltypen: o Nebenzellen / Zellen der pylorischen Region Mucine o Belegzellen (Parietalzellen) HCl / Intrinsic Faktor o Hauptzellen Pepsinogen - Mucine o Sie dienen dem Schutz vor Selbstverdauung und bilden hierzu eine ca. 200-500 µm dicke Schicht auf dem Magenepithel. o Es handelt sich um Glycoproteine, deren Molekulargewicht mehrer hundertausend Dalton beträgt. o Sie verfügen über einen außergewöhnlich hohen Gehalt an O-glykosidisch verknüpften Saccharidseitenketten. o Es gibt sowohl membranverankerte (Mucin 1) als auch frei lösliche (Mucin 6) Mucine. o Zwischen den Mucinen bestehen Quervernetzungen über Cysteinylreste, welche für die hohe Viskosität verantwortlich sind. o Es konnte gezeigt werden, dass Mucine für den pH-Gradienten von 1-2 im Magenlumen und 6-7 am Epithel verantwortlich sind. - Intrinsic Faktor o bindet Vitamin B12 o weist einen hohen Neuraminsäuregehalt auf, der es vor dem Abbau durch Pankreasenzyme schützt o Im Gegensatz zu anderen Nahrungsbestandteilen erfolgt die Resorption im terminalen Ileum. Es verfügt über einen Rezeptor, welcher die Endozytose ermöglicht. In Lysosomen erfolgt dann die Trennung vom Rezeptor sowie der proteolytische Abbau des intrinsic factors. - Pepsinogen o wird im Magenlumen durch limitierte Proteolyse in Pepsin umgewandelt o Das pH-Optimum liegt bei 1,8. o Es ist eine Endopeptidase, welche Peptidbindungen im Inneren von Peptiden spaltet. Besonders zugänglich sind diejenigen, an denen aromatische Aminosäuren beteiligt sind. Enzyme des Magensaftes - Pepsinogen siehe oben - Pepsin B: spaltet Hämoglobin nur unzureichend - Pepsin C (=Gastricin): spaltet Hämoglobin schnell, pH-Optimum bei 3, Funktion entspricht dem Renin (Labferment) UV 1 von 12 TJW - Labferment: wichtigstes Substrat ist das lösliche Casein der Milch, das durch begrenzte Proteolyse in unlösliches Casein umgewandelt wird Magenlipase: o pH-Optimum bei 4-7, aber auch bei pH 2 sehr säurestabil o Es wird angenommen, dass dieses Enzym bei Säuglingen zur Hydrolyse der Milchlipide herangezogen wird, da es eine hohe Affinität zu Triacylglycerinen mit kurzkettigen Fettsäuren hat, wie sie in der Milch vorkommen. Mechanismus der HCl-Sekretion - Das grundsätzliche Prinzip besteht darin, dass Belegzellen Protonen und ChloridIonen in das Magenlumen pumpen. Im Magenlumen entsteht daraus dann Salzsäure. - Hierzu findet sich auf der luminalen Seite eine 2H+ / 1K+- ATPase. Man muss hierbei beachten, dass der pH in der Zelle bei ca. 7 liegt und der pH im Magen Lumen bei ca. 1. Hieraus ergibt sich ein Gradient von 106. - Ein K+-Kanal sorgt für eine Aufrechterhaltung des Kalium-Gradienten, indem er Kalium wieder in Lumen entlässt. - Die H+-Ionen werden mit Hilfe der Carbonanhydrase gebildet. Dieses Enzym katalysiert folgende Reaktion: o H2O + CO2 H2CO3 o H2CO3 HCO3- + H+ - Das bei dieser Reaktion zusätzlich entstehende Hydrogencarbonat wird an der basolateralen Membran durch einen HCO3- / Cl-- Antiporter getauscht. - Exkurs: o Die 2H+ / 1K+- ATPase ist ein dimeres Protein aus je einer α- und einer βUntereinheit. o Die α-Untereinheit ist intrazellulär und die β-Untereinheit extrazellulär gelegen. o Der Pumpmechanismus zeigt große Ähnlichkeit mit der Natrium/KaliumATPase. (genauere siehe Löffler Seite 1056) o Man kann die 2H+ / 1K+- ATPase über spezifische Protonenpumpeninhibitoren blockieren, z.B. über Omeprazol. Dieses Medikament wird im sauren Milieu zu einem reaktiven Sulfenamid. Dieses reagiert mit Cysteinylresten der 2H+ / 1K+- ATPase und inaktiviert diese irreversibel. Regulation der HCl-Sekretion - Allein für die HCl-Sekretion im Magen wurden 16 hemmende bzw. aktivierende Faktoren beschrieben. - Es ist notwendig, dass gleichzeitig die intrazelluläre Calcium- und cAMPKonzentration ansteigen. Hierdurch kommt es dann zu einem Einbau der 2H+ / 1K+ATPase in die Plasmamembran. Die Einzelheiten der ablaufenden Reaktion sind noch weitgehend unbekannt. Dennoch sind folgende Mechanismen bekannt: o Ein wichtiger stimulierender Faktor ist Histamin aus den ECL-Zellen. Histamin wirkt parakrin an H2-Rezeptoren und stimuliert so die Adenylatcyclase. Diese produziert hohe Spiegel an cAMP. Hierdurch wird die Proteinkinase A aktiviert. o Gastrinzellen (G-Zellen) im Antrum setzen auf folgende Reize hin Gastrin frei: Dehnungsreize Anstieg des pH-Wertes Alkohol, Coffein bei der Proteinverdauung entstehende Peptide UV 2 von 12 TJW o o o o o Es gibt Gastrin mit 34, 17 oder 13 Aminosäuren. Die 4 C-terminalen Aminosäuren sind für die biologische Aktivität verantwortlich. Über das Blut gelangen sie zu den Parietalzellen und binden an einen Gastrinrezeptor. Dieser aktiviert G-Protein-vermittelt die Phospholipase Cβ. Dies führt zu einer Erhöhung der Calcium- und DAG-Konzentration. Über den N. vagus wird über muscarinische ACh-R ebenfalls die Phospholipase Cβ aktiviert und somit der Calcium-Spiegel erhöht. Außerdem kann der N. vagus über muscarinische ACh-R die Aktivität der ECL- und der G-Zellen steigern. Es wird ein gastrin releasing peptide (GRP) vom peptidergen postganglionären Parasympathikus und von Neuronen des enteralen Nervensystems freigesetzt, welches die Gastrinsekretion anregt. Somatostatin ist ein sehr wirkungsvoller Hemmstoff der HCl-Sekretion. Es wird in D-Zellen gebildet. Hohe Protonenkonzentrationen stimulieren die Freisetzung und cholinerge Neurone, Gastrin und GRP hemmen sie. Somtatostatin hemmt die ECL-Zellen und direkt die Parietalzellen. Dies funktioniert, da der Somatostationrezeptor ein inhibitorisches GProtein aktiviert und somit die Adenylatcyclase hemmt. Das führt zu einem Abfall des cAMP-Spiegels. Zusätzlich gibt es eine Hemmung über Sekretin (über Hemmung der Gastrinsekretion) und Prostaglandine. Vorgang der Eiweißverdauung - Die Eiweißverdauung beginnt im Magen mit der Denaturierung durch HCl und Hitze. Hierdurch wird es den Proteasen (Pepsin) leichter gemacht, anzugreifen. - Jedoch ist die Kapazität begrenzt, da die Proteine nur eine kurze Verweildauer im Magen und Duodenum haben. - Die im Magen entstandenen Peptone (Molekulargewicht 600 bis 3000) werden im Duodenum durch Trypsin, Chymotrypsin, Carboxypeptidasen, Aminopeptidasen und Dipeptidasen weiter zerlegt. - Beim Erwachsenen werden die Proteine in den Mukosazellen dann weiter gespalten, sodass nur L-Aminosäuren im Pfortaderblut erscheinen. Beim Neugeborenen ist dieser Prozess noch nicht optimal, sodass auch intakte Proteine in geringen Mengen aufgenommen werden (wahrscheinlich funktioniert dieser Mechanismus über Pinozytose). Transport und Resorption der Aminosäuren - Oligopeptidresorption: o Die Aufnahme der Peptide in die Mukosazelle folgt dem Prinzip des sekundär aktiven Transportes. Dieser ist in diesem Fall protonenabhängig. o Der Peptidtransporter PepT1 ist ein Symport, der Peptide zusammen mit Protonen in die Mukosazelle transportiert. o Zur Aufrechterhaltung des Protonengradienten gibt es ebenfalls an der luminalen Seite einen Protonen / Natrium – Antiporter. Der Protonen aus der Zelle und Natrium in die Zelle pumpt. o Damit die Natriumkonzentration in der Zelle nicht zu groß wird, sitzt an der basolateralen Membran eine Natrium/Kalium – ATPase. - Aminosäureresoption: UV 3 von 12 TJW - o Es gibt unterschiedliche Transportsysteme, da die Aminosäuren über unterschiedliche Strukturen und Ladungen in den Seitenketten verfügen. o Es sind Systeme für neutrale, saure und basische Aminosäuren beschrieben worden. o Man unterscheidet die zwei folgenden Mechanismen: Natrium-abhängige Transportsysteme, diese gleichen dem SGLT1 Natrium-unabhängige Transportsysteme, es sind heterodimere Transportproteine, die speziell für die Aufnahme basischer Aminosäuren verantwortlich sind (hier Widerspruch zur Vorlesung) o Die Abgabe der Aminosäuren über die Mukosazelle ins Blut erfolgt über entsprechende Uniporter. Die Kapazität der Transporter ist normalerweise nicht ausgelastet. renale epithelische Zellen: o Diese Zellen können Aminosäuren aufnehmen, indem sie folgende Schritte befolgen. Dieser Transporter kostet viel Energie, ist dafür aber schnell und hat eine hohe Kapazität. Spaltung des Tripeptids Glutathion und Anheftung der Aminosäure an γ-Glutamyl. Es entsteht γ-Glutamyl-Aminosäure und ein Dipeptid aus Cystein und Glycin. Das Dipeptid wird gespalten in Cystein und Glycin. Die Verbindung γGlutamyl-Aminosäure wird gespalten in γ-Glutamyl und die Aminosäure. Das γ-Glutamyl reagiert mit 5-Oxoprolin zu Glutamat. Glutamat reagiert unter Verbrauch von 2 ATP mit Cystein und Glycin. Somit ist das Glutathion regeneriert. Resorptionsmechanismen im Magen-Darm-Trakt: Verdauung und Resorption der Kohlehydrate - Vor der Resorption müssen Kohlehydrate in Monosaccharideinheiten zerlegt werden. - Die bedeutsamsten Polysaccharide Glycogen und Stärke werden von α-Amylasen (pH Optimum 6,4, bei pH< 4 inaktiv) aus dem Speichel, aber vor allem aus dem Pankreas, gespalten, dabei entstehen Dextrine (Oligosaccharide 4-10), Maltotriose (3x Glucose α-1,4) und Maltose (2x Glucose α-1,4). - Außerdem müssen in manchen Nahrungsmitteln anfallende Saccharose und Lactose gepalten werden. - Die Enzyme sind Amylo-1,6-α-Glucosidase, Isomaltase, verschiedene Maltasen, Lactase und Saccharase. - Lokalisiert sind diese Enzyme membranständig in den Mukosazellen von Duodenum und Jejunum. - Es wird angenommen dass die Spaltungsenzyme in der Nähe der spezifischen Transporter für die Resorption angesiedelt sind. - Allgemein zum Monosaccharidtransport: o verschiedene Hexosen werden mit unterschiedlicher Geschwindigkeit transportiert o der Transport ist stereospezifisch o Konzentration von Glucose ist innerhalb der Mukosazellen größer als im Lumen o Monosaccharidtransport erfolgt nur in Anwesenheit von Na+ - SGLT1: UV 4 von 12 TJW - o sekundär aktiver Transportmechanismus o Symport von Na+ und Monosacchariden o primärer chemischer Gradient wird durch Na+/K+-ATPase geschaffen o hohe Affinität zu Hexosen mit D-Konfiguration am 2. C-Atom GLUT2: o an der basalen Seite der Mukosazellen befinden sich GLUT2-Transporter o erleichterte Diffusion aus der Darmmukosa Fructose wird wahrscheinlich durch Carrier-vermittelte Diffusion aufgenommen und mit Hilfe von GLUT5 aus der Zelle ausgeschleust. Verdauung und Resorption der Proteine - Proteine werden im Darm in Form von Di- oder Tripeptiden aufgenommen und durch intrazelluläre Peptidasen in ihre Aminosäuren zerlegt. - Peptide werden durch PEPT1 (Peptidtransporter) sekundär aktiv im Symport mit Protonen aufgenommen, die primäre Triebkraft geht von der basolateralen Na+/K+ ATPase aus, im Zusammenspiel mit einem Na+/H+ Antiport an der apikalen Seite. - Für die Aufnahme von Aminosäuren gibt es je nach Struktur und Ladung unterschiedliche Transporter, die Na+-abhängig oder unabhängig sein können. - Die Abgabe ins Blut erfolgt über spezifische Uniporter. - siehe erstes Thema Verdauung und Resorption der Fette - Nahrungslipide (Triacyglycerine, Cholesterin, Vitamine E, D, K, A) müssen im Darm in eine resorptionsfähige Form überführt werden. - Nach Aufnahme werden Lipide zum Transport im Serum umgebaut. - Lipasen: o Magenlipase spaltet ca. 15% der Esterbindungen von Triacylglyceriden o Pankreaslipase erzeugt aus Triacylglycerin β-Monoacylglyceride und Fettsäuren Pankreaslipase muss durch Colipase aktiviert werden Procolipase wird aktiviert durch limitierte Proteolyse durch Trypsin o Carboxylesterase: Spaltet β-Monoacylglycerine (können nicht von Pankreaslipasen gespalten werden Spaltet Cholesterinester und Phospholipide hat eine hohe Aktivität in der Muttermilch, die somit gleich die nötigen Enzyme liefert o außerdem enthält der Pankreassaft noch eine Phospholipase A (spalten Fettsäuren vom C2-Atom von Phosphoglyceriden) - durch Lipasen entsteht eine Mischung aus Monoaylglycerinen, Fettsäuren und Cholesterin - unter Einwirkung von Gallensäuren bilden sich Mizellen - Bildung der Mizellen ist Voraussetzung für die Lipidresorption (Fettstühle). - Gallensäuren: o werden in der Leber aus Cholesterin erzeugt, zum größten Teil mit Glycin oder Taurin konjugiert (Gallensalze) o Cholsäure und Chenodesoxycholsäure (primäre Gallensäuren) o sekundäre Gallensäuren entstehen im Darm durch Abspaltung von Glycin/Taurin und Dehydroxylierung an C7 Desoxycholsäure / Lithocholsäure UV 5 von 12 TJW - - o Funktion der Gallensäuren: Bewirken die Bildung von Mizellen Cholesterol wird in der Galle durch Gallensäuren in Lösung gehalten, wenn der Gehalt an Gallensäuren sinkt, fällt Cholesterin aus (Steine). Colipase bindet an Gallensäuren. Gallensäuren durchlaufen den enterohepatischen Kreislauf, wo 90% der Gallensäuren zurückgeführt werden. Resorption: o Es gibt in der apikalen Mukosa Fettsäuretransportproteine, es wurde jedoch nachgewiesen, dass sie nicht notwendig für den Transport von Monoacylglycerinen und Fettsäuren sind, sie diffundieren einfach durch die Membran. o Cholesterin wird über NPC1-like Transporter in die Zelle transportiert, der Transporter kann dabei nicht zwischen Cholesterin und dem pflanzlichen Sitosterol, das nicht verwertet werden kann, unterscheiden. o Sitosterol wird dann über ABCG5 und ABCG8 wieder aus der Zelle geschleust, bei einer Mutation an diesen Transportern kommt es zur NiemannPick Erkrankung. Resynthese: o In der Mukosa werden über β-Monoacylglycerin oder α-Glycerophosphat zusammen mit Acyl-CoA neue Triacylglacerine synthetisiert. o Diese werden mit geringen Mengen Cholesterin, Cholersterolestern, Phospholipiden und Apo B48 in die Lymphbahn abgegeben (Chylomikronen). o Es ist zurzeit noch unklar, wie Chylomikronen durch die Basalmembran gelangen. Resorption von Mineralien und Wasser - Beim Menschen gehen täglich 2-3l Wasser, 7g Natrium und 4g Kalium durch Harn und Schweiß verloren, die ersetzt werden müssen. - Gesamtmenge der von Magen und Darmdrüsen abgegebenen Flüssigkeit 6-9l - Es müssen also beträchtliche Mengen an Wasser und Elektrolyten reabsorbiert werden. - Wasserresorption ist ein passiver Vorgang und folgt den osmotisch aktiven Substanzen des Darmes (Natrium, Chlorid und Hydrogencarbonat). - In Magen und Duodenum erfolgt keine Wasserabsorption, bei hypotonem Speisbrei wird Natrium zugeführt, bei hypertonem Wasser abgegeben, bis der Speisebrei isoton ist. - Wichtigster Ort der Wasserresorption ist das Jejunum! - Durch die Aktivitäten von SGLT1 und Na+-abhängigem Aminosäuretransport (s.o.) wird intrazellulär die Na+-Konzentration erhöht und durch die basale Na+/K+-ATPase in den extrazellulären Raum gepumpt, das Wasser folgt nun parazellulär. - Weitere Rolle spielt HCO3-, welches von Duodenum und Pankreas abgegeben wird. - Über den genauen Verlauf der HCO3- -Resorption besteht Unklarheit. - In Ileum und Colon geschieht die Na+-Resorption unabhängig von Zucker oder Aminosäuren. - Es werden 2 Transportmechanismen unterschieden: o Elektroneutrale NaCl-Resorption: benötigt werden ein Na+/H+ Antiporter und ein Cl-/HCO3- Antiporter Na+ und Cl- werden in die Zelle transportiert und durch die Na+/K+ATPase bzw. Cl- Kanäle nach extrazellulär gebracht, Wasser folgt. H+ und HCO3- gelangen in Darmlumen und werden durch eine Carboanhydrase zu Kohlensäure umgewandelt, was zum Absinken des UV 6 von 12 TJW osmotischen Druckes im Darm führt und die Wasserresorption begünstigt. o Elektrogene Na+ Aufnahme Natrium wird über ENaC in die Zelle und basolateral wieder herausgepumpt, Chlorid folgt über Kanäle oder parazellulär, genau wie Wasser. Nahrungsstoffe im Dickdarm - Im Colon werden die Nahrungsreste von Darmbakterien zersetzt. - Kohlehydrate und Lipide werden z.B. zu Lactat, Acetat und Butyrat vergoren, dabei entstehen Gase wie CO2, Methan und Wasserstoff. - Protein und Aminosäuren unterliegen dagegen Fäulnisprozessen. - Die dabei entstehenden Toxine werden zur Leber transportiert, dort an Sulfat oder Glucuronat gekoppelt und über die Niere ausgeschieden. - Ist dieser Abbau gestört, kommt es zur Ansammlung dieser Toxine und zur hepatischen Enzephalopathie (Saufen macht dumm, Herr Haufe!). Hormonelle Regulation der Verdauung und Resorption: Hormonelle Regulation über ACh, GRP, Gastrin, Histamin und Somatostatin - Die Abstimmung der Darmabschnitte aufeinander erfolgt durch gastrointestinale Hormone und parakrin aktive hormonartige Faktoren, die nicht von endokrinen Drüsen, sondern von einzelnen endokrin-aktiven Zellen sezerniert werden. - Magensaftsekretion: o Salzsäuresekretion: (siehe Thema 1) o Mucinsekretion: ACh sowie Sekretin stimulieren die Mucinsekretion über Adenylatcyclase. Prostaglandine des E-Typs sind wichtige Stimulatoren der Mucinsekretion und fördern Zellregeneration und Durchblutung, außerdem hemmen sie die HCl-Sekretion der Parietalzellen. Glucocorticoide sind wirksame Hemmstoffe der Mucinsekretion (Ulzerationen). o Pepsinogensekretion: Sekretion von Pepsinogen der Hauptzellen wird stimuliert durch: • Cholinerge nervale Reize • Gastrin • hohe Protonenkonzentration - Pankreatische Enzymsekretion: o Sekretorisch aktive Zellen sind Acinuszellen für die Verdauungsenzyme und Gangzellen für Wasser und Hydrogencarbonat. o Wichtigster Stimulus erfolgt durch parasympathische ACh Ausschüttung an M1-Rezeptoren und über Phospholipase Cβ. o weitere Stimulation erfolgt durch Cholecystokinin, das von I-Zellen in Duodenum und Jejunum sezerniert wird. o Cholecystokinin-Sekretion erfolgt nach Eintritt von Fettsäuren, Aminosäuren oder Peptiden ins Duodenum. o CCK löst außerdem eine Kontraktion der Gallenblase aus, die Gallensekret ins Duodenum entlässt. UV 7 von 12 TJW - o Die Wasser- und Hydrogencarbonatsekretion wird stimuliert durch Sekretin, welches in Duodenum und Jejunum gebildet wird. Gallensekretion: o Wichtigster Stimulus für die Gallesekretion in der Leber sind Gallensäuren, damit hängt die Gallesekretion direkt mit dem enterohepatischen Kreislauf zusammen. o Eine leicht stimulierende Wirkung hat auch Sekretin. Regulation der Nahrungsaufnahme - Die Kontrolle der Nahrungsaufnahme erfolgt über Hunger- und Sättigungswahrnehmungen. - Dabei spielt nicht nur der Energiestatus, sonder auch die Versorgung mit einzelnen Nährstoffgruppen eine Rolle. - Afferente Signale neuronaler oder humoraler Art laufen im Gehirn zusammen: o sensorische Wahrnehmung: Geruch, Geschmack, Aussehen der Nahrung o präabsorptive und postprandiale Signale, die durch Verdauung und Resorption entstehen - Gastrointestinaltrakt übernimmt die Aufgabe einen mutlisensorischen Systems über: o Dehnungsrezeptoren im Magen o Registrierung der Nahrungszusammensetzung durch gastrointestinale Peptide (Freisetzung von Cholezystokinin in Abhängigkeit von Protein- und Fettverdauung) - Neben neuronalen und humoralen Signalen geben auch die resorbierten Nährstoffe selbst Signale ans Gehirn ab, die Nahrungszufuhr und Appetit reduzieren. Was bewirken Leptin, Insulin und Ghrelin? - Leptin: o wird vom Fettgewebe abgegeben und informiert das ZNS über vorhandene Energiereservoirs o Bildung ist abhängig von Fettsäuresynthese bzw. Insulin o bindet nicht nur im ZNS, sondern erhöht auch den Energieumsatz o bei Adipositas wird davon ausgegangen das ständig zirkulierende Leptinspiegel zur Desensibilisierung der Rezeptoren führt - Insulin: o ist das einzige Hormon, dass den Blutzuckerspiegel senken kann o Molekulargewicht: 5,8 kDa o großes Proteohormon aus zwei Peptidketten, A-Kette (21 AS) und B-Kette (30 AS) o wird in Speichergranula des Langerhans’schen Inseln als Zinkkomplex gespeichert o steigert den Einbau von GLUT-4 in Muskel- und Fettzellen - Ghrelin: o besteht aus 28 Aminosäuren o wird in Hungerzuständen verstärkt vom Magenfundus sezerniert und scheint die Nahrungsaufnahme zu initiieren o Rezeptoren befinden sich in Hypothalamus, hier wirkt es als Gegenspieler des Leptins und steigert das Hungergefühl. o Außerdem finden sich Rezeptoren in der Hypophyse, hier fördert es die Sekretion von Wachstumshormonen. UV 8 von 12 TJW Synthese des Häms: Struktur von Häm - - Es handelt sich um ein Protoporphyringerüst. 4 Pyrrolringe mit 4 Methinbrücken mit 11 konjugierten Doppelbindung in den Seitenketten o 4 Methylgruppen (CH3) o 2 Vinylgruppen (CH=CH2) o 2 Propionylgruppen (CH2-CH2-COOH) Fe2+ ist zentral gelegen und geht 4 von 6 möglichen koordinativen Bindungen mit N (Pyrrolringe) sein. Welche Häm-Proteine gibt es? - Cytochrome der Atmungskette - Cytochrom P450 enthaltende Monooxygenasen - Fettsäuredesaturasen - Katalase und Peroxidase - Hämoglobin und Myoglobin - Tryptophanpyrrolase - Hieraus ist ersichtlich, dass alle Zellen, die Fähigkeit besitzen müssen, Häm zu bilden. Welche Vitamine werden für die Hämbiosynthese benötigt? - Vitamin B6 (Pyridoxalphosphat) δ-ALA-Synthase - Vitamin B5 (Pantothensäure) Aufbau von Coenzym A - Tetrahydrofolsäure wichtiger Methylgruppen-Donator - Vitamin B12 (Cobalamin) wird benötigt für die Regeneration von C1-Donatoren - Cu2+ - Fe2+ Ablauf des Synthesevorgangs - Der Biosynthese-Vorgang wird in 8 Einzelschritte unterteilt. Der prinzipielle Ablauf ist in allen Geweben gleich, jedoch gibt es teilweise gewebsspezifische Isoenzyme. - Für die Häm-Synthese sind als Grundstoffe nur Succinyl-CoA und Glycin notwendig. - 1. Schritt: Bildung von δ-Aminolävulinat o Ort: Mitochondrien-Matrix UV 9 von 12 TJW - - - - UV o Enzym: δ-Aminolävulinat-Synthase Pyridoxalphosphat-abhängig nicht ATP-abhängig, Energie kommt aus der Abspaltung des CoA o geschwindigkeitsbestimmender Schritt das Enzym hat nur eine Halbwertszeit von ca. 30 Minuten o Es gibt zwei Gene bei Menschen, die für dieses Enzym codieren, folglich gibt es zwei Isoformen: δ-ALA-S1-Gen ( house keeping enzyme in allen Geweben) δ-ALA-S2-Gen ( nur in Erythroblasten) o Ablauf der Reaktion: Glycin bildet eine Schiff’sche Base mit Pyridoxalphosphat aus. Nun ist es möglich, dass Glycin mit seinem α-C-Atom an die CO-SCoA-Gruppe des Succinyl-CoA bindet. Durch CoA-SH-Abspaltung entsteht das instabile α-Amino-βketoadipat. Durch spontane CO2-Abspaltung entsteht δ-Aminolävulinat (δ-ALA). 2. Schritt: Bildung von Porphobilinogen o Ort: Cytosol o Enzym: Porphobilinogen-Synthase (δ-ALA-Dehydratase) kommt in zwei Isoformen vor, die eine in allen Geweben, die andere nur in Erythroblasten o Ablauf der Reaktion: zwei Moleküle δ-Aminolävulinat kondensieren zu Porphobilinogen (PBG) unter Abspaltung von zwei Molekülen H2O 3. Schritt: Bildung einer Tetrapyrrolverbindung (Hydroxymethylbilan) o Ort: Cytosol o Enzym: PBG-Desaminase Es gibt hier ebenfalls zwei Isoformen, aber nur ein Gen. Dies wird hierdurch gewährleistet, dass die prä-mRNA unterschiedlich gespleißt wird. Es ist nicht bekannt, ob sich diese beiden Isoenzyme funktionell unterscheiden. o Ablauf der Reaktion: vier Moleküle Porphobilinogen kondensieren unter Abspaltung von vier Molekülen NH3 zu einem Molekül Hydroxymethylbilan Die entstehenden Pyrrolringe werden mit A, B, C und D bezeichnet, wobei als Ring A derjenige definiert wird, der über eine CH2OHGruppe verfügt. 4. Schritt: Bildung von Uroporphyrinogen III o Ort: Cytosol o Enzym: PBG-Isomerase (Uroporphyrinogen-III-Synthase) o Ablauf der Reaktion: Zunächst wird ein Molekül H2O abgespalten. Dann wird am D-Pyrrolring eine Vertauschung des Propionyl- gegen den Acetylrest vollzogen. Uroporphyrinogen III ist also durch seine asymmetrische Abfolge seiner Substituenten charakterisiert. Sollte dies nicht passieren, dann kommt es zu einer spontanen Zyklisierung zu Uroporphyrinogen I. 5. Schritt: Bildung von Koproporphyrinogen III o Ort: Cytosol 10 von 12 TJW - - - - o Enzym: Uroporphyrinogen-Decarboxylase o Ablauf der Reaktion: An allen vier Ringen kommt es zu einer Decarboxylierung. Es werden folglich 4 Moleküle CO2 abgespalten. 6. Schritt: Bildung von Protoporphyrinogen IX o Ort: Mitochondrium o Enzym: Koproporphyrinogen-Oxidase ist mit der Außenseiten der mitochondrialen Innenmembran assoziiert o Ablauf der Reaktion: Die Propionatseitenketten der Ringe A und B werden zu Vinylseitenketten dehydriert und decarboxyliert. Es werden vier Moleküle H+ auf molekularen Sauerstoff übertragen und gleichzeitig wird Kohlenstoffdioxid abgespalten. Das entstandene Moleküle Protoporphyrinogen IX ist durch die Abspaltung der Carboxylgruppe deutlich hydrophober geworden. 7. Schritt: Bildung von Protoporphyrin IX o Ort: Mitochondrium o Enzym: Protophorphyrinogen-Oxidase o Ablauf der Reaktion: Die Methylen-Gruppen, die die einzelnen Ringe verbinden, werden zu Methingruppen dehydriert. Hierdurch wird das farblose, nicht-konjugierte System mit 8 Doppelbindungen zu einem farbigen, konjugierten Tetrapyrrolsystem mit 11 Doppelbindungen. 8. Schritt: Bildung der Hämgruppe o Ort: Mitochondrium o Enzym: Ferrochelatase benötigt zweiwertiges Eisen das Enzym ist an die zur inneren Matrix zeigende Seite der inneren Membran gebunden o Ablauf der Reaktion: Zweiwertiges Eisen wird in den Tetrapyrrolring eingebaut. Es entsteht die fertige Hämgruppe. Von den insgesamt 8 Reaktionsschritten benötigt nur der erste Energie, welche aus der Spaltung von Succinyl-CoA frei wird. Außerdem ist molekularer Sauerstoff notwendig. Ob die einzelnen Transportvorgänge ebenfalls Energie benötigen ist nicht bekannt. Regulationsmechanismen in Leber und Erythrozyt/Knochenmark - Die Regulation der Hämbiosynthese unterscheidet sich zwischen Leber und Erythrozyt. - Regulationsmechanismen in der Leber: o Rückkopplungshemmung der δ-Aminolävulinat-Synthase Häm reprimiert die Transkription des δ-ALA-S1-Gens. • Damit dieser Prozess funktionieren kann, muss das Gen zwingend über eine sehr kurze Halbwertszeit verfügen. In diesem Fall liegt sie bei weniger als 30 Minuten. • Im Falle eines Häm-Mangels kann die Transkriptions des Gens um den Faktor 50 gesteigert werden. Häm hemmt das Proenzym Pro- δ-ALA-S1 an der Translokation ins Mitochondrium. UV 11 von 12 TJW - UV • Das Proenzym verfügt über eine N-terminale Erkennungssequenz. Wenn ausreichend Häm in der Zelle vorhanden ist, dann bindet es an ein hämregulatorisches Element des Proenzyms und verhindert somit die Translokation. Häm hemmt die Enzymaktivität über einen allosterischen Mechanismus. o Die Enzymaktivität wird durch Nahrungskarenz gesteigert und durch Glucosezufuhr hemmt. Bei Nahrungskarenz wird PGC-1α unter Vermittlung des CREB / cAMP-Systems vermehrt exprimiert. PGC-1α aktiviert nun die Transkriptionsfaktoren FOXO1 und NRF1. Diese stimulieren nun die Expression der δ-ALA-Synthase 1. Vermehrte Glucoseaufnahme hemmt genau diesen Stoffwechselweg. o Zusätzlich kann die Konzentration an freiem Häm durch den Einbau in andere Proteine und den Abbau durch die Hämoxygenase verändert werden. Deshalb induzieren Stoffe, welche die Biosynthese des Cytochroms P450 aktivieren, ebenfalls die Expression der δ-ALA-S1. o siehe Abb. 20.4a Löffler Seite 612 Regulationsmechanismen im Erythroblasten: o Hierbei handelt es sich um die Hauptproduzenten des Häms. Andere Gewebe können ihre Synthesekapazitäten immer schnell dem Bedarf anpassen, hier jedoch besteht immer Bedarf. o Zwei Faktoren spielen eine Rolle: Proliferation und Differenzierung der Erythrozyten, welche durch Erythropoietin reguliert werden Verfügbarkeit von Eisen o Beide Faktoren beeinflussen in unterschiedlicher Art und Weise die δ-ALASynthase 2: Stimulierung der Transkription • Erythropoietin stimuliert die Transkription des δ-ALA-S2-Gens. • Nach Bindung an den EPO-Rezeptor wird eine JAK2-Kinase aktiviert. Dies induziert sowohl die Enzyme der Globin- als auch die Enzyme der Häm-Biosynthese. Stimulierung der Translation • Die mRNA der δ-ALA-Synthase 2 verfügt über ein eisenregulatorisches Element (IRE). Bei niedrigen Eisenkonzentrationen bindet an dieses Element das eisenregulatorische Protein (IRP) und verhindert hierdurch die Translation. Aber es wird gleichzeitig die Transferrin-RezeptormRNA vermehrt translatiert. Dieser Rezeptor wird somit vermehrt in die Erythroblastenmembran eingebaut und es kommt zu einer höheren Eisenaufnahme. • Wenn die Konzentration von Eisen in der Zelle ansteigt, dann kommt es zur Ausbildung von sog. Eisen-Schwefel-Clustern. Diese führen nun dazu, dass das eisenregulatorische Protein seine Struktur ändert. Es kann nun nicht länger an das eisenregulatorische Element bindet und die Translation kann nicht länger gehemmt werden. 12 von 12 TJW