VL 12 A B Verdauungssystem-ZNS
Werbung

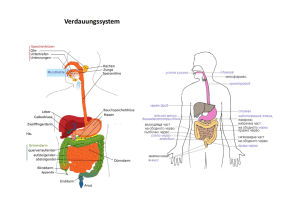
HELIOS Klinikum Bad Saarow Pathologie des Verdauungssystems Pathologie des Verdauungssystems Pathologie des Zentralnervensystems Privatdozent Dr. med. habil. Stefan Koch, Institut fü für Pathologie, Pieskower Straß Straße 33, 15526 Bad Saarow, Tel.: (033631) 73210, E-mail: [email protected]@helios-kliniken.de Anatomische Strukturen des MDT Anatomische Strukturen des MDT • • • • • • • • • • • • • • • • • • Mundhöhle, Zähne, Speicheldrüsen Ösophagus Magen/Duodenum Jejunum/Ileum Appendix vermiformis Kolon/Rektum Leber/Gallenblase/Extrahep. Gallengänge Pankreas Peritoneum VL Zahnmedizin Verdauungssystem PD Dr. St. Koch PD Dr. St. Koch 25 cm lang, Kardia ca. 40 cm von ZR entfernt Mundhöhle, Zähne, Speicheldrüsen Ösophagus Magen/Duodenum Jejunum/Ileum Appendix vermiformis Kolon/Rektum Leber/Gallenblase/Extrahep. Gallengänge Pankreas Peritoneum VL Zahnmedizin Verdauungssystem VL Zahnmedizin Verdauungssystem Ösophagus: Anatomie Anatomische Strukturen des MDT • • • • • • • • • Mundhöhle, Zähne, Speicheldrüsen Ösophagus Magen/Duodenum Jejunum/Ileum Appendix vermiformis Kolon/Rektum Leber/Gallenblase/Extrahep. Gallengänge Pankreas Peritoneum oberer Spinkter = pharyngiko-ösophagealer S. (verhindert Luftübertritt) unterer Spinkter = gastroösophagealer S. (verhindert gastroösophagelaen Reflux) 3 Engen: Ringknorpel Aorta/li. Stammbronchus Zwerchfell (Hiatus esophag.) PD Dr. St. Koch 1 Ösophagus: Divertikel Divertikel • Pulsionsdivertikel: Pseudodivertikel, Hypopharynxdivertikel im Bereich von Muskellücken u. – schwächen der dorsalen Schlundmuskulatur (Zenker-D.), selten, Vergrößerung durch Nahrungsausfüllung (Pulsion) • Traktionsdivertikel: echte Divertikel, durch Narbenzug aus der Umgebung (LK-Entzündung), häufig Traktionsdivertikel Pulsiondivertikel Ösophagus: Ösophagitis • Entzündungen des Ösophagus • tiefe Schichten erfassende Entzündungen können granulierende Entzündung mit Strikturen aufweisen • häufigste Ursachen: Reflux, Verätzungen, Infektionen Ösophagitis Ösophagus: Ösophagitis Spezialfall Refluxösophagitis • beruht auf Rückfluss von saurem Magensaft o. a. Verdauungssäften („Sodbrennen“) • 10 % der Bevölkerung • tiefe Schichten erfassende Entzündungen können granulierende Entzündung mit Strikturen aufweisen • 3 Grade (Hyperplasie, Erosion, Nekrose) • In 10 % Zylinderzellmetaplasie des unteren Ö. = Barrett-Syndrom: Dysplasie-Karzinom Ösophagus: Ösophagitis Spezialfall Soorösophagitis Refluxösophagitis III. Grades 2 Ösophagus: Ösophaguskarzinom Ösophagus: Ösophaguskarzinom • maligne Tumoren, 85 % gehen vom Plattenepithel aus, 15 % von Barrettmukosa (Adenokarzinome) • 2-5 % aller Malignome in westlichen Ländern (3-4 Fälle/100.000 Einw./Jahr) • Männer 3-4x häufiger betroffen (Alkohol, Nikotin) Anatomische Strukturen des MDT Magen: Gastritis • • • • • • • • • • Normalerweise kaum lymphatisches Gewebe im Magen • Gastritis kann nur mikroskopisch diagnostiziert werden • akute G.: Granulozyten • chron. G.: Lymphozyten/Plasmazellen • häufigste Form: chronisch-aktive G. • chemisch-reaktive G.: durch Reflux • ätiologische Bedeutung von Helicobacter pylori Mundhöhle, Zähne, Speicheldrüsen Ösophagus Magen/Duodenum Jejunum/Ileum Appendix vermiformis Kolon/Rektum Leber/Gallenblase/Extrahep. Gallengänge Pankreas Peritoneum VL Zahnmedizin Verdauungssystem PD Dr. St. Koch Gastritis-Klassifikation • Typ-A-Gastritis: • Typ-B-Gastritis: Gastritis: Helicobacter-pylori-Gastritis autoimmunbedingt bakteriell bedingt (Helicobacter pylori) • Typ-C-Gastritis: • Typ-D-Gastitis: – – – – – chemisch-toxisch, refluxbedingt diverse Sonderformen lymphozytäre G. Gastritis durch seltene Erreger granulomatöse G., Crohn-Gastritis eosinophile G. kollagene G. 3 Magen: Erosionen und Ulzera Hp-Entdeckung durch Warren und Marshall, 1982 Magen: Neoplasien Magen: Magenkarzinom • • • • • • maligner epithelialer Tumor • Ausgangspunkt: Stammzellen im Drüsenhals-bereich (primär) oder metaplastische Stammzellen (sekundär) • 90 % aller malignen Tumoren des Magens • Magenkarzinome nehmen in Westeuropa deutlich ab, hohe Inzidenz in Japan, Chile, Finnland • Erkrankungsalter: 55. – 65. Lebensjahr • Pathogenet. Faktoren: (1) Helicobacter-pylori-Infektion, (2) Umwelteinflüsse, (3) Nahrungskonservierung mit Nitriten und Nitraten unter Nitrosaminbildung, (4) erbliche Faktoren • Unterscheidung: Magenfrühkarzinome und fortgeschrittene Karzinome Benigne: Adenome Maligne: Magenkarzinom Neuroendokrine Tumoren Gastrointestinale Stromatumoren (GIST) Maligne Lymphome (MALT-Typ, Marginalzonenlymphom) VL Zahnmedizin Verdauungssystem PD Dr. St. Koch Magen: Magenkarzinom Magen: Magenkarzinom Magenfrühkarzinom • Tumoren mit Wachstum, das auf die Mukosa (MTyp) und Submukosa (SM-Typ) beschränkt ist. Lamina muscularis propria nicht befallen. • In Deutschland nur etwa 10-15 % der Magenkarzinome (in Japan wegen der existierenden Vorsorgeuntersuchung bis 50 %) • Tumorverdoppelungszeit: 1-5 Jahre • Metastasierung: M-Typ 5 %, SM-Typ 15 % Fortgeschrittenes Magenkarzinom • Tumoren mit Wachstum bis mindestens in die Tunica muscularis propria • Histologische Klassifikation nach WHO: tubuläre, papilläre, muzinöse, siegelringzellige Adenokarzinome • Klassifkation nach Adhäsionsverhalten (modif. LaurénKlassifikation: tubuläre („intestinale“) und diffuse Adenokarzinome, Mischtyp • Metastasierung: lymphogen (an kleiner Kurvatur kardiawärts, an großer Kurvatur pyloruswärts; hämatogen und kavitär (diffuse K.: Peritonealkarzinose, bei Frauen Absiedelung in Ovarien=Krukenberg-Tumoren; intestinale K.: Lebermetastasen) • Standardtherapie: Resektion des Tumors, Gastrektomie, endoskop. Mukosaresektion bei kleinen gut differenzierten Frühkarzinomen VL Zahnmedizin Verdauungssystem PD Dr. St. Koch VL Zahnmedizin Verdauungssystem PD Dr. St. Koch 4 Magen - GIST A 142/02 -GIST= gastrointestinaler Stromatumor, entstehen aus den Schrittmacherzellen der Peristaltik (CajalZellen), relativ selten, maligne Formen möglich -typische Mutation (c-kit) Magenfrühkarzinom Adenokarzinom, diffuser Typ (Siegelringzellen) Adenokarzinom, intestinaler (tubulärer) Typ B 10211-00 Anatomische Strukturen des MDT • • • • • • • • • Mundhöhle, Zähne, Speicheldrüsen Ösophagus Magen/Duodenum Jejunum/Ileum Appendix vermiformis Kolon/Rektum Leber/Gallenblase/Extrahep. Gallengänge Pankreas Peritoneum GIST VL Zahnmedizin Verdauungssystem PD Dr. St. Koch VL Zahnmedizin Verdauungssystem PD Dr. St. Koch Proliferationszonen (Ki67/MIB1) Was ist ein Adenom? • gutartiger, polypös erhabener epithelialer Tumor der Dickdarmschleimhaut mit drüsiger Differenzierung • 98 % aller Adenome entsteht sporadisch • Entstehung aus einer einzelnen Drüse (= Krypte) aus kryptenbasalen Zellen (monoklonal), aufsteigendes Wachstum, Ausbreitung an der Oberfläche, Einwachsen zwischen und in Krypten, scheinbare Verlagerung der Wachstumszone an die Oberfläche Hyperplastischer Polyp VL Zahnmedizin Verdauungssystem PD Dr. St. Koch VL Zahnmedizin Verdauungssystem Adenom PD Dr. St. Koch 5 Adenomtypen Was ist ein Adenom? • Makroskopische Wachstumsformen: • gestielte • schmalbasige • breitbasige Adenome • Mikroskopische Typen: • tubuläres (75 %) • villöses (5 %) • tubulovillöses (20 %) Tubuläres A. VL Zahnmedizin Verdauungssystem PD Dr. St. Koch Tubulo-villöses A. Villöses A. VL Zahnmedizin Verdauungssystem PD Dr. St. Koch Beziehungen von Adenom zu Adenokarzinom • Populationen mit hoher Prävalenz von Adenomen haben zugleich hohe Prävalenz von Adenokarzinomen • Lokale Verteilung von Adenomen und Adenokarzinomen innerhalb von Kolon/Rektum identisch • Häufigkeitsgipfel des Auftretens der Adenome vor dem von Adenokarzinomen • In der Umgebung (noch) wenig ausgedehnter invasiver Adenokarzinome befinden sich häufig Adenome • Korrelation zwischen Anzahl und Malignitätspotenzial der Adenome • Vorsorgeprogramme: Abtragung von Adenomen führt zur Abnahme der Inzidenz (invasiver) Adenokarzinome Tubulovillöses Adenom VL Zahnmedizin Verdauungssystem PD Dr. St. Koch VL Zahnmedizin Verdauungssystem PD Dr. St. Koch Übergang vom Adenom zum Adenokarzinom a = Adenom b = Adenokarzinom im Polypen c = invasives Adenokarzinom K P Adenom-Adenokarzinom-Sequenz P Adenom (Polyp), K Karzinom VL Zahnmedizin Verdauungssystem PD Dr. St. Koch VL Zahnmedizin Verdauungssystem PD Dr. St. Koch 6 Krebs - Molekulare Basis Exogene DNA schädigende Agentien (erworben, Umwelt): • Chemikalien • Strahlung • Viren Normale Zelle (Stammzelle) Keimbahn-Zelle Erfolgreiche Reparatur DNA-Schaden Vererbte Mutationen in Genen, die • DNA Reparatur bewirken • Zellwachstum und • Apoptose vermitteln Fehlerhafte DNA Reparatur Mutationen im Genom somatischer Zellen Aktivierung von wachstumsfördernden Onkogenen Morphologische und molekulargenetische Veränderungen während der Entstehung kolorektaler Karzinome Alterationen von Genen, die die Apoptose steuern Inaktivierung von Krebssupprimierenden Genen Expression veränderer Genprodukte Verlust von regulatorischen Genprodukten Klonale Expansion Zusätzliche Mutationen (Progression) Heterogenität (genetisch / morphologisch) Maligner Tumor VL Zahnmedizin Verdauungssystem Morphologisches Korrelat genetischer Veränderungen: Dysplasien/IEN PD Dr. St. Koch Grad der Dysplasie/intraepithelialen Neoplasie bei kolorektalen Adenomen • Dysplasie: atypische Drüsenformationen aus atypischen Epithelzellen • Grad der Dysplasie: Ausmaß der drüsigen Ausdifferenzierung, Kerngröße u. –form, Chromatinverteilung, Nukleolen, Mitosen • Dysplasie, gering – mäßig – schwer bzw. intraepitheliale Neoplasie (IEN) low grade (Dyplasie I + II), high grade (Dysplasie III) Dysplasie II Dysplasie I IEN = intraepitheliale Neoplasie Dysplasie III VL Zahnmedizin Verdauungssystem PD Dr. St. Koch VL Zahnmedizin Verdauungssystem PD Dr. St. Koch HELIOS Klinikum Bad Saarow Pathologie des Zentralnervensystems Pathologie des Zentralnervensystems Privatdozent Dr. med. habil. Stefan Koch, Institut fü für Pathologie, Pieskower Straß Straße 33, 15526 Bad Saarow, Tel.: (033631) 73210, E-mail: [email protected]@helios-kliniken.de 7 Allgemeine Angaben Besonderheiten von ZNS-Tumoren – Unterschiede zu Tumoren anderer Lokalisation • 2 % aller Tumoren beim Menschen • alle Altersstufen u. alle Abschnitte des ZNS betroffen • am häufigsten sind Gliome (des Großhirns) • Inzidenz intrakranieller Tumoren in Europa: 7 – 10 Neuerkrankungen auf 100.000 Einwohner u. Jahr • konstante Inzidenz, allerdings Zunahme primärer ZNS-Lymphome • Prognose nicht allein von biologischer Wertigkeit abhängig, da bereits kleinere Tumoren Hirndrucksteigerungen und Hirnmassenverschiebungen bedingen • klassische Malignitätskriterien nicht gegeben (infiltrativ-destruktives Wachstum); Übergreifen auf Nachbarstrukturen (Dura, Knochen) selten • hämatogene u. lymphogene Streuung sehr selten (Ausnahme Medulloblastom – Liquor) WHO-Klassifikation der ZNS-Tumoren (2007) WHO-Klassifikation der ZNS-Tumoren (Allgemeine Betrachtungen) • Zusammenfassung der Tumoren in Gruppen gleicher zellulärer Herkunft o. Ähnlichkeit • 60 primäre Tumorarten (15 Varianten des Meningeoms als ein Tumor gezählt) • 27 mesenchymale u. melanozytäre Tumoren • ca. 60 verschiedene Lymphomarten • 6 Keimzelltumoren • Summe: etwa 150 verschiedene Tumoren • Vielzahl möglicher Metastasen WHO-Klassifikation der ZNS-Tumoren (2007) – Tumorklassen Zusammenfassung der Epidemiologie intrakranialer Tumoren Tumor I. II. Tumoren des neuroepithelialen Gewebes Tumoren der Hirn- und paraspinalen (peripheren) Nerven III. Tumoren der Meningen IV. Lymphome u. hämatopoetische Neoplasien V. Keimzelltumoren VI. Tumoren der Sella-Region VII. Metastasen WHO -Grad Inzidenz Rate M/F Alter (Jahre) bei klinischer Manifestation (%) 0-20 21-45 >45 5-Jahres Überlebens -rate (%) Pilozytisches Astrozytom I 0,27 1,0 74 20 6 87 Diffus-infiltr. Astrozytom II 0,15 1,2 10 61 29 49 Anaplastisches Astrozytom III 0,48 1,4 9 49 42 31 Glioblastom IV 2,60 1,6 3 25 72 3 Oligodendrogliom II/III 0,29 1,5 8 46 46 63 Ependymom II/III 0,24 1,4 37 38 25 67 Medulloblastom IV 0,26 1,6 74 23 3 56 Schwannom/ MPNST I/III 0,75 0,8 3 43 54 >80 Meningeom I(II/III) 2,63 0,5 3 26 72 >70 8 Grading von Hirntumoren • hat bei astro- u. oligodendrozytären Gliomen höheren Stellenwert als bei „peripheren“ Neoplasien • Existenz verschiedener Grading-Systeme (Kernohan, Ringertz, Zülch, Saint-Anne-MayoSystem, WHO) • WHO-Grading: horizontales Grading (alle Neoplasien ungeachtet Gewebetyp in 4 Grade eingeteilt); vertikales Grading betrachtet nur identische Gewebetypen (z. B. solide Tumoren) Astrozytom WHO-Klassifikation der ZNS-Tumoren Tumorklassen I. Tumoren des neuroepithelialen Gewebes Astrozytome Oligodendrogliom Ependymome Plexuspapillom Embryonale Tumoren (Medulloblastom) Astrozytom • diffus infiltrierende Tumoren • unterschiedliche biologische Wertigkeit, starke Tendenz zur malignen Transformation • vorwiegend Großhirnrinde • 3 Formen: niedriggradiges A. (fibrilläres u. gemistozytisches A.), anaplastisches A., Glioblastom Diffuses fibrilläres Astrozytom Diffuses fibrilläres Astrozytom (GFAP) 9 Gemistozytisches Astrozytom Glioblastom Anaplastisches Astrozytom Glioblastom Genetische Veränderungen bei der Entstehung des primären und sekundären Glioblastoms Differenzierte Astrozyten oder Vorläuferzellen p53 Mutation (>65 %) EGFR Amplifikation (=40 %) Überexpression (=50 %) MDM2 Amplifikation (<10 %) PTEN Mutation (=30 %) Niedriggradiges Astrozytom LOH 19q (=50 %) Anaplastisches Astrozytom LOH 10q und 10q (>60 %) LOH 10q (>50 %) p16 Deletion (13%) p14 Deletion (44%) Sekundäres Glioblastom p16 Deletion (32 %) p14 Deletion (44 %) Primäres Glioblastom de novo Glioblastom 10 Oligodendrogliom Anaplastisches Oligodendrogliom Ependymom Plexuspapillom Medulloblastom WHO-Klassifikation der ZNS-Tumoren Tumorklassen II. Tumoren der Hirn- und paraspinalen (peripheren) Nerven Schwannom (Neurinom) Maligner peripherer Nervenscheidentumor (MPNST) Hochmaligner embryonaler Kleinhirntumor, außerhalb KH = PNET, Kindesalter, Liquoraussaat, Homer-Wright-Rosetten 11 Neurinom WHO-Klassifikation der ZNS-Tumoren Tumorklassen III. Tumoren der Meningen Meningeome (Auswahl) meningotheliomatös fibrös transitional psammomatös angiomatös mikrozystisch sekretorisch lymphoplasmazytenreich metaplastisch atypisch anaplastisch Akustikusneurinom: gekapselt, derb, benigne; maligne Form: MPNST Meningeom Fibröses Meningeom Sekretorisches Meningeom S-100 Klarzelliges Meningeom 12 WHO-Klassifikation der ZNS-Tumoren Tumorklassen IV. Lymphome u. hämatopoetische Neoplasien Papilläres Meningeom Primäres malignes Lymphom VL Zahnmedizin Verdauungssystem PD Dr. St. Koch WHO-Klassifikation der ZNS-Tumoren Tumorklassen VII. Metastasen zumeist Absiedlungen von Bronchial-, Mamma- und Nierenkarzinomen, gelegentlich Melanommetastasen CD20 13 HELIOS Klinikum Bad Saarow Pathologie des Verdauungssystems Pathologie des Zentralnervensystems Privatdozent Dr. med. habil. Stefan Koch, Institut fü für Pathologie, Pieskower Straß Straße 33, 15526 Bad Saarow, Tel.: (033631) 73210, E-mail: [email protected]@helios-kliniken.de 14