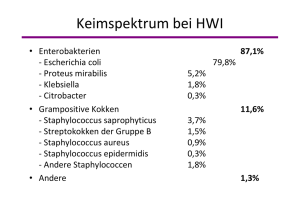
1 Einleitung
Werbung

Diplomarbeit Arzneimittelinteraktionen in der zahnheilkundlichen Antibiotikatherapie eingereicht von Stephan Werner Marcher Mat.Nr.: 0312324 zur Erlangung des akademischen Grades Doktor der Zahnheilkunde (Dr. med. dent.) an der Medizinischen Universität Graz ausgeführt am Institut für experimentelle und klinische Pharmakologie unter der Anleitung von Ao Univ. Prof. Dr. Donnerer Josef Ort, Datum....................... (Unterschrift) Eidesstattliche Erklärung Ich erkläre ehrenwörtlich, dass ich die vorliegende Arbeit selbstständig und ohne fremde Hilfe verfasst habe, andere als die angegebenen Quellen nicht verwendet habe und die den benutzten Quellen wörtlich oder inhaltlich entnommenen Stellen als solche kenntlich gemacht habe. Graz, am 10.10.2010 Stephan Marcher i Zusammenfassung Mit der steigenden Zahl und Vielfalt von pharmazeutischen Wirkstoffen, die uns in der Arzneitherapie zur Verfügung stehen, nimmt auch die Anzahl der möglichen Arzneimittelinteraktionen zu. Antibiotika werden in der Zahnheilkunde hauptsächlich zur Behandlung von oralen Infektionen eingesetzt, welche durch eine konservative Behandlungsmethode nicht beherrschbar sind. Aufgrund verschiedenster Grunderkrankungen, wie z.B. Bluthochdruck, kardiovaskuläre Erkrankungen, Diabetes oder chronischer Schmerzzustände, erhalten insbesondere ältere Patienten teilweise gleichzeitig unterschiedlichste Substanzen zu deren Behandlung. In der Zahnheilkunde werden antimikrobielle Medikamente für längere Zeit verschrieben, wodurch sich auch die Wahrscheinlichkeit möglicher Arzneimittelwechselwirkungen erhöht. Fortwährende Untersuchungen ergeben immer mehr Informationen über die verschiedenen Interaktionen, wobei aber nicht alle Wechselwirkungen von klinischer Relevanz sind. Das Ziel dieser Arbeit war es, anhand einer Literaturrecherche und mit Hilfe von Lehrbüchern die relevanten Interaktionen mit den in der Zahnmedizin gebräuchlichen Antibiotika Erythromycin, Clarithromycin, Doxycyclin, Metronidazol und Ciprofloxacin herauszufinden und zu beschreiben. Hierfür wurde mit Hilfe einer PubMed- Suche nach den Stichwörtern. „drug interactions“, „erythromycin“, „clarithromycin“, „doxycycline“, „metronidazole“ und „ciprofloxacin“ gesucht und die ausgewählten Interaktionen beschrieben. Anhand des Literaturverzeichnisses der ausgewählten Artikel wurden weitere relevante Studien bzw. Arbeiten gesucht. Zweiwertige Kationen können in der Resorptionsphase bestimmter Antibiotika interagieren, während Antibiotika selbst den enterohepatischen Kreislauf von Hormonen stören können. Manche Antibiotika lösen eine Alkoholunverträglichkeit aus. Ein Großteil der Medikamente wird durch das Cytochrom P-450 Enzymsystem verstoffwechselt, welches sich im endoplasmatischen Retikulum der Hepatozyten und der Enterozyten befindet. Die in der Zahnmedizin gebräuchlichen Antibiotika sind als Inhibitoren oder Substrate dieses Systems bekannt. Die möglichen Wechselwirkungen reichen von lebensbedrohlichen Komplikationen aufgrund eines gestörten Metabolismus und erhöhter Plasmaspiegel, bis hin zu einem Wirkungsverlust aufgrund zu niedriger Plasmaspiegel. In der Zahnheilkunde sollte das Risiko möglicher Arzneimittelinteraktionen mit Antibiotika stets im Auge behalten werden, Begleit-Dauermedikationen sollten überprüft und Dosisanpassungen und Ausweichmedikamente bedacht werden. ii Abstract With an increasing number of different medications prescribed to multi-morbid and elderly patients, also the potential for serious drug interactions continues to grow. In dental practice antibiotics are mainly used for the treatment of oral infections, which cannot be controlled with mechanical debridement and cleaning alone. When antibiotics are prescribed in dental care, it has to be taken into account that patients who suffer from chronic diseases, such as hypertension, chronic heart failure, diabetes or chronic pain receive already a long-term therapy with various drugs. Antibiotics are administered for a longer time period than other agents routinely used in dentistry, resulting in an increased risk of possible drug interactions. Drug interactions can result in unexpected adverse effects. As a result of continuing research, also information about drug interactions increases exponentially. The aim of this investigation was to identify specific adverse drug interactions that are relevant for the antimicrobial agents commonly used in dental practice: erythromycin, clarithromycin, doxycycline, metronidazole and ciprofloxacin. To determine relevant drug interactions, the literature and text books were searched by focusing on these five antibacterial agents. A PubMed search was conducted, using the keywords: “drug interactions”, “erythromycin”, ”clarithromycin”, ”doxycycline”, “metronidazole” and “ciprofloxacin”. Bibliographies of selected articles were further searched for potentially relevant articles. Divalent cations can interfere with the absorption phase of certain antibiotics, whereas antibiotics by themselves can interfere with the enterohepatic circulation of hormones. Certain antibiotics may produce an intolerance to alcohol. Most drugs are metabolized by the cytochrome P-450- enzyme system embedded in the lipid bilayer of the endoplasmatic reticulum of hepatocytes and enterocytes. Antibiotics routinely used in dentistry are inhibitors or substrates of this systems. The potential interactions may range from serious life-threatening side-effects due to impaired metabolism and increased plasma levels to therapeutic failure due to decreased plasma levels. Dentists should be aware of the potential risks of drug interactions with antibiotics, they should monitor the outcome of accompanying long-term medications during antibiotic therapy, or consider alternative, non-interacting drugs whenever possible. iii Inhaltsverzeichnis Eidesstattliche Erklärung.........................................................................................i Zusammenfassung ..................................................................................................ii Abstract .................................................................................................................iii Inhaltsverzeichnis ..................................................................................................iv Glossar und Abkürzungen ......................................................................................v Abbildungsverzeichnis ..........................................................................................vi Tabellenverzeichnis ..............................................................................................vii 1 Einleitung..............................................................................................................1 1.1 Definitionen und Einteilung...........................................................................1 1.2 Epidemiologie von Arzneimittelinteraktionen...............................................2 1.3 Allgemeine Wirkprinzipien – Interaktionen..................................................4 1.4 Pharmakodynamische Interaktionen...............................................................4 1.5 Pharmakokinetische Interaktionen..................................................................6 1.5.1 Interaktionen während der Resorption................................................6 1.5.2. Interaktionen während der Verteilung................................................7 1.5.3 Interaktionen während der Biotransformation....................................8 1.5.4 Interaktionen während der Elimination..............................................11 1.5.5 Interaktionen während des Arzneimitteltransports............................11 2 Die Substanzen und deren Wechselwirkungen.................................................13 2.1 Erythromycin und Clarithromycin............................................................….13 2.1.1 Wechselwirkungen von Erythromycin und Clarithromycin..............16 2.2 Doxycyclin......................................................................................................23 2.2.1 Wechselwirkungen von Doxycyclin...................................................25 2.3 Metronidazol...................................................................................................30 2.3.1 Wechselwirkungen von Metronidazol................................................31 2.4 Ciprofloxacin..................................................................................................34 2.4.1 Wechselwirkungen von Ciprofloxacin...............................................37 3 Diskussion.............................................................................................................44 4 Literaturverzeichnis............................................................................................47 iv Glossar und Abkürzungen A.a. Aggregatibacter actinomycetemcomitans AB Antibiotikum ABC ATP binding cassette ACE Angiotensin Converting Enzyme AS Aminosäure ASS Acetylsalicylsäure ATP Adenosintriphosphat AUC Area under the curve CI confidence interval CYP- 450 Cytochrom P- 450 DDT Dichlordiphenyltrichlorethan DNA Desoxyribonucleinsäure DRP digoxin reduction products EKG Elektrokardiogramm GABA γ- Aminobuttersäure HMG- CoA 3-Hydroxy-3-Methylglutaryl-Coenzym-A MTX Methotrexat NSAID non steroidal anti inflammatory drugs INR international normalized ratio OR odds ratio P-gp P- Glycoprotein pH pondus hydrogenii pKa negativer dekadischer Logarithmus der Säurekonstante Ptt Prothrombinzeit RNA Ribonucleinsäure ZNS zentrales Nervensystem v Abbildungsverzeichnis Abbildung 1: Systematik der Cytochrom P-450- Enzyme. Quelle: (15) Abbildung 2: Der prozentuelle Anteil der CYP- Subfamilien am Arzneistoffmetabolismus während der Phase-I-Reaktion. Quelle: (15) Abbildung 3: Funktion der Glycoproteine. Quelle: http://www.pharmazeutischezeitung.de/index.php?id=titel_13_2004 (26.10.2010) Abbildung 4: Strukturformel von Erythromycin. Quelle: www.arzneistoffe.net/Erythromycin.html (26.10.2010) Abbildung 5: Strukturformel von Clarithromycin. Quelle: www.arzneistoffe.net/Clarithromycin.html (26.10.2010) Abbildung 6: Wirkmechanismus der Makrolid- Antibiotika. Quelle:http://www.arzneistoffe.net/Wirkungsmechanismus%20der%20Makrolide.html (25.10.2010) Abbildung 7: Strukturformel von Doxycyclin. Quelle:http://gesundheit.germanblogs.de/wp-content/uploads/2010/06/doxycyclin.jpg (22.12.2010) Abbildung 8: Wirkmechanismus von Doxycyclin, Quelle: http://www.pharmawiki.ch/wiki/index.php?wiki=Tetrazykline (26.10.2010) Abbildung 9: Strukturformel von Metronidazol. Quelle: http://www.theodora.com/drugs/images/597.jpg (22.12.2010) Abbildung 10: Strukturformel von Ciprofloxacin. Quelle: www.arzneistoffe.net/Ciprofloxacin.html (27.10.2010) vi Tabellenverzeichnis Tabelle 1: Medikamente, die in der Studie von Greenlaw at al. am häufigsten Wechselwirkungen verursachten (8). Tabelle 2: Interaktionen von Makrolid-Antibiotika (modifiziert nach Austria Codex) (37). Tabelle 3: Interaktionen von Doxycyclin (modifiziert nach Austria Codex) (37). Tabelle 4: Interaktionen von Metronidazol (modifiziert nach Austria Codex) (37). Tabelle 5: Interaktionen von Ciprofloxacin (modifiziert nach Austria Codex) (37). vii 1 Einleitung 1.1 Definitionen und Einteilung Als Arzneimittelinteraktion beschreibt man die pharmakologischen Wechselwirkungen zwischen zwei oder mehreren Arzneimitteln, die bei gleichzeitiger oder nacheinander verabreichter Arzneimittelgabe zu einer quantitativen (Abschwächung oder Verstärkung) oder qualitativen Änderung der Wirkung führt (1). Diese Wechselwirkungen können sowohl zwischen Arzneimitteln untereinander als auch zwischen Arzneimitteln und Nahrungsbestandteilen oder Nahrungsergänzungsmitteln auftreten (2). Aus pharmakologischer Sicht wird zwischen pharmakokinetischen, welche die Prozesse der Resorption, Verteilung, Metabolismus oder Elimination beinhalten, und pharmakodynamischen Wechselwirkungen, bei denen die Wirkung eines Medikaments durch die Anwesenheit eines anderen Medikaments am Wirkungsort verändert wird, unterschieden (3). Es gibt zahlreiche Möglichkeiten Arzneimittelinteraktionen zu klassifizieren. Die Bundesvereinigung Deutscher Apotherkerverbände unterteilte Arzneimittelinteraktionen nach dem Schweregrad und der Häufigkeit der zu erwartenden Komplikationen (4): Schwerwiegend: Diese Arzneimittelkombination ist kontraindiziert, da sie bleibende Schäden verursacht, oder sogar lebensbedrohlich sein kann. Mittelschwer: Bei sorgfältiger Überwachung ist eine gleichzeitige Medikamentengabe möglich. Da es häufig zu therapeutischen Schwierigkeiten kommt, kann eine Dosisanpassung erforderlich sein. Geringfügig: Die Arzneimittelwirkungen können verstärkt oder vermindert werden, beziehungsweise treten sie nur bei bestimmten Personen (genetischer Polymorphismus; Nieren- und Leberinsuffizienz) auf. Unbedeutend: Durch das geringe Ausmaß der Wechselwirkungen besteht keine Anpassungsnotwendigkeit. 1 Eine andere Einteilung stammt von Yagiela und Picozzi (5): Antagonistisch: Die Wirkung eines Arzneimittels wird durch ein zweites Arzneimittel abgeschwächt. Potenzierend: Durch die Kombination zweier Arzneimittel mit unterschiedlichen pharmakologischen Eigenschaften erhöht sich die Wirkung eines Arzneimittels. Unerwartet: Bei der Kombination zweier Arzneimittel ergeben sich Wirkungen, die bei getrennter Applikation nicht beobachtet werden. Summierend: Die Wirkung wird durch die Arzneimittel-Kombination zweier Präparate mit ähnlichen pharmakologischen Eigenschaften verstärkt. Synergistisch: Durch die Arzneimittel- Kombination kommt es zu einer überschießenden Wirkung, die auch bei maximaler effektiver Dosis eines Arzneimittels allein nicht erreicht werden könnte. 1.2 Epidemiologie von Arzneimittelinteraktionen Die Wahrscheinlichkeit für das Auftreten einer unerwünschten Arzneimittelinteraktion steigt exponentiell mit der Anzahl der gleichzeitig verabreichten Medikamente, die ein Patient erhält (6). Bei der zeitgleichen Einnahme von weniger als 6 verschiedenen Arzneimitteln liegt die Häufigkeit von Interaktionen bei ca. 5%, wohingegen die Häufigkeit bei mehr als 15 verschiedenen, gleichzeitig eingenommenen Pharmaka auf über 40% ansteigt (7). In einer Studie am Holy Cross Hospital in Fort Lauderdale wurden 34 564 Behandlungstage stationärer Patienten ausgewertet und 1219 potentiell wichtige Arzneimittelinteraktionen gefunden, von welchen jedoch nur 116 auch tatsächlich von klinischer Relevanz waren (8). In Tabelle 1 sind alle Medikamente und die Häufigkeit ihrer Interaktionen aufgelistet, wie sie in dieser Studie von Greenlaw et al. beschrieben wurden. Somit war bei 3,5% aller Patienten mit potentiellen Wechselwirkungen zu rechnen, aber lediglich bei 0,3% traten auch klinisch relevante Arzneimittelinteraktion auf (9). Puckett et. al. untersuchten über 2 Monate in einer prospektiven Studie 2422 Patienten und fanden bei 113 (4,7%) Patienten potentielle Arzneimittelinteraktionen. Nur bei 7 (0,3%) Patienten fanden sich tatsächlich auch klinische Anzeichen einer Medikamentenwechselwirkung (10). Im Jahre 2004 untersuchte Pirmohamed et. al in der größten prospektiven Studie über unerwünschte Arzneimittelwirkungen von England alle Krankenhauseinweisungen zweier 2 Krankenhäuser in Merseyside. Es zeigte sich, dass von den 18 820 Krankenhauseinweisungen 203 (1,1%) auf Arzneimittelinteraktionen zurückzuführen waren. Arzneimittelinteraktionen waren damit verantwortlich für 16,6% aller unerwünschten Arzneimittelwirkungen. Als häufige Beispiele für solch interagierende Pharmaka gaben die Autoren Warfarin und ASS, ASS und NSAIDs, Diuretika und ACE Hemmer sowie Digoxin und Diuretika an (11). Tabelle 1: Medikamente, die in der Studie von Greenlaw et al. am häufigsten Wechselwirkungen verursachten Arzneimittelwechselwirkung Anzahl der Interaktionen Warfarin - Barbiturate - Sulfonamide - Acetylsalicylsäure - andere - insgesamt 5 1 12 7 25 Digoxin - Diuretica - Antazida - Carbenicillin oder Ticarcillin - insgesamt 7 6 2 15 Antazida - Eisenpräparate - Tetrazykline - Phenothiazine - andere - insgesamt 29 18 9 1 57 Diuretika - Steroide 6 Eisen - Tetrazykline 1 Heparin - Acetylsalicylsäure 3 Andere 9 insgesamt 116 Modifiziert nach (8) 3 1.3 Allgemeine Wirkprinzipien – Interaktionen Es gibt neben völlig einzigartigen Wirkungsweisen einige prinzipielle Wechselwirkungsmechanismen, welche immer wieder bei der Verabreichung von zwei oder mehreren Substanzen angetroffen werden. Grundsätzlich unterscheidet man nach der Wirkungsart zwischen pharmakodynamischen und pharmakokinetischen Interaktionen. Diese Unterscheidung hat auch Praxisrelevanz, da pharmakodynamische Interaktionen mit relativ großer Sicherheit vorhergesagt werden können, weil es sich um eine Summation von Einzelwirkungen und/oder Nebenwirkungen der jeweiligen Arzneimittel handelt. Hingegen ist es bei den pharmakokinetischen Interaktionen schwierig, eine genaue Vorhersage zu treffen, da diese nicht arzneistoffspezifisch sind und Wechselwirkungen in jedem Abschnitt auftreten können, angefangen von der Resorption des Stoffes, der Plasmaeiweißbindung, der Verteilung im Gewebe, der Rezeptorbindung, dem Metabolismus bis hin zur Elimination. 1.4 Pharmakodynamische Interaktionen Unter Pharmakodynamik versteht man die Wirkung, bzw. die Wirkmechanismen von Pharmaka auf den Organismus. Die Pharmakodynamik befasst sich mit der Art (Wirkprofil) und dem Ort der Wirkung, der Wirkstärke und der Wirksamkeit von Arzneimitteln. Bei pharmakodynamischen Interaktionen wird die Wirkung von einem Arzneimittel durch die Gegenwart eines weiteren Medikamentes beeinflusst. Zwei Wirkstoffe, die miteinander interferieren, können an einem Rezeptor, an einem Erfolgsorgan oder in einem Regelkreis synergistisch oder antagonistisch wirken (4). 1.4.1 Additive/synergistische Interaktionen: Bei gleichzeitiger Gabe von zwei Arzneimitteln mit demselben pharmakologischen Effekt, kann sich die Wirkung bzw. Nebenwirkungen dieser Arzneimittel verstärken. Wenn die Gesamtwirkung der Summe der Einzelwirkungen entspricht, handelt es sich um einen additiven Synergismus (12). 4 Synergistische Interaktionen können sowohl durch die Hauptwirkung als auch durch eine Nebenwirkung eines Medikamentes auftreten. Exemplarisch sei hier die verstärkte gerinnungshemmende Wirkung von oralen Antikoagulantien, die die Synthese von Gerinnungsfaktoren hemmen, durch Aspirin, das die Thrombozytenfunktion hemmt, erwähnt. 1.4.2 Antagonistische Interaktionen: Im Gegensatz zu den synergistischen Interaktionen gibt es auch Arzneimittel, die sich in ihrer Wirkung abschwächen. So kann es bei der gleichzeitigen Einnahme von Antikoagulantien, deren Einnahme normalerweise zu einer verlängerten Blutungszeit führt, und Vitamin K Präparaten wieder zu einer normalen Ptt kommen. Durch die pharmakologischen Kenntnisse der Arzneimittel und deren Wirkungen, bzw. Nebenwirkungen sind pharmakodynamische Wechselwirkungen gut abschätzbar. 5 1.5 Pharmakokinetische Interaktionen Pharmakokinetische Wechselwirkungen sind im Vergleich zu den pharmakodynamischen Interaktionen weitaus schwerer vorhersehbar, da diese nicht arzneistoffspezifisch sind. So können Wechselwirkungen in jeder pharmakokinetischen Phase auftreten, von der Resorption bis hin zur Elimination ergeben sich verschiedenste Möglichkeiten von Interaktionen. Die meisten Interaktionen finden während der Arzneistoffmetabolisierung statt. 1.5.1 Interaktionen während der Resorption Die Resorption beschreibt den Weg des Arzneimittels vom Applikationsort in die Blutbahn, von wo es an den Wirkort gelangt. Interaktionen während der Resorption äußern sich entweder in der veränderten Menge (gesteigert oder vermindert), was sich direkt auf die klinische Wirkung niederschlägt – die Verminderung der resorbierten Menge wirkt sich klinisch wie eine Verminderung der Dosis aus -, oder in einer veränderten Resorptionsgeschwindigkeit (gesteigert oder verkürzt) . Eine verlangsamte Resorptionsgeschwindigkeit geht mit verspätet eintretenden Blutspiegelmaxima einher, bzw. durch bereits beginnende Elimination des Arzneistoffes ist der Blutspiegel erniedrigt. Im Fall einer Dauermedikation ist eine verminderte Resorptionsgeschwindigkeit vernachlässigbar, da hierfür nur die Menge des resorbierten Stoffes und das Dosisintervall für einen gleichbleibenden Blutspiegel von Bedeutung sind. Wenn die Arzneimittelwirkung so rasch als möglich eintreten soll, wie z.B. bei der Schmerzbehandlung, kann sich eine verminderte Resorptionsgeschwindigkeit negativ auswirken, da es zu einem verzögerten Eintritt der Wirkung kommt (9). Die Resorption von Arzneimitteln bei enteraler Gabe wird durch die Veränderung des pHWerts im Magen–Darm–Trakt, die veränderte Geschwindigkeit der Magenentleerung oder Komplexbildung beeinflusst. Auch der Zustand und die Durchblutung der Magenschleimhaut ist von Bedeutung. So wird z.B. Ketoconazol (Antimykotikum) bei stark sauren pH-Werten besser resorbiert, wohingegen die gleichzeitige Gabe von Antazida, Histamin-H2-Rezeptorantagonisten oder Protonenpumpenhemmern ein Hindernis darstellen (13). 6 Werden Bisphosphonate oder Tetrazykline mit Magnesium-, Calcium- oder Eisensalzen kombiniert, können sich Komplexverbindungen bilden, die schlecht bzw. gar nicht resorbiert werden können. Dementsprechend sollten Tetrazykline nicht mit Milch, Eisenpräparaten oder Antazida kombiniert werden, da es ebenfalls zur Komplexbildung kommen kann. Auch bei der gleichzeitigen Gabe von Breitspektrum-Antibiotika und hormonalen Kontrazeptiva kann es zu Interaktionen kommen. Durch die Schädigung der Darmflora können Breitspektrum-Antibiotika den enterohepatischen Kreislauf der Kontrazeptiva stören, was zum Wirkungsverlust führen kann (14). 1.5.2. Interaktionen während der Verteilung Nachdem das Arzneimittel resorbiert wurde, wird es, reversibel gebunden an Albumin oder anderen Plasmaproteinen, über die Blutbahn im Körper verteilt. In Abhängigkeit von den physikalisch-chemischen Eigenschaften des Arzneistoffes, wie Molekülgröße oder Lipophilie, und den Eigenschaften der begrenzenden biologischen Membranen, tritt dieses in die verschiedenen Verteilungsräume ein. Zu diesen zählen der intravasale, der interstitielle und der intrazelluläre Raum. Auch die Durchblutung spielt hierfür eine wesentliche Rolle, da sich ein Pharmakon initial in gut durchbluteten Organen in weit höheren Konzentrationen anreichert (15). Bei gleichzeitigem Einsatz von mehreren Pharmaka besteht eine Konkurrenz um die Plasmaeiweiß-Bindungsstellen. Dadurch befinden sich im Plasma höhere Konzentrationen an freiem, nicht gebundenem Arzneimittel, was klinisch zu einem erhöhten Plasmaspiegel führt, gleichzusetzen mit einer Dosiserhöhung. NSAIDs können Antikoagulantien aus den Bindungsstellen verdrängen und somit kann es zu einer erhöhten Blutungsneigung kommen. Hierbei wäre als Beispiel die Kombination von Warfarin und Ibuprofen zu nennen. Warfarin hat eine Plasmaeiweißbindung von 99% und eine niedrige therapeutische Breite. Nur 1% liegt ungebunden vor und kann somit an Rezeptoren binden. Ibuprofen hat ebenfalls eine Plasmaeiweißbindung von 99% und kann Warfarin von den Proteinbindungsstellen verdrängen, sodass Warfarin nur mehr zu 97% in gebundener Form vorliegt, hingegen 3% frei im Plasma verfügbar sind. Durch den 3fachen Anstieg des Blutspiegels von Warfarin kommt es kurzfristig zu einer erhöhten Blutungsneigung. Durch den erhöhten Anteil an frei verfügbaren Pharmakon in der 7 Blutbahn, wird ein größerer Teil des Arzneimittels ausgeschieden und es kommt zur Einstellung eines neuen steady state. Weitere Beispiele für Interaktionen während der Verteilung sind die Kombinationen: Tolbutamid (Antidiabetikum der Sulfonylharnstoffreihe) mit Acetylsalicylsäure oder Phenylbutazon kann zur Hypoglykämie führen. Salicylate und Sulfonamide verdrängen Bilirubin und können bei Neugeborenen einen Kernikterus verursachen (13, 14). 1.5.3 Interaktionen während der Biotransformation Während der Biotransformation werden die Arzneistoffe in meist unwirksame, wasserlösliche Verbindungen umgewandelt, um die Ausscheidung zu erleichtern. Die dafür verantwortlichen Enzyme befinden sich im endoplasmatischen Retikulum der Leberzellen. (16) Generell können hierbei 2 Phasen unterschieden werden: 1. Während der Phase-I-Reaktion erfolgt durch Oxidation, Reduktion, Hydrolyse oder Hydratation eine Strukturänderung des Pharmakons. 2. Die Phase-II-Reaktion ist eine Konjugationsreaktion, bei der unter anderem Glucuronsäure, Schwefelsäure oder Glycin an das Pharmakon gekoppelt wird, wodurch dieses besser wasserlöslich wird und damit leichter über die Nieren eliminiert werden kann. Oft geht einer Phase-II-Reaktion eine Phase-I-Reaktion voraus. Es gibt auch Arzneimittel, die erst durch eine Phase-I-Reaktion aktiviert werden. Das applizierte Pharmakon ist sozusagen eine Vorstufe der eigentlichen Wirksubstanz, eine sogenannte Prodrug, die erst durch Metabolisierung wirksam wird (15). Die wichtigsten pharmakologischen Interaktionen finden in der Phase der Biotransformation statt. Werden verschiedene Arzneimittel durch dasselbe Enzym – wie z.B. Cytochrom P-450 – biotransformiert, kann es zur Verdrängung an den Bindungsstellen des Enzyms kommen. Das Cytochrom P-450 stellt das wichtigste Enzym während der Oxidationsreaktion dar. 8 Entsprechend der Homologie in der Aminosäuresequenz werden die CYP-Gene unterteilt in: Familien (Sequenzhomologie > 40%) Subfamilien (innerhalb einer Subfamilie AS-Sequenzhomologie > 55%) Isoformen innerhalb der Subfamilien Heute sind über 50 verschiedene CYP- Gene bekannt, wobei pharmakologisch nur 3 GenFamilien, 7 Subfamilien und 12 Isoformen von Bedeutung sind. Abb.1 Systematik der Cytochrom P- 450- Enzyme: Für den Abbau häufig eingesetzter Arzneistoffe sind die Isoformen angeführt. Quelle: (15) In Abb. 2 wird ersichtlich, dass das CYP 3A4 den Hauptteil der Phase-I-Reaktionen, die durch CYP-450 katalysiert werden, übernimmt (15). Die Abbaugeschwindigkeit eines Arzneistoffes hängt von der Enzymmenge ab. Daraus lässt sich schließen, dass durch veränderte Enzymmenge, bzw. durch veränderte Funktion der Enzyme, die Abbaugeschwindigkeit beeinflusst werden kann und Wechselwirkungen auf dieser Ebene entstehen können. 9 Arzneistoffmetabolisierung durch CYP-450 70 60 60 50 % 40 30 30 20 15 10 5 0 CYP 3A4 CYP 2C CYP 1A2, CYP 2B6, CYP 2D6 CYP 2E1 Enzym Abbildung 2: Der prozentuelle Anteil der CYP- Subfamilien am Arzneistoffmetabolismus während der Phase-I-Reaktion (modifiziert nach (15). Interaktionen durch Enzyminduktion Bestimmte Substanzen vermögen es, die Enzymmenge zu steigern. Dies kann durch gesteigerte Gentransskription, oder verminderten Enzymabbau erfolgen. Durch die gesteigerte Enzymmenge wird nun das Arzneimittel, welches durch diese Enzym metabolisiert wird, Plasmakonzentration vermehrt führt. abgebaut, Durch eine was wiederum Dosiserhöhung zu des einer erniedrigten stärker abgebauten Arzneimittels kann dieser Effekt kompensiert werden, jedoch kann es nach Absetzen des Enzyminduktors zu einer starken Erhöhung der Plasmakonzentration führen. Rifampicin induziert vor allem CYP3A4 in der Darmwand. Durch die vermehrte Enzymmenge werden z.B. Ciclosporin und Verapamil vermehrt abgebaut und dadurch deren Bioverfügbarkeit herabgesetzt (15). Interaktionen durch Enzymhemmung Wird bei der zeitgleichen Verabreichung zweier Pharmaka der Abbau eines Pharmakons gehemmt, spricht man von einer Enzyminhibition. Daraus resultiert eine verlängerte Halbwertszeit, eine erhöhte Wirkstoffkonzentration oder es kann zur Verstärkung der Nebenwirkungen kommen (14). Generell unterscheidet man 3 Arten von Enzymhemmung: 10 Um eine kompetitive Hemmung handelt es sich, wenn es zur Verdrängung von einem Arzneimittel durch ein anderes an der Enzymbindungsstelle kommt. Bei nicht-kompetitiver Hemmung kommt es zur Bindung eines Inhibitors an das Enzym, welcher aber selbst kein Substrat ist, was bedeutet, dass er nicht durch dasselbe Enzym abgebaut werden kann. Suizidinhibitoren werden durch das Enzym aktiviert und binden irreversibel an dieses, was zu dem Funktionsverlust des Enzyms führt (15). 1.5.4 Interaktionen während der Elimination Die Ausscheidung von Arzneimitteln erfolgt, je nach Molekülgröße, renal, biliär, intestinal und seltener über die Lunge. Wechselwirkungen während der renalen Ausscheidung treten aufgrund von pH-Wert Veränderungen im Urin auf. Weiteres können sie auch durch die Konkurrenz um die Bindungsstellen der Transportsysteme (ABC-Transporter), die für die tubuläre Rückresorption verantwortlich sind, entstehen (14). Probenicid kann durch diesen Mechanismus die Rückresorption von Penicillin hemmen (3). Des weiteren können NSAIDs, wie Ibuprofen, Diclofenac oder Naproxen die Rückresorption von Lithium hemmen, wodurch eine toxische Wirkung auf das ZNS und die Nieren hervorgerufen werden kann (13). Bei veränderten pH-Werten im Urin kommt es: Bei Erniedrigung des pH-Wertes zur vermehrten Ausscheidung von schwachen Basen (pKa 7,5-10,5), Bei Erhöhung des pH-Wertes zur vermehrten Ausscheidung von schwachen Säuren (pKa 3-7,5) (3). 1.5.5 Interaktionen während des Arzneimitteltransports Während der gesamten pharmakokinetischen Phase spielen aktive Transportvorgänge eine wichtige Rolle. Vor allem der ATP-abhängige Transmembrantransporter P-Glykoprotein ist an zahlreichen aktiven Transportprozessen bei intestinaler Absorption oder bei der 11 Elimination beteiligt (15). An der Blut-Hirn-Schranke fungiert es als Barriere, sodass bestimmte Pharmaka nicht in das Gehirn gelangen können. Abbildung 3: Funktionsweise der P-Glycoproteine (Quelle: http://www.pharmazeutischezeitung.de/index.php?id=titel_13_2004) Interaktionen können hier wieder während des Transports auftreten, durch Konkurrenz an den Bindungsstellen, durch Inhibition oder durch Induktion (14). Rifampicin stimuliert das P-Glykoprotein, wodurch es bei gleichzeitiger Verabreichung von Digoxin dazu führt, dass es zu einem verstärkten duodenalen Rücktransport von Digoxin kommt, was wiederum zu einer erniedrigten Plasmakonzentration führt. Ciclosporin hemmt die P-Glykoprotein Aktivität, wodurch der Digoxin-Abtransport verringert wird, was wiederum zu erhöhten Plasmakonzentrationen führt (3). 12 2 Die Substanzen und deren Wechselwirkungen Mit dem Begriff Antibiotikum werden üblicherweise antibakteriell wirksame Arzneimittel biologischer Herkunft (z.B. Penicillin als Produkt des Pilzes Penicillum notatum) bezeichnet. Von solchen abzugrenzen sind chemisch synthetisierte Stoffe, wie Sulfonamide, und chemische Modifikationen einer biosynthetischen Grundstruktur. Im deutschen Sprachgebrauch sowie auch in der wissenschaftlichen Fachliteratur werden jedoch generell antimikrobielle Wirkstoffe synonym mit dem Begriff Antibiotikum gebraucht (17). Antibiotika nehmen in der Zahnheilkunde durch die Dauer der Einnahme eine besondere Stellung ein. Beispielsweise werden Lokalanästhetika einmalig für die Dauer eines Eingriffes, analgetische Stoffe bei Bedarf für wenige Tage verabreicht. Die typische Antibiotika-Therapie bei dentogenen Infektionen dauert 5-10 Tage (18). Um einen Einblick über den Stellenwert und die Größenordnung der antimikrobiellen Antibiotikatherapie in der Zahnheilkunde zu geben, sei an dieser Stelle auf folgende Arbeit hingewiesen: In einer belgischen Studie analysierten Mainjot et al. die Verschreibungsgewohnheiten von 286 Zahnärzten in niedergelassenen Ordinationen in Bezug auf Antibiotika über einen Zeitraum von zwei Wochen. Bei insgesamt 24 421 Patientenbegegnungen wurde in 1033 Fällen (4,2% aller Patientenbegegnungen) ein Antibiotikum verschrieben. Zu den am häufigsten verschriebenen Antibiotika zählen Amoxicillin (51,1%), Amoxicillin + Clavulansäure (24%), Clindamycin (6,6%), Azithromycin (5,3%), Clarithromycin (4,4%), Doxycyclin (3,6%), Erythromycin (1,2%) und Ciprofloxacin (0,2%) (19). 2.1 Erythromycin und Clarithromycin Erythromycin und Clarithromycin werden zu der Gruppe der Makrolid-Antibiotika gezählt. Erythromycin wurde erstmals 1952 aus Stoffwechselprodukten des Streptomyces erythreus isoliert und stellt somit den ältesten Wirkstoff dieser Gruppe dar. 13 Abb.4 Strukturformel von Erythromycin Quelle: www.arzneistoffe.net/Erythromycin.html Erythromycin hat einen 14-gliedrigen Lactonring als Grundgerüst, eine Ketogruppe und 2 glykosidisch gebundene Zucker. Davon ist ein Zucker ein Neutralzucker (Cladinose) und der andere ein Aminozucker (Desosamin). Der Aminozucker ist für die basischen Eigenschaften verantwortlich. Nur die freie Base wirkt antibiotisch (15). Im sauren Milieu (pH<6) kommt es innerhalb des Moleküls zwischen zwei funktionellen Gruppen zu einer Reaktion mit Hemiketalbildung, wodurch eine Inaktivierung resultiert. Bei oraler Gabe wird Erythromycin daher in veresterter Form als Ethylsuccinat zur Verbesserung der Resorption verabreicht (14). Die neueren, synthetischen Roxithromycin sind in Makrolide, ihren wie funktionellen Clarithromycin, Gruppen Azithromycin verändert, sodass und diese Säureinstabilität verhindert werden kann. Clarithromycin ist ein Erythromycin- Derivat mit gleichartiger Wirkung, es wird allerdings langsamer eliminiert, wodurch eine niedrigere Dosis verabreicht werden kann und die Einnahme in zeitlich größeren Abständen erfolgen kann (20). Die Grundstruktur von Clarithromycin ist dieselbe wie bei Erythromycin: Als Grundgerüst dient ein 14-gliedriger Lactonring, an dem 2 glykosidisch gebundene Zucker hängen. Clarithromycin ist das 6-O-Methyl-Erythromycin. 14 Abb.5 Strukturformel von Clarithromycin Quelle: www.arzneistoffe.net/Clarithromycin.html Die Makrolid-Antibiotika wirken bakteriostatisch, indem sie die Proteinsynthese der Bakterien hemmen. Sie binden an die 50S-Untereinheit der 70S-Ribosomen und blockieren somit die Translokation der Peptidyl-t-RNA von der Akzeptorstelle zur Donorstelle, wodurch die Elongation der Polypeptidkette nicht mehr möglich ist. Abb. 6 Wirkmechanismus der Makrolid AB Quelle:http://www.arzneistoffe.net/Wirkungsmechanismus%20der%20Makrolide.html (25.10.) Das Wirkspektrum umfasst, ähnlich den Penicillinen, vor allem gram-positive Keime (z.B. Streptokokken, Bacillus anthracis), sie sind aber auch gegen bestimmte gram-negative Keime (z.B. Legionellen) und intrazelluläre Bakterien (z.B. Mykoplasmen) wirksam. Die Makrolide stellen eine Alternative bei Penicillinunverträglichkeit dar. 15 2.1.1 Wechselwirkungen von Erythromycin und Clarithromycin Da die beiden Wirkstoffe Erythromycin und Clarithromycin zu den Makrolid-Antibiotika gehören, werden diese hier in eine Gruppe zusammengefasst, da es sich hierbei um dieselbe Wirkungsweise handelt und somit auch in klinischen Studien untersuchte Interaktionen meist beide Substanzen betreffen. Benzodiazepine/Zopiclon und Erythromycin/Clarithromycin Bei gleichzeitiger Verabreichung von Benzodiazepinen bzw. Zopiclon mit Erythromycin oder Clarithromycin können diese Makrolid-Antibiotika die Serumkonzentration von Benzodiazepinen erhöhen. In einer Studie von Yasui et al. zeigte sich nach einer wochenlangen Therapie mit Erythromycin eine Erhöhung der Alprazolam Halbwertszeit von 16 auf 40 Stunden (21). Ein ähnlicher Effekt von Erythromycin auf Midazolam wurde nachgewiesen. Die AUC erhöhte sich auf das 4-fache und die Halbwertszeit verdoppelte sich (22, 23). Aranko et al. führten eine ähnliche Studie mit Zopiclon durch, wobei sich die AUC 2 Stunden nach Applikation auf das 2-fache erhöhte (24). Bei Nitrazepam erhöhte sich die AUC um 25 % (25) und bei Triazolam erhöhte sich unter Erythromycin-Gabe die AUC um 106 % (26). Der Mechanismus dieser Interaktion beruht auf der Inhibition von CYP 3A4 Isoenzymen. Aus diesem Grund scheinen Benzodiazepin-Präparate die über einen anderen Metabolisierungsweg verstoffwechselt werden, sicherer zu sein. Die gleichzeitige Behandlung mit Erythromycin, Clarithromycin oder Telithromycin und Midazolam oral soll jedenfalls vermieden werden. Wenn die gleichzeitige Behandlung mit Makrolid-Antibiotika und Midazolam oder einem anderen der betroffenen Benzodiazepine unbedingt erforderlich ist, müssen die Patienten sorgfältig auf eventuell verstärkte sedative Effekte hin überwacht werden, damit die Dosis bei Bedarf reduziert werden kann (27). Carbamazepin und Erythromycin/Clarithromycin Wong et al. zeigte in einer pharmakokinetischen Studie, dass Erythromycin den Abbau von Carbamazepin hemmte (28). Durch die Hemmung von CYP 3A4, durch welches Carbamazepin metabolisiert wird, kommt die verlängerte Abbauphase des Carbamazepins zustande. Zeichen einer Carbamazepinintoxikation beinhalten Verwirrung, Benommenheit, Ataxie, Schwindel und Übelkeit (29). 16 Ciclosporin und Erythromycin/Clarithromycin Das Immunsuppressivum Ciclosporin wird durch das Cytochrom- P-450-Isoenzym CYP 3A metabolisiert (30). Erythromycin und Clarithromycin können die Wirkung von Ciclosporin durch die Hemmung dieser Isoenzyme verstärken (31, 32). Durch die geringe therapeutische Breite von Ciclosporin kann es ab Konzentrationen über 400ng/ml vermehrt zu Nephro-, Hepato- und Neurotoxizität kommen (15). Cisaprid und Erythromycin/Clarithromycin Cisaprid wurde in Österreich zur Behandlung von gastroösophagealem Reflux eingesetzt und wird durch das CYP 3A4 metabolisiert, welches durch Makrolid- Antibiotika gehemmt wird. Diese Hemmung kann eine stärkere Wirkung von Cisaprid hervorrufen, wobei es zu einer Verlängerung des QT-Intervalls und zu ventrikulären Tachykardien (Torsade de pointes) kommen kann. Wegen Todesfällen aufgrund von Herzrhythmusstörungen (QTVerlängerung) wurden Cisapridpräparate in Österreich vom Markt genommen. In einem Fallbericht, von Kyrmizakis et al. beschrieben, wurde eine 47-jährige Patientin, die aufgrund eines gastroösophagealen Reflux mit Cisaprid behandelt wurde und wegen einer akuten Tonsillitis 500mg Erythromycin 4x/Tag für 10 Tage verordnet bekam, an der kardiologischen Abteilung vorstellig. Sie klagte über Herzrasen und wurde mittels EKG überwacht. Wenige Stunden später wurde die Patientin wegen Kammerflimmern defibrilliert. Erythromycin wurde abgesetzt die Patientin wurde mit 250mg Cefuroxim (Cephalosporin) weiterbehandelt. Wenige Tage später ergab eine neuerliche EKGUntersuchung eine Normalisierung und die Patientin war symptomfrei (33). Aufgrund der Schwere der möglichen Wechselwirkungen, sollte Cisaprid nicht zusammen mit Erythromycin bzw. Clarithromycin eingenommen werden. Corticosteroide und Erythromycin/Clarithromycin Eine Studie mit 9 erwachsenen Asthma-Patienten, die mit Methylprednisolon behandelt wurden, wiesen eine um 46% verminderte Steroid-Clearance nach einer einwöchigen Therapie mit Erythromycin (1 g/Tag) auf (34). Um Nebenwirkungen zu vermeiden empfiehlt es sich die Dosis von Corticosteroiden während ein Therapie mit Makrolid-Antibiotika zu vermindern. Die Ursache dieser Interaktion wird auf die Fähigkeit von Makrolid-Antibiotika zurückgeführt, CYP 3A4 zu hemmen (30). 17 Digoxin und Erythromycin/Clarithromycin Digoxin, ein häufig eingesetztes Arzneimittel zur Behandlung von chronischer Herzinsuffizienz und Herzrhythmusstörungen, hat eine geringe therapeutische Breite, wodurch es häufig zu Interaktionen mit anderen Arzneimitteln kommen kann. Wegen der Inhibition des Transportproteins P-gp durch Makrolid- Antibiotika kann Digoxin nur in verminderter Menge in das intestinale Lumen transportiert werden, was zu einer erhöhten Bioverfügbarkeit führt. Auch die renale Clearance von Digoxin wird durch den verminderten Transport in das Nierenlumen herabgesetzt (35). Gomes et al. untersuchten in einer Fall–Kontroll–Studie, die 15 Jahre dauerte, den Zusammenhang von Krankenhauseinweisungen aufgrund Digoxin- Intoxikation durch Einnahme von Makrolid- Antibiotika. Die Studie umfasste ein Patientenkollektiv von 327 142, von denen 150 459 männlich waren und alle älter als 66 Jahre. Allen Patienten wurde mindestens einmal Digoxin verschrieben, wobei die durchschnittliche Dauer der Digoxintherapie 1,5 Jahre betrug. 77 349 Patienten wurde während der Digoxintherapie ein Makrolid- Antibiotika mindestens einmal verschrieben. Insgesamt wurden 1 659 Patienten, die aufgrund einer Digoxin-Intoxikikation eingewiesen wurden, und 6 439 Kontrollpatienten untersucht. 48 Patienten starben während des Krankenhausaufenthalts wegen der Digoxinintoxikation. Die Analyse ergab einen direkten Zusammenhang von Digoxinintoxikation und der Behandlung mit Clarithromycin (OR 14,83; 95 % CI 7,8927,86), Erythromycin (OR 3,69; 95 %, CI 1,72-12,52) und Azithromycin (OR 3,71; 95%, CI 1,10-12,52) im Vergleich zur Kontrollgruppe (ohne Antibiotika). Die Wahrscheinlichkeit einer Digoxinintoxikation war mit Clarithromycin 4 mal höher als bei Verabreichung von Erythromycin oder Azithromycin (36). Es empfiehlt sich, während der gleichzeitigen Gabe von Digoxin und MakrolidAntibiotika, vor allem Clarithromycin, auf Überdosierungssymptome, wie Übelkeit, Erbrechen, Schwindel, Müdigkeit, Farbensehen, Gesichtsfeldausfälle, Herzrhythmusstörungen zu achten, die Digoxin Plasmakonzentrationen zu bestimmen und gegebenenfalls die Digoxin Dosis während der Antibiotika-Therapie zu vermindern (37). H1-Blocker der 2.Generation und Erythromycin/Clarithromycin Terfenadin wurde bei allergischen Reaktionen vom Typ I verabreicht, um kompetitiv die Wirkung von Histamin an H1-Rezeptoren zu hemmen. Hohe Konzentrationen von Terfenadin haben in seltenen Fällen zu unerwünschten kardiovaskulären Wirkungen 18 geführt. Über eine Blockade myokardialer Kaliumkanäle kommt es zu einer Verlängerung der QT-Zeit im EKG und zur Ausbildung teilweise schwerwiegender Arrhythmien (15). Honig et al. wiesen in einer Studie mit 9 Probanden eine starke Erhöhung der Serumkonzentration von Terfenadin bei gleichzeitiger Gabe von Erythromycin nach. Im EKG zeigten sich Veränderungen in den QT-Intervallen einiger Probanden (38). Der Mechanismus für diese Interaktion beruht auf einer Hemmung des CYP 3A4, welches auch den Metabolismus von Terfenadin katalysiert (37). Derzeit ist Terfenadin in Österreich als Arzneimittel nicht mehr erhältlich. HMG- CoA Reduktase Hemmer und Erythromycin/Clarithromycin Der Abbau einiger Cholesterol-Synthese-Hemmer wird bei gleichzeitiger Gabe von Erythromycin und Clarithromycin vermindert. Die AUC nach einer einmaligen Applikation von 300mg Cerivastatin stieg in einer Studie von Muck et al. um 21 % nach vorheriger Gabe von 500mg Erythromycin 3 mal pro Tag (39). In einer Fallbeschreibung von Wong et al. zeigte sich vermehrte Muskelschwäche, Myalgien und Anstieg der KreatininkinaseKonzentration, mit der Diagnose Rhabdomyolyse bei gleichzeitiger Einnahme von Lovastatin und Erythromycin (40). Nach 2-tägiger Gabe von Erythromycin (500mg, 3mal/Tag) erhöhte sich in einer Studie von Kantola et al. die AUC von 40 mg Simvastatin um das 6-fache (41). Der Wirkungsmechanismus beruht wahrscheinlich auf der Hemmung von CYP 3A4, welches für den Metabolismus von Simvastatin, Lovastatin und Atorvastatin verantwortlich ist. Diese Statine sollten nicht während einer Behandlung mit Erythromycin oder Clarithromycin verabreicht werden. Für die Dauer einer kurzzeitigen Antibiotika-Therapie besteht die Möglichkeit, Simvastatin für 8 bis 10 Tage abzusetzen. Als Alternativmedikament könnte Rosuvastatin verabreicht werden, da zwischen diesen Medikamenten keine Interaktionen auftreten (42). 19 Hormonelle Kontrazeptiva und Erythromycin/Clarithromycin Östrogene werden während der ersten Leberpassage mit Glucuronsäure konjugiert und gelangen in den Darm, wo sie teilweise durch Darmbakterien gespalten werden und die aktive Form erneut von der Leber aufgenommen werden kann. Breitspektrumantibiotika stehen im Verdacht, die Darmflora zu beeinträchtigen und diesen entero-hepatischen Kreislauf zu unterbrechen. Dadurch werden Östrogene schneller eliminiert (43). Abschließend sei an dieser Stelle darauf hingewiesen, dass in keiner pharmakokinetischen Studie der Beweis erbracht wurde, dass Makrolid- Antibiotika die Konzentration von Kontrazeptiva im Blut verändert (29). Immunsuppresiva und Erythromycin/Clarithromycin Tacrolimus ist ein Immunsuppressivum, welches durch das CYP 3A4 metabolisiert wird. Es hemmt vor allem die Aktivierung von T-Lymphozyten und gehört aus chemischer Sicht zu den Makroliden (15). In der Zeitschrift „Therapeutic Drug Monitoring“ wurde der Fall eines 47-jährigen herztransplantierten Patienten geschildert, der aufgrund eines positiven Helicobacter pylori Tests zusätzlich zu Tacrolimus unter anderem mit Clarithromycin behandelt wurde. Die Serumkonzentration von Tacrolimus stieg nach Einnahme von Clarithromycin deutlich an. Um potentiell toxische Tacrolimus-Konzentrationen zu vermeiden, wurde die Therapie mit Clarithromycin nach 7 Tagen abgebrochen (44). Um Wechselwirkungen zwischen Erythromycin/Clarithromycin und Immunsuppressiva wie Tacrolimus und Antibiotikatherapie Everolimus umsteigen, zu vermeiden, oder die sollte man auf Vollblutkonzentrationen eine alternative der genannten Immunsuppressiva engmaschig kontrollieren (3). Mutterkornalkaloide und Erythromycin/Clarithromycin Durch die Hemmung von CYP 3A4, welches auch Mutterkornalkaloide metabolisiert, kann die Wirkung von Ergotamin und anderen Mutterkornalkaloid-Derivaten verstärkt werden. Dies kann zu verstärkten Gefäßkonstriktionen mit Ischämien und Nekrosen der Extremitäten sowie der Zunge führen. Bei Stoffen, die hauptsächlich als DopaminAgonisten eingesetzt werden, wie Bromocriptin, Cabergolin und Dihydroergocryptin, kann es verstärkt zu Übelkeit, Erbrechen, Blutdruckabfall, Wahrnehmungsstörungen und Dyskinesien kommen (45). Die gleichzeitige Behandlung mit Mutterkornalkaloiden und Makrolid- Antibiotika sollte aus diesem Grund vermieden werden (37). 20 Pimozid und Erythromycin/Clarithromycin Wird Pimozid mit Clarithromycin oder Erythromycin kombiniert verabreicht, kann es durch die Hemmung des CYP 3A4, durch welches Pimozid oxidativ metabolisiert wird, durch die erhöhte Wirkung von Pimozid zu lebensbedrohlichen Zuständen kommen. Flockhart et al. veröffentlichten einen Fallbericht, indem ein tödlicher Ausgang durch die Kombination von Clarithromycin und Pimozid beschrieben wurde (46). Ein 27-jähriger Patient starb 2 Tage nach der kombinierten Verabreichung dieser 2 Medikamente an einem plötzlichen Herztod. Pimozid wird als Alternativpräparat statt Haloperidol zur Behandlung von Tourette-Syndrom eingesetzt. In einer Untersuchung an Kaninchen wurde festgestellt, dass Pimozid dosisabhängig das QT-Intervall verlängern kann. Die Ergebnisse zeigten einen Anstieg von 9,6 –14,6 % (46). Durch die möglichen lebensbedrohlichen Wechselwirkungen zwischen diesen Präparaten, ist die gleichzeitige Anwendung abzulehnen. Theophyllin und Erythromycin/Clarithromycin Bei gleichzeitiger Gabe von Makrolid- Antibiotika mit Theophyllin kann die TheophyllinPlasmakonzentration innerhalb weniger Tage ansteigen. Diese Wechselwirkung beruht wahrscheinlich auf einer Hemmung von CYP 1A2 (30, 31, 47). Durch die geringe therapeutische Breite von Theophyllin sollte auf unerwünschte Wirkungen wie Tachykardie, Übelkeit, Schwindel, Krämpfe und Kopfschmerzen vermehrt geachtet werden. Intoxikationserscheinungen treten bei Plasmakonzentrationen über 20μg/ml auf (29). Clarithromycin interagiert in geringerem Ausmaß als Erythromycin mit Theophyllin (48). Vitamin K Antagonisten und Erythromycin/Clarithromycin Warfarin wird in der Prophylaxe und Therapie von Thrombosen und Thrombembolien nach Operationen bei Vorhofflimmern und Behandlung thrombotischer und thrombophlebitischer Zustände eingesetzt (16). Durch die geringe therapeutische Breite besteht ein Risiko für Blutungen (29). Bachmann et al. beschrieben 1984 in einer Studie eine um 14% verminderte Warfarin Clearance nach einer achttägigen Applikation von 1g Erythromycin (49). In einigen Fallberichten wurden Blutungen als Komplikationen beschrieben (Hämatome, Hämoptyse, Hämorrhagien, Hämaturie), die in der Regel einige Tage nach Beginn der Therapie mit Makroliden auftraten (50-52). Der wahrscheinliche Wirkmechanismus beruht auf einer Hemmung von CYP3A4 durch Erythromycin und einem daraus resultierenden 21 vermindertem Metabolismus von Warfarin. Bei gleichzeitiger Behandlung mit Vitamin K Antagonisten und Makrolid-Antibiotika sollten Blutgerinnungsparameter in den ersten Wochen engmaschiger überwacht werden und eventuell eine Dosisanpassung der Antikoagulantien vorgenommen werden. Tabelle 2: Interaktionen mit Makrolid- Antibiotika Interagierende Substanzen Auswirkungen der Interaktion Makrolid-AB – Carboxamid- Gefahr einer Derivate Carbamazepinintoxikation Makrolid-AB – Digoxin und Gefahr einer Derivate Digoxinintoxikation Makrolid-AB – Verstärkte Wirkung der Mutterkornalkaloide Mutterkornalkaloide Makrolid-AB – Theophyllin Gefahr einer und –Derivate Theophyllinintoxikation Maßnahmen Überwachung/Anpassung Überwachung/Anpassung Vorsichtshalber kontraindiziert Überwachung/Anpassung Verstärkte Wirkung von Makrolid-AB – Ciclosporin Ciclosporin – Einschränkung Überwachung/Anpassung der Nierenfunktion Makrolid-AB – orale Antikoagulantien Makrolid-AB – Benzodiazepine Blutungsgefahr Verstärkte Wirkung der Benzodiazepine Makrolid-AB – Cholesterol- Gefahr von Myopathie oder Synthese-Hemmer Nierenversagen Makrolid-AB – H1-Blocker der 2.Generation Terfenadin, Gefahr von Kontraindiziert Kontraindiziert Herzrhythmusstörungen Verstärkte Immunsuppressive Immunsuppressiva Wirkung Makrolid-AB – Pimozid Überwachung/Anpassung Verstärkte Wirkung von Makrolid-AB – Makrolid-AB – Cisaprid Vorsichtshalber überwachen Gefahr von Herzrhythmusstörungen Gefahr von Herzrhythmusstörungen Überwachung/Anpassung Kontraindiziert Kontraindiziert Modifiziert nach Austria Codex (37) 22 2.2 Doxycyclin Doxycyclin zählt zu der Gruppe der Tetrazykline. Diese sind Breitspektrum- Antibiotika mit bakteriostatischer Wirkung. Die Grundstruktur besteht aus 4 Sechserringen, an welchen Ringsubstituenten gekoppelt sind, durch die die Substanzen unterschieden werden(14). Abb.7 Strukturformel von Doxycyclin Quelle: http://gesundheit.germanblogs.de/wp-content/uploads/2010/06/doxycyclin.jpg Durch passive Diffusion gelangt es durch die äußere Zellmembran des Bakteriums und über aktive Transportvorgänge durch die innere Zytoplasmamembran. Dort verhindern die Tetrazykline die Bindung von Aminoacyl-tRNA an die Akzeptorstellen der Ribosomen, sodass die Peptidkette nicht verlängert werden kann und somit die Proteinsynthese der Bakterien gestört wird (53). 23 Abb. 8 Wirkmechanismus von Tetrazyklinen Quelle: http://www.pharmawiki.ch/wiki/index.php?wiki=Tetrazykline Tetrazykline wirken bakteriostatisch auf gram-positive Bakterien, wie Streptokokken und viele gram-negative Bakterien, wie Neisserien, Yersinien, Brucellen, Haemophilus und Campylobacter Jejuni, sowie Spirochäten (Borrelien, Treponemen). Von klinischer Relevanz ist auch ihre Wirkung gegen intrazelluläre Keime, wie Legionellen, Listerien, Mykoplasmen und Chlamydien (14). Tetrazykline besitzen neben ihrer antibakteriellen Wirkung auch antiinflammatorische, immunsuppressive Eigenschaften. In der Literatur wird eine Hemmung der AntikörperProduktion in Lymphozyten, eine Verminderung der Phagozytose in neutrophilen Granulozyten ebenso wie eine Reduktion der Chemotaxis in Leukozyten und neutrophilen Granulozyten beschrieben (53). In der Zahnheilkunde werden Tetrazyklinpräparate aufgrund ihrer Wirkung auf parodontopathogene Erreger wie Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Fusobacterium nucleatum etc. sowohl lokal (z.B. in Form von Doxycyclinhyclat) als auch systemisch vor allem in der Parodontologie eingesetzt. Doxycyclin wird nach oraler Gabe aufgrund seiner hohen Lipidlöslichkeit mit > 90% sehr gut resorbiert. Aufgrund seiner Lipophilie verteilt sich Doxycyclin nach enteraler Resorption leicht im Körpergewebe. Es wird in der Leber rasch an Glucuronsäure gekoppelt und zum Teil mit der Galle sowie im Urin ausgeschieden (Urinausscheidung rund 25%) (15). 24 2.2.1 Wechselwirkungen von Doxycyclin polyvalente Kationen und Doxycyclin Doxycyclin bildet schwer lösliche Chelate mit Arzneimitteln, welche divalente und trivalente Kationen enthalten (Aluminium, Wismut, Calcium, Eisen, Lanthan, Magnesium, Strontium, Zink) (13). Dadurch kann die Wirkung des Doxycyclins herabgesetzt werden. Als weitere Interaktionsmechanismen kommen eine Erhöhung des pH-Wertes im Gastrointestinaltrakt, Adsorption an unlösbare Antazidapartikel, sowie eine Beeinflussung der Magenentleerung in Frage. Deppermann et al. veröffentlichten 1989 eine Arbeit, in der an 10 gesunden Probanden ein Antazidum (Kombinationspräparat mit 600mg Magnesiumhydroxid und 900 mg Aluminiumhydroxid) in 10 Einzeldosen und einmalig Doxycyclin 200mg peroral appliziert wurden (54). Die Bioverfügbarkeit von Doxycyclin verringerte sich um ca. 85%. Die maximale Serumkonzentration verringerte sich von 2,7mg/l ohne Antazidum auf 0,5mg/l mit Antazidum (54). Zu einem ähnlichen Ergebnis kamen Rosenblatt et al., wobei sich hier bei 15ml Aluminiumhydroxid die Serumkonzentration von Doxycyclin um nahezu 100% verringerte (55). Neuvonen und Penttilä verabreichten in einer doppel-blinden Studie 400mg Eisensulfat pro Tag und nach weiteren 3 Tagen 200mg Doxycyclin (56). Eine Bestimmung der Serumkonzentration von Doxycyclin ergab 20 - 45 % geringere Werte während der kombinierten Behandlung mit Eisen und Doxycyclin, als in der Plazebo- Gruppe, welche kein Eisensulfat erhielt. Die Halbwertszeit einer einzelnen intravenösen Dosis von 100 mg Doxycyclin verkürzte sich von 16,6 Stunden auf 11 Stunden. Doxycyclin und polyvalente Kationen sollten daher mit einem möglichst großen Zeitabstand versetzt eingenommen werden (56). Antidiabetika und Doxycyclin Bei Behandlung mit Doxycyclin wurde in einem Fallbericht von einer Hypoglykämie berichtet. Bei einem 19- jährigen Patienten mit Marfan- Syndrom wurde eine seit 7 Monaten bestehende Hypoglykämie auf die Einnahme von Doxycyclin (100mg/Tag) zurückgeführt (57). Der Mechanismus, durch welchen Doxycyclin eine Hypoglykämie induziert, ist unklar. Aus diesem Grund empfiehlt sich eine sorgfältige Überwachung von Diabetikern während einer erforderlichen Doxycyclin-Therapie (57). 25 Antiepileptika und Doxycyclin Die antimikrobielle Wirksamkeit von Doxycyclin kann durch enzym-induzierende Antiepileptika durch beschleunigten Metabolismus abgeschwächt werden. Bei gleichzeitiger Behandlung mit solchen Enzym-Induktoren müssen die Patienten sorgfältig auf die antimikrobielle Wirksamkeit von Doxycyclin überwacht werden (37). Penttilä et al. führten ein Studie an Patienten mit Epilepsie oder Trigeminus-Neuralgie, welche mit Phenytoin und/oder Carbamazepin behandelt wurden, durch (58). Alle Patienten erhielten über mehrere Monate eine antiepileptische Therapie, bevor sie eine einmalige Dosis von 100mg Doxycyclin intravenös appliziert bekamen. Die Halbwertszeit von Doxycyclin in einer Kontrollgruppe ohne medikamentöse Therapie betrug 15,1 Stunden. Dieser Wert war bei der mit Phenytoin behandelten Gruppe mit 7,2 Stunden bzw. mit 8,4 Stunden bei der mit Carbamazepin behandelten Gruppe signifikant kürzer. Die niedrigste Halbwertszeit mit 7,4 Stunden wurde bei der Gruppe gemessen, die sowohl Phenytoin als auch Carbamazepin einnahm (58). Antikoagulantien und Doxycyclin Grundsätzlich verändern Antibiotika die intestinale Flora. Durch die veränderte Darmflora während der antibiotischen Therapie kann es zu verminderter Bildung von Vitamin K kommen und somit werden weniger Vit.-K-abhängige Blutgerinnungsfaktoren (II, VII, IX, X) gebildet, was sich wiederum in einer gesteigerten Blutungsneigung äußert (59). Baciewicz beschrieb in einem Fallbericht eine Patientin mit seit 3 Tagen bestehenden abdominalen Schmerzen Computertomographie im gestellten, linken unteren Diagnose einer Quadranten mit retroperitonealer der, Blutung nach (60). Anamnestisch ergab sich eine seit Jahren bestehende Therapie mit einem Warfarinpräparat und Einnahme von 100mg Doxycyclin 6 Tage vor der Einweisung (60). Bei gleichzeitiger Behandlung mit oralen Antikoagulantien und Doxycyclin muss auf Anzeichen von Blutungen geachtet und Blutungsparameter besonders sorgfältig kontrolliert werden. 26 Barbiturate und Doxycyclin Barbiturate haben aufgrund ihrer geringen therapeutischen Breite ihre Bedeutung als Schlafmittel in Österreich verloren. Der Einsatz von Barbituraten beschränkt sich auf spezifische Indikationen, wie z.B. als Antagonisten bei konvulsiv wirkenden Substanzen wie DDT, Strychnin, usw. (15). Neuvonen und Penttilä veröffentlichten 1974 im British Medical Journal eine Studie, in der sie die Wirkung von Barbituraten auf die Serumkonzentration von Doxycyclin untersuchten (61). Hierfür wurde an 5 Probanden Doxycyclin 100mg intravenös verabreicht und anschließend die Serumkonzentration gemessen. Danach wurde denselben 5 Probanden zusätzlich zur einmaligen Doxycyclinapplikation für 10 Tage 3 mal 50mg Phenobarbital verabreicht und nach 10 Tagen wiederum die Serumkonzentration von Doxycyclin gemessen. Bei 5 weiteren Probanden, welche schon über einen längeren Zeitraum Barbiturate nahmen, wurde ebenfalls die Serumkonzentration von Doxycyclin nach einer einmaligen Dosis von 100mg intravenös gemessen. Die Halbwertszeit von Doxycyclin betrug in dieser Gruppe durchschnittlich 7,7 Stunden. Die Halbwertszeit in der Gruppe, in welcher keine Barbiturate verabreicht wurden, betrug 15,3 Stunden bzw. nach 10 tägiger Applikation von Phenobarbital 11,1 Stunden (61). Der genaue Wirkmechanismus ist nicht bekannt, da Phenobarbital viele metabolische Enzyme und Transportproteine induziert. Digoxin und Doxycyclin Digoxinderivate werden bei ca. 10 % aller Menschen durch Darmbakterien zu inaktiven Digoxin- Reduktionsprodukten abgebaut. Antibiotika beeinträchtigen diese Darmbakterien, sodass weniger Digoxin reduziert wird und die Digoxin-Plasmakonzentration ansteigt. Lindenbaum et al. veröffentlichten 1981im New England Journal of Medicine eine Studie, bei der gesunden Probanden während einer 22 - 29-tägigen Applikation von Digoxin nach 17 Tagen oral Doxycyclin verabreicht wurde (62). Die Konzentration von DigoxinReduktionsprodukten (DRP) im Harn fiel von ca. 100 μg/24 h auf 1,8 μg/24 h. Die SerumDigoxinkonzentration stieg von 0,72 ng/ml auf 1,03 ng/ml an (62). Werden digitalisierte Patienten mit Doxycyclin behandelt, muss vermehrt auf Überdosierungssymptome (Übelkeit, Erbrechen, Schwindel, Farbensehen, Herzrhythmusstörungen) geachtet werden und die Digoxin- Dosis nach Bedarf angepasst werden (37). 27 Methotrexat und Doxycyclin Tortajada-Ituren et al. veröffentlichten ein Fallbeispiel, in welchem eine Arzneimittelwechselwirkung zwischen Doxycyclin und hochdosiertes Methotrexat (MTX) auftrat (63). Ein 17- jähriges Mädchen bekam aufgrund eines Osteosarkoms im linken Femur hochdosiert MTX. Wegen eines Abszesses im linken Auge, erhielt die Patientin eine systemische Therapie mit Doxycyclin 100mg alle 12 Stunden. Die Plasmakonzentration von MTX wurde standardmäßig überprüft, um die „Leukovorin- Rescue“ zu bestimmen. Die biologische Halbwertszeit 12 bzw. 24 Stunden nach der Infusion offenbarte ein hohes Intoxikations-Risiko. Die Patientin entwickelte anschließend hämatologische und gastrointestinale Symptome einer Intoxikation und wurde für 11 Tage stationär aufgenommen. Als Ursache der Interaktion wird die Verdrängung von MTX aus den Plasmaproteinbindungsstellen diskutiert. Diese Wechselwirkung ist nur im oben genannten Fall geschildert und daher kann ihre Relevanz noch nicht sicher eingeschätzt werden (63). 28 Tabelle 3: Interaktionen mit Doxycyclin Interagierende Substanzen Auswirkungen der Interaktion Tetrazykline – orale Gesteigerte Antikoagulantien Blutungsneigung Maßnahmen Vorsichtshalber überwachen Anstieg der Tetrazykline – Digoxin und Digoxinkonzentration Derivate Überwachung/ Anpassung Überdosierungssymptome Tetrazykline – polyvalente Kationen Tetrazykline – Enzyminduktoren Herabgesetzte Doxycyclinwirkung durch Chelatbildung Herabgesetzte Hypoglykämie Tetrazykline – Methotrexat Intoxikationsrisiko Tetrazykline – Gefahr einer peripheren Mutterkornalkaloide Vasokonstriktion Tetrazykline – Calciumhaltige Nahrungsmittel Überwachung/ Anpassung Doxycyclinwirkung Tetrazykline – Antidiabetika Tetrazykline – Retinoide Überwachung/ Anpassung Erhöhte Inzidenz von Vorsichtshalber überwachen Vorsichtshalber überwachen Vorsichtshalber überwachen Kontraindiziert Hirndrucksteigerung Herabgesetzte Doxycyclinwirkung durch Überwachung/ Anpassung Chelatbildung Modifiziert nach Austria Codex (37) 29 2.3 Metronidazol Metronidazol gehört zu der Gruppe der Nitroimidazole, die chemisch synthetisch hergestellt werden. Wie in Abb. 1 ersichtlich wird, haben die Nitroimidazole als Grundgerüst einen Imidazolring und eine Nitro-Gruppe in der 5-Position (15). Metronidazol wirkt bakterizid durch Hemmung der Nukleinsäuresynthese. Abb. 9 Strukturformel von Metronidazol Quelle: http://www.theodora.com/drugs/images/597.jpg Metronidazol wird als Prodrug absorbiert und mittels passiver Diffusion kann es in die Zelle penetrieren. Im sauerstoffarmen Milieu kommt es durch Reduktion der Nitro-Gruppe zur Aktivierung des Pharmakons und es bilden sich reaktive Metaboliten, die DNAStrangbrüche verursachen und somit zum Zelltod führen. (53) Aus zahnmedizinischer Sicht ist es lediglich in der Parodontologie von Bedeutung. Das Wirkspektrum beschränkt sich auf gram-negative Anaerobier und Spirochäten, welche sich vor allem bei Parodontiden nachweisen lassen (64). In Kombination mit Amoxicillin, als Winkelhoff-Cocktail findet es in der Behandlung von Aggregatibacter actinomycetemcomitans-positiven Taschen Verwendung. 30 2.3.1 Wechselwirkungen von Metronidazol Alkohol und Metronidazol Wird Metronidazol zusammen mit Alkohol eingenommen, kann es zu erhöhter Alkoholunverträglichkeit kommen. Die Mechanismen dieser Interaktion sind noch weitgehend unbekannt, jedoch geht man von einer Hemmung der für den Alkoholabbau verantwortlichen Aldehyddehydrogenase durch Metronidazol aus. Symptomatisch kann sich diese Interaktion durch einen „Disulfiram- Effekt“ äußern. Hierbei kann es zu Flush, Übelkeit, Kopfschmerzen und Blutdruckabfall kommen (3). Cina et al. berichteten über den plötzlichen Herztod einer 31-jährigen Frau nach dem Angriff durch ihren männlichen Begleiter, der sie mehrere Male mit einer Holzbürste auf den Oberarm schlug (65). Die Frau, sie war Alkoholikerin, kollabierte und anschließende Wiederbelebungsversuche waren nicht erfolgreich. Die toxikologische Analyse ergab eine Ethanol-Serumkonzentration von 162mg/dl, die Acetaldehydkonzentration lag bei 4,6 mg/dl. Aufgrund der erhöhten Acetaldehydkonzentration wurden weiters die Disulfiramund die Metronidazol-Konzentrationen bestimmt, wobei die Metronidazol-Konzentration 0,42 mg/l betrug, jedoch kein Disulfiram nachweisbar war (65). Aufgrund dieser möglichen Interaktion mit Alkohol sollte während einer MetronidazolTherapie auf diese Wechselwirkung hingewiesen werden bzw. sollte ganz auf Alkohol verzichtet werden. Antikoagulantien und Metronidazol Durch zeitgleiche Verabreichung von Metronidazol und Antikoagulantien, im speziellen Warfarin, kann die antikoagulente Wirkung von Warfarin verstärkt werden, was zu einer erhöhten Blutungsneigung führen kann. O´Reilly et al. untersuchten an 8 gesunden Personen die Interaktionen zwischen Metronidazol und Warfarin, welches als Racemat verwendet wird (66). Hierbei wurde Warfarin einerseits in Form des Racemats und die aufgespaltenen Enantiomere getrennt in einer einmaligen Dosis verabreicht. Weiteres wurden oral 750 mg Metronidazol pro Tag (die Kontrollgruppe wurde ohne Metronidazol untersucht), 7 Tage vor der Warfaringabe verabreicht. Untersucht und verglichen wurden täglich gemessene Warfarinwerte und die Prothrombinzeit. Die Ergebnisse zeigten bei Metronidazoltherapie eine erhöhte Halbwertszeit des Warfarin- Racemats (von 35 auf 46 Stunden erhöht), S(-) Warfarin zeigte ebenfalls verstärkte antikoagulatorische Wirkung, nur R(+) Warfarin blieb 31 weitgehend unverändert. So könnte diese Arzneimittelwechselwirkung durch Verabreichung von R(+) Warfarin als Langzeittherapie vermieden werden (66). 2006 wurde eine Studie von Kui Zhang et al. veröffentlicht, in der das Blutungsrisiko aufgrund von Warfarininteraktionen mit anderen Arzneimitteln bestimmt wurde (67). Verglichen wurden Patienten, die nur Warfarin einnahmen, mit jenen, die ein weiteres Arzneimittel einnahmen bzw. bei denen während der Studienzeit eine Leberschädigung oder Herzinsuffizienz diagnostiziert wurde. 779 Patienten nahmen Warfarin kombiniert mit Metronidazol ein und bei 177 (22,7 %) Patienten trat eine Blutung auf (67). Barbiturate und Metronidazol Die gleichzeitige Anwendung von Barbituraten und Metronidazol kann zu einer abgeschwächten Wirkung von Metronidazol führen, auch Therapieversagen ist möglich. Phenobarbital induziert das CYP 3A4, wodurch Metronidazol verstärkt metabolisiert wird und die Plasmakonzentration abnimmt. Loft et al. untersuchten 1987 sieben gesunde Freiwillige auf Wechselwirkungen zwischen Metronidazol und Phenobarbital, Cimetidin und Antipyrin (68). Nach der Vorbehandlung mit Cimetidin (1g/Tag – 7 Personen), Phenobarbital (100mg/Tag für 7 Tage, 4 Personen) und Antipyrin (1g/Tag für 7 Tage, 5 Personen) wurde den Freiwilligen 500mg Metronidazol i.v. verabreicht. Blutproben wurden vor der Metronidazol- Gabe und 10, 20, 30, 40, 60, 80 Minuten und nach 2, 3, 5, 8, 12, 16, 24, 36 und 48 Stunden nach Verabreichung von Metronidazol genommen und ausgewertet. Auch der Urin wurde kontrolliert. Bei einer Versuchsperson traten unmittelbar nach Applikation von Metronidazol (nach Phenobarbital-Vorbehandlung) für einige Minuten neurotoxische Symptome auf, der eine etwa 1 Stunde andauernde Hypotension folgte. Die Auswertung ergab keine wesentlichen Veränderungen während der kombinierten Metronidazol-Cimetidin Behandlung, jedoch ergab sich für die Kombination von Metronidazol und Phenobarbital eine um etwa 1,6 fach erhöhte Metronidazol-Clearance, in Kombination mit Antipyrin stieg die MetronidazolClearance auf das 1,9 fache an (68). Aufgrund dieser Interaktion sollte während einer kombinierten Therapie die Plasmakonzentration von Metronidazol überwacht werden, und gegebenenfalls eine Dosisanpassung erfolgen (37). 32 Corticosteroide und Metronidazol Bei gleichzeitiger Therapie von Metronidazol mit Corticosteroiden kann die Ausscheidung von Metronidazol verstärkt werden, und somit kommt es zu einer abgeschwächten Wirkung von Metronidazol. Eradiri et al. untersuchten die Wechselwirkung von Metronidazol und Prednison an 6 Morbus Crohn erkrankten Patienten (69). Den Patienten wurde zuerst Metronidazol peroral 500mg/Tag verabreicht und danach 20 mg Prednison. Die kombinierte Therapie führte zu einer erhöhten Clearance und einer deutlich erniedrigten AUC (69). Tabelle 4: Interaktionen mit Metronidazol Interagierende Substanzen Nitroimidazol-Derivate – orale Antikoagulantien Auswirkungen der Interaktion Blutungsgefahr Nitroimidazol-Derivate – Erhöhte Ethanol Alkoholunverträglichkeit Nitroimidazol-Derivate – Disulfiram Gefahr von akuten Psychosen Maßnahmen Überwachung/Anpassung Vorsichtshalber kontraindiziert Überwachung/Anpassung Erhöhte Metronidazol – Lithiumsalze Lithiumkonzentrationen bis zur Vorsichtshalber überwachen Lithiumintoxikation Nitroimidazole – Herabgesetzte Enzyminduktoren (CYP 3A4) Nitroimidazolwirkungen Metronidazol – Propylenglycol Erhöhte Alkoholunverträglichkeit Vorsichtshalber überwachen Überwachung/Anpassung Modifiziert nach Austria Codex (37) 33 2.4 Ciprofloxacin Ciprofloxacin zählt zu der Gruppe der Fluorchinolone. Abb.10 Strukturformel von Ciprofloxacin Quelle: www.arzneistoffe.net/Ciprofloxacin.html Aufgrund ihrer hemmenden Wirkung auf die bakterielle DNA-Gyrase wurde diese Substanzgruppe früher auch als Gyrasehemmer bezeichnet. Um den DNA-Faden platzsparend in der Bakterienzelle unterzubringen, muss dieser sehr eng und dennoch funktionell günstig mehrfach verdrillt werden. Hierzu wird die DNA-Doppelhelix an der Oberfläche eines RNA-Kerns durch das Enzym Topoisomerase II (auch DNA-Gyrase genannt) zu Schleifen gefaltet (sogenannte „supercoils“) und durch gezielt induzierte Brüche und Wiederverknüpfungen spiralig verdrillt. (70). 34 Ciprofloxacin blockiert die Topoisomerase II in dem Stadium, in welchem die DNAStränge unterbrochen sind. Abbildung 11: a) Entfaltetes bakterielles Chromosom ohne „Überhelices"; b) Gyrase bildet „Überhelix "; c) durch „Überhelices " verdichtetes bakterielles Chromosom Die Fluorchinolone werden zur Unterscheidung in deren Anwendungsbereichen in 4 Gruppen unterteilt, wobei Ciprofloxacin zur Gruppe 2 zählt (14). Gruppe 1: Harnwegstherapeutika. Zu diesen zählen unter anderem Norfloxacin und Enoxacin. Wegen ihrer schlechten Gewebegängigkeit werden sie nur bei der Behandlung von Harnwegsinfekten eingesetzt Gruppe 2: Standardchinolone. Zu diesen werden Ciprofloxacin und Ofloxacin gezählt. Sie weisen eine stärkere Wirkung und ein breiteres Wirkspektrum auf. Ciprofloxacin wirkt gegen gram-negative Erreger, wie Haemophilus-, SalmonellaSpezies und Pseudomonaden. Hingegen weisen sie nur geringe Wirkung gegen Staphylokokken, Streptokokken und zellwandlose Bakterien auf. 35 Gruppe 3: Zur Gruppe 3 zählt unter anderem Levofloxacin, das aktive Enantiomer von Ofloxacin, welches eine stärkere Wirkung gegen grampositive und zellwandlose Bakterien aufweist. Gruppe 4: Zum Beispiel Moxifloxacin wird zu dieser Gruppe gezählt. Moxifloxacin wirkt noch stärker gegen grampositive und intrazelluläre Keime, hat aber auch eine Wirkung gegen Anaerobier. In der Zahnheilkunde wird Ciprofloxacin unter anderem bei chronischer Sinusitis aufgrund seiner guten Wirkung gegen Morganella katharralis und Pseudomonas aeruginosa empfohlen (71), sowie in der Therapie von parodontalen Infektionen mit Beteiligung von Aggregatibacter actinomycetemcomitans (30). 36 2.4.1 Wechselwirkungen von Ciprofloxacin Antidiabetika und Ciprofloxacin Glibenclamid, ein Sulfonylharnstoff der 2. Generation wird durch ein CYP 3A4 Isoenzym verstoffwechselt, welches auch von Ciprofloxacin inhibiert wird. In einem Fallbericht von Roberge et al. spiegelte sich diese Interaktion durch Verwirrtheit und undeutliche Sprache einer 89- jährigen Patientin 2 Stunden nach dem Abendessen wieder (72). Nachdem ein niedriger Blutzuckerspiegel gemessen wurde, erhielt die Patientin 2 mg Glucagon intramuskulär, wodurch es innerhalb einiger Minuten zu einer deutlichen Besserung der Symptome kam. Anamnestisch ergab sich neben anderen Krankheiten Altersdiabetes, der mit 5 mg Glibenclamid pro Tag therapiert wurde. Die Patientin wurde 7 Tage zuvor aufgrund einer akuten Cystitis mit Ciprofloxacin 500 mg/Tag in 2 Einzeldosen behandelt. Nach Ausschluss anderer Erkrankungen diagnostizierte man eine therapieresistente Hypoglykämie (72). Mohr et al. untersuchten Dysglykämien an insgesamt 17 108 Patienten, die mit Fluorchinolonen behandelt wurden (73). Von den 545 Patienten, welche Ciprofloxacin einnahmen zeigte keiner Blutzuckerwerte über 200mg/dl oder unter 50mg/dl innerhalb eines Zeitintervalls von 72 Stunden nach Applikation (73). Patienten unter Antidiabetikatherapie, welche gleichzeitig Ciprofloxacin erhalten, sollten in den ersten 3 Tagen besonders sorgfältig auf den Blutzuckerspiegel achten. Antikoagulantien und Ciprofloxacin Bei gleichzeitiger Verabreichung von Antikoagulantien und Ciprofloxacin kann es zu einer verstärkten blutgerinnungshemmenden Wirkung kommen. Ellis et al. berichteten 2000 von einer Ciprofloxacin - Warfarin – Wechselwirkung in 2 Fällen (74). Eine 50-jährige Patientin, die aufgrund einer rheumatoiden Arthritis und vorangegangenem Schlaganfall mit Warfarin antikoaguliert wurde, bekam wegen des Verdachts auf einen Harnwegsinfekt Ciprofloxacin 500mg (2 x/Tag) verschrieben. Nach 2 Tagen wurde sie mit zusätzlichen Beschwerden, wie Lethargie, Übelkeit und Schmerzen im frontalen Kopfbereich vorstellig. Es wurde ein bilaterales subdurales Hämatom diagnostiziert und die Prothrombinzeit lag bei 36,5s, der INR 8,8. In einem zweiten Fall wird über einen 50-jährigen Patienten berichtet, der aufgrund künstlicher Herzklappen antikoaguliert wurde. Wegen unstillbaren Nasenblutens wurde der Patient im Krankenhaus vorstellig, woraufhin eine Prothrombinzeit von 81,2 und ein INR von 53,9 gemessen 37 wurden. Vier Tage zuvor hatte der Patient Ciprofloxacin 750 mg verschrieben bekommen. Nach entsprechenden Maßnahmen konnten beide Patienten wieder auf deren normale Blutgerinnung eingestellt werden (74). Fischer et al. untersuchten in einer Studie an 134 637 Patienten, die mit Warfarin behandelt wurden, gastrointestinale Blutungen in Zusammenhang mit Antibiotika-Therapie (75). Behandlungen mit Ciprofloxacin zeigten eine erhöhte Inzidenz von Blutungen bei gleichzeitig stattfindender Warfarin-Therapie (75). In der Studie von Bianco et al. wurde keine Wechselwirkung zwischen Ciprofloxacin und Warfarin nachgewiesen (76). Hierbei wurde 16 mit Warfarin antikoagulierte Patienten für 10 Tage Ciprofloxacin 500mg verabreicht. Die Kontrollgruppe erhielt ein Plazebo 2 mal pro Tag. Bei der anschließenden Messung der INR-Werte ergaben sich keine wesentlichen Unterschiede zu der Plazebo-Gruppe (76). Ciclosporin und Ciprofloxacin Da Ciprofloxacin durch das CYP 3A4 Isoenzym, ebenso wie Ciclosporin, metabolisiert wird, kann es zwischen diesen beiden Medikamenten zu Arzneimittelinteraktionen kommen. In einem Fallbericht von Borrás- Blasco et al. wurde ein Anstieg der Serumkonzentration von Ciclosporin nach Ciprofloxacin- Therapie beobachtet (77). An einem 38-jährigen Mann mit erworbener isolierter aplastischer Anämie und einer deshalb durchgeführten Ciclosporintherapie wurde nach Fieber assoziiert mit einem nicht genauer benannten gastrointestinalen Leiden eine Therapie mit Ciprofloxacin 250mg i.v. durchgeführt. Daraufhin erhöhte sich die Serumkonzentration von Ciclosporin von 120 ng/ml auf 297 ng/ml. Nach Beendigung der Ciprofloxacin- Therapie erreichte die Ciclosporin-Serumkonzentration wieder einen Wert von unter 120 ng/ml (77). Aus diesem Grund wird bei gleichzeitiger Behandlung mit Ciprofloxacin und Ciclosporin eine genaue Beobachtung der Konzentration von Ciclosporin empfohlen. 38 Clozapin und Ciprofloxacin Brouwers et al. berichteten von zwei Patienten, bei denen sich eine Arzneimittelinteraktion unter der Therapie von Clozapin und Ciprofloxacin zeigte (78). Ein 46 jähriger Patient, der täglich 900 mg Clozapin einnahm, wurde wegen einer Sepsis ins Krankenhaus eingeliefert. Dort erhielt er für fünf Tage Ciprofloxacin und Amoxicilin. Zwei Tage nach Beendigung seiner antimikrobiellen Therapie, entwickelte der Patient Symptome einer Rhabdomyolyse. Die Therapie mit Clozapin wurde unterbrochen und Messungen der Serumkonzentration ergaben eine stark erhöhte Plasmakonzentration von Clozapin. Der zweite Patient nahm täglich 300 mg Clozapin ein, und wurde im Krankenhaus wegen des Verdachts einer Pneumonie oder eines urogenitalen Infektes mit Ciprofloxacin behandelt. Messungen seiner Clozapin Serumkonzentration einen Tag vor Beginn der antimikrobiellen Therapie bzw. 3 Tage danach ergaben eine Verdoppelung seiner Serumkonzentration während dieser Zeitspanne. Diese Wechselwirkung beruht auf einer Hemmung von CYP 1A2 und einer dadurch verminderten Metabolisierung von Clozapin. Da es zu schwerwiegenden unerwünschten Wirkungen kommen kann, empfiehlt sich der Gebrauch eines anderen antimikrobiellen Wirkstoffes oder die Reduzierung und sorgfältige Kontrolle der Serumkonzentration von Clozapin (78). Nicht-steroidale Antiphlogistika und Ciprofloxacin Ciprofloxacin inhibiert die Bindung von γ-Aminobuttersäure (GABA) zum GABAa – Rezeptor und ist dadurch verantwortlich für eine erhöhte Erregbarkeit des ZNS, sowie Unruhe, Schlafstörungen und Benommenheit. Einige NSAID verstärken die Blockierung des GABAa- Rezeptors (79). In einer Studie von Iqbal et al. zeigte sich bei kombinierter Einnahme von Ciprofloxacin und Diclofenac eine erhöhte maximale Serumkonzentration, erhöhte AUC und geringere Zeit bis zum Erreichen der maximalen Serumkonzentration (80). Bei dieser Studie wurde 12 gesunden Freiwilligen eine Einzeldosis Ciprofloxacin 500mg und Diclofenac 50mg oral verabreicht. Es wurden Blutproben nach 0,5, 1,2,3,4,6,8,10,12,16 und 24 Stunden post applikationem genommen und die Serumkonzentration von Ciprofloxacin bestimmt. Die maximale Serumkonzentration stieg von 2,5 μg/ml bei alleiniger Ciprofloxacin-Einnahme auf 3,9 μg/ml bei kombinierter Ciprofloxacin und Diclofenac Verabreichung an (80). Bei Patienten mit Epilepsie oder anderen Krankheiten des ZNS sollte die Kombination von Ciprofloxacin mit NSAIDs möglichst vermieden werden. 39 Phenytoin und Ciprofloxacin Durch die gleichzeitige Gabe von Ciprofloxacin und Phenytoin kann es durch herabgesetzte Serumkonzentrationen von Phenytoin zu einer verminderten Anfallskontrolle kommen. In einer Studie erhielten 7 gesunde Freiwillige 200mg Phenytoin am Tag (81). An Tag 9 wurde die Serumkonzentration von Phenytoin ermittelt und ab dem 10. Tag bekamen die Probanden 500mg Ciprofloxacin 2 mal am Tag. Eine neuerliche Messung des Phenytoin Blutspiegels am 14. Tag ergab keine signifikanten Unterschiede zwischen der maximalen Serumkonzentration und der AUC. An einem Probanden zeigte sich jedoch eine deutlich verminderte AUC und geringere maximale Serumkonzentration von Phenytoin. Ciprofloxacin scheint bei manchen Patienten ein gewisses Potential zu haben, die Elimination von Phenytoin zu beschleunigen (81). Polyvalente Kationen und Ciprofloxacin Gleichzeitige orale Applikation von polyvalenten Kationen (wie Al3+, Mg2+ und Ca2+ in Antazida sowie andere Arzneimittel, die zwei- oder dreiwertige Metallionen enthalten) und Ciprofloxacin vermindern die Absorption von Fluorchinolonen, was somit zu einer verminderten Serumkonzentration dieser Arzneimittelgruppe führt. Man vermutet, dass bestimmte funktionelle Gruppen des Antibiotikums mit polyvalenten Kationen unlösliche Chelate bilden, die schlechter resorbiert werden können (3). Miyata et al. veröffentlichten in einer Studie ein Modell, um diese ArzneimittelWechselwirkungen besser vorherzusagen und ein optimales zeitliches Intervall zwischen der Verabreichung dieser Arzneimittelgruppen zu erstellen (82). Um 90 % eines oral verabreichten Ciprofloxacinpräparates sicher absorbieren zu können, empfiehlt sich Ciprofloxacin entweder 4,5 Stunden nach bzw. 1 Stunde vor Applikationen von Substanzen mit polyvalenten Kationen zu verabreichen (82). 40 Sevelamer und Ciprofloxacin Sevelamer ist ein Arzneistoff aus der Gruppe der Phosphatbinder, der bei Hyperphosphatämie zur Bindung von Phosphaten aus der Nahrung eingesetzt wird. Die orale Bioverfügbarkeit von Ciprofloxacin ist bei gleichzeitiger Gabe mit Sevelamer stark vermindert. Kays et al. untersuchten in einer randomisierten Studie an 15 gesunden Probanden die Auswirkungen von Sevelamer und Calciumacetat auf die orale Bioverfügbarkeit von Ciprofloxacin (83). Die orale Bioverfügbarkeit von Ciprofloxacin verminderte sich um 48 % bei gleichzeitiger Gabe von Sevelamer bzw. um 51 % bei der Kombination mit Calciumacetat. Als Interaktionsmechanismus wird eine herabgesetzte Absorption von Ciprofloxacin durch Sevelamer diskutiert. Durch diese Reduktion der Bioverfügbarkeit von Ciprofloxacin bei gleichzeitiger Einnahme von Sevelamer sollte es mindestens 1 Stunde vor bzw. 3 Stunden nach der Sevelamerapplikation eingenommen werden (83). Theophyllin/Koffein und Ciprofloxacin Die Wirkung von Theophyllin und Koffein kann durch Ciprofloxacin, aufgrund einer Hemmung von CYP 1A2, verstärkt werden. Batty et al. zeigten in einer Studie eine um 19 % verminderte Clearance von Theophylline und einen Anstieg der Halbwertszeit um 26 % bei gleichzeitiger Gabe mit Ciprofloxacin (84). Symptome wie Herzklopfen, Erbrechen, Tachykardie und Unruhe können vermehrt, meist innerhalb von drei Tagen auftreten (84). Bei gleichzeitiger Applikation von Theophylline und Ciprofloxacin muss auf Theophyllinintoxikationssymptome geachtet werden. Koffein ist in seiner Struktur dem Theophyllin ähnlich, weswegen es an dieser Stelle zusammen mit Theophyllin abgehandelt wird. Healy et al. untersuchten an 10 gesunden Freiwilligen die Auswirkung von Ciprofloxacin auf Koffein (85). Die Halbwertszeit von Koffein verlängerte sich von 5,2 auf 8,2 Stunden, während sich die Elimination von 106ml/min auf 58,2ml/min per 1,73 m2 verringerte. Patienten sollen koffeinhältige Arzneiund Nahrungsmittel bei gleichzeitiger Ciprofloxacineinnahme nach Möglichkeit meiden (85). 41 Tizanidin und Ciprofloxacin Tizanidin gehört zu den zentral angreifenden Muskelrelaxantien und wird in der Zahnheilkunde gerne zur Behandlung von schmerzhaften Verspannungen der Kaumuskulatur angewendet. Es wird hauptsächlich durch das CYP 1A2, welches durch Ciprofloxacin gehemmt wird, metabolisiert. In einer randomisierten Doppel-Blind-Studie von Granfors et al. wurde an 10 gesunden Freiwilligen Ciprofloxacin 500mg (2x1) für 3 Tage verabreicht (86). Am dritten Tag wurde eine Stunde nach der Ciprofloxacineinnahme eine Einzeldosis Tizanidin 4mg appliziert. Die maximale Serumkonzentration von Tizanidin stieg um 660 % bei gleichzeitiger Einnahme von Ciprofloxacin, im Vergleich zu einer Plazebo- Gruppe. Durch die starke Erhöhung der Plasmakonzentration von Tizanidin können die unerwünschten Wirkungen des zentralen Muskelrelaxans vermehrt auftreten: Blutdruckabfall, Bradykardie, Mundtrockenheit, Müdigkeit, Benommenheit und Schwindel. Um schwerwiegende Folgen auszuschließen, ist die gleichzeitige Behandlung mit Tizanidin und Ciprofloxacin vorsichtshalber kontrindiziert (86). 42 Tabelle 5: Interaktionen mit Ciprofloxacin Interagierende Substanzen Gyrasehemmer – orale Antikoagulantien Auswirkungen der Interaktion Blutungsgefahr Maßnahmen Überwachung/Anpassung Gyrasehemmer – Theophyllin Verstärkte Wirkung von und –Derivate Theophyllin Gyrasehemmer – polyvalente Herabgesetzte Wirkung der Kationen Gyrasehemmer Gyrasehemmer – Koffein Verstärkte Koffeinwirkung Vorsichtshalber kontraindiziert Ciprofloxacin – Hydantoine Verminderte Hydantoinwirkung Überwachung/Anpassung Gyrasehemmer – Verminderte Wirkung der Calciumhaltige Nahrungsmittel Gyrasehemmer Gyrasehemmer –Ciclosporin Gyrasehemmer – Antidiabetika Gyrasehemmer – Tizanidin Gyrasehemmer – Duloxetin Erhöhte Ciclosporinkonzentrationen Hypoglykämie (selten Hyperglykämie) Verstärkte Wirkung von Tizanidin Verstärkte Wirkung von Duloxetin Ciprofloxacin – Furosemid, Verminderte Ciprofloxacin- Sevelamer Wirkung Gyrasehemmer – NSAIDs Erhöhtes Krampfanfalls- Risiko Ciprofloxacin – Clozapin, Verstärkte Wirkung von Olanzapin Clozapin,Olanzapin Gyrasehemmer – MelatoninAgonisten Gyrasehemmer – Clopidogrel Überwachung/Anpassung Überwachung/Anpassung Überwachung/Anpassung Vorsichtshalber überwachen Vorsichtshalber überwachen Vorsichtshalber kontraindiziert Vorsichtshalber kontraindiziert Überwachung/Anpassung Bei Risikofaktor Überwachung/Anpassung Vorsichtshalber überwachen Erhöhte MelatoninBioverfügbarkeit, verstärkte Vorsichtshalber kontraindiziert Schläfrigkeit Verminderte cardioprotektive Wirkung von Clopidogrel Vorsichtshalber kontraindiziert Modifiziert nach Austria Codex (37) 43 3 Diskussion Mit zunehmendem Alter eines Patienten steigt auch die Zahl seiner Erkrankungen sowie die Anzahl der applizierten Medikamente. Durch eine steigende Anzahl an verabreichten Medikamenten vergrößert sich auch die Anzahl der möglichen Arzneimittelinteraktionen eines Patienten. Obwohl es zahlreiche antimikrobielle Präparate für die Behandlung von lokalen und systemischen Infektionen gibt, findet nur eine begrenzte Anzahl dieser Medikamente routinemäßige Anwendung in der Zahnheilkunde. Bei der zahnärztlichen Antibiotikatherapie von odontogenen Infektionen werden diese für die durchschnittliche Dauer von 5 - 10 Tagen verordnet (87). Dieser scheinbaren Sicherheit, durch den limitierenden Faktor einer relativ begrenzten Menge an Arzneimitteln, sei die vergleichsweise lange Dauer der Antibiotikaeinnahme gegenübergestellt, wodurch ein beachtliches Interaktionspotential mit anderen Medikamenten zustande kommt. Vor allem bei Patienten, die aufgrund ihrer Multimorbidität mehrere Medikamente in Form einer Dauertherapie einnehmen, kann die gleichzeitige Gabe eines Antibiotikums Interaktionen hervorrufen. Nicht alle Arzneimittelinteraktionen sind von klinischer Relevanz, jedoch gibt es ein paar Stoffe, wie zum Beispiel Warfarin oder Erythromycin die sehr häufig unter anderem auch schwerwiegende Interaktionen hervorrufen können. Aufgrund der Schwere der Arzneimittelinteraktionen mit anderen Präparaten, mussten Terfenadin und Cisaprid sogar vom Markt genommen werden. Medikamente, die Wechselwirkungen hervorrufen können, haben meist: Eine geringe therapeutische Breite – die therapeutische und die toxische Dosis liegen eng beieinander Eine steile Dosis-Wirkungs-Kurve Einen hohen first-pass Effekt Die Elimination führt nur über einen Weg, der auch gehemmt werden kann (88). 44 Grundsätzlich können die von Lemmer und Brune beschriebenen MASTER Leitlinien zur Vermeidung bzw. Verminderung der Interaktionen berücksichtigt werden (89): Minimale Arzneimitteldosis Alternative Arzneimittel einsetzen Starten mit niedriger Dosierung – langsame Steigerung Titrieren der Dosierung nach Wirkung Erklärung der möglichen Probleme an den Patienten Regelmäßige Überwachung des Patienten. Im nachfolgenden Abschnitt soll auf den Umgang mit einigen Arzneimittelkombinationen bzw. die Vermeidung von möglichen Interaktionen im Speziellen eingegangen werden. Im klinischen Alltag kann die Notwendigkeit bestehen, einem Patienten mit gut eingestellter Dauertherapie ein Antibiotikum zu verordnen, welches möglicherweise Interaktionsprobleme macht. Wie soll man vorgehen, um solche potentiellen Interaktionen zu vermeiden bzw. zu minimieren, da man sowohl mit der Antibiotika-Therapie als auch mit der bereits vorhandenen Dauertherapie möglicherweise auf wenige Wirkstoffe limitiert ist. HMG-CoA-Reduktase-Inhibitoren werden zur Behandlung von Dyslipidämien, sowie zur Prophylaxe von kardio- und cerebrovaskulären Ereignissen eingesetzt. Patienten mit Erkrankungen aus diesem Formenkreis erhalten teilweise über viele Monate Statine im Sinne einer Dauertherapie. Statine werden, wie bereits erwähnt, über CYP 3A4 verstoffwechselt, ein Enzym, das von Erythromycin und Clarithromycin inhibiert wird. Eine Langzeittherapie mit Statinen ist normalerweise gut verträglich und mit einem geringem Risiko (0,2 pro 1000 Personenjahren) verbunden, eine Rhabdomyolyse zu entwickeln. Wenn die Behandlung von Patienten, welche dauerhaft mit Statinen (wie z.B. Simvastatin) therapiert werden, eine Applikation von Makroliden erfordert, ist es möglich, die Statintherapie für die Dauer der zahnärztlichen Antibiose einfach auszusetzen (90). Diese Vorgangsweise ist jedoch nicht bei allen Medikamenten möglich, da es beim Absetzten der meisten Dauertherapien zu einer Verschlechterung der Grunderkrankung kommen kann. 45 Die gemeinsame Behandlung mit Digoxin und Makrolid- Antibiotika bzw. Doxycyclin weist eine signifikante Erhöhung der Digoxintoxizität auf. Wenn eine Therapie mit Digoxin und einem der soeben genannten Wirkstoffen erforderlich ist, empfiehlt sich eine enge Blutspiegelkontrolle und eventuell eine vorübergehende Dosisanpassung von Digoxin (36). Ein analoges Vorgehen empfiehlt sich auch bei medikamentös immunsupprimierten Patienten (Ciclosporin, Methotrexat, u.a.) bei zeitgleicher Therapie mit Ciprofloxacin, Doxycyclin oder Makrolid- Antibiotika. Antikoagulantien werden zur Prophylaxe und Therapie von Venenthrombosen sowie zur Prävention thrombembolischer Komplikationen bei Herzklappenersatz, Vorhofflimmern, Kardiomyopathien etc. eingesetzt. Oftmals ist es nicht möglich, eine antikoagulatorische Therapie vor einer Antibiotikatherapie einfach abzusetzen. In solchen Fällen empfiehlt es sich, eine Kontrolle der Gerinnungshemmung durch Bestimmung der INR oder anderer Gerinnungsparameter durchzuführen und eventuell eine Dosisanpassung vorzunehmen. Da Arzneimittelinteraktionen unter Umständen bei einigen Diabetes-Medikamenten mit Antibiotikapräparaten auftreten können, sollte während einer kombinierten Therapie mit diesen Medikamenten der Blutzuckerspiegel sorgfältig überwacht werden. Eine Antibiotikatherapie, die nicht länger als 5-10 Tage durchgeführt wird, weist mit oralen hormonellen Kontrazeptiva normalerweise keine signifikanten Interaktionen auf, bzw. sind diese nicht von klinischer Relevanz. Jedoch sollten die Patientinnen aufgrund der Möglichkeit einer Interaktion aufgeklärt werden und eventuell sollte während des Zeitraums der Antibiotikaeinnahme eine andere Verhütungsmethode hinzugefügt werden, um das Risiko eines Therapieversagens zu minimieren (91). Auch auf Alkohol sollte während einer Antibiotikatherapie verzichtet werden, um Interaktionen zu vermeiden. Bei allen anderen Dauermedikationen hilft nur die Kenntnis über mögliche Interaktionen und aufgrund dessen sollte engmaschig vermehrt auf Symptome von Wirkungsverstärkungen oder -verminderungen geachtet werden. 46 4 Literaturverzeichnis (1) Pschyrembel Klinisches Wörterbuch; Walter de Gruyter- Verlag (2002); 259. Auflage (2) Beubler E.; Kompendium der Pharmakologie. Gebräuchliche Arzneimittel in der Praxis.; Wien: Springer-Verlag (2006). (3) Stockley I.H., Baxter K.; Stockley´s drug interactions; 8. Auflage (2007); Pharmaceutical Press. (4) GKK Medinfo. Arzneimittelinteraktionen. Neue Mechanismen und klinische Relevanz.; 16.Jg. (2006); Nr.6; elektronische http://www.stgkk.at/mediaDB/MMDB115343_MedInfo6_06_0.pdf Referenz; am 08.09.2010. (5) Yagiela J.A., Neidle E.A., Dowd F.J.; Pharmacology and therapeutics for dentistry; 4th ed. St. Louis: Mosby-Year Book (1998). (6) Bovill J.G.; Adverse drug interactions in anesthesia; Journal of Clinical Anesthesia (1997); 9:3–13. (7) Wood M.; Pharmacokinetic drug interactions in anaesthetic practice; Clinical Pharmacokinetics (1991); 21:285–307. (8) Greenlaw C.W.; Evaluation of a computerized drug interaction screening system; American Journal of hospital pharmacy (1981); 38(4):517-21. (9) Ammon H.P.T.; Arzneimittelneben- und –wechselwirkungen, Ein Handbuch und Tabellenwerte für Ärzte und Apotheker (Gebundene Ausgabe); 4.Auflage (2001); Wissenschaftliche Verlagsgesellschaft. (10) Puckett W.H., Visconti J.A.; An epidemiological study of the clinical significance of drug-drug interaction in a private community hospital; American Journal of hospital pharmacy (1971); 28:247. (11) Pirmohamed M., James S., Meakin S., Green C., Scott A.K., Walley T.J., Farrar K., Park B.K., Breckenridge A.M.; Adverse drug reactions as cause of admission to hospital: prospective analysis of 18 820 patients; British Medical Journal (2004); Jul 3;329(7456):15-9. (12) http://www.med.unimagdeburg.de/fme/institute/ikp/publikationen/publikatione n2005/apothekenmagazin72.pdf am 09.09.2010. (13) 47 (14) Hersh E.V. and Moore P.A.; Adverse drug interactions in dentistry; Periodontology 2000 (2008); 46:109–142. (15) Mutschler E., Geislinger G., Kraemer H.K. et al; Mutschler Arzneimittelwirkungen kompakt; Basiswissen, Pharmakologie und Toxikologie (2005); Wissenschaflticher Verlagsgesellschaft. (16) Aktories K., Förstermann U., Hoffmann F. et al; Allgemeine und spezielle Pharmakologie und Toxikologie; 9.Auflage (2004); Urban & Fischer. (17) Lüllmann H., Mohr K., Wehling M.; Pharmakologie und Toxikologie (2003); 15.Auflage; Georg Thieme Verlag. (18) Al Nawas B., Ziegler A.; Die Antibiotika in der Zahnmedizin; Quintessenz (2009); 60(12):1425-1437. (19) Hersh E.V.; Adverse drug interactions in dental practice: interactions involving antibiotics; Journal of the American Dental Association (1999); Vol. 130; Feb. (20) Mainjot A., D´Hoore W., Vanheusden A. and Van Nieuwenhuysen J.P.; Antibiotic prescribing in dental practice in Belgium; International Endodontic Journal (2009); 42:1112-7. (21) Reichl F., Mohr K., Hein L., Hickel R.; Taschenatlas der Pharmakologie und Toxikologie für Zahnmediziner (2007); Thieme Verlag. (22) Yasui N., Otani K., Kaneko S., et al; A kinetic and dynamic study of oral alprazolam with and without erythromycin in humans, in vivo evidence for the involvement of CYP 3A4 in alprazolam metabolism; Clinical Pharmacology and Therapeutics (1996); 59(5): 514-9. (23) Olkkola K.T., Aranko K., Luurila H., et.al.; A potentially hazardous interaction between erythromycin and midozolam; Clinical Pharmacology and Therapeutics (1993); 53(3):298-305. (24) Mattila M.J., Vanakoski J and Idanpaan-Heikkila J.J.; Azithromycin does not alter the effect of oral midazolam on human performance; European Journal of Clinical Pharmacology (1994); 47(1):49-52. (25) Aranko K., Luurila H., Backman J.T., et al.; The effect of erythromycin on the pharmacokinetics and pharmacodynamics of zopiclone; British Journal of Clinical Pharmacology (1994); 38(4):363-7. (26) Luurila H., Olkkola K.T. and Neuvonen P.J.; Interaction between erythromycin and nitrazepam in healthy volunteers; Pharmacology and Toxicology (1995); 76(4):255-8. 48 (27) Phillips J.P., Antal E.J. and Smith R.B.; A pharmacokinetic drug interaction between erythromycin and triazolam; Journal of Clinical Psychopharmacology (1986); 6(5):297-9. (28) Yeates R.A., Laufen H. and Zimmermann T.; Interaction between midazolam and clarithromycin: comparison with azithromycin; International Journal of Clinical Pharmacology and Therapeutics (1996); 34(9): 400-5. (29) Wong Y.Y., Ludden T.M. and Bell R.D.; Effect of erythromycin on carbamazepine kinetics; Clinical Pharmacology and Therapeutics (1983); 33:460-4. (30) Nahata M.; Drug interactions with azithromycin and the macrolides: an overview; Journal of Antimicrobial Chemotherapy (1996); 37 Suppl. C:133142. (31) Hersh E.V., Moore P.A.; Drug interactions in dentistry; The importance of knowing your CYPs; Journal of the American Dental Association Vol. 135 (2004). (32) Periti P., Mazzei T., Mini E. and Novelli A.; Pharmacokinetic drug interactions of macrolides.; Clinical Pharmacokinetics (1992); 23:106-31. (33) Gupta S.K., Bakran A., Johnson R.W. and Rowland M.; Cyclosporinerythromycin interaction in renal transplant patients; British Journal of Clinical Pharmacology (1998); 27:475- 81. (34) Kyrmizakis D.E., Chimona T.S., Kanoupakis E.N., Papadakis C.E., Velegrakis G.A., Helidonis E.S.; QT Prolongation and Torsades de Pointes Associated With Concurrent Use of Cisapride and Erythromycin; American Journal of Otolaryngology (2002); 23(5):303-7. (35) LaForce C.F., Szefler S.J., Miller M.F., et al. ; Inhibition of Methylprednisolon Elimination in the Presence of Erythromycin Therapy ; Journal of Allergy and Clinical Immunology (1983); 72(1): 34-9. (36) Wakasugi H. et al.; Effect of clarithromycin on renal excretion of digoxin with P-glycoprotein; Clinical Pharmacology and Therapeutics (1998); 64:123-128. (37) Gomes T., Mamdani M.M. and Juurlink D.N.; Macrolide- Induced Digoxin Toxicity: a Population- Based Study; Clinical Pharmacology and Therapeutics (2009); 86(4): 383-86. (38) Austria codex; www.medizinmedien.at; am 8.10.2010 49 (39) Honig P.K., Woosley R.L., Zamani K. Conner D.P., Cantilena L.R.Jr.; Changes in the pharmacokinetics and electrocardiographic pharmacodynamics of terfenadine with concomitant administration of erythromycin; Clinical pharmacology and therapeutics (1992); 52(3):231-8. (40) Muck W., Ochmann K., Rohde G., et al.; Influence of erythromycin pre- and cotreatment on single dose pharmacokinetics of the HMG-CoA reductase inhibitor cerivastatin; European Journal of Clinical Pharmacology (1998); 53(6): 469-73. (41) Wong P.W., Dillard T.A. and Kroenke K.; Multiple organ toxicity from addition of erythromycin to long-term lovastatin therapy; Southern Medical Journal (1998); 91(2):202-5. (42) Kantola T., Kivisto K.T. and Neuvonen P.J.; Erythromycin and verapamil considerably increase serum simvastatin and simvastatin acid concentrations; Clinical Pharmacology and Therapeutics (1998); 64(2):177-82. (43) Cooper K.J., Martin P.D., Dane A.L., et al.; The effect of erythromycin on the pharmacokinetics of Rosuvastatin; European Journal of Clinical Pharmacology (2003); 59(1):51-6. (44) Back D.J. and Orme M.L.; Pharmacokinetic drug interactions with oral contraceptives; Clinical Pharmacokinetics (1990); 18:472- 84. (45) Kunicki P.K., Sobieszczańska-Malek M.; Pharmacokinetic interaction between tacrolimus and clarithromycin in a heart transplant patient; Therapeutic drug monitoring (2005); 27(1):107-8. (46) Horowitz R.S., Dart R.C., Gomez H.F.; Clinical ergotism with lingual ischemia induced by clarithromycin-ergotamine interaction.; Archives of internal medicine (1996); 156(4):456-8. (47) Flockhart D.A., Drici M.D., Kerbusch T., Soukhova N.,Richard E., Pearle P., Mahal S.K., Babb V.J.; Studies on the Mechanism of a Fatal ClarithromycinPimozide Interaction in a Patient with Tourette Syndrome; Journal of Clinical Psychopharmacology (2000); 20(3):317-24. (48) Amacher D.E.; Schomaker S.J. und Retsema J.A.; Comparison of the effects of the new azalide antibiotic, azithromycin, and erythromycin estolate on rat liver cytochrome P- 450; Antimicrobial Agents and Chemotherapy (1991); 35:118690. 50 (49) Ruff F., Chu S.Y., Sonders R.C. and Senello L.T.; Effect of multiple doses of clarithromycin on the pharmacokinetics of theophylline. In Program and Abstracts of the Thirtieth Interscience Conference on Antimicrobial Agents and Chemotherapy (1990); Abstract 761. American Society for Microbiology, Washington, DC. (50) Bachmann K., Schwarz J.I., Forney R. Jr., et al.; The Effect of Erythromycin on the Disposition Kinetics of Warfarin; Pharmacology (1984); 28(3): 171-6. (51) Bartle W.R.; Possible Warfarin-Erythromycin Interaction; Archives of Internal Medicine (1980); 140(7): 985-7. (52) Husserl F.E.; Erythromycin-Warfarin Interaction; Archives of Internal Medicine (1983); 143(9):1831-6. (53) Hassell D.; Utt J.K.; Suspected Interaction: Warfarin and Erythromycin; Southern Medical Journal (1985); 78(8):1015-16. (54) Roberts M.C.; antibiotic toxicity, interactions and resistance development; Periodontology 2000 (2002); 28:280-207. (55) Deppermann K-M., Lode H., Höffken G., Tschink G., Kalz C., Koeppe P.; Influence of ranitidine, pirenzepine, and aluminum magnesium hydroxide on the bioavailability of various antibiotics, including amoxicillin, cephalexin, doxycycline, and amoxicillin-clavulanic acid; Antimicrobial Agents and Chemotherapy (1989); 33:1901–7. (56) Rosenblatt J.E., Barrett J.E., Brodie J.L., Kirby W.M.M.; Comparison of in vitro activity and clinical pharmacology of doxycycline with other tetracyclines; Antimicrobial Agents and Chemotherapy (1966); 6:134–41. (57) Neuvonen P.J. and Penttilä O.; Effect of oral Ferrous Sulphate on the Half-Life of Doxycycline in Man; European Journal of clinical Pharmacology (1974); 7: 361-363. (58) Basaria S., Braga M. and Moore T.W.; Doxycycline- Induced Hypoglycemia in a nondiabetic young man; Southern Medical Journal (2002); 95(11): 13531354. (59) Penttilö O., Neuvonen P.J., Aho K., et al.; Interaction Between Doxycycline and Some Antiepileptic Drugs; British Medical Journal (1974); 2(917): 470-2. (60) Gómez-Moreno G., Guardia J., Cutando A., Calvo-Guirado J.L.; Pharmacological interactions of anti-microbial agents in odontology; Medicina Oral, Patologia Oral y Cirugia Bucal (2009); 14(3):E123-8. 51 (61) Baciewicz A.M., Bal B.S.; Bleeding associated with doxycycline and warfarin tratment; Archives of Internal Medicines (2001); 161:1231. (62) Neuvonen P.J. and Penttilä O.; Interaction between Doxycycline and Barbiturates; British Medical Journal (1974); 1: 535-6. (63) Lindenbaum J., Rund D.G., Butler V.P., et al.; Inactivation of Digoxin by the Gut Flora: Reversal by Antibiotic Therapy; New England Journal of Medicine (1981), 305:789-94. (64) Tortajada-Ituren J.J., Ordovás-Baines J.P., Llopis-Salvia P., Jiménez-Torres N.V.; High-dose methotrexate-doxycycline interaction; Annals of Pharmacotherapy (1999); 33(7-8):804-8. (65) Halling F.; Zahnärztliche Pharmakologie (2008); Spitta Verlag (66) Cina SJ, Russell RA, Conradi SE. Sudden death due to metronidazole/ethanol interaction; American Journal of Forensic Medicine and Pathology (1996); 17: 343–6. (67) O´Reilly R.A.; The stereoselective interaction of warfarin and metronidazole in man; New England Journal of Medicine (1976); 295: 354–7. (68) Zhang K., Young C. and Berger J.; Administrative Claims Analysis of the Relationship between Warfarin Use and Risk of Hemorrhage Including DrugDrug and Drug-Disease Interactions; Journal of Managed Care Pharmacy (2006); 12(8):640-48. (69) Loft S., Sonne J., Poulsen H.E., Petersen K.T. Jørgensen B.G. and Døssing M.; Inhibition and Induction of Metronidazole and Antipyrine Metabolism; European Journal of Clinical Pharmacology (1987); 32:35-41. (70) Eradiri O., Jamali F., Thomson A.B., Interaction of metronidazole with phenobarbital, cimetidine, prednisone and sulfasalazine in Crohn´s disease; Biopharmaceutics & Drug Disposition (1988); 9: 219-227. (71) http://vmc.medunigraz.at/moodle/file.php/441/Uholzer-M12/AB3-S09.pdf am 21.11.2010 (72) Niederfuhr A, Kirsche H, Riechelmann H, Wellinghausen N. The bacteriology of chronic rhinosinusitis with and without nasal polyps; Archives of Otolaryngology - Head & Neck Surgery (2009); 135:131-6 (73) Roberge R.J., Kaplan R., Frank R., et al.; Glyburide- Ciprofloxacin Interaction with Resistant Hypoglycemia; Annals of Emergency Medicine (2000); 36(2):160-3. 52 (74) Mohr J.F., McKinnon P.S., Peymann P.J., et al.; A Retrospective, Comparative Evaluation of Dysglycemias in Hospitalized Patients Receiving Gatifloxacin, Levofloxacin, Ciprofloxacin, or Ceftriaxone; Pharmacotherapy (2005); 25:1303-9. (75) Ellis R.J., Mayo M.S. and Bodensteiner D.M.; Ciprofloxacin-Warfarin Coagulopthy: a Case Series; American Journal of Hematology (2000); 63:2831. (76) Fischer H.D., Juurlink D.N., Mamdani M.M., Kopp A., Laupacis A.; Hemorrhage During Warfarin Therapy Associated With Cotrimoxazole and Other Urinary Tract Anti-infective Agents; Archives of Internal Medicine (2010); 170(7):617-621. (77) Bianco T.M., Bussey H.I., Farnett L.E., Linn W.D., Roush M.K. and Wong Y.W.; Potential warfarin-ciprofloxacin interaction in patients receiving longterm anticoagulation; Pharmacotherapy (1992); 12(6):435-9. (78) Borrás- Blasco J., Conesa- Garcia V., Navarro- Ruiz A., Marin- Jiménez F., González- Delago M., Gomez- Corrons A.; Ciprofloxacin, but not Levofloxacin, Affects Cyclosporin Blood Levels in a Patient with Pure Red Blood Cell Aplasia; American Journal of the medical sciences (2005) 330(3):144-6. (79) Brouwers E.E., Söhne M., Kuipers S., van Gorp E.C., Schellens J.H., Koks C.H., Beijnen J.H., Huitema A.D.; Ciprofloxacin strongly inhibits clozapine metabolism: two case reports; Clinical Drug Investigation (2009); 29(1):59-63. (80) Akahane K., Sekiguchi M. Une T. and Osada Y.; Structure epileptogenicity relationship of quinolones with spezial reference to their interaction with gamma- aminobutyric acid receptor sites; Antimicrobial Agents and Chemotherapy (1989); 33: 1704-1708. (81) Iqbal Z., Khan A., Naz A., et al.; Pharmacokinetic Interaction of Ciprofloxacin with Diclofenac : a Single- Dose, Two- Period Crossover Study in Healthy Adult Volunteers; Clinical Drug Investigation (2009); 29(4): 275-81. (82) Job M.L., Arn S.K., Strom J.G., Jacobs N.F., D´Souza M.J.; Effect of ciprofloxacin on the pharmacokinetics of multiple-dose phenytoin serum concentrations; Therapeutic drug monitoring (1994); 16(4):427-31. (83) Miyata K., Ohtani H., Tsujimoto M., Sawada Y.; Antacid interaction with new chinolones: dose regimen recommendations based on pharmacokinetic 53 modeling of clinical data for ciprofloxacin, gatifloxacin and norfloxacin and metal cations; International Journal of Pharmacology and Therapeutics (2007); 45(1):63-70. (84) Kays M.B., Overholser B.R., Mueller B.A., Moe S.M. and Sowinski M.; Effects of sevelamer hydrochloride and calcium acetate on the oral bioavailability of ciprofloxacin; American Journal of kidney diseases: The official journal of the national kidney foundation (2003); 42(6):1253-9. (85) Batty K.T., Davis T.M., Ilett K.F., Dusci L.J., Langton S.R.; The effect of ciprofloxacin on theophyline pharmacokinetics in healthy subjects; British Journal of Clinical Pharmacology (1995); 39(3):305-11. (86) Healy D.P., Polk R.E., Kanwati L., Rock D.T., Mooney M.L.; Interaction between oral ciprofloxacin and caffeine in normal volunteers; Antimicrobial Agents and Chemotherapy (1989); 33(4):474-8. (87) Granfors M.T., Backman J.T., Neuvonen M. and Neuvonen P.J.; Ciprofloxacin greatly increases concentrations and hypotensive effect of tizanidine by inhibiting its cytochrome P 450 1A2- mediated presystemic metabolism; Clinical Pharmacology and Therapeutics (2004); 76(6):598-606. (88) Moore P.A., Gage T.W., Hersh E.V., Yagiela J.A., Haas D.A.; Adverse drug interactions in dental practice: professional and educational implications; Journal of the American Dental Association (1999); 130:47-54. (89) Byrne B.E.; Drug interactions: a review and update; Endodontic Topics (2003); 4: 9-21. (90) Lemmer B., Brune K.; Pharmakotherapie Klinische Pharmakologie, 13. überarbeitete und aktualisierte Auflage 2007; Springer Verlag (91) Wagner J.; Suessmair C., Pfister H.W.; Rhabdomyolysis caused by comedication with simvastatin and clarithromycin; Journal of neurology (2009); 256(7):1182-3. (92) Dickinson B.D., Altman R.D., Nielsen N.H. and Sterling M.L.; Drug Interactions Between Oral Contraceptives and Antibiotics; The American College of Obstetricians and Gynecologists (2001); 98(1):853-60. 54