Musterbildung in der Netzhaut
Werbung

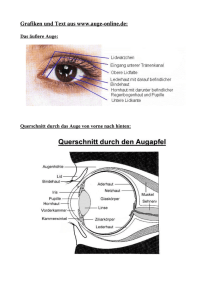
589_621_BIOsp_0607.qxd:589_621 606 18.09.2007 8:20 Uhr Seite 606 WISSENSCHAFT Retinaentwicklung Musterbildung in der Netzhaut DOROTHEA SCHULTE MAX-PL ANCK-INSTITUT FÜR HIRNFORSCHUNG, FRANKFURT A. M. Klassische embryologische Studien des letzten Jahrhunderts zusammen mit Arbeiten jüngeren Datums zeigen, dass die Topografie der Netzhaut bereits in der frühen Augenanlage durch das Zusammenspiel verschiedener Transkriptionsfaktoren festgelegt wird. ó Visuelle Wahrnehmung beginnt mit den Photorezeptoren, hoch spezialisierten Nervenzellen, die Lichtimpulse in elektrochemische Signale umwandeln. Photorezeptoren fallen in zwei prinzipielle Klassen: Zapfen dienen der Lichtwahrnehmung unter Tageslichtbedingungen, ermöglichen also das, was wir landläufig unter „Sehen“ verstehen, während Stäbchen auf visuelle Wahrnehmung in Dunkelheit spezialisiert sind. Menschen besitzen drei verschiedene Zapfentypen, deren maximale Lichtempfindlichkeit im kurzwelligen „blauen“ (S-Zapfen), im mittelwelligen „grünen“ (M-Zapfen) oder im langwelligen „roten“ (L-Zapfen) Wellenlängenbereich liegen. Das Zusammenwirken dieser Zapfentypen erlaubt uns, Farben in einem breiten A B Spektrum von Blau bis Rot zu unterscheiden. Die im Photorezeptor nach Lichtstimulation erzeugten elektrochemischen Signale werden bereits innerhalb der Netzhaut durch verschiedene Klassen von Interneuronen – den Amakrin-, Bipolar- und Horizontalzellen – verarbeitet. Retinale Ganglienzellen, die Projektionsneurone der Retina, leiten diese Signale dann an die visuellen Zentren im Mittelhirn weiter, bei Säugern an den Superior Colliculus (SC), bei Nicht-Säugern an das optische Tektum. Ganglienzellen der temporalen (also der Schläfe zugewandten) Seite der Netzhaut projizieren ins anteriore optische Tektum (bzw. in den anterioren SC), während Ganglienzellen der nasalen Netzhaut die posteriore Sei- te des Tektums innervieren. Auf ähnliche Art und Weise wird die dorso-ventrale (D-V) Achse der Netzhaut auf die medial-laterale Achse des Tektums abgebildet (Abb. 1). Die axonalen Projektionen retinaler Ganglienzellen ins optische Tektum bzw. in den SC spiegeln also die Lage ihrer Zellkörper im Zellverband der Netzhaut wider. Dadurch kann die visuelle Welt leicht verzerrt und einmal gespiegelt, aber topografisch korrekt im Gehirn abgebildet werden. Topografie in der Netzhaut ist aber nicht auf retinale Ganglienzellen beschränkt. Auch Photorezeptortypen sind bei fast allen Wirbeltieren in unterschiedlichen, oft Spezies-spezifischen Mustern über die Netzhaut verteilt. Im menschlichen Auge fehlen beispielsweise Stäbchen und S-Zapfen innerhalb der Fovea centralis, einem kleinen Bereich im Zentrum der Netzhaut, dessen Aufbau, zelluläre Zusammensetzung und synaptische Verschaltung die höchste Sehschärfe innerhalb der Netzhaut ermöglichen[1, 2] (Abb. 1). Auch bei manchen Vogelarten wie Tauben oder einigen Hühnervögeln fehlen Stäbchen im Zentrum der Netzhaut (Abb. 2B). Bei Hühnern nimmt darüber hinaus die Stäbchendichte von ventral nach C D E ˚ Abb. 1: Beispiele für retinale Topografie. A, Schichtaufbau der Netzhaut. B und C, Zapfenverteilung (B) und Stäbchendichte (C) in der menschlichen Netzhaut. Im Bereich der Fovea centralis fehlen S-Zapfen und Stäbchen. D und E, topografische Projektion retinaler Ganglienzellen. Die A-P-Achse der Retina wird auf die P-A-Achse des optischen Tektums (hier des Hühnchens), die D-V-Achse auf die L-M-Achse projiziert. A: anterior, P: posterior, D: dorsal, V: ventral, L: lateral, M: medial. BIOspektrum | 06.07 | 13. Jahrgang 589_621_BIOsp_0607.qxd:589_621 608 18.09.2007 8:21 Uhr Seite 608 WISSENSCHAFT A B C ˚ Abb. 2: A, links: anteriores Zentralnervensystem eines Hühnchenembryos im Zwölf-Somitenstadium; rechts: schematische Darstellung des optischen Vesikels. Die Expressionsdomänen mehrerer Transkriptionsfaktoren gliedern diesen in molekular unterschiedliche Domänen. B, Das typische Stäbchenmuster (Stäbchen-freie Area centralis im Zentrum der Netzhaut (Pfeil) und von ventral nach dorsal abnehmende Stäbchendichte) entsteht aus einer Augenanlage, in der die Expression des Transkriptionsfaktors Vax2/cVax auf die ventrale Seite beschränkt ist. C, Aufsicht auf eine adulte Hühnchennetzhaut nach retroviraler Vax2-Transfektion. Das Stäbchenmuster ist gestört, die Stäbchen-freie Area centralis fehlt. In B und C sind Stäbchen dunkel angefärbt. Nachdruck der Retinae in B und C mit freundlicher Genehmigung der Society for Neuroscience, 2007. Anterior: links, posterior: rechts, dorsal: oben, ventral: unten. dorsal ab, während bei vielen Mausstämmen S-Zapfen in der ventralen Netzhaut deutlich häufiger sind als in der dorsalen Netzhaut. Wie und wann entstehen diese Muster während der Embryogenese? Diese Frage war bereits zu Beginn des letzten Jahrhunderts Gegenstand intensiver Forschung und wurde durch Ablations-, Rotations- und Transplantationsexperimente der Augenanlage des Krallenfroschs (Xenopus laevis) oder Hühnchens zu beantworten versucht[3]. Der Grundstein für Ganglienzell- und Photorezeptormuster wird bereits im optischen Vesikel gelegt Die Netzhaut ist Teil des Zentralnervensystems und entwickelt sich als solche aus lateralen Ausstülpungen des Neuralrohrs im Bereich des Zwischenhirns, den optischen Vesikeln (Abb. 2). Wird bei Hühnchenembryos ein Teil des optischen Vesikels operativ entfernt (ablatiert), so regeneriert dieser innerhalb weniger Stunden durch vermehrte Zellteilung des verbliebenen Teils des Vesikels und kann eine morphologisch intakte Netzhaut erzeugen[4]. Nach einer solchen Operation zeigen die retinalen Ganglienzellen des regenerierten Teils der Netzhaut jedoch ein Projektionsverhalten, das ihrer ursprünglichen Lage im optischen Vesikel entspricht, anstatt das Projektionsverhalten der Region anzunehmen, die sie nach der Heilung ausfüllen. Auch eine generelle D-V-Polarität retinaler Ganglienzellen scheint bereits in der Augenanlage festgelegt zu sein[5] Wir haben kürzlich die Auswirkung vergleichbarer Experimente auf die Verteilung von Stäbchen untersucht und beobachtet, dass auch dieses Muster in seinen Grundzügen schon im optischen Vesikel angelegt ist. So entspricht beispielsweise nach Ablation der dorsalen Augenanlage die Stäbchenverteilung im adulten Tier einer Verdopplung des ventralen Musters[6]. Bereits im optischen Vesikel und damit lange bevor postmitotische Nervenzellen entstehen und differenzieren müssen retinale Vorläuferzellen also stabile Positionsinformationen besitzen, die sich in der topografischen Projektion der aus ihnen hervorgegangenen Ganglienzellen und der Dichteverteilung von Photorezeptortypen widerspiegeln. Ein früher Positionskode Wie werden diese Positionsinformationen molekular festgelegt? Auch wenn der optische Vesikel morphologisch noch nicht die komplexe Struktur der zukünftigen Retina erahnen lässt, ist er doch durch die Expression verschiedener Transkriptionsfaktoren in eine Vielzahl von Domänen unterteilt (Abb. 2). Die Expressionsdomänen der Transkrip- tionsfaktoren FoxG1, FoxD1, SOHo1 und GH6 zum Beispiel unterteilen den frühen optischen Vesikel in mehrere Domänen entlang der anterior-posterioren (A-P) Achse und legen damit eine erste Achsenpolarität der zukünftigen Netzhaut fest[7, 8]. Entlang der D-V-Achse bilden Vorläuferzellen der ventralen Augenanlage den Homeodomän-Transkriptionsfaktor Vax2 (cVax im Hühnchen), Zellen der dorsalen Augenanlage exprimieren T-BoxTranskriptionsfaktoren wie Tbx2, -3, -5 und -12, während Zellen in einem breiten, horizontalen Band dazwischen keinen dieser Faktoren exprimieren[9, 10]. Stattdessen zeigt dieses horizontale Band eine starke Expression des Transkriptionsfaktors Pax6, eines Proteins, das im gesamten Tierreich von entscheidender Bedeutung für die Augenentwicklung ist[11]. Bemerkenswerterweise treffen sich der horizontale Vax- und Tbx-freie und ein vertikaler FoxG1- und Fox-D1-freier Streifen genau im Zentrum der Augenanlage und damit in dem Bereich, der später die Area centralis bzw. bei Primaten die Fovea hervorbringen wird. Die entwicklungsbiologische Bedeutung dieser Expressionsmuster ist aber erst teilweise verstanden. Eine auf die ventrale Augenanlage beschränkte Expression von cVax/Vax2 ist für die normale Entwicklung ventraler Augenstrukturen entscheidend. So stört eine ektopische Vax2Expression in der dorsalen Augenanlage nicht nur die Entwicklung der retinotektalen Projektion, sondern auch die Faszikulierung und Wegfindung retinaler Ganglienzellaxone innerhalb der Netzhaut sowie die Verteilung von Stäbchenphotorezeptoren[6, 10, 12] (Abb. 2). Genverlust von Vax2 führt ebenfalls zu Störungen der retinotektalen Projektionen und zu Missbildungen des Auges[13]. Räumlich begrenzte Expression von FoxG1, FoxD1, SOHo1, GH6 oder Tbx5 im optischen Vesikel hingegen ist zwar entscheidend für die normale Entwicklung der retinotektalen Projektionen, hat aber keine Bedeutung für die korrekte Entwicklung des Photorezeptormusters[6]. Ein einfacher Positionskode, der sowohl der Entwicklung der retinotektalen Karte als auch dem Photorezeptormuster zugrunde liegt, wird also bereits im optischen Vesikel festgelegt, und einige der daran beteiligten Faktoren sind bekannt. Eine Vielzahl von Fragen bleibt aber noch zu beantworten. So ist beispielsweise noch weitgehend unklar, wie Spezies-spezifische Unterschiede in der Verteilung von Photorezeptortypen entstehen. Ein gutes Beispiel hierfür ist die menschliche BIOspektrum | 06.07 | 13. Jahrgang 589_621_BIOsp_0607.qxd:589_621 18.09.2007 8:21 Uhr Seite 609 609 Fovea. Obwohl die Sehleistung der Fovea von großer Bedeutung für unser tägliches Leben ist und Makulardegeneration, eine oft im Alter auftretende Degeneration der Netzhaut im Bereich der Fovea, die häufigste Ursache für Erblindung in Europa und Nordamerika darstellt, sind die Mechanismen, die zur Entwicklung einer Fovea oder Fovea-ähnlichen Struktur führen, noch völlig unbekannt. ó Literatur [1] Xiao, M., Hendrickson, A. (2000): Spatial and temporal expression of short, long/medium, or both opsins in human fetal cones. J. Comp. Neurol. 425: 545–559. [2] Bumsted O’Brien, K. M., Cheng, H., Jiang, Y., Schulte, D., Swaroop, A., Hendrickson, A. E. (2004): Expression of photoreceptor-specific nuclear receptor NR2E3 in rod photoreceptors of fetal human retina. Invest. Ophthalmol. Vis. Sci. 45: 2807–2812. [3] Goodhill, G. J., Richards, L. J. (1999): Retinotectal maps: molecules, models and misplaced data. Trends Neurosci. 22: 529–534. [4] Dutting, D., Thanos, S. (1995): Early determination of nasal-temporal retinotopic specificity in the eye anlage of the chick embryo. Dev. Biol. 167: 263–281. [5] Uemonsa, T., Sakagami, K., Yasuda, K., Araki, M. (2002): Development of dorsal-ventral polarity in the optic vesicle and its presumptive role in eye morphogenesis as shown by BIOspektrum | 06.07 | 13. Jahrgang embryonic transplantation and in ovo explant culturing. Dev. Biol. 248: 319–330. [6] Schulte, D., Peters, M. A., Sen, J., Cepko, C. L. (2005): The rod photoreceptor pattern is set at the optic vesicle stage and requires spatially restricted cVax expression. J. Neurosci. 25: 2823–2831. [7] Schulte, D., Cepko, C. L. (2000): Two homeobox genes define the domain of EphA3 expression in the developing chick retina. Development 127: 5033–5045. [8] Yuasa, J., Hirano, S., Yamagata, M., Noda, M. (1996): Visual projection map specified by topographic expression of transcription factors in the retina. Nature 382: 632–635. [9] Koshiba-Takeuchi, K., Takeuchi, J. K., Matsumoto, K., Momose, T., Uno, K., Hoepker, V., Ogura, K., Takahashi, N., Nakamura, H., Yasuda, K., Ogura, T. (2000): Tbx5 and the retinotectum projection. Science 287: 134–137. [10] Schulte, D., Furukawa, T., Peters, M. A., Kozak, C. A., Cepko, C. L. (1999): Misexpression of the Emx-related homeobox genes cVax and mVax2 ventralizes the retina and perturbs the retinotectal map. Neuron 24: 541–553. [11] Leconte, L., Lecoin, L., Martin, P., Saule, S. (2004): Pax6 interacts with cVax and Tbx5 to establish the dorsoventral boundary of the developing eye. J. Biol. Chem. 279: 47272–47277. [12] Mühleisen, T. W., Agoston, Z., Schulte, D. (2006): Retroviral misexpression of cVax disturbs retinal ganglion cell axon fasciculation and intraretinal pathfinding in vivo and guidance of nasal ganglion cell axons in vivo. Dev. Biol. 297: 59–73. [13] Mui, S. H., Hindges, R., O’Leary, D. D., Lemke, G., Bertuzzi, S. (2002): The homeodomain protein Vax2 patterns the dorsoventral and nasotemporal axes of the eye. Development 129: 797–804. Korrespondenzadresse: Dr. Dorothea Schulte Max-Planck-Institut für Hirnforschung Deutschordenstraße 46 D-60528 Frankfurt a. M. Tel.: 069-96769 335 Fax: 069-96769 206 [email protected] www.mpih-frankfurt.mpg.de AUTORIN Dorothea Schulte Studium der Biologie an der Universität Konstanz. 1992– 1996 Promotion am Lehrstuhl für Genetik der Universität Konstanz. 1996–2001 Forschungsaufenthalt an der Harvard Medical School, Boston. Seit 2001 Gruppenleiterin am MPI für Hirnforschung, Abteilung Neuroanatomie, in Frankfurt a. M.