Protein-Expressions-Analysen zur Etablierung prädiktiver
Werbung

Inaugural-Dissertation
zur Erlangung des Grades des Dr. rer. nat.
an der Universität Kassel, Fachbereich 18 Naturwissenschaften
Protein-Expressions-Analysen zur Etablierung prädiktiver Biomarker bei
der Behandlung fortgeschrittener Tumoren der Mamma und der Prostata
vorgelegt von
Dirk Zielinski
Kassel, im Oktober 2006
Inaugural-Dissertation
zur Erlangung des Grades des Dr. rer. nat.
an der Universität Kassel, Fachbereich 18 Naturwissenschaften
Protein-Expressions-Analysen zur Etablierung prädiktiver Biomarker bei
der Behandlung fortgeschrittener Tumoren der Mamma und der Prostata
vorgelegt von
Dirk Zielinski
angefertigt am
Institut für Pathologie, Klinikum Kassel
Tag der mündlichen Prüfung: 20. März 2007
1. Gutachter: Prof. Dr. rer. nat. Friedrich Herberg
(Universität Kassel, FB Naturwissenschaften, AG Biochemie)
2. Gutachter: Prof. Dr. med. Josef Rüschoff
(Institut für Pathologie, Klinikum Kassel)
Fûr Tom.
1. Inhaltsverzeichnis
1. INHALTS- UND ABKÜRZUNGSVERZEICHNIS
7
2. MEDIZINISCHE UND BIOLOGISCHE ASPEKTE DES MAMMA- UND DES PROSTATAKARZINOMS 13
2.1
2.2.1
2.2.2
2.2.3
2.1.4
2.1.5
2.2
2.3
2.4
2.4.1
2.4.2
2.4.3
2.5
2.6
Tumor-Diagnostik und –Therapie im Wandel der Zeit
13
Die klassische Systematik der Tumoren erfolgt nach histologischen Gesichtspunkten 14
Das Mammakarzinom aus histopathologischer Sicht
14
Histopathologische Besonderheiten des Prostatakarzinoms
16
Die Identifizierung prognostisch und therapeutisch relevanter Moleküle begründet die
moderne Biomarkeranalytik
17
Die Rezeptor-Tyrosin-Kinase Her-2 als Biomarker mit prognostischer und prädiktiver
Relevanz
18
Zellen kommunizieren mit ihren Nachbarn
19
EGF-Rezeptoren besitzen eine Tyrosin-Kinase-Aktivität
20
Aktivierte Her-Rezeptoren lösen eine Signalkaskade aus
22
Der MAP-Kinase-Signalweg fördert die Zellteilung
23
Die PIP3-abhängige Signaltransduktion beeinflusst zentrale Funktionen einer Zelle
24
Eine Vielzahl anderer Rezeptoren und Proteine beeinflusst die Her-assoziierte
Signaltransduktion
26
Tumoren der Mamma weisen Gemeinsamkeiten mit Prostatakarzinomen auf
26
Identifizierung und Validierung neuer Biomarker mit möglicher therapeutischer oder
prognostischer Relevanz als Hauptaufgabe der vorliegenden Arbeit
27
3. MATERIALIEN UND METHODEN
31
3.1
3.1.3
3.2
3.2.1
3.2.2
3.2.3
3.2.4
3.2.5
3.2.6
3.2.7
3.2.8
3.2.9
3.2.10
3.3
3.3.1
3.3.2
3.4
3.4.1
3.4.2
3.4.3
3.5
31
34
34
34
36
37
37
38
38
42
42
43
44
44
45
45
47
47
48
49
51
Gewebe für in situ-Expressionsanalytik
Herstellung von Multi-Gewebe-Blöcken
in situ-Analysen zur Protein-Expression: Immunhistochemie und Immunfluoreszenz
Antikörper
Weitere Reagenzien für Immunhistochemie und Immunfluoreszenz
Anfertigen und Deparaffinieren von Gewebeschnitten
Antigen Retrieval
Blockierung endogener Peroxidasen und unspezifischer Antikörperbindungsstellen
Primärantikörper
Plausibilitätsprüfung immunhistochemischer Färbeprotokolle
Detektion und Konservierung
Immunhistochemische Färbungen mit dem Färbeautomat
Immunfluoreszenz
Histopathologische Befundung von Gewebeschnitten
Besonderheiten des Prostatakarzinoms
Einheitliche Beurteilung immunhistochemischer Färbungen
Statistische Auswertung mit Hilfe bioinformatischer Methoden
Ermittlung der klinischen Relevanz eines Analyten: der MANN-WHITNEY-Test
Bivariate Datenanalysen: κ-value und MCNEMAR-Test
Data Adjustment der Rohdaten für 2D-Cluster-Analysen (Mamma)
Zellbiologische Methoden
7
Inhaltsverzeichnis
3.5.3
3.5.4
3.5.5
3.5.6
3.5.7
3.6
3.6.1
3.6.2
3.6.4
3.6.5
3.6.6
3.6.7
3.6.8
3.6.9
Transfektion von HEK293T-Zellen mit dem pRK5/Her-2-Vektor
Zellkultur und Ernten transfizierter Zellen
Transfektion von HEK293T-Zellen zur Immunfluoreszenz
Immunfluoreszenzfärbung
Zellaufschluß für proteinbiochemische Untersuchungen
Proteinbiochemische Methoden
Gewebeaufschluß und Fraktionierung durch differentielle Zentrifugation
Isolierung von Protein aus Frischgewebe-Schnitten
Proteinmengenbestimmung nach BRADFORD
SDS-PAA Gelelektrophorese
WESTERN Blot
COOMASSIE-Färbung von SDS-PAA Gelen
Immunpräzipitation
Enzyme-linked immunosorbent assay (ELISA)
4. ERGEBNISSE
4.1
4.1.2
52
52
53
53
54
54
55
55
56
57
57
58
59
59
61
in situ-Analysen zur Protein-Expression und -Aktivierung
61
Die Mitglieder der EGF-Rezeptor-Familie können in verschiedenen Kompartimenten der
Zelle nachgewiesen werden
62
4.1.3
Phosphorylierungsstatus der EGF-Rezeptoren in Mamma-Karzinomen
65
4.1.5
Nicht alle untersuchten Wachstumsfaktoren sind in Tumorgeweben nachweisbar
72
4.1.6
Aktivierung des MAP-Kinase-pathway ist in beiden untersuchten Tumorentitäten nur
selten nachweisbar
75
4.1.7
Der anti-apoptotische AKT-pathway erscheint in vielen Tumoren der Mamma und der
Prostata aktiviert
75
4.1.7.1 In Mamma-Karzinomen ist die Signaltransduktion über PTEN und AKT/PKB verstärkt
aktiviert
76
4.1.8
Regulatoren des Zellzyklus stellen sich in den untersuchten Tumorgeweben als stark
dereguliert exprimiert dar
80
4.1.9
Auch Komponenten weiterer Signaltransduktions-pathways sind in den untersuchten
Tumorgeweben dereguliert exprimiert
82
4.1.10 Einige Cytoskelett-assoziierte Proteine und Komponenten der extrazellulären Matrix
stellen sich im Tumorgewebe ebenfalls dereguliert dar
84
4.1.10 Der Transkriptionsfaktor NF-κB erscheint in Tumoren der Mamma und der Prostata
87
nicht signifikant stärker aktiviert als im Normalgewebe
4.1.11 Expression der Steroid-Hormon–Rezeptoren in Geweben der Mamma und Prostata
88
4.2
Bioinformatische Auswertungen zur Expression ausgewählter Proteine im
Prostatakarzinom
89
4.2.1
Das Prostatakarzinom zeigt eine gegenüber dem Normalgewebe veränderte Protein90
Expression
4.2.2
Protein-Expressions-Profilierung der untersuchten Prostata-Karzinome
92
4.3
Bioinformatische Bestimmung von Protein-Expressions- und Aktivierungsprofilen in
fortgeschrittenen Mammakarzinomen anhand ausgewählter Proteine
94
4.3.1
Viele Proteine sind im Mammakarzinom stärker exprimiert oder phosphoryliert als im
Normalgewebe
94
4.3.2
Bivariate Datenanalysen zur Darstellung aktiver Signaltransduktionspfade
96
4.3.3
Protein-Expressionsprofile in zufällig ausgewählten Karzinomen der Mamma
97
4.4
Untersuchungen zum Her-2 ectodomain shedding
101
4.4.1
Her-2p185 und Her-2p95 werden durch den in der Routinediagnostik eingesetzten
Antikörper erkannt
101
4.4.2
Her-2-Phosphorylierung (Tyr1248) ist immunhistochemisch nur in einem Teil der
untersuchten Her-2 überexprimierenden Tumoren nachzuweisen
102
4.4.3
Phosphoryliertes Her-2p185 ist ausschließlich in der Cytoplasmamembran lokalisiert 103
8
Inhaltsverzeichnis
5. DISKUSSION
5.1
5.2
5.3
5.4
5.5
5.6
5.6
5.6.1
5.7
5.8
5.9
109
Allgemeine Grundlagen der vorgelegten Arbeit
109
Limitationen der in situ-Analytik mit Phosphorylierungs-spezifischen Antikörpern
109
Molekulare Portraits von Tumoren der Prostata eröffnen neue Therapiemöglichkeiten
110
Protein-Expressionsprofile von Mamma-Tumoren geben Hinweise auf neue
zielgerichtete Therapieprotokolle
114
Der AKT-pathway steuert als Knotenpunkt multipler Signalwege eine Vielzahl zellulärer
und tumorrelevanter Funktionen und ist von besonderem Interesse bei der Entwicklung
zielgerichteter Medikamente
115
Angiogenese und Metastasierung sind essentielle Prozesse bei der Tumorerhaltung und
stellen ein Ziel für targeted therapies dar
116
Rezeptor-Tyrosin-Kinasen sind für die Entwicklung neuer targeted drugs von großem
Interesse
117
Zur Rolle der EGF-Rezeptor-Familie für die zielgerichtete Therapie des
Mammakarzinoms
118
Überlegungen zur Wirkweise der humanisierten monoklonalen Antikörper Trastuzumab
120
(Herceptin™™) und Pertuzumab (Omnitarg™™)
Die IHC-basierte Her-2-Diagnostik hat einen niedrigen positiven prädiktiven Wert 121
Hauptaufgaben der biomedizinischen und translationalen Forschung
124
6. ZUSAMMENFASSUNG / SUMMARY
127
7. LITERATURVERZEICHNIS
129
8. BEITRÄGE DRITTER UND KOOPERATIONEN
139
D
9
Abkürzungsverzeichnis
Abb.
ADAM
ADP, ATP
AR
BCR-abl
BPH
BSA
BTC
cDNA
cki
COX
DAB
DAG
DCIS
DNA
DUSP
ECD
EDTA
EGF/EGFR
ELISA
EPR
ER
ERK
FDA
FFPE
FISH
g
GIST
GnRH
HB-EGF
HEK
Her
HRPC
IGF-1R
IP2 / IP3
kDa
LH
MAPK
MMP
mRNA
mTOR
na
NF-kappaB
NRG
NSAID
p- / phosphoPAA / PAGE
PBS / PBST
Abbildung
a disintegrin and metalloprotease
Adenosindiphosphat, Adenosintriphosphat
Amphiregulin, Androgen-Rezeptor
chimäres Protein, c-ABL (Rezeptor-Tyrosin-Kinase mit unbek. Substrat und
BCR (breakpoint cluster region, unbek. Funktion)
benigne Prostatahyperplasie
Rinderserumalbumin
Betacellulin
complementary DNA
Cyclin-Kinase-Inhibitor
Cyclooxygenase
Diamnobenzidin
Diaglycerol
duktales carcinoma in situ
Desoxyribonukleinsäure
dual specificity phosphatase
extrazelluläre Domäne
Ethylen-Diamin-Tetraacetat
epidermal growth factor/ -receptor
enzyme-linked immunosorbent assay
Epiregulin
Östrogen-Rezeptor
extracellular signal regulated kinase
food and drug administration
formalin-fixed, paraffin embedded
fluorescence in situ hybridisation
Gramm, Gravitationskraft
gastro-intestinale Stroma-Tumoren
gonadotropin-releasing hormone
heparin-binding EGF
human embryonal kidney
human epidermal growth factor receptor
Hormon-refraktäres Prostatakarzinom
insulin-like growth factor-1 receptor
Inositol-Diphosphat / -Triphosphat
Kilodalton
Luteinisierungshormon
mitogen activated protein kinase
Matrix-Metallo-Protease
messenger ribonucleic acid
molecular target of rapamycin
nicht auswertbar, nicht angegeben
nuclear factor-κB
Neuregulin, auch: Heregulin
non-steroidal anti-inflammatory drug
phosphoryliert
Polyacrylamid / -Gelelektrophorese
phosphate-buffered saline / - TWEEN added
11
Abkürzungsverzeichnis
PCa
PCR
PDGF / PDGFR
PgR
PH
PI-3K
PIP
PKB/PKC
PLC
PMSF
pNPP
PSA
PTB
PTEN
PVDF
rpm
S, Ser
SCF
SDS
SERM
SH2/3
SRE
STAT
T, Thr
TBS / TBST
Tab.
TCF/LEF
TGF-α
TGF-βR1
TIMP
TMA
TMB
VEGF / VEGFR
Y, Tyr
12
Prostatakarzinom
Polymerase-Kettenreaktion
plated-derived growth factor / -receptor
Progesteron-Rezeptor
pleckstrin homology domain
Phosphatidyl-Inositol-3-Kinase
Phosphatidyl-Inositol
Protein-Kinase B/C
Phospholipase C
Phenylmethylsulfonylfluorid, Protease-Inhibitor
para-Nitrophenylphosphat
Prostata-spezifisches Antigen
phospho-tyrosine binding domain
phosphatase and tensin homologue, deleted on chromosome 10
Polyvinylidendifluorid
rounds per minute
Serin
stem cell factor
Natrium-Dodecylsulfat
selective estrogen receptor modulators
src-homology domain 2/3
serum responsive element
signal transducer and activator of transcription
Threonin
TRIS-buffered saline / - TWEEN added
Tabelle
T-cell-factor / leukocyte enhancing factor
transforming growth factor- α
transforming growth factor-β receptor 1
tissue inhibitor of metalloproteases
tissue micro array, Multi-Gewebe-Block
Tetrameythlbenzidin
vascular endothelial growth factor / -receptor
Tyrosin
2. Medizinische und biologische Aspekte des Mammaund des Prostatakarzinoms
2.1
Tumor-Diagnostik und –Therapie im Wandel der Zeit
Bedeutende Entdeckungen des 20. Jahrhunderts haben zur erfolgreichen Bekämpfung einer
Vielzahl von zuvor als unheilbar geltenden Krankheiten geführt. Als eine nach wie vor große
Herausforderung der Medizin gilt die Behandlung der Tumorerkrankungen, die bis auf wenige
Ausnahmen meist mit einer schlechten Prognose für den Patienten verbunden sind. So spielt in
der modernen biomedizinischen Forschung die Aufklärung der zum Krebs führenden
Mechanismen und die Suche nach neuen therapeutischen Konzepten eine übergeordnete Rolle.
Die
Entwicklung
führt
hierbei
fort
von
der
konventionellen,
systemisch
wirkenden
Chemotherapie hin zu einer targeted therapy, die sich an den molekularen Eigenschaften eines
Tumors orientiert. Die Entdeckung neuer Zielmoleküle und die Bestimmung der Faktoren, die
die Wirkung einer entsprechenden Therapie beeinflussen ist daher eine der vorrangigen
Aufgaben der Biomarkerforschung (Stoss, 2004).
Aus biologischen und ökonomischen Gründen erfordert die fortschreitende Entwicklung auf dem
Gebiet der zielgerichteten Substanzen zur Therapie von Krebserkrankungen die Entwicklung
neuer Verfahren zur Diagnostik von Tumoren. Die Spezifität der modernen Medikamente
verlangt zudem eine Selektion der für eine bestimmte Therapie in Frage kommenden Patienten.
Ausgehend von einer auf der histopathologischen Befundung von Gewebeschnitten basierenden
Diagnostik hat sich hier neben anderen molekulargenetischen Untersuchungsverfahren die in
situ-Analytik etabliert, die die Vorteile der etablierten histopathologischen Befundung mit der
Spezifität antikörper-basierter Nachweismethoden kombiniert.
Die folgenden Abschnitte illustrieren die verschiedenen Entwicklungen in der Diagnostik und
Therapie von Tumoren am Besipiel der in dieser Arbeit untersuchten Entitäten des Mamma- und
des Prostatakarzinoms. Analog zur tatsächlichen Entwicklung in der (bio-) medizinischen
Forschung wird zunächst auf morphologische Grundlagen der Tumordiagnostik eingegangen.
Die einem Tumorgeschehen zugrundeliegenden molekularen Vorgänge als Ausgangspunkt für die
Entwicklung zielgerichteter Therapeutika werden im zweiten Teil dieses einführenden Kapitels
dargestellt.
13
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
2.2.1 Die klassische Systematik der Tumoren erfolgt nach histologischen Gesichtspunkten
Tumoren werden nach verschiedenen Aspekten eingeteilt, die neben dem Ursprung der
Neubildung
ihr
biologisches
Verhalten
(Dignität)
berücksichtigen.
Hierbei
spielt
das
morphologische Erscheinungsbild der Tumorzellen, der sog. Differenzierungsgrad, eine
besondere Rolle. So wird für das grading zwischen hoch differenzierten (dem Ausgangsgewebe
ähnlich erscheinende) Tumoren, mittelgradig und wenig differenzierten Tumoren unterschieden
(G1-3). Tumoren ohne zu erkennende Differenzierung werden als anaplastisch bezeichnet (G4).
Die Ausbreitung eines malignen Tumors in das umliegende Gewebe (staging) wird anhand des
sog. TNM-Systems quantifiziert, das vorwiegend für die malignen soliden Tumoren epithelialen
Ursprungs verwendet wird. Dabei bezeichnet T1-4 die zunehmende Ausbreitung des
Primärtumors im Ursprungsorgan, N die Zahl und Größe von Lymphknotenmetastasen sowie M
das Auftreten von Fernmetastasen (Thomas, 2006).
Neben dieser allgemeinen Tumorklassifikation sind für jede Entität Besonderheiten zu
berücksichtigen, die eine genaue Charakterisierung des Tumors erlauben (typing). Diese sollen
im Folgenden sowohl für das Mamma- als auch für das Prostatakarzinom kurz vorgestellt
werden.
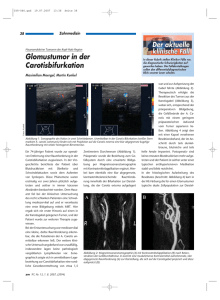
2.2.2 Das Mammakarzinom aus histopathologischer Sicht
Bösartige Veränderungen der Brustdrüse (Mamma) zählen mit 26.8% aller Krebserkrankungen zu
den häufigsten Tumoren bei Frauen. So wurden in Deutschland im Jahr 2002 etwa 55.100 neue
Fälle von invasiven Mamma-Tumoren neu registriert; bei steigender Inzidenz ist insgesamt seit
Mitte der 90er Jahre ein leichter Rückgang der Mortalität zu beobachten (Ges. epid.
Krebsregister, 2006). Die Inzidenz maligner Entartungen der Brustdrüse bei Männern ist mit
einem Anteil unter 1% aller Mammakarzinome vernachlässigbar gering (Kumar, 2005).
Die weibliche Brust ist ein bei Geburt nicht vollständig angelegtes Organ, das im Laufe des
reproduktionsfähigen Lebensabschnittes zyklischen Veränderungen unterworfen ist und erst
während einer Schwangerschaft seine endgültige Ausreifung erfährt. In ihrer Entwickung ist sie
von einer hormonellen Steuerung durch Progesteron und Östrogen abhängig.
Jede Brust besteht aus jeweils 15 bis 25 tubuloalveolären Einzeldrüsen mit eigenem
Ausführungsgang. Die Ausführungsgänge sowie die Lumina der terminalen Drüsenläppchen sind
von einem zweischichtig-isoprismatischen Epithel ausgekleidet, das aus zwei unterschiedlichen
Zelltypen zusammengesetzt ist. Neben einer basal gelegenen, diskontinuierlichen Schicht
flacher kontraktiler Zellen (Myoepithel) wird das Lumen von einer Schicht sekretbildender
Zellen ausgekleidet, die die Funktion der Milchproduktion jedoch nur in den Drüsenendstücken
14
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
A
B
C
Abbildung 1: A Histologisches Bild der normalen,
nicht laktierenden Mamma. Von faserreichem Stroma
mit
eingestreutem
Fettgewebe
umgebene
Drüsenläppchen. (HE-Färbung. Aus: Kumar, 2005)
B Lobuläres Mammakarzinom mit kettenartig
hintereinander angeordneten Zellverbänden. (HEFärbung. Aus: Tavassoli, 2003) C Inasiv ductales
Mammakarzinom mit Osteoclast-ähnlichen, multinukleären Riesenzellen (Pfeil) und Hämosideringefüllten Makrophagen (bräunliche Färbung der
Zellen). (HE-Färbung. Aus: Tavassoli, 2003)
wahrnehmen. Umgeben sind die einzelnen Drüsenläppchen von faserreichem Bindegewebe mit
eingestreutem Fettgewebe (Abb. 1a) (Kumar, 2005; Junqueira, 1996).
Ausgehend von den unterschiedlichen Zelltypen sind verschiedene benigne und maligne
Erkrankungen der Mamma bekannt. Gegenstand dieser Arbeit sind die Neubildungen epithelialen
Ursprunges.
Etwa 15-30% der Mamma-Tumoren können als in situ-Karzinome klassifiziert werden, die auf die
abführenden Gänge (duktales carcinoma in situ, DCIS) oder die Drüsenendläppchen (lobuläres
carcinoma in situ, LCIS) ohne Durchbruch der Basalmembran beschränkt sind (Kumar, 2005).
Beide Tumorarten weisen eine günstige Prognose für die betroffene Patientin auf; die 10Jahres-Überlebensrate bei einem diagnostizierten DCIS liegt bei 98% (Preiss, 2006).
Unter den invasiven Tumoren (70-85% der Mamma-Tumoren) stellen Karzinome besonderer
Differenzierung mit etwa 10% die Minderheit der malignen Entartungen dar (mucinöse,
medulläre, cribriforme oder papilläre Tumoren). Diese Tumoren gehen häufig mit einer
günstigeren Prognose einher (Preiss, 2006). Weitere 10% der invasiven Tumoren der Mamma
stellt das invasive lobuläre Mammakarzinom; das typische histologische Erscheinungsbild der
Tumoren beinhaltet kettenartig hintereinander angeordnete Tumorzellen (Abb. 1b). Die übrigen
invasiven Tumoren lassen sich keinem speziellen Subtypen zuordnen (no special type carcinoma,
NST) und machen mit etwa 80% die häufigste Unterkategorie der invasiven Mamma-Tumoren
15
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
A
B
→
Abbildung 2: A Histomorphologie der Prostata. Als tubulo-alveoläre Drüse ist sie stark verzweigt. Das Stroma
enthält neben zahlreichen kollagenen Fasern viele glatte Muskelzellen, Gefäße und Nerven. (HEFärbung,Vergrößerung: 300x. Aus: Junqueira, 1996) B Die benigne (noduläre) Prostatahyperplasie zeigt ein dem
Ausgangsgewebe sehr ähnliches histologisches Bild. In den Drüsenlichtungen können vereinzelte Prostatasteinchen
auftreten (Pfeil). (HE-Färbung. Aus: Thomas, 2006)
aus. Sie werden auch als invasiv daktale Tumoren bezeichnet (Abb. 1c) (Thomas, 2006; Kumar,
2005) und bedeuten meist eine ungünstige Prognose für den Patienten (Preiss, 2006).
2.2.3 Histopathologische Besonderheiten des Prostatakarzinoms
Das Prostatakarzinom ist in den westlichen Industrieländern die häufigste Krebserkrankung bei
Männern (Deutschland: 22.3%). In Deutschland wurde 2002 bei etwa 48.650 Männern ein Tumor
der Prostata diagnostiziert, wobei die Inzidenz in den letzten Jahren auf Grund verbesserter
Früherkennung stark zugenommen hat (Ges. epid. Krebsregister, 2006).
Die benigne oder noduläre Prostatahyperplasie BPH ist eine der häufigsten Erkrankungen bei
Männern ab einem Alter über 50 Jahren. Ausgehend von dem normalen (diskontinuierlichen)
zweischichtigen Epithel aus hochprismatischen Epithelzellen und Basalzellen stellt sich die BPH
im histologischen Präparat sehr ähnlich dar (Abb. 2). Die Lichtungen der Drüsen sind zuweilen
stark ausgeweitet; in das Lumen ragen Papillen (von Epithel überzogenes Stroma) oder
Pseudopapillen (Epithelknospen ohne Stroma) (Thomas, 2006).
Nach dem histologischen Erscheinungsbild lassen sich verschiedene Untergruppen der
Prostatatumoren (PCa) definieren. Das drüsenbildende Karzinom ist die häufigste Form dieser
Erkrankung. Zum grading hat sich das System nach GLEASON durchgesetzt (Abb. 3). Dabei
werden gut differenzierte Tumoren mit einheitlich aussehenden rundlichen Drüsen mit dem
Grad 1 bezeichnet. Grad 5 bezeichnet einen Tumor ohne glanduläre Differenzierung mit einer
Infiltration des umgebenden Bidegewebes. Die übrigen Grade stellen Abstufungen zwischen
beiden Extremen dar. Der Tatsache Rechnung tragend, dass sich Tumoren der Prostata
morphologisch sehr heterogen darstellen, werden für jeden Tumor die zwei dominierenden
Differenzierungsgrade ermittelt und zum sog. GLEASON-Score addiert (Gleason, 1966).
16
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
Abbildung
3:
Histologisches
grading
des
Adenokarzinoms der Prostata nach DF Gleason. Die
Zeichnung berücksichtigt neben der klassischen
Einteilung
mit
fünf
Abstufungen
auch
Unterkategorien.
aus: Gleason, 1966
2.1.4 Die Identifizierung prognostisch und therapeutisch relevanter Moleküle begründet
die moderne Biomarkeranalytik
Neben einer Tumordiagnostik auf der Grundlage morphologischer Beobachtungen haben sich in
jüngerer Vergangenheit biomedizinische molekulare Marker (Biomarker) etabliert. Als Biomarker
lassen sich solche Moleküle definieren, die in Geweben oder Körperflüssigkeiten eines Patienten
nachweisbar sind und auf molekularer Ebene Aussagen über seinen Krankheitszustand oder
–Verlauf (monitoring) oder die Wirksamkeit einer Therapie ermöglichen (Stoss, 2004).
Das sog. Prostata-spezifische Antigen PSA (Kallikrein 3) dient der Diagnostik und dem
monitoring des Prostata-Karzinoms. Das Enzym wird in geringen Mengen bereits im gesunden
Epithel der Drüse produziert, bei Vorliegen eines Tumors nimmt der PSA-Spiegel im Serum
jedoch zu. Der Nutzen der PSA-Bestimmung ist eingeschränkt, da das Protein zwar spezifisch für
ein Organ ist, jedoch nicht zwingend auf ein Tumorgeschehen hinweist. Trotz dieser
Einschränkungen ist PSA derzeit der Standard-Biomarker zur Diagnostik des Prostata-Karzinoms
(Kumar, 2005).
Als klassische Biomarker mit prognostischem und prädiktivem Wert für das Mammakarzinom sind
die Rezeptoren für Östrogen ER und Progesteron PgR zu nennen, deren Expression in der
Routinediagnostik mittels Immunhistochemie festgestellt wird. Etwa 50-85% der MammaTumoren exprimieren ER; für die ersten postoperativen Jahre stellt dies eine günstige Prognose
17
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
dar (Possinger, 2006). Patienten mit einem solchen Befund haben zusätzlich einen weitaus
größeren Nutzen von einer gezielten antihormonellen Therapie (Duffy, 2005; Possinger, 2006).
2.1.5 Die Rezeptor-Tyrosin-Kinase Her-2 als Biomarker mit prognostischer und prädiktiver
Relevanz
Als ein interessantes Ziel für zielgerichtete Therapieformen haben sich in den letzten Jahren
die an der Oberfläche von Tumorzellen im Vergleich zu den Ursprungsgeweben verstärkt
exprimierten Rezeptor-Tyrosin-Kinasen herausgestellt (Krause, 2005). Die bei Überexpression
erhöhte Aktivität dieser Moleküle kann durch niedermolekulare Kinase-Inhibitoren oder durch
Antikörper, die ihr Zielmolekül an der Zellaußenseite binden, gehemmt werden.
Ein besonderes Augenmerk bei der Entwicklung neuer Therapiemöglichkeiten liegt auf der EGFRezeptor-Familie. Die vier Mitglieder dieser Familie (EGFR/Her-1, Her-2, Her-3 und Her-4) sind
in einer Vielzahl von Tumorentitäten überexprimiert (Holbro, 2003; Yarden, 2001) und stellen so
ein wertvolles therapeutisches Ziel dar.
Innerhalb der EGF-Rezeptor-Familie kommt Her-2 eine besondere Rolle zu. Der Rezeptor wird in
etwa 20-30% der invasiven Mamma-Tumoren überexprimiert, was in der überwiegenden
Mehrzahl der Fälle auf eine Amplifikation des 17q21-Genlocus zurückzuführen ist (van de Vijer,
1988). Die Überexpression des Her-2 geht mit einer schlechten Prognose für die betroffenen
Patienten einher (Slamon, 1987), ist jedoch eine Voraussetzung für das Ansprechen auf eine
Therapie
mit
dem
humanisierten
monoklonalen
Antikörper
Herceptin™
(Trastuzumab,
Genentech, San Francisco, CA, USA). Das Medikament ist in den USA seit 1998 und in Europa seit
2000 zur Therapie Her-2-überexprimierender, metastasierter Mamma-Karzinome zugelassen
(Slamon, 2001; Cobleigh, 1999); nach jüngsten positiven Studienresultaten ist eine Zulassung
zur adjuvanten Behandlung im Jahre 2006 wahrscheinlich (Piccart-Gebhart, 2005).
Auf der Basis der immunhistochemischen Befundung, die zur Zeit als Standardverfahren zur
Identifizierung von für eine Therapie mit Herceptin™ geeigneten Patienten gilt, ergibt sich in
der Monotherapie eine response-Rate von derzeit etwa 30% der behandelten Patienten, die sich
in Kombination mit anderen Medikamenten (Taxane, Platin-Verbindungen) auf über 50% erhöht
(Baselga, 2005; Ocana, 2006). Der Mechanismus, der jedoch bei der überwiegenden Mehrheit
der behandelten Personen zu einer Resistenz gegen Herceptin™ trotz nachgewiesener
Überexpression des Her-2-Rezeptors führt, ist bislang ungeklärt.
Das Auftreten von Resistenzen gegen die Her-2-gerichtete Therapie hat zur Entwicklung neuer
Her-2-Inhibitoren geführt, die zur Zeit in klinischen Studien untersucht werden. Neben dem
niedermolekularen Kinase-Inhibitor Lapatinib (GW572016, Glaxo SmithKline, Research Triangle
Park, NJ, USA) ist hier der humanisierte monoklonale Antikörper Pertuzumab (Omnitarg™,
18
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
Genentech, San Francisco, CA, USA) zu erwähnen, von dem man sich eine verbesserte
Wirksamkeit und Ansprechrate gegenüber Herceptin™ erhofft (Hynes, 2004).
Bei ähnlicher Wirkweise und gleichem molekularen Ziel ist bei der Behandlung von Tumoren mit
Omnitarg™ von ähnlichen Wirk- und Resistenzmechanismen auszugehen wie bei Herceptin™. Die
vorliegende Arbeit widmet sich der Suche nach den Faktoren, die einen Erfolg bei der Therapie
mit
den
Her-2-gerichteten
Antikörpern
Trastuzumab
und
Pertuzumab
begünstigen,
berücksichtigt dabei auch andere (zielgerichtete) Therapieoptionen. Hinweise auf mögliche
Resistenzmechanismen können in Veränderungen der durch die therapeutischen Antikörper
erkannten Epitope innerhalb des Her-2-Proteins oder in der dem Rezeptor nachgeschalteten
Signaltransduktion zu finden sein (Hynes, 2005).
Die mit dem Her-2 Rezeptor auf zellulärer Ebene assoziierten Vorgänge stellen den Schwerpunkt
der folgenden Abschnitte dar.
2.2
Zellen kommunizieren mit ihren Nachbarn
Während z.B. die Hormone der Hypophyse Auswirkungen auf ein Organ oder ein Organsystem
haben, ist innerhalb eines Gewebes ein fein abgestimmtes Verhalten einer jeden Zelle wichtig.
Damit jede Zelle in einem Gewebeverband ihre Aufgabe übernehmen kann, erhält sie von ihren
unmittelbaren Nachbarzellen zu jeder Zeit Signale in Form sog. Wachstumsfaktoren. Da diese
Faktoren auf eine Zelle selbst oder ihre Nachbarzellen wirken, spricht man von einer autokrinen
oder parakrinen Stimulation. Eine wichtige Familie bilden die EGF (epidermal growth factor)ähnlichen Wachstumsfaktoren. Zu dieser Gruppe gehören neben EGF selbst auch HB-EGF
(heparin-binding
EGF),
TGF-α
(transforming
growth
factor-α),
Amphiregulin,
Epigen,
Betacellulin und Epiregulin sowie Heregulin 1-4 (Abb. 4). Alle werden in Form von teils sehr
großen, membranständigen Vorläuferproteinen synthetisiert und bei Bedarf durch MatrixMetalloproteasen (MMP) in ihrer aktiven Form freigesetzt. Allen diesen Wachstumsfaktoren
gemein ist die EGF-ähnliche Domäne, die den Hauptteil ihrer Struktur ausmacht (Harris, 2003;
Falls, 2003).
Damit eine Zelle die an sie gerichteten Signale empfangen kann, besitzt sie an ihrer Oberfläche
Rezeptoren, an die die Wachstumsfaktoren binden. Die Bindung eines solchen Liganden an
seinen Rezeptor bewirkt die Auslösung einer Signalkaskade, die in der spezifischen Antwort
einer Zelle endet.
19
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
A
EGF
TGF-α
AR
Epigen
HB-EGF
BTC
EPR
B
NRG
←
←
←
←
←
EGF
erbB1
Her-1
EGFR
erbB2
Her-2
neu
erbB3
Her-3
erbB4
Her-4
←
TGF- HBalpha EGF
←
←
AR
←
←
BTC
Dimerisierungs- und Liganden-Bindungsdomäne
EGF-ähnliche Domäne
Transmembranregion
Heparin-Bindungsdomäne
Tyrosinkinase-Domäne
←
←
←
←
←
←
EPR Epigen NRG
1-4
← proteolytische Schnittstelle
Abbildung 4: A Schematische Darstellung der Rezeptoren der EGFR/Her-Familie und ihrer jeweiligen
Wachstumsfaktoren. B EGF-ähnliche Wachstumsfaktoren werden als membranständige Vorläufer produziert und
bei Bedarf durch proteolytische Spaltung an den gekennzeichneten Stellen als funktionstüchtige Liganden der
Her-Rezeptoren freigesetzt. Die Neureguline NRG 1-4 liegen zusätzlich in verschiedenen durch alternatives
Splicing entstehenden Isoformen vor, die hier nicht dargestellt sind. Abkürzungen: EGF epidermal growth factor,
HB-EGF heparin-binding EGF, TGF-α transforming growth factor-α, BTC Betacellulin, AR Amphiregulin, EPR
Epiregulin, NRG Neuregulin
nach: Harris, 2003
2.3
EGF-Rezeptoren besitzen eine Tyrosin-Kinase-Aktivität
Die EGF-Rezeptoren EGFR/Her-1/erbB-1, Her-2/neu/erbB-2, Her-3/erbB-3 und Her-4/erbB-4
bilden die Familie der transmembranösen Typ-I-Rezeptor-Tyrosin-Kinasen und weisen eine
weitgehend einheitliche Struktur auf (Schlessinger, 2000; Olayioye, 2000). Die extrazellulär
gelegene Liganden-Bindungsdomäne kann je nach Rezeptor verschiedene Wachstumsfaktoren
der EGF-Familie binden (Abb. 4); entgegen Berichten zu Beginn der 90er Jahre (Lupu, 1992)
konnte für Her-2 bisher kein eigener Ligand identifiziert werden. Ebenfalls auf der
extrazellulären Seite der Rezeptoren befindet sich eine Dimerisierungsdomäne, der bei der
Aktivierung des Rezeptors durch Bindung eines Liganden eine besondere Bedeutung zukommt.
Mit Ausnahme von Her-2 liegen die EGF Rezeptoren in zwei unterschiedlichen Konformationen
vor (Abb. 5) (Burgess, 2003). Im inaktiven Zustand sind sie durch intramolekulare
Wechselwirkungen „gefaltet“ („tethered“) und die Ligandenbindungsstellen werden exponiert.
20
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
Abbildung 5: Struktur der
extrazellulären Domänen des
EGFR in inaktivem Zustand
(links) und nach Bindung eines
Liganden (rechts). In inaktivem
Zustand
sind
die
Bindungsdomänen I und III (rot)
exponiert;
durch
intramolekularer Wechselwirkungen
der Domän-en II und IV (grün)
liegt der Rezeptor in einer
gefalteten Konformation vor.
Bindung des EGF führt zu einer
Rotation des Moleküls und
Exposition der Domänen II und
IV, die über intermolekulare
Wechselwirkungen zur Stabilisierung des Rezeptor-dimers
beitragen (aus: Burgess, 2003).
Nach Bindung eines Wachstumsfaktors erfährt der Rezeptor eine Konformationsänderung,
wodurch die Dimerisierungsregion freigelegt wird. Durch intermolekulare Wechselwirkungen der
Dimerisierungsdomänen zweier Rezeptoren kommt es zur Ausbildung von Rezeptor-Dimeren und
nachfolgend zur Aktivierung der intrazellulär gelegenen Kinasedomänen, die über eine singlehelix-Transmembranregion mit dem ist der außerhalb der Zelle gelegenen Teil des
Rezeptormoleküls verbunden sind. Die Kinasedomäne des Her-3-Rezeptors galt lange Zeit als
funktionslos; erst vor kurzem konnte pyk2 als ein Zielprotein identifiziert werden (van der
Horst, 2005).
Ebenfalls
auf
der
cytoplasmatischen
Seite
der
EGF-Rezeptoren
befindet
sich
eine
Regulatordomäne, deren Tyrosin-Seitengruppen nach der Rezeptoraktivierung eine wichtige
Rolle spielen. Die Aktivierung der Kinasedomänen der in einem Dimer verbundenen Rezeptoren
hat die trans-Phosphorylierung der jeweiligen Regulatordomänen zur Folge, womit die
Aktivierung
des
Rezeptordimers
abgeschlossen
ist.
Die
für
jedes
Rezeptordimer
charakteristischen Phosphorylierungsmuster werden von Adaptorproteinen gebunden, die
verschiedene Effektorproteine aktivieren. Neben der Stimulation verschiedener Signalkaskaden
werden so ebenfalls verschiedene regulatorische Proteine aktiviert, wodurch eine Modulation
von Signalstärke und -dauer erreicht wird (Schlessinger, 2000; Sweenes, 2004). Jedem
Rezeptordimer kann so ein transformierendes Potenzial zugeschrieben werden, das für Her2/Her-3-Heterodimere am größten ist, da diese sich einer Degradation entziehen (Citri, 2003).
Die Aktivierung des 1985 erstmals klonierten humanen Her-2 ist von der Bindung eines Liganden
unabhängig (Schechter, 1985). Es liegt konstitutiv in der „offenen“ Form vor und ist daher der
bevorzugte Dimerisierungspartner für die übrigen Mitglieder der EGFR-Familie; auch die Bildung
anderer Homo- oder Heterodimere ist möglich (Burgess, 2003). Durch die ständige Bereitschaft
zur Dimerisierung besteht ebenfalls die Möglichkeit der spontanen Bildung von Her-2Homodimeren.
21
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
2.4
Aktivierte Her-Rezeptoren lösen eine Signalkaskade aus
Die Regionen der Tyrosin-Autophosphorylierung dienen als Bindungsstelle für Adaptorproteine
mit SH2/SH3- (src homology 2/3), PH- (pleckstrin homology) oder PTB- (phospho-tyrosine
binding) Domänen (Schlessinger, 2000). Die Selektivität der Proteine für eine bestimmte
Bindungsstelle wird durch die Erkennung einer bestimmten Aminosäurensequenz C-terminal des
phosphorylierten Tyrosins erreicht. Die Adaptorproteine, zu denen Grb2, Gab1, SHC, shk und
weitere gehören, bilden zusammen mit dem aktivierten Rezeptor einen sog. Signalkomplex aus.
Dabei ist noch ungeklärt, ob mehrere Adaptorproteine an ein Rezeptormolekül binden können
(Gomperts, 2004). Die zur Zeit bekannten Phosphorylierungsstellen der Her-Rezeptoren und die
dort jeweils bindenden Adaptoren sind in Abb. 6 dargestellt.
Der Signalkomplex rekrutiert weitere Effektorproteine und aktiviert diese ebenfalls durch
Phosphorylierung. Eine Vielzahl von Signalwegen kann auf diese Weise gezielt aktiviert werden;
eine fehlgesteuerte Regulation der Signaltransduktion wurde in vielen Fällen als mit der
Entstehung von Tumoren verbunden beschrieben. Die wichtigsten dieser pathways werden im
Folgenden vorgestellt.
EGFR
Her-2
Y
845
Y
974
Y
992
Y
1045
Y
1068
Y
1086
Y
1101
Y
1148
Y
1173
c-src
AP-1
PLCγ
cbl
Grb2
Gab1
c-src
SHC
SHC
PLCγ
Y
1139
T
S
1172 1174
Y
1196
Y
1221/22
c-src
Grb2
CaMK2α
T
686
Y
877
Y
992
PLCγ
c-src
Y
Y
1023 1112
Y
Y cbl
Y
1035
Her-3
Her-4
Y
1241
Y
1248
SHC
Grb2
PLCγ
Y
1178
Y
1180
Y
1203
Y
1243
PI-3K PI-3K
(p85) (p85)
Grb7
PI-3K PI-3K Grb7
(p85) (p85)
SHC
Grb2
PLCγ
shk
Y
1257
Y
1270
Y
1289
PI-3K
(p85)
PI-3K PI-3K
(p85) (p85)
Y
1309
SHC
Y
845
Y
974
Y
992
Y
1056
Y
1068
Y
1086
Y
1101
Y
1148
Y
1188
Y
1242
845
974
992
PI-3K
(p85)
1068
1086
1101
1148
SHC
SHC
Abbildung 6: Rezeptoren der Her-Familie (extrazelluläre Domäne • verkürzt dargestellt). Dargestellt sind die
bekannten intrazellulären Phosphorylierungsstellen und mögliche Interaktoren. Auf die Bedeutung der einzelnen
Interaktionen für Signaltransduktion wird im Text eingegangen.
Quelle: www.phosphosite.org
22
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
2.4.1 Der MAP-Kinase-Signalweg fördert die Zellteilung
Bindung des Adaptorproteins Grb2 über dessen SH2-Domäne an einen phosphorylierten HerRezeptor führt zur Aktivierung des MAP (mitogen activated protein)-Kinase Signalweges
(Abb. 7). In Verbindung mit dem guanylate exchange factor (GEF) Sos kommt es zur Aktivierung
der GTPase ras (Bar-Sagi, 2000). Eines der vielen Zielmoleküle von ras ist die Serin/ThreoninKinase raf, die ihrerseits eine weitere Kinase, MEK, phosphoryliert. MEK, eine Threonin/TyrosinKinase, phosphoryliert als einziges bisher identifiziertes Substrat ERK (extracellular signal
regulated kinase). In der Folge kommt es zur Bildung von ERK-Dimeren, die sowohl Zielproteine
im Cytoplasma aktivieren als auch in den Nukleus translozieren können.
Eine Funktion der Serin/Threonin-Kinase ERK ist die Aktivierung der ribosomalen ProteinSynthese durch Modulation der mRNA-Bindung des Initiations-Faktors eIF-4E. Dieses Protein ist
essentiell für die Assemblierung der ribosomalen Untereinheiten.
Daneben fördert ERK die mRNA-Synthese durch Aktivierung von Transkriptionsfaktoren im
Zellkern. Beispiel hierfür ist p62TCF, das einen DNA-bindenden Komplex mit p67SRF bildet und die
Transkription von Genen fördert, deren Promotor-Regionen serum response elements SRE
beinhalten. Eines der so transkribierten Gene ist c-fos. Der von diesem Gen codierte
Transkriptionsfaktor fördert die Transkription von Cyclin D, das für den Übergang von G0- zur G1-
Zellmembran
Rezeptor
Grb2 Sos
ras
raf
inaktiv
Initiation der Proteinsynthese
MEK
MEK
aktiv
ERK
ERK
inaktiv
aktiv
eIF-4e
ERK ERK
MNK1
40S
60S
Kernmembran
ERK ERK
TCF SRF
Gen-Transkription: c-fos
SRE
DNA binding domain
Abbildung 7: Über den MAP (mitogen activated protein)-Kinase Signalweg können verschiedene Reaktionen einer
Zelle hervorgerufen werden. Die Proteinsynthese wird durch Bindung des Initiationskomplexes an der mRNA
gesteigert. Die spezifische Transkription zellzyklusrelevanter Gene erfolgt durch Aktivierung entsprechender
Transkriptionsfaktoren. In beiden Fällen spielt die Serin/Threonin-Kinase ERK eine entscheidende Rolle.
23
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
Phase des Zellzyklus vonnöten ist. Die Aktivierung von Cyclin D und das damit verbundene
Fortschreiten des Zellzyklus erfolgt in weniger als einer Stunde nach Bindung des
entsprechenden Wachstumsfaktors (Gomperts, 2004).
2.4.2 Die PIP3-abhängige Signaltransduktion beeinflusst zentrale Funktionen einer Zelle
Phosphatidyl-Inositol-2,3,4-Triphosphat PIP3 dient einigen Enzymen als Substrat, die in der
Signaltransduktion eine zentrale Rolle einnehmen. Zu diesen zählen Phospholipase C, die ein
wichtiges Glied in der Ca2+-vermittelten Signaltransduktion darstellt, sowie PDK1 als direkter
Aktivator der Serin-Kinase AKT/PKB (Protein Kinase B). Zu den wichtigsten Funktionen dieses
Enzyms gehören die Regulation der Glucose-Aufnahme und –Speicherung, der Apoptose und des
Teilungsverhaltens (Vivanco, 2002).
Zur Aktivierung von AKT kann es auf verschiedenen Wegen kommen; der häufigste involviert
Rezeptor-Tyrosin-Kinasen wie der EGF-Rezeptor-Familie (Abb. 8). Diese werden durch die
regulatorische Untereinheit der Phosphatidyl-Inositol-3-Kinase (PI-3K), p85, über eine PTBDomäne erkannt. Sie bildet zusammen mit der katalytischen Untereinheit p110 das PI-3KHoloenzym, das die Bildung von PIP3 aus Phosphatidyl-Inositol-3,4-Diphosphat PIP2 katalysiert.
Dieser Reaktion entgegen wirkt die Phosphatase PTEN (phosphatase and tensin homologue).
Eine fehlende Expression dieses Enzyms oder loss of function-Mutationen haben eine
konstitutive Aktivierung der PIP3-abhängigen pathways zur Folge (Vivanco, 2002; Cully, 2006).
Rezeptor
p85
PIP2
Zellmembran
PTEN
PIP3
GLUT4
Translokation
p85 p110
PDK1
PI3-K
AKT
inaktiv
AKT
aktiv
Glucoseaufnahme und
- Metabolismus
GSK3β
Inhibition der Apoptose
Bcl2
bad
Bcl-Xl
APAF
14-3-3
Nukleus
14-3-3
bad
AKT
Zellzyklus
Mitochondrium
p27
p27 Cyclin D
Cyclin D
Abbildung 8: Aktivierung von AKT hat Auswirkungen auf den Stoffwechsel und das Teilungsverhalten einer Zelle;
Glucose wird aus der Umgebung aufgenommen und steht zum Energiegewinn zur Verfügung. Pro-apoptostische
Vorgänge in der Mitochondrienmembran werden unterbunden, der Zellzyklus zugleich vorangetrieben.
24
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
Unter anderem hat Aktivierung von AKT/PKB Auswirkungen auf das Teilungsverhalten einer
Zelle. Durch Phosphorylierung des cdk4-Inhibitors p27Kip1 wird das Fortschreiten des Zellzyklus
am Übergang von G0- zu G1-Phase ermöglicht (Shin, 2002). Zusätzlich inhibiert AKT die Apoptose
durch Phosphorylierung des Moleküls 14-3-3, das daraufhin durch Inhibition von bad die Bildung
des pro-apoptotischen Komplexes aus bad, Bcl-2, Bcl-Xl und Apaf1 in der äußeren
Mitochondrienmembran verhindert (Abb. 8).
Ein weiterer PIP3-abhängiger Signalweg ist der PLC/PKC-pathway (Abb. 9). Phospholipase C
bindet über eine SH2-Domäne an aktivierte Her-Rezeptoren. Nach Phosphorylierung durch deren
Kinase katalysiert das Enzym die Umsetzung von Phosphatidyl-Inositol-Triphosphat PIP2 zu 1,2Diaglycerol DAG und Inositol-Triphosphat IP3. Dieses wirkt aktivierend auf IP3-sensitive
Ionenkanäle in der Membran des endoplasmatischen Retikulums. In der Folge kommt es zu
einem Einstrom von Ca2+-Ionen in das Cytoplasma, gesteigert durch ebenfalls geöffnete
Ionenkanäle in der Cytoplasmamembran (Gomperts, 2004).
Calcium-Ionen und DAG sind zur Aktivierung der Protein Kinase C notwendig. Dieses Enzym wird
unter anderem mit den tumorrelevanten Prozessen der Invasion und Metastasierung in
Verbindung gebracht, da PKC-Aktivierung die Aktivierung von Matrix-Metalloproteasen MMP zur
Folge haben kann. Ähnlich AKT/PKB hemmt PKC die Funktion der Glucagon-Synthase-Kinase 3β
und beeinflusst so den Zuckerhaushalt der Zelle. Zuletzt kann PKC ebenfalls die Serin/ThreoninKinase raf aktivieren und wirkt somit fördernd auf den MAP-Kinase-Signalweg.
Zellmembran
Rezeptor
PLCγ
PIP3
PTEN
MMP
PIP2
1.2-DAG
GlucoseMetabolismus
IP3
PKC
Calcium
PKC
GSK3β
raf
MAP-Kinase
pathway
Endoplasmatisches
Retikulum
Calcium
Ionenkanal
(IP3-sensitiv)
Calmodulin
Abbildung 9: Bindung der Phospholipase C an aktivierte EGF-Rezeptoren führt zum Einstrom von Ca2+-Ionen aus
dem ER (und dem Extrazellularraum). In der Folge kommt es zur Aktivierung verschiedener Calcium-abhängiger
Moleküle, darunter Calmodulin und PKC. Diese beeinflusst Glucosestoffwechsel und Teilungsverhalten der Zelle.
25
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
2.4.3 Eine Vielzahl anderer Rezeptoren und Proteine beeinflusst die Her-assoziierte
Signaltransduktion
Die Vielzahl der mit der EGF-Rezeptor-Familie verknüpften Signalkaskaden wird zusätzlich
vergrößert durch eine große Zahl von Rezeptoren und anderen Molekülen, die in einem
„Netzwerk aus Netzwerken“ die bereits beschriebenen pathways nutzen und beeinflussen
(Yarden, 2001). Obwohl die (teilweise) Entwirrung dieses Netzwerkes eines der Ziele dieser
Arbeit sein soll, ist eine vollständige Darstellung aller Signalwege an dieser Stelle nicht möglich.
Ein Beispiel für einen alternativen Rezeptor ist der IGF-1R, dem in der Literatur eine große
Rolle bei der Entstehung von Resistenzen gegen Her-2-gerichtete Therapien zugeschrieben wird
(Albanell, 2001; Lu, 2001). Die Eigenschaften des IGF-1R sind denen der Her-Rezeptoren sehr
ähnlich, da er über insulin receptor substrate-1 IRS1 an den MAP-Kinase-pathway gekoppelt ist
und zudem über eine Bindungsstelle für die p85-Untereinheit der PI-3K verfügt (Pollak, 2004).
Steroidhormon-Rezeptoren spielen ebenfalls eine bedeutende Rolle in der Kreuzaktivierung von
EGF-Rezeptor-assoziierten Signalkaskaden. Östrogen etwa löst nach Bindung an einen
entsprechenden nukleären Rezeptor, der zugleich als Transkriptionsfaktor dient, die
Transkription des IGF-1R-Genes aus. Zusätzlich interagiert der Östrogenrezeptor (ER) mit
verschiedenen Komponenten der MAP-Kinase- und AKT-Signalwege.
2.5
Tumoren der Mamma weisen Gemeinsamkeiten mit Prostatakarzinomen auf
Neoplasien der Brustdrüse sind in ihrer Entstehung zu einem großen Teil von Steroidhormonen
abhängig. Dieser Zusammenhang zwischen endokrinem System und einer Tumorerkrankung hat
zur Entwicklung spezieller therapeutischer Konzepte geführt, die eine Unterbrechung dieser
Interaktion zum Ziel haben und allgemein als erste erfolgreich angewandte zielgerichtete
Therapie angesehen werden. Im Falle des Mammakarzinoms gehören die Anti-Östrogene
Tamoxifen und Fulvestrant sowie Anastrozol und Letrozol als Aromatase-Hemmer zu den
bevorzugten Therapeutika. Beide haben in unterschiedlichen Organen verschiedene agonistische
und antagonistische Effekte und werden wegen dieser Wirkweise als selective estrogen receptor
modulators SERMs bezeichnet (Rau, 2005; Smith, 2003).
Ähnlich den Tumoren der Brustdrüse bei der Frau ist das Prostatakarzinom die häufigste
geschlechtsspezifische maligne Erkrankungsform bei Männern. Über die auslösenden Faktoren ist
bisher wenig bekannt, jedoch konnten Veränderungen auf chromosomaler Ebene nachgewiesen
werden. So wurden Mutationen in Tumorsuppressorgenen wie p53, PTEN und KAI1 gefunden.
Expressionsstudien mit cDNA-Mikroarrays zeigten zudem Überexpression verschiedener Gene wie
der Serin-Protease Hepsin, der α-methyl-acyl-CoA-Racemase oder des Transkriptionsfaktors
EZH2 (Feldman, 2001).
26
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
Die Bestimmung des Serum-Spiegels der Serin-Protease Kallikrein 3 (KLK3), das sog. prostatespecific antigen PSA, dient der Diagnostik des Prostatakarzinoms. Bei einem sicher
diagnostizierten Prostatakarzinom zählen die radikale Prostatektomie, Radiotherapie sowie, in
Analogie zu den Tumoren der Mamma, die hormonelle Intervention zu den therapeutischen
Optionen. Insgesamt wird so bei über 90% der Patienten eine Überlebensrate von mehr als 15
Jahren erreicht, sofern der Primärtumor restlos entfernt werden konnte und noch kein Befall
tumornaher Lymphknoten oder weiter entfernter Organe vorliegt (Feldman, 2001).
Die Hormonabhängigkeit der gesunden Prostata und ihrer frühen Neoplasien legt eine gegen
diese Stoffe gerichtete Therapie nahe. So kam es durch HUGGINS und HODGES zu ersten Schritten
auf dem Gebiet der Androgenablationstherapie (Huggins, 1941). Nachdem zunächst gezeigt
wurde, dass Orchiektomie (Entfernung des Hodens) zur Reduktion des Wachstums von
Prostatatumoren
führt,
kommen
heutzutage
medikamentöse
Strategien
(„chemische
Kastration“) zum Einsatz. Die Verwendung von GnRH (Gonadotropin Releasing Hormone)Antagonisten führt zu einem Ausbleiben der LH (luteinisierungshormon)-Produktion, was
wiederum die Testosteron-produktion in den Hoden unterbindet. Zusätzlich können Inhibitoren
des Androgen-Rezeptors AR verabreicht werden.
Im Laufe einer antihormonellen Therapie treten bei einem Großteil der Patienten Rezidive auf,
zu deren molekularen Charakteristika ein Hormon-unabhänges Wachstum gehört. Zur
Behandlung dieser sog. hormon-refraktären Prostatakarzinome (HRPC) ist zum jetzigen
Zeitpunkt keine wirksame Therapie bekannt. Ebenso ist der genaue Entstehungsmechanismus bis
dato ungeklärt. Neben verschiedenen Theorien, die sich mit Veränderungen der AR-assoziierten
Signaltransduktion befassen Feldman, 2001), wird derzeit die Rolle des Her-2-Rezeptors
diskutiert (Di Lorenzo, 2004). In einigen Studien wurde eine Überexpression des HER-2-Genes
nachgewiesen (Osman, 2001; Shi, 2001); zusätzlich konnten Interaktionen mit dem Androgen
Rezeptor ermittelt werden (Mellinghoff, 2004; Yeh, 1999). Hieraus ergibt sich die Frage nach
der Übertragbarkeit bereits etablierter Her-2-gerichteter Strategien auf das (hormonunabhängige) Prostatakarzinom.
2.6
Identifizierung und Validierung neuer Biomarker mit möglicher therapeutischer oder
prognostischer Relevanz als Hauptaufgabe der vorliegenden Arbeit
Neben der Identifizierung neuer molekularer Zielproteine, die einer Therapie zugänglich sind,
ist die Untersuchung möglicher response- oder resistenzvermittelnder Proteine eine große
Herausforderung für die pharmazeutische Industrie. In einer im März 2005 veröffentlichten
Empfehlung der FDA (US food and drug administration) wird gefordert, für neu entwickelte
Medikamente möglichst umfassende Daten zu den entsprechenden Biomarkern zu erheben(FDA,
27
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
2005). Daher stellt die Biomarkeranalytik einen aktuellen Fokus der biomedizinischen Forschung
und Entwicklung dar (Stoss, 2004).
Die vorliegende Arbeit befasst sich mit der Suche nach neuen Biomarkern, die die Vorhersage
eines Therapieerfolges bei der Behandlung des metastasierten Mammakarzinoms mit den
humanisierten monoklonalen Antikörpern Trastuzumab (Herzeptin) und Pertzumab (Omnitarg™)
ermöglichen. In Anbetracht einer Therapieantwort von etwa 30% der behandelten Patienten in
einer Herceptin™-Monotherapie ist dies aus medizinischer und nicht zuletzt ökonomischer Sicht
sinnvoll. Auch im Hinblick auf die Übertragung der Her-2-gerichteten Therapie auf das
Prostatakarzinom
oder
weitere
Tumorentitäten
ist
zunächst
eine
Aufklärung
des
Wirkmechanismus und beeinflussender Faktoren erforderlich.
In retrospektiv durchgeführten Untersuchungen an humanem Material orientiert sich die
vorgestellte Arbeit weitgehend an einem Patientenkollektiv, das in seinen klinischen
Eigenschaften die Normalbevölkerung widerspiegelt. In Bezug auf die Expression des Her-2Rezeptors sind die zufällig selektierten Patienten so in der Mehrzahl für eine Therapie mit
Pertuzumab (Omnitarg™) geeignet. Diese Patienten zeichnen sich durch eine nur in geringen
Mengen nachweisbare Expression des Her-2 Proteins aus. Zu einem deratigen Patientenkollektiv
liegen bislang keine entsprechenden Untersuchungen bezüglich der Prädiktion bei Her-2gerichteten Therapieformen vor.
Im Gegensatz zu proteomischen Studien untersuchte diese Arbeit in einem gezielten Ansatz die
Expression und Aktivierung von Proteinen der Her-2-assoziierten Signaltransduktion. Da nicht
alle an den Signalwegen beteiligten Proteine untersucht werden können, fand im Vorfeld eine
Selektion statt. Grundlage hierfür waren in der Literatur beschriebene Zusammenhänge der
entsprechenden
Proteine
mit
Therapieresistenz.
Ebenfalls
von
Interesse
waren
als
therapeutische target-Strukturen geeignete Moleküle (Review: Hynes, 2005). Insgesamt wurden
36 Proteine ausgewählt (Tab. 1), deren Expression oder Aktivierungszustand in den Entitäten
des Mamma- und/oder Prostatakarzinoms mittels Immunhistochemie an humanen Geweben
untersucht wurde. Das Verfahren der in situ-Analytik an humanem Material wurde gewählt, da
es zurzeit die Standardmethode in der Untersuchung von fixierten Gewebeproben darstellt
(Sauter, 2003). Die zur Expressionsanalytik verwendeten Antikörper sind mit wenigen
Ausnahmen nicht in der Routinediagnostik etabliert, sondern stellen für Forschungszwecke
geeignete Antikörper dar.
28
Medizinische und biologische Aspekte des Mamma- und des Prostatakarzinoms
Tabelle 1: Ausgewählte Proteine der Her-2-assoziierten Signaltransduktion
EGFR/Her-1
phospho-Her-3
c-kit/CD116
phospho-srcp60
Heregulin
phospho-ERK1/2
CyclinD1
cbl
MMP-9
Östrogen-Rezeptor
Neben
der
dem
Her-2
Her-4
PDGFR
TGF-βR
VEGF
phospho-AKT/PKB
mTOR
bcl-2
phospho-p65 (NF-κB)
Her-2-Rezeptor
phospho-Her-2
IGF-1R
FLT1/VEGFR1
EGF
TGF-α
phospho-PKCβ
phospho-mTOR
TIMP-1
Androgen-Rezeptor
nachgeschalteten
Her-3
phospho-IGFR
FLK1/VEGFR2
HB-EGF
PTEN
phospho-STAT3
p27kip1
MMP-1
Progesteron-Rezeptor
Signaltransduktion
sind
außerdem
Veränderungen des Moleküls selbst von Interesse. Als mögliche Ursache für die Entstehung von
Resistenzen gegen Her-2-gerichtete Therapieregimes ist der Vorgang des „ectodomain
shedding“ seit einigen Jahren bekannt; die biologischen Folgen des „shedding“ sind dabei
bislang ebenso unbekannt wie der genaue Mechanismus (Codony-Servat, 1999); klinisch zeichnen
sich betroffene Tumoren offensichtlich durch eine schlechte Prognose aus (Sáez, 2006). Da der
Prozess zu einer Abspaltung der extrazellulären Domäne des Her-2-Rezeptors und damit zum
Verlust
des
Herceptin™-Epitopes
führt,
ist
ein
Zusammenhang
mit
Therapieresistenz
naheliegend. Neben weiteren in situ-Analysen an Paraffin-Geweben sollen Protein-biochemische
Untersuchungen an menschlichen Tumoren und Zellkultur-Material bei der Aufklärung des
„shedding“ und der klinischen Folgen des Prozesses behilflich sein.
Die erhaltenen Resultate sollen im Idealfall durch vorliegende Daten zum Krankheitsverlauf
sowie zum Verlauf einer entsprechenden Therapie ergänzt werden. So sollten am Ende dieser
Arbeit die gesammelten Daten neue Anhaltspunkte zu möglichen prädiktiven Markern und
Resistenzmechanismen bei der Tumortherapie mit Her-2-Inhibitoren liefern. Durch die Vielzahl
der analysierten potentiellen Biomarker sollten ebenfalls Aussagen über die potentielle Eignung
alternativer targeted therapies möglich sein.
29
3. Materialien und Methoden
3.1
Gewebe für in situ-Expressionsanalytik
Die Immunhistochemie und die Immunfluoreszenz stellen in der täglichen Routinediagnostik die
wichtigsten angewandten Verfahren dar. Auch im Rahmen dieser Arbeit diente menschliches
Gewebe als Ausgangsmaterial, das nach der operativen Entnahme zur Konservierung in 4%
Formalin fixiert und in Paraffin eingebettet wurde. Die Gewebeproben wurden routinemäßig vor
der
weiteren
Verarbeitung
mit
einer
laufenden
Nummer
versehen,
wodurch
eine
Anonymisierung der untersuchten Proben gewährleistet ist.
3.1.1 Mamma
Im Rahmen der vorgestellten Studien wurden zunächst zufällig ausgewählte Normal- und
korrespondierende Tumorgewebe von insgesamt 118 Patientinnen mit fortgeschrittenem
Mammakarzinom untersucht. Das Ausgangsmaterial für die Erstellung von Multi-Gewebe-Blöcken
(siehe 3.1.3) stellten ausschließlich in Formalin fixierte und in Paraffin eingebettete (FFPE)
Gewebeproben dar. Die untersuchte Population zeichnete sich durch die in Tab. 2 aufgeführten
Eigenschaften aus.
Tabelle 2: Klinische Parameter der untersuchten Mammakarzinome
durchschnittliches Alter 61 Jahre (max. 89 Jahre, min. 35 Jahre)
staging
pT1
pT2
pT3
pT4
39
54
9
12
33%
46%
8%
10%
pN0
pN1
pN2
pN3
17
21
3
2
14%
18%
3%
2%
pM1
pM2
1
1
0.8%
0.8%
G1
G2
G2-3
G3
1
77
1
38
0.8%
65%
0.8%
32%
grading
(fortges.)
31
Materialien und Methoden
Tabelle 2: Klinische Parameter der untersuchten Mammakarzinome (Forts.)
Rezeptoren
a) Östrogen-Rezeptor
negativ
positiv
28
82
24%
69%
b) Progesteron-Rezeptor
negativ
positiv
44
67
37%
57%
c) Her-2/neu (DAKO HercepTest Score)
0
1+
2+ / FISH2+ / FISH+
3+
38
31
21
4
16
32%
26%
18%
3%
14%
In einem zweiten Abschnitt der Untersuchungen zur Biologie des Mammakarzinoms wurden
Gewebe von weiteren 44 Patientinnen mit metastasiertem Mammakarzinom analysiert. Neben
FFPE Geweben wurden hier zusätzlich korrespondierende Frischgewebe untersucht, die direkt
nach der Entnahme in flüssigem Stickstoff gefroren und bei –80°C gelagert wurden.
Die untersuchten Gewebe wurden nach der Expression des Her-2 Rezptors ausgewählt.
Insgesamt 6 Gewebeproben wiesen eine niedrige Her-2-Expression auf (HercepTest Score 0, 1+,
2+/FISH neg.); 37 Gewebe konnten als Her-2 überexprimierende Tumoren klassifiziert werden
(HercepTest Score 3+, 2+/FISH pos.). Von besonderem Interesse in diesem Teil der Arbeit waren
die tatsächlichen klinischen Verläufe der Erkrankung; hierzu waren jedoch nur selten gut
dokumentierte Daten verfügbar. Sämtliche Informationen zu den untersuchten Geweben sind in
Tab. 3 zusammengefasst.
Tabelle 3: Histopathologische und klinische Parameter der an
Frischgeweben untersuchten Mammakarzinome
durchschnittliches Alter 61 Jahre (max. 79 Jahre, min. 33 Jahre)
staging
pT1
pT2
pT3
9
19
5
20%
43%
11%
pNx
pN0
pN1
pN2
30
7
6
1
68%
16%
14%
2%
G2
G2-3
G3
11
3
18
25%
7%
41%
grading
Rezeptoren
negativ
positiv
32
a) Östrogen-Rezeptor
13
28
30%
64%
(fortges.)
Materialien und Methoden
Tabelle 3: Histopathologische und klinische Parameter der an
Frischgeweben untersuchten Mammakarzinome (Forts.)
Rezeptoren
b) Progesteron-Rezeptor
negativ
positiv
21
19
48%
43%
c) Her-2/neu (DAKO HercepTest Score)
1+
2+ / FISH2+ / FISH+
3+
6
1
1
36
14%
2%
2%
82%
Therapie
Herceptin (adjuvant; klinische Studie BOND006)
Herceptin (palliativ)
CMF (Cyclophosphamid / Methotrexat / 5-Fluoracil)
EC (Epirubicin / Cyclophosphamid)
Tamoxifen
6
3
3
5
7
14%
7%
/%
11%
16%
3.1.2 Prostata
Es standen insgesamt Gewebeproben von 79 Patienten mit Prostatakarzinom zur Verfügung
(Tab. 4), die in multi tissue arrays zusammengefasst wurden. Korrespondierende normale
Prostatagewebe konnten aus den vorliegenden Gewebeblöcken nur selten gewonnen werden;
nach Möglichkeit wurde auf Gewebeproben aus der Vesicula seminalis zurückgegriffen,
ansonsten wurde Gewebe aus Zonen mit benigner Prostatahyperplasie (BPH) als annähernd
normal angenommen.
Tabelle 4: Klinische Parameter der untersuchten Prostatakarzinome
durchschnittliches Alter 65 Jahre (max. 77 Jahre, min. 51 Jahre)
staging
pT1
pT2
pT3
pT4
0
49
28
1
0%
62%
35%
1%
pN0
pN1
pNx
63
5
9
80%
6%
11%
G1
G2
G2-3
G3
3
48
10
14
4%
61%
13%
18%
2
1
2
20
24
10
17
1
3%
1%
3%
25%
30%
13%
22%
1%
grading
Gleason score
0
2
4
5
6
7
8
9
33
Materialien und Methoden
3.1.3 Herstellung von Multi-Gewebe-Blöcken
Mit Ausnahme der zusammen mit ihren korrespondierenden Frischgeweben untersuchten
Mammatumoren wurden alle untersuchten FFPE Gewebe aus Mamma und Prostata in MultiGewebe-Blöcken
(tissue
micro
arrays,
TMA)
zusammengefasst,
die
das
eigentliche
Untersuchungsgut bildeten.
Zur Herstellung der TMAs wurden zunächst von Pathologen repräsentative Gewebeareale auf
Hämalaun-Eosin-gefärbten
Gewebeschnitten
aus
der
Routinediagnostik
markiert.
Diese
Markierung wurde auf den korrespondierenden Paraffinblock übertragen; mit einer Handstanze
wurden Gewebezylinder mit einem Durchmesser von 1,5 mm und einer maximalen Länge von 1
cm entnommen. Von jedem Patienten wurde jeweils eine Stanze mit normalem (histologisch
unverändertem)
Gewebe
Ausnahmefällen
wurde
sowie
eine
mit
tumorartig
zweite
Stanze
verändertem
mit
Gewebe
Tumorgewebe
für
verwendet.
In
weitergehende
Untersuchungen archiviert.
Zur Erstellung eines Multi-Gewebe-Arrays (TMA) mit 60 Geweben wurden jeweils Normal- und
korrespondierende Tumorgewebe-Stanzen von 27 Patienten verwendet, so dass insgesamt fünf
TMAs mit Mamma-Geweben und drei TMAs mit Geweben aus der Prostata erstellt wurden. Die
übrigen Positionen eines TMA wurden mit Geweben belegt, die in den durchgeführten
Färbeprozeduren als Kontrollen verwendet wurden. Diese Gewebe stammten aus Tonsille,
Skelettmuskulatur, glatter Muskulatur des Colon (inklusive Schleimhaut), Epidermis (Naevus),
Niere sowie Leber. Ein weiteres, exzentrisch angeordnetes Kontrollgewebe (Herzmuskel, Hund)
dient der Orientierung auf dem TMA. Mit der Herstellung der TMAs wurde die Firma Multiblock
GmbH, Hannover beauftragt.
3.2
in situ-Analysen zur Protein-Expression: Immunhistochemie und Immunfluoreszenz
3.2.1 Antikörper
a) Rezeptoren
Antigen
Klon
EGFR/Her-1
Her-2
polycl.
polycl.
R
R
DAKO Cytomation
DAKO Cytomation
Her-2 ECD
10A7
M
Novocastra
phospho-Her-2 Y1248
polycl.
R
Cell Signaling
phospho-Her-2 Y1121
phospho-Her-2 Y877
Her-3
polycl.
polycl.
SGP1
R
R
M
Cell Signaling
Cell Signaling
NeoMarkers
34
Spezies Bezugsquelle
Katalognr.
K1492
K5204
Applikation
IHC
IHC, WB
IHC, IF, IP,
NCL-L-CBE-356
ELISA
IHC, IF,
2247
WB, IP
IHC
2241
IHC
MS-725-P
IHC
Materialien und Methoden
Antigen
Klon
phospho-Her-3 Y1289
Her-4
TGFβR1
IGF-1R
phospho-IR / IGF-1R
EphA2
PDGFR
c-kit / CD117
Flt-1/VEGFR1
KDR/VEGFR2
21D3
HFR-1
8A11
24-31
polycl.
polycl.
polycl.
polycl.
polycl.
polycl.
Spezies Bezugsquelle
M
M
M
M
R
R
R
R
R
R
Cell Signaling
Oncogene
Novocastra
Acris Antibodies
Cell Signaling
Santa Cruz Inc
Santa Cruz Inc.
DAKO cytomation
Acris Antibodies
Acris Antibodies
Katalognr.
Applikation
4791
OP122
NCL-TGFBR1
DM375
3021
sc-924
sc-338
A4502
DP076
DP077
IHC
IHC
IHC
IHC, WB
IHC
IHC
IHC
IHC
IHC
IHC
Katalognr.
Applikation
sc-275
AF-259-NA
18-7338
NCL-HEREG
AF-261-NA
18-7328
IHC
IHC
IHC
IHC
IHC
IHC
b) Wachstumsfaktoren
Antigen
Klon
EGF
HB-EGF
TGF-α
Heregulin
Betacellulin
VEGF
polycl.
polycl.
P/T1
P137
polycl.
VG1
Spezies Bezugsquelle
R
G
M
M
G
M
Santa Cruz Inc
R&D Systems
Zymed
Novocastra
R&D Systems
Zymed
c) Komponenten der extrazellulären Matrix, des Cytoskelettes und Zell-Adhäsionsmoleküle
Antigen
Klon
MMP-1
MMP-9
TIMP-1
Actin
Beta-Catenin
3B6
2C3
polycl.
polycl.
17C2
Spezies Bezugsquelle
M
M
R
R
M
Santa Cruz Inc.
Santa Cruz Inc.
Santa Cruz Inc.
Santa Cruz Inc.
Novocastra
Katalognr.
Applikation
sc-21731
sc-21733
sc-5538
sc-7210
NCL-B-CAT
IHC
IHC
IHC
WB
IHC
d) Signaltransduktion
Antigen
Klon
Erbin
PTEN
phospho-AKT1/2/3
FRAP/mTOR
phospho-mTOR
phospho-ERK1/2
Cyclin D
polycl.
A2B1
polycl.
polycl.
polycl.
polycl.
polycl.
bcl-2/
100/D5
Bcl-2
Spezies Bezugsquelle
Katalognr.
Applikation
G
M
R
R
R
R
R
Santa Cruz Inc.
Santa Cruz Inc.
Santa Cruz Inc.
Santa Cruz Inc.
Cell Signaling
Santa Cruz Inc.
DCS
sc-13249
sc-7974
sc-7985-R
sc-8319
2971
sc-7976-R
CI677C01
IHC
IHC
IHC, WB
IHC
IHC
IHC, WB
IHC
M
Novocastra
NCL-BCL2
IHC
35
Materialien und Methoden
Antigen
Klon
phospho-STAT3 (Tyr)
phospho-src
cbl
phospho-PKC
polycl.
polycl.
polycl.
polycl.
DCS72.F6
p27kip1
Spezies Bezugsquelle
Katalognr.
Applikation
R
R
R
R
Cell Signaling
Cell Signaling
Santa Cruz Inc.
Santa Cruz Inc.
9131
2101
sc-170
sc-11760
IHC
IHC
IHC
IHC
M
DCS
Mob 281
IHC
Katalognr.
Applikation
e) Transkriptionsfaktoren
Antigen
Östrogen-Rezeptor
(ER)
Progesteron-Rezeptor
(PR)
Androgen-Rezeptor
(AR)
phospho-NF-kB p65
Klon
Spezies Bezugsquelle
6F11
M
Novocastra
RTU-ER-6F11
IHC
PgR636
M
DAKO Cytomation
M3569
IHC
441
M
Santa Cruz Inc.
sc-7305
IHC
polycl.
R
Cell Signaling
3031
IHC
f) Sekundär- und Brückenantikörper sowie Immunglobulin-Fraktionen
Antigen
Bezugsquelle
Katalognr.
DAKO ChemMate EnVision™ antiRabbit/Mouse
DAKO cytomation, Hamburg
K5007
rabbit-α-Ziege-IgG
rabbit Immunglobulin Fraction
mouse IgG1
mouse IGM
mouse IgG2a
mouse IgG2b
Jackson Immunoresearch,
London
DAKO cytomation, Hamburg
DAKO cytomation, Hamburg
DAKO cytomation, Hamburg
DAKO cytomation, Hamburg
DAKO cytomation, Hamburg
305-005-045
X0903
X0931
X0942
X0943
X0944
3.2.2 Weitere Reagenzien für Immunhistochemie und Immunfluoreszenz
Wasserstoffperoxid, 30%
Ziegenserum (präimmun)
humanes Serum (präimmun)
AntibodyDiluent
Sigma-Aldrich, Taufkirchen
DAKO Cytomation, Hamburg
Dianova, Karlsruhe
DAKO Cytomation, Hamburg
1 mM EDTA pH 8.0
370 mg EDTA
ad 1 Liter aq.dest.
10x TBS-Puffer pH 7.6
61g TRIS
90g NaCl
ad 1 Liter aq.dest.
36
Materialien und Methoden
TBST-Puffer (Gebrauchslsg.)
1 x TBS-Puffer + 0.05% TWEEN20
PBS-Puffer pH 7.6 (Gebrauchslsg.) 12.4 g Kaliumdihydrogenphosphat KH2PO4
43.1 g Di-Natriumhydrogenphosphat Na2HPO4 x 2 H2O
42.5 g NaCl
ad 5 Liter aq.dest.
10x Citratpuffer pH 6.0
0.1 M Zitronensäure C6H8O7 x H2O
0.1 M Natriumcitrat C6H5O7Na3 x 2 H2O
3.2.3 Anfertigen und Deparaffinieren von Gewebeschnitten
Von in 4% Formalin fixiertem und in Paraffin eingebettetem (FFPE) Gewebe wurden mit einem
Handmikrotom 2-4 µm dünne Schnitte angefertigt, die auf silanisierte Objektträger aufgezogen
und über Nacht bei 38°C im Wärmeschrank getrocknet wurden.
Erforderte das nachfolgend angewandte immunhistochemische Protokoll eine durch Hitze
induzierte Freilegung des nachzuweisenden Antigens (siehe 3.2.4), erfolgte vor der weiteren
Bearbeitung eine 30minütige Inkubation bei 60°C im Wärmeschrank.
Zur Deparaffinierung wurden die Schnitte 2 x 5 Minuten in Xylol inkubiert. Die Rehydrierung des
Gewebes erfolgte in einer absteigenden Ethanolreihe mit jeweils 3minütiger Inkubation in 2 x
100%, 1 x 96%, 1 x 80%, 1 x 70% Ethanol und zuletzt destilliertem Wasser.
3.2.4 Antigen Retrieval
Die Fixation von humanem Gewebe in Formalin führt zu einer irreversiblen Reaktion der
Gewebsproteine mit dem Fixativ. Durch Formalin kommt es zu einer Quervernetzung der
Proteine im Bereich Schwefel-haltiger Seitengruppen der Aminosäuren. Dies führt gegenüber
nativem Gewebe zu einer Maskierung von Epitopen. Durch eine entsprechende Vorbehandlung
müssen die Epitope wieder dem Antikörper zugänglich gemacht werden. Dieser Vorgang wird als
„antigen retrieval“ bezeichnet und ist bislang nicht vollständig aufgeklärt (Montero, 2003;
Referenzen dort).
Zu den gängigen antigen retrieval-Protokollen gehören die hitzeinduzierte Freisetzung des
Epitopes sowie die Behandlung der Probe mit Proteasen, z.B. Trypsin oder Proteinase K.
Zur Freilegung des Antigens mittels Hitze ist 10 mM Citratpuffer bei pH 6.0 oder 5 mM EDTA bei
pH 8.0 das Mittel der Wahl. Die Objektträger mit den aufgezogenen Gewebeschnitten werden in
einer Plastikküvette mit dem gewählten Puffer bedeckt und im Dampfkochtopf, der Mikrowelle
oder einem Autoklav inkubiert. Nach der Wärmebehandlung kühlen die Schnitte im Puffer ca. 30
Minuten auf ca. 50-60°C ab.
Die erforderliche Vorbehandlung wurde für jeden eingesetzten Antikörper separat ermittelt;
eine Zusammenfassung ist unter 3.2.6 Primärantikörper aufgeführt.
37
Materialien und Methoden
3.2.5 Blockierung endogener Peroxidasen und unspezifischer Antikörperbindungsstellen
Nach 3.2.4 behandelte Gewebeschnitte sind prinzipiell geeignet für die immunhistochemische
Untersuchung, besitzen jedoch noch zwei sehr störende Eigenschaften.
Zum einen können im Gewebe endogene Peroxidasen enthalten sein. Bei der abschließenden
Färbereaktion können sie eine unerwünschte Hintergrundfärbung produzieren, da diese
Reaktion ebenfalls durch Peroxidase katalysiert wird. Gewebsperoxidasen werden durch 510minütige Inkubation in 0.3% H2O2 in Methanol inaktiviert. Anschließend werden die Schnitte
fünf Minuten in PBS und weitere fünf Minuten in TBS + 0.05% TWEEN gewaschen.
Zuletzt muss eine Absättigung unspezifischen Bindestellen erfolgen. Dies geschieht durch
Inkubation mit Präimmunseren (10% Ziegenserum oder humanes Serum in PBS), Casein-Lösung
oder BSA. Humanes Serum erzielt eine sehr hohe Reduktion des Hintergrundes bei der
Verwendung von Primärantikörpern aus Kaninchen. Die Blockierlösung wird bei einem Volumen
von 100 µL für 30 Minuten auf dem Schnitt belassen und danach auf einer saugfähigen Unterlage
abgeklopft.
3.2.6 Primärantikörper
Die Inkubation der Schnitte mit dem Primärantikörper erfolgt in der Regel bei 4°C über Nacht.
Die übrigen Schritte werden bei Raumtemperatur durchgeführt.
Der in einem Volumen von 100 µL auf die Schnitte aufgetragene Primärantikörper wird in PBS
oder im gebrauchsfertigen AntibodyDiluent (DAKO Cytomation, Hamburg) verdünnt. Damit die
Schnitte während der langen Inkubation nicht austrocknen, werden sie in eine mit feuchten
Tüchern ausgelegte abgeschlossene Kammer gelegt.
Nachfolgend sind die verwendeten Antikörper und entsprechenden Behandlungsmethoden
aufgelistet. Sofern nicht anders unter „Bemerkung“ erwähnt, handelt es sich bei allen
Protokollen
um
von
Hand
durchzuführende
Färbungen
mit
einer
Inkubation
des
Primärantikörpers bei 4°C über Nacht, einer Peroxidase-Inaktivierung durch 10minütige
Inkubation in 0.3% H2O2 in Methanol und einer Absättigung unspezifischer Bindestellen durch 10%
Ziegenserum in PBS (30 Minuten).
38
Materialien und Methoden
a) Rezeptoren
Antigen
Antigen
retrieval
Verdünnung
(DAKO
AntibodyDil.)
Bemerkung
EGFR pharmDX staining kit; Durchführung entsprechend Herstellerangaben
(DAKO Cytomation, Hamburg)
DAKO HercepTest™; Durchführung entsprechend Herstellerangaben(DAKO
Her-2
Cytomation, Hamburg)
Steamer EDTA,
Her-2 ECD
1:25
20 min
phospho-Her-2 Steamer EDTA,
1:10
Peroxidase-Block: 3% H2O2 in PBS, 10 min
Y1248
20 min
phospho-Her-2 Steamer EDTA,
1:10
Y877
20 min
Steamer,
Citratpuffer
Her-3
1:10
Autostainer
pH6.0 20min
Steamer EDTA,
phospho-Her-3
1:10
20 min
ohne
Her-4
1:75
Autostainer
Vorbehandlung
Steamer,
Citratpuffer
1 :50
Inkubation des Primär-AK: 1h, RT
TGFβR1
pH6.0 20min
Steamer EDTA,
Autostainer, identisches Färberesultat bei
IGF-1R
1:75
20 min
manueller Färbung
phospho-IGF- Steamer EDTA,
1:10
1R
20 min
Steamer,
EphA2
Citratpuffer
1:50
Autostainer
pH6.0 20min
Mikrow. 250W,
PDGFR
Citratpuffer
1:100
Autostainer
pH6.0 30min
Steamer,
c-kit / CD117 Citratpuffer
1:50
Autostainer
pH6.0 20min
Steamer,
Flt
Citratpuffer
1:25
Autostainer
pH6.0 20min
Steamer,
Citratpuffer
KDR
1:25
Autostainer
pH6.0 20min
EGFR/Her-1
39
Materialien und Methoden
b) Wachstumsfaktoren
Antigen
EGF
HB-EGF
TGF-α
Heregulin
Betacellulin
VEGF
Antigen
Retrieval
Steamer,
Citratpuffer
pH6.0 20min
Steamer,
Citratpuffer
pH6.0 20min
Steamer,
Citratpuffer
pH6.0 20min
Steamer,
Citratpuffer
pH6.0 20min
Steamer EDTA,
20min
Steamer,
Citratpuffer
pH6.0 20min
Verdünnung
(DAKO
AntibodyDil.)
1:50
Bemerkung
manuelle Färbung, identisches Resultat bei
Durchführung mit dem Autostainer
1:100
1:75
c) Komponenten der extrazellulären Matrix, Zell-Adhäsionsmoleküle
Antigen
MMP-1
MMP-9
TIMP-1
β-Catenin
40
Antigen
Retrieval
Steamer,
Citratpuffer
pH6.0 20min
Steamer EDTA,
20min
Steamer,
Citratpuffer
pH6.0 20min
Steamer,
Citratpuffer
pH6.0 20min
Verdünnung
(DAKO
AntibodyDil.)
Bemerkung
1:25
1:25
1:75
1:25
Inkubation des Primär-AK: 1h, RT
Materialien und Methoden
d) Signaltransduktion
Antigen
PTEN
phosphoAKT1/2/3
phosphoERK1/2
Cyclin D
Bcl-2
phosphoSTAT3 (Tyr)
phospho-src
cbl
phospho-PKC
p27kip1
Antigen
Retrieval
Steamer,
Citratpuffer
pH6.0 20min
Steamer,
Citratpuffer
pH6.0 20min
Steamer,
Citratpuffer
pH6.0 20min
Steamer,
TargetRetriev.
Solution pH9.0
20min
Mikrowelle
250W,
Citratpuffer
pH6.0 30min
Steamer,
Citratpuffer
pH6.0 20min
Steamer EDTA,
20 min
Steamer,
Citratpuffer
pH6.0 20min
Steamer,
Citratpuffer
pH6.0 20min
Steamer,
Citratpuffer
pH6.0 20min
Verdünnung
(DAKO
AntibodyDil.)
Bemerkung
1:40
Autostainer
1:50
Autostainer
1:40
Autostainer
1:100
Autostainer
1 :30
Autostainer
1:40
Autostainer
1:10
1:50
Autostainer
1:40
Autostainer
1:30
e) Transkriptionsfaktoren
Antigen
ÖstrogenRezeptor (ER)
ProgesteronRezeptor (PR)
Antigen
Retrieval
Steamer,
TargetRetriev.
Solution pH9.0
20 min
Steamer,
EpitopeRetr.
Solution pH6.1
2x20 min
Verdünnung
(DAKO
AntibodyDil.)
Bemerkung
gebrauchsfertig Autostainer
1 :20
Autostainer
41
Materialien und Methoden
Antigen
Antigen
Retrieval
Bemerkung
Verdünnung
(DAKO
AntibodyDil.)
Mikrowelle
250W,
Citratpuffer
pH6.0 30min
Phospho-NF-κB Steamer EDTA,
20 min
p65
AndrogenRezeptor (AR)
1:50
1:10
3.2.7 Plausibilitätsprüfung immunhistochemischer Färbeprotokolle
Um unspezifische Bindungen des verwendeten Primär-Antikörpers ausschließen zu können, wird
in Negativ-Kontrollen der Primärantikörper durch entsprechende Mengen Immunglobulin aus
prä-Immunseren ersetzt. Alternativ kann auch ein Antikörper mit gleichem Ig-Isotyp wie der in
dem Färbeprotokoll verwendete eingesetzt werden, der gegen ein nicht-menschliches Epitop
gerichtet
ist.
Im
Idealfall
sollte
untersucht
werden,
inwieweit
die
Inhibition
der
Antikörperbindung durch simultane Inkubation mit dem entsprechenden Epitop/Peptid möglich
ist; zu den im Rahmen dieser Arbeit verwendeten Antikörpern lagen die jeweiligen Peptide
nicht vor, weswegen die Ig-Isotyp-spezifische Plausibilitätsprüfung der Färbeprotokolle
durchgeführt wurde.
Für jede der vorgestellten immunhistochemischen Färbeprozeduren wurde eine Ig-spezifische
Isotypkontrolle mit der jeweiligen Konzentration des Primär-Antikörpers entsprechenden
Mengen
Immunglobulin
etabliert.
Dabei
wurde
bei
gleichen
Färbeprotokollen
mit
unterschiedlichen Konzentrationen des Primär-Antikörpers in der Isotyp-Kontrolle nur die
maximale Konzentration berücksichtigt. Zusätzlich wurde durch Auslassen des Primärantikörpers
die unspezifische Bindung des enzymgekoppelten Detektions-Antikörpers untersucht.
3.2.8 Detektion und Konservierung
Gebundene Primär-Antikörper werden durch eine enzymkatalysierte Färbereaktion, bei der ein
chromogenes Substrat umgesetzt wird, sichtbar gemacht. Standardmäßig wurde im Rahmen
dieser Arbeit das EnVision+-System (DAKO Cytomation, Hamburg) verwendet. Hier sind mehrere
Einheiten der Meerrettich-Peroxidase HRP über ein Polymer an den entsprechenden
Sekundärantikörper gebunden, so dass eine hohe Amplifikation des Signals gegeben ist. Das
Substrat stellt DAB (3,3-Diaminobenzidin-Tetrahydrochorid, DAKO Cytomation, Hamburg) dar,
das in 1:50-Verdünnung in einem speziellen Puffer auf die Schnitte gegeben wird. Die
Färbereaktion erfolgt während der 10minütigen Inkubation mit dem Färbesubstrat.
42
Materialien und Methoden
Anschließend erfolgte eine Gegenfärbung mit dem Farbstoff Hämatoxilin. Die Substanz bindet
an negativ geladene Komponenten des Gewebes (z.B. die DNA des Nukleus) und färbt diese an.
Der zunächst rote Farbstoff wird durch eine pH-Änderung in die unlösliche blaue Form
überführt. Zuletzt wurde in einer aufsteigenden Alkoholreihe das Gewebe dehydriert und
anschließend mit einem Kunstharz (DEPEX, Pertex, Eukitt, Histomount) und einem Deckgläschen
konserviert. Bei Verwendung eines wässerlöslichen Färbesubstrates, z.B. DAKO FastRed bei
alkalischer Phosphatase-gekoppelten Sekundärantikörpern, ist die Konservierung des Schnittes
durch den Einsatz wässriger Medien entsprechend anzupassen.
3.2.9 Immunhistochemische Färbungen mit dem Färbeautomat
Die Durchführung immunhistochemischer Färbeprotokolle von Hand ist zumindest bei großen
Probenzahlen zeitaufwendig. Hier hilft eine Automatisierung, wobei nicht alle Färbeprotokolle
übertragbar sind. Ein Großteil der im Rahmen dieser Arbeit etablierten Nachweise ist jedoch für
eine automatisierte Färbung geeignet und entsprechend optimiert, was eine routinemäßige
high-troughput Durchführung dieser Protokolle erlaubt.
Die immunhistochemische Färbung von Schnittpräparaten mit dem TECAN Genesis RSP200
Immunostainer (Software: Gemini 3.40) erforderte wie die manuelle Färbung zunächst eine
Deparaffinierung der Schnitte sowie eine Vorbehandlung zum antigen retrieval und Blockieren
endogener Peroxidasen. Nicht notwendig war die Blockierung unspezifischer Bindestellen durch
Präimmunseren. Die Schnitte wurden in den Färbeautomat eingesetzt und eine Computergesteuerte Routine gestartet. Sie unterschied sich im Wesentlichen nicht von der manuellen
Färbung, lediglich die applizierten Volumina sowie Inkubationszeiten waren leicht verändert.
Zwischen den folgenden Schritten erfolgte jeweils ein Waschschritt mit 1400 µL PBS/TWEEN
pH 7.4. Die Inkubation des Primärantikörpers erfolgte bei Raumtemperatur über 60 min (“TagProgramm”) oder über vier Stunden (“Nacht-Programm”), die erforderliche Verdünnung wurde
in einem Volumen von 120 µL in DAKO AntibodyDiluent pro Schnitt aufgetragen. Der
Sekundärantikörper (DAKO EnVision+ anti rabbit/mouse) wurde ebenfalls in einem Volumen von
120 µL aufgetragen und verblieb bei Raumtemperatur für 30 Minuten auf dem Schnitt. Die
abschließende Färbereaktion erfolgte durch 10minütige Inkubation in 120 µL DAB-ChromogenLösung (1:50), nach einem erneuten Waschen wie zuvor wurden die Schnitte abschließend noch
einmal mit destilliertem Wasser gewaschen.
Die folgende Gegenfärbung sowie Konservierung der Schnitte entsprach der unter 3.2.8
beschriebenen Vorgehensweise.
43
Materialien und Methoden
3.2.10
Immunfluoreszenz
Die Immunfluoreszenz ist ein geeignetes Verfahren zum simultanen Nachweis mehrerer
Zielstrukturen in einem Gewebe. Durch den Einsatz fluorophor-gekoppelter Sekundärantikörper
ist die Zahl der möglichen Simultan-Färbungen nahezu unbegrenzt. Eine Einschränkung ist bei
der Untersuchung von FFPE-Geweben gegeben, da hier die für die Bindung der eingesetzten
Primärantikörper erforderlichen Vorbehandlungen zusammen passen müssen.
Je nach der verwendeten Kombination von Primärantikörpern entspricht die Vorbehandlung der
Schnitte jeweils der unter 3.2.6 angegebenen Prozedur; eventuell ist eine Anpassung der
Konzentration
des
Primärantikörpers
erforderlich,
da
die
Signalverstärkung
in
der
Immunfluoreszenz nicht der der IHC entspricht.
Nach der Inkubation mit dem Primärantikörper wurden die Schnitte 2x3 Minuten in TBST
gewaschen. Zur Detektion kam ein Fluorophor-gekoppelter Sekundärantikörper zum Einsatz
(Tab. 5). Bei einem aufgetragenen Volumen von 100 µL erfolgte die Inkubation auf dem Schnitt
über 1 Stunde in 1x PBS + 1% BSA bei Dunkelheit.
Tabelle 5: Sekundärantikörper für Immunfluoreszenz
Sekundärantikörper/Verdünnung Bezugsquelle
Katalognr.
Jackson Immunoresearch, London
Jackson Immunoresearch, London
goat-α-rabbit-Cy5
goat-α-mouse-Cy3
111-175-003
115-165-062
Nach der Inkubation mit dem Sekundärantikörper wurden die Schnitte 2x3 Minuten in 1x TBSTPuffer gewaschen. Überschüssiger Puffer wurde danach von den Schnitten entfernt, die zuletzt
mit 1-2 Tropfen ProLong Gold Antifade Reagent + DAPI(Invitrogen, Karlsruhe) versehen und
einem Deckgläschen eingedeckt wurden. Nach einer Einwirkzeit von ca. 2 Stunden konnten die
Schnitte mit einem Fluoreszenzmikroskop (Axioplan 2 imaging, Zeiss, Jena) betrachtet werden.
Zum Schutz vor Austrocknung erfolgte die dauerhafte Versiegelung des Präparates mit
farblosem Nagellack.
3.3
Histopathologische Befundung von Gewebeschnitten
Die Tumordiagnose durch den Pathologen spielt für den behandelnden Arzt eine entscheidende
Rolle. Sie erfolgt ausschließlich auf der Grundlage morphologischer Veränderungen gegenüber
dem
gesunden
Gewebe,
die
unter
dem
Mikroskop
sichtbar
werden.
Die
Vielzahl
histopathologischer Veränderungen hat zur Etablierung einheitlicher Nomenklatur- und
44
Materialien und Methoden
Klassifizierungssysteme geführt. Auf der Grundlage dieser Systeme wurden alle in dieser Arbeit
untersuchten (Tumor-) Gewebe charakterisiert.
Zur besseren Orientierung wurden in dieser Arbeit Abbildungen von Schnittpräparaten die
wichtigsten histopathologischen Parameter (TNM-Klassifikation, ggf. GLEASON-Score) sowie eine
kurze Zusammenfassung des histologischen Befundes hinzugefügt.
3.3.1 Besonderheiten des Prostatakarzinoms
Wegen ihrer morphologisch dem Ursprungsgewebe äußerst ähnlichen Erscheinung wurden im
Rahmen dieser Arbeit untersuchte Gewebestanzen aus Arealen mit BPH als normale, nicht
neoplastische
Gewebe
klassifiziert.
Weiterhin
wurden
Hormon-sensitive
und
Hormon-
unabhängige Prostata-Karzinome gleichberichtigt behandelt, da sich diese Tumoren im
histologischen Bild nicht voneinander unterscheiden lassen.
3.3.2 Einheitliche Beurteilung immunhistochemischer Färbungen
Wie die Etablierung der unterschiedlichen Färbeprotokolle wurde die Auswertung der Färbung
zunächst in enger Zusammenarbeit mit einem erfahrenen Pathologen durchgeführt. Nach
ausführlichem Training war eine selbstständige Befundung der Gewebe möglich.
Für alle neu etablierten Färbungen wurde dabei in Kooperation mit einem Mediziner ein
einheitliches System festgelegt, dass bei der Erstbefundung zum Einsatz kam. Zur Bewertung
der Her-2 Expression nach immunhistochemischer Färbung mit dem DAKO HercepTest (s. 3.3.3)
und andere bereits etablierte Nachweise, z.B. der Auswertung nach Remmele oder für den
Nachweis der Östrogen- und Progesteron-Rezeptor-Expression, wurden die schon gebräuchlichen
Richtlinien zur Auswertung angewandt.
Das in Zusammenarbeit entwickelte scoring-Schema berücksichtigt die zelluläre Lokalisation des
analysierten Proteins sowie die Intensität der Färbung als Ausdruck der Expressionsstärke.
Zusätzlich wird der prozentuale Anteil der gefärbten Zellen an der Gesamt-(Tumor-)Zellzahl
ermittelt. Durch Multiplikation (Prostata) oder Addition (Mamma) der Einzel-Analyten wurde ein
gesamt-Score ermittelt (Beispiel: Abb. 10A und B), in dem den einzelnen Faktoren jeweils eine
unterschiedliche Gewichtung zukam. Beide Verfahren erlauben die exakte Wiedergabe des
Färberesultates.
45
Materialien und Methoden
Lokalisation
Intensität
keine
Färbung
schwach
mäßig
stark
2
3
Membran
0
1
Cytoplasma
0
1
2
Nukleus
0
1
2
X
X
Score
Quantität
X
<20%
21-40% 41-60% 61-80%
>80%
Intensität x Quantität
9
1
2
X
3
4
5
3
1
2
3
4
5
3
1
2
3
4
5
X
5
0
Abbildung 10A: Auswertungs-Sytem für IHC-Nachweise in Geweben der Prostata. Für jeden IHC-Nachweis wird
zunächst die stärkste Färbeintensität in einem Kompartiment sowie der prozentuale Anteil der entsprechend
gefärbten Zellen festgehalten. Aus beiden Einzel-Analyten wird durch Multiplikation ein gesamt-score gebildet.
Beispiel: in einer Gewebestanze wurde in etwa 50% der Zellen (3) eine starke Membran- (3) und zusätzlich in über
80% aller Zellen (5) eine schwache cytoplasmatische Färbung festgestellt (1); keine Färbung des Kernes (0). Durch
Multiplikation der Einzel-Analyten ergibt sich so ein gesamt-score z.B. für die Membranfärbung von
3 (Intensität) x 3 (Quantität) = 9
Lokalisation
Intensität
keine
Färbung
Score
Quantität
schwach
mäßig
stark
<20%
2
3
0.2
0.4
X
0.6
X
>80%
Intensität + Quantität
0.8
1
3.6
21-40% 41-60% 61-80%
Membran
0
1
Cytoplasma
0
1
2
3
0.2
0.4
0.6
0.8
1
Nukleus
0
1
2
3
0.2
0.4
0.6
0.8
1
X
X
X
2
0
Abbildung 10B: Auswertungs-Sytem für IHC-Nachweise in Mamma-Geweben. Zunächst wird ebenfalls die stärkste
Färbeintensität in einem Kompartiment sowie der prozentuale Anteil der entsprechend gefärbten Zellen
ermittelt. Aus den Einzel-Analyten wird durch Addition ein
gesamt-score gebildet. Beispiel: in einer
Gewebestanze wurde in etwa 50% der Zellen (0.6) eine starke Membran- (3) und zusätzlich in über 80% aller
Zellen (1) eine schwache cytoplasmatische Färbung festgestellt (1); keine Färbung des Kernes (0). Durch Addition
der Einzelwerte ergibt sich ein score z.B. für die Membranfärbung von 3 (Intensität) + 0.6 (Quantität) = 3.6
3.3.3 Der DAKO HercepTest zur Bestimmung des Her-2-Expressionsstatus
Zur Auswahl geeigneter Patienten für eine Therapie mit dem anti-Her-2-Antikörper Herceptin™
wurde der Expressionsstatus des Her-2-Rezeptors immunhistochemisch mit dem DAKO
HercepTest (DAKO Cytomation, Hamburg) bestimmt. Das Resultat des in situ-Nachweises wurde
nach einem festgelegten Algorithmus bestimmt (Abb. 11). Zur Bewertung wurde per
Übereinkunft die Membranfärbung in Verbindung mit dem prozentualen Anteil der gefärbten
Zellen zu Rate gezogen; eine cytoplasmatische Färbung wurde als artifiziell eingestuft, obwohl
dies wahrscheinlich auf detektierte Vorläuferproteine oder internalisierte Rezeptoren zurück zu
führen war. Bei einem nicht eindeutigen Ergebnis (HercepTest Score: 2+) wurde die
Amplifikation des 17q21-Genlocus mittels Fluoreszenz in situ-Hybridisierung überprüft. Im
Rahmen der vorgestellten Arbeit untersuchte Mamma-Tumoren wurden bereits im Vorfeld auf
den Her-2-Expressionsstatus hin analysiert. Unter Einsatz des entsprechenden Algorithmus zur
46
Materialien und Methoden
0
1+
2+
3+
keine Färbung oder
schwache Membranfärbung
in < 10% Tumorzellen
schwache, unvollständige
Membranfärbung in > 10%
Tumorzellen
schwache bis mäßige,
vollständige Färbung der
Membran in > 10%
Tumorzellen
kräftige vollständige
Färbung der Membran in
> 10% Tumorzellen
Abbildung 11: Expression des Her-2-Proteins im Mammakarzinom. Tumoren mit einer niedrigen Expression des
Rezeptors (HercepTest Score 0, 1+) sind nicht geeignet für eine anti-Her-2-Therapie, während eine hohe
Expression des Proteins die Rationale für eine entsprechende Therapie darstellt (HercepTest Score: 3+). Bei
einem nicht eindeutigen Ergebnis (HercepTest Score: 2+) wird das Ergebnis durch FISH-Analytik verifiziert. Aus:
Guidelines for scoring HercepTest, DAKO cytomation, Hamburg)
Auswertung des immunhistochemischen Nachweises wurden zusätzlich die Gewebe-Arrays mit
Geweben der Mamma ausgewertet. Die Bestimmung des Her-2-Status an zu TMAs zusammengefassten prostatischen Geweben wurde ebenfalls unter Verwendung des vorgegebenen
Algorithmus durchgeführt.
3.4
Statistische Auswertung mit Hilfe bioinformatischer Methoden
Die durch Auswertung der an einer großen Probenanzahl durchgeführten immunhistochemischen
Färbungen erhaltenen Ergebisse wurden in Zusammenarbeit mit einem Bioinformatiker mit Hilfe
der Bio-Informatik-Software „R“, Version 9.1 statistisch ausgewertet. Im Folgenden werden die
eingesetzten Routinen erläutert.
3.4.1 Ermittlung der klinischen Relevanz eines Analyten: der MANN-WHITNEY-Test
Die klinische Relevanz eines Analyten, z.B. der Membranfärbung bei Nachweis des Her-2Proteins, ergibt sich aus dem Vergleich der Ergebnisse im gesunden und korrespondierenden
malignen Gewebe. Idealerweise ist ein Analyt in Normalgewebe nicht zu finden, in
Tumorgewebe in 100% der Fälle vorhanden.
Die Stärke dieses Zusammenhanges wird durch den p-value ausgedrückt. Dieser Wert gibt an,
inwieweit das berechnete Ergebnis die Folge eines zufälligen Zusammenhanges ist. Je näher
dieser Wert an 0 (= 100% sicherer Zusammenhang) liegt, desto relevanter ist der Analyt in
diesem Fall für die Klinik.
In der Regel wird ein p-Value unter 0.05 als signifikant anerkannt. Unter Berücksichtigung der
Stichprobengröße können zum Teil andere Grenzen angenommen werden. Die sog. SIDAK47
Materialien und Methoden
Korrektur des p-values erlaubt eine genauere Aussage über die Relevanz eines Analyten. Die
Routine zum Vergleich von Normal- und Tumorgewebe ist in Listing 1 aufgeführt.
Listing 1:
Programm1 <- function()
{
i=3
while(i < max. Spaltenzahl+1)
{
x1 <- Name Tabelle[Name Tabelle$Gewebe == '0',][,i]
x2 <- Name Tabelle[Name Tabelle$Gewebe == '1',][,i]
ergebnis <- wilcox.test(x1,x2)
cat('Ergebnis für: ', colnames(Name Tabelle[i]))
cat(': ', ergebnis$p.value, '\n ')
i=i+1
}
}
3.4.2 Bivariate Datenanalysen: κ-value und MCNEMAR-Test
Die Abhängigkeit ψ zweier Analyten voneinander wird in der Regel durch den sog. χ2-Test
ermittelt. Eine derartige Betrachtungsweise ist bei klinischen Daten oftmals nicht möglich, da
die beobachteten Merkmalsausprägungen einander beeinflussen. Es ist somit eine Betrachtung
der jeweiligen miteinander gekoppelten Merkmalsausprägungen nötig. Der MCNEMAR-Test liefert
mit dem κ-value das Ergebnis einer solchen gekoppelten (pair-wise) Analyse. Die entsprechende
hier zum Einsatz gekommene Routine ist in Listing 2 aufgeführt.
Listing 2:
48
multikappa <- function(x,z)
{
corlength <- length(colnames(x))
cortable <- array(‘NA’, dim=c(corlength,corlength))
rownames(cortable) <- colnames(x)
colnames(cortable) <- colnames(x)
I=1
while(I <= corlength)
{
j=1
while(j <= corlength)
{
M <- ftable(x[,i],x[,j])
l1 <- length(M[1,])
l2 <- length(M[,1])
if (l1 == 4 && l1 == l2)
{
result <- mcnemar.test(M)
exactagreements <- M[1,1]+M[2,2]+M[3,3]+M[4,4]
Total <- sum(M[1,1:4])+sum(M[2,1:4])+sum(M[3,1:4])+sum(M[4,1:4])
totalpercent <- exactagreements/Total
freq1 <- sum(M[1,1:4])*sum(M[1:4,1])/Total
freq2 <- sum(M[2,1:4])*sum(M[1:4,2])/Total
freq3 <- sum(M[3,1:4])*sum(M[1:4,3])/Total
(Forts.)
Materialien und Methoden
Listing 2 (Fortsetzung):freq4 <- sum(M[4,1:4])*sum(M[1:4,4])/Total
totalexpfreq <- freq1+freq2+freq3+freq4
prop <- totalexpfreq/Total
kappa <- (totalpercent - prop)/(1-prop)
if (result$p.value <= z || result$p.value == “NaN”) cortable[I,j] <- kappa
}
else if (l1 == 3 && l1 == l2)
{
result <- mcnemar.test(M)
exactagreements <- M[1,1]+M[2,2]+M[3,3]
Total <- sum(M[1,1:3])+sum(M[2,1:3])+sum(M[3,1:3])
totalpercent <- exactagreements/Total
freq1 <- sum(M[1,1:3])*sum(M[1:3,1])/Total
freq2 <- sum(M[2,1:3])*sum(M[1:3,2])/Total
freq3 <- sum(M[3,1:3])*sum(M[1:3,3])/Total
totalexpfreq <- freq1+freq2+freq3
prop <- totalexpfreq/Total
kappa <- (totalpercent - prop)/(1-prop)
if (result$p.value <= z || result$p.value == “NaN”) cortable[I,j] <- kappa
}
else if (l1 == 2 && l1 == l2) {
result <- mcnemar.test(M)
exactagreements <- M[1,1]+M[2,2]
Total <- sum(M[1,1:2])+sum(M[2,1:2])
totalpercent <- exactagreements/Total
freq1 <- sum(M[1,1:2])*sum(M[1:2,1])/Total
freq2 <- sum(M[2,1:2])*sum(M[1:2,2])/Total
totalexpfreq <- freq1+freq2
prop <- totalexpfreq/Total
kappa <- (totalpercent - prop)/(1-prop)
if (result$p.value <= z || result$p.value == “NA”) cortable[I,j] <- kappa
}
else if (l1 > 4 && l1 == l2) cortable[I,j] <- “out of range”
else cortable[i,j] <- “non-symmetric”
j=j+1
}
i=i+1
}
write.table(cortable, ‘multikappa.txt’)
read.table(‘multikappa.txt’, header = T)
}
3.4.3 Data Adjustment der Rohdaten für 2D-Cluster-Analysen (Mamma)
Die Darstellung aller untersuchten Analyten über die gesamte Population erfolgte in 1D- oder
2D-cluster-Analysen. Eindimensionale Analysen wurden wie die vorhergehenden Berechnungen
unter Verwendung des DIANA-Algorithmus mit der Statistik-Software R, Version 9.1,
durchgeführt. Nachteil dieser Routine ist, dass die zur Bildung der cluster führenden Kriterien
nicht für den Anwender ersichtlich sind. Aufschluss über die Stabilität der cluster gibt der durch
die Routine ermittelte divisive coefficient an, der möglichst nahe bei 1 liegen sollte.
Zweidimensionale cluster-Analysen wurden mit Hilfe der Software Cluster, Version 3.1 (Stanford
University, Stanford, MA, USA) durchgeführt. Hierbei wurde ohne eine zuvorige Zentrierung
49
Materialien und Methoden
(centering) der Daten nach dem Mittelwert oder Median ein hierarchisches, unsupervised
clustering ermittelt.
Die graphische Darstellung der Resultate erfolgte mit dem Programm
TreeView, Version 1.60 (Stanford University, Stanford, MA, USA).
Einzug in die cluster-Analysen fanden ausschließlich die aus den einzelnen Analyten (Intensität
und Quantität) einer jeden Färbung ermittelten scores (s.o.) statistisch signifikant veränderter
Analyten. Diese wurden im Falle des Prostatakarzinoms ohne weitere Skalierung in die clusterAnalysen eingebracht; auch der zur Diagnostik des Prostatakarzinoms verwendete Gleason Score
wurde unverändert übernommen, da er im gleichen Zahlenraum wie der immunhistochemische
Bewertungsscore angesiedelt ist.
Zur Untersuchung von Expressionsprofilen in Mammakarzinomen wurden zunächst alle scores,
auch die bereits etablierter Auswertungssysteme wie für den DAKO HercepTest (Her-2), oder
Remmele- und Harvey Score (Östrogen- und Progesteron-Rezeptor), auf einen Wert zwischen 0
(minimaler Wert) und 100 (maximaler Wert) skaliert (Tab. 6 und 7). Die Einzelwerte der
Zwischenstufen errechnen sich aus 100 / (Zahl der Abstufungen – 1).
Für alle im Rahmen dieser Arbeit neu etablierten Expressionsnachweise wurden in einem
zweiten Schritt nur selten vorkommende Werte häufig ermittelten Abstufungen gleichgestellt,
so dass schließlich fünf Kategorien resultierten, die zur Erstellung des 2D-cluster herangezogen
wurden (Tab. 6). Um eine Verzerrung der Originaldaten zu vermeiden, wurde die beschriebene
Skalierung nicht für Her-2- und ER/PgR-scoring-Systeme durchgeführt.
Tabelle 6: Umwandlung des ermittelten IHC-score zur 2D-Clusteranalyse (Mamma)
Ursprungs-score
%
neue Skalierung
0
0
1
6.3
Ursprungs-score
%
neue Skalierung
1.2
12.5
0
2.8
62.5
1.4
18.8
3
68.5
68.5
1.6
25
3.2
75
1.8
31.3
31.3
3.4
81.3
2
37.5
3.6
87.5
2.2
43.8
3.8
93.8
100
2.4
50
50
2.6
56.3
4
100
Tabelle 7: Umwandlung des Remmele-Score in Prozentskalierung (Mamma)
Remmele
Score
%
50
0
1
2
3
0
8.3
16.6
25
4
5
33.3 41.6
6
50
7
8
58.3 66.6
9
75
10
11
83.3 91.6
12
100
Materialien und Methoden
3.5
Zellbiologische Methoden
Zellkultursysteme besitzen gegenüber menschlichen Geweben einen großen Vorteil: sie sind zu
einem großen Teil beeinflussbar, d.h. man kann durch verschiedene Reize Einfluss auf das
Verhalten einer Zelle nehmen. Die erhaltenen Ergebnisse sind somit bei ansonsten konstanten
Bedingungen direkt auf den angewandten Reiz zurück zu führen.
In dieser Arbeit diente die Kultivierung einer mit einem entsprechenden Vektor transfizierten
HEK293T-Zelllinie der Expression der Her-2-Rezeptor-Tyrosinkinase.
3.5.1 Transformation von Vektor-DNA in Escherichia coli (E. coli)
Zur Vervielfältigung eines Her-2 beinhaltendenden Vektors wurde das entsprechende Plasmid
zunächst in elektrisch kompentente E. coli Zellen transformiert.
Der verwendete Vektor pRk5/Her2 (U3 Pharma, München) wurde in 50µl TE-Puffer gelöst. Die
DNA-Konzentration des Eluates wurde photometrisch bestimmt. Ein Aliquot (50µl) E. coli
NovaBlue GigaSingles™ Zellen (Novagen) wurde auf Eis aufgetaut und mit etwa 50 ng Vektor
DNA versetzt. Nach 1 Minuten auf Eis wurde der Ansatz in eine vorgekühlte Küvette überführt
und bei 2500V im Elektroporator (Easyjet Prima, EquiBio) transformiert. Danach wurde der
Ansatz mit 750 µl LB-Medium (+ 20 mM Glucose, Endkonzentration) versetzt und für 45 Minuten
bei 37°C regeneriert. Die Ausplattierung der transformierten Zellen erfolgte auf LB-AmpicillinPlatten, die anschließend bei 37°C über Nacht inkubiert wurden.
Einzelne Bakterienkolonien wurden am folgenden Tag in jeweils 150 ml LB-Ampicillin
Flüssigmedium überführt und unter leichtem Schwenken (150-250 rpm) über Nacht bei 37°C
inkubiert.
3.5.2 Plasmid-DNA-Präparation aus E. coli
Eine über Nacht gewachsene Flüssigkultur wurde durch Zentrifugation für 10 Minuten bei 4000
rpm pelletiert; die Pellets wurden in 5 ml sterilem Wasser resuspendiert, vereinigt und erneut
wie zuvor zentrifugiert. Die folgende Plasmid-DNA-Präparation wurde mit dem QIAGEN FastPrep
Kit (Qiagen, Hilden) exakt nach der Vorgabe des Herstellers durchgeführt. Nach der
Aufreinigung wurde die DNA Konzentration photometrisch bestimmt.
51
Materialien und Methoden
3.5.3 Transfektion von HEK293T-Zellen mit dem pRK5/Her-2-Vektor
Etwa 24 Stunden vor der geplanten Transfektion wurden 2,5 x 106 HEK293T-Zellen pro
Kulturflasche (75 cm2 Grundfläche) ausgesetzt und mit 30 mL RPMI1640 Medium versetzt.
Transfiziert wurde den Angaben des Herstellers folgend direkt in der Flasche durch Zugeben der
entsprechend vorbereiteten DNA.
Zunächst wurden in einem Mikro-Reagenzgefäß 768 µL serumfreies RPMI1640 Medium vorgelegt
und mit 24 µL Fugene6 (Roche, Mannheim) Transfektionsreagenz versetzt. Der Ansatz wurde
nach leichtem Schwenken fünf Minuten bei RT inkubiert; danach wurden ca. 8 µg Plasmid-DNA
hinzugegeben. Nach kurzem Schütteln wurde dieser Ansatz 15 Minuten bei RT inkubiert, bevor
er tropfenweise auf die kultivierten Zellen gegeben wurde. Vor der Ernte wurden die nunmehr
transfizierten Zellen 48 Stunden inkubiert.
3.5.4 Zellkultur und Ernten transfizierter Zellen
Alle Arbeiten mit Zellkulturen wurden unter sterilen Bedingungen unter einer Sterilbank (Holten
LaminAir, W.H. Mahl) durchgeführt. Transfizierte und nicht transfizierte HEK293T-Zellen
wurden in RPMI1640 Medium und 10% fetalem Kälberserum (FCS) bei 37°C und 7% CO2 im
Brutschrank (Binder) gehalten. Die Passage der Zellen erfolgte zweimal wöchentlich im Abstand
von 3-4 Tagen und diente der Erneuerung des Mediums und dem Einstellen der optimalen
Zelldichte. Dazu wurde das Medium mit einer sterilen Pipette abgezogen und die
Zellen
zweimal mit PBS gewaschen. Nach dem Abtragen des Puffers wurden die Zellen mit 5 ml
Accutase™ (Gibco) versetzt und 10-45 Minuten im Brutschrank inkubiert. Anschließend wurden
die Zellen vorsichtig vom Boden der Kulturflaschen abgschlagen und die Aktivität der Accutase™
durch Zugabe von 10 ml Vollmedium inhibiert. Die Zellsuspension wurde in ein steriles
Zentrifugenröhrchen überführt und für 5 Minuten bei etw 500 x g pelletiert. Der Überstand
wurde abgetragen und das Zellpellet in 5 ml RPMI1640 Medium resuspendiert. Die Zellzahl
wurde mit Hilfe einer Neubauer-Zählkammer ermittelt. Die Zellzahl der nächsten Passage wurde
auf 2 x 104 Zellen in 50 ml RPMI1640 + 10% FCS eingestellt.
Die Ernte transfizierter Zellen erfolgt durch Zugabe von 3-5 mL Accutase™ (Gibco/Invitrogen,
London) auf zuvor mit 10 mL PBS gewaschene adhärente Zellen. Nach 5minütiger Inkubation im
Brutschrank werden die Zellen ggf. durch leichtes Schütteln vom Grund der Kulturflasche gelöst
und in ein Falcon-Gefäß überführt. Geerntete Zellen werden durch Zentrifugation (5 min,
2000 rpm) pelletiert und, nachdem der Überstand entfernt wurde, entweder sofort weiter
verarbeitet oder bei -80°C gelagert.
52
Materialien und Methoden
3.5.5 Transfektion von HEK293T-Zellen zur Immunfluoreszenz
Zur Immunfluoreszenz werden Zellen direkt auf einem Kammer-Objektträger transfiziert. Dazu
werden 24 Stunden vor der geplanten Transkfektion 2 x 104 HEK293T-Zellen pro Kammer
ausgesät. Am folgenden Tag kann die Transfektion erfolgen.
In einem sterilen Eppendorff-Gefäß wurden 92 µL serumfreies RPMI1640-Medium vorgelegt und
mit 6 µL Fugene6 Transfektionsreagenz versetzt. Nach einer Inkubation von fünf Minuten bei RT
wurden 2 µg Plasmid-DNA hinzugegeben. Nach erneuter Inkubation für 15 Minuten bei RT wurde
der Transfektionsansatz direkt in die entsprechende Kammer des Objektträgers pipettiert.
3.5.6 Immunfluoreszenzfärbung
Zum Nachweis der zellulären Lokalisation von Proteinen eignet sich die ImmunfluoreszenzFärbung. Diese kann etwa 48 Stunden nach einer Transfektion durchgeführt werden. Dazu wird
zunächst mit einer Pipette das Medium aus den Kammern abgezogen. Jede Kammer wird mit 3 x
500 µL PBS-Puffer gewaschen. Die folgenden Schritte werden jeweils bei Raumtemperatur in
einem Volumen von 500 µL durchgeführt.
Zur Fixierung werden die Zellen mit 3,7% Paraformaldehyd in PBS für 20 Minuten inkubiert.
Nach erneutem Waschen wie zuvor erfolgt die Permeabilisierung der Zellen durch Zugabe von
0,2% Triton X-100 in PBS (10 Minuten). Nach Entfernen dieser Lösung wird durch 5% BSA in
Permeabilisierungspuffer eine Absättigung freier Stellen auf dem Objektträger erreicht. Die
Inkubation mit dem Primärantikörper (Tab. 8) in Permeabilisierungspuffer mit 1% BSA erfolgt
über eine Stunde; Simultanfärbungen zum Nachweis mehrerer Antigene sind möglich. Nicht
gebundener Antikörper wird durch dreimaliges Waschen mit PBS entfernt. Mit dem
fluorophorkonjugierten Sekundärantikörper (Tab. 8) wird analog verfahren; die KammerObjektträger werden wegen der Lichtempfindlichkeit des Fluorophors im Dunkeln gelagert.
Tabelle 8: Sekundärantikörper für Immunfluoreszenz
Antikörper
Verdünnung
Bezugsquelle
α-pY1248 Her-2
α-Her-2 extrazelluläre
Domäne
1:250 / 1:500
Cell Signaling (Beverly, MA, USA) 2247
goat-α-rabbit-Cy5
1:500
goat-α-mouse-Cy3
1:500
1:500 / 1:1.000 Novocastra (Newcastle, UK)
Jackson Immunoresearch
(London, UK)
Jackson Immunoresearch
(London, UK)
Katalognr.
NCL-L-CBE-356
111-175-003
115-165-062
53
Materialien und Methoden
Zuletzt werden die Zellen mit 3,7% Parafolmaldehyd in PBS fixiert. Nach dem Abziehen der
Fixierungslösung wird der Plastikaufsatz vom Objektträger entfernt, die Kammern mit je einem
großen Tropfen ProLong Gold antifade Reagent/DAPI (Invitrogen, Karlsruhe) versetzt und
schließlich mit einem Deckgläschen verschlossen. Das Deckglas kann mit durchsichtigem
Nagellack gegen Verrutschen gesichert werden.
Auf diese Weise erstellte Präparate können bei -20°C über einen längeren Zeitraum ohne
Qualitätseinbußen gelagert werden. Die Auswertung erfolgt mit einem Fluoreszenzmikroskop
(Axioplan 2 imaging, Zeiss, Jena).
3.5.7 Zellaufschluß für proteinbiochemische Untersuchungen
Die geernteten und pelletierten Zellen werden vorsichtig in 4 Vol. Lysepuffer resuspendiert und
mit Hilfe eines Potters zum Platzen gebracht. Zelltrümmer werden durch kurzes Zentrifuieren
bei 600 x g aus dem Lysat entfernt; zuvor wird ein Aliquot (Gesamtprotein) entnommen.
Durch 5minütiges Zentrifugieren bei 15000 x g werden Zellkerne sowie Mitochondrien aus dem
Zelllysat entfernt. Das erhaltene Pellet wird in dem gleichen Volumen resuspendiert wie zuvor
das Ausgangsmaterial. Eine letzte Zentrifugation (1 h, 100000 x g, Beckmann Ultrazentrifuge)
trennt die Zellmembran und kleinere Organellen vom Cytosol, das den Überstand darstellt.
Membranhaltige Pellets werden in kleinen Volumina Lysepuffer (ca. 50-100 µL) oder direkt in
3x LÄMMLI-Probenpuffer resuspendiert.
LYSEPUFFER: 50 mM Tris/HCl pH 8.0
150 mM NaCl
2 mM EDTA
1 mM PMSF
1% Protease-Inhibitoren-Mix (Sigma)
1% Phosphatase-Inhibitoren-Mix 2 (Sigma)
3.6
Proteinbiochemische Methoden
Im Vordergrund der angewandten biochemischen Verfahren stehen Antikörper-basierte
Untersuchungsmethoden. Antikörper besitzen aufgrund ihrer einzigartigen Eigenschaften ein
nahezu unerschöpfliches Potential in der Proteinanalytik und zur Entwicklung neuartiger
Nachweisverfahren.
Konzentrationsangaben in Rezepten für Puffer entsprechen den tatsächlich im jeweiligen
Experiment eingesetzten Verhältnissen. Alle Puffer wurden jedoch als 10fach-Konzentrate
hergestellt und bei Bedarf entsprechend verdünnt.
54
Materialien und Methoden
3.6.1 Gewebeaufschluß und Fraktionierung durch differentielle Zentrifugation
Menschliches Frischgewebe wurde unmittelbar nach der Entnahme in flüssigem Stickstoff
eingefroren und bis zur weiteren Verwendung bei -80°C gelagert. Das angewandte Protokoll zur
Erstellung von Gewebe-Homogenaten entsprach einer bereits publizierten, standardisierten
Prozedur zur Erstellung von Gewebe-Homogenaten für die Verwendung in Enzym-Immunoessays
(Eppenberger-Castori, 2001).
Je nach Verfügbarkeit wurden 100-200 mg humanes Frischgewebe eingesetzt. Das gefrorene
Gewebe
wurde
in
Flüssig-Stickstoff-gekühlten
Teflongefäßen
mit
Hilfe
eines
Mikro-
Dismembrators (B.Braum AG, Melsungen) bei 2300 rpm zunächst mechanisch zertrümmert und
danach in 1 ml eiskaltem Lysepuffer aufgenommen.
Zur weiteren Gewebelyse wurden die Extrakte mit Ultraschall behandelt (30 Intervalle, 0.5
repeat cycle, -050 power level). Durch konsequente Lagerung auf Eis wurden mögliche störende
Enzymaktivitäten auf ein Minumum reduziert.
LYSEPUFFER: 50 mM Tris/HCl pH 8.0
150 mM NaCl
2 mM EDTA
1 mM PMSF
1% Protease-Inhibitoren-Mix (Sigma)
1% Phosphatase-Inhibitoren-Mix 2 (Sigma)
Untersuchungen zur Lokalisation des analysierten Proteins bedürfen einer weiteren Aufreinigung
der verschiedenen Zellkompartimente, die sich durch ihr unterschiedliches Gewicht im
Zentrifugalfeld trennen lassen. Dabei wurden nach kurzem Sedimentieren nicht aufgelöster
Gewebereste zunächst die Zellkerne durch 10minütige Zentrifugation bei 800 x g aus der
Suspension entfernt. Der Überstand wurde in ein neues Gefäß überführt und 5 min bei 15.000 x
g zentrifugiert, wodurch kleinere Organellen wie Mitochondrien und Endosomen pelletierten.
Ein letzter Zentrifugationsschritt für 60 Minuten bei 100.000 x g löste die Fragmente der
Zellmembran vom Cytosol, das den Überstand bildete. Die erhaltenen Organellen-haltigen
Pellets wurden 2 x in eiskaltem Lysepuffer gewaschen, in 100 µL (Membranfraktion: 50 µL)
Lysepuffer resuspendiert und ggf. aliquotiert.
3.6.2 Isolierung von Protein aus Frischgewebe-Schnitten
Soll bei der Aufreinigung von Proteinen aus Geweben Verunreinugungen vorgebeugt werden,
eignet sich in begrenztem Umfang eine Mikrodissektion von Gefriergewebe-Schnittpräparaten
(Krieg, 2005). Hierzu werden zunächst von einem Pathologen in Frage kommende Areale auf
einem mit Hämalaun-Eosin gefärbten Schnitt angezeichnet. Die korrespondierenden Schnitte
55
Materialien und Methoden
aus Frischgewebe für die Mikrodissektion werden nach einem alternativen Protokoll gefärbt, um
eine Modifikation der aufzureinigenden Proteine durch den Färbevorgang zu verhindern.
Inkubation für 30 Sekunden in 70% Ethanol dient der Fixierung des Gewebes. Nach kurzem
Waschen in destilliertem Wasser (10 Sekunden) werden die Schnitte für 30 Sekunden in
Hämatoxilin (Sigma) gefärbt. Erneute Inkubation in Wasser und 0.5% Natriumhydrogencarbonat
für jeweils 10 Sekunden bewirkt eine sehr schwache bläulich-braune Färbung des Präparates.
Ein letzter Fixierungsschritt in Ethanol wie zu Beginn beendet den Färbevorgang. Alle
verwendeten Lösungen enthalten je 1% Protease-Inhibitoren Mix (Sigma) und PhosphataseInhibitoren-Mix 2 (Sigma).
Die Schnitte sollten bis kurz vor der Färbung bei -80°C (max. -20°C) gelagert werden; die
Färbeprozedur
sowie
die
anschließende
Mikrodissektion
werden
bei
Raumtemperatur
durchgeführt. Um ungewünschte Degradationen zu vermeiden, sollte für die gesamte Prozedur
vom Auftauen der Schnitte bis zum Einfrieren des Lysates ein Zeitraum von 30 Minuten nicht
überschritten werden.
Für die Mikrodissektion dienen die zuvor markierten HE-Schnitte als Vorlage. Die mit einer
Skalpellklinge oder sterilen Kanüle vom Objektträger gekratzten Gewebeareale werden in ca.
500 µL Lysepuffer (s. 3.6.1) überführt. Alternativ ist eine Lyse direkt in Lämmli-Puffer denkbar.
3.6.4 Proteinmengenbestimmung nach BRADFORD
Eine größtmögliche Vergleichbarkeit der Resultate wird gewährleistet durch miteinander
vergleichbare eingesetzte Proteinmengen. Hierzu werden die Proteingehalte der nach 3.6.2
erstellten Organellenfraktionen nach der Methode von BRADFORD (1976) ermittelt und dann nach
Möglichkeit auf einen einheitlichen Wert von 500 µg/mL eingestellt.
Von der zu untersuchenden Probe wird eine 1:10- (Membranfranktion) bzw. 1:20- Verdünnung in
TBS erstellt. 10 µL hiervon werden mit 200 µL BRADFORD-Reagens versetzt und 10 Minuten bei RT
inkubiert. Die Proteinmenge kann nun durch Messung der Absorption bei 520 nm und Abgleich
mit einer entsprechend behandelten Standardreihe mit bekannten Proteinmengen (100500 µg BSA/mL) bestimmt werden.
56
Materialien und Methoden
3.6.5 SDS-PAA Gelelektrophorese
Proteine unterschiedlicher Größe lassen sich im elektrischen Feld nach ihrem Molekulargewicht
auftrennen. Als Mittel der Wahl dient hier eine denaturierende SDS-PAA Gelektrophorese
(Lämmli, 1970).
Gele für WESTERN Blot oder Massenspektrometrie bestehen aus einem 6%igen Trenn- und einem
4%igen Sammelgel. Pro Spur werden 10 µg Gesamtprotein aufgetragen; die Probe wird zuvor in
½ Volumen LÄMMLI-Probenpuffer verdünnt und 5 Minuten bei 95°C denaturiert. In einer mit
Elektrophoresepuffer gefüllten Elektrophoresekammer werden die Gele 35 min bei konstant 60
mA inkubiert.
ELEKTROPHORESEPUFFER:
25 mM Tris Base
200 mM Glycin
0.1 % SDS
3x LÄMMLI-PROBENPUFFER:
200 mM Tris/HCl pH 6.8
6% SDS
9% Mercaptoethanol
24% Glycerol
X% Bromphenolblau
3.6.6 WESTERN Blot
Elektrophoretisch getrennte Proteingemische können ebenfalls im elektrischen Feld auf
Nitrocellulose- oder PVDF-Membranen übertragen werden.
Eine zuvor in Methanol aktivierte PVDF-Membran wird auf das Gel gelegt und beides zusammen
zwischen 2 x 2 in Blotpuffer getränkte WHATMAN-Papiere gelegt. Im angewandten Tank BlotVerfahren wird die gesamte Kammer mit Blotpuffer gefüllt. Geblottet wird mit etw 2 mA/cm2
Membran für zwei Stunden. Die Zeit variiert hierbei mit der Größe der zu blottenden Proteine.
Nach dem Blotten erfolgt die Kontrolle des Proteintransfers durch Färbung der Membran mit
PONCEAU S-Lösung. Die rote Färbung gebundener Proteine ist reversibler Natur und kann durch
mehrmaliges Waschen mit TBS + 0.05% TWEEN entfernt werden.
Unspezifische Antikörperbindungsstellen werden durch Übernacht-Inkubation der Membran in
TBS + 5% Magermilchpulver blockiert. Am folgenden Tag wird die Membran nach einem
15minütigen Waschen in TBS + 1% Milchpulver (Waschpuffer) mit dem entsprechenden
Antikörper inkubiert. Die Dauer der Inkubation sowie optimale Verdünnung in Waschpuffer
müssen zuvor experimentell ermittelt werden. Nach erneutem Waschen erfolgt die Inkubation
mit dem enzymgekoppelten Sekundärantikörper. Nach dem letzten Waschen in Waschlösung +
0.05% TWEEN erfolgt die Detektion der Antikörperbindung durch eine enzymkatalysierte,
57
Materialien und Methoden
lichtemittierende Reaktion. Diese sog. ECL-Reaktion wird exakt nach dem Protokoll des
Herstellers durchgeführt.
Das fluoreszierende Präzipitat, Antikörper und Sekundärantikörper können nahezu ohne
Beeinträchtigung der gebundenen Proteine von der Membran entfernt werden, um diese einer
erneuten Detektion zugänglich zu machen. Dazu wird die Membran zunächst 10 Minuten in 100%
Acetonitril geschwenkt. Anschließend erfolgt eine 30minütige Inkubation in stripping-Puffer bei
60°C im Wärmeschrank unter gelegentlichem Schwenken. Die Lösung wird durch Waschen mit
großen Mengen TBS + 0.05% TWEEN entfernt, danach erfolgt eine erneute Blockierung
unspezifischer Antikörper-Bindungsstellen auf der Membran durch Inkubation in TBS + 5%
Magermilchpulver über eine Stunde. Ausgehend von der Inkubation mit dem Primärantikörper
kann nun verfahren werden wie zuvor.
BLOTPUFFER: Tris Base
Glycin
SDS
20% Vol. Methanol
STRIPPING-PUFFER: 62.5 mM TRIS/HCl, pH 6.7
100 mM 2-Mercaptoethanol
2% SDS
3.6.7 COOMASSIE-Färbung von SDS-PAA Gelen
Zur Visualisierung von gelelektrophoretisch aufgetrennten Proteinen im Gel dient der Farbstoff
COMMASSIE-Blau (Sigma), der reversibel an Proteine bindet. Die untere Nachweisgrenze liegt nach
eigenen Erfahrungen bei etwa 50 ng Protein.
Zur Färbung wird ein Gel etwa 2 Minuten in der gebrauchsfertigen Lösung geschwenkt. Die
Entfärbung erfolgt über 2-3 Stunden durch Zugabe von Entfärbelösung, die zur Beschleunigung
des Prozesses häufiger gewechselt werden sollte. Auf den entfärbten Gelen werden die
Proteinbanden sichtbar. Für die Massenspektrometrie werden die interessierenden Banden mit
einem sterilen Skalpell ausgeschnitten und bis zur weiteren Bearbeitung eingefroren.
COOMASSIE-ENTFÄRBELÖSUNG:
58
60% aq. dest.
30% Methanol
10% Eisessig
Materialien und Methoden
3.6.8 Immunpräzipitation
In einem Gesamtvolumen von 400 µL IP-Puffer werden Probe und Primärantikörper unter
leichtem Schwenken über Nacht bei 4°C inkubiert. Bei Proben aus humanen Geweben ist zuvor
ein pre-clearing des Ansatzes mit Protein A-Agarose (1 h, 4°C) durchzuführen, um endogene
Immunglobuline zu entfernen, die sonst ebenfalls an Protein A binden könnten.
Am folgenden Tag wird der Präzipitationsansatz mit 50 µL Protein A-Agarose versetzt und
weitere 4-5 h wie zuvor inkubiert. Nach kurzer Zentrifugation wird das Präzipitat drei Mal mit
eiskaltem IP-Puffer gewaschen. Schließlich erfolgt durch Zugabe von 30 µL Lämmli-Puffer und
erhitzen auf 95°C (5 Minuten) die Gewinnung des Zielproteins.
Ein auf diese Weise gewonnenes Präzipitat enthält in großer Menge den eingesetzten
Antikörper. Liegt das Molekulargewicht des aufzureinigenden Proteins nahe 50 kDa bzw. 25 kDa,
ist die Elution über einen Tris/HCl-pH-Gradienten empfehlenswert. Während Immunglobuline
erst etwa bei pH 2.5 bis pH 2.0 von Protein A gelöst werden können, eluieren gebundene
Proteine bereits bei pH 4.0 - 3.0.
Auf diese Weise gewonnene Proteine können mittels Western Blot oder Massenspektrometrie
nach COOMASSIE-SDS-PAGE weiter bearbeitet werden.
IP-PUFFER:
20 mM Tris/HCl pH 8.0
150 mM NaCl
0.5 % nonidet P-40
0.1 % NaN3
0.1 mM PMSF
1% Phosphatasehemmer-Mix (Sigma)
1% Protease-Inhibitor-Mix (Sigma)
3.6.9 Enzyme-linked immunosorbent assay (ELISA)
Die Vorteile eines ELISA liegen in einer besonders hohen Sensitivität und Spezifität des Systems,
das bei einer einfachen Durchführbarkeit einen hohen Probendurchsatz in der RoutineDiagnostik ermöglicht.
Das folgende Protokoll beschreibt die Durchführung eines „Sandwich“-ELISA-Systems, mit dessen
Entwicklung im Rahmen dieser Arbeit begonnen wurde. Die in Tab. 2 angegebenen
Antikörperverdünnungen können dabei von den letzlich einzusetzenden Werten abweichen.
Bindung des in PBS verdünnten „Fänger“-Antikörpers an die Polystyrol-Oberfläche einer
Mikrotiterplatte (Nunc GmbH, Wiesbaden) erfolgt durch Inkubation bei 4°C über Nacht;
Auftragsvolumen 100 µL/Vertiefung. Unspezifische Bindestellen wurden durch Inkubation mit 5%
BSA in PBS oder 5% Milchpulver in PBS blockiert. Nach dreimaligem Waschen mit
59
Materialien und Methoden
300 µL/Vertiefung PBS + 0.1% TWEEN kann die Mikrotiterplatte getrocknet und bei 4°C gelagert
werden.
Die Inkubation mit 100 µL einer den Analyten enthaltenden Probe erfolgt über 2 Stunden bei
Raumtemperatur. Anschließendes Waschen mit 3 x 300 µL PBS + 0.1% TWEEN entfernt nicht
gebundene Probenbestandteile. Im Folgenden wird durch Zugabe eines „Detektor“-Antikörpers
das gebundene Antigen (phospho-Her-2) für die weitere Detektion markiert (100 µL/Vertiefung,
2h, RT). Durch Waschen wie zuvor wird nicht gebundener Antikörper entfernt.
Die Detektion erfolgt nach der Zugabe eines Enzym-gekoppelten (Meerrettisch-Peroxidase HRP,
alt.: alkalische Phosphatase AP) Antikörpers; Inkubation 1h, RT, 100 µL/Vertiefung. Nach
Waschen wie zuvor erfolgt die Zugabe von 100µL Färbesubstrat (TMB, gebrauchsfertige Lösung;
Amersham, Little Chalfont, GB), das durch das Enzym in ein blaues Produkt umgesetzt wird.
Nach 15minütiger Inkubation unter Lichtabschluss wird die Reaktion durch Zugabe von 100 µL
2M Schwefelsäure gestoppt. Das nicht über einen längeren Zeitraum stabile Produkt kann bei
einer Wellenlänge von 450 nm photometrisch quantifiziert werden. Durch Abgleich mit einer
Verdünnungsreihe aus bekannten Konzentrationen des Analyten kann so der Gehalt einer
beliebigen Probe ermittelt werden.
Tabelle 9: Im ELISA-System eingesetzte Antikörper /-Verdünnungen
(Entwicklungsphase)
Antikörper
Maus-anti-Her2
extrazelluläre Domäne,
Klon 10A7 („Fänger“)
Maus-anti phospho-Tyrosin,
Klon P-Tyr-100 („Detektor“)
Esel-anti-Maus IgG,
HRP-konjugiert
60
Hersteller
Verdünnung (in PBS)
Novocastra Ltd.,
Newcatle, UK
1:4000
Cell Signaling, Beverly,
MA, USA
Amersham, Little
Chalfont, GB
1:1000
1:500 - 1:20.000
4. Ergebnisse
4.1
in situ-Analysen zur Protein-Expression und -Aktivierung
Nahezu alle untersuchten Proteine der Her-2-assoziierten Signaltransduktion wiesen in der
Gesamtheit der Tumorgewebe im Vergleich zu den korrespondierenden Normalgeweben eine
statistisch signifikant verstärkte Expression oder Aktivierung auf. Dabei stellte sich die
Expressionsveränderung zumeist unabhängig von der Intensität einer Färbung als Zunahme des
prozentualen Anteils der gefärbten Zellen dar.
4.1.1 Expression der Rezeptor-Tyrosin-Kinase Her-2 in ausgewählten Karzinomen der
Mamma und der Prostata
Basierend
auf
verschiedenen
der
Fragestellung
Tumorentitäten
zur
wurde
Wirksamkeit
die
Her-2-gerichteter
untersuchte
Population
von
Therapeutika
Patienten
in
mit
fortgeschrittenen Mammakarzinom nach der im Vorfeld immunhistochemisch nachgewiesenen
Her-2-Expression vorselektiert. Hierbei wurde ein besonderes Augenmerk auf Tumoren mit einer
mit dem DAKO HercepTest nachgewiesenen niedrigen Her-2-Expression gelegt, da diese
Patienten von einer Behandlung mit Omnitarg™ profitieren könnten. Insgesamt wurde die
analysierte Patienten-Kohorte wie in Tab. 10a dargestellt nach dem Her-2-Status klassifiziert.
Hierbei stellte sich die untersuchte Population als überwiegend Her-2-„negativ“ dar (DAKOScore 0, 1+, 2+/FISH neg.)*1. Mit 20 Patienten (18%) war in der ausgewählten Population der
Anteil für eine Herceptin-Therapie geeigneter Patienten gegenüber der statistischen Häufigkeit
im Mammakarzinom (ca. 20-30%) leicht erniedrigt.
Interessanterweise zeigten 25 morphologisch als unverändert zu bezeichnende Gewebe bereits
eine leichte immunhistochemisch detektierbare Her-2-Expression (HercepTest Score 1+); in
einem Fall war zusätzlich eine unvollständige Membranfärbung zu beobachten (HercepTest
Score 2+). Mit p = 7 x 10-16 wurde für die untersuchten Tumorgewebe aus der Mamma eine im
Vergleich zu den korrespondierenden Normalgeweben statistisch hoch signifikante Veränderung
in der Expression des Her-2 Rezeptors ermittelt.
*1
Hierbei entspricht die immunhistochemisch festgestellte Her-2 Überexpression (3+) einer Rezeptordichte von
bis zu 2 Millionen Molekülen pro Zelle. Der DAKO Score 2+ entspricht einer Rezeptordichte von etwa 500.000
Her-2 Molekülen pro Zelle; die normale Expression des Rezeptors liegt bei etwa 20.000 Molekülen pro Zelle
(Nahta, 2006; Ross, 2004).
61
Ergebnisse
Prostatatumoren wurden ohne Berücksichtigung der Her-2-Expression willkürlich zur in situAnalytik ausgewählt. Die Klassifizierung der Patientenpopulation nach dem Resultat des DAKO
HercepTest ist in Tab. 10b aufgeführt. Danach wurden alle untersuchten Prostatakarzinome als
Her-2-„negativ“ eingestuft (DAKO-Score 0, 1+), wobei 64% der Tumoren zumindest eine leichte
Expression zeigten. Eine Überexpression des Rezeptors konnte unter Anwendung der für das
Mammakarzinom gültigen Kriterien zur Beurteilung des Her-2-Nachweises nicht gezeigt werden.
Zudem wiesen 54 (69%) der korrespondierenden prostatischen Normalgewebe ebenfalls eine
schwache Her-2-Expression auf (HercepTest Score 1+) auf. Eine statistisch signifikante
Expressionsänderung im Tumorgewebe konnte somit in der hier untersuchten Population nicht
festgestellt werden.
Tabelle 10a: Her-2-Expression in Mammatumoren
(Häufigkeit DAKO-Score)
HercepTest
Score
Häufigkeit
0
1+
38
31
2+
(FISH neg.)
21
2+
(FISH pos.)
4
3+
total
16
110
Tabelle 10b: Her-2-Expression in Tumoren der Prostata
(Häufigkeit DAKO-Score)
HercepTest
Score
Häufigkeit
0
1+
2+
3+
total
28
50
0
0
78
4.1.2 Die Mitglieder der EGF-Rezeptor-Familie können in verschiedenen Kompartimenten
der Zelle nachgewiesen werden
Alle Rezeptoren für Wachstumsfaktoren nehmen ihre biologische Funktion in der Zellmembran
wahr. Entsprechend ist im immunhistochemischen Nachweis mit einer Membranfärbung zu
rechnen. Cytoplasmatische Färbemuster sind entweder auf die Detektion von unmodifizierten
oder noch nicht vollständig gefalteten Vorläuferproteinen zurück zu führen, oder auf aktive
Moleküle, die als Folge ihrer Aktivierung internalisiert wurden.
Der epidermal growth factor receptor, EGFR oder Her-1, war nur in wenigen Tumoren der
Mamma (n = 17; 14%) und Prostata (n = 7; 9%) exprimiert. Die Färbeprozedur unter Verwendung
des DAKO EGFR-pharmDX-Kit lieferte eine Membranfärbung mit cytoplasmatischer Komponente
(Abb. 12). Trotz einer nicht statistisch signifikanten Expressionsänderung in den untersuchten
62
Ergebnisse
A
B
Abbildung 12: Repräsentative Ergebnisse eines IHC-Nachweises des EGFR. A Invasiv duktales, gering
differenziertes Mammakarzinom; G3 pT3m pN2a L1 R1 (10x). B Prostatakarzinom geringer Differenzierung, G3
pT2 pN1(1/31), Gleason-Score: 3 + 5 = 8 (20x). Informationen zur Häufigkeit der EGFR-Expression in den Entitäten
des Mamma- und Prostatakarzinoms finden sich im Text.
Indikationen (pMamma= 0.045; pProstata= 0.046) wurde der EGFR wegen seiner Bedeutung für die
Signaltransduktion in nachfolgende statistische Analysen einbezogen.
Her-3 konnte sowohl im Mammakarzinom (Abb. 13A) als auch in fortgeschrittenen Tumoren der
Prostata (Abb. 14A) immunhistochemisch überwiegend im Cytoplasma nachgewiesen werden.
Daneben war in 23% der Tumoren der Prostata (n = 18) und 31% der korrespondierenden
Normalgewebe
(n = 24)
eine
nukleäre
Färbung
zu
beobachten
(Abb.
14C/D).
Die
cytoplasmatische Expression von Her-3 in Tumoren der Mamma und der Prostata war statistisch
signifikant gegenüber den entsprechenden Normalgeweben erhöht (pMamma = 0.00017; pProstata =
0.00019), was ein Hinweis auf die klinische Bedeutung des Rezeptors sein könnte.
Die Expression des Her-4 Rezeptors wurde nur an Geweben der Mamma untersucht (Abb. 15).
Hier konnte im Vergleich zu den Normalgeweben eine statistisch hochsignifikante Zunahme der
cytoplasmatischen Expression in den Tumorgeweben festgestellt werden (p = 8 x 10-15).
Aufgrund seiner hohen Prävalenz mit nachgewiesener Expression in
78 (66%) der hier
untesuchten Fälle scheint so Her-4 neben Her-2 die größte Bedeutung für die Signaltransduktion
im Mammakarzinom zu besitzen. Zusätzlich konnte der Rezeptor in 36 (31%) der
Mammakarzinome im Zellkern detektiert werden; der Expressionsunterschied zu den
korrespondierenden Normalgeweben war ebenfalls statistisch signifikant (p = 1 x 10-4).
63
Ergebnisse
B
Tumor
Cytoplasma
Häufigkeit
Normal
Cytoplasma
Häufigkeit
A
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Normal
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Tumor
Abbildung 13: Expressionsnachweis des Her-3-Rezeptors im Mammakarzinom. A Invasiv-duktales Karzinom (10x)
B Prozentualer Anteil der gefärbten Zellenan der gesamt-Tumorzellzahl. Häufigkeitsverteilung in der
untersuchten Population. Darstellung als Säulendiagramm (oben) und Boxplot (unten).
B
Tumor
Cytoplasma
Häufigkeit
Normal
Cytoplasma
Häufigkeit
A
0 20 40 60 80
Anteil gefärbter Zellen [%]
Tumor
Normal
Nukleus
Tumor
Nukleus
Häufigkeit
D
Normal
Häufigkeit
C
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
0 20 40
60 80
Anteil gefärbter Zellen [%]
Normal
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Tumor
Abbildung 14: Her-3 Expressionsnachweis in Tumoren der Prostata. A Mittelgradig differenziertes
Prostatakarzinom. pT2c pN0, Gleason-Score 3 + 3 = 6. (10x) B Häufigkeit der cytoplasmatischen Her-3-Expression
in der untersuchten Population. Bei überwiegend nicht nachweisbarer Expression im Normalgewebe nimmt der
Anteil der gefärbten Zellen im Tumor deutlich zu C Invasives, mittelgradig differenziertes Prostatakarzinom. G2
pT2b pN0, Gleason-Score 3 + 2 = 5 (10x). In dem Gewebe lässt sich eine nukleäre Expression des Rezeptors
nachweisen. D Statistische Verteilung der nukleären Expression des Her-3-Rezeptors in der Gesamtpopulation.
Angegeben ist der Prozentsatz der gefärbten Zellen an der gesamt-Tumorzellzahl.
64
Ergebnisse
Tumor
Cytoplasma
Häufigkeit
Normal
Cytoplasma
B
Häufigkeit
A
0 20 40 60 80 100
C
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Anteil gefärbter Zellen [%]
Tumor
Häufigkeit
Häufigkeit
Normal
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Abbildung 15: Charakteristisches Färberesultat eines immunhistochemischen Her-4-Nachweises. A Solid
wachsendes, undifferenziertes Mammakarzinom; G3 pT4 pN1b (10x) . B Häufigkeit der Färbung in der
untersuchten Population. Angegeben ist der Prozentsatz cytoplasmatisch gefärbter Zellen in einem Gewebe. C
Häufigkeit nukleärer Färbung in der Gesamtpopulation. Angegeben ist jeweils der Prozentsatz gefärbter Zellen an
der Gesamt-Zellzahl normaler oder Tumorzellen.
4.1.3 Phosphorylierungsstatus der EGF-Rezeptoren in Mamma-Karzinomen
Der spezifische Nachweis einer Phosphorylierung charakteristischer Tyrosin-Seitengruppen der
EGF-Rezeptoren gelang für Her-2 und Her-3. Ein entsprechender in situ-Nachweis des
phosphorylierten EGFR wurde ebenfalls durchgeführt; bei bestehenden Zweifeln an der
Spezifität des verwendeten Primärantikörpers wurde das etablierte Protokoll verworfen. Auf die
Bestimmung des Her-4-Phosphorylierungsstatus musste verzichtet werden, da derzeit keine
entsprechenden Antikörper kommerziell erhältlich waren.
Die Bedeutung der Aktivierung/Phosphorylierung von Her-2 für eine Therapieresponse bei der
Behandlung mit anti-Her-2-Therapeutika ist nicht geklärt. In Rahmen dieser Arbeit wurden
insgesamt drei Phosphorylierungs-spezifische Antikörper eingesetzt, die eine Phosphorylierung
des Her-2 Moleküls an Tyrosin 1248, Tyrosin 877 sowie an Tyrosin 1221/1222, erkennen. Alle
IHC-Nachweise resultieren in einem cytoplasmatischen Färbemuster, das häufig mit einer
Färbung
der
Zellmembran
einhergeht
(Abb.
50,
Kap.
4.4.2).
Hierbei
zeigte
der
immunhistochemische Nachweis der Phosphorylierung an verschiedenen Tyrosin-Seitengruppen
des Her-2-Rezeptors jeweils eine identische Verteilung in den Geweben. Die cytoplasmatische
Lokalisation des aktivierten Rezeptors kann durch Phosphorylierung an Tyr1112 erklärt werden;
diese Phosphorylierungsstelle wird durch die Ubiquitin-Ligase cbl erkannt, wodurch eine
Internalisierung und anschließende lysosomale Degradation des Rezeptors bewirkt wird.
Entsprechend der Funktionalität des phosphorylierten Her-2 wurde bei der Begutachtung der
Färbungen neben der Membran- auch die cytoplasmatische Färbung als Kriterium zur
Beurteilung der Gewebe herangezogen; wegen der übergeordneten Rolle des Tyr1248 als
Bindestelle für Adaptorproteine des MAPK-pathway sowie PLCγ wird in weiteren Analysen
ausschließlich auf diese Phosphorylierunggstelle eingegangen. Hier konnte eine statistisch
65
Ergebnisse
A
B
Abbildung 16: Her-3-Phosphorylierung (Tyr1289) in fortgeschrittenen Mammakarzinomen. A Das dargestellte
invasiv duktale Karzinom (40x) zeigt eine schwache Membranfärbung. In diesem Fall korreliert der positive
Nachweis von pHer-3 mit einem positiven Befund im pHer-2-Nachweis. B Mittelgradig differenziertes, invasiv
lobuläres Mammakarzinom; G2 pT1c (20x). Deutliche nukleäre Färbung mit anti-phospho-Her-3 Antikörper in
einem großen Teil der Zellen. Die Ursache für eine Translokation membranständiger Rezeptoren ist ebenso wie
die biologische Funktion unklar.
signifikante Zunahme der Phosphorylierung in der untersuchten Population der Mamma-Tumoren
im Vergleich zu den korrespondierenden Normalgeweben festgestellt werden (p = 0.00012).
Während keine Phosphorylierung in den Normalgeweben nachgewiesen werden konnte,
resultierte der in situ-Nachweis in 27% der entsprechenden Tumoren (n = 31) in einer
schwachen bis mäßigen Färbung. Hierbei korrelierte die Intensität der Färbung mit dem
Ergebnis des jeweiligen Gewebes im DAKO HercepTest.
Sämtliche Malignome der Prostata lieferten in diesem Nachweis entsprechend der schwachen
Expression des Her-2-Proteins einen negativen Befund.
Der Phosphorylierungsnachweis für Her-3 wurde ausschließlich an Geweben der Mamma
durchgeführt. Trotz der nicht nachzuweisenden Expression des Her-3-Liganden Heregulin (s.u.)
ließ sich in einzelnen Tumoren (n = 3; 2%) eine sehr schwache Her-3-Phosphorylierung darstellen
(Abb. 16A). In einem weiteren Fall konnte phosphoryliertes Her-3 im Kern detektiert werden
(Abb. 16B). Auf der Grundlage statistischer Berechnungen konnte keine klinische Relevanz einer
Aktivierung des Her-3 festgestellt werden.
66
Ergebnisse
4.1.3 Untersuchungen zur Expression weiterer Rezeptor-Tyrosin-Kinasen in Karzinomen
der Mamma und der Prostata
Neben der Expression der Mitglieder der EGF-Rezeptor-Familie wurde die Expression anderer
Rezeptor-Tyrosin-Kinasen untersucht. Hierzu gehörten neben c-kit/CD115 (stem cell factor
receptor) der Rezeptor des insulin-like growth factor-1 (IGF-1R), die Rezeptoren des vascular
endothelial growth factor KDR und FLT-1 sowie der platelet-derived growth factor receptor
PDGFR und der Ephrin-Rezeptor Eph2A.
Die Expression des c-kit, PDGFR und EphA2 wurde ausschießlich für Prostatatumoren ermittelt,
während die übrigen Rezeptoren in beiden Tumor-Entitäten untersucht wurden.
4.1.3.1
Mamma-Tumoren exprimieren IGF-1R und VEGF-Rezeptoren
Der Rezeptor des insulin-like growth factor 1 (IGF-1R) wird als eines der für eine HerceptinResistenz hauptverantwortlichen Proteine vermutet, da er die gleichen Signalkaskaden
aktivieren kann wie der Her-2-Rezeptor. IGF-1R ist in nahezu allen Gewebetypen physiologisch
exprimiert und ließ sich dementsprechend auch im gesunden Gangepithel der Mamma
nachweisen.
Zusätzlich
stellten
sich
die
kontraktilen
Zellen
die
Myoepithels
im
immunhistochemischen Präparat als IGF-1R-positiv dar.
In den untersuchten Mamma-Tumoren war bei einer ausgeprägten membranösen Färbung mit
cytoplasmatischer Komponente eine sehr starke Expression des Rezeptors zu beobachten, die
sich in einer hohen Färbeintensität widerspiegelte (Abb. 17A). Gleichzeitig nahm in den
Tumoren der Mamma der Prozentsatz gefärbter Zellen im Vergleich zu den entsprechenden
Normalgeweben deutlich zu (Abb. 17B). Diese Expressionszunahme war statistisch signifikant
(p = 0.00024).
Normal
Membran
Tumor
Membran
Häufigkeit
B
Häufigkeit
A
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Normal
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Tumor
Abbildung 17: Expression des IGF-1R in fortgeschrittenen Mamma-Tumoren. A Charakteristisches Färberesultat
mit Anfärbung der Zellmembran sowie des Cytoplasma; gering differenziertes, invasiv duktales Karzinom mit
intraduktaler Komponente und Invasion der Lymphgefäße G3 pT2 L1 (10x) B Der prozentuale Anteil der im
immunhistochemischen Präparat angefärbten Zellen nimmt in den Tumorgeweben signifikant zu.
67
Ergebnisse
Die VEGF-Rezeptoren KDR/VEGFR-1 und FLT-1/VEGFR-2 sind Transmembranproteine, konnten
im immunhistochemischen Präparat jedoch als cytoplasmatisch exprimiert dargestellt werden.
Das
in
beiden
Fällen
charakteristische
Färbemuster
weist
auf
die
Detektion
eines
Vorläuferproteins hin (Abb. 18A, Abb. 19A). Die VEGF-Rezeptoren konnten sowohl im
Tumorgewebe als auch in der Wandung von Blutgefäßen und verschiedenen Leukozyten
dargestellt werden. Hier zeigt sich die besondere Bedeutung dieser Rezeptoren zum einen für
die Tumorgenese (autokrine Stimulation durch VEGF), zum anderen für die Angiogenese im
Rahmen der Tumorversorgung und Metastasierung.
In den Geweben der Mamma stellten sich KDR und FLT-1 als sehr unterschiedlich exprimiert dar.
Während FLT-1 nur in 6/118 (5%) morphologisch normalen Geweben exprimiert war, ließ sich
der Rezeptor in 43/118 (36%) der korrespondierenden Tumoren nachweisen. Dieser Zuwachs war
mit p = 4 x 10-6 statistisch hoch signifikant. Die Expression des FLT-1 betraf in den meisten
Fällen mehr als 80% der Tumorzellen einer Gewebestanze; in etlichen Fällen war jedoch die
Anfärbung geringerer prozentualer Anteile der Tumorzellen zu beobachten (Abb. 18B).
Im Vergleich zu den entsprechenden Normalgeweben nahm auch die Expression des KDR im
Mamma-Tumorgewebe signifikant zu (p = 2 x 10-5). Der Rezeptor konnte in 27/118 (23%) der
gesunden Gewebe nachgewisen werden, die Prävalenz nahm in den korrespondierenden
Tumoren bis auf 61% (n = 72) zu. Von der Färbung waren bei nur wenigen Ausnahmen jeweils
alle Zellen eines Tumors betroffen (Abb. 19B).
B
Tumor
Cytoplasma
Häufigkeit
Normal
Cytoplasma
Häufigkeit
A
0 20 40 60 80
Anteil gefärbter Zellen [%]
Normal
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Tumor
Abbildung 18: Expression des FLT-1/VEGFR-1 im Mammakarzinom. A Expression des Rezeptors ist durch eine
cytoplasmatische Anfärbung von Tumorzellen nachweisbar (10x). Die Abbildung zeigt die Expression des VEGFR-1
in einer Haut-Metastase eines invasiv-duktalen Mamma-Tumors; G2 pT4 B Häufigkeitsverteilung der ermittelten
prozentualen Anteile gefärbter Zellen. In den untersuchten Tumoren ist im Vergleich zu den korrespondierenden
Normalgeweben eine deutliche Zunahme der FLT-1-Expression zu erkennen, die zumeist alle Zellen eines Tumors
betrifft.
68
Ergebnisse
B
Tumor
Cytoplasma
Häufigkeit
Normal
Cytoplasma
Häufigkeit
A
0
20 40 60 80
Anteil gefärbter Zellen [%]
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Normal
Tumor
Abbildung 19: Expression des KDR/VEGFR-2 in Mammatumoren. A Anfärbung des Cytoplasma im positiven IHCNachweis (10x); invasiv duktales Mammakarzinom G3 pT2 L1. B Statistische Verteilung des prozentualen Anteils
der gefärbten Zellen in der untersuchten Population. Hierbei ist in den Tumoren eine deutliche Zunhame der
jeweils angefärbten Zellen zu beobachten. Mit wenigen Ausnahmen stellen sich alle Zellen in einem Tumor als
KDR-positiv dar.
4.1.3.2
Nur ein Teil der untersuchten Rezeptor-Tyrosin-Kinasen stellt sich in Tumoren
der Prostatata als verstärkt exprimiert dar
Der Rezeptor für den stem cell factor, c-kit/CD117 konnte in keiner der ausgewählten
prostatischen Gewebeproben nachgewiesen werden. Dies galt nicht für den platelet derived
growth factor receptor PDGFR, dessen Kinase-Domäne wie die des c-kit/CD117 ebenfalls durch
Glivec™ (Imatinib, Novartis) inhibiert wird. Bei einem cytoplasmatischen Färbemuster (Abb.
20A) konnte im immunhistochemischen Nachweis eine im Vergleich zu den jeweiligen
Normalgeweben hoch signifikante Zunahme der Expression in den Tumoren festgestellt werden
(p = 2 x 10-8). Bei einer hohen Prävalenz des Rezeptors in morphologisch normalen Geweben
(n = 56; 72%) nahm in den Tumoren die Expressionsstärke ebenso zu wie die Zahl der
betroffenen Gewebe (n = 74; 95%) (Abb. 20B).
In den Tumoren der Prostata konnte die Expression des IGF-1R (Abb. 21A) als gegenüber dem
Normalgewebe nahezu unverändert angesehen werden; die Intensität der Färbung sowie der
prozentuale Anteil der gefärbten Zellen an der Gesamt-Zellzahl war jeweils unvermindert.
Hierbei war gegenüber den gesunden Geweben (n = 9; 12%) eine Zunahme der nicht gefärbten
Gewebe in den Tumoren (n = 29; 37%) festzustellen (Abb. 21B). Entsprechend war im Vergleich
zu morphologisch unverändertem Drüsenepithel der Prostata keine statistisch signifikante
Expressionsänderung des IGF-1R in den korrespondierenden Tumoren erkennbar.
69
Ergebnisse
B
Tumor
Cytoplasma
Häufigkeit
Normal
Cytoplasma
Häufigkeit
A
0
1
2
3
0 1
Färbeintensität
2
3
Färbeintensität
Normal
Tumor
Abbildung 20: Expression des PDGFR ist in 95% der ausgewählten Prostata-Tumoren nachweisbar. A Typisches
Färberesultat mit cytoplasmatischer Lokalisation des nachgewiesenen Proteins in einem mittelgradig bis gering
differenzierten Prostatakrzinom. G2-3 pT2c pN0, Gleason-Score 4 + 3 = 7 (10x) B Die Färbeintensität kann als
Ausdruck der Expressionshöhe als einziges Kriterium zur Beurteilung der Färbung herangezogen werden.
Erkennbar ist so eine deutliche Zunahme der Färbeintensität in den Tumorgeweben; gleichzeitig nimmt auch die
Zahl der betroffenen Fälle im Vergleich zu den korrespondierenden Normalgeweben zu.
B
Tumor
Cytoplasma
Häufigkeit
Normal
Cytoplasma
Häufigkeit
A
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Normal
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Tumor
Abbildung 21: IGF-1R kann sowohl im Normalgewebe der Prostata als auch in den entsprechenden Malignomen
nachgewiesen werden. A Charakteristisches Ergebnis eines IGF-1R-Nachweises in einem mittelgradig
differenzierten Prostatakarzinom. pT2c pN0, Gleason-Score 3 + 3 = 6.PCa. Neben der Anfärbung des Cytoplasma
ist auch ein Nachweis des Rezeptors in der Membran möglich (10x). B Der Anteil der IGF-1R-negativen Gewebe
nimmt in den Tumoren im Vergleich zu den Normalgeweben zu. Hier dargestellt sind die Häufigkeiten des
prozentualen Anteils gefärbter Zellen in einem Gewebe: die ungleichmäßige statistische Verteilung lässt ein
heterogenes Färbemuster erahnen.
Auch die VEGF-Rezeptoren KDR/VEGFR-1 und FLT-1/VEGFR-2 waren in den untersuchten
Prostata-Tumoren exprimiert (Abb. 22); der Nachweis des KDR gelang in 40% (n = 31), während
FLT-1 in 41% (n = 32) der Tumoren exprimiert war. Zusätzlich stellten sich in beiden Fällen
zahlreiche morphologisch unverändert erscheinende Epithelien als VEGFR-positiv dar. Hierbei
konnte KDR in 27% (n = 21), FLT-1 in 35% (n = 27) der entsprechenden Normalgewebe
nachgewiesen werden. Für beide Rezeptoren konnte damit keine statistisch relevante
Expressionsänderung beider Rezeptoren ermittelt werden. Dennoch mag die hohe Prävalenz der
VEGF-Rezeptoren ein Hinweis auf eine Eignung als therapeutisches target sein.
70
Ergebnisse
A
B
→
→
Abbildung 22: Expression der VEGF-Rezeptoren in Prostata-Tumoren. Dargestellt ist jeweils der gleiche Tumor
(Histo). A Cytoplamatisches Färbemuster im immunhistochemischen Nachweis des FLT-1. Mittelgradig
differenziertes Adenokarzinom G2 pT2c pN0, Gleason-Score 3 + 3 = 6 (20x). Zusätzlich kann eine Anfärbung von
Blutgefäßen beobachtet werden (Pfeil). B Im gleichen Gewebe resultiert auch der IHC-Nachweis des KDR in einem
cytoplasmatischen Färbemuster (10x).
B
Normal
Cytoplasma
Tumor
Cytoplasma
Häufigkeit
Häufigkeit
A
0
1
2
0 1
Färbeintensität
2
3
Färbeintensität
Normal
Tumor
Abbildung 23: Expression des Ephrin-Rezeptors Eph2A in Tumoren der Prostata. A cytoplasmatisches Färbemuster
in einem mittelgradig differenzierten Adenokarzinom. G2 pT2c pNX, Gleason-Score 3 + 2 = 5 (10x). B Statistische
Verteilung der beobachteten Färbeintensitäten in der analysierten Population. Erkennbar ist bei gleich bleibender
Anzahl nicht gefärbter Gewebe eine Zunahme der beobachteten Intensität.
Der Expressionsnachweis des Ephrin-Rezeptors EphA2 resultierte in einem cytoplasmatischen
Färbemuster (Abb. 23A). Der positive Nachweis des Rezeptors betraf jeweils alle Zellen eines
Gewebes, so dass die Intensität einer Färbung als Ausdruck der Expressionsstärke als alleiniges
Kriterium zur Beurteilung der Gewebestanzen verwendet wurde. Im Vergleich zu den
korrespondierenden
Normalgeweben
konnte
eine
statistisch
mäßig
Expressionszunahme in den Tumoren festgestellt werden (p = 0.0018).
signifikante
Hierbei blieb die
ermittelte Prävalenz des Rezeptors in den Tumoren (n = 57) gegenüber den Normalgeweben
(n = 52) nahezu unverändert.
71
Ergebnisse
4.1.5 Nicht alle untersuchten Wachstumsfaktoren sind in Tumorgeweben nachweisbar
Da die EGF-ähnlichen Wachstumsfaktoren in einer auto- oder parakrinen Weise die Zellen eines
Epithels stimulieren, kann ihre Expression ein erster Hinweis auf eine unerwünschte
Teilungsaktivität in Tumorgewebe sein. Nahezu alle Liganden der Her-Rezeptor-Familie sowie
zusätzlich der vascular endothelial growth factor VEGF wurden auf ihre Expression im
Tumorgewebe untersucht; mit Ausnahme des TGF-α und des VEGF beschränkten sich die
Analysen auf den Expressionsnachweis im Mammakarzinom.
Im Nachweis der verschiedenen Wachstumsfaktoren ist im gesunden Gangepithel der Mamma
und den Einzeldrüsen der Prostata eine apikale, dem Lumen zugewandte Färbung zu erwarten.
Entsprechend der polaren Organisation epithelialer Zellen werden Wachstumsfaktoren dort in
Form membranständiger Vorläuferproteine exprimiert, die bei einer Verletzung des Gewebes
freigesetzt werden und so am basolateralen Pol der Epithelzellen mit ihren jeweiligen
Rezeptoren zusammen kommen können.
Der epidermal growth factor EGF war in 79% (93/118) der untersuchten Normalgewebe der
Mamma exprimiert. Die Färbeintensität sowie der prozentuale Anteil der gefärbten Zellen
nahmen in den korrespondierenden Tumoren zu. Insgesamt exprimierten 78% (92/118) der
untersuchten Mammakarzinome EGF; die Expressionsveränderung im Tumorgewebe war
statistisch nur mäßig signifikant (p = 0.0064). In den gefärbten Geweben konnte eine
charakteristische Verteilung des nachgewiesenen Wachstumsfaktors beobachtet werden. In der
Hauptsache war die Färbung im Cytoplasma zu finden (Abb. 24A); in 59 Tumoren (50%) war bei
ungeklärter Ursache zusätzlich eine Anfärbung der Zellkerne zu beobachten (Abb. 24B). Es
erscheint möglich, dass es durch die hohe Verbreitung der in einer Reihe von Liganden
konservierten EGF-Domäne zu falsch-positiven Färberesultaten kam.
A
B
Abbildung 24: Der epidermal growth factor EGF kann in Mamma-Karzinomen im Cytoplasma und im Zellkern
detektiert werden. A Ausschließlich cytoplasmatisches Färbemuster; invasiv-duktales Karzinom G2 pT2 L1 (10x) B
Gemischt cytoplasmatisch-nukleäres Färberesultat in einem undifferenzierten invasiv-duktalen Karzinom der
Mamma G3 pT2 L1 (10x).
72
Ergebnisse
A
B
Abbildung 25: A Typisches Färberesultat bei immunhistochemischem Nachweis der HB-EGF-Expression in einem
invasiv-duktalen Mammakarzinom (10x). B Auch der vascular endothelial growth factor VEGF kann
immunhistochemisch im Cytoplasma von Mamma-Tumorzellen nachgewiesen werden (10x).
Die Expression des zum Transport im Serum an Heparin gebundenen HB-EGF konnte in etwa
einem Drittel der Mammakarzinome nachgewiesen werden (n = 44; 37%), im Vergleich zur
Expression in den korrespondierenden Normalgeweben war die Veränderung statistisch
hochsignifikant (p = 1 x 10-6) (Abb. 25A). Dies gilt nicht für das physiologisch in den B-Zellen der
LANGERHANS-Inseln des Pancreas gebildete Betacellulin BTC, das in der Zellmembran und im
Cytoplasma sowohl von morphologisch normalen Zellen als auch Tumorzellen gefunden wurde.
Da die Färbung nur in einer äußerst geringen Anzahl von Geweben (n = 4; 3%) und dort jeweils
nur in weniger als 20% der Tumorzellen zu beobachten war, konnte eine Bedeutung des
Wachstumsfaktors in der Tumorgenese statistisch nicht eindeutig nachgewiesen. Das Protein
wurde daher ebenso von weiteren Betrachtungen ausgenommen wie der Her-3/Her-4-Ligand
Heregulin, das in keinem der untersuchten Tumoren nachgewiesen werden konnte.
B
Normal
Cytoplasma
Tumor
Cytoplasma
Häufigkeit
Häufigkeit
A
0 20 40 60 80 100
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Anteil gefärbter Zellen [%]
Normal
Tumor
Abbildung 26: TGF-α ist im Cytoplasma und der Zellmembran nachweisbar. A Die Abbildung zeigt ein typisches
Färbeergebnis eines Mamma-Tumors, wobei in diesem Fall die fokale Färbung nur eines Teils der Tumorzellen
auffällig ist; mittelgradig differenziertes, invasiv duktales Mammakarzinom mit intraduktaler Komponente G2
pT1c(is) (10x). B Statistische Verteilung. Während nur wenige Normalgewebe TGF-α exprimieren, kann der
Wachstumsfaktor in 59% der Mamma-Tumoren nachgewiesen werden. Hier betrifft die Färbung zumeist alle Zellen
eines Tumors.
73
Ergebnisse
Der immunhistochemische Nachweis von TGF-α (transforming growth factor-α) resultierte in
einer ebenfalls cytoplasmatischen Färbung mit membranöser Komponente (Abb. 26A). Im
Normalgewebe der Mamma konnte das Protein im Cytoplasma und zusätzlich im apikalen
Kompartiment der Membran dargestellt werden, was auf die Polarisierung von Epithelzellen
hinweist (n = 20; 17%). Die Membranfärbung ist auf die Existenz von Vorläuferproteinen zurück
zu führen, aus denen der Wachstumsfaktor durch proteolytische Spaltung freigesetzt wird;
zusätzlich wäre der Nachweis von Rezeptor-gebundenen Molekülen denkbar. Insgesamt
exprimierten 69 (59%) der hier untersuchten Mamma-Tumoren TGF-α (Abb. 26B). Somit konnte
immunhistochemisch in der Mamma eine statistisch hoch signifikante Expressionsänderung im
Verlauf vom gesunden zum bösartig veränderten Gewebe festgestellt werden (p = 4 x 10-8).
Der vascular endothelial growth factor VEGF ist einerseits für die Neubildung von Gefäßen zur
Tumorversorgung nötig und regt zudem Tumorzellen in einer autokrinen Stimulation zum
Wachstum an. VEGF konnte in den Normalgewebe der Mamma nicht nachgewiesen werden. Der
immunhistochemische Nachweis ergab eine cytoplasmatische Lokalisation in 59% (69/118) der
untersuchten Tumorgewebe (Abb. 25B); die Expressionsänderung im Verlauf der Tumorbildung
kann mit p = 3 x 10-11 als statistisch hoch signifikant angesehen werden. Zusätzlich war eine
Anfärbung der Endothelzellen zu beobachten; ein Kriterium, das im Rahmen dieser
Untersuchung als positiv-Kontrolle für den Färbevorgang verwendet wurde.
Die Expression von TGF-α und VEGF wurde ebenfalls in Geweben der Prostata untersucht. Der
Wachstumsfaktor konnte in keinem Normalgewebe und nur in fünf Prostatakarzinomen
nachgewiesen werden (6%); die Expressionsänderung war nicht statistisch signifikant. Im
Gegensatz hierzu gelang der Nachweis der Expression des TGF-α in 59 (76%) Tumoren der
Prostata (Abb. 27). Bei einer gegenüber den gesunden Geweben nahezu unveränderten
Expressionsstärke in den Tumoren wurde keine signifikante Expressionsänderung festgestellt.
B
Tumor
Cytoplasma
Häufigkeit
Normal
Cytoplasma
Häufigkeit
A
0 1
2
3
Färbeintensität
Normal
0 1
2
3
Färbeintensität
Tumor
Abbildung 27: Expression des TGF-α im Prostatakarzinom. A Typisches Färberesultat mit cytoplasmatischem
Färbemuster. Wenig differenziertes, infiltrierendes Adenokarzinom der Prostata. G3 pT3b pN1, Gleason-Score
4 + 4 = 8 (10x) B Häufigkeitsverteilung der festgestellten Färbeintensitäten.
74
Ergebnisse
A
B
Abbildung 28: Durch Phosphorylierung aktivierte ERK1/2 ist im Cytoplasma und im Nukleus nachweisbar; auch
exklusive Färbung nur eines Kompartimentes ist möglich. A Mittelgradig differenzierter, invasiv duktaler MammaTumor G2 pT1c (10x). B Mittelgradig differenzierter Tumor der Prostata. G2 pT2c pN0, Gleason-Score 3 + 3 = 6
(20x).
4.1.6 Aktivierung des MAP-Kinase-pathway ist in beiden untersuchten Tumorentitäten nur
selten nachweisbar
Als zentrales Protein des MAP-Kinase-pathway wurde der Aktivierungszustand der extracellular
signal regulated kinase ERK1/2 untersucht. Die multiplen Funktionen von ERK1/2 finden
Ausdruck im immunhistochemischen Färbeverhalten; das Protein ließ sich in den hier
untersuchten Tumor-Entitäten des fortgeschrittenen Mamma- und Prostatakarzinoms sowohl im
Cytoplasma als auch im Nukleus lokalisieren (Mamma: Abb. 28A, Prostata: Abb. 28B).
Während in den Tumoren der Mamma insgesamt 37 Gewebe (31%) eine Phosphorylierung von
ERK1/2
aufwiesen,
waren
davon
11
Tumoren
der
Prostata
(14%)
betroffen.
Die
korrespondierenden Normalgewebe zeigten eine ERK1/2-Phosphorylierung in 15 Fällen (Mamma;
13%) bzw. 14 Fällen (Prostata; 18%) auf. Das Protein konnte meist nur in einem Bruchteil der
gesamt-Zellmasse nachgewiesen werden, der zumeist unter 20% der gesamt-Zellzahl lag.
Insgesamt konnte sowohl für das Mamma- als auch das Prostatakarzinom keine statistisch
signifikante Zunahme der Aktivierung in Form einer Phosphorylierung charakteristischer Serinund Threoninseitengruppen von ERK1/2 festgestellt werden.
4.1.7 Der anti-apoptotische AKT-pathway erscheint in vielen Tumoren der Mamma und der
Prostata aktiviert
Signaltransduktion über den AKT/PKB-pathway nimmt aufgrund der Vielzahl der beeinflussten
zellulären Funktionen eine zentrale Rolle ein. Zu den im Rahmen dieser Arbeit untersuchten
Proteinen dieses Signalweges gehörten PTEN und phospho-AKT/PKB sowie als direkte
Zielproteine von AKT mTOR und der Zellzyklus-Regulator p27kip1 (4.1.8).
75
Ergebnisse
4.1.7.1
In Mamma-Karzinomen ist die Signaltransduktion über PTEN und AKT/PKB
verstärkt aktiviert
Seinen vielfältigen Funktionen folgend konnte PTEN im immunhistochemischen Präparat in
Normal- und Tumorgeweben sowohl im Cytoplasma als auch im Nukleus nachgewiesen werden
(Abb. 29A); in Einzelfällen (n = 4) konnte eine Membran-assoziierte Lokalisation festgestellt
werden. Insgesamt zeigten 16 Normalgewebe (14%) der Mamma sowie 37 (31%) der
korrespondierenden Tumoren eine nukleäre Lokalisation von PTEN. Eine cytoplasmatische
Lokalisation von PTEN konnte in 20 (17%) der Mamma-Normalgewebe gefunden werden. Die
Expression nahm in den entsprechenden Tumorgeweben auf 58% (69/118) zu; hierbei betraf die
Färbung zumeist alle Tumorzellen (Abb. 29B). Der festgestellte Expressionsunterschied
zwischen Normal- und Tumorgeweben war statistisch hoch signifikant (p = 4 x 10-7). Ein totaler
Verlust der PTEN-Expression war in 47 Karzinomen (40%) zu beobachten.
Da
der
zum
in
situ-Nachweis
verwendete
Antikörper
nicht
zwischen
verschiedenen
Aktivierungszuständen von PTEN differenziert, konnte keine Aussage über den Anteil der
tatsächlich aktiven Moleküle getroffen werden.
Phosphoryliertes AKT ließ sich entsprechend seiner Funktion mittels Immunhistochemie im
Cytoplasma sowie im Kern darstellen (Abb. 30A). Die Färbung ergab einen Nachweis von
phosphoryliertem AKT in 29 (25%) der Normalgewebe der Mamma. Im Verlauf der
Tumorentstehung nahm die Aktivität des Enzyms deutlich zu; von den korrespondierenden
Tumorgeweben stellten sich 77 (65%) als phospho-AKT-positiv dar. Eine Färbung betraf zumeist
einen hohen Prozentsatz der Tumorzellen eines jeweiligen Gewebes (Abb. 30B). Die Zunahme
der Aktivität von AKT in den untersuchten Tumoren der Mamma kann als statistisch hoch
signifikant angesehen werden (p = 6 x 10-6).
Tabelle 11: Zusammenhang von PTEN-Expression und Aktivierung der PKB/AKT
in Tumoren der Mamma
PTEN-Expression
AKT-Phosphorylierung
76
neg.
schwach
mäßig
stark
Σ
neg.
17
13
12
0
42
schwach
6
5
16
2
29
mäßig
2
8
2
4
16
stark
2
2
1
0
5
Ergebnisse
B
Normal
Cytoplasma
Tumor
Cytoplasma
Häufigkeit
Häufigkeit
A
0 20 40 60 80 100
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Anteil gefärbter Zellen [%]
Normal
Tumor
Abbildung 29: In situ-Expressionsnachweis der Phosphatase PTEN. A Im dargestellten invasiv-duktalen
Mammakarzinom (G2 pT2 L1) lässt sich das Protein sowohl im Cytoplasma als auch im Nukleus nachweisen (10x).
B Häufigkeitsverteilung der in der analysierten Population festgestellten prozentualen Anteile gefäbter Zellen an
der Gesamt-(Tumor-) Zellzahl. Während nur wenige Normalgewebe eine Färbung aufweisen, kann PTEN in 58% der
Mamma-Tumoren nachgewiesen werden. Hier betrifft eine Färbung zumeist alle Zellen eines jeweiligen Gewebes.
Eine nicht nachweisbare Expression von PTEN liegt in 47 Fällen (40%) vor.
B
Tumor
Cytoplasma
Häufigkeit
Normal
Cytoplasma
Häufigkeit
A
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Normal
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Tumor
Abbildung 30: AKT/PKB-Phosphorylierung im Mammakarzinom. A Kräftige Färbung des Cytoplasma und des
Nukleus; invasiv-duktales Karzinom mit prominenter intraduktaler Komponente (10x). B Häufigkeitsverteilung der
in der analysierten Population festgestellten prozentualen Anteile gefäbter Zellen an der Gesamt-(Tumor-)
Zellzahl. In den Normalgeweben kann eine AKT-Phosphorylierung nur in wenigen Fällen nachgwiesen werden (n =
29). In den korrespondierenden Tumoren sind nur 28 Fälle phospho-AKT-negativ. Eine erfolgreiche Färbung
betrifft zumeist mehr als 80% der Tumorzellen einer Gewebestanze.
Entsprechend der negativ-Regulation durch PTEN ist in Tumoren mit Verlust der PTENExpression mit einer verstärkten Aktivierung von AKT zu rechnen. Dies konnte an dem in dieser
Arbeit untersuchten Patientenkollektiv nur bedingt bestätigt werden; von insgesamt 42 PTENnegativen Tumoren wiesen 25 (60%) eine detektierbare Phosphorylierung von AKT auf (Tab. 11).
Gleichzeitig zeigten jedoch nur 10 von 50 PTEN exprimierenden Tumoren eine fehlende
Phosphorylierung von AKT.
Stellvertretend für die Zielproteine der PKB/AKT wurden im Rahmen dieser Arbeit der
Aktivierungszustand des molecular target of rapamycin mTOR sowie die Expression des
Zellzyklus-Inhibitors p27kip1 (4.1.8) untersucht.
77
Ergebnisse
A
B
→
→
Abbildung 31: Phosphroylierung des molecular target of rapamycin mTOR kann in nahezu allen Tumoren der
Mamma nachgewiesen werden. A Auffällig ist die besonders starke Aktivität von mTOR während der Zellteilung
(Pfeil) in dem dargestellten gering differenzierten, invasiv-duktalen Mammakarzinom. Auch Zellen des
Bindegewebes sind phospho-mTOR-positiv (20x) B Homogenes Färbemuster in einem mittelgradig differenzierten,
invasiv-duktalen Mammakarzinom (G2 pT2 L1) (10x).
Bei einer cytoplasmatischen Lokalisation von phospho-mTOR konnte mittels IHC in nahezu allen
Normalgeweben und korrespondierenden Tumoren (Abb. 31) aktiviertes mTOR dargestellt
werden. Lediglich 14 der Normalgewebe (12%) sowie 11 der untersuchten Tumoren (9%) zeigten
im Schnittpräparat keine Phosphorylierung von mTOR. Es konnte daher keine statistisch
signifikante Veränderung in der Aktivität des Proteins festgestellt werden.
Der Komplex mTOR/Rictor steuert die ebenfalls die Aktivität von AKT. Hierdurch ergibt sich
eine zusätzliche Aktivierungsmöglichkeit des Proteins unabhängig von einer Regulation durch
PTEN. Dieser Befund kann eine Erklärung für den hohen Anteil von 80% (40/50) phospho-AKTpositiver Tumoren unter den PTEN-exprimierenden Tumoren sein. Eine sichere Aussage hierzu
ist nicht möglich, da der für die Immunhistochemie eingesetzte anti-phospho-mTOR-Antikörper
nicht zwischen verschiedenen mTOR-haltigen Komplexen unterscheidet.
4.1.7.2
In Karzinomen der Prostata kann eine Zunahme der Signaltransduktion über
AKT/PKB nachgewiesen werden
In den ausgewählten Geweben der Prostata wurden ebenfalls das Expressionsniveau der
Phosphatase PTEN als Regulator von AKT, der Aktivierungszustand der Protein Kinase B/AKT
selbst sowie Expression und Aktivierung des Effektorproteins mTOR in situ bestimmt.
Eine cytoplasmatische Expression der Phosphatase PTEN wurde in 50/79 (63%) Normalgeweben
sowie in 51/79 (65%) Karzinomen der Prostata nachgewiesen (Abb. 32A); somit konnte keine
statistisch signifikante Zunahme der cytoplasmatischen Expression von PTEN festgestellt werden
(p = 0.8060). Eine nukleäre Lokalisation des Proteins wurde in 25 (32%) Normalgeweben sowie in
8 Tumoren (10%) beobachtet. Die Abnahme der nukleären Expression von PTEN in den
78
Ergebnisse
untersuchten Karzinomen wurde unter Berücksichtigung der geringen Stichprobengröße als
statistisch signifikant ermittelt (p = 0.0001).
Der Verlust der PTEN-Expression ist ein möglicher Marker für Ansprechen auf eine Therapie mit
zielgerichteten Substanzen, die in die Signaltransduktion downstream von PTEN eingreifen. Der
komplette Expressionsverlust von PTEN, der eine Aktivierung nachgeschalteter Signalwege zur
Folge hat, wurde in 22/79 (28%) Karzinomen der Prostata beobachtet.
Die Expression von PTEN kann als ein Anhaltspunkt für eine Aktivierung von PKB/AKT angesehen
werden, die zusätzlich von weiteren Proteinen beeinflusst wird. Der ermittelte Zusammenhang
zwischen PTEN Expression und AKT Phosphorylierung ist in Tab. 12 dargestellt. Im Gegensatz zu
Tumoren der Mamma, die zu einem großen Teil eine Aktivierung der Protein Kinase B/AKT
zeigen, konnte in den analysierten Prostatakarzinomen eine Phosphorylierung von AKT in 23
Geweben (29%) festgestellt werden (Abb. 32B). Bei einem erfolgreichen Nachweis von phosphoAKT in nur 6 der korrespondierenden Normalgewebe (8%) war die gesteigerte Aktivierungsrate
dieses Schlüsselenzyms statistisch signifikant (p = 0.00015).
Tabelle 12: PTEN-Expression und Aktivierung von PKB/AKT
in Prostatakarzinomen
AKT/PKB
Phosphorylierung
negativ
positiv
Σ
A
PTEN Expression
negativ
positiv
16
34
6
17
22
51
Σ
50
23
73
B
Abbildung 32: Darstellung der Phosphatase PTEN und Nachweis der Phosphorylierung von AKT im
Prostatakarzinom. A Typisches Färberesultat eines PTEN IHC-Nachweises mit gemischt cytoplasmatischer und
nukleärer Färbung. Wenig bis gering differenziertes Prostatakarzinom (G2-3 pT2b pN0, Gleason-Score 4 + 3 = 7,
10x). B Charakteristisches Resultat des in situ-Nachweises der Phosphorylierung von AKT/PKB (10x).
79
Ergebnisse
Abbildung 33: Phosphorylierung von mTOR kann in
allen untersuchten Geweben der Prostata und der
entsprechenden Tumoren festgestellt werden. Hier
dargestellt ein mittelgradig differenzierter Tumor der
Prostata. G2 pT2c pN0, Gleason-Score 2 +3 = 5. Die
Färbung betrifft sowohl normale Anteile (Pfeil) als
auch Areale mit Tumorinfiltraten (stärker gefärbt).
(10x)
Zuletzt wurde der Expressions- und Aktivierungsstatus des molecular target of rapamycin mTOR
in den ausgewählten Geweben der Prostata bestimmt. Wie zuvor in Karzinomen der Mamma
zeigte der immunhistochemische Nachweis auch hier eine hohe Prävalenz; jeweils alle
Normalgewebe und ihre korrespondierenden Tumoren exprimierten das multifunktionale Protein
und stellten sich zudem als phospho-mTOR-positiv dar (Abb. 33). Somit konnte im Vergleich
zwischen Tumoren und normalen Geweben der Prostata kein statistsich signifikanter
Untersuchied in der Expression und der Aktivierung von mTOR ermittelt werden.
4.1.8 Regulatoren des Zellzyklus stellen sich in den untersuchten Tumorgeweben als stark
dereguliert exprimiert dar
Im Rahmen der hier vorgestellten Expressionsanalysen dienten das wachstumsfördernde
Cyclin D1 sowie der Tumorsuppressor p27kip1 als Indikator für die Teilungsaktivität in den
untersuchten Tumorgeweben.
Der cki (cyclin kinase inhibitor) p27Kip1 ist ein direktes target von PKB/AKT. Er lässt sich
immunistochemisch im Kern nachweisen, wo er das Voranschreiten des Zellzyklus durch
Inhibition der cyclin-abhängigen Kinase 4 (cdk4) unterbindet. Durch Interaktion mit AKT wird
p27 phosphoryliert/inaktiviert und transloziert in das Cytoplasma. In der IHC konnten durch den
verwendeten Antikörper sowohl im Mamma- als auch im Prostatakarzinom beide Formen des
p27kip1 nachgewiesen werden (Abb. 34A/C).
In den untersuchten Mammakarzinomen zeigte sich im Vergleich zu den dazugehörigen
Normalgeweben eine statistisch signifikante Zunahme der cytoplasmatischen Lokalisation von
p27kip1 (p = 2 x 10-9). Ausgehend von 13 Fällen (11%) mit einem positiven Nachweis im
Normalgewebe exprimierten 80 der korrespondierenden Tumoren (68%) p27kip1 im Cytoplasma
(Abb. 34B).
Die Expression von Cyclin D1 als Gegenspieler von p27 in der Regulation der cdk4 weist auf die
Teilungsaktivität in einem Gewebe hin. Es konnte in 69/118 (58%) der untersuchten Mamma80
Ergebnisse
Tumoren nachgewiesen werden, während nur 18 (15%) der korrespondierenden Normalgewebe
eine Färbung aufwiesen. Die gesteigerte Expression von Cyclin D1 im Tumorgewebe (p = 2 x 10-9)
und die Translokation von p27 in das Cytoplasma weisen auf eine insgesamt gesteigerte
Proliferationsrate im Tumorgewebe hin.
In der analysierten Kohorte zufällig ausgewählter Prostatatumoren und der korrespondierenden
Normalgewebe war ebenfalls eine statistisch hoch signifikante Translokation von p27kip1 in das
Cytoplasma der Tumorzellen zu beobachten (p = 3 x 10-5). Hierbei war zu beoachten, dass alle
untersuchten Tumoren zumindest eine leichte Kernfärbung in weniger als 40% der Zellen
aufwiesen. Verglichen mit den korrespondierenden Normalgeweben war jedoch sowohl die
Färbeintensität als Ausdruck der Expressionsstärke als auch der prozentuale Anteil der
gefärbten Zellen in einem Gewebe in den Tumoren der Prostata vermindert (Abb. 34D).
B
Normal (Cyt.)
Tumor (Cyt.)
Häufigkeit
Häufigkeit
A
0 20 40 60 80 100
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
→
Tumor
Normal
Tumor
Häufigkeit
D
Normal
Häufigkeit
C
Anteil gefärbter Zellen [%]
Score (Int. x Quant.)
Normal
Score (Int. x Quant.)
Tumor
Abbildung 34: Expression und veränderte Lokalisation des Zellzyklus-Inhibitors p27kip1 in Tumoren der Mamma
und der Prostata. A Cytoplasmatische Lokalisation in einem gering differenzierten, invasiv-duktalen
Mammakarzinom (G3 pT2). (10x) B Häufigkeitsverteilung der ermittelten prozentualen Anteile cytoplasmatisch
gefärbter Zellen. Bei einem positiven Nachweis sind zumeist mehr als 80% der Zellen betroffen. C In dem
beispielhaft dargestellten mittelgradig differenzierten Adenokarzinom der Prostata (G2 pT2b pN0, Gleason-Score
4 + 3 = 7) ist p27 ebenfalls im Cytoplasma detektierbar; Areale mit normalem Gewebe (Pfeil) weisen eine
nukleäre Färbung auf. D Häufigkeitsverteilung des Gesamt-Scores aus Färbeintensität und prozentualem Anteil
nukleär gefärbter Zellen an der Gesamt-Zellzahl. In allen Prostata-karzinomen ist eine zumindest leichte
Kernfärbung feststellbar. Während jedoch Normalgewebe der Prostata einen hohen Anteil stark gefärbter
Zellkerne zeigen (hoher score), nimmt in den entsprechenden Tumoren der Anteil nukleäer gefärbter Zellen
ebenso wie die Intensität der Kernfärbung ab (niedriger score).
81
Ergebnisse
Entsprechend der geänderten Lokalsition von p27 nahm in den untersuchten Karzinomen der
Prostata die Expression von Cyclin D1 signifikant zu (p = 1 x 10-10). Bei 28 Normalgeweben (35%)
mit einem positiven Nachweis von Cyclin D1 zeigten 63 Tumoren (80%) eine gesteigerte
Proliferationsrate, die sich in einer verstärkten Expression von Cyclin D1 widerspiegelt.
4.1.9 Auch Komponenten weiterer Signaltransduktions-pathways sind in den untersuchten
Tumorgeweben dereguliert exprimiert
Neben einer Vielzahl von Proteinen der direkt mit den EGF-Rezeptoren assoziierten
Signaltransduktion
wurden einige weitere untersucht, die einerseits an der Regulation der
Rezeptordichte an der Zelloberfläche beteiligt sind (cbl) oder andererseits mit der
Queraktivierung der bereits angesprochenen pathways in Verbindung gebracht werden. Zu
dieser Gruppe gehörten STAT3, (phospho-) PKC und p60src (s. 4.1.10).
Im
Rahmen
der
hier
vorgestellten
Expressionsanalysen
wurde
der
Tyrosin-
Phosphorylierungsstatus von STAT3 im fortgeschrittenen Mamma- und Prostatakarzinom
bestimmt. In beiden Entitäten konnte eine nur geringe Prävalenz festgestellt werden.
Entsprechend der Aktivierung an der Zellmembran und nachfolgender Translokation in den
Nukleus konnte der Transkriptionsfaktor in beiden Kompartimenten nachgewiesen werden.
Insgesamt waren im immunhistochemischen Nachweis nur 5 von 118 Tumoren der Mamma
gefärbt; die Färbung betraf jeweils weniger als 20% der Tumorzellen, so dass der Einfluss der ILvermittelten Signaltransduktion über STAT3 in dieser Tumorentität äußerst gering erscheint.
Auch in den Tumoren der Prostata war nur eine sehr niedrige Prävalenz phosphorylierten STAT3
zu beobachten. Waren insgesamt 17 (22%) morphologisch normal erscheinende Gewebe
phospho-STAT3-positiv, konnte eine Aktivierung des Proteins nur in 7 (9%) der entsprechenden
Tumoren nachgewiesen werden. Damit scheint die Interleukin-assoziierte Signaltransduktion im
Prostata-Karzinom in den zufällig ausgewählten Gewebeproben keine klinische Relevanz zu
besitzen.
Die Ubiquitin-Ligase cbl markiert membranständige Rezeptoren für eine Degradation in den
Lysosomen und kontrolliert auf diesem Wege die Rezeptorendichte an der Zelloberfläche sowie
die Dauer der von ihnen in das Zellinnere abgegebenen Signale. Sowohl EGFR als auch Her-2
besitzen eine Bindungsdomäne für cbl. Heterodimere aus EGFR/Her-3 sowie Her-2/Her-3
entziehen sich einer lysosomalen Degradation, da wegen der funktionsuntüchtigen KinaseDomäne des Her-3 hier die entsprechende cbl-Bindestelle nicht phosphoryliert wird.
Die Expression von cbl wurde sowohl im Mamma- als auch im Prostatakarzinom sowie den
entsprechenden Normalgeweben untersucht (Abb. 35). In beiden Tumor-Entitäten konnte im
Karzinom eine statistisch hoch signifikante Zunahme der cytoplasmatischen Expression von cbl
82
Ergebnisse
A
B
Abbildung 35: Die Ubiquitin-Ligase cbl lässt sich im immunhistochemischen Nachweis als cytoplasmatisch
lokalisiertes Protein darstellen. A Darstellung der cbl-Expression in einem gering differenzierten, invasiv-duktalen
Karzinom der Mamma; G3 pT2 R1 L1 (10x) B Ein erfolgreicher Expressionsnachweis von cbl in fortgeschrittenen
Tumoren der Prostata resultiert ebenfalls in einem cytoplasmatischen Färbemuster (10x).
A
B
Abbildung 36: Cytoplasmatische Expression der aktivierten Protein Kinase C in Mamma- und Prostata-Tumoren.
A Invasives, duktales Mammakarzinom; G3 pT2 R1 L1 (10x) B Mittelgradig differenziertes Prostatakarzinom. pT2c
pN0, Gleason-Score 3 + 3 = 6. (10x)
festgestellt werden (pMamma = 1 x 10-11; pProstata = 4 x 10-5). Insgesamt war das Protein in 68%
(80/118) der untersuchten Mamma-Karzinome sowie 67% (53/79) der Prostata-Tumoren
nachweisbar; bis auf wenige Ausnahmen betraf eine Färbung alle Zellen einer Gewebestanze.
Aktivierung der Protein Kinase C kann auf verschiedenen Wegen erfolgen. Während eine erste
Möglichkeit die Signalweiterleitung von G-Protein-gekoppelten Rezeptoren beeinhaltet,
erfordert ein weiterer Weg die Bildung von 1,2-Diaglycerol DAG sowie das Vorhandensein von
Ca2+-Ionen. Die Bildung von DAG aus PIP2 geschieht durch Phospholipase C, wodurch die Aktivität
dieses Signalweges indirekt ebenfalls von der Expression und Aktivität der Phosphatase PTEN
abhängig ist. Aktivierung von PKC hat vielfältige Auswirkungen, die unter anderem eine
Regulation des Glucose-Metabolismus, die Aktivierung des MAP-Kinase Signalweges und eine
Aktivierung von Metalloproteasen einschließen.
83
Ergebnisse
Der
immunhistochemische
Nachweis
von
phosphorylierter
PKC
resultierte
in
einem
cytoplasmatischen Färbemuster (Abb. 36). In insgesamt 14 Normalgeweben (12%) der Mamma
konnte eine schwache Färbung festgestellt werden. Von den dazu gehörenden Tumoren wiesen
55% (62/188) eine Aktivierung der PKC auf. Die zu beobachtende Färbeintensität variierte dabei
sehr stark. Insgesamt kann die Zunahme der Aktivierung der PKC in Tumoren der Mamma als
statistisch hoch signifikant bezeichnet werden (p = 3 x 10-8).
Auch in den ausgewählten Karzinomen der Prostata konnte phospho-PKC nachgewiesen werden.
In dieser Entität nahm die Prävalenz von phospho-PKC im Verlauf vom gesunden zum entarteten
Gewebe zu, jedoch war die Änderung unter Berücksichtigung der geringen Stichprobengröße
nicht ausreichend signifikant (p = 0.0027); eine Aktivierung des Enzyms konnte in 19
Normalgeweben (24%) sowie 38 Tumorgeweben (49%) dargestellt werden.
4.1.10 Einige Cytoskelett-assoziierte Proteine und Komponenten der extrazellulären Matrix
stellen sich im Tumorgewebe ebenfalls dereguliert dar
Der Expressionsstatus der Metalloproteasen MMP1 und MMP9 wurde für die Entität des
fortgeschrittenen Mammakarzinoms untersucht. Zusätzlich wurde der Expressionsstatus des
MMP-Regulators tissue inhibitor of metalloproteases-1 TIMP-1 bestimmt.
Im in situ-Nachweis konnten sowohl MMP1 (Abb. 37) als auch MMP9 (Abb. 38) im Cytoplasma
von Tumorzellen nachgewiesen werden. In beiden Fällen konnte eine signifikante Zunahme der
Expression im Tumorgewebe ermittelt werden. Während MMP1 in nur 17 Normalgeweben der
Mamma exprimiert wurde (14%), stellten sich 69 der korrespondierenden Tumoren (58%) als
MMP1-positiv dar. Mit p = 8 x 10-10 war die Expressionszunahme statistisch hoch signifikant mit
B
Tumor (Cyt.)
Häufigkeit
→
Normal (Cyt.)
Häufigkeit
A
0 20 40 60 80
Anteil gefärbter Zellen [%]
Normal
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Tumor
Abbildung 37: Expression der Metalloproteinase-1 im Mammakarzinom. A Cytoplasmatisches Färbemuster in
einem invasiv duktalen Karzinom. Besonders starke Anfärbung infiltrierender Entzündungszellen (Pfeil). (10x)
B Häufigkeitsverteilung der ermitteleten prozentualen Anteile gefärbter Zellen in einer Gewebestanze. Während
nur wenige Normalgewebe eine Anfärbung zeigen, stellen sich die meisten Tumoren als MMP-1-positiv dar. Eine
Anfärbung betrifft meist alle Zellen eines Gewebes.
84
Ergebnisse
Normal
Cytoplasma
Tumor
Cytoplasma
Häufigkeit
B
Häufigkeit
A
0 20 40 60 80
Anteil gefärbter Zellen [%]
Normal
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Tumor
Abbildung 38: Expression von MMP-9 im Mammakarzinom. A Cytoplasmatisches Färbemuster in einem invasiv
duktalen Tumor; G3 pT2 L1 (10x). B Häufigkeitsverteilung der prozentualen Anteile gefärbter Zellen in einer
Gewebestanze. Während eine Färbung im Normalgewebe nur in Einzelfällen nachgewiesen werden kann,
exprimieren 39% der korrespondieren Tumoren MMP-9 in mehr als 80% der Zellen.
B
Tumor
Cytoplasma
Häufigkeit
Normal
Cytoplasma
Häufigkeit
A
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
→
Normal
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Tumor
Abbildung 39: TIMP-1-Expression im Mammakarzinom. A Cytoplasmatische Färbung in einem invasiv duktalen
Karzinom. Besonders starke Anfärbung infiltrierender Entzündungszellen (Pfeil). (10x) B Häufigkeitsverteilung der
ermitteleten prozentualen Anteile gefärbter Zellen in einer Gewebestanze. Während nur wenige Normalgewebe
eine Anfärbung zeigen, sind die meisten Tumoren TIMP-1-positiv. Eine Anfärbung betrifft meist alle Zellen eines
Gewebes.
der Tumorentwicklung verbunden. Gleiches gilt für die Expression der Matrix-Metalloprotease 9
(p = 3 x 10-6), die ausgehend von 6 (5%) gefärbten Normalgeweben in 46 Mammakarzinomen
(39%) nachgewiesen werden konnte. Die Expression sowohl von MMP1 als auch MMP9 betraf in
den meisten Fällen mehr als 80% der Tumorzellen in einer Gewebestanze.
Das gleiche Färbemuster resultierte aus dem Nachweis von TIMP-1 (Abb. 39). Eine
cytoplasmatische Expression von TIMP-1 konnte in 21 Normalgeweben (18%) der Mamma
festgestellt werden. Die korrespondierenden Tumorgewebe zeigten in 63% (74/118) der Fälle
eine Färbung auf. Die ermittelte Zunahme der Expression von TIMP-1 in den untersuchten
Tumoren der Mamma war mit p = 2 x 10-7 statistisch hoch signifikant.
85
Ergebnisse
Der immunhistochemische Nachweis des Phosphorylierungsstatus der non-receptor TyrosinKinase c-src (p60) resultierte in einem cytoplasmatischen Färbemuster mit einer zusätzlichen
Membranfärbung (Abb. 40). Eine Phosphorylierung des Enzyms konnte jeweils in 23% der
Tumoren nachgewiesen werden (Mamma: n = 27; Prostata: n = 18); weder in den hier
untersuchten Mamma- oder Prostatageweben konnte ein signifikanter Unterschied in der
Aktivierung von p60src zwischen Normal- und korrespondierenden Tumorgeweben ermittelt
werden.
Ähnlich p60src dient β-Catenin der Aufrechterhaltung von Zell-Zell-Kontakten, in dem es das
Actin-Cytoskelett mit der cytoplasmatischen Domäne des E-Cadherin verbindet. Zusätzlich kann
es nach Aktivierung als Co-Transkriptionsfaktor fungieren und spielt so eine doppelte Rolle in
der
Tumorgenese.
Prostatakarzinom
Expression
untersucht.
und
Im
Lokalisation
von
β-Catenin
immunhistochemischen
Präparat
wurden
konnte
nur
das
für
das
Protein
entsprechend seiner Funktionen als Membran-assoziiertes und nukleäres Protein nachgewiesen
werden (Abb. 41A). Während alle morphologisch normalen und Tumorgewebe eine Lokalisation
in der Membran demonstrierten, konnte hier eine hochsignifikante Veränderung der nukleären
Expression festgestellt werden (p = 2 x 10-9). Diese nahm im Verlauf vom normalen Epithel zum
Tumorgewebe ab. Eine nukleäre Färbung wurde in 50 Normalgeweben der Prostata festgestellt
(64%), dagegen zeigten nur 15 (19%) der korrespondierenden Tumoren ein entsprechendes
Färbemuster (Abb. 41B). Eine Erklärung für diesen Befund könnte die Tatsache sein, dass
Gewebestanzen aus Arealen mit benigner Prostatahyperplasie BPH als Normalgewebe
klassifiziert
wurden. Möglicherweise spielt die Aktivierung der β-Catenin-vermittelten
Transkription eine Rolle in frühen Stadien der Entwicklung des Prostatakarzinoms.
A
B
→
Abbildung 40: Typisches Resultat eines in situ-Nachweises von phospho-p60src mit einem cytoplasmatischen
Färbemuster und zusätzlicher membranöser Komponente. A phospho-src in einem solid wachsenden, invasivduktalen Mammakarzinom. B Aktivierung von src in einem niedrig differenziertes Prostatakarzinom. G3 pT3a pN0,
Gleason-Score 4 + 4 = 8 (10x). Gewebeareale mit einem unveränderten Epithel (Pfeil) zeigen keine
Phosphorylierung von p60src.
86
Ergebnisse
Normal
Nukleus
Tumor
Nukleus
Häufigkeit
B
Häufigkeit
A
0 20
40
60
80
Anteil gefärbter Zellen [%]
Normal
0 20
40
60
Anteil gefärbter Zellen [%]
Tumor
Abbildung 41: β-Catenin nimmt in der Zelle unterschiedliche Aufgaben wahr, die sich in einer Lokalisation in der
Membran oder im Zellkern ausdrücken. A Immunhistochemisches Färberesultat in einem mittelgradig
differenzierten Adenokarzinom der Prostata. G2 pT2c pN0, Gleason-Score 3 + 3 = 6 mit Anfärbung der Membran
und des Cytoplasma. Nukleäre Färbung im korrespondierenden Normalgewebe (kleines Bild) (jeweils 10x). B
Häufigkeitsverteilung der ermittelten prozentualen Anteile nukleär gefärbter Zellen. Die Kernfärbung nimmt im
Verlauf vom Normal- zum Tumorgewebe ab.
4.1.10
Der Transkriptionsfaktor NF-κB erscheint in Tumoren der Mamma und der Prostata
nicht signifikant stärker aktiviert als im Normalgewebe
Der Transkriptionsfaktor NF-κB spielt in vielen zellulären Prozessen eine wichtige Rolle und
wurde als essentiell für die Vorgänge der epithelial-mesenchymalen Transition EMT sowie der
Metastasierung identifiziert (Huber, 2004). Seine Aktivität wurde immunhistochemisch durch
Nachweis der Phosphorylierung der p65-Untereinheit untersucht. Sie liegt im Cytoplasma im
Komplex mit einer weiteren Untereinheit des Transkriptionsfaktors (p50) sowie dem Inhibitor
IκB vor. Nach Phosphorylierung und Degradation von IκB kann NF-κB in den Nukleus
translozieren. Phosphorylierung von p65 aktiviert die Transkription spezifischer Gene
(Bäuerle, 1994).
Dem vorgestellten Aktivierungsmechanismus entsprechend konnte p65 in situ in zwei
Zellpompartimenten nachgewiesen werden; sowohl Cytoplama als auch Zellkern färbten sich an.
Die Verteilung war hierbei variabel. Es konnten sowohl Co-Lokalisationen als auch
Einzelfärbungen der jeweiligen Kompartimente festgestellt werden (Abb. 42). Da der
Transkriptionsfaktor seine Funktion nur bei einer Lokalisation im Zellkern wahrnehmen kann,
wurde bei der Auswertung der immunhistochemischen Nachweise nur die Kernfärbung
berücksichtigt.
In den morphologisch normal erscheinenden Geweben der Mamma konnte in 32 Fällen (27%)
eine nukleäre Färbung festgestellt werden. Die dazu gehörenden Tumoren färbten sich in 32%
(38/118) der Fälle an. In den Geweben der Prostata zeigte sich ein sehr ähnliches Bild. Dort
konnte phopho-p65 in insgesamt 29 Normalgeweben und 30 Tumoren nachgewiesen werden. So
konnte weder im Mamma- noch im Prostatakarzinom gegenüber den jeweiligen Normalgeweben
eine signifikante Veränderung der p65-Phosphorylierung und -Aktivierung festgestellt werden.
87
Ergebnisse
A
B
Abbildung 42: Immunhistochemischer Nachweis der p65-Untereinheit des Transkriptionsfaktors NF-κB in
Tumorgeweben. A Solid wachsendes, invasiv-duktales Mammakarzinom (10x) B Adenokarzinom der Prostata mit
geringer bis mittelgradiger Differenzierung. G2-3 pT3a pN0, Gleason-Score 4 + 4 = 8 (10x)
4.1.11 Expression der Steroid-Hormon–Rezeptoren in Geweben der Mamma und Prostata
Die Rezeptoren für die weiblichen und männlichen Geschlechtshormone fungieren nach Bindung
eines entsprechenden Liganden als Transkriptionsfaktoren. Dementsprechend stellen sie sich im
immunhistochemischen Nachweis als nukleär exprimierte Proteine dar.
Die Bestimmung des Expressionsstatus des Östrogen (ER)- und des Progesteron (PgR)-Rezeptors
ist bereits in der Routinediagnostik für das Mammakarzinom etabliert. Für die hier vorgestellten
Untersuchungen wurden die von einem Pathologen ermittelten Daten aus den entsprechenden
Befunden übernommen; Tabelle 13 fasst die nach dem Remmele-Score ermittelten
Expressionsstärken des ER zusammen. Insgesamt konnten 70% der zufällig ausgewählten
Mamma-Tumoren als ER-positiv klassifiziert werden. Nach dem gleichen scoring-System wurde
die Expression des PgR beurteilt. Danach waren insgesamt 67 Tumoren (57%) als PgR-positiv zu
bezeichnen, 44 Tumoren (37%) zeigten keine Expression des Rezeptors.
Tabelle 13: Expression des Östrogen-Rezeptors in Mamma-Tumoren
(Beurteilung nach Remmele)
RemmeleScore
Häufigkeit
0
1
2
3
4
6
8
9
12
NA
total
21
5
2
1
7
44
18
5
8
7
118
%
18
4
2
1
6
37
15
4
7
6
100
88
Ergebnisse
B
Tumor
Nukleus
Häufigkeit
Normal
Nukleus
Häufigkeit
A
0 20 40 60 80 100
0 20 40 60 80 100
Anteil gefärbter Zellen [%]
Anteil gefärbter Zellen [%]
Tumor
Häufigkeit
C
Häufigkeit
Normal
neg. schwach mäßig
Färbeintensität
neg. schwach mäßig
Färbeintensität
Abbildung 43: Expression des Androgen-Rezeptors AR in Geweben der Prostata. A Charakteristisches
Färberesultat mit einer nukleären Lokalisation des Proteins. Mittelgradig differenziertes Adenokarzinom der
Prostata. G2 pT3a pN0, Gleason-Score 3 + 3 = 6 (10x). B Häufigkeitsverteilung der ermittelten prozentualen
Anteile gefärbter Zellen in den Normal- und korrespondierenden Tumorgeweben. C Häufigkeitsverteilung der
ermittelten Färbeintensitäten in den untersuchten Geweben.
Analog zum immunhistochemischen Nachweis für ER und PgR stellte sich der Androgen-Rezeptor
(AR) im Prostatagewebe ebenfalls als nukleäres Protein dar (Abb. 43). Der Rezeptor konnte
sowohl in den Normalgeweben (n = 64, 82%) als auch in den entsprechenden Karzinomen
nachgewiesen werden (n = 68, 87%). Die Intensität der Färbung als Ausdruck der
Expressionsstärke nahm ebenso wie der prozentuale Anteil AR-exprimierender Zellen in den
Tumorgeweben zu. Insgesamt konnte die ermittelte Expressionsänderung unter Berücksichtigung
der Stichprobengröße als nicht ausreichend signifikant bewertet werden (p = 0.0012).
4.2
Bioinformatische Auswertungen
Prostatakarzinom
zur
Expression
ausgewählter
Proteine
im
Die hier vorgestellten immunhistochemischen Untersuchungen differenzieren zwischen Normalund Tumorgewebe aus der Prostata. Normales Prostatagewebe liegt in klinischen Proben selten
vor; nach Möglichkeit wurde auf Gewebeproben aus der Bläschendrüse Vesicula seminalis
zurückgegriffen, ansonsten wurde Gewebe aus Zonen mit benigner Prostatahyperplasie (BPH)
als annähernd normal angenommen. Insgesamt standen Gewebeproben von 79 Patienten zur
Verfügung, die in TMA-Blöcken zusammengefasst wurden.
Bei der Bewertung der immunhistochemischen Nachweise wurde ein einheitliches System
angewendet (s. 3.3.2). Zur statistischen Auswertung wurde für jedes zelluläre Kompartiment,
in dem ein Protein immunhistochemisch nachgewiesen werden konnte, aus den ermittelten
Einzelwerten für Intensität und Quantität zusätzlich ein Gesamtscore gebildet (Score =
Intensität x Quantität), der Werte zwischen 0 und 15 annehmen kann. Somit liegen für jedes
untersuchte Protein mehrere Werte vor, die im Folgenden als Analyten bezeichnet werden.
89
Ergebnisse
Expression und Aktivierungszustand der in Tab. 14 aufgeführten Signaltransduktions-Proteine
wurde in Bezug auf eine mögliche Rolle bei der Entstehung des HRPC untersucht:
Tabelle 14: Im Prostatakarzinom auf Expression und Aktivierungszustand
untersuchte Proteine der Signaltransduktion
EGFR/Her-1
phospho-srcp60
VEGF
FLK1/VEGFR2
phospho-AKT/PKB
PSA
phospho-p65 (NF-κB)
Her-2
c-kit/CD116
TGF-α
CyclinD1
phospho-PKCβ
phospho-STAT5
phospho-Her-2
PDGFR
PTEN
AR
mTOR
bcl-2
Her-3
FLT1/VEGFR1
phospho-ERK1/2
p27kip1
phospho-mTOR
cbl
4.2.1 Das Prostatakarzinom zeigt eine gegenüber dem Normalgewebe veränderte ProteinExpression
Bei Berücksichtigung der Probengröße ergibt sich nach SIDAK-Korrektur des p-values ein cut off
von p ≤ 0.00065 für eine statistisch signifikante Änderung des entsprechenden Analyten.
Anwendung der unter 3.4.1 aufgeführten Routine ergibt 13 Analyten als im Vergleich vom
Normal- zum Tumorgewebe signifikant verändert (ohne SIDAK-Korrektur: 27 Analyten), die in
Tabelle 15 im Einzelnen und nach Signifikanz geordnet aufgeführt sind.
Von weiteren statistischen Analysen ausgenommen wurden c-kit/CD116, phospho-Her-2
(Tyr1248), mTOR und PSA, da alle untersuchten Gewebestanzen entweder negativ (c-kit/CD116,
phospho-Her-2) oder stark positiv (mTOR, PSA) angefärbt waren. Eine graduelle Differenzierung
der Expressionsstärke war nicht möglich und unter statistischen Gesichtspunkten nicht sinnvoll.
Tabelle 15: Signifikant veränderte Analyten im Vergleich Normal (BPH) → Tumor
Cyclin D Quantität:
Cyclin D Nukleus:
β-Catenin Nukleus:
β-Catenin Nukleus Quantität:
PDGFR:
β-Catenin Nukleus Intensität:
pAKT Quantität:
pp65 Cytoplasma:
p27kip1:
cbl:
β-Catenin Membran:
Her-3 Cytoplasma:
Cyclin D1 Cytoplasma:
90
6.15 x 10-15
1.10 x 10-10
2.14 x 10-9
1.14 x 10-9
9.57 x 10-9
2.23 x 10-8
6.31 x 10-6
8.69 x 10-6
2.95 x 10-5
3.63 x 10-5
0.00019
0.00019
0.00016
Ergebnisse
Die im Tumorgewebe als gegenüber dem Ursprungsgewebe statistisch signifikant dereguliert
exprimierten Analyten eignen sich somit als Tumormarker. Während bei den meisten Analyten
zu einer Zunahme in der Expressionsstärke (Intensität) oder einer Zunahme der exprimierenden
Zellen (Quantität) zu verzeichnen war, beruhte die signifikante Änderung bei p27kip1 und βCatenin auf einer Modifikation in der zellulären Lokalisation. Beide Proteine waren in den
untersuchten Tumorgeweben weniger im Kern nachzuweisen. Während nukleäres p27kip1 eine
Inhibition des Zellzyklus bedeutet, ist die Translokation von β-Catenin in den Zellkern mit einer
gesteigerten Transkriptionsrate von Zellzyklus-assoziierten Genen verbunden. Membranassoziiertes β-Catenin ist an dem Aufbau von E-Cadherin-vermittelten Zell-Zell-Kontakten
beteiligt.
Weitere Untersuchungen schlossen neben dem GLEASON-Score auch das Tumor-Grading sowie die
TNM-Klassifikation als histopathologische Parameter ein. In bivariaten Untersuchungen
(Tab. 16) konnte keine Korrelation zwischen der Expression eines Proteins und klinischen
Merkmalen gefunden werden. Die Analyse nach SPEARMAN offenbarte einige mäßig signifikante
Korrelationen ( ⏐ρ⏐ > 0,4) zwischen potentiellen Biomarkern. Hier fielen Komponenten des
AKT/PKB-Signalweges, der Angiogenese sowie der Androgen-Rezeptor und die WachstumsfaktorRezeptoren Her-3, PDGFR und EphA2 auf.
Tabelle 16: Interaktionen zwischen potentiellen Markerproteinen im Prostatakarzinom
basierend auf SPEARMAN-Korrelationskoeffizienten ( ⏐ρ⏐ > 0.4)
EphA2
Her-3 Cytoplasma
p-AKT Cytoplasma
PDGFR
phospho-p65
- VEGF
- FLT1
- FLT1
- phospho-PKC
- VEGF
- phospho-PKC
- AR Quantität
- Her-3 Cytoplasma
- phospho-src
- AR
0.4112
0.4809
0.4266
0.4342
0.4408
0.4126
0.4035
0.4040
0.6358
0.4457
Die besondere Bedeutung einiger der als bedeutsam ermittelten Zusammenhänge und Proteine
stellt die multivariate Analytik heraus. In diese Untersuchungen wurden nicht alle Analyten
übernommen. Bei Proteinen mit mehreren möglichen zellulären Lokalisationen wurde diejenige
gewählt, die die biologische Funktion widerspiegelt.
Tab. 17
aufgelisteten
Proteine
nach
der
Somit wurden die in der folgenden
ermittelten
Lokalisation
in
den
weiteren
Untersuchungen betrachtet. Der für multivariate Untersuchungen herangezogene Analyt war
jeweils der Gesamt-Score aus Färbeintensität und dem prozentualen Anteil gefärbter Zellen in
einem Gewebe. Zusätzlich wurden histopathologische Parameter in die Untersuchungen
eingeschlossen (grading, staging, TNM-Klassifikation).
91
Ergebnisse
Tabelle 17: Zur Expressionsprofilierung des Prostatakarzinoms herangezogene Analyten
phospho-ERK1/2 Cytoplasma
phospho-p65 Nukleus
EGFR Membran
Her-3 Cytoplasma
FLT1 Cytoplasma
PDGFR Cytoplasma
Eph2A Cytoplasma
cbl Cytoplasma
p27 Nukleus
phospho-src Cytoplasma
phospho-AKT/PKB Cytoplasma
phospho-PKC Cytoplasma
Her2 (DAKO score)
AR Nukleus
KDR Cytoplasma
IGF-1R Membran
β-Catenin Nukleus
TGF-α Membran
Cyclin D1 Nukleus
4.2.2 Protein-Expressions-Profilierung der untersuchten Prostata-Karzinome
Das zweidimensionale clustering erlaubt die Gegenüberstellung der analysierten Proteine und
der gesamten Patientenpopulation (Abb. 44). Hierdurch ergibt sich in der X-Dimension eine
Gruppierung nach biologischen Eigenschaften (Protein-Expression), während in Y-Richtung die
untersuchten Patienten angeordnet sind. Die erhaltenen cluster konnten unter Verwendung des
DIANA-Algorithmus als sehr stabil identifiziert werden (divisive coefficient = 0.74).
Das hierarchische, unsupervised clustering resultierte in der Bildung von drei TumorSubgruppen. Diese ließen sich entsprechend der Expression einiger Analyten differenzieren.
Während der überwiegende Teil der untersuchten Tumoren eine starke nukleäre Expression des
Androgen-Rezeptors aufwies, zeichnete sich eine kleine Gruppe (12/78 Tumoren, 15%) durch
fehlende oder nur schwache Expression des Proteins aus (Cluster A). Diese Tumoren zeigten
zudem eine Co-Expression des EGFR und IGF-1R, jedoch ohne eine Aktivität der den beiden
Rezeptoren nachgeschalteten Signaltransduktion.
In Tumoren mit hoher AR-Expression ließen sich zwei etwa gleich große Untergruppen
definieren. In der ersten Subgruppe (Cluster B) war mit wenigen Ausnahmen keine
Phosphorylierung von AKT/PKB, PKC, c-srcp60 sowie NF-κBp65 zu beobachten. Entsprechend
zeigten diese Tumoren ein niedriges Expressionsniveau des Proliferationsmarkers Cyclin D1.
Ebenfalls fiel hier eine gegenüber den übrigen Tumoren niedrigere Expression des IGF-1R auf.
Die zweite Gruppe der AR-positiven Tumoren (Cluster C) wies neben einer verstärkten
Aktivierung der Signaltransduktion über AKT/PKB, PKC und NF-κB die Expression verschiedener
Wachstumsfaktor-Rezeptoren auf. Hierzu zählen IGF-1R und Her-3 sowie FLT-1/VEGFR1 und
PDGFR als Komponenten des angiogenetischen Systems. PDGFR war zwar in nahezu allen
Tumoren exprimiert, erscheint jedoch in Tumoren des Cluster C am stärksten. Entsprechend
korrelierte PDGFR-Expression in bivariaten Analysen mit Expression von Her-3 sowie
Phosphorylierung der Protein Kinase C. In stärkerem Maße galt dies für FLT-1/VEGFR1; nahezu
alle Tumoren des Cluster C waren FLT-1-positiv, während in Cluster A und B keine Expression
des Rezeptors nachweisbar war.
92
Ergebnisse
A
Abbildung 44: 2D-ClusterAnalyse der per TMA
untersuchten Prostatakarzinome. Es lassen sich
insgesamt 3 Expressionsprofile ausmachen, die
eine Subklassifikation des
zufällig
ausgewählten
Patientenkollektivs
ermöglichen. Hierbei stellt
Cluster A die Gruppe der
nicht
Androgen-Rezeptor
exprimierenden Tumoren
dar. Tumoren des Cluster B
weisen
bei
starker
Expression des AR keine
Aktivität der untersuchten
Proteine der Signaltransduktion auf; anders als
Tumoren des Cluster C.
Hier ist eine Aktivierung
der
Signal-transduktion
über AKT, PKC und NF-κB
feststellbar, die in einigen
Tumoren
über
Her-3
vermittelt scheint.
B
C
93
Ergebnisse
4.3
Bioinformatische Bestimmung von Protein-Expressions- und Aktivierungsprofilen in
fortgeschrittenen Mammakarzinomen anhand ausgewählter Proteine
Im Rahmen der durchgeführten Studie wurden Normal- und korrespondierende Tumorgewebe
von insgesamt 118 Patienten untersucht. Die Expression oder der Aktivierungszustand einer
Vielzahl Her-2-assoziierter Signaltransduktionsproteine wurde zunächst in bezüglich ihrer
Verwendbarkeit als Tumormarker untersucht (Tab. 18):
Tabelle 18: Bezüglich Expressionsstärke und Aktivierungszustand im Mammakarzinom
ausgewählte Proteine der Her-2-assoziierten Signaltransduktion
EGFR/Her-1
phospho-Her-3
EGF
VEGF
phospho-ERK1/2
p27
TIMP-1
ER
Her-2
Her-4
TGF-α
FLT1/VEGFR1
phospho-AKT/PKB
cbl
MMP-9
PgR
phospho-Her-2
IGF-1R
HB-EGF
FLK1/VEGFR2
phospho-PKCβ
phospho-STAT3
MMP-1
phospho-p65 (NF-κB)
Her-3
phospho-IGF-1R
Heregulin
PTEN
CyclinD1
bcl-2
phospho-c-srcp60
4.3.1 Viele Proteine sind im Mammakarzinom stärker exprimiert oder phosphoryliert als im
Normalgewebe
Für die statistischen Untersuchungen zur klinischen Relevanz (MANN-WHITNEY-Test) ergibt sich
unter Berücksichtigung der Stichprobengröße nach SIDAK ein Grenzwert von p ≤ 0.00067 für
klinisch relevante Analyten. Bei Anwendung der unter 3.4.1 aufgeführten Routine ergab sich so
eine statistisch signifikante Veränderung von 62 Analyten im Vergleich vom Normal- zum
Tumorgewebe, die in Tab. 19 im Einzelnen aufgeführt sind.
Die Änderung der Expression oder Aktivierung eines Proteins im Verlauf der Tumorerkrankung
betraf neben der Intensität (Expressionsstärke) auch die Zahl der exprimierenden Zellen in den
jeweiligen Geweben. Die Zahl der betroffenen Zellen schien hierbei eine gewichtigere Rolle zu
spielen als das Expressionsniveau (Färbeintensität), da dies sowohl in einem Tumor als auch in
der Gesamt-Population zum Teil starken Schwankungen unterworfen sein kann und die
Bestimmung der Färbeintensität zusätzlich ein weniger objektives Kriterium zur Auswertung von
Gewebeschnitten darstellt.
Die ermittelten Expressions- oder Aktivierungsniveaus zeigten ohne Ausnahme eine Zunahme
des entsprechenden Parameters. Im Falle von p27kip1 konnte bei zunehmend cytoplasmatischer
Lokalisation ähnlich wie im Prostatakarzinom von einer Translokation aus dem Zellkern in das
Cytoplasma ausgegangen werden.
94
Ergebnisse
Tabelle 19: Signifikant veränderte Analyten (Normalgewebe → Tumorgewebe)
HER-2 Totalschnitt:
6.95 x 10-16
HER-2 Stanzen:
4.50 x 10-10
pHER-2 IntensitätCytopl.:
pHER-2 QuantitätCytopl.:
pHER-2Cytoplasma:
0.00013
0.00012
0.00012
HER-3 IntensitätCytopl.:
HER-3 QuantitätCytopl.:
HER-3 Cytoplasma:
0.00019
0.00019
0.00017
HER-4 IntensitätCytopl.:
HER-4 QuantitätCytopl.:
HER-4 Cytoplasma:
1.11 x 10-15
3.73 x 10-15
7.62 x 10-15
HER-4 IntensitätNukl.:
HER-4 QuantitätNukl.:
HER-4_Nukleus:
7.33 x 10-5
0.0001
9.90 x 10-5
IGF-1R IntensitätMemb.:
IGF-1R QuantitätMemb.:
IGF-1RMembran:
0.00023
0.00025
0.00022
VEGF IntensitätCytopl.:
VEGF QuantitätCytopl.:
VEGF Cytoplasma:
1.83 x 10-11
3.94 x 10-11
3.47 x 10-11
TGF-α IntensitätCytopl.:
TGF-α QuantitätCytopl.:
TGF-α Cytoplasma:
2.51 x 10-8
3.74 x 10-8
3.54 x 10-8
TGF-α IntensitätMemb.:
TGF-α QuantitätMemb.:
TGF-αMembran:
5.64 x 10-6
7.28 x 10-6
6.61 x 10-6
PTEN IntensitätCytopl.:
PTEN QuantitätCytopl.:
PTEN Cytoplasma:
1.00 x 10-6
6.57 x 10-7
4.01 x 10-7
pAKT IntensitätCytopl.:
pAKT QuantitätCytopl.:
pAKT Cytoplasma:
4.79 x 10-5
6.82 x 10-5
6.42 x 10-6
cbl IntensitätCytopl.:
cbl QuantitätCytopl.:
cbl Cytoplasma:
6.48 x 10-11
1.34 x 10-11
1.45 x 10-11
pPKC IntensitätCytopl.:
pPKC QuantitätCytopl.:
pPKC Cytoplasma:
7.00 x 10-8
4.85 x 10-8
3.03 x 10-8
p27 IntensitätCytopl.:
p27 QuantitätCytopl.:
p27 Cytoplasma:
2.67 x 10-10
3.97 x 10-9
1.61 x 10-9
Cyclin D1 IntensitätNukl.:
Cyclin D1 QuantitätNukl.:
Cyclin D1 Nukleus:
1.75 x 10-9
2.53 x 10-9
1.60 x 10-9
FLT IntensitätCytopl.:
FLT QuantitätCytopl.:
FLT Cytoplasma:
4.30 x 10-6
4.51 x 10-6
4.26 x 10-6
KDR IntensitätCytopl.:
KDR QuantitätCytopl.:
KDR Cytoplasma:
5.99 x 10-5
0.00012
2.36 x 10-5
TIMP-1 IntensitätCytopl.:
TIMP-1 QuantitätCytopl.:
TIMP-1Cytoplasma:
1.06 x 10-8
2.13 x 10-7
2.09 x 10-7
MMP-1 IntensitätCytopl.:
MMP-1 QuantitätCytopl.:
MMP-1Cytoplasma:
8.65 x 10-10
5.54 x 10-9
7.85 x 10-10
MMP-9 IntensitätCytopl.:
MMP-9 QuantitätCytopl.:
MMP-9Cytoplasma:
1.80 x 10-6
2.96 x 10-6
2.60 x 10-6
HBEGF IntensitätCytopl.:
HBEGF QuantitätCytopl.:
HBEGFCytoplasma:
1.11 x 10-6
1.09 x 10-6
1.09 x 10-6
Die als statistisch signifikant verändert ermittelten Analyten ließen sich insgesamt 19 Proteinen
zuordnen, die verschiedene Signalwege repräsentieren (Tab. 20). Diese Signalwege konnten
somit durch die verstärkte Expression oder Phosphorylierung als im Tumorgewebe aktiviert
dargestellt werden. Hierzu zählten neben zahlreichen Wachstumsfaktor-Rezeptoren vor allem
der anti-apoptotische AKT-pathway sowie die an den Prozessen der Angiogenese und
Metastasierung beteiligten Proteine. Die Übereinstimmung mit den an den Tumoren der
Prostata ermittelten Befunden unterstreicht die klinische Relevanz der betroffenen Signalwege.
95
Ergebnisse
Tabelle 20: Im Tumorgewebe signifikant deregulierte Proteine und ihre Rolle in der
Signaltransduktion
Her-2, p-Her-2, Her-3, Her-4, IGF-1R
HB-EGF, TGF-α
cbl
PTEN, p-AKT, p-PKC
p27, Cyclin D1
VEGF, FLT, KDR
MMP-1, MMP-9, TIMP-1
Wachstumsfaktor-Rezeptor
Ligand
lysosomale Degradation
Signaltransduktion
Zellzyklus
Angiogenese
Invasion und Metastasierung
4.3.2 Bivariate Datenanalysen zur Darstellung aktiver Signaltransduktionspfade
Um weitere Aussagen über die Signifikanz der zuvor ermittelten Analyten treffen zu können,
benötigt man einen Hinweis auf die Stärke der Korrelationen der einzelnen Analyten
untereinander. Hierzu eignet sich die Berechnung des Korrelationskoeffizienten nach SPEARMAN
(3.4.2). In diese Analysen wurden ebenfalls histopathologische Parameter (TNM-Klassifikation,
grading) sowie das Alter der Patienten einbezogen.
Die Analyse nach SPEARMAN ergab eine Vielzahl signifikanter Zusammenhänge (Tab. 21). Als
zentrales Ereignis stellte sich die Translokation von p27kip1 in das Cytoplasma dar, die mit der
Expression und/oder Aktivierung einer Vielzahl von Proteinen verknüpft ist. Hierzu gehörten
neben der Expression einer Anzahl von Wachstumsfaktor-Rezeptoren (Her-3, Her-4, FLT-1, KDR)
die Aktivierung von Komponenten des AKT/PKB-pathway (PTEN, phospho-AKT/PKB, phospho-p65
NF-κB) sowie nukleäre Expression von Cyclin D1. Diese Beobachtung scheint einherzugehen mit
der Expression der Metalloproteasen MMP-1 und MMP-9 sowie deren Regulator TIMP-1. Die
proliferationsfördernde Wirkung von TIMP-1 über p27kip1 (ρ = 0.6581) wurde kürzlich ebenfalls
von Taube et al. (2006) beschrieben und mag ein Hinweis auf eine Wachstumsfaktorunabhängige Stimulation von Tumorzellen sein.
Die Expression des VEGF scheint nach den vorliegenden Daten nicht mit der seiner Rezeptoren
FLT-1 und KDR einherzugehen; das Vorhandensein dieser Rezeptoren korreliert jedoch mit der
Expression von Metalloproteasen. Ebenfalls auffällig ist die fehlende Korrelation zwischen der
Expression des IGF-1R und der Aktivierung des AKT-Signalweges, die in der Literatur als
verantwortlich für Resistenzen gegen Her-2-gerichtete Therapeutika diskutiert wird.
Expression und Phosphorylierung des molecular target of rapamycin mTOR konnte in nahezu
allen Tumoren beobachtet werden. Dieses ist zwar ein Zielmolekül von phospho-AKT/PKB, dient
in der Zelle jedoch auch als Sensor für verfügbare Nährstoffe und wird daher zusätzlich
unabhängig von den hier untersuchten pathways stimuliert.
96
Ergebnisse
Tabelle 21: SPEARMAN-Korrelationskoeffizienten ausgewählter Co-exprimierter Proteine der
Signaltransduktion ( ⏐ρ⏐ > 0.4)
PTEN - pAKT
- pp65
- p27
- Cyclin D
0.4010
0.5080
0.4866
0.4572
Her-3 - p27
0.4455
Her-4 - p27
- TIMP
- cbl
0.6946
0.5906
0.5719
KDR
- FLT-1
- TIMP
- MMP-1
- p27
0.4182
0.5698
0.5248
0.4532
- pERKNukl.
-0.4397
pT
EGFNukl.- p27Nukl.
EGFCyt. - cbl
pAKT - pp65
- pPKC
0.4534
0.4756
pp65
- p27
0.4456
VEGF - p27
- cbl
0.7032
0.5494
p27
- TIMP
- MMP-1
- Cyclin D1
0.6581
0.5842
0.4967
Her-2 - pHer-2Cyt.
0.4708
EGFR - ER
-0.4030
MUC-1 - Her-2
- Her-4
0.5287
0.4368
0.4382
0.4624
4.3.3 Protein-Expressionsprofile in zufällig ausgewählten Karzinomen der Mamma
Die Population der auf TMA-Schnitten untersuchten Mammakarzinome stellte sich in der
Expression der exemplarisch ausgewählten möglichen Biomarker als äußerst heterogen dar. Die
Cluster-Analysen ließen sich nur mit teilweise zusammengefassten Daten durchführen (siehe
3.4.3). Wegen geringer Prävalenz wurde der EGFR ohne Auswirkung auf das Ergebnis von den
folgenden Untersuchungen ausgeschlossen.
Zweidimensionale
cluster-Verfahren
erlauben
die
Darstellung
verschiedener
Protein-
Expressionsprofile (X-Achse) innerhalb der untersuchten Population (Y-Achse) (Abb. 45,
Seite 97). Die untersuchte Patienten-Kohorte konnte in drei Subgruppen unterteilt werden, die
durch unterschiedliche Expression der Protein-Expressions-Cluster A, B und C entstanden.
In Cluster A zeigten sich neben dem IGF-1 Rezeptor auch die Rezeptor-Tyrosin-Kinasen Her-3
und Her-4 sowie die VEGF-Rezeptoren KDR und FLT als miteinander korrelierend exprimiert. Als
Proteine der Signaltransduktion fanden sich hier ebenfalls die downstream dieser Rezeptoren
gelegenen PTEN, phospho-AKT und phospho-mTOR, welches zuvor als weitgehend unabhängig
von der AKT-vermittelten Signaltransduktion ermittelt wurde. Weiterhin waren in dieser Gruppe
die Metalloproteasen MMP-1 und MMP-9 sowie deren Inhibitor TIMP-1 angeordnet. Die für das
Überleben eines soliden Tumors essentiellen Funktionen der Angiogenese und Metastasierung
wurden bereits in bivariaten Datenanalysen als miteinander korrelierend identifiziert.
97
Ergebnisse
Cluster B enthielt neben dem Östrogen-Rezeptor ER die Zellzyklusmarker p27kip1 und Cyclin D1,
sowie im Kern lokalisiertes PTEN, das in diesem Fall als aktiver Co-Transkriptionsfaktor wirksam
ist. Daneben fanden sich in diesem Cluster die EGFR-Liganden TGF-α und EGF, der sich in einer
großen Anzahl von Tumoren als nukleär lokalisiert darstellte. Die Bedeutung einer
Kerntranslokation von Her-4 ist gleichsam bislang nicht vollständig geklärt (Ni, 2001).
Zuletzt bildete sich in Cluster C die Her-2-induzierte Signaltransduktion über den MAP-Kinase
Signalweg ab. Neben Her-2 waren hier aktiviertes Her-2 (pY1248) sowie nukleär lokalisiertes,
phosphoryliertes ERK1/2 als miteinander co-exprimiert/phosphoryliert dargestellt. Ebenso war
phospho-p60src als ein direkter Interaktor und Aktivator des Her-2 in diesem Cluster zu finden.
Gleiches galt für phospho-PKC, die in Zusammenhang mit der Aktivierung von Metalloproteasen
(ADAMs) zur Freisetzung aktiver Wachstumsfaktoren betrachtet wird; zudem kann ihre
Phosphorylierung ein Hinweis auf aktive Signaltransduktion über G-Protein-gekoppelte
Rezeptoren sein77, die ebenfalls in Verbindung mit der Freisetzung aktiver Wachstumsfaktoren
gebracht wird. Entsprechend korrelierte hier der Expressionsnachweis des HB-EGF mit
Phosphorylierung von PKC. Der Zusammenhang einer Phosphorylierung des Transkriptionsfaktors
NF-κB (p65) mit den übrigen Proteinen in diesem Cluster beruht vielmehr auf statistischen
Berechnungen als auf einer biologischen Interaktion.
In den untersuchten Mamma-Karzinomen korellierte einzig die Expression des VEGF mit der
seiner Rezeptoren (Angiogenese); die Expression keines der EGF-ähnlichen Wachstumsfaktoren
korrelierte mit der seines jeweiligen Rezeptors. Die Expression von EGF und TGF-α korrelierte
mit der Expression mit Her-3 und Her-4; der EGF-Rezeptor selbst wurde nur in einer zu
vernachlässigenden Zahl von Tumoren exprimiert. Ein Beleg hierfür könnte die Aktivierung der
non-receptor-Tyrosinkinase p60src sein, die in einer großen Zahl von Tumoren zusammen mit der
Expression der Her-Rezeptoren nachweisbar ist. Das Enzym ist in eine Vielzahl von Tumorassoziierten Prozessen involviert, zu denen unter anderem Metastasierung und Angiogenese
zählen. Zusätzlich verfügen EGFR und Her-2 über eine direkte p60src-Interaktionssite, wodurch
beide unabhängig von der Co-Expression entsprechender Liganden aktiviert werden können.
Die untersuchte Patienten-Population ließ sich anhand der vorgestellten Protein-Expressionscluster in drei Subgruppen I/II/III unterscheiden. Die Expression des Östrogen-Rezeptors war
ebenso wie die des Her-2-Proteins ist in allen Gruppen nachweisbar und stellt daher kein
primäres Unterscheidungsmerkmal dar.
Gruppe I zeichnete sich durch eine inaktive Signaltransduktion auf, obwohl IGF-1R, ÖstrogenRezeptor und in einigen Tumoren auf niedrigem Niveau auch Her-2 exprimiert wurden. Einige
Tumoren dieser Gruppe wiesen phosphoryliertes p60src auf, was ein Hinweis auf andere, hier
nicht untersuchte aktive Signaltransduktionswege sein könnte. Erwähnenswert ist die in dieser
Gruppe feststellbare sehr geringe Aktivierung von mTOR. Dies könnte auf eine Mangelversorgung
dieser Tumoren infolge einer verminderten Perfusion hinweisen. Tatsächlich waren auch die
98
Ergebnisse
entsprechenden Faktoren der Angiogenese in dieser Subpopulation nicht exprimiert. Dies könnte
ein Hinweis auf ein nicht funktionierendes System zur Gewährleistung der Sauerstoffversorgung
sein (hypoxia inducible factor HIF-induzierte Signaltransduktion).
Verglichen mit Tumoren der Gruppe III zeichnetenn sich Tumoren aus Cluster II durch eher
mäßige Expression von Proteinen des Clusters A aus. Diese Tumoren zeigten eine starke
Expression des Östrogen-Rezeptors (Cluster B) bei gleichzeitiger Expression von Cyclin D1 und
des cdk4/6-Inhibitors p27kip1. Auffällig in dieser Tumorgruppe war die nukleäre Lokalisation von
EGF, PTEN und Her-4, was auf eine gegenüber anderen Tumoren stark veränderte
transkriptionelle Aktivität hinweist.
Die Expression und Aktivierung des Her-2-Rezeptors konnte in einer großen Anzahl von Tumoren
dieser Gruppe beobachtet werden, ebenso wie die aktive Signaltransduktion über den MAPKinase-pathway und die übrigen dem Cluster C zugeordneten Signaltransduktionsproteine.
Zuletzt lassen sich die Tumoren der Gruppe III als Signaltransduktions-aktive Tumoren
bezeichnen; sie zeichneten sich hauptsächlich durch Expression von Proteinen der Cluster A und
C aus. Die Expression des Cluster B spielt hier keine so große Rolle wie in Gruppe II-Tumoren.
Entsprechend sind Gruppe III-Tumoren als stark proliferierend mit invasivem Charakter zu
bezeichnen. Die Her-2-assoziierte Signaltransduktion in dieser Tumorgruppe zeigte eine
Aktivierung von PKC und p60src. Entsprechend ließ sich eine starke Aktivierung und Expression
von p60src-assoziierten Proteinen nachweisen (MMPs, TIMP-1, KDR, FLT). Daneben war eine
starke Aktivierung der Her-3/Her-4-assiierten Signalwege über PTEN und AKT zu beobachten;
diese kann ebenso auf Aktivierung des in diesen Tumoren stark exprimierten IGF-1R
zurückgehen.
99
Ergebnisse
C
B
A
I
II
III
Abbildung 45: 2D-Cluster-analyse
der untersuchten Mammatumoren. Die Population lässt sich
aufgrund verschiedener ProteinExpressionsmuster A, B und C in
drei große Subgruppen I, II und III
unterteilen. Genaue Beschreibung
siehe Text.
Wegen geringer Prävalenz wurde
EGFR ohne Einfluss auf das hier
gezeigte Ergebnis von der Analyse
ausgeschlossen. Die Primärdaten
zur Expression des ER wurden wie
die übrigen Primärdaten vor der
Clusteranalyse auf einen Prozentscore skaliert (siehe 3.4.3).
100
Ergebnisse
4.4
Untersuchungen zum Her-2 ectodomain shedding
4.4.1 Her-2p185 und Her-2p95 werden durch den in der Routinediagnostik eingesetzten
Antikörper erkannt
Expression
und
Aktivierungszustand
des
Her-2-Proteins
wurden
an
fraktionierten
Proteinextrakten aus insgesamt 43 Frischgewebe-Proben untersucht, die nach der an
korrespondierenden FFPE Gewebeproben immunhistochemisch festgestellten Expression des
Her-2-Proteins selektiert wurden. Insgesamt 6 Gewebeproben wiesen eine niedrige Her-2Expression auf (HercepTest Score 0, 1+, 2+/FISH neg.), die übrigen 37 Gewebe konnten bei
einer hohen Expression des Rezeptors (HercepTest Score 3+, 2+/FISH pos.) als für eine
Herceptin™-Therapie geeignete Tumoren klassifiziert werden. Die zusätzlich eingesetzte
Herceptin™-sensitive Zelllinie SkBr3 (Santa Cruz Inc., CA, USA) diente als positiv-Kontrolle.
Für den WESTERN Blot-basierten Nachweis der Her-2-Expression wurde der polyklonale Antikörper
aus dem DAKO HercepTest verwendet, um eine möglichst hohe Vergleichbarkeit zwischen den
Resultaten aus der immunhistochemischen Färbung von FFPE Geweben sowie WESTERN Blot zu
gewährleisten. Das Epitop des eingesetzten Antikörpers liegt in der cytoplasmatisch gelegenen
Region in der Nähe des C-Terminus des Her-2-Proteins.
Der eingesetzte Antikörper aus dem DAKO HercepTest erkannte im Western Blot zwei Formen
des Her-2-Moleküls (Abb. 46). Obwohl von jeder fraktionierten Gewebeprobe jeweils gleiche
Proteinmengen (10 µg der Membran- und Cytoplasmafraktion) eingesetzt wurden, kann keine
quantitative Aussage getroffen werden, da je nach Expressionsniveau des Rezeptors die
Belichtungszeiten einer Anpassung bedurften. In immunhistochemisch schwach positiven Fällen
(HercepTest Score 1+) konnten im Western Blot bei längeren Belichtungszeiten (1-2 Minuten)
spezifisch geringe Mengen des Her-2 Rezeptors detektiert werden. Hierbei wurde in vier Proben
ausschließlich membrangebundenes Her-2p185 nachgewiesen, während in zwei Geweben
cytoplasmatisch lokalisiertes Her-2p95 dargestellt werden konnte. Immunhistochemisch stark
positive Gewebe (HercepTest Score 3+) zeigten im Western Blot schon bei kurzen
Belichtungszeiten (< 15 sek.) prominente Banden bei 185 kDa und 95 kDa. Beide Spezies des
Her-2 Rezeptors konnten sowohl in der Membran- als auch in der Cytoplasma-Fraktion
nachgewiesen werden.
Neben dem spezifischen Nachweis des Her-2 Proteins deuteten in stark Her-2 exprimierenden
Geweben zusäzliche Banden bei etwa 170 kDa sowie unterhalb 95 kDa auf eine Kreuz-Reaktion
des Antikörpers mit anderen Proteinen hin. Um welche Proteine es sich hierbei handelte,
konnte nicht geklärt werden. Wahrscheinlich handelte es sich um Fragmente des Rezeptors, die
durch alternativen Start der Translation entstehen können (Anido, 2006). Die Bedeutung dieses
Befundes für die Routinediagnostik konnte nicht abschließend geklärt werden.
101
M
C
M
C
M
C
M
C
M
C
M
SkBr3
31084/02
16033/03
31084/02
42657/02
40565/02
19837/02
Ergebnisse
C
Total
185 kDa
95 kDa
HercepTest Score (IHC)1+
2+
3+
Abbildung 46: Expression des Her-2 Rezeptors in Mammakarzinomen und der Zelllinie SkBr3. Die nach dem
Resultat der immunhistochemischen Expressionsbestimmung (DAKO HercepTest) geordneten Proben zeigten in mit
3+ beurteilten Geweben eine deutliche Expressionszunahme des Rezeptors, die sowohl Her-2p185 als auch Her-2p95
gleichermaßen betrifft. Schwach Her-2 exprimierende Gewebe (HercepTest Score 1+) wiesen nur eine Her-2Spezies auf, während stark Her-2 exprimierenden Karzinomen beide Proteinspezies nachgewiesen werden
konnten. Zusätzliche Banden im Blot stellen vermutlich Fragmente des Her-2 Proteins dar, die durch alternativen
Translationsbeginn entstehen können. (Antikörper: anti-Her-2 (DAKO HercepTest, DAKO Cytomation, Hamburg),
1:10, Belichtungszeiten: 1+ = 2 Minuten, 2+ = 30 Sekunden; 3+ / SkBr3 = 5 Sekunden. Auftragsmenge: 10 µg
Protein/Spur)
4.4.2 Her-2-Phosphorylierung (Tyr1248) ist immunhistochemisch nur in einem Teil der
untersuchten Her-2 überexprimierenden Tumoren nachzuweisen
Zur Analyse des Her-2-Aktivierungsstatus wurde die Phosphorylierung an Tyrosin 1248
untersucht. Diese Hauptphosphorylierungsstelle des Rezeptors dient den Adaptorproteinen SHC
und Grb2 des MAP-Kinase Signalweges sowie der Phospholipase C als Bindungsstelle.
Der immunhistochemische Nachweis der Phosphorylierung des Her-2-Rezeptors (Tyr1248) gelang
ausschließlich in den Fällen, die zuvor im DAKO HercepTest mit 3+ (kräftige, ringförmige
Membranfärbung, >10% Tumorzellen) bewertet wurden (Abb. 47). Eine vorhandene, mit dem
angewendeten Verfahren jedoch nicht detektierbare Aktivierung des Rezeptors in Her-2 gering
exprimierenden Karzinomen kann nicht ausgeschlossen werden.
Unter
den
Her-2
überexprimierenden
Geweben
wiesen
insgesamt
18/37
(48%)
eine
Phosphorylierung des Rezeptors auf. Der erfolgreiche Nachweis der Her-2-Phosphorylierung
resultierte in einem membranösen Färbemuster mit cytoplasmatischer Komponente; die zu
beobachtende Intensität der Färbung variierte von schwach bis stark positiv. Hierbei war in
vielen Fällen eine stärkere Färbung am Rand der Präparate zu beobachten, die graduell zum
Zentrum der Schnitte hin abnahm. Ursache hierfür ist sehr wahrscheinlich die Aktivität von
Phosphatasen, die während des Fixierungsvorganges am Rand des Präparates schneller
inaktiviert werden als im Zentrum.
Gewebe, die im immunhistochemischen Präparat eine Färbung in mindestens 5% des
Tumorareals zeigten, wurden als „phospho-Her-2 positiv“ klassifiziert. Hierbei spielte die
Lokalisation der Färbung keine Rolle, so dass die Klassifikation auch Gewebe mit ausschließlich
cytoplasmatischer Anfärbung einschloss.
102
Ergebnisse
19008/02 HercepTest
5810/03 HercepTest
41748/02 HercepTest
19008/02 pY1248 Her-2
5810/03 pY1248 Her-2
41748/02 pY1248 Her-2
6365/04 HercepTest
6365/04 pY1248 Her-2
Abbildung 47: Aktivierung/Phosphorylierung des Her-2-Rezeptors konnte mittels Immunhistochemie in insgesamt
18 von 37 (48%) stark Her-2-exprimierenden Karzinomen nachgewiesen werden. Das Färbespektrum reichte dabei
von einer schwachen Anfärbung der Gewebe bis hin zu einem starken Phosphorylierungsnachweis, der eine hohe
Aktivität der Kinasedomäne des Her-2 Rezeptors impliziert. Gewebe mit einer Anfärbung in mehr als 10% des
gesamt-Tumorareals wurden als „positiv“ eingestuft. Exemplarische Darstellung von vier der analysierten Fälle
(je 10x). Antikörper: DAKO HercepTest (obere Reihe), anti-pY1248 Her-2 1:10 (Cell Signaling Inc., untere Reihe).
4.4.3 Phosphoryliertes Her-2p185 ist ausschließlich in der Cytoplasmamembran lokalisiert
Analog zu den vorherhenden Untersuchungen wurde der zum immunhistochemischen Nachweis
der Her-2 Phosphorylierung eingesetzte Antikörper ebenfalls für Western Blot-basierte Analysen
an Gewebelysaten verwendet.
Entsprechend dem Epitop in der intrazellulären Domäne des Her-2 Proteins wurden durch den
phospho-Y1248-Her-2-spezifischen Antikörper zwei Her-2-Spezies mit einem Molekulargewicht
von 95 kDa bzw. 185 kDa erkannt (Abb. 48). Hierbei zeigte sich eine differentielle Lokalisation
beider Formen des Rezeptors. pY1248-Her-2p185 zeigte sich als ausschließlich in der Zellmembran
lokalisiert, während pY1248-Her-2p95 sowohl in der Membran als auch im Cytoplasma
nachgewiesen werden konnte (Abb. 48). Alle untersuchten Gewebelysate, in deren
korrespondierenden FFPE Geweben pY1248-Her-2 mittels Immunhistochemie nachgewiesen
werden konnte, wiesen in der Western Blot-Analyse cytoplasmatisches pY1248-Her-2p95 auf. Die
jeweils detektierten Mengen waren jedoch starken Schwankungen unterworfen.
103
Ergebnisse
5810-03 pHer-2
3353-02 pHer-2
M
C
M
C
41748-02 pHer-2
M
C
185 kDa
95 kDa
Abbildung 48: An Tyrosin 1248 phosphoryliertes Her-2p185 ist ausschließlich in der Zellmembran lokalisiert,
während Her-2p95 sowohl in Membran als auch Cytoplasma gefunden wird. Exemplarische Darstellung der
immunhistochemischen Färbung und des WESTERN Blot-Resultates von drei der insgesamt 43 untersuchten
Gewebeproben. Antikörper: anti-pY1248 Her-2 (Cell Signaling Inc.); IHC 1:10, Western Blot 1:100;
Auftragsmenge: 10 µg Protein/Spur; M Membran-, C Cytosol-Fraktion
4.4.4 Her-2p185 ist nur in einem Teil der untersuchten Gewebe nachweisbar
Während mit Ausnahme der Zelllinie SkBr3 nahezu alle auf Her-2-Phosphorylierung untersuchten
Gewebe eine Aktivierung des N-terminal trunkierten Rezeptors Her-2p95 aufwiesen, konnte
membranständiges pY1248-Her-2p185 nur in 35% (13/43) aller Proben sowie der Herceptin™sensitiven Zelllinie SkBr3 nachgewiesen werden (Abb. 49). Das mit dem WESTERN Blot ermittelte
Resultat war dabei unabhängig von der Färbeintensität im immunhistochemischen Nachweis der
Her-2-Phosphorylierung.
Die Betrachtung aller Gewebe verdeutlichte eine graduelle Abnahme der festgestellten
Phosphorylierung des Her-2p95 bei gleichzeitiger Zunahme der Aktivierung des Her-2p185 auf
(Abb. 49). Auf der Grundlage dieser Beobachtung konnten Her-2-positive Tumoren nach ihrem
Phosphorylierungsstatus in pY1248-Her-2p95 -, pY1248-Her-2p95/p185 - und pY1248-Her-2p185-positive
Tumoren subklassifiziert werden.
104
1
C
2
M C M
C
M
3010/99
6556/99
5810/02
3353/02
41001/02
41748/02
Ergebnisse
3
C
M
C M C M SkBr3
185 kDa
95 kDa
p-Her2p95
phospho-Her2p185
Abbildung 49: Subklassifizierung Her-2-positiver Tumoren nach ihrem Phosphorylierungsstatus. Während Tumoren
der Gruppe 1 ausschließlich pY1248-Her-2p95 zeigen, sind in Tumoren der Gruppe 2 beide Formen des Her-2Rezeptors phosphoryliert. Tumoren der Gruppe 3 exprimieren ausschließlich pY1248-Her-2p185. Zu dieser Gruppe
zählen neben der Herceptin™-sensitiven Zelllinie SkBr3 35% der hier betrachteten Gewebe. Antikörper: antipY1248 Her-2 (Cell Signaling Inc.) 1:100; Auftragsmenge: 10 µg Protein/Spur; C Cytosol, M Membran
4.4.5 Zusammenfassung der Daten zum Her-2 ectodomain shedding
Die vorgestellten Ergebnisse erlauben eine Subklassifizierung Her-2-exprimierender Tumoren
nach dem Phosphorylierungsstatus und dem Expressionsniveau der identifizierten Spezies des
Rezeptors. Die klinische Relevanz dieser Befunde bezüglich eines Ansprechens auf Her-2gerichtete Therapien konnte nicht geklärt werden, da die zufällig ausgewählten Patienten keine
entsprechende Therapie erfahren haben. Aussagen über einen prognostischen Wert der
ermittelten Daten konnten ebenfalls nicht getroffen werden, da die vorhanden klinischen Daten
häufig nur einen eng begrenzten Zeitraum dokumentierten.
Zusätzlich zu den vorgestellten Western Blot-basierten Untersuchungen wurde neben der
Expression des IGF-1-Rezeptor die Aktivierung des AKT-Signalweges sowie des MAP-Kinasepathway mittels Immunhistochemie an korrespondierenden FFPE-Gewebeschnitten bestimmt. Es
konnte keine Korrelation zwischen der Phosphorylierung des Her-2-Rezeptors und der
Aktivierung eines der untersuchten Signalwege ermittelt werden. Ebenso bestand kein
Zusammenhang zwischen der Expression oder dem Aktivierungszustand eines der analysierten
Proteine und dem Verlauf einer antitumoralen Therapie. Tabelle 22 stellt die Ergebnisse der
aufgeführten Untersuchungen sowie die jeweiligen Therapieverläufe für jede untersuchte
Gewebeprobe im Einzelnen dar.
105
Ergebnisse
Tabelle 22: Zusammenfassung der Ergebnisse zur Untersuchung
des Her-2 ectodomain shedding im Mamma-Karzinom
Patient
Hercep
Test
Her-2
pY1248
pHer2 p185
pHer2p95
pERK
pAKT
IGFR
Therapie
Response
(IHC)
(IHC)
(WB)
(WB)
(IHC)
(IHC)
(IHC)
13020/99
3+
+
M
M
-
-
++
na
na
14612/99
3+
-
-
-
-
-
+
CMF
Progress
33197/98
3+
-
-
-
-
-
++
Tam
-
-
-
++
EC
-
-
++
+
++
EC
-
-
-
++
+
CMF
3+
+
M
-
-
+
+
CMF
19527/99
3+
-
-
-
-
-
++
Tam
5114/99
3+
-
-
-
-
+
+++
Tam
stabil
> 12 Mon.
stabil
> 12 Mon.
Stabil
(unbek.
Zeitraum)
stabil
> 12 Mon.
stabil
> 12 Mon.
stabil
> 12 Mon.
stabil
> 12 Mon.
6018/99
3+
-
-
10697/99
3+
-
1858/99
3+
3010/99
3171/99
15350/99
4116/99
3+
3+
3+
-
-
-
++
+
++
+++
++
na
EC
na
na
na
na
6556/99
3+
+
M
M
++
+
++
EC
32721/98
3+
+
-
M,C
-
+
++
Tam
stabil
> 12 Mon.
stabil
> 12 Mon.
2032/99
4571/99
11021/99
925/99
17415/99
3+
3+
3+
3+
3+
+
+
+
M
M
M
M
-
+++
+++
++
+
+
++
+
-
++
+++
+++
++
+
na
na
Tam
Her (pall.)
EC
na
na
na
Progress
na
31551/98
3+
+
na
na
-
-
-
Her (pall.)
5758/99
12742/99
3+
3+
-
-
-
+
-
-
+
-
Tam
na
part.
Regress
Progress
+
na
41748/02
3+
+
-
M,C
-
++
+++
Her (adj.)
>
3353/02
3+
+
M
C
+
++
+
Her (adj.)
>
5810/03
3+
+
M
C
+
+
++
Her (adj.)
>
6365/04
3+
+
na
na
+++
+
++
Her (adj.)
>
19008/02
3+
-
-
-
-
+
+
Her (adj.)
>
40565/02
1+
na
-
C
na
na
na
na
>
na
-
C
na
na
na
Her (adj.)
>
+
na
M
-
M,C
M,C
+
+++
+
++
na
na
na
Tam
31084/02
41001/02
3098/03
2+ (FISH
pos.)
3+
1+
stabil
12 Mon.
stabil
12 Mon.
stabil
12 Mon.
stabil
12 Mon.
stabil
12 Mon.
stabil
12 Mon.
stabil
12 Mon.
na
na
(Forts.)
106
Ergebnisse
Tabelle 22: Zusammenfassung der Ergebnisse zur Untersuchung
des Her-2 ectodomain shedding im Mammakarzinom (fortges.)
Patient
16033/03
42657/02
5307/99
17281/02
12579/02
19638/01
19837/02
20895/02
15561/02
18804/01
18816/02
17937/02
Hercep
Test
Her-2
pY1248
pHer2 p185
pHer2p95
pERK
pAKT
IGFR
(IHC)
(IHC)
(WB)
(WB)
(IHC)
(IHC)
(IHC)
3+
+
-
M,C
-
-
-
-
M,C
-
+
na
na
na
na
na
na
na
na
na
na
M
M
-
na
M,C
-
na
na
na
na
na
na
na
na
na
2+ (FISH
neg.)
3+
1+
1+
1+
1+
3+
3+
3+
3+
3+
Therapie
Response
na
Her (pall.)
stabil
> 12 Mon.
++
na
na
Progress
na
na
na
na
na
na
na
na
na
na
na
na
na
na
na
na
na
na
na
na
+
+++
na
na
na
na
na
na
na
na
na
na
na
na
na
na
na
na
na
na
Abkürzungen: na nicht auswertbar/nicht angegeben, M Membran, C Cytoplasma, Her Herceptin, adj. adjuvante
Therapie, pall. palliative Therapie, Tam Tamoxifen, EC Epirubicin + Cyclophosphamid, CMF Cyclophosphamid +
Metothrexat + 5-Fluoracil
107
Ergebnisse
5. Diskussion
5.1
Allgemeine Grundlagen der vorgelegten Arbeit
In jüngster Vergangenheit haben Fortschritte im Verständnis des komplexen Prozesses der
Tumorentstehung zur Entwicklung neuartiger Therapeutika geführt. Im Gegensatz zu früheren,
systemisch wirkenden Chemotherapeutika sind diese sog. targeted drugs gegen ein einzelnes
molekulares Ziel gerichtet. Trotz der erwiesenen Wirksamkeit dieser Medikamente sind jedoch
die genauen Wirkmechanismen nach wie vor nicht vollständig aufgeklärt. Dabei stellen
Resistenzen ein besonderes Problem dar, deren Entstehung ebenfalls ungeklärt ist. Neben der
Entwicklung neuer zielgerichteter Medikamente rückt daher zunehmend die Aufklärung der
exakten Wirk- und Resistenzmechanismen in den Vordergrund. Entsprechend fordert die US food
and drug administration (FDA) für neue Therapeutika seit März 2005 eine vollständig
dokumentierte Analytik der biologischen Zusammenhänge (FDA, 2005).
Eine Aufgabe der vorliegenden Arbeit ist die Identifizierung klinisch relevanter Proteine, die
neben ihrer Eigenschaft als Tumormarker auch einen prädiktiven Wert im Hinblick auf die
Vorhersage eines möglichen Therapieerfolges bei der Krebstherapie besitzen. Dabei liegt der
besondere Schwerpunkt dieser Arbeit auf der Therapie des metastasierten Mammakarzinoms mit
den humanisierten monoclonalen Antikörpern Trastuzumab (Herceptin™) und Pertuzumab
(Omnitarg™). Weiterhin sollen gleichartige Untersuchungen an Gewebematerial aus der Prostata
die Frage der Übertragbarkeit derartiger Therapieformen auf eine andere Tumorentität
beantworten.
5.2
Limitationen der in situ-Analytik mit Phosphorylierungs-spezifischen Antikörpern
Im Sinne einer einfach durchzuführenden Diagnostik wurde für die vorgestellten Untersuchungen
die
Immunhistochemie
Signaltransduktionsaktivität
als
in
semiquantitative
einem
Gewebe
Methode
eingesetzt.
zur
Das
Untersuchung
Verfahren
ist
in
der
der
Routinediagnostik fest verankert und gilt neben der PCR-Analytik als Standard zur Detektion von
Expressionsveränderungen. Hierbei werden Veränderungen auf Protein-Ebene erfasst, was für
eine gerichtete Therapie von entscheidender Bedeutung ist.
Der Nutzen der hier zum Teil verwendeten phosphorylierungs-spezifischen Antikörper wird
zurzeit diskutiert (Mandell, 2003). Die Untersuchung phosphorylierter Proteine in situ birgt
einige Risiken, die nur mäßig kalkulierbar sind. So wird der Phosphorylierung in vivo durch
109
Diskussion
Phosphatasen entgegengewirkt, die im Zeitraum zwischen Gewebeentnahme und Fixierung
ungehindert arbeiten können. Noch während das Fixans in das Gewebe diffundiert, sind
Phosphatasen aktiv. So sind mit Phosphorylierungs-spezifischen Antikörpern nicht selten
inhomogene Färbeergebnisse zu beobachten, die am äußeren Rand der Gewebeschnitte eine
stärkere Färbung aufweisen als in der Mitte. Eine mögliche Lösung für das Problem wäre der
Zusatz entsprechender Phosphatase-Inhibitoren zur Fixierungslösung, was jedoch in der
täglichen Routine noch nicht durchgeführt wird.
Zusätzlich ist davon auszugehen, dass zum Zeitpunkt der Probengewinnung nur ein Bruchteil des
nachzuweisenden phosphorylierten Proteins tatsächlich entsprechend modifiziert ist. Dies stellt
besondere Anforderungen an die Sensitivität Phosphorylierungs-spezifischer Nachweise. In den
vorgestellten Western Blot-basierten Untersuchungen zeigt sich dies beispielsweise in einer
verlängerten Belichtungszeit im Nachweis von phosphoryliertem Her-2.
Insgesamt muß bei den vorgestellten immunhistochemischen Nachweisen davon ausgegangen
werden, dass falsch negative Färberesultate einen nicht einschätzbaren Einfluss auf das
Gesamt-Ergebnis haben.
5.3
Molekulare Portraits von Tumoren der Prostata eröffnen neue Therapiemöglichkeiten
In klinisch lokalisierten Tumorstadien ist die radikale Prostatektomie derzeit das Verfahren der
Wahl (Wedding, 2006). Im Rahmen der systemisch wirkenden Heilverfahren wird ein Großteil
der Prostatatumoren durch „chemische Kastration“ in Form der Hormontherapie behandelt.
Durch den Nachweis der Her-2-Expression in einem Teil der Prostatatumoren stellt sich die
Frage nach einer möglichen Behandlung dieser Tumorentität mit Herceptin, das zur Therapie
metastasierter, Her-2 überexprimierender Mammakarzinome bereits seit einigen Jahren
zugelassen ist (Di Lorenzo, 2004). Zudem wurde Her-2-Expression in Zusammenhang mit der
Entwicklung von Resistenzen gegen die Androgen-Ablation im HRPC gebracht (Shi, 2001). Eine
aktuelle Studie belegt für Her-2-positive Prostatakarzinome einerseits einen längeren Zeitraum
bis zum biochemischen Progress hormon-sensitiver Tumoren, andererseits eine verkürzte
Überlebensdauer für Patienten mit Hormon-unabhängig wachsenden Tumoren (Edwards, 2006).
Diese Beobachtungen aus der Literatur legen die Vermutung nahe, dass auch diese Tumorentität
für eine gegen Her-2 gerichtete (adjuvante) Therapie geeignet ist.
Jüngere Genexpressionsstudien konnten zeigen, dass sich die Genexpressions-Profile von
Prostatakarzinomen im Laufe der Erkrankung sowie unter dem Einfluss der AndrogenAblationstherapie verändern (Holzbeierlein, 2004; Best, 2005). Die festgestellte Veränderung
besteht hierbei in einer logisch erscheinenden geänderten Expression Androgen-responsiver
Gene. Die Etablierung alternativer, diesem Umstand angepasster Therapieregimes ist bisher
nicht gelungen. Eine Ursache hierfür mag in der fehlenden Biomarkeranalytik auf Proteinebene
110
Diskussion
1
2
3
4
Abbildung 50: Übersicht der möglicherweise für neu zu etablierende alternative Therapieregimes in Frage
kommenden Subgruppen des Prostatakarzinoms (vgl. Abb. 44). Etwa die Hälfte aller PCa (Gruppe 1) scheint
durch ausschließliche Expression des AR als target der anti-hormonellen Therapie für keine andere targeted
therapy geeignet. Die übrigen Tumoren weisen zusätzlich Expression und/oder Aktivierung alternativer
Signalwege auf: NF-κB (Gruppe 2) oder IGF-1R, Her-3 und phospho-PKC (Gruppe 3) weisen auf mögliche
Therapiemarker hin. Nahezu ohne feststellbare Expression geeigneter Marker erscheinen Tumoren in Gruppe 4 als
mit zielgerichteten Therapien nur schwer behandelbar. Hier wäre vermutlich der Einsatz systemisch wirkender
Therapieregimes oder einer Strahlentherapie von größerem Nutzen.
liegen, die eine weitaus geeignetere Basis zur Etablierung neuer therapeutischer targets
darstellt.
Im Rahmen der hier vorgestellten Untersuchungen konnte ein neues Modell zur Subklassifikation
der Tumorentität des Prostatakarzinoms vorgestellt werden (Abb. 44), das wegen der
exemplarisch ausgewählten Zielproteine und der geringen Zahl untersuchter Gewebe keinen
Anspruch auf Vollständigkeit erhebt. Die in dieser Arbeit als möglicherweise klinisch relevant
ermittelten Proteine weisen auf eine erhebliche Rolle der nicht Androgen-vermittelten
Signaltransduktion hin. Hier könnte ein Schlüsselpunkt zur Entwicklung neuer Therapieformen
für das Prostatakarzinom liegen, da Resistenzen gegen derzeitig angewandte Regimes in den
Protokollen selbst liegen können. So zeigte Marques (2005), dass Mutationen des AR zu einer
Fehl-Aktivierung des Rezeptors durch das Antiandrogen Flutamid führen können.
Die
vorliegenden
Ergebnisse
unterstreichen
die
Bedeutung
des
AR-vermittelten
Tumorwachstums durch die hohe Prävalenz des Rezeptors. Mit 43% (34/79) zeigte nahezu die
Hälfte aller untersuchten Tumoren bei hoher Expression des AR keine nennenswerte Expression
anderer Rezeptoren oder Signaltransduktionsproteine. In einer parallel zu dieser Arbeit
durchgeführten Studie konnte gezeigt werden, dass in späteren, hormon-unabhängig
erscheinenden Stadien der Erkrankung die Expression des AR stark zunimmt (Saur-Metz, 2006),
was als Hinweis auf eine Hypersensibilisierung der Zellen gegenüber in der Therapie
verminderte Testosteron-Spiegel gewertet werden kann. Zu einem ähnlichen Ergebnis kamen
111
Diskussion
bereits frühere Untersuchungen, die eine kompensatorische Überexpression des AR unter
langwieriger Androgen-Ablation beobachteten (Kokontis, 1994; Culig, 1999).
Verschiedene Studien belegen eine Androgen-unabhängige Aktivierung des AR durch IL-6
(Hobisch, 1998) sowie EGF (Reinikainen, 1996; Bonaccorsi, 2004) und Her-2. Letztere Erkenntnis
führte zu der Annahme, dass der Her-2 Rezeptor eine bedeutende Rolle in der Entstehung von
Prostatatumoren und der Progression zum HRPC spielt und ein gutes therapeutisches
Zielmolekül im Prostatakarzinom darstellt. Tatsächlich konnten in jüngerer Zeit einige direkte
und indirekte Interaktionen zwischen Her-2 und AR nachgewiesen werden. Liu et al. (2005)
wiesen eine Abhängigkeit der transkriptionellen Aktivität des AR von einer intakten Her-2Signaltransduktion nach, die u.a. durch den Her-2-Kinase-Inhibitor Lapatinib™ unterbunden
werden kann. Auch Wen et al. (2000) berichten von einer Aktivierung des AR durch Her-2induzierte Signalwege, die sich durch Blockierung des AKT-pathway inhibieren lässt.
Im
Gegensatz hierzu berichten Yeh et al. (1999) von einer Androgen-unabhängigen Aktivierung ARabhängiger Gene über Her-2-induzierte MAP-Kinase pathways. Dies könnte eine Erklärung für
diagnostizierbares Ansteigen des Serum-PSA-Spiegels im HRPC sein.
Zur Expressionshöhe des Her-2-Rezeptors liegen in der Literatur stark divergierende Daten vor.
An klinischem Material konnte im HRPC sowohl eine Expressionszunahme (Osman, 2001; Shi,
2001, Signoretti, 2000) als auch eine unveränderte Her-2-Expression (Calvo, 2003; Savinainen,
2002) belegt werden. Die Daten der vorliegenden Arbeit zeigen insgesamt eine niedrige
Prävalenz und Expressionsstärke des Her-2-Rezeptors im Prostatakarzinom; eine gegenüber den
korrespondierenden
Tumorgeweben
Normalgeweben
konnte
nicht
statistisch
nachgewiesen
signifikante
werden.
Durch
Expressionszunahme
die
Untersuchung
in
einer
Mischpopulation aus Hormon-sensitiven und –insensitiven Prostatakarzinomen sowie fehlende
klinische Daten zum Krankheitsverlauf der untersuchten Patienten und lassen die ermittelten
Befunde keine Aussage über die Rolle des Her-2 in der Entwicklung des HRPC zu.
Die hier vorgestellten Daten widersprechen nicht nicht aktuellen Theorien zur Interaktion des
Her-2 mit Androgen-abhängigen Faktoren (PSA), lassen aber die Eignung des Rezeptors als
therapeutisches target für das Prostatakarzinom in anderem Licht erscheinen. Auf der
Grundlage für das Mammakarzinom gültiger Kriterien zur immunhistochemischen Her-2
Expressionsanalytik stellt das
Prostatakarzinom nach den hier vorgestellten Daten keine
Indikation für eine Therapie mit Herceptin™ dar. Dennoch bestehen zur Zeit Bestrebungen, die
eine Zulassung zur Therapie metastasierter Prostata-Karzinome zum Ziel haben. Die CoExpression von Her-3 und Aktivierung Her-3-assoziierter Signalwege in einer Reihe von Geweben
schließt auch die Behandlung derartiger Tumoren z.B. mit Omnitarg™ oder Lapatinib™ nicht aus.
Zu einem ähnlichen Resultat gelangen Mellinghoff et al. (2004), die die Her-2/Her-3-abhängige
Signaltransduktion als klinisches target im HRPC identifizieren.
112
Diskussion
Die durch die vorliegenden Daten belegte fehlende Expression des AR in 15% (12/79) und CoExpression einer Vielzahl anderer Faktoren in 42% der untersuchten Tumoren weist auf eine
nicht ausschließlich Androgen-abhängige Tumorentstehung in der Prostata hin. Vielmehr kann in
einer großen Anzahl von Karzinomen der Prostata von einer zusätzlichen Aktivierung Hormonunabhängiger Signalwege ausgegangen werden, die als Angriffspunkt für zielgerichtete
Therapieformen dienen können. So erscheint eine Reihe bereits etablierter targeted therapies
für den Einsatz in der Behandlung des (hormon-unabhängigen) Prostatakarzinoms geeignet.
Sicherlich können die hier vorgestellten Ergebnisse nur einen ersten Hinweis auf derartige
Optionen geben; weitaus größere Studien sind erforderlich um den tatsächlichen Nutzen
möglicher neuer Therapieregimes zu belegen.
Die hohe Prävalenz des PDGFR, wenn auch auf relativ niedrigem Expressionsniveau, lässt einen
Einsatz des Tyrosinkinase-Hemmers Glivec™ (Imatinib) zur Behandlung des PCa möglich
erscheinen. Das Medikament findet als spezifischer Inhibitor der BCR-abl-Tyrosinkinase zurzeit
hauptsächlich Verwendung zur Behandlung der CML (chronische myeloide Leukämie) aber auch
bei c-kit (SCF, stem-cell factor)-exprimierenden gastro-intestinalen Stromatumoren GIST. Ein
derartiges Behandlungsschema wurde bisher in zwei klinischen Studien (Phase II) an
Prostatakarzinomen erprobt und zeigte neben einer starken Toxizität keinen positiven Effekt
hinsichtlich eines nachweisbaren Rückganges der PSA-Expression auf (Rao, 2005; Lin, 2006).
Weiterhin wäre trotz niedriger Expression weiterer Angiogenese-fördernder Faktoren (VEGF,
KDR und FLT) in den Tumorzellen eine Avastin™ (Bevacizumab)-basierte anti-angiogenetische
Therapie denkbar, da der Nachweis dieser Proteine sehr häufig in tumornahen und in im Tumor
gelegenen Blutgefäßen gelang.
Die hohe Prävalenz (37%) des aktivierten Transkriptionsfaktors NF-κB lässt eine Behandlung
derartiger Tumoren mit nicht-steroidalen Entzündungshemmern (NSAIDs) wie selektiven COX-2Inhibitoren (z.B. Celecoxib, Sulindac) sinnvoll erscheinen (Gupta, 2001). Der bekannteste
Vertreter dieser Medikamenten-Klasse ist Acetylsalicylsäure (Aspirin™), deren Wirksamkeit in
der Prophylaxe und Therapie kolorektaler Karzinome bekannt ist (Gupta, 2001; Rüschoff, 1998).
In einer Studie von Lim et al. (2003) wurde ein inhibierender Effekt von NSAIDs auf die
Expression des Androgen Rezeptors nachgewiesen.
Weitere zielgerichtete Substanzen befinden sich derzeit in der Entwicklung oder in der
Erprobung in präklinischen Studien. Von Bedeutung für das Prostatakarzinom wäre hier der
selektive mTOR-Inhibitor RAD0001/Everolimus (Novartis Oncology), der etwa in Tumoren mit
aktiviertem AKT-pathway zum Einsatz kommen könnte. mTOR stellt als drug target eine
besondere Struktur dar, da es als Regulator für eine Vielzahl von zellulären Funktionen fungiert
und oft unabhängig von der Expression von Wachstumsfaktor-Rezeptoren aktiviert ist.
Weitere therapeutische Substanzen in der Entwicklung haben IGF-1R zum Ziel, einen in vielen
Geweben exprimierten Rezeptor. Von den hier untersuchten Prostatatumoren zeigten nur
113
Diskussion
25% (20/79) keine Expression des Rezeptors, so dass hier möglicherweise eine neue
therapeutische Zielstruktur vorliegt.
5.4
Protein-Expressionsprofile von Mamma-Tumoren
zielgerichtete Therapieprotokolle
geben
Hinweise
auf
neue
In jüngerer Vergangenheit wurden hauptsächlich die Ergebnisse von Gen-Expressionsanalysen
zur Subklassifikation nahezu aller bekannten Tumorentitäten herangezogen. Entsprechende
Untersuchungen an Tumoren der Mamma ergaben fünf charakteristische Expressionssignaturen,
die eine Neuklassifikation ermöglichen (Perou, 2000; Sorlie, 2001; Oh, 2006). Danach sind
Mammakarzinome unabhängig von ihrer morphologischen Erscheinung auf molekularer Ebene in
Hormonrezeptor (ER)-positive, Her-2 + / ER -, „normal breast-like“ sowie „luminal-like A und
B“ und „basal-cell-like“-Tumoren zu kategorisieren. Diese Gensignaturen wurden hauptsächlich
bezüglich ihres prognostischen Wertes interpretiert (Oh, 2006).
Nur selten werden Expressionsprofile auf Protein-Ebene erstellt (Jacquemier, 2005; Makretsov,
2004). Noch seltener wird bei diesen Untersuchungen der Frage nach dem prädiktiven Wert der
identifizierten Marker nachgegangen; in der Regel steht die Identifizierung neuer Tumormarker
und deren prognostischer Wert im Vordergrund.
Die hier vorgestellten immunhistochemischen Untersuchungen an einem Kollektiv überwiegend
Her-2-negativer Patienten sind wegen fehlender Verlaufsdaten in ihrer prognostischen und
3
2
1
Abbildung 51: Darstellung verschiedener Subgruppen der untersuchten Mammatumoren (vgl. Abb. 45).
Expression des Her-2 Proteins sowie des Östrogen-Rezeptors lassen sich in allen Gruppen darstellen. Demnach
unterscheiden sich die jeweiligen Unterkategorien durch verschiedene Signaltransduktions-Aktivitäts-Muster.
Während Gruppe 3 nahezu keine aktive Signaltransduktion aufweist und damit für eine zielgerichtete
Therapieform vermutlich nicht in Frage kommt, bietet Gruppe 1 durch hohe Expression und Aktivität nahezu aller
untersuchten Proteine zahlreiche therapeutische Optionen für den Einsatz von targeted drugs. Das erhaltene
Expressionsmuster in Gruppe 2 weist auf die Einsatzmöglichkeit einer Reihe neuer Substanzen hin, die zur Zeit
noch in der Entwicklung befindlich sind (siehe Text).
114
Diskussion
prädiktiven Aussagekraft zwar limitiert, können als target-Prävalenz-Analyse jedoch erste
Hinweise auf einen möglichen klinischen Nutzen der untersuchen Proteine geben. So konnten
verschiedene pathways der Her-2-assoziierten Signaltransduktion als für das Mammakarzinom
offensichtlich klinisch relevant ermittelt und zu einer Subklassifizierung der untersuchten
Population herangezogen werden (Abb. 57).
Die 2D-Clusteranalyse offenbart wie zuvor bei der Entität des Prostatakarzinoms eine kleine
Untergruppe von Tumoren ohne festzustellende Überexpression oder -aktivierung einzelner
möglicher Markerproteine. Diese Gruppe macht 15% (18/118) der Gesamtpopulation aus. Als
einziges therapeutisches target exprimieren diese Tumoren ER; verschiedene therapeutische
Optionen in Form von Aromatase-Hemmern oder Anti-Östrogenen sind bekannt. Der
überwiegende Teil der hier untersuchten Tumoren weist eine zum Teil sehr aktive
Signaltransduktion auf. Dabei spielt bei nur etwa der Hälfte dieser Tumoren die Induktion der
Zellteilung - ausgedrückt durch eine hohe Expression von Cyclin D1 - eine Rolle. Dagegen weisen
fast 85% der untersuchten Tumoren eine Aktivierung anti-apoptotischer oder nicht Wachstumsoder Überlebens-assoziierter Signalwege auf. Dies könnte ein Hinweis auf die Tatsache sein,
dass es in Tumoren nicht zu einem vermehrten Zellwachstum, sondern vielmehr zu einer
verminderten Apoptoserate kommt.
Die in dieser Arbeit vorgestellten in situ-Analysen unterstreichen sowohl für die Entität des
Prostatakarzinoms als auch im Falle fortgeschrittener Tumoren der Mamma eindrucksvoll die
klinische Relevanz des anti-apoptotischen AKT-pathways sowie der für einen Tumor essentiellen
Funktion der Angiogenese und (Gewebs-) Invasion. Auf beides wird im Folgenden unter
Berücksichtigung neuer zielgerichteter therapeutischer Optionen näher eingegangen, bevor
abschließend die besondere Rolle der (EGF-) Rezeptor-Tyrosin-Kinasen im Mittelpunkt steht.
5.5
Der AKT-pathway steuert als Knotenpunkt multipler Signalwege eine Vielzahl
zellulärer und tumorrelevanter Funktionen und ist von besonderem Interesse bei der
Entwicklung zielgerichteter Medikamente
Zahlreiche Publikationen belegen die therapeutische Relevanz des pro-mitotischen MAP-KinaseSignalweges durch konstitutiv aktivierende Mutationen z.B. der GTPase ras (Downward, 2003;
Sepolt-Leopold, 2004). Die Entwicklung von Farnesyl-Transferase-Inhibitoren zur Inhibition von
ras oder des B-raf-Inhibitors BAY-43-9006 (Bayer) tragen dieser Erkenntnis Rechnung.
Die Ergebnisse dieser Arbeit weisen darauf hin, dass eine Aktivierung des MAP-KinaseSignalweges möglicherweise keine große Rolle in den hier betrachteten Tumoren spielt. Damit
erscheint dieser pathway zunächst nicht für eine zielgerichtete Therapie geeignet. Eine
mögliche Ursache für den hier ermittelten Befund könnte die negativ-Regulation des pathways
durch dual specificity phosphatases DUSPs sein (Theodosiou, 2002), die sich in einer parallel zu
115
Diskussion
dieser Arbeit durchgeführten Genexpressions-Profilierungsstudie als im Prostatakarzinom
dereguliert exprimiert dargestellt haben (Stoss, 2006, in Vorb.). Ebenso kann eine
Queraktivierung von ERK1/2 über andere Signalwege nicht ausgeschlossen werden (Wetzker,
2003), da diese zumeist andere Phosphorylierungsstellen als die hier untersuchten involvieren.
Nach den hier vorgestellten Daten scheint die PIP3-abhängige Signaltransduktion von besonderer
Bedeutung zu sein; hier sind vor allem anti-apoptotische Signalwege über AKT/PKB von
übergeordnetem Interesse. Eine Vielzahl von Rezeptoren aktiviert diese Signalkaskaden, denen
neben der Regulation des Überlebens („nicht sterben“) einer Zelle auch die Kontrolle über den
Stoffwechsel obliegt. Der Serin/Threonin-Kinase AKT kommt damit in einer Vielzahl von
physiologischen und mit dem Tumorwachstum assoziierten Prozessen eine zentrale Bedeutung
zu (Klein, 2005). Aktivierung des AKT-pathway scheint ebenfalls mit einer Resistenz gegen eine
Vielzahl von Therapieprotokollen einherzugehen (Knuefermann, 2003; Tokunaga, 2005). Eine
Anzahl neuer targeted drugs, die zur Zeit noch in der präklinischen Entwicklung sind oder in
frühen klinischen Studien an kleinen Patientenkollektiven erprobt werden hat daher die
Inhibierung dieser Signaltransduktionspfade zum Ziel (Nahta, 2006). Dabei spielen AKTInhibitoren,
z.B.
in
Form
des
in
klinischer
Phase
II
erprobten
Perifosin
(Keryx
Biopharmaceuticals, New York, NY, USA), nur eine untergeordnete Rolle. Als ein wertvolles
target hat sich mTOR erwiesen (Shaw, 2006), das als Vermittler zwischen Bedingungen
außerhalb der Zelle (Sensor für Nährstoffe) und dem Teilungs- bzw. Überlebensverhalten
fungiert. mTOR wird in allen somatischen Zellen physiologisch exprimiert und stellt daher eine
natürlich vorhandene Zielstruktur dar. Die mTOR-Inhibitoren CCI-779 (Wyeth, Madison, NJ,
USA), AP23573 (Ariad, Cambridge, MA, USA) und besonders RAD001 (Novartis, New York, NY,
USA) befinden sich derzeit in frühen klinischen Studien und werden in Zukunft zum Einsatz
kommen. In dieser Arbeit exprimierten nahezu alle Tumoren aktives mTOR, was einen positiven
klinischen Effekt in entsprechend selektierten Patienten erwarten lässt.
5.6
Angiogenese und Metastasierung sind essentielle Prozesse bei der Tumorerhaltung
und stellen ein Ziel für targeted therapies dar
Eine herausragende Rolle bei allen Arten von invasiven Prozessen kommt der Familie der
Metalloproteasen zu, die nicht nur bei Tumorerkrankungen eine Rolle spielen. Metalloproteasen
spielen zudem bei verschiedenen anderen Tumorrelevanten Prozessen eine wichtige Rolle
(Egeblad, 2002). So dienen sie im Rahmen der auto- oder parakrinen Stimulation epithelialer
Zellen der Freisetzung reifer Wachstumsfaktoren aus membranständigen Vorläufermolekülen
(Dong, 1999). Dieser Prozess wird ebenfalls durch einen G-Protein gekoppelten ÖstrogenRezeptor in der Zellmembran initiiert (Filardo, 2000; Hewitt, 2005; Revankar, 2005). Über den
sog. triple-membrane-passing-pathway führt Bindung des Liganden zur Freisetzung von HB-EGF
116
Diskussion
oder Heregulin. Metalloproteasen sind ebenfalls beteiligt an der Modifikation extrazellulärer
Domänen von Wachstumsfaktor-Rezeptoren.
Sowohl Angiogenese als auch Aktivierung von Metalloproteasen können unter anderem auf die
Aktivität von p60src zurück geführt werden (Yeatman, 2004), die zelluläre Form eines der ersten
identifizierten viralen Onkogene. Diese non-receptor-Tyrosinkinase, die auch mit der Regulation
des Cytoskelettes verbunden ist, zeigte sich in den in dieser Arbeit untersuchten Tumoren als
gegenüber den korrespondierenden Normalgeweben nicht signifikant aktiviert. Dies kann ein
Hinweis auf eine andere Art der Regulation der beiden Prozesse sein. So ist beispielsweise die
Induktion
der
Angiogenese
Sauerstoffversorgung
als
anzusehen.
Anpassungsreaktion
Entsprechend
eines
denkbar
Tumors
wäre
eine
auf
verminderte
Aktivierung
der
entsprechenden Gene über Stress-induzierte Signalwege (p38, SAPK, JUNK), die hier nicht
untersucht wurden.
Der Prozess der Angiogenese spielt nicht nur im Rahmen der Versorgung eines Tumors mit
Nährstoffen eine Rolle, sondern auch bei der Metastasierung und der Stimulation des
Tumorwachstums selbst. Eine nicht geringe Anzahl von Tumoren exprimieren sowohl den
vascular endothelial growth factor VEGF als auch die entsprechenden Rezeptoren FLT-1/
VEFGFR-1
und
KDR/VEGFR-2.
Entsprechend
ist
der
anti-VEGF-Antikörper
Bevacizumab
(Avastin™, Roche) zur Behandlung des fortgeschrittenen kolorektalen Karzinoms bereits
zugelassen . Eine erfolgreiche Übertragung entsprechender Therapieprotokolle auf die Entitäten
des Mamma- und Prostatakarzinoms wäre bei der hier festgestellten Prävalenz der
Zielstrukturen denkbar. Der Einsatz des derzeit in der klinischen Erprobung befindlichen MultiKinase-Inhibitors BAY-43-9006 (Bayer) in einer anti-angiogenetischen Therapie der hier
untersuchten Tumorentitäten erscheint ebenfalls möglich, da neben anderen RTK die KinaseDomäne des VEGFR ein target dieses Medikamentes darstellt.
5.6
Rezeptor-Tyrosin-Kinasen sind für die Entwicklung neuer targeted drugs von großem
Interesse
Wegen ihrer für zielgerichtete Therapeutika guten Erreichbarkeit an der Oberfläche der
Tumorzellen spielen Rezeptor-Tyrosin-Kinasen eine besondere Bedeutung bei der Entwicklung
neuer targeted drugs. Ein besonderes Augenmerk liegt dabei auf der Familie der EGFRezeptoren, die in einer großen Anzahl verschiedener Tumorentitäten als dereguliert exprimiert
nachgewiesen werden konnten. Mit der Entwicklung der humanisierten monoklonalen Her-2gerichteten Antikörper Trastuzumab und Pertuzumab (beide Genentech, San Francisco, CA,
USA) sind Medikamente mit einem großen therapeutischen Potenzial entwickelt worden. Ihnen
wird unter 5.6.1 besondere Aufmerksamkeit gewidmet.
117
Diskussion
Neben den erwähnten Rezeptoren der EGFR-Familie spielt der IGF-1-Rezeptor eine zunehmend
bedeutende Rolle in der Entwicklung neuer Therapeutika. Der Rezeptor aktiviert die gleichen
Signalkaskaden und wird zudem mit der Entwicklung von Resistenzen gegen Her-2-gerichtete
Therapieregimes in Verbindung gebracht (Pollak, 2004). Eine aktuelle Studie sieht dem
entgegen keinen Zusammenhang zwischen Expression des IGF-1R und Ausbildung einer Resistenz
gegen Herceptin™ (Kostler, 2006). Die Resistenzbildung gegen Her-2-gerichtete Therapieformen
scheint dennoch begünstigt durch eine direkte Interaktion des IGF-1R mit Mitgliedern der EGFRezeptorfamilie. Hier konnte eine Heterodimerisierung mit EGFR und Her-2 nachgewiesen
werden (Ahmad, 2004; Nahta, 2005).
Entsprechend der offensichtlichen Eignung als therapeutisches target und wegen der hohen
Prävalenz des IGF-1-Rezeptors werden zwei Substanzen zur Zeit in präklinischen Studien auf
ihre Verwendbarkeit hin untersucht (Nahta, 2006). Hierbei bedienen der monoklonale
Antikörper CP-751871 (Pfizer, New York, NY, USA) und der small molecule TyrosinkinaseInhibitor NVP-AEW541 (Novartis, Basel, Schweiz) unterschiedliche Wirkmechanismen. Ebenfalls
beschrieben wurde kürzlich ein bispezifischer anti-Her-2/IGF-1R-Antikörper, der bisher jedoch
nur in Zellkulturexperimenten erfolgreich eingesetzt wurde (Lu, 2004).
5.6.1 Zur Rolle der EGF-Rezeptor-Familie
Mammakarzinoms
für
die
zielgerichtete
Therapie
des
Die Expression der EGF-Rezeptoren, Her-1/EGFR, Her-3 und Her-4 und ihrer Liganden wurde in
vielen Studien untersucht (Suo, 2002 und 2002a; Abd El-Rehim, 2004; Wiseman, 2005) und ist
Grundlage für die Entwicklung einer Vielzahl neuer zielgerichteter Therapieformen. Eine
Außenseiterrolle kommt hierbei dem Her-4 zu, das bisher nur in wenigen Untersuchungen
berücksichtigt wurde. Eine Ursache hierfür mag die Existenz verschiedener, offensichtlich
physiologisch exprimierter Formen des Rezeptors sein (Sawyer, 1998). Zusätzlich konnte in
verschiedenen Studien gezeigt werden, dass Fragmente des aktivierten Her-4 Rezeptors in den
Nukleus translozieren (Ni, 2001; Lee, 2002). Die biologische Funktion wird auf der Ebene der
transkriptionellen Regulation vermutet. Das der Translokation von Oberflächenrezeptoren in
den Zellkern zugrunde liegende Phänomen ist bislang nicht vollständig geklärt. Verschiedene
Theorien hierzu deuten unter anderem auf einen Zusammenhang mit der proteolytischen
Abspaltung der extrazellulären Domänen dieser Rezeptoren hin (Wells, 2002).
Die hier vorgestellten Untersuchungen belegen durch eine hohe Prävalenz des Her-4-Rezeptors
im Mammakarzinom eine mögliche klinische Relevanz des Moleküls. Weitere Analysen, die
insbesondere den Aktivierungszustand mit einbeziehen, sind erforderlich um die tatsächliche
Bedeutung des Her-4 als therapeutische Zielstruktur zu ermitteln.
118
Diskussion
Her-1/EGFR, von dem ebenfalls verschiedene, zum Teil von Liganden unabhängige Formen
beschrieben sind (Jorissen, 2003), scheint nach den Daten dieser Arbeit mit einer Prävalenz von
14% in den untersuchten Karzinomen der Mamma nur selten exprimiert. Angaben in der
Literatur weisen auf eine EGFR-Expression in 20% bis 36% der Mamma-Karzinome hin (Suo, 2002;
Abd El-Rehim, 2004; Wiseman, 2005). Neben einer Aktivierung der im Rahmen dieser Arbeit
analysierten Signalwege durch EGFR konnten Yu et al. (2004) zusätzlich eine Interaktion
zwischen STAT3 und EGFR ermitteln. Eine über IL-6 und STATs vermittelte Signaltransduktion
wurde für die Entität des Prostatakarzinoms beschrieben (Hobisch, 1998). In der vorliegenden
Arbeit wurde daher der Phosphorylierungsstatus von STAT3 bestimmt; bei einer nachweisbaren
Phosphorylierung des Proteins in einer äußerst geringen Anzahl von Karzinomen (Mamma: 4%;
Prostata: 9%) erscheint eine Aktivierung dieses pathway sowohl über EGFR als auch Interleukine
in beiden Tumorentitäten nicht sehr wahrscheinlich.
Die besondere Bedeutung des EGFR für die Entstehung des NSCLC (nicht-kleinzelliges
Bronchialkarzinom) hat zur Entwicklung einiger targeted drugs geführt. Im Falle des
niedermolekularen
EGFR-Kinase-Inhibitors
fortgeschrittener Lungentumoren
Tarceva™
(Erlonitib),
der
zur
Behandlung
eingesetzt wird, konnte gezeigt werden, dass trotz einer
nachgewiesenen (Über-) Expression des Zielmoleküls nur ein kleiner Teil der behandelten
Patienten auf die Therapie anspricht. Die Ursache hierfür liegt in einer Mutation in der DNASequenz der Kinase-Domäne des Rezeptors, die zu einer höheren Bindungsaffinität sowohl von
ATP als auch dem Medikament als ATP-Struktur-Analogon führt (Paez, 2004; Sordella, 2004;
Lynch, 2004). Dem entsprechend werden in jüngeren Studien neben der Expression auf ProteinEbene ebenfalls mögliche DNA-Veränderungen mit berücksichtigt.
Dem Her-3 Rezeptor kommt wegen seiner gegenüber anderen Her-Rezeptoren inaktiven KinaseDomäne eine besondere Rolle zu; als ein target der Her-3-Kinase wurde kürzlich pyk2
identifiziert (van der Horst, 2005). Dies kann ein Hinweis auf die Quer-Aktivierung von
Cytoskelett-assoziierten pathways durch EGF-Rezeptoren sein.
Her-3-haltigen Rezeptor-Dimeren wird nach Zellkultur-basierten Experimenten das höchste
transformierende Potenzial zugeschrieben, da diese sich einer negativ-Regulation z.B. durch
Internalisierung und Degradation entziehen (Citri, 2003). Die Daten der vorliegenden Arbeit
bestätigen durch Expression des Rezeptors in einer nicht geringen Anzahl von Tumoren eine
mögliche klinische Relevanz, die sich in der Entwicklung Her-3-gerichteter Therapeutika
widerspiegelt (van der Horst, 2005).
In vivo benötigt Her-3, ebenso wie Her-4, zur vollen
Aktivierung jedoch den Liganden Heregulin, der in den hier vorgestellten Untersuchungen nicht
nachgewiesen werden konnte. Entsprechend konnte aktiviertes Her-3 nur in drei Tumoren der
Mamma gefunden werden; hier ist die nachgewiesene Aktivierung vermutlich auf Interaktion mit
liganden-unabhängigen Molekülen zurückzuführen. Diese Befunde lassen die klinische Relevanz
119
Diskussion
der Signaltransduktion über Her-3 in den untersuchten Tumorentitäten zumindest fragwürdig
erscheinen.
Analog zu Her-4 ist für Her-3 ebenfalls eine Translokation von Rezeptorfragmenten in den
Zellkern beschrieben worden. Die biologische Bedeutung dieses Befundes ist bis dato nicht
geklärt. Im Falle des Prostatakarzinoms scheint dies in Verbindung mit der Entwicklung zum
HRPC zu stehen (Koumakpayi, 2006). Übereinstimmend mit dieser Studie wurde in der
vorliegenden Arbeit in 23% der Prostatakarzinome eine nukleäre Lokalisation des Rezeptors
ermittelt, ohne einen Zusammenhang zur Entwicklung des HRPC herstellen zu können.
Die besondere Rolle des Her-2 bei der Entstehung des Mammakarzinoms ist in zahlreichen
Studien dokumentiert und hat zur Entwicklung des therapeutischen anti-Her-2 Antikörpers
Trastuzumab (Herceptin™, Genentech, San Francisco, CA, USA) geführt. Trotz einer breiten
Anwendung
und
einem
verhältnismäßig
hohen
klinischen
Nutzen
ist
der
genaue
Wirkmechanismus dieses Therapeutikums nach wie vor ungeklärt; ebenso sind die Mechanismen,
die eine Resistenz gegen eine Herceptin™-Therapie fördern bislang nicht vollständig
entschlüsselt.
5.7
Überlegungen zur Wirkweise der humanisierten
Trastuzumab (Herceptin™) und Pertuzumab (Omnitarg™)
monoklonalen
Antikörper
Die zielgerichteten Therapeutika Herceptin™ und Omnitarg™ binden an den an der Oberfläche
von
Krebszellen
exprimierten
Her-2-Rezeptor.
Einziger
Unterschied
zwischen
beiden
Medikamenten ist das jeweils erkannte Epitop. Während Herceptin™ an die extrazelluläre
Region IV des Rezeptors bindet, erkennt Omnitarg™ die ebenfalls extrazellulär gelegene
Region II (Cho, 2003; Franklin, 2004). Beide Regionen sind für intra- und inter-RezeptorInteraktion verantwortlich. Durch die unterschiedlichen Epitope wird im Falle von Herceptin™
eine inhibierende Wirkung auf den Prozess der Her-2 Homodimerisierung vermutet, Omnitarg™
hingegen soll zusätzlich die Entstehung von Her-2-Heterodimeren verhindern und daher auch bei
Patienten mit einem niedrigen Her-2 Expressionsniveau wirksam sein (Hynes, 2004).
Der Wirkmechanismus von Herceptin™ ist bislang nicht vollständig aufgeklärt; verschiedene
Modelle werden diskutiert (Hynes, 2005). Die Bindung von Herceptin™ soll im Patienten eine
Immunantwort durch Aktivierung von T-Zellen auslösen. Zusätzlich wird diskutiert, inwieweit
Herceptin™ die Degradation des Her-2-Moleküls positiv beeinflusst und somit Einfluss auf die
Rezeptordichte an der Zelloberfläche hat (Klapper, 2000). Der anti-proliferativer Effekt von
Herceptin™ beruht auf der Stabilisierung des Zellzyklus-Inhibitor p27Kip1 im Nukleus (Le, 2005);
p27-defiziente Zellen haben sich als Herceptin™-resistent erwiesen (Nahta, 2004). Nicht zuletzt
unterbindet das Medikament den Prozess des Her-2-shedding (Molina, 2001), was durch eine
120
Diskussion
sterische Inhibition dieses nicht vollständig aufgeklärten proteolytischen Prozesses erklärt
werden
kann.
Nach
neuesten
Erkenntnissen
scheint
das
shedding
jedoch
nur
von
untergeordneter Bedeutung, da die Entstehung der verschiedenen Her-2-Spezies auf einen
alternativen Beginn der Translation zurückgeführt werden konnte (Anido, 2006).
Aufgrund seiner hohen Ähnlichkeit zu Herceptin™ ist bei Omnitarg™ von sehr ähnlichen Wirkund Resistenzmechanismen auszugehen. Durch das leicht veränderte Epitop wird bei Omnitarg
jedoch im Gegensatz zu Herceptin™ eine Inhibierung von Her-2-Heterodimeren vermutet. Dem
entsprechend wird Omnitarg™ zur Zeit unter anderem an Patienten getestet, die keinen Nutzen
von einer vorhergehenden Herceptin™-Therapie hatten.
5.8
Die IHC-basierte Her-2-Diagnostik hat einen niedrigen positiven prädiktiven Wert
Der zurzeit zur Her-2-Diagnostik verwendete HercepTest (DAKO Cytomation, Hamburg) hat sich
im Vergleich zu einem Referenzsystem in klinischen Tests als ausreichend sensitiv erwiesen. Der
Hersteller weist auf eine fehlende Validierung des Testsystems bezüglich einer prognostischen
oder prädiktiven Aussagekraft hin. Durch korrekte Anwendung des Testalgorithmus zur
Bestimmung des Her-2-Protein-Expressionsstatus, gegebenenfalls in Verbindung mit der
Fluoreszenz-in situ-Hybridisierung zum Nachweis einer Amplifikation des 17q12 Genlocus,
können jedoch mit großer Sicherheit alle Patienten von einer Her-2-gerichteten Therapie
ausgeschlossen werden, die nicht von der Behandlung profitieren (Baselga, 2005; Nahta, 2006).
Dennoch hat mit etwa 30% nur ein Bruchteil der als Therapie-tauglich eingestuften Patienten
tatsächlich einen klinischen Nutzen von der Behandlung. Aufgrund der unterschiedlichen
Epitope des diagnostischen und des therapeutischen Antikörpers kommt es offensichtlich zur
Auswahl von Patienten, die nicht von einer gezielten Therapie mit Her-2-gerichteten
Substanzen profitieren können.
Im Rahmen der Analysen an Proteinextrakten aus gefrorenem Frischgewebe konnte in dieser
Arbeit gezeigt werden, dass der Her-2-Rezeptor in zwei membranständigen Isoformen
exprimiert wird. Das diesem Phänomen zu Grunde liegende Prinzip des shedding ist seit langem
bekannt. Mehrere Publikationen beschreiben die Existenz verschiedener Her-2-Formen. Hierbei
wird den verschiedenen Spezies eine unterschiedliche prognostische Bedeutung zugeschrieben.
Molina et al. (2002) weisen einen Zusammenhang zwischen der Expression des Her-2p95 und dem
Vorkommen von Metastasen in Lymphknoten nach. Ein im Serum nachweisbarer hoher Spiegel
der abgespaltenen extrazellulären Domäne Her-2ECD/p110 ist nach Saghatchian et al. (2004) mit
einer schlechteren gesamt-Prognose für die Patientin verbunden.
Baselga
et
al.
(2002)
beschrieben
phosphorylierungsabhängigen
Prozess
nach
und
in
vitro-Analysen
identifizierten
das
den
shedding
tissue
als
einen
inhibitor
of
121
Diskussion
metalloproteases-1 (TIMP-1) als beteiligtes Protein. Eine neuere Publikation von Liu et al.
identifiziert die Metalloprotease ADAM-10 als das für das shedding verantwortliche Enzym. Dies
erscheint logisch, da im Fall des Her-4-shedding ebenfalls ADAM-Metalloproteasen als beteiligte
Enzyme identifiziert wurden und die erkannte Aminosäurensequenz in der EGF-Rezeptor-Famile
ein hochkonserviertes Motiv darstellt (Ni, 2001; Lee, 2002; Yuan, 2003). Molina et al. (2002)
empfehlen schließlich zusätzlich zur Standard-Her-2-Diagnostik eine Analytik der möglichen am
shedding beteiligten Faktoren. Unabhängig von einer proteolytischen Spaltung des Rezeptors
diskustieren Anido et al. (2006) die Möglichkeit der Entstehung verschiedener Her-2-Fragmente
durch alternativen Beginn der Translation und sehen in diesem Mechanismus einen dem
shedding übergeordneten Faktor.
In Übereinstimmung mit bereits vorliegenden Daten zeigt diese Arbeit Unstimmigkeiten in der
Selektion zur Therapie mit Her-2-gerichteten Substanzen geeigneter Patienten auf, die auf die
Existenz
verschiedener
Spezies
des
Her-2
Proteins
zurückzuführen
sind.
Das
bisher
gebräuchliche Verfahren der Immunhistochemie ist demnach für die Diagnostik nur bedingt
geeignet, da es nicht zwischen den verschiedenen Her-2 Spezies differenzieren kann. Dennoch
kann eine Verbesserung des prädiktiven Wertes derartiger Verfahren durch Verwendung
alternativer Antikörper erreicht werden. Das entsprechende Epitop sollte in der extrazellulären
Domäne des Her-2 Proteins liegen, um einen spezifischen Nachweis des Her-2p185 zu
gewährleisten. Eine gleichermaßen einfache wie kostenintensive Bestimmung der Her-2
Expression stellt so der Gebrauch des therapeutischen Antikörpers zur in situ-Diagnostik dar. In
einer Studie von Bussolati et al. (2005) wurde biotinyliertes Herceptin™ als diagnostischer
Antikörper in der Immunhistochemie eingesetzt. Interessanterweise lag die so erreichte positive
Vorhersagekraft bei etwa 50%, was als Hinweis auf andere Faktoren gesehen werden kann, die
einen Therapieerfolg ausmachen. Im Rahmen dieser Arbeit wurde daher ebenfalls zunächst ein
alternatives Protokoll zur in situ-Detektion des Her-2p185-Proteins etabliert. Unter dem
Vorbehalt eines nicht ausgereiften Auswertungsalgorithmus konnte in einigen Fällen ein von
dem Ergebnis der derzeitigen Standard-Diagnostik abweichendes Resultat ermittelt werden.
Zusätzlich wurde ein geeignetes Protokoll für eine Immunfluoreszenz-basierte Analytik von
FFPE-Geweben etabliert. Das System ermöglicht durch Einsatz verschiedener Fluorophorgekoppelter Antikörper den gleichzeitigen Nachweis des Her-2p185 sowie der Phosphorylierung
des Rezeptors und wurde zunächst an in Her-2 überexprimierenden HEK293T-Zellen sowie
wenigen FFPE-Geweben getestet. Eine ähnliche Technik zum parallelen Expressionsnachweis der
Mitglieder
der
EGF-Rezeptor-Familie
sowie
zur
gleichzeitigen
Detektion
der
Her-2
Genamplifikation und Protein-Expression wurde vor kurzem vorgestellt (Sassen, 2006).
Eine weitere Möglichkeit zum spezifischen Nachweis der extrazellulären Domäne des Her-2
Rezeptors stellt ein weitgehend anerkanntes ELISA-System (Bayer, Leverkusen) dar, das den
Serum-Gehalt der vom Her-2-Rezeptor abgespaltenen extrazellulären Domäne ermittelt.
122
Diskussion
Verschiedene Studien belegen den Wert dieses Tests zur Überwachung des Therapieerfolges und
des weiteren Krankheitsverlaufes (Carney 2003, 2004). Die zusammengefassten Ergebnisse aus
vier Phase-II/III-Studien zeigten jedoch einen niedrigen prädiktiven Wert des Verfahrens auf
(Leyland-Jones, 2004).
Die Ergebnisse dieser Arbeit unterstreichen die mögliche Bedeutung der Phosphorylierung des
Her-2-Rezeptors. Ähnliches fanden Hudelist et al. (2003, 2005) in in situ-Analysen, die mit
einem positiven Vorhersagewert von 50% eine ähnliche Verbesserung gegenüber der StandardDiagnostik erreichten wie zuvor Bussolati et al. (2005) mit der Verwendung des biotinylierten
Trastuzumab. Die hier vorliegende Arbeit vereint zum ersten Mal beide Denkweisen, indem sie
den Phosphorylierungszustand und das Vorhandensein der extrazellulären Domäne als
prädiktiven Faktor für ein Ansprechen auf Her-2-gerichtete Therapien sieht. Mittels Western
Blot an einer sehr kleinen Population erhaltene Ergebnisse nähren diese Hypothese, indem die
Phosphorylierung des Her-2p185 in 35% der Herceptin-geeigneten Tumorgeweben nachgewiesen
werden konnte. Diese Zahl entspricht etwa der zuvor bestimmten Ansprechrate bei einer
Herceptin-Monotherapie. Zusätzlich zeigte die Herceptin-sensitive Zelllinie SkBr3 ausschließlich
Phosphorylierung des Her-2p185 und weist so auf die mögliche Bedeutung der Phosphorylierung
verschiedener Her-2-Rezeptorspezies hin.
Unvollständige oder fehlende Daten zum Krankheits- und Therapieverlauf lassen keine
endgültige Aussage über die tatsächliche klinische Relevanz der ermittelten Befunde zu. Dies
kann nur durch eine prospektiv durchgeführte Studie an einem größeren Patientenkollektiv
geschehen, in der über einen längeren Zeitraum sämtliche therapierelevanten Daten erhoben
werden und zur Auswertung zur Verfügung stehen.
Sollte sich die hier aufgestellte Hypothese in weiterführenden Studien bestätigen, ist ein neues
Verfahren zur Selektion Herceptin™- und Omnitarg™-geeigneten Patienten unabdinglich. Im
Rahmen dieser Arbeit wurde mit der Entwicklung verschiedener Testsysteme begonnen, deren
klinischer Nutzen zunächst in entsprechenden Studien verifiziert werden muss.
Neben dem bereits vorgestellten Verfahren zur in situ-Analytik des Her-2 Expressions- und
Phosphorylierungsstatus wurde mit der Entwicklung eines ELISA-basierten Systems zum
selektiven Nachweis des phospho-Her-2p185 aus Gewebelysaten begonnen. Ein ähnliches Projekt
wurde vor kurzem von Cicenas (2006) beschrieben. Vorteile des in dieser Arbeit nicht
vollständig etablierten Testsystems sind hohe Sensitivität und Spezifität, wodurch die sichere
Detektion geringer Mengen des Analyten ermöglicht wird. Als Probenmaterial dienten in ersten
Tests humane Frischgewebe sowie Lysate Her-2-überexprimierender HEK293T-Zellen.
Als limitierend eines solchen auf Frischgewebe beruhenden Assays könnte sich die heterogene
Expression des Her-2 in verschiedenen Tumorarealen herausstellen. In DCIS-Bereichen sind
Expression und Phosphorylierung des Rezeptors stärker als in invasiven Regionen; diese sind
jedoch für die Diagnostik entscheidend, da intraduktale Regionen nicht von Herceptin™ erreicht
123
Diskussion
werden (Chan, 2001). Eine Lösung dieses Problems wäre die Mikrodissektion des entsprechenden
Gewebes vor der Durchführung des Testes. Eine entsprechende Prozedur stellte als sehr
zeitaufwändig und insensitiv heraus, wodurch sie für die Routinediagnostik nicht geeignet ist.
Unter Berücksichtigung aller erwähnten Einschränkungen ist der Einsatz eines FrischgewebeImmunassays somit als eine Ergänzung zur in situ-Diagnostik zu sehen.
5.9
Hauptaufgaben der biomedizinischen und translationalen Forschung
Fortschritte im molekularen Verständnis der Entwicklung von Tumorerkrankungen haben in den
letzten Jahren zur Entwicklung neuartiger Medikamente geführt. Eine Vielzahl dieser neuen
Substanzen zur Krebstherapie wirkt nicht systemisch, sondern selektiv gegen eine (Tumor-)
Zellpopulation, die sich durch besondere molekulare Eigenschaften auszeichnet.
Die „erste Generation“ der zielgerichteten Krebsmedikamente besteht aus monoklonalen
Antikörpern, mit deren Hilfe Strukturen an der Oberfläche von Tumorzellen inhibiert werden.
Zu den bekanntesten Vertretern dieser Gruppe zählen Avastin (Bevacizumab), Erbitux
(Cetuximab)
und
Herceptin
(Trastuzumab).
Weiterentwicklungen
Antikörper-basierte
Therapieregimes werden mit Sicherheit auch in der Zukunft eine bedeutende Rolle in der
Onkologie spielen (Adams, 2005).
Zusätzlich wird eine zweite Klasse der targeted therapies in den Mittelpunkt rücken:
niedermolekulare Substanzen erlauben die spezifische Inhibition intrazellulärer Moleküle und
werden als mögliche Kombinationspräparate zu derzeitigen Therapeutika gesehen (Baselga,
2006). Neben den derzeit verbreiteten Inhibitoren von Rezeptor-Tyrosin-Kinasen sind neuere
targeted drugs gegen Signaltransduktionsmoleküle gerichtet, die an Knotenpunkten downstream
der Rezeptoren liegen und somit vielfältige eingehende Signale hemmen und ein größeres
Spektrum an zellulären Funktionen beeinflussen können. Auch bei diesen Substanzen handelt es
sich vornehmlich um Kinase-Inhibitoren.
Die besondere Herausforderung für die Diagnostik liegt in der Selektion geeigneter Patienten,
die von einer zielgerichteten Therapie profitieren können. Dazu wird neben der targetPrävalenzanalyse die Bestimmung der zum Therapieerfolg nötigen Vorraussetzungen und
Analytik der entsprechenden Kofaktoren gehören. An diesem Punkt setzt die neue Disziplin der
klinischen Proteomik an (Petricoin, 2002).
Zwei aktuelle Arbeiten aus dem Gebiet der Systembiologie analysieren die Gesamtheit der EGFRezeptor-assoziierten Signaltransduktion sowie der möglichen Interaktionspartner dieser
Rezeptorfamilie (Oda, 2005; Jones, 2005), ohne einen direkten klinischen Bezug herzustellen.
Die Hauptaufgabe der biomedizinischen Forschung liegt vor allem in einer Übertragung
derartiger
Erkenntnisse
(Janni, 2006).
124
aus
der
Grundlagenforschung
auf
klinische
Fragestellungen
Diskussion
Die vorliegende Arbeit ist an dem Schnittpunkt zwischen experimenteller und klinischer
Forschung anzusiedeln und kann als Grundlage für weitere Analysen auf diesem Gebiet
verwendet werden. Die hier vorgestellten Erkenntnisse bedürfen dazu sicherlich einer weiteren
Validierung an einem größeren Patientenkollektiv und benötigen zusätzlich gut dokumentierte
klinische Verlaufsdaten, um Aussagen über die therapeutische Relevanz der untersuchten
Marker zu erlauben. Am Ende solcher weitergehenden Untersuchungen könnte ein neuartiges
System zur Klassifikation maligner Tumoren nach ihren therapeutischen Eigenschaften stehen.
Eine entsprechende Diagnostik könnte in Zukunft Karzinome ähnlich der in der Mikrobiologie
bekannten „bunten Reihe“ kategorisieren und so dem behandelnden Arzt entscheidende
Hinweise über anzuwendende Therapien und deren Wirksamkeit geben. Diese Arbeit ist somit
ein Beitrag zur zukunftsorientierten Entwicklung in Richtung einer personalisierten Medizin und
Therapie.
125
Ergebnisse
6. Zusammenfassung / Summary
Zusammenfassung. Aktuelle Entwicklungen auf dem Gebiet der zielgerichteten Therapie zur
Behandlung maligner Erkrankungen erfordern neuartige Verfahren zur Diagnostik und Selektion
geeigneter Patienten. So ist das Ziel der vorliegenden Arbeit die Identifizierung neuer
Zielmoleküle, die die Vorhersage eines Therapieerfolges mit targeted drugs ermöglichen.
Besondere Aufmerksamkeit gilt dem humanisierten monoklonalen Antikörper Trastuzumab
(Herceptin™), der zur Therapie Her-2 überexprimierender, metastasierter Mammakarzinome
eingesetzt wird. Jüngste Erkenntnisse lassen eine Anwendung dieses Medikamentes in der
Behandlung des Hormon-unabhängigen Prostatakarzinoms möglich erscheinen. Therapiebeeinflussende Faktoren werden in der dem Rezeptor nachgeschalteten Signaltransduktion oder
Veränderungen des Rezeptors selbst vermutet.
Mittels Immunhistochemie wurden die Expressions- und Aktivierungsniveaus verschiedener
Proteine der Her-2-assoziierten Signaltransduktion ermittelt; insgesamt wurden 37 molekulare
Marker untersucht. In Formalin fixierte und in Paraffin eingebettete korrespondierende Normalund
Tumorgewebe
von
118
Mammakarzinom-Patientinnen
sowie
78
Patienten
mit
Prostatakarzinom wurden in TMAs zusammengefasst. Die in Zusammenarbeit mit erfahrenen
Pathologen ermittelten Ergebnisse dienten u.a. als Grundlage für zweidimensionales,
unsupervised hierarchisches clustering. Ergebnis dieser Analysen war für beide untersuchten
Tumorentitäten die Möglichkeit einer Subklassifizierung der untersuchten Populationen nach
molekularen Eigenschaften. Hierbei zeigten sich jeweils neue Möglichkeiten zur Anwendung
zielgerichteter Therapien, deren Effektivität Inhalt weiterführender Studien sein könnte.
Zusätzlich wurden an insgesamt 43 Frischgeweben die möglichen Folgen des sog. shedding
untersucht. Western Blot-basierte Untersuchungen zeigten hierbei die Möglichkeit der Selektion
von Patienten aufgrund falsch-positiver Befunde in der derzeit als Standard geltenden
Diagnostik. Zusätzlich konnte durch Vergleich mit einer Herceptin™-sensitiven Zelllinie ein
möglicher
Zusammenhang
eines
Therapieerfolges
mit
dem
Phosphorylierungs-/
Aktivierungszustand des Rezeptors ermittelt werden.
Fehlende klinische Daten zum Verlauf der Erkrankung und Therapie der untersuchten Patienten
lassen keine Aussagen über die tatsächliche Relevanz der ermittelten Befunde zu. Dennoch
verdeutlichen die erhaltenen Resultate eindrucksvoll die Komplexität der molekularen
Vorgänge, die zu einem Krebsgeschehen führen und damit Auswirkungen auf die Wirksamkeit
von targeted drugs haben können. Entwicklungen auf dem Gebiet der zielgerichteten Therapie
erfordern Verbesserungen auf dem Gebiet der Diagnostik, die die sichere Selektion geeigneter
127
Zusammenfassung / Summary
Patienten erlauben. Die Zukunft der personalisierten, zielgerichteten Behandlung von
Tumorerkrankungen
wird
verstärkt
von
molekularen
Markerprofilen
ähnlich
den
hier
vorgestellten Daten beeinflusst werden.
Summary. Recent advances in the molecular understanding of carcinogenesis have led to the
development of targeted cancer drugs. The main aim of this Ph.D. thesis is to identify and
evaluate novel biomarker candidate molecules for the diagnosis and selection of eligible
patients. Without neglecting other targeted drugs, the main focus lies on the humanized
monoclonal antibody Trastuzumab (Herceptin™), which has been approved for the treatment of
Her-2 overexpressing metastatic breast cancer. Recent evidence offers the possibility of using
Herceptin™ for the treatment of hormone-refractory prostate cancer. The main factors
influencing the success of such therapy are thought to originate from alterations in the Her-2
associated downstream signal transduction or in the receptor itself.
By means of immunohistochemistry, formalin-fixed and paraffin-embedded tissues of 118
Patients with primary or metastatic breast cancer and 78 patients with prostate cancer were
analysed for expression or activation status of 37 selected candidate marker proteins from the
Her-2 associated signal transduction. Tissue sections were evaluated in cooperation with
experienced pathologists. The obtained data were used for statistical analyses including
unsupervised hierarchical 2D clustering. For each patient population, the cluster analysis
revealed the possibility of sub-classification by means of molecular marker expression patterns
independent of clinical features.
In addition, 43 samples of fresh-frozen tumor tissues were analysed for alterations in the Her-2
receptor molecule itself. Western blot analysis revealed the possibility of false-positive results
in the current standard diagnostic procedure. Further analyses showed a possible link between
Her-2 phosphorylation and Herceptin therapy outcome.
Unfortunately, corresponding clinical data of the investigated patients were not available. The
presented work can therefore be classified as multi-target prevalence analysis and the results
can only give a hint on the possibilities, challenges and obstacles of targeted therapies. In the
nearby future, protein expression analyses like the herein presented work will help physicians
with their decisions and therefore lead to a more personalised therapy.
128
Ergebnisse
7. Literaturverzeichnis
Abd El-Rehim DM, Pinder SE, Paish CE, Bell JA, Rampaul RS, Blamey RW, Robertson JF,
Nicholson RI, Ellis IO, “Expression and Co-Expression of the Members of the Epidermal
Growth Factor Receptor (EGFR) Family in Invasive Breast Carcinoma” Br J Cancer 91
(2004), 1532-1542
Adams GP, Weiner LM, „Monoclonal Antibody Therapy of Cancer“ Nat Biotech 23 (2005), 11471157
Ahmad T, Farnie G, Bundred NJ, Anderson NG, “The Mitogenic Action of Insulin-Like Growth
Factor I in Normal Mammary Epithelial Cells Requires the Epidermal Growth Factor
Receptor Tyrosine Kinase” J Biol Chem 279 (2004), 1713-1719
Albanell J, Baselga J, „Unraveling Resistance to Trastuzumab (Herceptin): Insulin-Like Growth
Factor-I Receptor, A New Suspect“ J Nat Cancer Inst 93 (2001), 1830-1832
Anido J, Scaltriti M, Bech Serra JJ, Josefat BS, Todo FR, Baselga J, Arribas J, „Biosynthesis of
Tumorigenic Her-2 C-Terminal Fragments by Alternative Initiation of Translation“ EMBO
J 2006, doi 10.1038/sj.emboj.7601191
Bäuerle PA, Henkel T, „Function and Activation of NF-κB in the Immune System“ Ann Rev
Immunol 12 (1994), 141-179
Baker AH. Edwards DR, Murphy G, „Metalloproteinase Inhibitors: Biological Actions and
Therapeutic Opportunities“ J Cell Sci 115 (2002), 3719-3727
Bar-Sagi D, Hall A, „Ras and Rho GTPases: A Family Reunion“ Cell 103 (2000), 227-238
Baselga J, Carbonell X, Castaneda-Soto NJ, Clemens M, Green M, Harvey V, Morales S, Barton C,
Ghahramani P, „Phase II Study of Efficacy, Safety, and Pharmacokinetics of Trastuzumab
Monotherapy Administered on a 3-Weekly Schedule“ J Clin Oncol 23 (2005), 2162-2171
Baselga J, „Targeting Tyrosine Kinases in Cancer: The Second Wave“ Science 312 (2006), 1175178
Best CJM; Gillespie JW, Yi Y, Chandramouli GVR, Perlmutter MA, Gathright Y, Erickson HS,
Georgevich L, Tangrea MA, Duray PH, Gonzalez S, Velasco A, Linehan WM, Matusik RJ,
Price DK, Figg WD, Emmert-Buck MR, Chuaqui RF, “Molecular Alterations in Primary
Prostate Cancer after Androgen Ablation Therapy” Clin Cancer Res 11 (2005), 6823-6834
Bonaccorsi L, Muratori M, Carloni V, Marchiani S, Formigli L, Forti G, Baldi E, “The Androgen
Receptor Associates with the Epidermal Growth Factor Receptor in Androgen-Sensitive
Prostate Cancer Cells” Steroids 69 (2004), 549-552
Bradford M, “A Rapid and Sensitive Method for the Quantification of Microgram Quantities of
Protein Utilizing the Principles of Protein-Dye Binding” Anal Biochem 72 (1976), 248-254
Burgess AW, Cho HS, Eigenbrot C, Ferguson KM, Garrett TPJ, Leahy DJ, Lemmon MA, Sliwkoski
MX, Ward CW, Yokohama S, „An Open-And-Shut Case? Recent Insights into the Activation
of EGF/ErbB Receptors“ Mol Cell 12 (2003), 541-552
Bussolati G, Montemurro F, Righi L, Donadio M, Aglietta M, Sapino A, „A Modified Trastuzumab
Antibody for the Immunohistochemical Detection of Her-2 Pverexpression in Breast
Cancer“ Br J Cancer 92 (2005), 1261-1267
129
Literaturverzeichnis
Calvo BF, Levine AM, Marcos M, Collins QF, Iacocca MV, Caskey LS, Gregory CW, Lin Y, Whang
YE, Earp HS, Mohler JL, „Human Epidermal Receptor-2 Expression in Prostate Cancer“
Clin Cancer Res 9 (2003), 1087-1097
Carney WP, Neumann R, Lipton A, Leitzel K, Ali S, Price CP, „Potential Clinical Utility of Serum
Her-2/neu Oncoprotein Concentrations in Patients with Breast Cancer“ Clin Chem 49
(2003), 1579-1598
Carney WP, Neumann R, Lipton A, Leitzel K, Ali S, Price CP, „Monitoring the Circulating Levels
of the Her2/neu Oncoprotein in Breast Cancer“ Clin Breast Cancer 5 (2004), 105-116
Chan KC, Knox WF, Gandi A, Slamon DJ, Potten CS, Bundred NJ, „Blockade of Growth Factor
Receptors in Ductal Carcinoma in situ Inhibits Epithelial Proliferation“ Br J Surg 88
(2001), 412-418
Cho HS, Mason K, Ramyar KX, Stanley AM, Gabelli SB, Denney DW, Leahy DJ, „Structure of the
Extracellular Region of Her-2 Alone and in Complex With the Herceptin Fab“ Nature 421
(2003), 756-760
Cicenas J, Urban P, Küng W, Vuaroqueaux V, Labuhn M, Wight E, Eppenberger U, EppenbergerCastori S, „Phosphorylation of Tyrosine 1248-ErbB2 Measured by ChemiluminiscenceLinked Immunoassay is an Independent Predictor of Poor Prognosis in Primary Breast
Cancer Patients” Eur J Cancer 42 (2006), 636-645
Citri A, Skaria KB, Yarden Y, „The Deaf and the Dumb: The Biology of ErbB2 and ErbB3“ Exp Cell
Res 284 (2003) 54-65
Cobleigh MA, Vogel CL, Tripathy D, Robert NJ, scholl S, Fehrenbacher L, Wolter JM, Paton V,
Shak S, Lieberman G, Slamon DJ, „Multinational Study of the Efficacy and Safety of
Humanized Anti-Her-2 Monoclonal Antibody in Women Who Have Her-2-Overexpressing
Metastatic Breast Cancer That Has Progressed After Chemotherapy for Metastatic
Disease“ J Clin Oncol 17 (1999), 2639-2648
Codony-Servat J, Albanell J, Lopez-Talavera JC, Arribas J, Baselga J, „Cleavage of the Her-2
Ectodomain is a Pervanadate-activable Process That is Inhibited by the Tissue Inhibitor
of Metalloproteases-1 in Breast Cancer Cells“ Cancer Res 59 (1999), 1196-1201
Culig Z, Hoffmann J, Erdel M, Eder IE, Hobisch A, Hittmair A, Bartsch G, Utermann G,
Schneider MR, Parczyk K, Klocker H, “Switch from Antagonist to Agonist of the Androgen
Receptor Bicalutamide is Associated with Prostate Tumour Progression in a New Model
System” Br J Cancer 81 (1999), 242-251
Cully M, You H, Levine AJ, Mak TW, „Beyond PTEN Mutations: The PI3K Pathway as an Integrator
of Multiple Inputs During Tumorigenesis“ Nat Rev Cancer 6 (2006), 184-192
Di Lorenzo G, Autorino R, De Laurentiis M, Cindolo L, D’Armiento M, Bianco AR, De Placido S,
„Her-2/neu Receptor in Prostate Cancer Development and Progression to Androgen
Independence“ Tumori 90 (2004), 163-170
Dong J, Opresko LK, Dempsey PJ, Lauffenburger DA, Coffey RJ, Wiley HS, “MetalloproteaseMediated Ligand Release Regulates Autocrine Signaling Through the Epidermal Growth
Factor Receptor” Proc Natl Acad Sci USA 96 (1999), 6235-6240
Downward J, „Targeting ras Signaling Pathways in Cancer Therapy“ Nat Rev Cancer 3 (2003),
11-22
Duffy MJ, „Predictive Markers in Breast and Other Cancers: A Review“ Clinical Chemistry 51
(2005), 494-503
Edwards J, Traynor P, Munro AF, Pirret CF, Dunne B, Bartlett JMS, “The Role of Her-1 – Her-4
and EGFRvIII in Hormone-Refractory Prostate Cancer” Clin Cancer Res 12 (2006), 123-130
Egeblad M, Werb Z, „New Functions for the Matrix Metalloproteinases in Cancer Progression“
Nat Rev Cancer 2 (2002), 161-174
130
Literaturverzeichnis
Eppenberger-Castori S, Kueng W, Benz C, Caduff R, Varga Z, Bannwart F, Fink D, Dietrerich H,
Hohl M, Muller H, Paris K, Schoumacher F, Eppenberger U, „Prognostic and Predictive
Significance of ErbB-2 Breast Tumor Levels Measured by Enzyme Immunoassay“ J Clin
Oncol 19 (2001), 645-656
Falls DL, „Neuregulins: Functions, Forms, and Signaling Strategies“ Exp Cell Res 284 (2003), 1430
FDA US Department of Health and Human Services, Food and Drug Administration, “Guidance
for Industry: Pharmacogenomic Data Submissions” März 2005
Feldman BJ, Feldman D, “The Development of Androgen-Independent Prostate Cancer” Nat Rev
Cancer 1 (2001), 34-45
Filardo EJ, Quinn JA, Bland KI, Frackelton AR, “Estrogen-Induced Activation of ERK-1 and ERK-2
Requires the G Protein Coupled Receptor Homolog, GPR30, and Occurs via TransActivation of the Epidermal Growth Factor Receptor Through Release of HB-EGF” Mol
Endocrinol 14 (2000), 1649-1660
Franklin MC, Carey KD, Vajdos FF, Leahy DJ, de Vos AM, Sliwkowski MX, „Insights into ErbB
Signaling from the Straucture of the ErbB2-Pertuzumab Complex“ Cancer Cell 5 (2004),
317-328
Gensler M, Buschbeck M, Ullrich A, „Negative Regulation of Her-2 Signaling by the PEST-Type
Protein-Tyrosine Phosphatase BDP1“ J Biol Chem 279 (2004), 12110-12116
Ges. der epidemiologischen Krebsregister, Robert-Koch-Institut (Hrsg.), „Krebs in Deutschland –
Häufigkeiten und Trends“, Saarbrücken, 5. Auflage 2006
Gleason DF, “Classification of Prostatic Carcinoma” Cancer Chemother Rep 50 (1966), 125-128
Gomperts BD, Kramer IM, Tatham PER, „Signal Transduction“ Elsevier, London, 1st Edition 2004
Gupta RA, DuBois RN, “Colorectal Cancer Prevention and Treatment by Inhibition of
Cyclooxygenase-2” Nat Rev Cancer 1 (2001), 11-21
Harris RC, Chung E, Coffey RJ, „EGF Receptor ligands“ Exp Cell Res 284 (2003), 2-13
Hewitt SC, Deroo BJ, Korach KS, “A New Mediator for an Old Hormone?” Science 307 (2005),
1572-1573
Hobisch A, Eder IE, Putz T, Horninger W, Bartsch G, Klocker H, Culig Z, „Interleukin-6 Regulates
Prostate-Specific Protein Expression in Prostate Carcinoma Cells by Activation of the
Androgen Receptor“ Cancer Res 58 (1998), 4640-4645
Holbro T, Civenni G, Hynes NE, „The ErbB Receptors and Their Role in Cancer Progression“ Exp
Cell Res 284 (2003), 99-110
Holzbeierlein J, Lal P, LaTulippe E, Smith A, Satagopan J, Zhang L, Ryan C, Smith S, Scher H,
Scardino P, Reuter V, Gerald WL, “Gene Expression Analysis of Human Prostate
Carcinoma During Hormonal Therapy Identifies Androgen-Responsive Genes and
Mechanisms of Therapy Resistance” Am J Pathol 164 (2004), 217-27
Huber MA, Azoitei N, Baumann B, Grünert S, Sommer A, Pehamberger H, Kraut N, Beug H,
Wirth T, „NF-κB is Essential for Epithelial-Mesenchymal Transition and Metastasis in a
Model of Breast Cancer Progression“ J Clin Invest 114 (2004), 569-581
Hudelist G, Köstler WJ, Attems J, Czerwenka K, Müller R, Manavi M, Steger GG, Kubista E,
Zielinski CC, Singer CF, „Her-2/neu-Triggered Intracellular Tyrosine Kinase Activation: in
vivo Relevance of Ligand-Independent Activation Mechanisms and Impact Upon the
Efficacy of Trastuzumab-Based Treatment“ Br J Cancer 89 (2003), 983-991
131
Literaturverzeichnis
Hudelist G, Kostler WJ, Czerwenka K, Kubista E, Attems J, Muller R, Gschwantler-Kaulich D,
Manavi M, Huber I, Hoschutzky H, Zielinski CC, Singer CF, „Her-2/neu and EGFR Tyrosine
Kinase Activation Predict the Efficacy of Trastuzumab-Based Therapy in Patients with
Metastatic Breast Cancer” Int J Cancer 118 (2006), 1126-1134
Huggins C, Hodges CV, „Studies on Prostatic Cancer: The Effect of Castration, of Estrogen and
of Androgen Injection on Serum Phosphatases in Metastatic Carcinoma of the Prostate“
Cancer Res 1 (1941), 293-297
Hynes NE, Badache A, „A New Therapeutic Antibody Masks ErbB2 to ist Partners“ Cancer Cell 5
(2004), 299-301
Hynes NE, Lane HA, „ErbB Receptors and Cancer: The Complexity of Targeted Inhibitors“ Nat
Rev Cancer 5 (2005), 341-354
Jackson JG, St Clair P, Sliwkowski MX, Brattain MG, „Blockade of Epidermal Growth Factor- or
Heregulin-Dependent ErbB2 Activation with the Anti-ErbB2 Monoclonal Antibody 2C4 Has
Divergent Downstream Signaling and Growth Effects“ Cancer Res 64 (2004), 2601-2609
Janni W, “Translationale Forschung – oft vernachlässigte Forschung gewinnt in Deutschland an
Fahrt” FORUM 21 (2006), 62
Jaquemier J, Ginestier C, Rougemont J, Bardou VJ, carafe-Jauffret E, Geneix J, Adelaide J,
Koki A, Houvenaeghel G, Hassoun J, Maraninchi D, Viens P, Birnbaum D, Bertucci F,
“Protein Expression Profiling Identifies Subclasses of Breast Cancer and Predicts
Prognosis” Cancer Res 65 (2005), 767-779
Jones RB, Gordus A, Krall JA, MacBeath G, „A Quantitative Protein Interaction Network for the
ErbB Receptors Using Protein Microarrays“ Nature (2005), doi: 10.1038/nature04177
Jorissen RN, Walker F, Pouliot N, Garrett TPJ, Ward CW, Burgess AW, “Epidermal Growh Factor
Receptor: Mechanisms of Activation and Signalling” Exp Cell Res 284 (2003), 31-53
Junqueira LC, “Histologie” Springer Verlag, Berlin, 4. Auflage 1996
Klapper LN, Waterman H, Sela M, Yarden Y, „Tumor-Inhibitory Antibodies to Her-2/ErbB-2 May
Act by Recruiting c-cbl and Enhancing Ubiquitination of Her-2“ Cancer Res 60 (2000),
3384-3388
Klein S, McCormick F, Levitzki A, “Killing Time For Cancer Cells” Nat Rev Cancer 5 (2005), 573580
Knuefermann C, Lu Y, Liu B, Jin W, Liang K, Wu L, Schmidt M, Mills GB, Mendelson J, Fan Z,
“Her-2/PI-3K/AKT Activation Leads to a Multidrug Resistance in Human Breast
Adenocarcinoma Cells” Oncogene 22 (2003), 3205-3212
Kokontis J, Takakura K, Hay N, Liao S, “Increased Androgen Receptor Activity and Altered c-myc
Expression in Prostate Cancer Cells after Long-Term Androgen Deprivation” Cancer Res
54 (1994), 1566-1573
Kostler WJ, Hudelist TG, Rabitsch W, Czerwenka K, Muller R, Singer CF, Zielinski CC, “InsulinLike Growth Factor-1 Receptor (IGF-1R) Expression Does Not Predict for Resistance to
Trastuzumab-Based Treatment in Patients with Her-2/neu Overexpressing Metastatic
Breast Cancer” J Cancer Res Clin Oncol 132 (2006), 9-18
Koumakpayi IH, Diallo JS, Le Page C, Lessard L, Gleave M, Begin LR, Mes-Masson AM, Saad F,
„Expression and Nuclear Localization of ErbB3 in Prostate Cancer“ Clin Cancer Res 12
(2006), 2730-2737
Krause DS, van Etten RA, „Tyrosine Kinases as Targets for Cancer Therapy“ N Engl J Med 353
(2005), 172-187
132
Literaturverzeichnis
Krieg RC, Gaisa NT, Paweletz CP, Knuechel R, “Proteomic Analysis of Human Bladder Tissue
Using SELDI Approach Following Microdissection Techniques” Methods Mol Biol 293
(2005), 255-267
Kumar V, Abbas AK, Fausto N, “Pathologic Basis of Disease“, Elsevier Saunders, Philadelphia, 7th
Edition 2005
Lämmli UK, “Cleavage of Structural Proteins During Assembly of the Head of Bacteriophage T4”
Nature 227 (1970), 680-685
Le XF, Pruefer F, Bast RC, “Her2-Targeting Antibodies Modulates the Cyclin-Dependent Kinase
Inhibitor p27jip1 via Multiple Signaling Pathways” Cell Cycle 4 (2005), 87-95
Lee HJ, Jung KM, Huang YZ, Bennett LB, Lee JS, Mei L, Kim TW, „Presenilin-Dependent γSecretase-Like Intramembrane Cleavage of ErbB4“ J Biol Chem 277 (2002), 6318-6323
Leyland-Jones B, Marty M, Baselga J, “Effects of Trastuzumab (Herceptin) and Chemotherapy on
Circulating HER2 Extracellular Domain (ECD) in Patients with Metastatic Breast Cancer
(MBC) and Non-Small Cell Lung Cancer (NSCLC)” Proc Am Soc Clin Oncol 23 (2004), 19
(Abstract 507)
Lin AM, Rini BI, Weinberg V, Fong K, Ryan CJ, Rosenberg JE, Fong L, Small EJ, “A Phase II Trial
of Imatinib Mesylate in Patients with Biochemical Relapse of Prostate Cancer afeter
Definitive Local Therapy” BJU Int 2006, im Druck
Liu X, Fridman JS, Wang Q, Caulder E, Yang G, Covington M, Liu C, Marando C, Zhuo J, Li Y,
Yoa W, Vaddi K, Newton RC, Scherle PA, Friedman SM, “Selective Inhibition of ADAM
Metalloproteases Blocks Her-2 Extracellular Domain (ECD) Cleavage and Potentiates the
Anti-Tumor Effects of Trastuzumab” Cancer Biol Ther 5 (2006), im Druck
Liu Y, Majumder S, McCall W, Sartor CI, Mohler JL, Gregory CW, Earp HS, Whang YE, “Inhibition
of Her-2/neu Kinase Impairs Androgen Receptor Recruitment to the Androgen Responsive
Enhancer” Cancer Res 65 (2005), 3404-3409
Lu D, Zhang H, Ludwig D, Persaud A, Jimenez X, Burtrum D, Balderes P, Liu M, Bohlen P,
Witte L, Zhu Z, “Simultaneous Blockade of Both the Epidermal Growth Factor Receptor
and the Insulin-Like Growth Factor Receptor Signaling Pathways in Cancer Cells with a
Fully Human Recombinant Bispecific Antibody” J Biol Chem 279 (2004), 2856-2865
Lu Y, Zi X, Zhao Y, Mascarenhas D, Pollak M, „Insulin-Like Growth Factor-I Receptor Signaling
and Resistance to Trastuzumab (Herceptin)“ J Nat Cancer Inst 93 (2001), 1852-1857
Lupu R, Colomer R, Kannan B, Lippman ME, „Characterization of A Growth Factor That Binds
Exclusively to the erbB-2 Receptor and Induces Cellular Responses“ Proc Natl Acad Sci
USA 89 (1992), 2287-2291
Lynch TJ, Bell DW, Sordella R, Gurubhagavatula, Okimoto RA, Brannigan BW, Harris PL,
Haserlat SM, Supko JG, Haluska FG, Louis DN, Christiani DC, Settleman J, Haber DA,
“Activating Mutations in the Epidermal Growth Factor Receptor Underlying
Responsiveness of Non-Small-Cell Lung Cancer to Gefinitib” N Engl J Med 350 (2004),
2129-2139
Makretsov NA, Hundtsman DG, Nielsen TO, Yorida E, Peacock M, Cheang MCU, Dunn SE, Hayes
M, van de Rijn M, Bajdik C, Gilks CB, “Hierarchical Clustering Analysis of Tissue
Microarray Immunostaining Data Identifies Prognostically Significant Groups of Breast
Carcinoma” Clin Cancer Res 10 (2004), 6143-6151
Mandell JW, „Phosphorylation State-Specific Antibodies: Applications in Investigative and
Diagnostic Pathology“ Am J Pathol 163 (2003), 1687-1698
133
Literaturverzeichnis
Marques RB, Erkens-Schulze S, de Ridder CM, Hermans KG, Waltering K, Visakorpi T, Trapman J,
Romijn JC, van Weerden WM, Jenster G, ”Androgen Receptor Modifications in Prostate
Cancer Cells upon Long-Term Androgen Ablation and Antiandrogen Treatment” Int J
Cancer 117 (2005), 221-229
Mellinghoff IK, Vivanco I, Kwon A, Tran C, Wongvipat J, Sawyers CL, „Her-2/neu KinaseDependent Modulation of Androgen Receptor Function Through Effects on DNA Binding
and Stability“ Cancer Cell 6 (2004), 517-527
Montero C, “The Antigen-Antibody Reaction in Immunohistochemistry” J Histochem Cytochem
51 (2003), 1-4
Molina MA, Codony-Servat J, Albanell J, Rojo F, Arribas J, Baselga J, „Trastuzumab (Herceptin),
a Humanized Anti-Her-2 Receptor Monoclonal Antibody, Inhibits Basal and Activated Her2 Ectodomain Cleavage in Breast Cancer Cells“ Cancer Res 61 (2001), 4744-4749
Molina MA, Saez R, Ramsey EE, Garcia-Barchino MJ, Rojo F, Evans AJ, Albanell J, Keenan EJ,
Lluch A, Garcia-Conde J, Baselga J, Clinton GM, „NH2-Terminal Truncated HER-2 Protein
but not Full-Length Receptor is Associated with Nodal Metastasis in Human Breast
Cancer“ Clin Cancer Res 8 (2002), 347-353
Nagata Y, Lan KH, zhou X, Tan M, Esteva FJ, Sahin AA, Klos KS, Li P, Monia BP, Nguyen NT,
Hortobagyi GN, Hung MC, Yu D, „PTEN Activation Contributes to Tumor Inhibition by
Trastuzumab, and Loss of PTEN Predicts Trastuzumab Resistance in Patients“ Cancer Cell
6 (2004), 117-127
Nagy P, Vereb G, Sebestyen, Horvath G, Sebestyen Z, Horvath G, Lokett SJ, Damjanovich S,
Park JW, Jovin TM, Szöllösi J, „Lipid Rafts and the Local Density of ErbB Proteins
Influence the Biological Role of Homo- and Heteroassociations of ErbB2“ J Cell Sci 115
(2002), 4251-4262
Nahta R, Takahashi T, Ueno NT, Hung MC, Esteva F, „p27kip1 Down-Regulation is Associated
with Trastuzumab Resistance in Breast Cancer Cells“ Cancer Res 64 (2004), 3981-3968
Nahta R, Yuan LXH, Zhang B, Kobayashi R, Esteva FJ, “Insulin-Like Growth Factor-I Receptor /
Human Epidermal Growth Factor Receptor 2 Heterodimerization Contributes to
Trastuzumab Resistance of Breast Cancer Cells” Cancer Res 65 (2005), 11118-11128
Nahta R, Yu D, hung MC, Hortobgyi GN, Esteva FJ, “Mechanisms of Disease: Understanding
Resistance to Her-2-Targeted Therapy in Human Breast Cancer” Nat Clin Pract Oncol 3
(2006), 269-280
Ni CY, Murphy MP, Golde TE, Carpenter G, „γ-Secretase Cleavage and Nuclear Localization of
ErbB-4 Receptor Tyrosine Kinase“ Science 294 (2001), 2179-2181
Ocana A, Cruz JJ, Pandiella A, „Trastuzumab and Antiestrogen Therapy: Focus on Mechanisms of
Action and Resistance“ Am J Clin Oncol 29 (2006), 90-95
Oda K, Matsuoka Y, Funahashi A, Kitano H, „A Comprehensive Pathway Map of Epidermal
Growth Factor Receptor Signaling“ Mol Systems Biol (2005), doi: 10.1038/msb4100014
Oh DS, Troester MA, Usary J, Hu Z, He X, Fan C, Wu J, Carey LA, Perou CM, “Estrogen-Regulated
Genes Predict Survival in Hormone Receptor-Positive Breast Cancers” J Clin Oncol 24
(2006), epub: 10.1200/JCO.2005.03.2755
Olayioye MA, Neve RM, Lane HA, Hynes NE, „The ErbB Signaling Network: receptor
Heterodimerization in Development and Cancer“ EMBO J 19 (2000), 3159-3167
Osman I, Scher HI, Drobnjak M, Verbel D, Morris M, Agus D, Ross JS, Cordon-Cardo C, „Her2/neu (p185neu) Protein Expression in the Natural or Treated History of Prostate
Cancer“ Clin Cancer Res 7 (2001), 2643-2647
134
Literaturverzeichnis
Paez JG, Jänne PA, Lee JC, Tracy S, Greulich H, Gabriel S, Herman P, Kaye FJ, Lindeman N,
Boggon TJ, Naoki K, Sasaki H, Fujii Y, Eck MJ, Sellers WR, Johnson BE, Meyerson M,
„EGFR Mutations in Lung Cancer: Correlation with Clinical Response to Gefinitib
Therapy“ Science 304 (2004), 1497-1500
Perou CM, Sorlie T, Eisen MB, van de Rijn M, Jeffrey SS, Rees CA, Pollak JR, Ross DT, Johnsen H,
Akslen LA, Fluge O, Pergamenschikov A, Williams C, Zhu SX, Lonning PE, Boressen-Dale
AL, Brown PO, Botstein D, “Molecular Portraits of Human Breast Tumors” Nature 406
(2000), 747-752
Petricoin EF, Zoon KC, Kohn EC, Barrett JC, Liotta LA, „Clinical Proteomics: Translating
Benchside Promise Into Bedside Reality“ Nat Rev Drugdisc 1 (2002), 683-695
Piccart-Gebhart MJ, Procter M, Leyland-Jones B, Goldhirsch A, Untch M, Smith I, Gianni L,
Baselga J, Bell R, Jackisch C, Cameron D, Dowsett M, Barrios CH, Steger G, Huang CS,
Andersson M, Inbar M, Lichinitser M, Lang I, Nitz U, Iwata H, Thomssen C, Lorisch C,
Suter TM, Rüschoff J, Sütö T, Greatorex V, Ward C, Straehle C, McFadden E, Dolci MS,
Gelber RD (for the HERA Trial Study Team), „Trastuzumab after Adjuvant Chemotherapy
in Her-2-Positive Breast Cancer“ N Engl J Med 353 (2005), 1659-1672
Pollak MN, Schernhammer ES, Hankinson SE, „Insulin-Like Growth Factors and Neoplasia“ Nat
Rev Cancer 4 (2004), 505-518
Possinger K, Schmid P, Schmoll HJ, Höffken K, Kreienberg R, Dunst J, „Mammakarzinom der
Frau“, in: „Kompendium Internistische Onkologie“ Springer Verlag, Berlin, 4. Auflage
2006
Preiss JC, Dornoff W, Hagmann FG, Schmieder A (Hrsg.), “Taschenbuch Onkologie 2006/2007”
W.Zuckerschwerdt Verlag GmbH, München, 13. Auflage 2006
Rao K, Goodin S, Levitt MJ, Dave N, Shih WJ, Lin Y, Capanna T, Doyle-Lindrud S, Juvidian P,
DiPaola RS, “A Phase II Trial of Imatinib Mesylate in Patients with Prostate Specific
Antigen Progression after Local Therapy for Prostate Cancer” Prostate 62 (2005), 115122
Rau KM, Kang HY, Cha TL, Miller SA, Hung MC, „The Mechanisms and Managements of HormoneTherapy Resistance in Breast and Prostate Cancers“ Endocrine-Related Cancer 12 (2005),
511-532
Reinikainen P, Palvimo JJ, Janne OA, “Effects of Mitogens on Androgen Receptor-Mediated
Transactivation” Endocrinology 137 (1996), 4351-4357
Revankar CM, Cimino DF, Sklar LA, Arterburn JB, Prossnitz ER, “A Transmembrane Intracellular
Estrogen Receptor Mediates Rapid Cell Signaling” Science 307 (2005), 1625-1630
Ross JS, Fletcher JA, Bloom KJ, Linette GP, Stec J, Symmans WF, Pusztai L, Hortobagyi GN,
“Targeted Therapy in Breast Cancer: the HER-2/neu Gene and Protein” Mol Cell
Proteomics 3 (2004), 379-398
Rüschoff J, Wallinger S, Dietmaier W, Bocker T, Brockhoff G, Hofstädter F, Fishel R, “Aspirin
Suppresses the Mutator Phenotype Associated with Hereditary Nonpolyposis Colorectal
Cancer by Genetic Selection” Proc Natl Acad Sci USA 95 (1998), 11301-11306
Sáez R, Molina MA, Ramsey EE, Rojo F, Keenan EJ, Albanell J, Lluch A, Garcia-Conde J, Baselga
J, Clinton GM, „p95Her-2 Predicts Worse Outcome in Patients with Her-2-Positive Breast
Cancer“ Clin Cancer Res 12 (2006), 424-431
Saghatchian M, Guepratte S, Hacene K, “Serum Her-2 Extracellular Domain: Relationship with
Clinicobiological Presentation and Prognostic Value Before and After Primary Treatment
in 701 Breast Cancer Patients” Int J Biol Markers 19 (2004), 14-22
Sarbassov DD, Guertin DA, Ali SM, Sabatini DM, „Phosphorylation and Regulation of AKT/PKB by
the Rictor-mTOR Complex“ Science 307 (2005), 1098-1101
135
Literaturverzeichnis
Sassen A, Vollmann A, Schwarz S, Brockhoff G, „Kooperation zwischen Mitgliedern der HERRezeptorfamilie - neue Methoden der Darstellung“ Poster #108, 90. Jahrestagung der
Deutschen Gesellschaft für Pathologie, Berlin 2006
Saur-Metz K, „Molekulare Analysen beim hormonunabhängigen Prostatakarzinom mit dem Ziel
der Darstellung von Biomarkern“, Diplomarbeit, Univ. Kassel, 2006
Sauter G, Simon R, Hillan K, „Tissue Microarrays in Drug Discovery“ Nat Rev Drugdisc 2 (2003),
962-972
Sawyer C, Hiles I, Page M, Crompton M, Dean C, “Two erbB-4 Transcripts are Expressed in
Normal Breast and in Most Breast Cancers” Oncogene 17 (1998), 919-924
Schechter AL, Hung MC, Vaidyanathan L, Weinberg RA, Yang-Feng TL, Francke U, Ullrich A,
Coussens L, „The neu Gene: An erbB-Homologous Gene Distinct from and Unlinked to the
Gene Encoding the EGF Receptor“ Science 229 (1985), 976-978
Schlessinger J, „Cell Signaling by Receptor Tyrosine Kinases“ Cell 103 (2000), 211-225
Sebolt-Leopold JS, Herrera R, „Targeting the Mitogen-Activated Protein Kinase Cascade to Treat
Cancer“ Nat Rev Cancer 4 (2004), 937-947
Shaw RJ, Cantley LC, “ras, PI(3)K and mTOR Signaling controls Tumor Cell Growth” Nature 441
(2006), 424-430
Shi Y, Brands FH, Chatterjee S, Feng AC, Groshen S, Schewe J, Lieskovsky G, Cote RJ, „Her2/neu Expression in Prostate Cancer: High Level of Expression Associated with Exposure
to Hormone Therapy and Androgen Independent Disease“ J Urol 166 (2001), 1514-1519
Shin I, Yakes FM, Rojo F, Shin NY, Bakin AV, Baselga J, Arteaga CL, „PKB/AKT Mediates CellCycle Progression by Phopshorylation of p27kip1 at Threonine 157 and Modulation of its
Cellular Localization“ Nat Med 8 (2002), 1145-1152
Signoretti S, Montironi R, Manola J, Altimari A, Tam C, Bubley G, Balk S, Thomas G, Kaplan I,
Hlatky L, Hahnfeldt P, Kantoff P, Loda M, “Her-2-neu Expression and Progression Toward
Androgen Independence in Human Prostate Cancer” J Natl Cancer Inst 92 (2000), 19181925
Slamon DJ, Clark GM, Wong SG, Levin WJ, Ullrich A, McGuire WL, „Human Breast Cancer:
Correlation of Relapse and Survival With Amplification of the Her-2/neu Oncogene“
Science 235 (1987), 177-182
Slamon DJ, Leyland-Jones B, Shak S, Fuchs H, Paton V, Bajamonde A, Fleming T, Eiermann W,
Wolter J, Pegram M, Baselga J, Norton L, „Use of Chemotherapy Plus A Monoclonal
Antibody Against Her-2 for Metastatic Breast Cancer That Overexpress Her-2“ N Engl J
Med 344 (2001), 783-792
Smith IE, Dowsett M, „Aromatase Inhibitors in Breast Cancer“ N Engl J Med 348 (2003), 24312442
Sordella R, Bell DW, Haber DA, Settleman, „Gefinitib-Sensitizing EGFR Mutations in Lung Cancer
Activate Anti-Apoptotic Pathways“ Science 305 (2004), 1163-1167
Sorlie T, Perou CM, Tibshirani R, Aas T, Geisler S, johnsen H, Hastie T, Eisen MB, van de Rijn M,
Jeffrey SS, Thorsen T, Quist H, Matese JC, Brown PO, Botstein D, Eystein-Lonning P,
Boressen-Dale AL, “Gene Expression patterns of Breast Carcinomas Distinguish Tumor
Subclasses with Clinical Implications” Proc Natl Sci USA 98 (2001), 10869-10874
Stoss O, Henkel T, „Biomedical Marker Molecules for Cancer – Current Status and Perspectives“
DDT:targets 3 (2004), 228-237
Suo Z, Risberg B, Karlsson MG, Willman K, Tierens A, Skovlund E, Nesland JM, “EGFR Family
Expression in Breast Carcinomas. C-erbB-2 and c-erbB-4 Receptors have Different Effects
on Survival” J Pathol 196 (2002) 17-25
136
Literaturverzeichnis
Suo Z, Risberg B, Karlsson MG, Villman K, Skovlund E, Nesland JM, “The Expression of EGFR
Family Ligands in Breast Carcinomas” Int J Surg Pathol 10 (2002a), 91-99
Sweeney C, Carraway KL, „Negative Regulation of ErbB Family Receptor Tyrosine Kinases“ Br J
Cancer 90 (2004), 289-293
Taube ME, Liu XW, Fridman R, Kim HRC, „TIMP-1 Regulation of Cell Cycle in Human Breast
Epithelial Cells via Stabilization of p27“ Oncogene 25 (2006), 3041-3048
Tavassoli FA, Devilee P „World Health Organization Classification of Tumours: Tumours of the
Breast and Female Genital Organs“ IARC Press, Lyon 2003
Theodosiou A, Ashworth A, „MAP Kinase Phosphatases“ Genome Biol 3 (2002), epub:
reviews3009.1-reviews3009.10
Thomas C, “Histopathologie” Schattauer Verlag, Stuttgart, 14. Auflage 2006
Thor AD. Liu S, Edgerton S, Moore D, Kasowitz KM, Benz CC, Stern DF, DiGiovanna MP,
„Activation (Tyrosine Phosphorylation) of ErbB-2 (Her-2/neu): A Study of Incidence and
Correlation With Outcome in Breast Cancer“ J Clin Oncol 18 (2000), 3230-3239
Tokunaga E, Kataoka A, Kimura Y, Oki E, Mashino K, Nishida K, Koga T, Morita M, Kakeji Y, Baba
H, Ohno S, Maehara Y, “The Association Between AKT Activation and Resistance to
Hormone
Therapy in Metastatic Breast Cancer” Eur
J Cancer, doi:
10.1016/j.ejca.2005.11.025
van de Vijver M, Mooi WJ, Peterse JL, Nusse R, “Amplification and Over-Expression of the neu
Oncogene in Human Breast Carconomas” Eur J Surg Oncol 14 (1988), 111-114
van der Horst EH, Weber I, Ullrich A, „Tyrosine Phosphorylation of PYK2 mediates HeregulinInduced Glioma Invasion: Novel Heregulin/Her-3-Stimulated Pathway in Glioma“ Int J
Cancer 113 (2005), 689-698
van der Horst EH, Murgia M, Treder M, Ullrich A, „Anti-Her-3 MAbs Inhibit Her-2 Mediated
Signaling in Breast CAncer Cell Lines Resistant to Anti-Her-2 Antibodies“ Int J Cancer 115
(2005), 519-527
Vivanco I, Sawyers CL, „The Phosphatidylinositol 3-Kinase-AKT Pathway in Human Cancer“ Nat
Rev Cancer 2 (2002), 489-501
Wedding U, Budach W, Huland H, Höffken K, “Prostatakarzinom” in: „Kompendium
Internistische Onkologie“ Springer Verlag, Berlin, 4. Auflage 2006
Wells A, Marti U, „Signaling Shortcuts: Cell-Surface Receptors in the Nucleus?“ Nat Rev Mol Cell
Biol 3 (2002), 697-702
Wen Y, Hu MCT, Makino K, Spohn B, Bartholomeusz, Yan DH, Hung MC, “Her-2/neu Promotes
Androgen-Independent Survival and Growth of Prostate Cancer Cells Through the AKT
Pathway” Cancer Res 60 (2000), 6841-6845
Wetzker R, Böhmer FD, „Transactivation Joins Multiple Tracks to the ERK/MAPK Cascade“ Nat
Rev Mol Cell Biol 4 (2003), 651-657
Wiseman SM, Makretsov N, Nielson TO, Gilks B, Yorida E, Cheang M, Turbin D, Gelmon K,
Huntsman DG, “Coexpression of the Type 1 Growth Factor Receptor Family Members
HER-1, Her-2, and Her-3 Has a Synergistic Negative Prognostic Effect on Breast
Carcinoma Survival” Cancer 103 (2005), 1770-1777
Yarden Y, Sliwkowski MX, “Untangling the ErbB Signaling Network” Nat Rev Mol Cell Biol 2
(2001), 127-137
Yeatman TJ, „A Renaissance for src“ Nat Rev Cancer 4 (2004), 470-480
137
Literaturverzeichnis
Yeh S, Lin HK, Thin TH, Lin MF, Chang C, „From Her-2/neu Signal Cascade to Androgen Receptor
and ist Coactivators: A Novel Pathway by Induction of Androgen Target Genes Through
MAP Kinase in Prostate Cancer Cells“ Proc Natl Acad Sci USA 96 (1999), 5458-5463
Yu H, Jove R, „The STATs of Cancer - New Molecular Targets Come of Age“ Nat Rev Cancer 4
(2004), 97-105
Yuan CX, Lasut AL, Wynn R, Neff NT, Hollis GF, Ramaker ML, Rupar MJ, Liu P, Meade R,
“Purification of Her-2 Extracellular Domain and Identification of its Cleavage Site”
Protein Expr Purif 29 (2003), 217-222
138
Ergebnisse
8. Beiträge Dritter und Kooperationen
Die in dieser Dissertationsschrift beschriebenen Untersuchungen wurden erst möglich durch die
Unterstützung zahlreicher Personen „im Hause“ und die Mithilfe anderer Forschungsinstitute
und Kliniken. Allen Beteiligten sei zunächst hierfür herzlich gedankt.
Die medizinisch-technischen Assistentinnen des Instituts für Pathologie und der Firma TARGOS,
Katja Bräutigam, Katja Wagner, Maria Scheurer, Alexandra Otto, Sabrina Arend, Christina
Koppel und Ursula Hein fertigten ungezählte Gewebeschnitte an. Die immunhistochemischen
Färbungen mit dem Färbeautomaten wurden zusätzlich von Herma Bergbauer, Gisela Herstell
und Heide Nitsch betreut.
Die Auswertung der Färbungen und Etablierung des Scoring-Systems erfolgte in Zusammenarbeit
mit Dr. med. Manfred Hofmann (Mamma) und Dr. med. Peter Middel (Prostata); durch eine
intensive Einführung in die Histopathologie der entsprechenden Tumorerkrankungen war
schließlich eine selbstständige Auswertung möglich.
Die bioinformatische Auswertung der erhobenen Daten erfolgte in Zusammenarbeit mit
Dr.rer. nat. Oliver Stoss, der die entsprechenden Routinen entwickelte und bei weiterführenden
Schritten hilfreich zur Seite stand.
In Zusammenarbeit mit der Arbeitsgruppe Biochemie des FB18 der Universität Kassel wurden die
hier nicht aufgeführten massenspektrometrischen Untersuchungen durchgeführt; hier zeichnete
sich Oliver Bertinetti hauptverantwortlich.
Die Durchführung Zellkultur-basierter Experimente wurde von Mandy Diskar, Angelika Wattrodt
und Carmen Demme fachmännisch begleitet.
Die Firma U3 Pharma, München stellte den pRK5/Her-2 Vektor zur Verfügung, der zur
Transfektion der HEK-Zellen verwendet wurde.
Kurz vor Abgabe der Arbeit stellte Prof.Dr.med. Arndt Hartmann (Universitätsklinikum
Regensburg) Frisch-Gewebe zur Verfügung, zu denen klinische Verlaufs-Daten verfügbar waren.
Die Aufarbeitung der Schnitte wurde von Dr.rer.nat. Robert Stöhr betreut.
139
Ergebnisse
Danksagung
Da das Leben eines Wissenschaftlers offensichtlich zu 95% aus Fehlschlägen besteht, benötigt
jeder das passende Umfeld, dass ihm auf der Suche nach den übrigen 5% behilflich ist.
Für die tolle Unterstützung in den letzten Jahren möchte ich Herrn Prof. Dr. Josef Rüschoff
herzlich danken. Seine Begeisterungsfähigkeit, besonders für präliminäre Daten und neue
Denkweisen ist mir stets ein Ansporn gewesen, was mich zugegebenermaßen aber auch in so
manche (lehrreiche) Sackgasse geführt hat.
Herrn Prof. Dr. Friedrich Herberg von der Arbeitsgruppe Biochemie an der Universität Kassel
möchte ich für die Übernahme der Betreuung und die vielen wertvollen Hinweise zur
Massenspektrometrie danken.
Mein besonderer Dank für unzählige Tipps und wertvolle Gespräche gilt Herrn Dr. Thomas
Henkel, der in den letzten Jahren meine Vorliebe für Signaltransduktion und biomedizinische
Forschung stets gefördert hat. Auch für seine nicht selbstverständliche Rücksicht- und
Anteilnahme in für mich schweren Zeiten möchte ich mich an dieser Stelle aufrichtig bedanken.
Lehrreiche Einblicke in die ungeliebte Welt der Statistik gewährte mir Dr. Oliver Stoss, der
glücklicherweise die Auswertung der IHC Resultate betreute und zudem fast jederzeit gute
Tipps auf Lager und stets ein offenes Ohr für mich hatte.
Für die vielen wertvollen Tipps zur Etablierung der immunhistochemischen Färbeprotokolle
möchte ich Dr. Gabriela Westphal danken.
Allen medizinisch-technischen Assistentinnen vom Institut für Pathologie und der Firma TARGOS
danke ich für ihre jederzeit engagierte Unterstützung meiner Arbeit und für das kollegiale
Arbeitsklima. Gleiches gilt für Meike Werther („Käffchen?“), der ich für ihren weiteren Weg
alles Gute wünsche.
Mandy Diskar und Oliver Bertinetti aus der Arbeitsgruppe Biochemie haben aller Sinnlosigkeit
zum Trotz meine Bemühungen zum Her-2-phospho-mapping intensiv unterstützt. Für die
investierte Zeit vielen Dank!
Auch ohne meine Freunde wäre in der letzten Zeit vieles schwerer gewesen. Vielen Dank!
Nicht zuletzt möchte ich auch meiner Familie für ihre Unterstützung während des gesamten
Studiums danken.
Meiner Frau Nadine danke ich für ihre unglaubliche Kraft und Geduld und dafür, dass mit ihr
alles ein wenig schöner ist.
141
Lebenslauf
Name, Vorname:
Zielinski, Dirk
Geburtsdatum, Geburtsort:
06. Mai 1974, Dortmund
Schulausbildung / -abschluss:
1984 – 1994 Freiherr-vom-Stein-Gymnasium, Lünen/Westf.
1994 Allgemeine Hochschulreife
Zivildienst:
1995 - 1996 St. Marien-Krankenhaus, Lünen/Westf.
Studium:
1996 – 2002 Studium der Biologie (Dipl.) an der Universität
Kassel
Diplomarbeit:
„Quantifizierung der Expression der humanen DNAReparaturgene hMLH1 und hMSH2 mittels RT-PCR zur
Diagnostik
des
hereditären
nicht-polypösen
Kolonkarzinoms“, März – Okt. 2002, Klinikum Kassel, Institut für
Pathologie
Berufsfeldbezogene Praktika:
Mai 1990 SCHERING AG, Bergkamen
Nov./Dez. 1999 Immunolab GmbH, Kassel
Juni/Juli 2000 Klinikum Kassel, Institut für Pathologie
Berufstätigkeit:
Feb. - Sept. 1996, Hilfskraft, St. Marien-Krankenhaus,
Lünen/Westf.
1997 - 2000 Hilfskraft, HYCOR Biomedical, Kassel
2000 - 2001 Hilfskraft, IMMUNOLAB GmbH, Kassel
2000 - 2002 studentische Hilfskraft, Universität Kassel, AG
Zellbiologie/Humanbiologie
März 2003 - Juni 2006 wissenschaftlicher Mitarbeiter,
Institut für Pathologie, Abt. Biomedizinische Forschung
seit Juli 2006 Wissenschaftler, TARGOS Molecular Pathology
GmbH, Kassel
Förderung:
2005 Förderpreis Schiller-Stiftung
Veröffentlichungen / Kurzartikel: Zielinski D, Henkel T, „New therapeutic potential for
NSAIDs“ DDT 9 (2004), 147
Zielinski D, Henkel T, „A new drug in the pipeline?“ DDT 9
(2004), 376
Zielinski D, Henkel T, „Small molecule, great oppurtunities“
DDT 9 (2004), 540
Zielinski D, Henkel T, „Alternatives to Herceptin“ DDT 9
(2004), 722
Zielinski D, Henkel T, „A helping hand for Gleevec“ DDT 9
(2004), 942
143
Posterbeiträge zu Konferenzen:
Zielinski D, Rüschoff J, Henkel T, “Expression und
Aktivierungszustand des Her-2p185 Proteins als ein möglicher
positiver Prädiktor für Her2-gerichtete Therapie” 90.
Jahrestagung der Gesellschaft für Pathologie, Berlin 2006
Zielinski D, Hofmann M, Stoss O, Rüschoff J, Henkel T,
“Darstellung der Her-2 assoziierten Signaltransduktion an
klinischen
Proben
mittels
Immunhistochemie”
90.
Jahrestagung der Gesellschaft für Pathologie, Berlin 2006
Vorträge:
„The Receptor Tyrosine Kinase Her2/neu : Analysis of
Therapy Resistance Mechanisms” Biochemistry Retreat,
Wesendorf 2005
„Novel Insights Into Herceptin Resistance Mechanisms“
Biochemistry Retreat, Wesendorf 2006
„Eignet sich der Aktivierungszustand des Her-2p185 als
prädiktiver Marker für eine Her-2-gerichtete Therapie?“
Deutscher Krebskongress, Berlin 2006
144
„Mag der eine durch die anatomische Untersuchung des
Krankhaften, der andere durch klinische Beobachtung
der Vorgänge, der dritte durch das pathologische und der
vierte durch das therapeutische Experiment, einer durch
chemische oder physikalische, und wieder ein anderer
durch historische Forschungen vorwärts zu schreiten
suchen, die Wissenschaft ist groß genug, alle diese
Richtungen gewähren zu lassen, wenn sie nicht exklusiv
sein wollen, wenn sie nicht ihre Grenze überschreiten,
wenn sie nicht alles zu leisten prätendieren. Zu große
Versprechungen haben noch immer geschadet,
zu große Ansprüche immer verletzt,
Selbstüberschätzung beleidigt oder sich selbst
lächerlich gemacht.“
RUDOLF VIRCHOW
145
Erklärung
Hiermit versichere ich, dass ich die vorliegende Dissertation selbständig und ohne unerlaubte
Hilfsmittel angefertigt und andere als die in der Dissertation angegebenen Hilfsmittel nicht
benutzt habe. Alle Stellen, die wörtlich oder sinngemäß aus veröffentlichten oder
unveröffentlichten Schriften entnommen sind, habe ich als solche kenntlich gemacht. Kein Teil
dieser Arbeit ist in einem anderen Promotions- oder Habilitationsverfahren verwendet worden.
Dirk Zielinski
Bad Emstal, im Oktober 2006
146