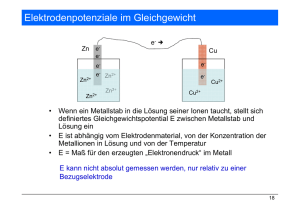
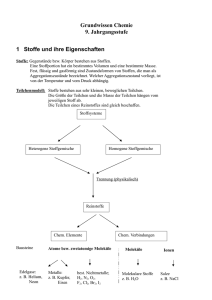
Theorie-Skript zum Chemie-Praktikum (AC) für Mediziner 1
Werbung

Theorie-Skript zum Mediziner-Praktikum (AC) Theorie-Skript zum Chemie-Praktikum (AC) für Mediziner 1 1.1.1 1.1.2 1.2 1.2.1 1.3 2 Atommodell nach BOHR......................................................5 Beispiel Wasserstoff: ......................................................... 5 Informationen aus dem PSE:.............................................. 5 PSE (Periodensystem der Elemente ): .............................. 7 Berechnung der Molmassen M (molaren Massen): ........... 8 Molvolumen: ....................................................................... 8 Aggregat-Zustände .........................................................10 2.1 3 Phasenbegriff: .................................................................. 10 Stofftrennverfahren .........................................................11 3.1.1 3.1.2 3.2 3.2.1 3.3 3.4 3.4.1 3.5 3.5.1 3.5.2 3.5.3 4 Physikalische Verfahren ................................................... 11 Chemische Verfahren....................................................... 11 Dampfdruck und Destillation ............................................ 11 Destillation von Gemischen.............................................. 12 Siedepunkt:....................................................................... 13 Extraktion und NERNSTscher Verteilungssatz................ 13 Versuch: Stofftrennung durch Extraktion.......................... 14 Chromatographie und Retentionsfaktor ........................... 14 Versuch: Dialyse............................................................... 17 Aufgabe ............................................................................ 17 Aufgabe: Ideales Gasgesetz ............................................ 18 Bindungstypen .................................................................19 4.1 4.2 4.2.1 4.2.2 4.2.3 4.3 4.3.1 4.3.2 5 Oktettregel:....................................................................... 19 Intramolekulare Bindungen .............................................. 19 Ionenbindung .................................................................... 19 Kovalente Bindung............................................................ 20 Metallbindung ................................................................... 20 Intermolekulare Bindungen .............................................. 20 Wasserstoffbrückenbindung ............................................ 20 VAN-DER-WAALS-Kräfte................................................. 21 Dynamisches Gleichgewicht .........................................21 5.1 6 Massenwirkungsgesetz .................................................... 22 Löslichkeitsprodukt .........................................................22 6.1.1 6.1.2 Lösungsvorgang ............................................................... 22 Beispiele........................................................................... 23 Seite 1 Theorie-Skript zum Mediziner-Praktikum (AC) 6.1.3 6.1.4 7 Aufgabe ............................................................................ 23 Aufgabe 3 ......................................................................... 24 Elektrochemie ..................................................................24 7.1.1 7.2 7.2.1 7.2.2 7.3 7.3.1 7.4 7.4.1 7.4.2 8 Elektrolyt ........................................................................... 24 Elektrisches Feld.............................................................. 24 Massentransport............................................................... 25 Ladungstransport.............................................................. 25 Leitfähigkeit ...................................................................... 26 Dissoziationsgrad α.......................................................... 26 Konduktometrie ................................................................ 26 Neutralisationsreaktion..................................................... 27 Titrationsgleichung ........................................................... 27 Osmose ............................................................................28 8.1.1 8.1.2 8.1.3 8.1.4 8.1.5 8.1.6 8.1.7 8.1.8 9 Versuch: Anorganische Gärten ........................................ 28 PFEFFER'sche Zelle........................................................ 28 Osmotischer Druck Π....................................................... 29 Beispiel ............................................................................. 29 Dynamisches Gleichgewicht ............................................ 29 Beinflussung des Gleichgewichtes .................................. 30 Aufgabe ............................................................................ 30 Aufgabe ............................................................................ 31 Säuren und Basen ..........................................................31 9.1.1 9.1.2 9.1.3 9.1.4 9.2 9.3 9.3.1 9.4 9.5 9.5.1 9.5.2 9.5.3 10 10.1 Definition nach Brönsted .................................................. 31 Beispiele für Protolysereaktionen..................................... 31 Ampholyte......................................................................... 32 Autoprotolyse.................................................................... 32 Ionenprodukt des Wassers (KW ) ...................................... 33 Säurekonstante (KS)......................................................... 33 Beispiele: pKS- und pKB-Werte einiger Säure-Base-Paare .......................................................................................... 34 Basenkonstante (KB) ........................................................ 34 Berechnung von pH / pOH-Werten .................................. 35 Starke Säuren (starke Basen) .......................................... 35 Schwache Säuren (schwache Basen) ............................. 35 Aufgabe ............................................................................ 36 Neutralisationsreaktionen ...............................................37 Beachtung der Stöchiometrie........................................... 37 Seite 2 Theorie-Skript zum Mediziner-Praktikum (AC) 10.1.1 10.2 10.2.1 10.2.2 10.2.3 11 12 Aufgabe ............................................................................ 37 pH-Verlauf bei Säure-Base-Titrationen............................ 38 Endpunktbestimmung....................................................... 38 Starke Säure / starke Base............................................... 38 Schwache Säure / starke Base ........................................ 39 Indikatoren ........................................................................39 Puffersysteme..................................................................40 12.1.1 12.1.2 12.2 13 Puffergleichung: Henderson-Hasselbach ........................ 41 Versuch: Herstellen eines Puffers.................................... 41 pH-Verlauf eines Puffersystems ...................................... 42 Redoxreaktionen ..............................................................43 13.1 13.1.1 13.1.2 13.1.3 13.1.4 13.1.5 13.1.6 13.1.7 13.1.8 13.1.9 13.1.10 13.1.11 13.2 13.2.1 13.2.2 13.2.3 13.2.4 13.3 13.3.1 13.3.2 13.3.3 13.3.4 13.3.5 14 14.1.1 14.2 Definitionen ...................................................................... 43 Oxidation........................................................................... 43 Reduktion.......................................................................... 43 Redoxreaktion................................................................... 43 Oxidationsmittel ................................................................ 43 Reduktionsmittel ............................................................... 43 Oxidationszahlen .............................................................. 43 Regeln zur Bestimmung der Oxidationszahlen ................ 44 Beispiele: .......................................................................... 44 Aufgabe ............................................................................ 45 "Triebkraft der Redoxreaktionen": .................................... 45 Aufstellung von Reaktionsgleichung: ............................... 45 Beispiele........................................................................... 46 Versuch: Oxidation von Zn mit H3O+! ............................... 46 Versuch: Redoxtitration Iodometrie .................................. 46 Oxidation von SO32- mit MnO 4- in saurem Milieu.............. 47 Oxidation von SO32- mit MnO 4- in alkalischem Milieu....... 47 Elektrochemische Potentiale............................................ 47 Redoxpotential.................................................................. 47 Halbzelle........................................................................... 47 Normal-Wasserstoff-Elektrode (NWE) ............................ 48 Merke:............................................................................... 48 Beispiel ............................................................................. 51 NERNST'SCHE GLEICHUNG ....................................52 Redoxgleichung für das Redox-Paar Mn2+/MnO4-: ........... 52 Elektromotorische Kraft (EMK)......................................... 53 Seite 3 Theorie-Skript zum Mediziner-Praktikum (AC) 14.2.1 14.3 14.3.1 14.3.2 14.3.3 14.3.4 14.3.5 15 Allgemein gilt nach Nernst : ............................................. 53 Galvanisches Element: .................................................... 53 Versuch: Daniell-Element................................................. 53 Konzentrations-Element ................................................... 55 Aufgabe ............................................................................ 55 Zusammenhang der Gleichgewichtskonstanten K mit der EMK .................................................................................. 56 Aufgabe ............................................................................ 57 Koordinative Bindung......................................................58 15.1 15.1.1 15.1.2 15.1.3 15.1.4 15.1.5 15.1.6 15.1.7 15.1.8 15.1.9 15.2 15.2.1 15.2.2 15.2.3 15.2.4 15.2.5 16 Begriffe zur koordinativen Bindung .................................. 58 Koordinationszahl ............................................................. 58 Struktur ............................................................................. 58 Liganden ........................................................................... 59 Zähnigkeit ......................................................................... 59 Ambident .......................................................................... 59 Schreibweise von Komplexen .......................................... 59 Aufgabe ............................................................................ 59 Gleichgewichtskonstante ................................................. 60 Aufgabe ............................................................................ 61 Beispiele für biologisch relevante Komplexe ................... 62 Hämoglobin ...................................................................... 62 Chlorophyll........................................................................ 63 Ca-EDTA .......................................................................... 63 Aufgabe ............................................................................ 64 Aufgabe ............................................................................ 64 Photometrie ......................................................................64 16.1.1 16.1.2 16.2 16.2.1 17 Energie der elektromagnetischen Strahlung.................... 64 Energieniveaus der Orbitale............................................. 65 Lambert-Beer-Gesetz....................................................... 66 Aufgabe ............................................................................ 68 Thermodynamik ...............................................................69 17.1.1 17.1.2 17.1.3 17.1.4 GIBBS-HELMHOLTZ-GLEICHUNG ................................. 71 Aufgabe: ........................................................................... 71 Zusammenhang zwischen ∆G, der Gleichgewichtskonstante K und des elektrochemischen Potentials E ...................................................................... 72 Aufgabe: ........................................................................... 73 Seite 4 Theorie-Skript zum Mediziner-Praktikum (AC) 18 Kinetik................................................................................74 18.1.1 18.1.2 18.1.3 18.1.4 18.1.5 18.1.6 18.1.7 19 Allgemeine Formulierung für ein Geschwindigkeitsgesetz: .......................................................................................... 74 Reaktion 0. Ordnung ........................................................ 75 Reaktion 1. Ordnung: ....................................................... 75 Reaktion 2. Ordnung: ....................................................... 76 Aufgabe ............................................................................ 76 Bestimmung der Geschwindigkeitskonstanten k ............. 77 Aufgabe ............................................................................ 78 Die Geschwindigkeitskonstante k, Theorie nach ARRHENIUS ...................................................................79 19.1.1 19.1.2 Bestimmung der Aktivierungsenergie EA und des präexponentiellen Faktors ko ............................................ 80 Aufgabe ............................................................................ 81 1 Atommodell nach BOHR Ein Atom besteht aus einem positiv geladenen Atomkern mit Protonen (positiv geladen) und Neutronen (neutral) sowie negativ geladenen Elektronen, die auf Schalen in energetisch definierten Abständen vom Kern (K-, L-, ...-Schale) kreisen. Ordnungszahl: Massenzahl: Anzahl der Protonen im Kern Anzahl der Protonen und Neutronen im Kern Isotope: Atome mit gleicher Ordnungszahl, aber unterschiedlicher Massenzahl (d.h. gleiche Protonenanzahl, aber unterschiedliche Neutronenanzahl) 1.1.1 Beispiel Wasserstoff: Massenzahl 1 Ordnungszahl 1 H 2 1 H 3 1 H Neutron Proton Elektron Abbildung 1: Die drei Isotope des Wasserstoffs 1.1.2 Informationen aus dem PSE: ∗ Elemente einer Gruppe (jeweils eine Spalte im PSE) haben gleiche Valenzelektronenanzahl (Außenelektronen). Diese bestimmen die Zugehörigkeit eines Elementes zu einer Haupt- oder Nebengruppe und damit die Chemie des Elementes. ∗ relative Atommassen (Mittel aus allen Isotopenmassen unter Berücksichtigung der relativen Häufigkeit) Seite 5 Theorie-Skript zum Mediziner-Praktikum (AC) ∗ Die Elektronegativität EN (Tendenz Elektronen anzuziehen) nimmt in einer Periode von links nach rechts zu (Atomradius nimmt ab - mehr Protonen im Kern ziehen die Elektronen auf der Schale stärker an). ∗ Die Elektronegativität EN nimmt in einer Gruppe von oben nach unten ab (Atomradius nimmt zu - mehr Schalen ⇒ größerer Abstand zw. den sich anziehenden Ladungen ⇒ Coulomb-Kraft wird schwächer). Seite 6 Theorie-Skript zum Mediziner-Praktikum (AC) 1.2 PSE (Periodensystem der Elemente ): Seite 7 Theorie-Skript zum Mediziner-Praktikum (AC) Um chem. Reaktionen zu beschreiben, formuliert man Reaktionsgleichungen, diese beschreiben die Stöchiometrie, das heißt die Stoffmengenverhältnisse der miteinander reagierenden Reaktionspartner. 2 H2 + O2 2 H2O Stoffmenge: Einheit [mol] 23 1 mol Stoffmenge entspricht 6,023 * 10 Teilchen (LOSCHMIDT'sche Zahl NL oder AVOGADRO-Zahl NA) 1.2.1 Berechnung der Molmassen M (molaren Massen): Durch Aufaddieren der relativen Atommassen: Beispiel Wasser (H2O): MH = 1 g/mol MO =16 g/mol MH2O = 18 g/mol 1 mol Wasser = 18 g H2O = 6,023 * 10 23 Teilchen 1.3 Molvolumen: Satz von AVOGADRO: Gleiche Raumteile von Gasen enthalten bei gleichen Bedingungen gleich viele Teilchen. 1 mol eines idealen Gases nimmt immer ein bestimmtes Volumen (22,4l bei 0°C) ein, unabhängig von der Gasart. Beispiel Wasser: Egal ob Wasser flüssig oder gasförmig ist, 18g H2O enthalten 23 immer 6,023 * 10 Moleküle. Ist Wasser flüssig, haben 18g bei 4°C ein Volumen von 18mL, gasförmig nehmen 18g ein Volumen von 22,4l unter Annahme idealen Verhaltens ein. Beispiel Chlor: 71g Chlorgas (Cl2 mit 2mal MCl = 35,5 g/mol) = 1 mol nimmt ein Volumen von 22,4 L ein (vorausgesetzt es handelt sich um ein ideales Gas). Aufgabe: Konzentrationsberechnung Versuch: Herstellen eines Alkohol-/Wassergemisches Sie geben 10 g Ethanol (CH3CH2OH) (Dichte = 0,79 g/mL) in einen 1-LiterMeßkolben und füllen mit Wasser (Dichte = 1 g/mL) auf. Berechnen Sie die verschiedenen Konzentrations- und Gehaltsangaben. (Mischungseffekte vernachlässigen!) (a) Molare Masse M des Ethanols (CH3CH2OH) [g/mol]: 46 g/mol (MC = 12 g/mol; MH = 1 g/mol; MO = 16 g/mol) (b) Stoffmengenkonzentration cn = molare Konz. des Ethanols [mol/L]: es gilt: cn = n V Seite 8 Theorie-Skript zum Mediziner-Praktikum (AC) Zusammenhang zwischen Stoffmenge und molarer Masse: m=M*n M = molare Masse [g/mol] n = Stoffmenge [mol] m = Masse (absolutes Gewicht) [g] n m 10 g c = = = = 0,22 mol / L n V M * V 46 g / mol * 1L (c) Volumengehalt [Vol%]: es gilt: ρ= m V ⇒ V = ? (rho) ist die Dichte m 10 g = = 12,66 mL ρ 0,79 g / mL da also in 1 L Lösung (100 %) 12,66 mL Ethanol (x %) sind: ⇒ Volumengeh alt = (d) 12,66 mL EtOH* 100% = 1,266 Vol.% 1000 mL Lösung Massengehalt [Gew.%]: Dichte (H2O) = 1 g/mL (d.h. 1 Liter wiegt 1 kg, definiert für 4°C) es gilt: Massengeha lt= Gewicht Et OH * 100 % 10 g * 100 % = Gesamtgew. der Lsg. 1000 g = 1 Gew.% Seite 9 Theorie-Skript zum Mediziner-Praktikum (AC) 2 Aggregat-Zustände Abbildung 2: Aggregat-Zustände ∗ gasförmig (g): Teilchen fliegen regellos und voneinander unbeeinflußt (bei idealen Gasen) im Raum (Gase sind volumen- noch formstabil). ∗ flüssig (l): Teilchen ziehen sich gegenseitig an, haben aber keine festen Gitterplätze (Flüssigkeiten sind volumenstabil, aber nicht formstabil). ∗ fest (s): Teilchen ziehen sich gegenseitig an, sie liegen auf festen Gitterplätzen (Festkörper sind volumen- und formstabil) 2.1 Phasenbegriff: Eine Phase ist ein Stoffsystem, innerhalb dessen keine sprunghaften Änderungen der physikalischen und chemischen Eigenschaften auftreten. Beispiel 1: Phase 1: Phase 2: Beispiel 2: gesättigte Kochsalzlösung mit Bodensatz Bodensatz = fest Lösung = flüssig 2 unterschiedliche Phasen (die Eigenschaften ändern sich sprunghaft an der Grenzfläche) Öl in Wasser Öl besteht aus gleichmäßig aufgebauten organischen Molekülen, beim Wasser hingegen führt eine starke Ladungsverteilung innerhalb des Moleküls zu einer Polarisierung. Da Wasser also polarer ist, mischt es sich schlecht mit Öl. Obwohl beide Substanzen flüssig sind, bilden Seite 10 Theorie-Skript zum Mediziner-Praktikum (AC) sich zwei Phasen. ∗ homogenes System: 1 Phase Beispiele: Luft, Salzlösungen ∗ heterogenes System: 2 (oder mehrere Phasen) Beispiele: Seeluft (feine Flüssigkeits- und Feststoffpartikel in Luft = Aerosol), s. a. Versuche zur Extraktion 3 Stofftrennverfahren 3.1.1 Physikalische Verfahren 3.1.2 Chemische Verfahren Grundlage: Abtrennung ohne Stoffveränderung, Trennung aufgrund unterschiedlicher physikalischer Eigenschaften z.B. :Größe, Polarität, Molmasse, Dichte, etc. Destillation (Siedepunkte) Elektrophorese (Beweglichkeit) Extraktion (Löslichkeit, Polarität, Versuch 2) Chromatographie (Polarität, Versuch 3) Dialyse (Molekülgröße, Versuch 4) Grundlage: Abtrennung durch Stoffveränderung Eine chemische Reaktion liefert ein Reaktionsprodukt, das aufgrund anderer Eigenschaften als die Ausgangsstoffe abgetrennt werden kann. Fällungsreaktionen Beispiel: Silber in Form von Silbernitrat (AgNO3 ) soll aus einer Lösung abgetrennt werden. AgNO3 aber ist in Wasser gut löslich Ag+ + NO - -Lösung 3 + Na+ + Cl- AgCl + Na+ + NO3 Silberchlorid ist ein in Wasser sehr schlecht lösliches Salz und fällt daher aus 3.2 Dampfdruck und Destillation Ihr Dampfdruck sorgt dafür, daß Flüssigkeiten schon weit unter ihrem Siedepunkt verdunsten. Im geschlossenen System (siehe Abb. 3), sättigt sich der Gasraum über der Flüssigkeit mit Wasserdampf. Es stellt sich ein dynamisches Gleichgewicht ein, das temperatur- und druckabhängig ist. (s. a. Luftfeuchtigkeit in der Luft über See oder Meer, etc.) Die Temperaturabhängigkeit des Dampfdruckes wird durch Dampfdruckkurven beschrieben. Seite 11 Theorie-Skript zum Mediziner-Praktikum (AC) Abbildung 3: Dampf über einer Flüssigkeit ∗ dynamisches Gleichgewicht: Anzahl kondensierender Teilchen ist gleich der Anzahl verdampfender Teilchen. ∗ Keine Konzentrationsänderung in der Gasphase und der Lösung, solange Temperatur und Druck konstant sind. 3.2.1 Destillation von Gemischen Flüssigkeitsgemisch wird zum Sieden gebracht und der Dampf anschließend an anderer Stelle kondensiert und aufgefangen. Beide Komponenten gehen in die Gasphase über. Die leichter flüchtige Komponente reichert sich stärker an. Abbildung 4: Schema einer Destillationsapparatur Beispiel: Destillation eines Ethanol/Wasser-Gemisches Wasser und Ethanol mischen sich in beliebigen Mengen sehr gut und bilden eine Phase. Diese gilt es aufzutrennen. Trennprinzip: Stofftrennung aufgrund unterschiedlicher Siedepunkte von i.a. homogenen Flüssigkeitsgemischen. Seite 12 Theorie-Skript zum Mediziner-Praktikum (AC) Abbildung 5: Dampf über einem Gemisch von Flüssigkeiten 3.3 Siedepunkt: 5 Siedepunktsangaben werden auf den Luftdruck (p = 1,013 10 Pa) bezogen Siedevorgang: es gehen ständig Teilchen aus der flüssigen in die Gasphase über. Solange noch Flüssigkeit vorhanden ist, bewirkt weitere Wärmezufuhr keine Temperaturerhöhung. (Zugeführte Energie wird von Teilchen aufgenommen ⇒ kinetische Energie, Wärmebewegung) Flüssigkeit Siedepunkt Wasser 100 oC Ethanol 78 oC EtOH-H2O Gemisch Siedebereich! Ethanol reichert sich in der Gasphase an, da es einen höherer Dampfdruck besitzt. Die höher siedende Komponente (hier: H2O) reichert sich in der flüssigen Phase stärker an, als die niedriger siedende Komponente Ethanol. Verstärkte Anreicherung einer Komponente und höhere Trennwirkung erzielt man durch Mehrfachdestillation bzw. Destillation mit Kolonnen (Rektifikation). 3.4 Extraktion und NERNSTscher Verteilungssatz Grundlage: Ein Stoff ist in nicht mischbaren Phasen (heterogenes System) unterschiedlich gut löslich. Prinzip: GLEICHES LÖST SICH IN GLEICHEM !!! (Polare Substanzen lösen sich also gut in polaren Lösungsmitteln, und unpolare in unpolaren.) Flüssig-Fest-Extraktion: Beispiel Kaffee kochen ⇒ Wasser (flüssige Phase) löst bestimmte Bestandteile des festen Kaffeepulvers. Seite 13 Theorie-Skript zum Mediziner-Praktikum (AC) Flüssig-Flüssig-Extraktion: Substanz wird aus einem Gemisch extrahiert mit Hilfe eines Lösungsmittels, welches sich nicht mit der "Urlösung" mischt und die gewünschte Substanz besser löst! 3.4.1 Versuch: Stofftrennung durch Extraktion Einfaches Beispiel: Vorgelegte Lösung: Jod (I2, unpolar) in Wasser (polar) Lösungsmittel zum Ausschütteln: Heptan (unpolar) unpolares I2 löst sich besser im unpolaren Heptan als in Wasser, ein kleiner Rest Iod bleibt aber im Wasser, keine vollständige Abtrennung. Es bildet sich ein Verteilungsgleichgewicht zwischen den beiden nicht mischbaren Phasen des heterogenen Systems. Es gilt der NERNST‘sche Verteilungssatz: k = COberphase/CUnterphase k = Verteilungskoeffizient COberphase = Konz. des gelösten Stoffes in der Oberphase CUnterphase = Konz. des gelösten Stoffes in der Unterphase Im Praktikum wird ein Pflanzenextrakt, der eine Vielzahl von Stoffen enthält, mit Speiseöl (unpolar) und Speiseessig (polar) „ausgeschüttelt“, das heißt durch Schütteln in einem Reagenzglas mit Essig und Öl kommt der Extrakt mit beiden Phasen in Kontakt, und die im Extrakt enthaltenen Pflanzeninhaltsstoffe reichern sich je nach ihrer Polarität in der Öl- oder Essig-phase an. 3.5 Chromatographie und Retentionsfaktor Es gibt verschiedene Formen der Chromatographie: ∗ Dünnschicht-Chromatographie (DC) ∗ Säulen-Chromatographie (SG) ∗ Gas-Chromatographie (GC) ∗ Hochdruck-Flüssigkeits-Chromatographie (HPLC) ∗ Ionen-Chromatographie (IC) Prinzip der Chromatographie am Beispiel der Dünnschichtchromatographie(DC): Man nutzt das Verteilungsgleichgewicht von Substanzen zwischen einer festen, stationären Phase (DC-Folie, Säule) und einer flüssigen, mobilen Phase (Laufmittel = Lösemittel oder Gemisch von Lösemitteln), um Stoffgemische zu trennen. Dazu werden kleine Mengen der Gemische auf eine mit Kieselgel beschichtete Alu-Folie aufgetragen und in ein mit wenig Laufmittel (Lösemittel) gefülltes Gefäß gestellt. Das Laufmittel beginnt in Folge der Kapillarkräfte sofort an der Folie hoch zu laufen. Seite 14 Theorie-Skript zum Mediziner-Praktikum (AC) Ähnlich wie bei der Extraktion gibt es auch bei der Chromatographie ein Größe, die die Affinität einer Substanz zu den beiden Phasen zeigt. Er wird Rf –Wert (Retentionsfaktor) genannt und ist ein charakteristischer Wert für jede Substanz bei gleicher fester und flüssiger Phase. d1 R f1 = ; f d2 R f2 = f Wobei Rf immer kleiner 1 ist! Der Rf-Wert hat nicht wie bei der Extraktion mit der Löslichkeit der Substanz zu tun sondern er beschreibt wie weit sie vom Laufmittel „getragen“ wird, das heißt wie stark die aufsteigende Lösemittelfront das Substrat von der festen Phase verdrängen und mitführen kann. Da in den meisten Fällen die festen Phasen polarer gewählt werden als das Laufmittel, wollen wir deshalb eine polare feste Phase zur vereinfachenden Erläuterung des Rf-Wertes annehmen. Stationäre Phase Laufmittel Substrat Wechselwirkung Laufmittel mit stationärer Phase Wechselwirkung Substanz mit stationärer Phase RfWert Polar Unpolar Unpolar schwach Schwach Mittel Polar Polar Unpolar stark Schwach Groß Polar Unpolar Polar schwach Stark Klein Polar Polar Polar stark Stark Mittel ⇒ Je polarer das Laufmittel desto höher wird das Substrat getragen ⇒ Je unpolarer das Substrat desto höher wird es getragen Mit dieser Methode können jedoch nur kleine Mengen Substrat getrennt werden. Trägt man zu viel Substanz auf oder stellt die Folie zu weit an den Rand wobei es zu Seite 15 Theorie-Skript zum Mediziner-Praktikum (AC) einer ungleichmäßigen Benetzung kommen kann, können folgende „Pannen“ passieren, die das Auswerten erschweren: Säulenchromatographie(SC): Wenn man größere Substanzmengen trennen will, braucht man eine größere Menge an Kieselgel. Für den Fall, daß man die Substanzen nicht nur auf dem Kieselgel haben sondern noch weiter verwenden will, läßt man das Laufmittel nicht an fixiertem Kieselgel hochsteigen, sondern packt eine größere Menge in ein Glasrohr (Säule) und läßt das Laufmittel hindurchlaufen. Die Säulenchromatographie bietet die Möglichkeit, Substanzgemische aufzutrennen, die im herauslaufendem Laufmittel gelöst sind. Fängt man das Laufmittel in Portionen (Fraktionen) auf, hat man nach dem Verdampfen des Laufmittels die im Gemisch enthaltenen Substanzen getrennt vorliegen. Seite 16 Theorie-Skript zum Mediziner-Praktikum (AC) 3.5.1 Versuch: Dialyse Prinzip: "Sieb" Homogenes System, ein Lösungsmittel, in dem zwei verschiedene Substanzen gelöst sind. Die Trennung erfolgt nach Größe der Teilchen, Dialyseschlauch ist nur durchlässig für kleine Teilchen, wie Wasser und kleine Ionen. Wasser Abbildung 6: Dialyse-Schlauch enthält wässrige Lösung von Disulfinblau (großes org. Molekül) und Cobaltchlorid (Co2+ + 2 Cl-, kleine Ionen) Konzentrationsgefälle⇒ Diffusion zum Ausgleich des Gefälles 2+ Co + 2 Cl- sind klein genug, um durch die Poren des Schlauchs in das umgebende Wasser zu wandern, Disulfinblau ist zu groß, um die Poren zu passieren ⇒ Konzentrationsausgleich durch Verdünnung ⇒ H2O wandert in den Schlauch, der sich aufbläht. 3.5.2 Aufgabe Wieviel Liter CO2 entstehen bei der Verbrennung von 32 g Methan bei O2-Überschuß? CH4 n [mol]: M [g/mol]: m [g]: + 1 16 16 2 O2 CO2 2 32 64 1 44 44 + 2 H2O 2 18 36 32 g CH4 entsprechen 2 mol nach der Reaktionsgleichung folgt: aus 1 mol CH4 entsteht 1 mol CO2, ⇒ aus 2 mol CH4 entstehen 2 mol CO2, die bei Normalbedingungen und unter Annahme idealen Verhaltens ein Volumen von 2 * 22,4 L = 44,8 L einnehmen. Seite 17 Theorie-Skript zum Mediziner-Praktikum (AC) 3.5.3 Aufgabe: Ideales Gasgesetz Das ideale Gasgesetz lautet: p*V=n*R*T p = Druck [Pa] V = Volumen [m 3] n = Stoffmenge [mol] R = allg. Gaskonst. 8,314 J/mol K T = Temperatur [K], 273,15 K = 0°C p es gilt: V proportional T, wenn n und p konstant. Mit x= T lautet das ideale Gasgesetz x = (n*R)/V wobei x, n und R konstant sein sollen. Mit i als eine zunächst beliebige Indexzahl erhält man dann: pi = x*Ti Auf welches Volumen V dehnen sich 4 L Luft (bei 0 oC) beim Einatmen (Erwärmung auf 36 oC) aus? T1 = 0 °C V1 = 4 L T2 = 36 °C V2 = ? L Es gilt: V proportional T, da p konstant (Luftdruck) V1 = x *T1 ; V2 = x *T2 ⇔ V1 / T1 = V2 / T2 ⇒ V2 = V1 * T2 / T1 ⇒ V2 = 4 L * 309 K = 4,53 L 273 K Seite 18 Theorie-Skript zum Mediziner-Praktikum (AC) 4 Bindungstypen 4.1 Oktettregel: Grundlage vieler Reaktionen und damit der Bindungen ist das Bestreben von Atomen, durch Aufnahme oder Abgabe von Elektronen eine vollständig besetzte Valenzschale (Oktett, Edelgaskonfiguration) zu erreichen. Die verschiedenen Verbindungsformen und die Entscheidung über Abgabe oder Aufnahme von Elektronen sind abhängig von der Elektronegativität (EN). 4.1.1.1 Ausschnitt aus dem Periodensystem der Elemente (PSE): mit den Elektronegativitäten nach PAULING Gruppe→ 2 Periode↓ 1 1 H 2,1 2 Li Be 1,0 1,5 3 Na Mg 0,9 1,2 4 K Ca 0,8 1,0 5 Rb Sr 0,8 1,0 6 Cs Ba 0,7 0,9 ... 13 14 15 16 17 18 He ... C 2,5 Si 1,8 ... N 3,0 P 2,1 ... O 3,5 S 2,5 ... ... ... ... ... ... ... ... ... ... ... F 4,0 Cl 3,0 Br 2,8 I 2,5 ... Ne ... B 2,0 Al 1,5 ... ... Ar ... ... ... ∗ Elektronegativität EN (Tendenz Elektronen anzuziehen) nimmt in einer Periode von links nach rechts zu (Atomradius nimmt ab, da mehr Protonen im Kern die Elektronen auf der Außenschale stärker anziehen. Hierfür ist die elektrostatische Anziehung (Coulomb-Kraft) verantwortlich.) ∗ Elektronegativität EN nimmt in einer Gruppe von oben nach unten ab (Atomradius nimmt zu - mehr Schalen ⇒ größerer Abstand zw. den sich anziehenden Ladungen ⇒ Coulomb-Kraft wird schwächer). 4.2 Intramolekulare Bindungen Die Bindungen in einem Molekül bzw. Salz beruhen auf starker Wechselwirkung zwischen den Atomen. 4.2.1 Ionenbindung Beruht auf dem vollständigen Übergang der Bindungselektronen zu dem elektronegativeren Atom. Zwischen positiv und negativ geladenen Ionen wirkt eine elektrostatische Anziehungskraft, die Coulombkraft. Sie bewirkt, daß sich Seite 19 Theorie-Skript zum Mediziner-Praktikum (AC) entgegengesetzt geladene Ionen einander annähern. Sie ist abhängig von der Größe der Ladungen und vom Abstand dieser beiden Ladungen voneinander. Positive und negative Ionen können sich einander nicht unendlich weit nähern, da irgendwann Abstoßungskräfte wirksam werden (Elektronenhüllen stoßen sich ab). + + - + + + + + - + + + - + + Abbildung 7: Anordnung der Ionen in einem Kristall Oberhalb einer Elektronegativitätsdifferenz von etwa 1.8 liegen ionische Bindungen vor, unterhalb kovalente. 4.2.2 Kovalente Bindung Auch Atombindung oder Elektronenpaarbindung genannt. Die Bindung zwischen zwei Atomen kommt durch ein gemeinsames Elektronenpaar zustande: H-H unpolar H – Cl ENH = 2,1 ENCl = 3,0 polar 4.2.3 Metallbindung Ein Metallkristall besteht aus positiven Ionen und Valenzelektronen, die in diesem Kristall wie Gaspartikel frei beweglich sind (Elektronengas). 4.3 Intermolekulare Bindungen Diese Bindungen beruhen auf schwachen Wechselwirkungen zwischen Molekülen. 4.3.1 Wasserstoffbrückenbindung Im Wassermolekül ist die kovalente Bindung zwischen Sauerstoff und Wasserstoff polarisiert. Da Sauerstoff elektronegativer ist als Wasser-stoff, zieht der Sauerstoff das bindende Elektronenpaar stärker zu sich heran und wird somit negativ, der Wasserstoff positiv polarisiert. Durch diese permanenten Partialladungen kommt es zu elektrostatischen Wechselwirkungen mit anderen Wassermolekülen. Seite 20 Theorie-Skript zum Mediziner-Praktikum (AC) δ δ H H + + δ - O O δ - H H δ δ + δ + H O δ + + δ - H Abbildung 8: Wasserstoffbrücken verbinden Wassermoleküle 4.3.2 VAN-DER-WAALS-Kräfte Sie wirken zwischen einzelnen Molekülen. Es sind schwache Anziehungskräfte, die auf der Anziehung zwischen spontan induzierten und fluktuierenden Partialladungen schwach polarisierter Moleküle beruhen. + + + I2 - + + + - I2 - Abbildung 9: Iod-Moleküle werden durch VAN-DER-WAALS-Kräfte im Kristall gebunden Vergleich der Bindungskräfte: Intramol. Bindung Wasserstoffbrückenbindung Van-der-Waals-Kräfte 80-500 kJ/mol 15-25 kJ/mol 8-20 kJ/mol 5 Dynamisches Gleichgewicht Reaktion des Silberions, Komplexbildung /-zerfall, Fällungsreaktion Reaktion des Barium-Ions, Löslichkeiten von BaCO3 und BaSO4 Jede chem. Reaktion ist eine Gleichgewichtsreaktion, da sie nur bis zu einem Punkt abläuft, an dem die Reaktion in die entgegengesetzte Richtung (Bildung der Edukte) gleich schnell ist, also bezogen auf das gesamte Reaktionsgemisch keine weiteren Produkte entstehen. Solche Gleichgewichte bezeichnet man als dynamische Gleichgewichte. Allgemein: nA + mB AnBm Edukte Produkte Seite 21 Theorie-Skript zum Mediziner-Praktikum (AC) 5.1 Massenwirkungsgesetz Um die Lage eines Gleichgewichts zu beschreiben, formuliert man ein Massenwirkungsgesetz für die jeweilige Reaktion. Dieses beschreibt das Verhältnis von Produkten zu Edukten im Gleichgewicht: [A B ] n m [Produkte] K= = [Edukte] [A]n * [B]m K = Gleichgewichtskonstante = f (T,p) Stöchiometriezahlen: Die Zahlen vor den chem. Verbindungen (molare Koeffizienten) erscheinen im MWG als Exponenten. Beispiel: Im Praktikum werden Barium-Ionen mit Carbonat-Ionen gefällt: Ba2+ + CO32- BaCO3 Edukte Produkte Für diese Reaktion ergibt sich folgendes Massenwirkungsgesetz: [BaCO ] [Produkte] 3 K= = 2 + 1 [Edukte] [Ba ] * [CO 2 - ]1 3 6 Löslichkeitsprodukt Die Löslichkeit eines Stoffes gibt die Menge eines Stoffes an, die maximal in einem Lösungsmittel gelöst werden kann. Sie ist temperatur-abhängig und wird in [mol/L] angegeben. Das Löslichkeitsprodukt (Lp oder KL) ist das Maß für die Löslichkeit eines Salzes in Wasser, definiert als Produkt aus den Konzentrationen der gelösten Stoffe/Ionen. Die tabellierten Werte sind stoffspezifisch und temperaturabhängig. 6.1.1 Lösungsvorgang δ+ δ+ H δ+ + + - + + + + + - + δ + H δ- δ- O + + H O H δ + O + O lösen + H + - δ- O δ- H H δ+ δ+ H δ+ δ- H δ+ δ- H H δ+ δ+ δ+ H δ+ H O - O H δ+ + δ δ+ H δ- δ- H O Abbildung 10: Lösungsvorgang eines Salzes in Wasser Seite 22 Theorie-Skript zum Mediziner-Praktikum (AC) AmBn m An+ + n Bm- BaCO3 Ba2+ + CO32- 2 + ]1 * [CO 2 - ]1 [A n + ]m * [B m − ]n [Ba 3 K= = [A B ] [BaCO ] 3 m n Bei einer gesättigten Lösung (Bodensatz) und eingestelltem Gleichgewicht ergibt sich das Löslichkeitsprodukt Lp: 2+ 2- Lp = K * [BaCO3] = [Ba ] * [CO3 ] 6.1.2 Beispiele 1) Ba2+ + CO32- BaCO3 2+ 2- -9 2 2+ + 2 Cl Lp = [Ba ] [CO3 ] = 5*10 mol /L 2 2) PbCl2 Pb 2+ - 2 -5 - 3 Lp = [Pb ] [Cl ] = 2*10 mol /L 3 3) Al3+ + 3 Cl- AlCl3 3+ - 3 Lp = [Al ] [Cl ] 6.1.3 Aufgabe Das Löslichkeitsprodukt von Bariumcarbonat ist: -9 2 Lp = 5*10 mol /L 2 Wie groß sind die Konzentrationen der Ba Lösung? 2+ 2+ 2- und der CO3 -Ionen in der gesättigten 2- Lp = [Ba ] [CO3 ] 2+ 2- [Ba ] = [CO3 ] da nur diese vorhanden, und Ladungsausgleich erfolgen muß 2+ 2- 2+ 2 2- 2 -9 2 [Ba ] * [CO3 ] = [Ba ] = [CO3 ] = Lp = 5*10 mol /L 2+ 2- [Ba ] = [CO3 ] = Lp = 2 5 * 10 − 9 = 7*10-5 mol/L Seite 23 Theorie-Skript zum Mediziner-Praktikum (AC) 6.1.4 Aufgabe 3 Stellen Sie die Massenwirkungsgesetze für die Reaktionen 1 bis 3 auf. Vergleichen Sie K1*K2 mit K3! 1) K<<1 für: Ag+ + Cl- AgCl [ Ag+ ] * [ Cl − ] K1 = [ AgCl] 2) K>1 für: Ag+ + 2 NH3 [Ag(NH3) 2]+ Silberdiaminkomplex + [ Ag(NH 3 ) 2 ] K2 = [ Ag+ ] * [NH 3 ] 2 3) Gesamtreaktion AgCl + Ag+ + 2 NH3 K 3 = K ges Ag+ + Cl- + [Ag(NH3)2]+ [Ag+ ] [Cl - ] [[Ag(NH3 ) 2 ] + ] = [AgCl] [Ag+ ] [NH3 ] 2 = K 1 *K 2 7 Elektrochemie Versuch Leitfähigkeit, Ionisation, Dissoziation, Elektrolyte Versuch Konduktometrische Titration von HCl 7.1.1 Elektrolyt Elektrolyte sind Stoffe (Salze, Säuren, Basen), die in wäßriger Lösung in hydratisierte Ionen dissoziieren und dadurch den elektrischen Strom leiten. NaCl Na+ + Cl- HCl H+ + Cl- NaOH Na+ + OH- 7.2 Elektrisches Feld Hält man zwei Elektroden in eine Salzlösung und legt eine Spannung an, entsteht ein elektrisches Feld. Die geladenen Teilchen (Ladungsträger) wandern im Seite 24 Theorie-Skript zum Mediziner-Praktikum (AC) elektrischen Feld. Anionen (negative Ionen) wandern zur Anode (positive Elektrode), Kationen (positive Ionen) wandern zur Kathode (negative Elektrode). Dabei beobachtet man folgende Transportphänomene: 7.2.1 Massentransport Kathode Anode - + Elektr. Feld Abbildung 11: Ladungstransport durch Ionenwanderung ∗ Ionen und damit Ladungen wandern zur Elektrode ∗ Ist langsamer, da Ionen beim Wandern, u.a. auf Grund ihrer Hydrathülle mehr Widerstand erfahren. 7.2.2 Ladungstransport pos. Ladung wandert H H +O H H H O O H H Elektronen wandern H bleiben am Ort Abbildung 12: Ladungstransport durch "umklappende" Elektronenpaare ∗ Tritt nur bei Säuren und Basen auf. ∗ Es wandern keine Ionen sondern Ladungen. Säuren und Basen bilden H-Brücken aus, so daß Bindungen nur „umklappen“ müssen, um die Ladung weiterzuleiten. ∗ Ist wesentlich schneller, so daß Säuren und Basen wesentlich besser leiten. Seite 25 Theorie-Skript zum Mediziner-Praktikum (AC) 7.3 Leitfähigkeit -1 Einheit = Siemens [S] = [Ω ] spezifische Leitfähigkeit: normiert auf die Abmessungen der Elektrode K= l 1 * A R l/A = Zellkonstante R = Widerstand, 1/R = Leitfähigkeit Leitfähigkeit steigt: ∗ je höher die Ionenbeweglichkeit (je kleiner das Ion, desto beweglicher) ∗ je höher die Konzentration der Ionen (je höher der Dissoziationsgrad) ∗ je höher die Temperatur ∗ je höher die Ladung 7.3.1 Dissoziationsgrad α α= c0 − c c = 1− c0 c0 α = Anzahl der dissoziierten Moleküle c0 = Ausgangskonz. c = Konz. der undissoziierten Moleküle ∗ α~ 1 wenn c << co : Starker Elektrolyt ∗ α<< 1 wenn c ∼ co : Schwacher Elektrolyt ∗ α= 0 wenn c = co: Kein Elektrolyt Beispiel Essigsäure dissoziert in Wasser nur teilweise: CH3COOH =c0 - CH3COO + H + CH3COOH (aq) =c 7.4 Konduktometrie Bestimmung der Konzentration einer Elektrolytlösung durch eine Leitfähigkeitsmessung. Im Praktikumsversuch wird eine starke Säure (HCl) mit einer starken Base (NaOH) titriert, wobei nach jeder Basenzugabe die Leitfähigkeit der Lösung gemessen wird. Seite 26 Theorie-Skript zum Mediziner-Praktikum (AC) 7.4.1 Neutralisationsreaktion Zugabe von + Na + OH + Zugabe von + Na + OH + - 2Na - Na + Cl H3O + Cl Säure + OH + Cl -2H2O Ladungsträger: + Salz - Base, Salz Leitfähigkeit [µS] ÄP Verbrauch NaOH [ml] Abbildung 13: Titrationskurve der Konduktometrie ∗ Leitfähigkeit sinkt, da H -Ionen (Ladungstransport) durch Na -Ionen (Massentransport) ersetzt werden ⇒ geringere Leitfähigkeit. + ∗ am Äquivalenzpunkt (Schnittpunkt der beiden Geraden) sind alle H -Ionen durch OH -Ionen neutralisiert worden + ∗ Leitfähigkeit steigt durch weitere Zugabe von Na /OH -Ionen + + 7.4.2 Titrationsgleichung zur Berechnung der Konzentration der HCl-Lösung cn1 * V1 = cn2 * V2 cn1 V1 cn2 V2 gesuchte Konz. der HCl Volumen der vorgelegten HCl Konz. der NaOH Volumen der verbrauchten NaOH Seite 27 - Theorie-Skript zum Mediziner-Praktikum (AC) 8 Osmose 8.1.1 Versuch: Anorganische Gärten Wasserglas FeCl3, CaCl2, MnCl2 Osmose ist das einseitige Hindurchdiffundieren von Lösungsmittelmolekülen durch eine semipermeable Membran, diese ist nur für Lösungsmittelmoleküle durchlässig. Sind zwei verschieden konzentrierte Lösungen durch eine semipermeable Membran getrennt, so kommt es durch Diffusion der Lösungsmittelmoleküle zu einem Konzentrationsausgleich. Die Volumenzunahme auf der einen Seite der Membran hat eine Druckzunahme zur Folge, dieser Überdruck wird als osmotischer Druck (Π) bezeichnet, den man mit der PFEFFERschen Zelle messen kann. c1 < c2 c1 ≈ c2 Lösungsmittelmoleküle wandern zum Ort der größeren Konzentration Abbildung 14: Konzentrationsausgleich durch Osmose 8.1.2 PFEFFER'sche Zelle Steigrohr ∆h ∼ Π Lösung eines Stoffes i semipermeable Membran Lösungsmittel Abbildung 15: Schemat. Darstellung einer PFEFFERschen Zelle Seite 28 Theorie-Skript zum Mediziner-Praktikum (AC) 8.1.3 Osmotischer Druck Π Der osmotische Druck ist abhängig von der Konzentration aller gelösten Teilchen und von der Temperatur. Je größer die Konzentration, desto größer der Druck. Diesen Zusammenhang beschreibt die VAN't HOFF'sche Gleichung Π=c*R*T c = Konz. der gelösten Teilchen R = allg. Gaskonstante T = Temperatur [K] 8.1.4 Beispiel Welche Lösung besitzt den höheren osmotischen Druck? 0,5 m FeCl3: 4 * 0,5 mol Ionen = 2 mol 1,5 m NaCl : 2 * 1,5 mol Ionen = 3 mol 1 m Zucker : 1 * 1 mol Ionen = 1 mol 8.1.5 Dynamisches Gleichgewicht am Beispiel des HABER-BOSCH-Verfahrens: Ammoniaksynthese Hinreaktion : N2 + 3 H2 2 NH3 Rückreaktion : NH3 N2 + 3 H2 Gleichgewicht: N 2 + 3 H2 2 NH3 Edukte Produkte Massenwirkungsgesetz [NH ]2 [Produkte] 3 K= = [Edukte] [N ] * [H ] 3 2 2 K = Gleichgewichtskonstante = f (T,p) Lage des Gleichgewichtes ∗ K > 1 ⇒ GG liegt auf der Seite der Produkte ∗ K < 1 ⇒ GG liegt auf der Seite der Edukte Seite 29 Theorie-Skript zum Mediziner-Praktikum (AC) 8.1.6 Beinflussung des Gleichgewichtes 1. Zusammensetzung des Reaktionsgemisches variieren 2. Entzug des Produktes, dann wird das Produkt nachgebildet 3. Überschuß Edukt, "Verwertung" des Eduktes wird gefördert 4. äußere Bedingungen variieren a) Druck b) Temperatur 8.1.7 Aufgabe Betrachten Sie die Reaktion N2 + 3 H 2 2 NH3 + Wärme 4 Mol Gas 2 Mol Gas a) In welche Richtung verschiebt sich das System bei Temperaturerhöhung bzw. Druckverringerung? Der Einfluß äußerer Bedingungen auf die Lage eines Gleichgewichtes läßt sich durch das "Prinzip von LE CHATELIER" beschreiben: Jedes sich in einem Gleichgewicht befindliche System versucht einem äußeren Zwang auszuweichen. ∗ T-Erhöhung ⇒ GG wird zur Seite der Edukte verschoben ∗ p-Erhöhung ⇒ GG wird zur Seite der Produkte verschoben ∗ p-Erniedrigung ⇒ GG wird zur Seite der Edukte verschoben b) Durch welche Maßnahmen kann die Ausbeute der Ammoniaksynthese erhöht werden? ∗ [N2], [H2] erhöhen ∗ NH3 entfernen ∗ T erniedrigen ∗ p erhöhen c) Kann die Reaktion vollständig ablaufen? Die Reaktion kann nicht vollständig ablaufen, da sich immer ein Gleichgewicht zwischen Produkten und Edukten einstellt. Da N2 sehr reaktionsträge ist, arbeitet man in der Praxis bei einem Druck von 200 bar, einer Temperatur von 400-500°C und benutzt zusätzlich einen Katalysator, um die hohe Aktivierungsenergie des N2 herabzusetzen. Seite 30 Theorie-Skript zum Mediziner-Praktikum (AC) 8.1.8 Aufgabe Normalerweise steigt der Siedepunkt einer Verbindung mit ihrem Molekulargewicht. Begründen Sie, warum Wasser (M = 18g/mol, Siedepunkt = 100°C) dagegen einen wesentlich höheren Siedepunkt besitzt als Schwefelwasserstoff (H2S, M = 34 g/mol, Siedepunkt = -60.7°C)! H H + + H2S - O H + + H 2S - H O H-Brücken ENO = 3,5 ENH = 2,1 ∆EN = 1,4 VAN-DER-WAALS-Kräfte ENS = 2,5 ENH = 2,1 ∆EN = 0,4 9 Säuren und Basen 9.1.1 Definition nach Brönsted + Säuren: Protonendonatoren (Stoffe, die (H ) abgeben) HCl Säure Cl- + (H+) korrespondierende Base + Basen: Protonenakzeptoren (Stoffe, die (H ) aufnehmen) NH3 + (H+) NH4+ Base korrespondierende Säure Merke: + + Ein Proton (H ) kommt niemals frei vor! Wird also (H ) von einer Säure abgegeben, so muß eine Base dieses aufnehmen (z. B. Wasser, s.u.). Eine Protonenübertragungsreaktion wird als PROTOLYSE bezeichnet. 9.1.2 Beispiele für Protolysereaktionen HCl + H2O Cl- + H3O+ Säure 1 + Base 2 Base 1 + Säure 2 Seite 31 Theorie-Skript zum Mediziner-Praktikum (AC) HCl Cl- Säure 1 Base 1 H2O H3O+ Base 2 Säure 2 Korrespondierende Säure-Base-Paare NH3 + H2O NH4+ + OH- Base 1 + Säure 2 Säure 1 + Base 2 Auch bei der zweiten Reaktion gehen die jeweiligen Säure-Base-Paare ineinander über. Statt korrespondierend wird häufig der synonyme Ausdruck ‘konjugiertes Säure-Base-Paar’ verwendet. 9.1.3 Ampholyte Stoffe, die sowohl als Säure als auch als Base reagieren können (z.B. Wasser, Ammoniak (= NH3), Aminosäuren). H3O+ + Cl- H2O + HCl Base OH- + Na+ + HAc H2O + NaAc Säure (Ac = Acetat, Anion der Essigsäure) 9.1.4 Autoprotolyse Protolyse-Reaktion eines Stoffes (Ampholyten) mit sich selbst. H2O + H2O OH- + H3O+ Säure 1 + Base 2 Base 1 + Säure 2 MWG: [H O + ][OH − ] K= 3 [H O] 2 2 2 + - K [H2O] = KW = [H3O ] [OH ] Da Wasser das Lösungsmittel und in großem Überschuß ([H2O] = 55 mol/L) vorhanden ist, wird seine Konzentration als konstant angesehen und in die Gleichgewichtskonstante mit einbezogen. Seite 32 Theorie-Skript zum Mediziner-Praktikum (AC) 9.2 Ionenprodukt des Wassers (KW) Gibt an, wieviel Wasser dissoziert vorliegt und ist temperaturabhängig. + - KW = [H3O ] [OH ] = 10 -14 2 2 mol /L (bei 20°C) pKW = -lg KW = 14 Der pH-Wert (Wasserstoffionenkonzentration) von neutralem Wasser läßt sich wie folgt berechnen. + [H3O ] = [OH ], da immer gleichviel Anionen und Kationen vorhanden sein müssen = pH = K -7 = 10 mol/L W + - lg [H3O ] = 7 Gelegentlich wird auch nach der Hydroxid-Ionen-Konzentration (pOH) gefragt, sie ergibt sich aus: + - KW = [H3O ] [OH ] = 10 -14 2 2 mol /L bzw. pKw = pH + pOH = 14 9.3 Säurekonstante (KS) Maß für die Stärke einer Säure gegenüber Wasser (tabelliert in Chemiebüchern). Je größer der KS-Wert, desto stärker die Säure, desto mehr Protonen werden freigesetzt. Je stärker die Säure ist, desto weiter ist das Dissoziationsgleichgewicht auf der rechten Seite: HCl + H2O Cl- + H3O+ Säure 1 + Base 2 Base 1 + Säure 2 MWG: [Cl− ][H3 O+ ] K= [HCl][H2 O] [Cl− ][H3O+ ] K S = K [H2O] = [HCl] pKS = -lg KS KS = 10 -pKs starke Säuren: schwache Säuren: 2 KS > 10 -4 KS < 10 pKS < -2 pKS > 4 Seite 33 Theorie-Skript zum Mediziner-Praktikum (AC) 9.3.1 Beispiele: pKS- und pKB-Werte einiger Säure-Base-Paare Säurestärke pKS Säure-Base- PKB Basenstärke 20 niedrig - 17 (extrem schwache Base) - 11,9 Paar - hoch -6 HCl-Cl (starke Säure) -3 H2SO4-HSO4 2,1 H3PO4-H2PO4 4,8 HAc-Ac mittel 6,4 (H2CO3)-HCO3 (schwache Säure) 7,2 H2PO4 -HPO4 9,2 NH4 -NH3 4,8 9,2 HCN-CN - 4,8 10,4 HCO3 -CO3 niedrig 12,3 HPO4 -PO4 (extrem schwache Säure) 23 NH3-NH2 - 9,2 - - 7,6 mittel 2- 6,8 (schwache Base) + - 2- 3,6 2- 3- 1,7 hoch -9 (starke Base) - 9.4 Basenkonstante (KB) Maß für die Stärke einer Base gegenüber Wasser. Je größer der KB-Wert, desto stärker die Base. + - NH3 + H2O NH4 + OH Base 1 + Säure 2 Säure 1 + Base 2 [NH + ][OH− ] 4 K= [NH ][H O] 3 2 [NH + ][OH − ] 4 K B = K[H2 O] = [NH ] 3 MWG: pKB = -lg KB starke Base: schwache Base: 2 KB > 10 -4 KB < 10 pKB < -2 pKB > 4 Zusammenhang zwischen KS- und KB-Wert: KS*KB = KW = 10 -14 pKS + pKB = pKW = 14 Seite 34 Theorie-Skript zum Mediziner-Praktikum (AC) 9.5 Berechnung von pH / pOH-Werten Sie geben an, wie sauer bzw. wie basisch eine Lösung ist. + pH = -lg [H3O ] - pOH = -lg [OH ] 9.5.1 Starke Säuren (starke Basen) Die Säurestärke ist abhängig vom Dissoziationsgrad. Starke Säuren (pKS < -2) sind nahezu vollständig dissoziiert, d.h. es werden nahezu alle Protonen auf das + Lösungsmittel Wasser übertragen. Die Konzentration der H3O -Ionen entspricht in diesem Fall der Konzentration der Säure. Diese Bedingungen gelten analog für starke Basen. für starke Säuren gilt: + pH = -lg [Säure] = -lg [H3O ] 1m 0,1m 0,01m 0,001m HCl HCl HCl HCl ⇒ ⇒ ⇒ ⇒ pH = 0 pH = 1 pH = 2 pH = 3 für starke Basen gilt: - pOH = -lg [Base] = -lg [OH ] 0,1m 1m 10m NaOH NaOH NaOH ⇒ ⇒ ⇒ pOH = 1 pOH = 0 pOH = -1 ⇒ ⇒ ⇒ pH = 13 pH = 14 pH = 15 9.5.2 Schwache Säuren (schwache Basen) Schwache Säuren dissoziieren nicht vollständig, so dass die Konzentration der + H3O -Ionen nicht gleich der Säurekonzentration ist. Analog verhalten sich schwache Basen. Eine 0,1 molare Essigsäure liegt nur zu 1,25% dissoziert vor. H2O + HAc + - H3O + Ac (Ac = Acetat, Anion der Essigsäure, CH3COOH=HAc) [ Ac− ][H O+ ] 3 KS = [HAc] Seite 35 Theorie-Skript zum Mediziner-Praktikum (AC) Es gelten die Voraussetzungen: + - [H3O ] = [Ac ] [HAc] = [HAc]0 (Anfangskonzentration (näherungsweise)) Einsetzen in KS gibt: [H O + ] 2 K = 3 S [HAc] 0 + 2 [H3O ] = KS [HAc]0 [H O+ ] = K [HAc] 3 S 0 + -lg [H3O ] = -1/2 lg (KS [HAc]0) Für schwache Säuren gilt: pH = 1/2 (pKS - lg [Säure]0) Analog für schwache Basen: pOH = 1/2 (pKB - lg [Base]0) 9.5.3 Aufgabe Berechnen Sie den pH-Wert einer 0,2 M Salzsäure und einer 0,2 M Ammoniaklösung! (pKS (HCl) = -6, pKB (NH3) = 4,76) Da HCl eine starke Säuren ist, gilt: pH = -lg [HCl] (vollständige Dissoziation) -1 pH = -lg 2.10 pH = 0,7 Da Ammoniak eine schwache Basen ist, gilt: pOH = ½ (pKB -lg [NH3]0) pOH = ½ (4,76 -lg 2.10 ) -1 pOH = 2,7 mit pH + pOH = pKW = 14 pH = 14 - pOH pH = 11,3 Seite 36 Theorie-Skript zum Mediziner-Praktikum (AC) 10 Neutralisationsreaktionen Titration HCl mit NaOH und Titration HAc mit NaOH Reaktion zwischen einer Säure und einer Base, wobei ein Salz und Wasser entstehen. Protonen werden dabei durch Hydroxid-Ionen neutralisiert. Einzelreaktionen (bei der Herstellung der Reagenzien): + H2O + HCl - H3O + Cl Base - H2O + NaAc + OH + Na + HAc Säure Gesamtreaktion: H3O+ + Cl- + OH- + Na+ + 2 H2O + Na+ + Cl- - Da Na und Cl auf beiden Seiten unverändert in der Reaktionsgleichung auftreten, werden sie herausgekürzt und man erhält die eigentliche Reaktion: H3O+ + OH- 2 H2O 10.1 Beachtung der Stöchiometrie Für Titrationen ist die Anzahl der zu neutralisierenden Protonen wichtig, um aus der Konzentration der verbrauchten Base die unbekannte Konzentration der Säure zu errechnen. Da aber die Molarität einer Lösung nicht immer direkt der Anzahl der entstehenden Protonen entspricht, muß man beachten, wieviele Protonen pro Formeleinheit die Säure freisetzt: + + HCl: H + Cl 1M ⇒ 1 mol H = aktive Teilchen + 2+ H2SO4: 2 H + SO4 1M ⇒ 2 mol H + 3+ H3PO4: 3 H + PO4 1M ⇒ 3 mol H - Zur Neutralisierung von 1 mol HCl benötigt man nur 1 Mol OH , für H2SO4 aber schon 2 Mol und für H3PO4 3 Mol. 10.1.1 Aufgabe 1 Liter Lösung einer starken Säure hat den pH-Wert 0. Wieviel mL einer 10m Natronlauge benötigt man zur Neutralisation? + [H3O ] = 10 -pH 0 = 10 = 1 mol/L cn1 . V1 = cn2 . V2 c ⋅V 1 ⋅ 1000 mL V = n2 2 = 1 c 10 n1 V1 = 100 mL Seite 37 Theorie-Skript zum Mediziner-Praktikum (AC) 10.2 pH-Verlauf bei Säure-Base-Titrationen 10.2.1 Endpunktbestimmung kann durch ∗ Leitfähigkeit ∗ pH-Verlauf ∗ Indikatoren erfolgen. 10.2.2 Starke Säure / starke Base Titration von HCl mit NaOH pH WP = ÄP = NP pH 7 x [mL] Zugabe NaOH Abbildung 16: Titrationskurve Starke Säure/Starke Base ∗ steiler pH-Sprung am Äquivalenzpunkt (ÄP) ∗ der ÄP entspricht dem Wendepunkt der Kurve ∗ ÄP und NP (Neutralpunkt) fallen zusammen: + [OH ]zugetropft = [H3O ]vorgelegt nach Zugabe des Volumens x NaOH Seite 38 Theorie-Skript zum Mediziner-Praktikum (AC) 10.2.3 Schwache Säure / starke Base Titration von CH3COOH mit NaOH pH 2.WP = ÄP pH 7 = NP pKs 1.WP x1 x2 [mL] Zugabe NaOH Abbildung 17: Titration Schwache Säure/starke Base ∗ die Kurve besitzt zwei Wendepunkte ∗ der erste Wendepunkt entspricht dem pKS-Wert, im Bereich rechts und links dieses Punktes ist der pH-Wert während Zugabe von NaOH konstant. ∗ der zweite Wendepunkt entspricht dem ÄP, erreicht bei Zugabe von x2 mL NaOH ∗ ÄP und NP (bei x1) fallen nicht zusammen ∗ ÄP liegt im basischen, da das Acetat-Ion eine stärkere Base ist als Wasser und somit zusätzlich OH -Ionen freisetzt Grund: Neutralisationsreaktion H3O+ + Ac- + Na + + OH- 2 H2O + Ac- + Na+ Acetat-Reaktion mit Wasser H2O + Ac- OH- + HAc 11 Indikatoren Indikatoren sind organische Farbstoffe, die selbst schwache Säuren oder Basen sind und bei ihrer Protonierung bzw. Deprotonierung eine Farbänderung zeigen. Jeder Indikator hat einen speziellen pH-Bereich, in dem die Farbe umschlägt. Der Indikator wird so gewählt, dass er im Bereich des Umschlagspunktes der Säure/Base Reaktion einen Farbwechsel zeigt. Die schwachen Säuren und ihre korrespondierenden Basen werden wie andere Säure-Base-Paare auch durch ihre Säurekonstante KSInd charakterisiert. HInd + H O 2 H O+ + Ind3 Seite 39 Theorie-Skript zum Mediziner-Praktikum (AC) [H 3 O + ][Ind− ] K SInd = [HInd] pH = pK SInd + lg [Ind− ] [HInd] Das menschliche Auge erfasst die reine Farbe der Säure bzw. der Base dann, wenn ein Konzentrationsverhältnis vorliegt von: - [HInd] : [Ind ] = 10 : 1 bzw. 1 : 10 Aus der obigen Gleichung ergibt sich für diesen Wechsel folgendes pH-Intervall: pH = pKSInd + lg 10 = pKSInd + 1 pH = pKSInd + lg 0,1 = pKSInd - 1 12 Puffersysteme Versuch zur Pufferwirkung von Natriumacetat Puffer sind Lösungen, die in der Lage sind, den pH-Wert von Lösungen bei Zugabe von Säure oder Base konstant zu halten. Um Säuren und Basen neutralisieren zu können, muß die Pufferlösung selbst eine Säure und eine Base enthalten. Geeignet zur Herstellung von Puffern sind schwache Säuren und deren korrespondierende Basen. - CH3COOH / CH3COO 2HCO3 / CO3 2H2PO4 / HPO4 pH = 4,75 pH ≈ 10-11 pH ≈ 6-8 Gepuffert wird nur in einem bestimmten pH-Bereich: pH = pKS +/- 1 Das Pufferoptimum liegt bei pH = pKS, da hier die Konzentration der Säure genauso groß ist wie die Konzentration der korrespondierenden Base und somit gleich viel Säure bzw. Base abgefangen werden kann. Die Pufferkapazität gibt an, wieviel Säure bzw. Base abgefangen werden kann. Sie hängt von der Konzentration der schwachen Säure und der ihrer korrespondierenden Base ab. ∗ Abfangen einer Base CH3COOH + OH - - CH3COO + H2O ∗ Abfangen einer Säure + CH3COO + H3O CH3COOH + H2O Seite 40 Theorie-Skript zum Mediziner-Praktikum (AC) 12.1.1 Puffergleichung: Henderson-Hasselbach Mit Hilfe dieser Gleichung ist eine genaue pH-Einstellung der Pufferlösung möglich. Hier wird ein Beispiel eines Essigsäure/Acetat-Puffers vorgestellt. Analoge Überlegungen lassen sich auch für andere Puffersysteme anstellen, indem [Ac ] durch die Konzentration des basischen Salzes und [HAc] durch die der korrenpondierenden Säure ersetzt wird. H3O + + Ac- HAc + H2O [H3 O+ ][ Ac − ] KS = [HAc] [H3 O + ] = K S [HAc] [ Ac − ] pH = pK S + lg [ Ac − ] [HAc ] 12.1.2 Versuch: Herstellen eines Puffers Stellen Sie 50mL eines Essigsäure/Acetat-Puffers mit dem pH= 5 her. Es gilt die Henderson-Hasselbach-Gl. (s.o.). Es werden 10mL 1M Essigsäure vorgegeben. (= 10mmol) Umwandlung der Gleichung: - lg [Ac ] = pH - pKs + lg [HAc] mit cm = 10mmol/50mL = 0,2 mmol/mL = 0,2 mol/L folgt: - lg [Ac ] = 5 - 4,75 + lg 0,2 = -0,449 - [Ac ] = 0,356 mmol/mL da cn = n / V n = cn * V n = 0,356 mmol/mL *50 mL n = 17,8 mmol mit m = n * M und MNaAc = 82 g/mol m = 1460 mg Seite 41 Theorie-Skript zum Mediziner-Praktikum (AC) 12.2 pH-Verlauf eines Puffersystems pH pKs Pufferbereich Abbildung 18: Lage des Pufferbereichs pH pKS3=12,3 2- HPO 4 + OH - 3PO 4 + H2O H2PO 4- + OH pKS2=7,2 - - H3PO4 + OH pKS1=2,2 1 2- HPO4 + H2O H2PO4 + H2O 2 3 Mol NaOH pro Mol H3PO 4 Abbildung 19: Eine mehrprotonige Säure wie die Phosphorsäure kann mehrere Puffer-Bereiche haben Seite 42 Theorie-Skript zum Mediziner-Praktikum (AC) 13 Redoxreaktionen 13.1 Definitionen 13.1.1 Oxidation Abgabe von Elektronen und damit Erhöhung der Oxidationszahl. Na0 Na+ + e- 13.1.2 Reduktion Aufnahme von Elektronen und damit Erniedrigung der Oxidationszahl. Cl20 + 2 e- 2 Cl- 13.1.3 Redoxreaktion Gekoppelte Gesamtreaktion aus Oxidation und Reduktion (ElektronenÜbertragungs-Reaktion). Cl20 + 2 Na0 2 Cl- + 2 Na+ - + Na gibt Elektronen (e ) ab, ist also Reduktionsmittel, wird oxidiert zu Na . Cl2 nimmt Elektronen (e ) auf, ist also Oxidationsmittel, wird reduziert zu Cl . 13.1.4 Oxidationsmittel ∗ Nimmt Elektronen auf. ∗ Stoff, der einen anderen oxidiert und dabei selbst reduziert wird. ∗ Z.B. Sauerstoff, Halogene, Verb. mit viel Sauerstoff. 13.1.5 Reduktionsmittel ∗ Gibt Elektronen ab. ∗ Stoff, der einen anderen reduziert und dabei selbst oxidiert wird. ∗ Z.B. Alkalimetalle, Erdalkalimetalle. 13.1.6 Oxidationszahlen Fiktive Größe zur Beschreibung der Bindungsverhältnisse in Molekülen. Sie gibt an, welche theoretische Ladung ein Element in einer Verbindung tragen würde, wenn die bindenden Elektronen zum jeweils elektronegativeren Atom gezählt würden. Die Oxidationszahlen werden in römischen Ziffern angegeben. Seite 43 Theorie-Skript zum Mediziner-Praktikum (AC) Kennt man die Strukturformel der Verbindung, so ist die Zuordnung der Oxidationszahlen einfach: Z.B. Wasser -II O H H +I +I ENO = 3,5 ENH = 2,1 ∆EN = 1,4 Die Bindungselektronenpaare werden dem Atom mit der höheren Elektronegativität (EN) zugeordnet. In diesem Fall also dem Sauerstoff (Oxidationszahl -II). 13.1.7 Regeln zur Bestimmung der Oxidationszahlen Die obigen Überlegungen kann man für die Festlegung der Oxidationszahlen in folgende 6 Regeln zusammenfassen. Mit diesen Regeln können fast alle Fälle richtig entschieden werden. Wichtig: Diese Regeln von oben nach unten befolgen!! Wenn das beachtet wird, sind auch die meisten Ausnahmen erfasst: 1. Elementar vorliegende Stoffe haben die Oxidationszahl 0 2. Summe der Oxidationszahlen ist gleich der Gesamtladung des Teilchens 3. Metalle haben positive Oxidationszahlen (Alkali +I, Erdalkali +II) 4. Wasserstoff: +I 5. Sauerstoff: -II 6. Halogene: -I 13.1.8 Beispiele: HF (Fluor ist das elektronegativste Element, und hat daher immer die Oxidationszahl -I) Cl2 NH3 0 H =+I, N =-III H2SO4 H = +I, O = -II, S = +VI MnO4 - SO3 2- O = -II, S = + IV H2O2 O = -II, Mn = +VII H = +I, O = -I HCCl3 Fe(SCN)3 H = +I, Cl = -I, C = +2 Fe = +III Na2S2O3 Na = +I, O = -II, S = +II S4O6 2- O = -II, S = +2,5 Seite 44 Theorie-Skript zum Mediziner-Praktikum (AC) 13.1.9 Aufgabe Wodurch unterscheiden sich Redoxsysteme prinzipiell von Säure-Base-Paaren? Woran erkennen Sie eine Reduktion / Oxidation? Säure-Base-Reaktion: + Übertragung eines (H )-Ions von einer Säure (Protonendonator) auf eine Base (Protonenakzeptor) ohne Veränderung der Oxidationszahlen . HCl + H2O Cl- + H3O+ Säure 1 + Base 2 Base 1 + Säure 2 Redox-Reaktion: Übertragung eines Elektrons von einem Elektronendonator auf einen Elektronenakzeptor, die eine Veränderung der Oxidationszahlen zur Folge hat. 2 Na + Cl2 2 Na+ + 2 Cl- Red 1 + Ox 2 Ox 1 + Red 2 Das heißt, analog dem Säure-Base-Paar wird auch hier ein Redox-Paar gebildet. 13.1.10 "Triebkraft der Redoxreaktionen": Bestreben der Elemente, die Edelgaskonfiguration (vollbesetzte Außenschale energieärmerer Zustand) zu erreichen, meßbar in den chemischen Potentialen. 13.1.11 Aufstellung von Reaktionsgleichung: 1. Redoxpaare suchen (aus der Aufgabenstellung: was wird reduziert, was oxidiert?) 2. Teilgleichungen aufstellen a) Produkt und Edukt ins stöchiometrische Verhältnis bringen, d.h. zuerst gleichviele Nicht-H und Nicht-O-Atome auf beide Seiten b) Abgleich der Oxidationszahldifferenz durch Hinzufügen von e + c) Ladungen ausgleichen durch Hinzufügen von H3O bzw. OH d) Stöchiometrie H- und O-Atome ergänzen durch Hinzufügen von H2O 3. Teilgleichungen einander anpassen (e -Anzahl in beiden Gleichungen angleichen, den benutzten Faktor auf alle Reaktionsteilnehmer anwenden) 4. Gesamt-Redox-Gleichung aufstellen (Teilgleichungen addieren), auf beiden Seiten vorhandene Teilchen streichen Seite 45 Theorie-Skript zum Mediziner-Praktikum (AC) 13.2 Beispiele + 13.2.1 Versuch: Oxidation von Zn mit H3O ! Ox: Zn0 Zn2+ + 2 e- 2 H3O+ + 2 e- H20 + H2O Red: Gesamt: + 0 2 H3O + Zn 2+ Zn 0 + H2 + 2 H2O 13.2.2 Versuch: Redoxtitration Iodometrie 1. Schritt: Kupfer(II)-Lsg. und Kaliumiodid im Überschuß reagieren in saurer Lösung: Ox.: 2 I- I2 + 2 e- Cu2+ + e- Cu+ 2 Cu2+ + 4 I- 2 CuI + I2 Red.: Gesamt: 2. Schritt: Titration des Iod mit Natriumthiosulfatlösung bis die Blaufärbung des IodStärkekomplexes verschwindet: Ox.: 2 S 2O32- S4O62- + 2 e- I2 + 2 e- 2 I- I2 + 2 S2O32- 2 I- + S4O62- Red.: Gesamt: Seite 46 Theorie-Skript zum Mediziner-Praktikum (AC) 2- - 13.2.3 Oxidation von SO3 mit MnO4 in saurem Milieu Ox: SO32- + 3 H2O SO42- + 2 e- + 2H3O+ Red: MnO4- + 8 H3O+ + 5 e- Mn2+ + 12 H2O Gesamt: 2 MnO4- + 6 H3O+ + 5 SO322- 2 Mn2+ + 9 H2O + 5 SO42- 13.2.4 Oxidation von SO3 mit MnO4 in alkalischem Milieu Ox: SO32- + 2 OH- SO42- + 2 e- + H2O Red: MnO4- + 2 H2O + 3 e- MnO2 + 4 OH- Gesamt: 2 MnO4- + H2O + 3 SO32- 2 MnO2 + 2 OH- + 3 SO42- 13.3 Elektrochemische Potentiale 13.3.1 Redoxpotential Es ist ein Maß für die relative Stärke eines Oxidationsmittels bzw. Reduktionsmittels, d.h. für die Tendenz eines Teilchens Elektronen aufzunehmen oder abzugeben. Es ist eine meßbare Größe, die auf der Änderung der freien Enthalpie ∆G bei der Elektronenaufnahme bzw. -abgabe beruht. 13.3.2 Halbzelle Ist ein vollständiges Redox-Paar, d.h. reduzierte und oxidierte Form liegen nebeneinander vor. Dabei verlassen Ionen die Metalloberfläche der Elektrode, Elektronen bleiben im Metall. Dadurch entsteht ein elektrisches Potential. 2+ Z.B. ein Zink-Blech (Metall = reduzierte Form) taucht in eine Zn -Lösung (Metallsalz = oxidierte Form), wie in Abbildung 20 (nächste Seite, rechte Halbzelle) dargestellt. Es liegen also vor: Zn0 Zn2+ + 2 e- Red. Ox. Seite 47 Theorie-Skript zum Mediziner-Praktikum (AC) Dieses Potential kann nur gegen eine andere Halbzelle gemessen werden. Um die Potentiale verschiedener Halbzellen vergleichen zu können, wählt man die Normalwasserstoffelektrode (= NWE, Abbildung , linke Halbzelle) als Bezugspunkt mit dem gesetzten Potential E0 = 0V. Potentiale von Halbzellen gemessen gegen die NWE unter Normbedingungen werden Normalpotentiale genannt. Diese werden in der elektrochemischen Spannungsreihe tabelliert. 13.3.3 Normal-Wasserstoff-Elektrode (NWE) Zugrundeliegende Reaktion: 2 H3O+ + 2 e- H2 + H2O Ox Red 13.3.4 Merke: Redoxpotentiale sind temperatur- und konzentrationsabhängig. Um also reproduzierbare Werte für Redoxpotentiale zu messen und diese anschließend tabellieren zu können, hat man die Meßbedingungen normiert: T = 298,15 K (25°C) cn = 1 mol/L (aller beteiligten Lösungen) p = 1 bar Meßgerät H2 1bar Salzbrücke PtDraht H3O 2+ H3O + Zn + H3 O H3O H3 O + H3 O Zn + + 2+ Zn Zn + Zinkblech 2+ 2+ 2+ Zn Zn 2+ 1 m H3O -Lösung + Zn -Lösung 2+ NWE Vergleichs-Halbzelle Abbildung 20: NWE gegen eine Zink-Halbzelle geschaltet Seite 48 Theorie-Skript zum Mediziner-Praktikum (AC) Durch die Salzbrücke werden die Lösungen elektrolytisch leitend verbunden, ohne sie würde die Reaktion zum Stillstand kommen. Seite 49 Theorie-Skript zum Mediziner-Praktikum (AC) Seite 50 Theorie-Skript zum Mediziner-Praktikum (AC) Informationen aus der Spannungsreihe ∗ Gibt man zwei Redoxpaare zusammen (unter Normalbedingungen), so kann man mit Hilfe der Spannungsreihe voraussagen, welcher Stoff reduziert (Redox-Paar mit positiverem E0) und welcher Stoff oxidiert wird (Redox-Paar mit negativerem E0). ∗ Anordnung der Redoxpaare entsprechend ihrer Normalpotentiale, d.h. nach ihrem Redox-Verhalten ∗ Halbzellen, die gegenüber der NWE reduzierend wirken, selbst also oxidiert werden, haben ein negatives Normalpotential. ∗ Je negativer E0, desto leichter wird das Redox-Paar oxidiert. ∗ Halbzellen, die gegenüber der NWE oxidierend wirken, selbst also reduziert werden, haben ein positives Normalpotential. ∗ Je positiver E0, desto leichter wird das Redox-Paar reduziert. ∗ Unedle Metalle: Metall-Redox-Paare mit negativem Potential. Edle Metalle: Metall-Redox-Paare mit positivem Potential. 13.3.5 Beispiel 2+ 0 Versuch: Reaktion von Cu mit Fe Ein Eisennagel taucht in Cu(II)-Lösung Abbildung 21: Schematische Darstellung des Auflösungsprozesses eines Eisennagels Fe Fe2+ + 2 e- E0= -0,44V Cu Cu2+ + 2 e- E0= +0,34V ⇒ Fe + Cu 2+ Fe2+ + Cu Seite 51 Theorie-Skript zum Mediziner-Praktikum (AC) 14 NERNST'SCHE GLEICHUNG Reale Potentiale sind abhängig von: ∗ Temperatur ∗ Konzentration ∗ Druck Der Zusammenhang zwischen dem Potential und den Reaktionsbedingungen (Druck, Temperatur und Konzentration) wird durch die NERNST’sche GLEICHUNG beschrieben: E = E0 + R* T [ Ox] * ln n *F [Re d] E = reales (momentanes) Potential [V] E0 = tabelliertes Normalpotential [V] R = Allgemeine Gaskonstante = 8,314 J / mol K n = Anzahl der ausgetauschten Elektronen F = Faraday-Konstante = 96 400 C / mol T = Temperatur (298,15 K = 25°C) [Ox] = Konz. (Partialdruck bei Gasen) der ox. Form [Red] = Konz. (Partialdruck bei Gasen) der red. Form Ersetzt man den natürlichen Logarithmus (zur Basis e (Euler’sche Zahl)) durch den dekadischen Logarithmus (zur Basis 10) und fasst diesen mit den konstanten Größen (T,R,F) zusammen, ergibt sich für T = 25°C die vereinfachte NERNST’sche GLEICHUNG: E = E0 + 0,059 V [Ox] * log n [Re d] Weitere Vereinfachung für Halbzellen, bei denen ein elementares Metall in die dazugehörige Metall-Ionen-Lösung taucht: Konzentration der reduzierten Form (elementares Metall) =1 mol/L E = E0 + 0,059 V * lg[Ox ] n 2+ - 14.1.1 Redoxgleichung für das Redox-Paar Mn /MnO4 : MnO4- + 8 H3O+ + 5 e- Mn2+ + 12 H2O Somit ergibt sich für die Nernst-Gleichung: − E = E0 + [MnO 4 ] * [H3 O + ]8 0,059 V * lg 5 [Mn 2+ ] * [H 2 O]12 Seite 52 Theorie-Skript zum Mediziner-Praktikum (AC) Wasser ist im großen Überschuß als Lösungsmittel ⇒ [H2O] = konst. = 1 also: − E = E0 + [MnO 4 ] * [H3 O + ]8 0,059 V * lg 5 [Mn 2 + ] + 8 Das Potential ist also pH-abhängig: [H3O ] 14.2 Elektromotorische Kraft (EMK) ∗ Spannungs- bzw. Potentialdifferenz zwischen zwei Halbzellen bzw. Redoxpaaren. ∗ Maß für die „Triebkraft“, die in der gesamten Redoxreaktion steckt (nämlich der freien Reaktionsenthalpie ∆G, näheres im Kapitel Thermodynamik). 14.2.1 Allgemein gilt nach Nernst : EMK = Er - Eo Index r: reduziertes Redoxpaar bzw. Paar mit dem größeren Potential, das also edler ist Index o: oxidiertes Redoxpaar bzw. Paar mit dem kleineren Potential, das also unedler ist EMK = E 0r − E 0 o + [Ox r ] * [Re do ] 0,059 V * lg [Re dr ] * [Ox o ] n 14.3 Galvanisches Element: Die Kombination zweier Halbzellen, die durch eine Salzbrücke leitend miteinander verbunden sind, wird allgemein galvanisches Element genannt. Die Salzbrücke dient dem Ionenausgleich, damit beide Systeme elektroneutral bleiben. Zur Anode (positive Elektrode) wandern die Anionen (negativ geladene Ionen) und geben dort ihre Elektronen ab. Zur Kathode (negative Elektrode) wandern die Kationen (positiv geladene Ionen) und nehmen dort Elektronen auf. 14.3.1 Versuch: Daniell-Element Beim Daniell-Element werden zwei Halbzellen mit Kupfer- und Zinkelektroden sowie deren Salzlösungen gekoppelt. Man mißt solange eine Spannungsdifferenz bis die Konzentration der ‘unedleren Halbzelle’ soweit angestiegen ist, dass der konzentrationsabhängige Teil der Nernstschen Gleichung die Differenz der Normpotentiale ausgleicht. Seite 53 Theorie-Skript zum Mediziner-Praktikum (AC) Zn Zinkblech 2+ Zn2+ Zn Zn Cu2+ 2+ Cu 2+ Cu2+ 2+ Zn2+ 2+ 2+ Cu2+ Cu2+ 2+ Zn Zn Kupferblech Cu2+ Zn2+ Zn Cu2+ Zn2+ Cu 2+ Cu2+ 2+ Cu Abbildung 22: Daniell-Element Zn2+-Lösung Cu2+-Lösung Zn2+ + 2 e- Zn Cu2+ + 2 e- E0 = - 0,76 V Anode (Ort der Oxidation) Materialabnahme Gesamtreaktion: Cu E0 = + 0,35 V Kathode (Ort der Reduktion) Materialzunahme Cu2+ + Zn Cu + Zn2+ [Cu2 + ][ Zn] 0,059 V * lg [Cu][ Zn 2+ ] 2 da [Cu] = [ Zn ] = 1mol / L EMK = E 0 Cu − E 0 Zn + EMK = E 0 Cu − E 0 Zn 0,059 V [Cu2 + ] * log + 2 [ Zn 2 + ] Seite 54 Theorie-Skript zum Mediziner-Praktikum (AC) 14.3.2 Konzentrations-Element Auch wenn zwei gleichartige Halbzellen mit unterschiedlichen Konzen-trationen in den Lösungen zusammengeschaltet werden, kann man solange eine Spannungsdifferenz (EMK) messen, bis die Konzentrationen ausgeglichen sind. Zinkblech 2+ Zn Zinkblech 2+ Zn 2+ Zn 2+ Zn 2+ Zn 2+ Zn 2+ Zn 2+ Zn 2+ Zn 2+ 2+ Zn 2+ Zn Zn Zn2+ Zn2+ 2+ Zn Abbildung 23: Im Konzentrationselement sind in den Lösungen verschiedene Ionenkonzentrationen vorhanden 1 mol/L Zn2+-Lösung 0,01 mol/L Zn2+-Lösung Zn2+ + 2 e- Zn E r = − 0 ,76 V + 1mol / L 0 ,059 V * log 2 1mol / L = − 0 ,76 V Zn2+ + 2 e- Zn E o = − 0,76V + 0,059V 0,01 mol/L * log 2 1mol/L = − 0,819V Potential größer Potential kleiner das heißt: EMK = Er - Eo EMK = - 0,76 - (- 0,819) = 0,059 V oder 0,059 V 1mol / L * 1mol / L EMK = − 0,76 − (−0,76) + * log 2 1mol / L * 0,01mol / L = 0,059 V 14.3.3 Aufgabe Ein Daniell-Element bestehe aus 1L einer 1m ZnSO4-Lösung, in die eine ZnElektrode eintaucht, und einer Kupferelektrode, die in eine 1m CuSO4-Lösung eintaucht. Beide Lösungen sind durch ein Diaphragma getrennt. Berechnen Sie die EMK dieser Zelle bei 25°C a) zu Beginn b) nachdem 50% der Cu-Ionen verbraucht wurden c) nachdem 99.9% der Cu-Ionen verbraucht wurden! Seite 55 Theorie-Skript zum Mediziner-Praktikum (AC) Ox: Zn Red: Cu2+ + 2 e- Zn2+ + 2 e- E0 = - 0,76 V Cu E0 = + 0,35 V a) Es folgt für die EMK zu Beginn: [Cu2 + ][Zn] 0,059V * lg 0Cu 0Zn 2 [Cu][Zn 2 + ] 1mol/L * 1mol/L 0,059V * lg EMK = 0,35 − (−0,76) + = 1,11V 2 1mol/L * 1mol/L EMK = E −E + b) Es folgt für die EMK (50%): 2+ Anfangskonzentration: [Cu ] 1mol/L ⇒ - 50% ⇒ 0.5mol/l 2+ Anfangskonzentration: [Zn ] 1mol/L ⇒ + 50% ⇒ 1.5mol/L EMK = 0,35 − (−0,76) + 0,059 V 0,5mol / L * 1mol / L * log = 1,096 V 2 1mol / L * 1,5mol / L c) Es folgt für die EMK (99,9%): 2+ Anfangskonzentration: [Cu ] 1mol/L ⇒ - 99,9% ⇒ 0,001 mol/L 2+ Anfangskonzentration: [Zn ] 1mol/L ⇒ + 99,9% ⇒ 1.999 mol/L EMK = 0,35 − (−0,76) + 0,059 V 0,001mol / L * 1mol / L * log = 1,013 V 2 1mol / L * 1,999mol / L 14.3.4 Zusammenhang der Gleichgewichtskonstanten K mit der EMK Für eine Gleichgewichtsreaktion: Cu2+ + Zn Cu + Zn2+ EMK = E 0 Cu − E 0 Zn + 0,059 V [Cu 2 + ][ Zn ] * lg 2 [Cu ][ Zn 2 + ] = E 0 Cu − E 0 Zn − 0,059 V [Cu][ Zn 2 + ] * lg 2 [Cu 2 + ][ Zn ] mit [Cu][ Zn2+ ] K= [Cu2+ ][Zn] EMK = E 0 Cu − E 0 Zn − 0,059 V * lgK 2 Seite 56 Theorie-Skript zum Mediziner-Praktikum (AC) allgemein: EMK = E 0r − E 0O − 0,059 V * lg K n Mit Hilfe dieser Gleichung kann man also aus messbaren Potentialdifferenzen die Gleichgewichtskonstante K für eine Reaktion berechnen. 14.3.5 Aufgabe Im Gleichgewicht ist das Bestreben der Redoxreaktion weiterzureagieren nicht mehr vorhanden, deswegen ist auch die EMK = 0. Wie lässt sich die Gleichgewichtskonstante K des Daniell-Elements mit Hilfe der Halbzellen-Potentiale berechnen? Eo Zn/Zn2+ = - 0,76 V Eo Cu/Cu2+ = + 0,35 V EMK = E0 Cu − E0 Zn − ∆E0 = R* T * ln K n *F ln K = n*F * ∆E0 R* T ln K = ∆E0 * n*F R*T R* T * ln K = 0 n*F ∆E 0 * und damit K=e n*F R* T Seite 57 Theorie-Skript zum Mediziner-Praktikum (AC) 15 Koordinative Bindung Der Bindungstyp in Komplexen wird koordinative Bindung genannt. Die Elektronen für diese Bindung werden nur von einem Bindungspartner (Ligand) geliefert, während der andere, das Zentralatom, "Elektronenlücken", d.h. leere Orbitale besitzt. Das Zentralatom ist üblicherweise positiv geladen oder neutral, die Liganden sind normalerweise neutral oder negativ geladen. Da jedes Orbital mit zwei Elektronen besetzt werden kann, steuert jeder Ligand mindestens ein Elektronenpaar (= zwei Elektronen) zur Bindung bei. 2- Zentralatom (Z) Ligand (L) z.B. [CoCl4] 2+ aus Co und 4 Cl L L Cl Co Z L Cl 2- L Cl Cl 15.1 Begriffe zur koordinativen Bindung 15.1.1 Koordinationszahl Die Koordinationszahl ist die Anzahl der vom Zentralatom ausgehenden koordinativen Bindungen, diese stimmt nicht immer mit der Anzahl der Liganden überein (Zähnigkeit, s.u.). Sie ist abhängig davon, wieviele Elektronen dem Zentralatom zur Erreichung der Edelgaskonfiguration fehlen. Oft ist das Zentralatom ein Nebengruppenelement, und dann werden zum Erreichen der Edelgaskonfiguration 18 Elektronen benötigt (18-Elektronen-Regel). 4 Elektronen fehlen ⇒ 2 koordinative Bindungen 6 Elektronen fehlen ⇒ 3 koordinative Bindungen 8 Elektronen fehlen ⇒ 4 koordinative Bindungen 12 Elektronen fehlen ⇒ 6 koordinative Bindungen 15.1.2 Struktur Die räumliche Struktur eines Komplexes hängt von der Anzahl der Liganden ab. Die Liganden ordnen sich räumlich so an, dass sie die maximale Entfernung zu einander haben: 2 Liganden: Linear 4 Liganden: Tetraedrisch, quadratisch planar 6 Liganden: Oktaedrisch Seite 58 Theorie-Skript zum Mediziner-Praktikum (AC) 15.1.3 Liganden Als Liganden sind Atome oder Moleküle geeignet, die freie Elektronenpaare besitzen, die sie in eine koordinative Bindung einbringen können, z.B.: H2O, NH3, Cl , CN , CO 15.1.4 Zähnigkeit Anzahl der Bindungen, die ein Ligand zum Zentralatom ausbilden kann. Wird nur eine Bindung ausgebildet, so ist der Ligand einzähnig. Wenn aber zwei oder mehr Bindungen ausgebildet werden, so bezeichnet man den Liganden als mehrzähnig oder als Chelat-Liganden (griechisch: Krebsschere), z.B. Glycin (s. unten). 15.1.5 Ambident Moleküle, die entweder über das eine oder andere Atom koordinieren können, werden als ambident bezeichnet, Beispiel: CO (siehe nächste Seite.) 15.1.6 Schreibweise von Komplexen ∗ ∗ ∗ ∗ Komplex steht in eckigen Klammern Zentralatom wird zuerst genannt Anionische Liganden kommen vor neutralen Liganden Ladung des Komplexes steht außerhalb der Klammer +I 0 [Ag(NH3)2]+ +II -I 0 [Fe(CN)(H2O)5]+ +II 0 [Cu(en)2]2+ 15.1.7 Aufgabe Welche der nachfolgend aufgeführten Ionen und Moleküle können als Komplexliganden auftreten? Wieviel zähnig sind die Liganden? H N H H 1-zähnig O H H N H 1-zähnig H + H H kein Ligand Seite 59 Theorie-Skript zum Mediziner-Praktikum (AC) + O H H2N H2N H H CH2 Kein Ligand - C N CH2 2-zähnig C N - - O+ C 1-zähnig, ambident C Cl- O 1-zähnig, ambident 1-zähnig Versuch: Darstellung des Bis(glycin)kupfer-(II)-Komplexes CH 2 CO H 2N Cu O - O - 2+ H 2N CH 2 CO Kupfer ist vierfach koordiniert, Glycin ist ein zweizähniger, chelatisierender Ligand 15.1.8 Gleichgewichtskonstante Versuch: Komplex-Reaktionen des Kobalts (Co) Auch Komplexbildungsreaktionen sind Gleichgewichtsreaktionen: Co2+ + 4 Cl- [CoCl4]2- Von links nach rechts läuft die Bildungsreaktion ab, dafür gilt die Gleichgewichtskonstante KBildung. Von rechts nach links läuft die Zerfallsreaktion ab, hier gilt KZerfall. K Bildung = CoCl 4 2− 4 C o 2 + ⋅ C l− K Zerfall = 4 Co2 + ⋅ Cl− CoCl 4 2− KBildung = 1 / KZerfall Seite 60 Theorie-Skript zum Mediziner-Praktikum (AC) KZerfall ist ein Maß für die Stabilität eines Komplexes. Je kleiner Kzerfall ist, desto stabiler ist der Komplex. Für KBildung gilt das Umgekehrte! Komplexe können an chemischen Reaktionen beteiligt sein. Ein Beispiel ist eine Ligandenaustauschreaktion, bei der einige oder alle Liganden ausgetauscht werden: [CoCl4]2- + 2 SCN- [Co(SCN)2] + 4 Cl- Bei solchen Reaktionen ändern sich oft die Farbe und andere Eigenschaften, wie das Löslichkeitsverhalten. 15.1.9 Aufgabe Formulieren Sie für die folgenden Komplexe die Zerfallsreaktionen und sagen Sie, welcher der beiden Komplexe stabiler ist? +II -I [Fe(CN) 6] +III 4- Fe 2+ + 6 CN 3- Fe - K1 = 10 3+ + 6 CN -44 - K2 = 10 -I [Fe(CN) 6] -31 K1 < K2 ⇒ [Fe(CN)6] ist stabiler 4- Seite 61 Theorie-Skript zum Mediziner-Praktikum (AC) 15.2 Beispiele für biologisch relevante Komplexe 15.2.1 Hämoglobin Abbildung 24: Sauerstoffbindender Eisen-Komplex im Hämoglobin Hämoglobin ist ein Eisen-Protein-Komplex, der aus vier Untereinheiten mit je einer Häm-Gruppe besteht. Sie enthält einen sogenannten Porphyrin-Ring sowie Eisen als Zentralatom und kann somit Sauerstoff in der Lunge binden, der dann über das Blut zu den Muskeln und Organen transportiert wird. Seite 62 Theorie-Skript zum Mediziner-Praktikum (AC) 15.2.2 Chlorophyll Abbildung 25: Blattfarbstoff Chlorophyll 15.2.3 Ca-EDTA Versuch: Bestimmung der Wasserhärte mit EDTA Abbildung 26: Ethylen-Diamin-Tetra-Acetat komplexiert eine Vielzahl von Metallkationen chelatisierend Seite 63 Theorie-Skript zum Mediziner-Praktikum (AC) 15.2.4 Aufgabe Welche Liganden erkennen Sie in der Zeichnung des Hämoglobins (Abbildung 24) und welche Zähnigkeit besitzen diese? Nennen Sie die Koordinationszahl! Koordinationszahl : 6 Liganden : Porphyrin-Ring (4-zähnig) Histidin (1-zähnig) O2 (1-zähnig) 15.2.5 Aufgabe Erklären Sie anhand der Erkenntnisse aus den Aufgaben 15.1.9 und 15.2.4 die Giftigkeit des Cyanid-Ions (CN )! Durch das Cyanid wird ein Enzym der Atmungskette (Cytochromoxidase, enthält ebenfalls Eisen) blockiert, da die Bindung zwischen Cyanid und Eisen wesentlich stabiler ist als die zwischen Sauerstoff und Eisen. 16 Photometrie Versuch: Photometrische Bestimmung eines Eisen-Komplexes 16.1.1 Energie der elektromagnetischen Strahlung Sichtbares Licht ist elektromagnetische Strahlung mit einer Wellenlänge zwischen 350 und 750 nm (je nach Farbe). Elektromagnetische Strahlung kann durch die Größen Energie (E), Frequenz (ν) und Wellenlänge (λ) charakterisiert werden. Der Zusammenhang zwischen diesen Größen ist: E = h⋅ν= h⋅c λ E = Energie [J] h = Planck'sches Wirkungsquantum = 6.6262 . 10-34 [Js] ν = Frequenz [s-1] = [Hz] λ = Wellenlänge [m] c = Lichtgeschwindigkeit = 2.997925 . 108 [m/s] Je größer die Wellenlänge, desto kleiner der Energieinhalt! Seite 64 Theorie-Skript zum Mediziner-Praktikum (AC) Abbildung 27: Kontinuierliches Spektrum der elektromagnetischen Wellen 16.1.2 Energieniveaus der Orbitale } ∆E=h⋅ν Grundzustand angeregter Zustand Abbildung 28: Übergang von Elektronen auf energetisch unterschiedliche Niveaus kann Farbigkeit erzeugen Trifft elektromagnetische Strahlung auf einen Komplex kommt es zu einer Wechselwirkung: Licht einer bestimmten Energie wird absorbiert, wodurch Elektronen in höher liegende Orbitale übergehen. Der Komplex zeigt dann die Komplementärfarbe des absorbierten Lichtes. Aus dem angeregten Zustand fallen die Elektronen wieder in den Grundzustand zurück, wobei die frei werdende Energie in alle Richtungen abgegeben wird. Seite 65 Theorie-Skript zum Mediziner-Praktikum (AC) Schemazeichnung eines Photometers I0 Lichtquelle I trans Gitter Küvette mit Photozelle Probe Abbildung 29: Der Weg des Lichtstrahls in einem Photometer ∗ ∗ ∗ ∗ Das Gitter macht das Licht monochromatisch (= einfarbig). I0 = Intensität des eintreffenden Lichtstrahls Itrans = Intensität des Lichtstrahls, der die Probe verläßt Iabs = absorbierte Lichtmenge = I0 - Itrans Als Absorption (A) bezeichnet man den Quotienten aus absorbierter und eintreffender Lichtmenge: A= Iabs I0 16.2 Lambert-Beer-Gesetz Zusammenhang zwischen absorbiertem Licht und der Konzentration des absorbierenden Stoffes. Itrans = I0 ⋅ e− k⋅c⋅d k = Proportionalitätsfaktor c = Konzentration der Probe d = Schichtdicke der Küvette e = Eulersche Zahl = 2.71828 Itrans c [mol/L] Abbildung 30: Direkte Auftragung der durch die Küvette tretenden Intensität gegen die Konzentration nach dem Lambert-Beer-Gesetz Seite 66 Theorie-Skript zum Mediziner-Praktikum (AC) Da die e-Funktion für praktische Anwendungen unhandlich ist (Abbildung 30, Steigung kann nicht abgelesen werden), wird die Gleichung logarithmiert. Man erhält dann eine Geradengleichung. I0 Itrans lg = e k⋅c⋅d I0 Itrans = c ⋅ d ⋅ k ⋅ lg e mit E = lg I0 Itrans und ε = k ⋅ lg e läßt sich schreiben: E= ε* c * d E = Extinktion (dimensionslos) ε = molarer Extinktionskoeffizient (abhängig von λ) ⇒ dieser ist charakteristisch für jeden Farbkomplex [cm2 / mol] E E3 E2 Ex E1 c1 cx c2 c3 c Abbildung 31: Grafische Darstellung der Extinktion gegen die Konzentration Steigung: Steigungswinkel: ∆E / ∆c tg α [ε] = = = εd εd 2 cm /mol Mit einer Kalibrationsgeraden läßt sich die Konzentration einer unbekannten Probe und deren Extinktionskoeffizient graphisch ermitteln. Dafür werden mindestens drei Proben bekannter Konzentration vermessen und die ermittelten Extinktionen gegen die Konzentrationen aufgetragen. Für eine Probe unbekannter Konzentration wird am Photometer die Extinktion abgelesen und in der Eichgerade die dazugehörige Konzentration graphisch bestimmt. Um den Extinktionskoeffizienten zu bestimmen, muß aus der Kalibrationsgeraden die Steigung bestimmt werden. Seite 67 Theorie-Skript zum Mediziner-Praktikum (AC) 16.2.1 Aufgabe Zweiwertiges Eisen bildet mit 1,10-Phenanthrolin einen oktaedrischen Komplex. 6 Dieser Komplex besitzt einen molaren Extinktionskoeffizienten von ε = 11.1 * 10 2 [cm /mol] bei einer Wellenlänge von 508 nm. Gegeben sind 250 mL einer wäßrigen Lösung dieses Komplexes, die bei der photometrischen Vermessung (d = 1 cm) eine Extinktion von 0,7 aufweist. a) Berechnen Sie die Molarität der Lösung bezüglich des Komplexes! b) Berechnen Sie die Masse an Eisen in der gesamten Probe! c) Was bewirkt eine Verdoppelung der Schichtdicke? d) Gibt es Grenzen für die Anwendung photometrischer Bestimmungen? 5a) Konzentration des Eisens 0,7 * 1mol 3 cm 11,1⋅ 10 6 = 6,3 ⋅ 10 − 5 molL cn = E 5b) ε ⋅d = Masse des Eisens im Kolben cm = M ⋅ cn = 55,8 g mol ⋅ 6,3 ⋅ 10 -5 mol L = 3,5 ⋅ 10− 3 g L m = c m ⋅ V = 3,5 ⋅ 10 −3 g ⋅ 250mL = 0,88mg L 5c) Verdoppelung der Schichtdicke E1 = ε c d1 E2 = ε c 2d1 = konstant ε, c E 1 / d1 = E2 / 2d1 E2 = 2 E1 5d) Grenzen der photom. Bestimmung ∗ Konzentration außerhalb des linearen Meßbereichs (sehr große oder sehr kleine Konzentrationen) ∗ andere Substanzen, welche die gleiche Wellenlänge absorbieren oder mit der Probe reagieren Seite 68 Theorie-Skript zum Mediziner-Praktikum (AC) 17 Thermodynamik Die Thermodynamik dient dazu, Voraussagen zu machen, ob chemische Reaktionen ablaufen können oder nicht. In allen Stoffen ist chemische Energie gespeichert, z.B. in Erdgas und Erdöl, aber auch in Nahrung (Kohlenhydrate). Diese chemische Energie wird ENTHALPIE (Symbol: H) Einheit: [ kJ/mol ] genannt und angegeben in kJ/mol oder kcal/100g (bei Lebensmitteln). Sobald chemische Reaktionen stattfinden, muß die Differenz zwischen den Energiegehalten der Edukte und Produkte (Enthalpiedifferenz ∆H) dadurch ausgeglichen werden, dass Energie aufgenommen oder abgegeben wird. Bei der Verbrennung von Erdgas zu Kohlendioxid wird Wärmeenergie abgegeben (ebenso bei der Verdauung = „Verbrennung“ von Kohlenhydraten): CH4 (Erdgas) + 2O2 ∆H = - 889 kJ/mol CO2 + 2 H2O ∆H ist hier negativ, da Energie freigesetzt wird. So eine Reaktion heißt exotherm. Wenn Energie verbraucht wird, ist ∆H positiv, die Reaktion wird endotherm genannt. Für eine Reaktion: C + D A + B läßt sich die Reaktionsenthalpie ∆H wie folgt angeben: ∆H = ∆HProdukte - ∆HEdukte ∆H = (HC+ HD) - (HA + HB) Es gilt für ∆H: ∆H < 0 exotherme Reaktionen, bei der Reaktion wird Wärme frei endotherme Reaktionen, die Reaktion nimmt Wärme auf ∆H > 0 H exotherme Reaktion, ∆ H < 0 H endotherme Reaktion, ∆H > 0 A+B ∆H ∆H C+D A+B C+D Abbildung 32: Je nach Verlauf der Reaktion wird Enthalpie freigesetzt oder aufgenommen Seite 69 Theorie-Skript zum Mediziner-Praktikum (AC) Aber: Es gibt auch spontan ablaufende endotherme Reaktionen: Einige Salze lösen sich unter Abkühlung der Lösung spontan auf, obwohl Energie aufgenommen werden muß. Was passiert beim Auflösen (= Solvatation,= Hydratation (bei Wasser)) eines Salzes? Versuch: Lösungswärmen von Salzen Abbildung 33: Auflösungsprozeß eines Salzes und die dabei erfolgende Wärmetönung Salze sind aus Ionen aufgebaut, die einen Ionenkristall ausbilden. Zwischen den Ionen unterschiedlicher Ladung gibt es die elektrosta-tischen Anziehungskräfte (Coulomb-Wechselwirkungen). Die Summe dieser Bindungskräfte im Ionengitter (Gitterenergie) halten die Ionen dieses Kristalls zusammen. Beim Lösen eines Salzes muß folglich: ∗ die Gitterenergie EGitter (= Summe aller Coulombschen WW zwischen den Ionen) aufgebracht werden, um Ionen aus dem Gitterverband zu lösen, ∗ Solvatationsenergie ESolv freiwerden, da die Ionen von Hydrathüllen umgeben und ihrerseits mit den Wassermolekülen Coulombsche WW (Anziehung zwischen Ion und dem Dipol Wasser) eingehen werden. Es gilt für die Wärmebilanz des Auflösungsvorganges: ∆H = EGitter-ESolv ist ∆H > 0, die Lösung des Salzes kühlt sich ab, endotherme Reaktion Wenn EGitter < ESolv , ist ∆H < 0, Erwärmung der Lösung, exotherme Reaktion Es gibt sowohl exotherme als auch endotherme Reaktionen, die freiwillig und spontan ablaufen. Wenn man entscheiden möchte, ob eine Reaktion ablaufen kann, ist es also nicht ausreichend zu wissen, ob die Enthalpie bei dieser Reaktion zuoder abnimmt. Außer der Enthalpieänderung muß es eine weitere treibende Kraft geben, die eine Reaktion fördert oder verhindert. Diese wird Hieraus folgt: Wenn EGitter > ESolv , Seite 70 Theorie-Skript zum Mediziner-Praktikum (AC) ENTROPIE (Symbol S) Einheit [kJ/mol*K] genannt und ist ein Maß für den Ordnungszustand eines Systems. Es ist definiert worden, dass Systeme mit großer Unordnung eine große Entropie besitzen. Beispiele: 1. Systeme hoher Ordnung (kleiner S-Wert): z.B. Salze (Ionengitter) 2. Systeme mit hohem Unordnungsgrad (großer S-Wert): z.B. Gase 17.1.1 GIBBS-HELMHOLTZ-GLEICHUNG Die beiden Antriebskräfte einer Reaktion, Enthalpie und Entropie, werden in der Gibbs-Helmholtz-Gleichung mathematisch zusammengefaßt und mit einer neu eingeführten Größe, der Freien Enthalpie, verknüpft. ∆G = ∆H - T * ∆S ∆G = Freie Reaktionsenthalpie ∆H = Reaktionsenthalpie ∆S = Änderung der Entropie T = Temperatur [K] Zusammenfassend kann sagt gesagt werden, dass Reaktionen genau dann ablaufen können, wenn die Änderung der Freien Reaktions-enthalpie ∆G negativ ist! Bei chemischen Reaktionen gibt es zwei Triebkräfte, die Enthalpieab-nahme und die Entropiezunahme. Nur wenn beide Einflüsse berück-sichtigt werden, kann entschieden werden, ob eine Reaktion ablaufen kann oder nicht. Umformung obiger Gleichung: ∆H = ∆G + T * ∆S ∆G: Energieanteil, der max. in Arbeit umgesetzt werden kann T *∆S: kann nicht in Arbeit umgesetzt werden, nicht nutzbar Es gilt für ∆G: ∆G < 0: ∆G > 0: ∆G = 0: Exergone Reaktion (Reaktion läuft freiwillig ab) Endergone Reaktion (Reaktion läuft nicht freiwillig ab, Versuch Lösungswärmen von Salzen) Reaktion befindet sich im Gleichgewicht 17.1.2 Aufgabe: Erklären Sie mit Hilfe der Gibbs-Helmholtz-Gleichung, warum sich CaCl2 ⋅ 6 H2O trotz Abkühlung (endotherme Reaktion, ∆H > 0) in Wasser auflöst! Es handelt sich um eine endotherme Reaktion, der Lösungsvorgang verbraucht Energie, diese wird dem Lösungsmittel Wasser entzogen. Folge: Das System kühlt sich ab. Seite 71 Theorie-Skript zum Mediziner-Praktikum (AC) Es handelt sich gleichzeitig um eine exergone Reaktion (∆G < 0), denn die Reaktion läuft freiwillig ab. Eigentliche Triebkraft der Reaktion ist die Zunahme der Entropie: SIonen im Gitter < SIonen in der Lösung Die Zunahme der Entropie übertrifft die Zunahme der Enthalpie. Es gilt: T ⋅ ∆S > ∆H also ∆G < 0 17.1.3 Zusammenhang zwischen ∆G, der Gleichgewichtskonstante K und des elektrochemischen Potentials E 1. Die Freie Reaktionsenthalpie ∆G ist ein Maß dafür, ob eine Reaktion ablaufen kann. 2. Die Gleichgewichtskonstante K beschreibt, wie weit rechts oder links das Gleichgewicht einer Reaktion liegt. Auch anhand der Gleichgewichtskonstanten kann man also beurteilen, ob Stoffe miteinander reagieren können oder nicht. 3. Redoxpotentiale E geben an, welche Stoffe oxidiert und welche reduziert werden. Sie sind also bei Redox-Reaktionen ein Maß für die Triebkraft einer Reaktion. Da diese drei Größen (∆G, K und E) auf verschiedene Arten beschreiben, ob oder wie weit Reaktionen ablaufen können, stellt sich die Frage, ob es einen Zusammenhang gibt. Für eine allg. Gleichgewichtsreaktion A+B C+D lautet das Massenwirkungsgesetz K= [C] * [D] [A] * [B] Der Zusammenhang zwischen ∆G und K lautet hier ∆G0 = - R * T * ln K R = allgem. Gaskonstante T = Temperatur Je negativer ∆G, desto größer ist K, d.h. desto weiter liegt das Gleichgewicht auf Seiten der Produkte. Ist also ∆G bekannt, so kann die Gleichgewichtskonstante K errechnet werden, bzw. ∆G kann mittels K berechnet werden. ∆ Eo = R* T ln K n *F n = Anzahl der pro Formelumsatz ausgetauschten mol eF = Faradaykonstante = 96500 As/mol Seite 72 Theorie-Skript zum Mediziner-Praktikum (AC) Mit den zwei letzten Gleichungen kann der Zusammenhang zwischen EMK (= ∆E) und ∆G hergestellt werden (Umformen nach RT lnK und Gleichsetzen der Gleichungen): ∆G = - n * F *∆ E Somit ist aus der EMK (Potentialdifferenz zwischen zwei Halbzellen bzw. Redoxpaaren) ∆G experimentell bestimmbar. 17.1.4 Aufgabe: Berechnen Sie für das Daniell-Element die maximal mögliche Arbeit ∆G pro mol Umsatz. ∆G bitte in kWh angeben. Die EMK beträgt 1.11 V. Reaktion : Zn0 + Cu2+ Es sind: Es gilt: Einsetzen: Zn2+ + Cu0 n = 2 (Anzahl der e- durch Formelumsatz), F = 96500 As/mol ∆E = 1.11 V = E0Cu/Cu2+ - E0Zn/Zn2+ ∆G = - n * F * ∆E ∆G = - 2 * 96500 As/mol * 1.11V -3 = - 214230 * 10 kWs/mol -3 1 kWh/mol = - 214230 * 10 * 3600 = - 0.0595 kWh/mol = 214,2 kJ/mol mit Einheiten V*A = W Seite 73 Theorie-Skript zum Mediziner-Praktikum (AC) 18 Kinetik Die Reaktionskinetik beschreibt den zeitlichen Ablauf einer Reaktion anhand der Reaktionsgeschwindigkeit v. Weiterhin wird mit Hilfe der Kinetik versucht, Reaktionsmechanismen zu formulieren. Reaktion: A+B C+D Die Reaktionsgeschwindigkeit v ist definiert als die Konzentrationsänderung einer Komponente pro Zeiteinheit: v= v: Konzentrationsänderung dc = dt Zeitspanne negatives Vorzeichen positives Vorzeichen v=− d [ A] dt =− d[B] dt = Konzentrationsabnahme (Edukte) = Konzentrationszunahme (Produkte) = d [ C] dt = d[D] dt Wie die Reaktionsgeschwindigkeit von den verschiedenen Stoffen abhängt, muß experimentell ermittelt werden. Allgemein kann man schreiben: v = k ⋅ [ A] ⋅ [B] a b Dabei ist k die Geschwindigkeitskonstante. Sie ist für jede Reaktion anders und hängt von der Temperatur ab. Die Reaktionsordnung 1. kann nur experimentell ermittelt werden, indem die Konzentration z.B. der Edukte im Verlauf der Reaktion bestimmt werden, 2. ist die Summe der Exponenten der Konzentrationsausdrücke aus dem Geschwindigkeitsgesetz, auch Ordnungen mit gebrochenen Zahlen sind möglich 3. hat nichts mit den Stöchiometriezahlen zu tun! 18.1.1 Allgemeine Formulierung für ein Geschwindigkeitsgesetz: v = k ⋅ cn Seite 74 Theorie-Skript zum Mediziner-Praktikum (AC) 18.1.2 Reaktion 0. Ordnung Beispiel: einige Enzymreaktionen d[ A ] v=− dt = k ⋅ [ A] = k 0 Hieraus ergibt sich, dass die Reaktiongeschwindigkeit v völlig konzentrationsunabhängig ist: v = k 18.1.3 Reaktion 1. Ordnung: Reaktion: A d[ A ] v=− dt B = k ⋅ [A] 1 oder v= d[B] dt = k ⋅ [A ] 1 Beispiel: Versuch Zerfall von Mangan-(III)-oxalato-Komplex [ 2 Mn( C 2 O 4 ) 3 v=− ] 3− [[ → 2Mn 2 + + 5 C 2 O 4 d Mn( C 2 O 4 ) 3 dt ] 3− 2− + 2CO 2 ] = k ⋅ [[Mn(C O ) ] ] 3− 2 4 3 weiteres Beispiel: Radioaktiver Zerfall ist eine Reaktion erster Ordnung. Seite 75 Theorie-Skript zum Mediziner-Praktikum (AC) 18.1.4 Reaktion 2. Ordnung: Reaktion: A+B v=− C d [ A] dt = k ⋅ [ A ] ⋅ [B] 1 1 oder v=− d [ A] dt = k ⋅ [A] 2 oder v=− d[B] dt = k ⋅ [B] 2 Beispiel: H2 + I 2 v= 2 HI d [HI] = k ⋅ [H 2 ] ⋅ [I 2 ] dt 18.1.5 Aufgabe Gegeben sei folgende Reaktion 2. Ordnung: Fe2+ + Mn3+ Fe3+ + Mn 2+ Bitte formulieren Sie den Ausdruck für die Geschwindigeitsgleichung 2+ a) für die Abnahme der Fe -Konzentration 3+ b) für die Zunahme der Fe -Konzentration zu a) d[Fe 2+ ] 2+ 3+ v== k * [Fe ] * [Mn ] dt zu b) d[Fe 3+ ] 2+ 3+ v=+ = k * [Fe ] * [Mn ] dt Theoretisch sind folgende Geschwindigkeitsgesetze für obige Reaktion möglich: 2+ 3+ v = k * [Fe ] * [Mn ], 2+ 2 v = k * [Fe ] 3+ 2 v = k * [Mn ] Seite 76 Theorie-Skript zum Mediziner-Praktikum (AC) 18.1.6 Bestimmung der Geschwindigkeitskonstanten k Versuch Zerfall von Mangan-(III)-oxalato-Komplex Es gibt zwei Möglichkeiten, aus experimentellen Daten die Geschwindigkeitskonstante für eine chemische Reaktion erster Ordnung zu bestimmen. a) Steigungsmethode Das Geschwindigkeitsgesetz v=− dc =k⋅c dt hat die Form einer Differentialgleichung. Durch Umformung und Integration dieser Gleichung erhält man zwei andere Schreibweisen: lnc = −k ⋅ t + lnc 0 ⇔ c = c 0 ⋅ e − k⋅ t Links steht die logarithmische Form, rechts die exponentielle Form des integrierten Geschwindigkeitsgesetzes. Die logarithmische Form hat die Form einer Geradengleichung (y = ax + b). Wird in einem Diagramm der natürliche Logarithmus der Konzentration (ln c) gegen die Zeit t aufgetragen, sollte sich deshalb eine Gerade ergeben. Die Steigung dieser Geraden hat den Wert k = − ∆lnc ∆t Also kann man k direkt aus der Steigung der Geraden ablesen (s. Abbildung 34 links). b) Halbwertszeitmethode Zwischen der Halbwertszeit τ und der Geschwindigkeitskonstanten k besteht folgender Zusammenhang (Herleitung s. Praktikumsprotokoll): ln2 = k ⋅ τ ⇔ k = 0,693 τ Man kann die Geschwindigkeitskonstante also ausrechnen, wenn man die Halbwertszeit kennt. Diese wird ermittelt, indem man in einem Diagramm die Konzentration c gegen die Zeit t aufträgt und dann abliest, nach welcher Zeit sich die Konzentration halbiert hat (s. Abbildung 34 rechts). c0 ln c0 ln cA Steigung = - k c0 /2 ln cE t1 t2 t τ = Halbwertszeit t Abbildung 34: Links die logarithmische und rechts die exponentielle Auftragung der Konzentration gegen die Zeit Seite 77 Theorie-Skript zum Mediziner-Praktikum (AC) 18.1.7 Aufgabe Ein in der biologischen Forschung eingesetztes radioaktives Isotop ist das 11C. Seine Halbwertszeit beträgt 20 min. Welcher Bruchteil unzerfallenes 11C ist nach 3 Stunden noch vorhanden? Beim radioaktiven Zerfall handelt sich eine Reaktion 1. Ordnung. Dann gilt das Zeitgesetz für den Radioaktiven Zerfall: c = c 0 * e -k*t A) Geschwindigkeitskonstante k des 11C -Zerfalls: Mit t = τ = 20 min läßt sich aus dem Zerfallsgesetz k berechnen: k = ln2 = 0,693 τ 20min B) Wieviel nicht zerfallenes 11C ist nach 3h noch vorhanden? Einsetzen: t = 3h = 180 min, sowie k = ln2 = 0,693 τ 20min in Zerfallsgesetz: c = c0 ⋅ e− k ⋅ t c = c0 ⋅ e -ln2⋅180min 20min = 0,002 ⋅ c 0 In Prozent ausgedrückt: Nach 3 Stunden sind nur noch 0.2% des radioaktiven Stoffs vorhanden. Seite 78 Theorie-Skript zum Mediziner-Praktikum (AC) 19 Die Geschwindigkeitskonstante k, Theorie nach ARRHENIUS Versuch Zerfall von H2O2, Katalyse durch FeCl3 Exergone Reaktionen, deren Freie Reaktionsenthalpie ∆G negativ ist, die also thermodynamisch betrachtet ablaufen dürften, finden manchmal nicht statt. Z.B. ist die Verbrennung von Nahrung (Kohlenhydrate) eine exergone Reaktion. Trotzdem fängt Zucker oder Schokolade nicht plötzlich an zu brennen. Das gleiche gilt für Erdgas oder ein explosives Gemisch aus Wasserstoff und Sauerstoff. Woran liegt das? Diese Systeme können zwar unter Energieabgabe reagieren, aber sie brauchen erst eine Art „Zündung“: die Reaktionspartner benötigen für die Reaktion eine Mindestenergie. Diese Mindestenergie wird auch als Aktivierungsenergie EA bezeichnet. Erst wenn viele Teilchen diese Energie haben, läuft die Reaktion merklich ab. In einem Reaktionsdiagramm läßt sich das so darstellen: Abbildung 35: Energiebilanz einer exothermen Reaktion Damit eine solche Reaktion wirklich abläuft, muß 1. entweder die Energie der Teilchen A + B soweit erhöht werden, dass sie „über die Energiebarriere rutschen“ können, 2. oder die Energiebarriere EA muß soweit erniedrigt werden, dass die Teilchen sie auch mit der vorhandenen Energie überwinden können. Zufuhr von Energie kann durch Erwärmen oder Bestrahlung erfolgen. Die Erniedrigung der Energiebarriere wird durch einen Katalysator erreicht. Ein Katalysator ∗ verringert die benötigte Aktivierungsenergie EA ∗ beschleunigt die Reaktion und somit die Gleichgewichtseinstellung ∗ verändert nicht die Lage des GG ∗ hat keinen Einfluß auf ∆G Seite 79 Theorie-Skript zum Mediziner-Praktikum (AC) ∗ verändert den Reaktionsmechanismus Abbildung 36: Energetischer Vergleich einer Reaktion mit und ohne Katalysator Wenn die Aktivierungsenergie für eine Reaktion vermindert wird, steigt dadurch die Reaktionsgeschwindigkeit. Dann haben nämlich mehr Teilchen die nötige Energie, um die Energiebarriere zu überwinden. Eine höhere Reaktionsgeschwindigkeit bedeutet mathematisch eine größere Geschwindigkeitskonstante k. Wie sich die Temperatur und die Höhe der Aktivierungsenergie auf die Geschwindigkeitskonstante auswirken, wird durch die ARRHENIUS-Gleichung beschrieben: k = k0 ⋅ e − EA R ⋅T k: Geschwindigkeitskonstante ko: präexponentieller Faktor, muß experimentell bestimmt werden, ist Temperaturunabhängig EA: Aktivierungsenergie 19.1.1 Bestimmung der Aktivierungsenergie EA und des präexponentiellen Faktors ko Durch Umformung erhält man eine andere Schreibweise der Arrhenius-Gleichung: lnk = lnk 0 − E A R⋅ T zur Erinnerung: Geradengleichung: y = b + ax, hierbei sind b der y-Achsenabschnitt und a die Steigung. Die Steigung dieser Geraden ist also -EA/R, der y-Achsenabschnitt entspricht ln k0. So lassen sich die Aktivierungsenergie und der präexponentielle Faktor aus einem solchen ln k - 1/T-Diagramm ermitteln. Seite 80 Theorie-Skript zum Mediziner-Praktikum (AC) ln k ln k 0 Steigung = - E A /R 1/T Abbildung 37: Darstellung lnk als Funktion von (1/T) 19.1.2 Aufgabe a) Wie wirkt sich eine Temperaturerhöhung auf k aus? b) Wie wirkt sich die Zugabe eines Katalysators auf k aus? zu a) Es gilt: ln k = ln ko - EA RT Bei einer Temperaturerhöhung wird der Term EA kleiner, folglich wird k größer. RT zu 5b) Ein Katalysator setzt die Aktivierungsenergie EA einer Reaktion herab. Folglich wird der Term EA kleiner (Arrhenius-Gleichung) und k größer, d.h. die Reaktion läuft mit RT Katalysator schneller ab als ohne Einsatz des Katalysators. Seite 81