Methoden zur Identifizierung von posttranslationalen Modifikationen
Werbung

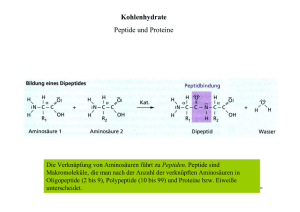
Fachbereich V – Life Sciences and Technology Methoden zur Identifizierung von posttranslationalen Modifikationen in acetylierten Proteinen Dipl.-Chem. Tanja Westphalen, Prof. Dr. Roza Maria Kamp Kooperationspartner: Proteome Factory AG; Projektlaufzeit: 01.06.2012 - 30.11.2013 Kurzfassung In eukaryotischen Zellen ist ein Großteil der intrazellulären, löslichen Proteine N-terminal modifiziert, wobei die Acetylierung eine der häufigsten Modifizierungen ist. In den meisten Fällen sind Proteine nur zu einem sehr geringen Anteil (substöchiometrisch, z.B zu 1 %) modifiziert, sodass der Nachweis im komplexen Proteom derzeit eine der größten Herausforderungen in der Proteomik darstellt. Im Rahmen der Forschungsassistenz VI werden Methoden zur Anreicherung von N-terminal acetylierten Proteinen entwickelt, mit dem Ziel diese in komplexen biologischen Proben selektiv im Hochdurchsatz und in automatisierbaren Verfahren mittels Massenspektrometrie nachweisen zu können. Abstract N-terminal acetylation is one of the most common protein modifications in eukaryotes. Within the highly diverse and dynamic proteome N-terminal acetylated peptides occur in a relative low amount. Therefore it is essential to reduce the complexity of the proteins with focus on acetylproteom to analyse this modification. Here we present a very simple method for depletion of internal peptides to enrich only the N-terminal acetylated peptides in the proteom. This procedure is applicable for high-throughput analysis of N-terminal acetylations by mass spectrometry and has a high potential for fully automatisation. Einleitung Die Proteomik untersucht nicht nur die Zusammensetzung der Proteine in einer Zelle, sondern auch die Beziehung zwischen Funktion und Strukturen der Proteine innerhalb des gesamten Proteoms. Posttranslationale Modifikationen eines Proteins können über die Funktion innerhalb eines Organismus entscheiden. Die N-terminale Acetylierung beeinflusst z.B. die Stabilität und Lebensdauer einiger Proteine und ist von Bedeutung für das Zellwachstum, die Tumorbildung, sowie die Interaktion und Lokalisierung von Proteinen (Van Damme, Lasa et al. 2012). Hauptteil In Eukaryonten, beispielsweise in Menschen wird geschätzt, dass 80-90 % der cytosolischen Proteine am N-Terminus acetyliert werden, in Hefe sind es 50 % (Polevoda and Sherman 2003)8@. Es ist wichtig die biologische Relevanz und Bedeutung der N-terminalen Modifikation umfassend aufzuklären. Dies erfordert eine robuste Methode, die sowohl qualitativ und quantitativ auch in großem Maßstab durchgeführt werden kann (Van Damme, Arnesen et al. 2013). Methoden, mit denen erfolgreich N-terminal acetylierte Peptide nachgewiesen werden konnten, basieren einerseits auf einer chromatographischen Fraktionierung (Gevaert, Goethals et al. 2003); (Mohammed and Heck 2011). Andere Gruppen nutzten aktivierte Harze zur selektiven Anreicherung N-terminaler modifizierter Peptide (Beynon 2006) oder dendritische Polyglycerol- Aldehyd-Polymere (Kleifeld, Doucet et al. 2010). Im Rahmen des Projektes Forschungsassistenz VI wurde eine einfache, unkomplizierte, kostengünstige Methode zur Anreicherung der N-terminal modifizierten Peptide entwickelt. Diese basiert auf der chemischen Reaktion von Aminogruppen mit p-phenylendiisothiocyanat (DITC) (Abbildung 1, links), welches über einen Aminopropyl-Linker an Kieselgel als Festphase gebunden ist. In Abbildung 1 zeigt das UPLC-Chromatogramm rechts, dass aus einem 1:1-Gemisch (oben) der synthetischen Peptide P1 (acetyliert) und P3 (nicht acetyliert), nach der DITC-Reaktion sich P1 selektiv isolieren läßt (mittig). Nur P3 bindet an die DITC und läßt sich sauer wieder von der Festphase abspalten (unten). In komplexeren biologischen Proben, wie beispielsweise tryptischen Verdaus von Proteinen oder sogar kompletten Proteomen, tragen zusätzlich zu den nichtacetylierten N-termini auch die Lysin-Seitenketten Aminogruppen. Methoden zur selektiven Anreicherung N-terminal modifizierter Peptide müssen gewährleisten, dass die N-terminal modifizierten Peptide nicht über Lysin-Seitenketten an das DITC-Material binden. Dieses Ziel wurde im Rahmen des Projektes in zwei unterschiedlichen Methoden (A und B) verfolgt. Die Methoden A und B sollen an synthetischen Peptiden, Standardproteinen, sowie an Proteinen von Hefe-Mutanten getestet, miteinander verglichen und optimiert werden. In Tabelle 1 sind die Vor- und Nachteile der beiden Methoden A und B einander gegenübergestellt. Beuth Hochschule für Technik Berlin 49 Fachbereich V – Life Sciences and Technology Abb. 1: Links : Darstellung des DITCs. Das bifunktionale Molekül wird auf der einen Seite über einen Aminopropyllinker an Kieselgel als feste Phase gebunden. Die andere Isothiocyanatgruppe verbleibt als reaktives Zentrum zur Reaktion mit freien Aminogruppen. Rechts : UPLC-Chromatogramm von synthetischen Peptiden im 1:1-Gemisch vor und nach der DITC-Kopplung Methode A Methode B Chemische Modifikation keine erforderlich Proteolytische Spaltung Auf Lys-N festgelegt Detektierbarkeit mit MS Beliebig Multi-ProteaseAnsätze möglich Abhängig von der Signalverstärkung Sequenz des Ndurch die ModifiTerminus kation Tabelle 1: Gegenüberstellung der Methoden A und B zur selektiven Anreicherung N-terminal acetylierter Peptide. Bei der Methode A handelt es sich um einen sehr unkomplizierten und zeitsparenden Ansatz. Durch den Einsatz der rekombinanten Metalloendopeptidase LysN, welche am N-terminalen Ende der Lysine Proteine spaltet, wird erreicht, dass die N-terminal modifizierten Peptide ohne zusätzliche chemische Modifikation als einzige keine freien Aminogruppen tragen und somit nach der DITC-Reaktion selektiv im Überstand nachgewiesen werden können. Für die proteolytischen Spaltung ist man bei Methode A auf das Enzym Lys-N festgelegt und generiert möglicherweise im Massenspektrometer schwierig nachzuweisende Analyten, weil diese keine positive Ladung tragen. Um die Nachweisbarkeit N-terminal modifizierter Peptide ohne Lysin zu testen, wurden die synthetischen Peptide P7 und P8 (Abbildung 3) massenspektrometrisch untersucht. In Abbildung 3 sind die Spektren der Peptide P7 und P8 dargestellt, die sich nur an zwei Positionen der Sequenz unterscheiden. Es ist deutlich zu erkennen, dass sich das Peptid P8 ohne basische Aminosäuren (R) mittels Massenspektrometrie schlecht Abb. 2: Schematische Darstellung der DITC-Reaktion zur Anreicherung N-terminal acetylierter Peptide. analysieren läßt. Damit Methode A als universelle Methode zur Anreicherung N-terminal acetylierter Peptide eingesetzt werden kann, ist es notwendig die Messungen in der Massenspektrometrie so zu optimieren, dass Peptide ohne basische Aminosäuren mit vergleichbaren Intensitäten wie Peptide mit basischen Aminosäuren detektiert werden können. 50 Nachhaltige Forschung in Wachstumsbereichen – Band iv Fachbereich V – Life Sciences and Technology Peptid Sequenz m/z P7 Acetyl-SDAVTIRTR 1061,33 P8 Acetyl-SDAVTIGTG 861,90 Abb. 3: Peptide P7 und P8 mit geringen Sequenzunterschieden werden im MALDI-TOF-MS mit deutlich unterschiedlichen Signalintensitäten detektiert. In der Methode B wird die selektive Anreicherung der Nterminal modifizierten Peptide erreicht, indem die Aminogruppen der Lysin-Seitenketten chemisch modifiziert werden, sodass deren Reaktion mit dem DITC-Material verhindert wird. In vorhergehenden Projekten wurden zahlreiche Reagenzien zur Modifikation der Lysine untersucht (Stephani-Kosin, Kamp 2011), mit dem Ziel einerseits eine selektive Modifikation der Lysine ohne Umsetzung der N-termini zu bewirken und darüber hinaus durch die Modifikation eine Signalverstärkung in der Massenspektrometrie zu erreichen. Der Einsatz der zyklischen Guadinium-Gruppe 2-methoxy-4,5-dihydro-1H-imidazole (MeO-DHIM) um die Lysin-Seitenkette zu modifizieren zeigte eine deutliche Signalverstärkung, sowie eine gute Selektivität. Es konnte eine Lysin-spezifische Reaktion beobachtet werden (Peters, Horn et al. 2001). Durch die chemische Modifikation von Peptiden verändert sich deren Hydrophobizität und damit das Verhalten in der Probenvorbereitung. Daher sollte ein Reagenz eingesetzt werden, dessen Einfluss geringer ist als der des 2-methoxy-4,5-dihydro-1H-imidazole und dennoch dessen positve Eigenschaften behalten. Dazu wurde die Synthese des 2-Ethoxy-1,4,5,6tetrahydropyrimidin-5-ol angestrebt (Abbildung 4). Die Synthese wurde nach dem Protokoll zur Ringschlusssynthese durchgeführt (Ho, Shieh et al. 2009). Die Darstellung des 2-Ethoxy-1,4,5,6-tetrahydropyrimidin-5-ol wurde nach dem oben genannten Protokoll nicht erreicht, sodass die Umsetzung mit den freien Aminogruppen der Peptide nicht durchgeführt werden konnte. Es ist notwendig eine alternative Synthesesmethode zu entwickeln. Darüber hinaus sollten auch weniger komplexe Blockierungen, wie beispielsweise eine Dimethylierung in Betracht gezogen werden. Abb. 4: Reaktionsgleichung zur Synthese des 2-Ethoxy-1,4,5,6-tetrahydropyrimidin-ol. Zusammenfassung Der Nachweis von N-terminal acetylierten Peptiden in komplexen biologischen Proben stellt nach wie vor eine der größten Herausforderungen in der Proteomik dar. Im Rahmen des Projektes Forschungsassistenz VI wurde gemeinsam mit der Proteome Factory AG eine unkomplizierte und kostengünstige Methode entwickelt, um N-terminal modifzierte Peptide selektiv anzureichern. Das DITC-Material eignet sich hervorragend als Scavenger für freie Aminogruppen und ist sehr gut einsetzbar in allgemein gebräuchlichen Puffersystemen. Um sicher zu stellen, dass N-terminal modifizierte Peptide nicht über freie Aminogruppen der Lysin-Seitenketten an das DITC-Material binden, kann die Methode A eingesetzt werden, in der die Wahl der Protease verhindert, dass das N-terminale Peptid ein Lysin trägt. Dabei zeigten sich Schwierigkeiten diese Peptide ohne basische Aminosäuren in der Massenspektrometrie nachweisen zu können, sodass die Messbedingungen optimiert werden müssen. In der Methode B werden freie Aminogruppen chemisch modifiziert. Diese verändern das Verhalten der Peptide in der Probenvorbereitung unterschiedlich stark in Abhängigkeit des Modifizierungsreagenzes. Die Synthese eines Modifizierungsreagenzes, welches selektiv an die Aminogruppen der Lysin-Seitenketten gelang im Rahmen dieses Projektes nicht. Beuth Hochschule für Technik Berlin 51 Fachbereich V – Life Sciences and Technology Literatur Beynon, L. M. R. J. (2006). “Positional proteomics: preparation of amino-terminal peptides as a strategy for proteome simplification and characterization.” NATURE PROTOCOLS 1(4): 17901798. Gevaert, K., M. Goethals, et al. (2003). “Exploring proteomes and analyzing protein processing by mass spectrometric identification of sorted Nterminal peptides.” Nature Biotechnology 21(5): 566-569. Ho, M.-Y., Y.-T. Shieh, et al. (2009). “Functional Dihydro-1H-imidazole Derivatives for MALDI Signal Enhancement of a Lysine-Specific Chemical Modification.” Journal of the Chinese Chemical Society 56(5): 987-994. Kleifeld, O., A. Doucet, et al. (2010). “Isotopic labeling of terminal amines in complex samples identifies protein N-termini and protease cleavage products.” Nature Biotechnology 28(3): 281U144. Mohammed, S. and A. J. R. Heck (2011). “Strong cation exchange (SCX) based analytical methods for the targeted analysis of protein post-translational modifications.” Current Opinion in Biotechnology 22(1): 9-16. Peters, E. C., D. M. Horn, et al. (2001). “A novel multifunctional labeling reagent for enhanced protein characterization with mass spectrometry.” Rapid Communications in Mass Spectrometry 15(24): 2387-2392. Polevoda, B. and F. Sherman (2003). “N-terminal acetyltransferases and sequence requirements for N-terminal acetylation of eukaryotic proteins.” Journal of Molecular Biology 325(4): 595-622. Stephani-Kosin, K. und Kamp, R.M. (2011). „Methoden zur Identifizierung von posttranslationalen Modifikationen in Proteinen.“ Abschlussbericht PROMOD. Van Damme, P., T. Arnesen, et al. (2013). “In-gel Nacetylation for the quantification of the degree of protein in vivo N-terminal acetylation.” Methods in molecular biology (Clifton, N.J.) 981: 115-126. Van Damme, P., M. Lasa, et al. (2012). “N-terminal acetylome analyses and functional insights of the N-terminal acetyltransferase NatB.” Proceedings of the National Academy of Sciences of the United States of America 109(31): 1244912454. Abbildungsverzeichnis Abb. 1 Tanja Westphalen, Dr. Kunigunde Stephani-Kosin Abb. 2-4 Tanja Westphalen 52 Nachhaltige Forschung in Wachstumsbereichen – Band iv Kontakt Prof. Dr. Roza-Maria Kamp Beuth Hochschule für Technik Berlin Fachbereich V Seestraße 64, 13353 Berlin Telefon:(030) 4504-3923 E-Mail: [email protected] Kooperationspartner Prof. Dr. Christian Scheler Proteome Factory AG Magnusstr. 11, 12489 Berlin Telefon:(030) 20616265 E-Mail: [email protected]