Therapie-Empfehlungen Clostridium difficile - MRE
Werbung

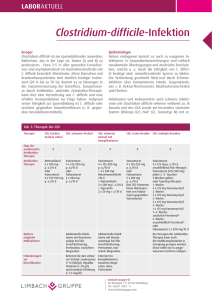
Clostridium difficile / CDI Clostridium difficile ist ein anaerobes, grampositives, sporenbildendes Stäbchenbakterium. Es kommt ubiquitär in der Umwelt und im Darm von Mensch und Tier vor. Ca. 1% -4% der Normalbevölkerung und 15-35% der Krankenhauspatienten sind ohne Krankheitssymptome mit dem Erreger kolonisiert und können die Sporen des Erregers bei mangelnder Hygiene übertragen. Die Sporen von Clostridien kommen überall auf der Erde im Boden, in Schmutz oder Staub vor. Im Rahmen einer Antibiotikatherapie kann es zur massiven Vermehrung von Clostridium difficile und Freisetzung darmwandschädigender Toxine (Toxin A und B) kommen. Die Inzidenz der Clostridium difficile-assoziierten Diarrhoen (CDAD) ist in den letzten Jahren erheblich angestiegen. Gleichzeitig ist ausgehend von den USA und Kanada über Europa ein neuer Stamm (NAP1 oder 027) aufgetreten, der durch vermehrte Toxinbildung eine höhere Virulenz und Letalität aufweist. In Deutschland wird dieser Stamm seit 2007 isoliert. Er hat schwere, in einigen Fällen tödlich verlaufende Infektionen verursacht. Der Erreger wird über den Stuhl des Menschen ausgeschieden. Als Infektionswege der nosokomialen C. difficile Infektion (CDI) kommen sowohl die direkte, fäkal-orale Übertragung von Mensch zu Mensch als auch die indirekte Übertragung über Personal, Flächen oder Gegenstände in Frage. Auf Grund der Sporenbildung kann der Erreger mehrere Monate persistieren, so dass der indirekte Übertragungsweg über kontaminierte Flächen (z.B. Betten, Matratzen) nicht unerheblich ist. Krankheitsbilder Leichte bis mittelschwere Diarrhoe Kolitis mit unterschiedlicher Entzündungsaktivität, pseudomembranöse Enterokolitis Komplikationen: Toxisches Megakolon, Darmperforation mit einhergehender Sepsis Therapie Die asymptomatische Kolonisation mit C. difficile erfordert keine antibiotische Therapie. Bei leichten Erkrankungsfällen genügt das Absetzen der (mit-)verursachenden Antibiotika, da diese die Zusammensetzung der physiologischen Darmflora durch Reduktion von Bacteroides verändern können, was die Vermehrung von C. difficile begünstigt. Ist kein Absetzen möglich, oder handelt es sich um mittelschwere bis schwere Fälle, sind Antibiotika indiziert (Bauer et al. 2009; Schneider et al 2007). In den letzten Jahren werden vermehrte Therapie-Versager unter Metronidazol oder eine verstärkte Rate von Rezidiven nach primär erfolgreicher Therapie gesehen. Die Rate an Therapieversagern ist mit dem Auftreten hypervirulenter Stämme mit gleichzeitiger Antibiotikaresistenz (NAP1, 027) von 5% (1983) auf über 30% (2006), die der Rezidivpatienten von 5% (1983) über 20% (1998) bis zu über 40% bei Ausbrüchen (2005 und 2006) gestiegen (Johnson 2009). Die Wahl des Antibiotikums erfolgt abhängig vom Schweregrad der Clostridium-difficile-Infektion (CDI). Für leichte bis mittelschwere Verläufe wird immer noch Metronidazol empfohlen. Die Dosierung beträgt (bei normalgewichtigen, nierengesunden Erwachsenen) 500 mg 3x tgl für 10 Tage. Ein Therapieerfolg gelingt damit in etwa 70-90% der Fälle. Die Erregerelimination aus dem Darm erfolgt im Vergleich zu Vancomycin verzögert (Johnson 2009). Therapiedauer in der Regel 10 Tage. Vancomycin 125mg/4x tgl. für 10 Tage und Fidaxomicin 200mg/ 2x tgl. für 10 Tage werden ebenfalls gleichermaßen empfohlen Nach Studienlage hat sich für Vancomycin die Dosierung von 4 x 125 mg pro Tag als ausreichend erwiesen. Höhere Dosen von 4 x 500 mg pro Tag weisen die gleiche Heilungsrate wie die 125 GrammDosierung auf. Erarbeitet Fachausschuss Antibiotika-Therapie im MRE-Netz Mittelhessen Stand Mai 2014 1 Clostridium difficile - CDI Bei einem ersten Rezidiv kann je nach Schwere durchaus erneut mit der primären Therapie begonnen werden. Bei nicht-schweren weiteren (oder späteren) Rückfällen einer CDI wird Vancomycin 125mg/4x tgl für 10 Tage gefolgt von einem Pulsregimen (125-500mg/Tag alle 2-3 Tage für mindestens 3 Wochen) oder Fidaxomicin 200mg, 2xtgl für 10 Tage oral empfohlen. Vancomycin und Fidaxomicin sind gleich effektiv in Bezug auf Reduktion von CDI-Symptomen, aber die Anwendung von Fidaxomicin ist nach dem ersten Rückfall mit einer geringeren Wahrscheinlichkeit eines Rückfalls assoziiert. Bei mehrfachen Rezidiven kann ein Protokoll mit initial 4 x 500 mg Vancomycin und anschließend langsam (im 2-Wochenrythmus) reduzierten Vancomycin-Dosen, gegebenenfalls auch in Kombination mit probiotischen Präparaten (z.B. Sacharomyces boulardii) versucht werden. Vancomycin muss oral verabreicht werden, da bei parenteraler Anwendung keine ausreichenden Wirkstoffkonzentrationen in der Kolonmukosa erreicht werden. Bei schwerer CDI gilt Vancomycin aufgrund seiner pharmakokinetischen Eigenschaften als überlegen gegenüber Metronidazol. Die Vancomycin Hoch-Dosis-Therapie (500 mg/4x tgl oral) stand zwar in den IDSA-Leitlinien zum Management schwerer CDI, aber es gibt keine Evidenz für die Anwendung von Dosen >125 mg 4x tgl bei Fehlen eines Ileus. Fidaxomicin war Vancomycin bei der initialen Heilung einer CDI nicht unterlegen, aber es gibt keine Daten zur Effektivität bei schwerer, lebensbedrohlicher Erkrankung. Das schmale Fidaxomicin-Wirkungsspektrum ist vorteilhaft, da die gastrointestinale Flora weitgehend erhalten bleibt (Louie et al. 2009). Je geringer die Beeinflussung der normalen gastrointestinalen Flora, desto höher ist der Schutz vor einer Rekolonisation mit Clostridium difficile und dem Wiederauftreten der Infektion (Rezidiv). Die Rückfall- und Heilungsraten sind unter Fidaxomicin deutlich besser als bei Vancomycin (Rückfallrate 13,0% versus 24,36%, klinische Heilung 91,9% versus 90,2%). Dosierung: Zweimal täglich 200mg (Tablette), unabhängig von den Mahlzeiten einzunehmen. Keine Dosiseinschränkung bei älteren Patienten oder Patienten mit Niereninsuffizienz (Duggan 2011). Weitere Alternativen, die bei Therapieversagen oder Unverträglichkeiten eingesetzt werden können (begründete Einzelfallentscheidung), sind Fusidinsäure, Bacitracin, Nitazoxanid, Rifaximin. Rifaximin weist wie Rifampicin eine Resistenzrate von 22% auf (Morris et al., 53rd ICAAC, 2013). Auch andere orale Glykopeptide (Teicoplanin) wirken. Tigecyclin und Linezolid besitzen in vitro eine gute Wirksamkeit gegen C. difficile. Zu Tigecyclin gibt es auch klinische Erfahrungen. Wirkstoff/Substanz Tagesdosierung Primärtherapie Metronidazol Vancomycin Fidaxomicin 3 x 400 mg bis 4 x 500 mg 4 x 125 mg bis 4 x 500 mg 2 x 200mg Reservetherapie (nur in begründeten Einzelfällen) Tigecyclin 2 x 50 mg Teicoplanin 2 x 100 mg bis 3 x 200 mg Fusidinsäure 3 x 250 mg bis 3 x 500 mg Bacitracin 4 x 25.000 IU Nitazoxanid 2 x 500 mg bis 3 x 500 mg Rifaximin 2–3 x 400 mg/d p.o. 14 Tage Dosierungen der in der primären und Reserve-Therapie der CDI verwendbaren antimikrobiellen Substanzen (normalgewichtige, leber- und nierengesunde Erwachsene). (Grünewald et a., 2010) Anmerkung: Absetzen einer Therapie mit Protonenpumpenhemmer nach klinischem Bild sollte erwogen werden. Begründung: FDA Drug Safety Communication: Clostridium difficile-associated diarrhea can be associated with stomach acid drugs known as proton pump inhibitors (PPIs) Safety Announcement [02-08-2012] Ausmaß der Assoziation sehr variabel Einnahme von PPI erhöht das Risiko um den Faktor 1,4 bis 2,75 Erarbeitet Fachausschuss Antibiotika-Therapie im MRE-Netz Mittelhessen Stand Mai 2014 2 Clostridium difficile - CDI In den fünf Studien, die Angaben zum klinischen Ausgang der Erkrankung machten, wurde laut FDA über Kolektomien und in seltenen Fällen auch über Todesfälle berichtet. Literatur 1. Debast SB, Bauer MP, Kuijper EJ, on behalf of the Committee: European Society of Clinical Microbiology and Infectious Diseases: Update of the Treatment Guidance Document for Clostridium difficile Infection; Clin Microbiol Infect, 20(2), 2014 2. Duggan ST. Fidaxomicin. In Clostridium difficile. Drugs 71(18): 2445-2456, 2011 3. Grünewald T, Kist R, Mutters R, Ruf BR, Kern WV: Clostridium-difficile-Infektion; Dtsch. Med. Wochenschr 135:699-703, 2010 4. Högenauer Ch: Clostridium difficile Enterokolitis – Update 2010 unter besonderer Berücksichtigung der Therapie und Prophylaxe; Wiener Medizinische Wochenschrift Skriptum 7, 2010 5. Johnson S: Recurrent Clostridium difficile infection: a review of risk factors, treatments, and outcomes. J Infect 58: 403-10, 2009 6. Louie TJ, Emery J, Krulicki W, et al.: OPT-80 eliminates Clostridium difficile and is sparing of Bacteroides species during treatment of C. difficile infection; Antimicrob Agents Chemother 53: 261-263, 2009 7. Schneider T, Eckmanns T, Ignatius R, Weist K, Liesenfeld O.: Clostridium-difficile-assoziierte Diarrhö: Ein zunehmendes klinisches Problem durch neue hochvirulente Erreger; Dtsch Ärztebl 104: A-1588, 2007 Erarbeitet Fachausschuss Antibiotika-Therapie im MRE-Netz Mittelhessen Stand Mai 2014 3