Sein oder Nicht-Sein? Kontroversen um Helicobacter pylori
Werbung
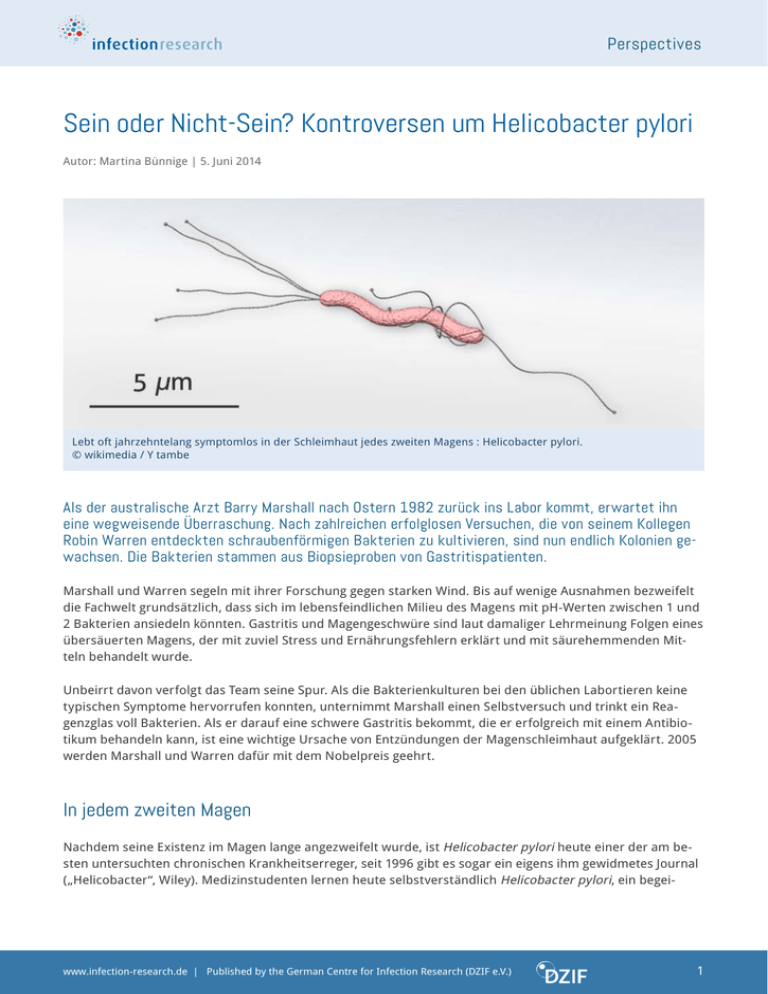
Perspectives Sein oder Nicht-Sein? Kontroversen um Helicobacter pylori Autor: Martina Bünnige | 5. Juni 2014 Lebt oft jahrzehntelang symptomlos in der Schleimhaut jedes zweiten Magens : Helicobacter pylori. © wikimedia / Y tambe Als der australische Arzt Barry Marshall nach Ostern 1982 zurück ins Labor kommt, erwartet ihn eine wegweisende Überraschung. Nach zahlreichen erfolglosen Versuchen, die von seinem Kollegen Robin Warren entdeckten schraubenförmigen Bakterien zu kultivieren, sind nun endlich Kolonien gewachsen. Die Bakterien stammen aus Biopsieproben von Gastritispatienten. Marshall und Warren segeln mit ihrer Forschung gegen starken Wind. Bis auf wenige Ausnahmen bezweifelt die Fachwelt grundsätzlich, dass sich im lebensfeindlichen Milieu des Magens mit pH-Werten zwischen 1 und 2 Bakterien ansiedeln könnten. Gastritis und Magengeschwüre sind laut damaliger Lehrmeinung Folgen eines übersäuerten Magens, der mit zuviel Stress und Ernährungsfehlern erklärt und mit säurehemmenden Mitteln behandelt wurde. Unbeirrt davon verfolgt das Team seine Spur. Als die Bakterienkulturen bei den üblichen Labortieren keine typischen Symptome hervorrufen konnten, unternimmt Marshall einen Selbstversuch und trinkt ein Reagenzglas voll Bakterien. Als er darauf eine schwere Gastritis bekommt, die er erfolgreich mit einem Antibiotikum behandeln kann, ist eine wichtige Ursache von Entzündungen der Magenschleimhaut aufgeklärt. 2005 werden Marshall und Warren dafür mit dem Nobelpreis geehrt. In jedem zweiten Magen Nachdem seine Existenz im Magen lange angezweifelt wurde, ist Helicobacter pylori heute einer der am besten untersuchten chronischen Krankheitserreger, seit 1996 gibt es sogar ein eigens ihm gewidmetes Journal („Helicobacter“, Wiley). Medizinstudenten lernen heute selbstverständlich Helicobacter pylori, ein begei- www.infection-research.de | Published by the German Centre for Infection Research (DZIF e.V.) 1 Perspectives ßeltes gram-negatives Bakterium, als wichtigsten Auslöser von Gastritis Typ-B und Magen- und Zwölffingerdarmgeschwüren kennen. Es gilt außerdem als wichtigster Risikofaktor für Magenkrebs und das MALT-Lymphom. Die WHO ordnet ihn seit 1997 sogar zur Gruppe I der Karzinogene. Damit ist H. pylori das erste bekannte Bakterium, das Krebs auslösen kann. Schätzungen zufolge besiedelt der an sein lebensfeindliches Milieu bestens angepasste Keim heute jeden zweiten menschlichen Magen. Damit zählt er zu den häufigsten chronischen Infektionserregern weltweit. Doch nicht jeder Träger wird auch krank: Zwar ist bei allen Infizierten eine chronische Entzündung der Magenschleimhaut nachweisbar, doch nur bei etwa 10 % entwickeln sich daraus behandlungsbedürftige Geschwüre in Zwölffingerdarm oder Magen. Bei einem von hundert Patienten führt die unbehandelte Infektion zu Magenkrebs. Heute Standard, bald wirkungslos? DreifachTherapie mit Antibiotika und säuresekretionshemmenden Mitteln. © wikimedia / Simplicius Wird der Erreger im Krankheitsfall nachgewiesen, erhalten Patienten in der Regel eine Kombination aus Antibiotika und Säuresekretionshemmern. Wegen seiner gefährlichen möglichen Auswirkungen und auch angesichts der bekannten Resistenzproblematik, die inzwischen auch H. pylori betrifft (siehe Infobox ResiNet), suchen Forscher dringend nach Alternativen zur etablierten Therapie. Einen wichtigen Schlüssel zu einer nachhaltigen Behandlung von H. pylori- Infektionen sehen die Forscher in den vielfältigen Wirt-Erreger-Beziehungen. Trickreiches Pathogen Seit den 1990er Jahren arbeiten Forschergruppen weltweit an der Entwicklung eines Impfstoffes gegen H. pylori. „Es ist ein sehr variabler Erreger in einer besonderen ökologischen Nische, insofern ist nicht zu erwarten, dass das einfach ist“, sagt Prof. Dr. Sebastian Suerbaum, Leiter des Instituts für Medizinische Mikrobiologie und Krankenhaushygiene an der Medizinischen Hochschule Hannover: „Das ist aber kein Grund pessimistisch zu sein – neue Kenntnisse über Bakterien und über das Immunsystem führen über kurz oder lang zum Erfolg.“ Suerbaums Labor befasst sich intensiv mit den Pathogenitätsfaktoren, mit der Populationsgenetik und der Evolution des Magen-Bakteriums. Seine experimentelle Arbeiten der letzten zwei Jahrzehnte förderten neben vielfältigen Anpassungen von H. pylori an seinen extremen Lebensraum sowie seine hohe Variabilität zutage und haben dadurch international Wegweisendes zum Verständnis dieser chronischen Infektion beigetragen. Eine zentrale Rolle für die erfolgreiche Persistenz des Bakteriums spielt die gamma-Glutamyl-Transpeptidase (gGT). Dieses bakterielle Enzym blockiert die T-Zellen und unterbindet so die Immunantwort. Bakterielle Mutanten ohne gGT besiedeln im Mausmodell den Magen signifikant weniger. Die Transpeptidase hat außerdem direkten Einfluss auf die Entzündungsreaktion in der Magenschleimhaut. Sie wird bei allen H. pylori-Stämmen gefunden und gilt daher als vielversprechendes Target für eine alternative Bekämpfungssstrategie. www.infection-research.de | Published by the German Centre for Infection Research (DZIF e.V.) 2 Perspectives Bakterielles Karzinogen Neben dem Vaculating Toxin (VacA), das Magenzellen zerstört und die Heilung der Schleimhaut hemmt, gilt die CagPathogenitätsinsel (Cag-PAI) als wichtigster Virulenzfaktor im Zusammenhang mit Krebs. Diese Region im Genom von H. pylori kodiert für ein Typ4 Sekretionssystem (T4SS). Mithilfe dieser molekularen Injektionsspritze bringt das Bakterium das Effektorprotein, CagA genannt, in die Magenepithelzellen ein. Es greift intensiv in die Signalübertragung und andere Zellfunktionen und gilt daher als bakterielles Onkoprotein. Suerbaums Labor untersuchte auch die biogeographische Verteilung dieser Cag-PAI- Gene[1,2]. Diese ist sehr uneinheitlich: Während z. B. nur etwa 70-80 % der H. pylori -Isolate in der westlichen Welt diesen Krankheitsfaktor tragen, haben ihn im ostasiatischen Raum so gut wie alle. Hier ist auch die Magenkrebsrate besonders hoch. Der Besitz einer funktionellen Cag-Pathogenitätsinsel ist statistisch hoch assoziert mit höherer Pathogenität, sowohl für Gastritis als auch Krebs. „Doch“, ergänzt Prof. Suerbaum, „auch das Effektorprotein CagA ist sehr variabel und kann in sehr unterschiedlicher Stärke die Signalübertragung im Magenepithel stören“. Nach chronischer Besiedlung durch H. pylori können sich Geschwüre im Magen und Zwölffingerdarm bilden. © wikimedia / Ed Uthman Koevolution seit 60.000 Jahren Infektionen mit H. pylori sind seit drei Jahrzehnten bekannt. Neuartig sind sie aber keineswegs. Zusammen mit einem internationalen Forscherteam wies Suerbaums Labor 2003 nach, dass bereits unsere frühen Ahnen auf ihrem Weg aus Afrika vor rund 60.000 Jahren Helicobacter pylori in sich trugen. [3,4] Die Wissenschaftler korrelierten dazu die DNA verschiedener Helicobacter-Stämme mit historischen und rezenten Migrationswegen der Menschheitsgeschichte. Der Magenbewohner hatte viel Zeit, sich perfekt an seine extreme Nische anzupassen und den Angriffen des Immunsystems seines einzigen Wirtes Mensch zu entgehen. „Helicobacter ist ein normaler Bestandteil unserer Mägen, oder ist es zumindest einmal gewesen,“ ist Prof. Dr. Anne Müller überzeugt. Sie erforscht im Institut für molekulare Krebsforschung Zürich die Wirt-Erreger-Beziehungen von H. pylori. Untersuchungen zeigen, dass der Magenkeim zunehmend aus der menschlichen Mikrobiota verschwindet. Während es in Entwicklungsländern Populationen gibt, bei denen fast alle Menschen mit H. pylori infiziert sind, verzeichnen Epidemiologen in Industrieländern seit Jahren eine deutlich sinkende Zahl von Infizierten. Hier haben nur noch 20 bis 40 % der Erwachsenen und deutlich weniger Kinder H. pylori im Magen. Diesen Rückgang schreiben die Forscher dem Einsatz von Antibiotika, allgemein hohen Hygienestandards sowie einer steigenden Zahl von Kaiserschnittgeburten zu. Für die Gefährlichkeit von H. pylori sei vor allem der Zeitpunkt der Infektion von großer Bedeutung, erklärt www.infection-research.de | Published by the German Centre for Infection Research (DZIF e.V.) 3 Perspectives Müller. Infiziert man sich erst als Jugendlicher oder sogar als Erwachsener, bekämpft das Immunsystem den Eindringling besonders heftig. Eine frühkindliche Infektion hingegen schütze vor Allergien, legen epidemiologische Studien und auch ihre experimentellen Daten nahe. Prof. Müller: „Träger von Helicobacter haben ein deutlich geringeres Allergierisiko, wenn sie den Keim bereits als Babys erworben haben. Aus unseren experimentellen Arbeiten an Mäusen wissen wir auch: Die dauerhafte Besiedlung während der Entwicklung ist eine Voraussetzung für diesen Schutz.“ Eingriffe ins Immunsystem Zwei Effekte, die für den Asthma-Schutz bei frühkindlicher Konfrontation mit dem Bakterium verantwortlich sind, können die Allergie-Forscher bereits benennen: H. pylori aktiviert die sogenannten regulatorischen TZellen (Tregs) und programmiert Dentritische Zelle (DC) so um, dass sie H. pylori tolerieren. Er gilt daher als stark immunmodulierender Keim. Dafür setzt er zwei der bereits bekannten Pathogenitätsfaktoren ein: das VacA-Toxin und die gGT. Sie sorgen dafür, dass das Immunsystem das Bakterium nicht erkennt. Als Nebeneffekt werden aber auch die Immunantworten auf Allergene unterdrückt. Im Mausmodell sorgen also dieselben Faktoren von H. pylori für den Asthmaschutz, die auch die dauerhafte Besiedlung des Magens begünstigen und die Magenbeschwerden verursachen. Die Forscher sind überzeugt, dass die Erkenntnisse über diese immunmodulierenden Eigenschaften des Magenspezialisten auch neue Wege zu Vorbeugung und Behandlung von Allergien weisen - und theoretisch ebenso für die Eradikation von H. pylori. [5,6] Das im Labor von Prof. Müller etablierte Maus-Modell eines H. pylori-vermittelten Asthmaschutzes unterstützt experimentell die “Disappearing Microbiota”-Hypothese. Diese ist gewissermaßen eine Konkretisierung der Hygiene-Hypothese. Kurzgefasst ist demnach der Anstieg von Asthma und Allergien in hochentwickelten Gesellschaften eine direkte Konsequenz des Niedergangs unserer ursprünglichen Mikroflora. Im Mausmodell schützten frühkindliche Infektionen mit H pylori vor Allergien und Asthma. © fotolia / petert2 Die Experten diskutieren allerdings heute kontrovers, ob eine konsequente Bekämpfung des Keims angesichts der inzwischen vermuteten positiven Effekte für die Entwicklung angeraten ist. Die Bedeutung der Mikroflora des Menschen, speziell des Darms oder der Lunge, wird seit einigen Jahren sehr intensiv erforscht. Wissenschaftler beleuchten die engen Verflechtungen der Stoffwechselwege der Pro- und Eukaryonten und wissen auch, dass es Übergange zwischen harmlosen kommensalen und pathogenen Bakterien gibt, sogenannte Pathobionten. „Ihre Funktion in ihrer ökologischen Nische zu verstehen, ist eine große Herausforderung“, unterstreicht Prof. Suerbaum. www.infection-research.de | Published by the German Centre for Infection Research (DZIF e.V.) 4 Perspectives Wer sind „wir“? Einer der Vordenker dieser Sichtweise ist Prof. Dr. Martin Blaser, Professor an der School of Medicine der New York University und Leiter des dort angesiedelten Human Microbiome Program. Seiner Hypothese zufolge verändert sich unsere gesamte Mikroflora seit Mitte des 20. Jahrhunderts, drastisch (siehe auch Interview). „Wer sind wir?“ betitelte er 2006 seinen Artikel, in dem er Bezug nimmt auf die Tatsache, dass 90% der Zellen in unserm Körper mikrobiellen Ursprungs sind. Blaser betont die Bedeutung der authochtonen Mikroflora für die gesunde Physiologie des Menschen. H. pylori schließt er darin ausdrücklich ein. Er warnt vor einer verallgemeinerten Bakterienangst, die einen differenzierten Blick auf die Vor- und Nachteile unserer bakteriellen Mitbewohner erschwere - und im Gegenzug die negativen Folgen ihres Fehlens verschleiere. Magenhormone steuern Appetit und Fettproduktion. Wird H. pylori im Mausversuch entfernt, verfettet die Maus. © fotolia / Mirko Raatz Unter seiner Federführung wiesen New Yorker Forscher 2011 einen deutlichen Einfluss von H. pylori auf das Ernährungsverhalten von erwachsenen Menschen nach: Fehlte der Magenkeim, stieg der Spiegel des Appetit regulierenden Hormons Ghrelin signifikant an. Dieses auch „Hungerhormon“ genannte Eiweiß steigert den Appetit und regt außerdem die Fettproduktion an. Auch sein Gegenspieler Leptin wird durch die An- oder Abwesenheit von H. pylori beeinflusst. Die Experten vermuten daher auch einen Zusammenhang zwischen dem Schwinden des alten Magenmitbewohners und der signifikant zunehmenden Fettleibigkeit von Kindern und Jugendlichen. [7] Guter böser Keim? Inzwischen sind einige Faktoren bekannt, die das Risiko erhöhen, mit einem Helicobacter eine behandlungsbedürftige Gastritis und Magenkrebs zu bekommen. Diese gravierenden negativen Effekte betreffen vor allem Erwachsene. Prof. Müller:„Ungünstig wäre, wenn H. pylori ganz verschwände, da er dann nicht mehr von frühester Kindheit an erworben werden kann und uns vor Allergien schützt. Seine positiven Effekte überwiegen jedoch nur bis ins frühe Erwachsenenalter. Danach dominieren die negativen Auswirkungen der Helicobacter-Infektion.“ Prof. Suerbaum gibt zu bedenken: „Weltweit verursacht H. pylori 550.000 bis 600.000 neue Magenkrebsfällen pro Jahr mit hoher Todesrate. Alle Diskussionen über mögliche positive Wirkungen von H. pylori auf den Menschen müssen dazu in Beziehung gesetzt werden und dürfen kein Grund für Passivität sein.“ Einen Impfstoff gegen Helicobacter pylori hält er deshalb für unerlässlich. Noch vor nicht allzulanger Zeit galt der Magen für Lebewesen als so unwirtlich wie der Mond. Mit der kürzlichen Entdeckung, dass neben H. pylori noch eine Vielzahl weiterer Bakterien im Magen nachgewiesen werden können (ob sie dort wirklich ein stabiles Mikrobiom bilden und sich vermehren, ist bislang unklar), www.infection-research.de | Published by the German Centre for Infection Research (DZIF e.V.) 5 Perspectives gewinnt die auch Forschung an dem ersten bekannten Magenbakterium noch einen weiteren spannenden Aspekt hinzu. Die Experten erwarten, dass die Zusammensetzung des neu entdeckten Magenmikrobioms möglicherweise auch die krankmachenden Eigenschaften von H. pylori beeinflussen könnte. [8,9] Seit 2001 überwacht das Nationale Referenzzentrum (NRZ) für Helicobacter pylori am Institut für Medizinische Mikrobiologie und Hygiene des Universitätsklinikums Freiburg Resistenzentwicklung des Magenkeims. Mit der multizentrischen Studie ResiNet identifiziert es relevante Risikofaktoren sowie zeitliche Trends. Ein Hauptrisikofaktor für Resistenzen sind vorherige Antibiotikabehandlungen. Die Primärresistenzraten von H. pylori liegen zurzeit zwischen 7 % (Clarithromycin) und 31 % (Metronidazol). Bereits nach einer erfolglosen Therapie stiegen die Resistenzraten deutlich, nach zwei Anläufen liegen sie bei bis zu 80 %. Parallel dazu stiegen die Doppel- und Dreifachresistenzen stark an. Zwischen 2006 und 2011 ist ein signifikanter Anstieg sowohl der Chinolon-Resistenz (21 % auf 29 %) als auch gegen die Dreifach-Therapie mit Metronidazol/ Clarithromycin/Amoxicillin (13 % auf 19 %) messbar. Quelle: Epidemiologisches Bulletin 3/2013 des Robert-Koch-Instituts. www.rki.de/DE/Content/Infekt/ EpidBull/Archiv/2013/Ausgaben/03_13.pdf Zitate und weiterführende Literatur: [1] Hatakeyama M.; Higashi H. (2005) Helicobacter pylori CagA: a new paradigm for bacterial carcinogenesis. Cancer Science 96: 835–843. DOI:10.1111/j.1349-7006.2005.00130.x. PMID 16367902 [2] Olbermann P et al. (2010) A global overview of the genetic and functional diversity in the Helicobacter pylori cag pathogenicity island. PLoS Genet 6(8): e1001069. DOI:10.1371/journal.pgen.1001069 [3] Falush D et al. (2003) Traces of Human Migrations in Helicobacter pylori Populations. Science 7, Vol. 299: 1582-1585. DOI:10.1126/science.1080857 [4] Linz B et al. (2007) An African origin for the intimate association between humans and Helicobacter pylori. Nature. 445(7130): 915–918. DOI: 10.1038/nature05562 [5] Arnold IC, Hitzler I & Müller A (2012) The immunomodulatory properties of Helicobacter pylori confer protection against allergic and chronic inflammatory disorders. Front. Cell. Inf. Microbio. 2:10. DOI: 10.3389/fcimb.2012.00010 [6] Mathias Oertli et al. (2013) Helicobacter pylori gamma-glutamyl transpeptidase and vacuolating cytotoxin promote gastric persistence and immune tolerance. Proc Natl Acad Sci U S A. 110 (8): 3047-52. DOI: 10.1073/pnas.1211248110. www.infection-research.de | Published by the German Centre for Infection Research (DZIF e.V.) 6 Perspectives [7] Francois et al. (2011) The effect of H. pylori eradication on meal-associated changes in plasma ghrelin and leptin BMC Gastroenterology 11:37. www.biomedcentral.com/1471-230X/11/37 [8] Martin M, Solnick JV (2014) The gastric microbial community, Helicobacter pylori colonization, and disease. Gut Microbes 18 5(3) [9] Lofren J et al.(2011) Lack of commensal flora in H. pylori -infected INS-GAS mice reduces gastritis and delays intraepithelial neoplasia. Gastroenterology 140(1): 210–220. DOI: 10.1053/j. gastro.2010.09.048Gravitz L (2012) Turning a new Phage. Nature medicine 18 (9) 1318- 1320. Moodley Y et al. (2012) Age of the association between Helicobacter pylori and man. PLoS Pathog 8(5): e1002693. DOI:10.1371/journal.ppat.1002693 Yang, I., Nell, S. and Suerbaum, S. (2013) Survival in hostile territory: the microbiota of the stomach. FEMS Microbiology Reviews, 37: 736–761. DOI: 10.1111/1574-6976.12027 Blaser MJ (2006) Who are we? EMBO reports 7, 10 : 956-96 Salama, NR, Hartung ML, Müller A (2013) Life in the human stomach: persistence stratgies of the bacterial pathogen Helicobacter pylori. Nat Rev Microbiol 11(6) 385-399. DOI:10.1038/nrmicro3016 Taube C, Müller A. (2012) The role of Helicobacter pylori infection in the development of allergic asthma. Expert Rev Respir Med. Aug;6(4):441-9. DOI: 10.1586/ers.12.40. Arnold IC, Hitzler I, Müller A. (2012) The immunomodulatory properties of Helicobacter pylori confer protection against allergic and chronic inflammatory disorders. Front Cell Infect Microbiol. 16;2:10. DOI: 10.3389/fcimb.2012.00010. Bik EM et al. (2006) Molecular analysis of the bacterial microbiota in the human stomach. Proc Natl Acad Sci U S A. 103(3):732-7. DOI 10.1073/pnas.0506655103 Lee YY, Mahendra Raj S, Graham DY. (2013) Helicobacter pylori infection--a boon or a bane: lessons from studies in a low-prevalence population. Helicobacter. 2013 Oct;18(5):338-46. DOI: 10.1111/hel.12058. www.infection-research.de | Published by the German Centre for Infection Research (DZIF e.V.) 7