Untersuchung von DNA-Schäden entlang der Spuren
Werbung

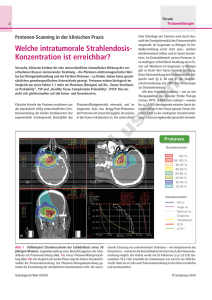
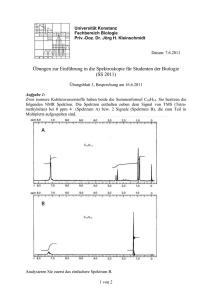
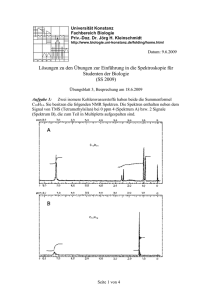
39. DGMP Tagung 2008 in Oldenburg Untersuchung von DNA-Schäden entlang der Spuren niederenergetischer Protonen in Zellkernen Schrögel, Philipp¹; Dr. rer. nat. Andreas Teufel¹, Dr. rer. nat. Cecilia Pizzolotto¹, Dr. med. Luitpold Distel², Prof. Dr. Wolfgang Eyrich¹ ¹Universität Erlangen-Nürnberg, Physikalisches Institut Abteilung IV ²Universitätsklinikum Erlangen, Strahlenklinik Einleitung Die mikroskopisch biologische Wirkung von Protonen- und Ionenstrahlung mit hohen LET-Werten sowie die Reparaturmechanismen von DNA-Schäden, insbesondere von schwierig zu reparierenden „Bulky Lesions“ sind von grundlegender Bedeutung für das Verständnis der Reparatur in Abhängigkeit von der Ionisationsdichte. Die Fragestellung wurde schon vor einiger Zeit in Erlangen aufgeworfen [1] und ist auch momentan Gegenstand weiterer Arbeiten [2],[3]. In diesem Projekt wurden der Erlanger Messplatz reaktiviert und erweitert, um Protonen gezielt in Zellkernen zu stoppen und die Reparatur der entstandenen Schäden entlang der Teilchenspuren zu beobachten. Material und Methoden Die Zellbestrahlungen finden am senkrechten Strahlrohr des Erlanger Tandem-Van-De-Graaf Beschleunigers statt. Der Protonenstrahl wird zur Erzeugung eines homogenen Strahlfelds durch Aufstreufolien aufgeweitet, dessen räumliche Verteilung mit einem Strahlprofildetektor überprüft wird. Die applizierte Dosis wird mit einem Monitordetektorsystem überwacht, das die Protonen am Rand des Strahlrohrs detektiert [4], zusätzlich steht eine Markuskammer (PTW 23343) zur Verfügung. Erste Testmessungen zur Energie und Verteilung der Protonen mit dem pixelierten Silizium-Detektor Medipix [5] lieferten vielversprechende Ergebnisse. Zur Zellbestrahlung wird die Energie der Protonen über die Beschleunigungsspannung und Abschwächungsfolien so gewählt, dass sie in den fast senkrecht zur Strahlrichtung stehenden Zellen (~3°) im Bereich des Bragg-Peaks liegt und die Protonen möglichst im Zellkern gestoppt werden. Die aufgenommenen QDC-Spektren werden zur Energiekalibrierung mit verschiedenen Simulationsdaten verglichen. Ein in das Analyseframework ROOT [6] integriertes Datenaufnahmesystem für die Scaler- und QDC-VME-Module ermöglicht die online-Beobachtung der Daten. Die Zellen werden auf Deckgläsern eingesät und zur Bestrahlung kopfüber in Folienbodenschälchen (2µm Hostaphan) gelegt. Die Schälchen werden dann in Probenhalter eingespannt, die einen Anstellwinkel von 0° bis 15° zum Strahl ermöglichen. Je nach Anstellwinkel legen die Protonen eine unterschiedliche Strecke im Wasser bzw. Medium zurück, worüber ebenfalls der Energieverlust der Protonen in den Zellen variiert werden kann. Einstrahlwinkel Abb.1: Schema der verschiedenen Schichten Wegstrecke in Wasser bzw. Zellmedium 1° 573 µm 2° 287 µm 3° 191 µm 4° 143µm 5° 115µm Abb.2: Weglängen der Protonen bei unterschiedlichen Anstellwinkeln 39. DGMP Tagung 2008 in Oldenburg Ein ferngesteuerter Drehteller ermöglicht die Bestrahlung von mehren Proben nacheinander, im Anschluss werden die Zellen wieder in Petrischalen mit Nährmedium im Brutschrank aufbewahrt und nach unterschiedlichen Reparaturzeiten fixiert und mit Immunostaining angefärbt. Die strahleninduzierten Phosphorylierungen an Reparaturproteinen bilden durch die Markierung mit fluoreszierenden phosphospezifischen Antikörpern deutlich sichtbare Foci in den Zellkernen. Abb.3 (a) mit DAPI gefärbter Zellkern (b) yH2AX Foci, 1h Reparaturzeit (c) PML Foci Abb.4: weitere Spuren aus yH2AX Foci in zwei Zellkernen Ergebnisse Primäre Hautfibroplasten eines gesunden Spenders wurden mit Protonen von ursprünglich 5MeV bei einem Winkel von 3° bestrahlt. Die Abbildung 3 und 4 zeigen die deutlich sichtbaren Teilchenspuren in den Zellkernen. Die Parallelität im Rahmen der Winkelstreuung der Protonen und die Fortsetzung mancher Spuren in benachbarten Zellkernen ermöglichen die Identifikation. Die Protonenenergien sind so zu wählen, das weniger ionisierende Protonen keine einzelnen Schadstellen außerhalb von erkennbaren Spuren verursachen und somit die Auswertung erschweren Diskussion Die hier vorgestellte Methode ermöglicht es, die Protonenenergie so einzustellen, dass die Protonen in den Zellkernen im Bereich des Bragg-Peaks sehr hohe LET-Werte aufweisen beziehungsweise dort auch gestoppt werden. Mit der Kenntnis der damit mikroskopisch deponierten Energie können die Reparaturmechanismen der Bulky Lesions verfolgt werden. Durch eine Bestrahlung zur Erzeugung möglichst klarer Spuren kann die Reparaturkinetik, insbesondere das Verhalten der PML Nuclear Bodies beobachtet werden. Durch die Bestimmung der Kolokalisation der PML Nuclear Bodies und der Doppelstrangbrüche sowie die Kenntnis über die lineare Anordnung der Schadstellen ist es möglich den Reparaturort schwerer DNA-Schäden festzustellen, wie erste Messungen in Erlangen gezeigt haben [1]. Ziel weiterer Untersuchungen soll die Reparatur der DNA Doppelstrangbrüche in den Spuren der Protonen sein, mit besonderer Berücksichtigung der räumlichen Beziehung verschiedener an der Reparatur beteiligter Proteine. Literatur 1. 2. 3. 4. 5. 6. Heinrich Mörtel, „Ursachen für eine erhöhte Relative Biologische Wirksamkeit nach Bestrahlung von Zellen mit niederenergetischen Protonen: Zell- und molekularbiologische Untersuchungen“, Dissertation, Universität Erlangen-Nürnberg, September 2005 Jan Stap et al., „Induction of linear tracks of DNA double-strand breaks by alpha-particle irradiation of cells“, Nature Methods 5 (2008), 261-266 A. Hauptner et al., „DNA-repair protein distribution along the tracks of energetic ions“, Radiation Protection Dosimetry 122 (2006), 147-149 Heinrich Mörtel, „Automation of the particle dosimetry and the dose application for radiobiological experiments at a vertical proton beam“, Nucl. Instr. Meth. A 489 (2002), 503-508 X. Llopart and M. Campbell, „First test measurements of a 64k pixel readout chip working in single photon counting mode“,Nucl. Instr. Meth. A 509 (2003), 157-163 http://www.root.cern.ch