Allergologie Skriptum zum Wahlfach SE 514011 1) Verwendete
Werbung

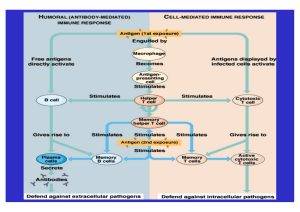
Allergologie Skriptum zum Wahlfach SE 514011 1) Verwendete Unterlagen/ Bücherempfehlung: Abbas, Lichtman, Pober: Immunologie Janeway, Travers: Immunologie Roitt,Brostoff, Male: Kurzes Lehrbuch der Immunologie Heppt, Renz, Röcken: Allergologie zusammengestellt von Dr. Beatrice Jahn-Schmid Institut für Pathophysiologie Zentrum für Physiologie, Pathophysiologie und Immunologie Juni 2007 1) Die Inhalte dieser Präsentation sind ausschließlich für Lehrzwecke bestimmt Inhaltsverzeichnis Seite 1. Immunologische Mechanismen 3 1.1. Das Immunsystem 3 1.2. Zellen des Immunsystems 3 1.3. Phasen der spezifischen Immunantwort 4 1.4. Vom Antigen zum Antikörper 4 1.5. Antikörper / Ig-Subklassen 5 1.6. Monoklonale Antikörper/ CD Nomenklatur 7 1.7. T-Zell-Immunantwort 7 1.8. Antigen-präsentierende Zellen (APC) 10 2. Allergie 11 2.1. Hypersensibilität Typ I-IV 11 2.2. Typ I Allergie 12 2.2.1. Der atopische Formenkreis 12 2.3. Allergene 13 2.4. IgE -Rezeptoren 15 2.5. Pathomechanismus 16 2.5.1. Sensibilisierungsphase 16 2.5.2. Effektorphase 17 2.6. Nicht-IgE-vermittelte Mastzell-Degranulierung 18 3. Allergie-Diagnostik 18 3.1. Pathogenetische Faktoren 18 3.2. Erscheinungsformen der Allergie 19 3.3 Diagnostik 20 3.3.1 Diagnostik in vivo 20 3.3.2. Diagnostik in vitro 21 4. Allergie-Therapie 22 3.1. Anti-allergische und anti-entzündliche Pharmakotherapie 22 3.2. Kausaltherapie/Spezifische Immuntherapie 25 3.3. Neue Konzepte in der spezifischen Immuntherapie 26 2 1. Immunologische Mechanismen 1.1. Das Immunsystem Die Immunabwehr gliedert sich in eine angeborene (natürliche) Immunität, die eine schnelle Reaktion auf Erreger und Noxen ermöglicht und eine spezifische (erworbene) Immunität. Die spezifische (erworbene) Immunantwort stellt erst die zweite Verteidigungslinie dar, hat aber die Möglichkeit ein spezifisches Gedächtnis auszubilden, das bei einem erneuten Kontakt mit demselben Erreger eine schnellere und verstärkte Abwehrreaktion ermöglicht. Beiden Systemen stehen für die Abwehr humorale (lösliche) als auch zelluläre Mechanismen zur Verfügung. Natürliche Immunität: Epitheliale Barriere, Phagozyten, NK-Zellen; anti-mikrobielle Peptide, Komplement, Interferone Spezifische Immunität: B-Lymphozyten > humorale Antikörper (Immunglobulin)/ T-Lymphozyten (zelluläre Immunität) 1.2. Zellen des Immunsystems Alle Zellen des Immunsystems leiten sich von Stammzellen aus dem Knochenmark ab. Sie reifen über verschiedene Vorstufen (Precursor) zunächst in primären lymphatischen Organen, und differenzieren dann in sekundären lymphatischen Organen, wo sie auf fremdes Antigen treffen zu Effektor-Zellen. Effektor-Funktionen von Lymphozyten: B-Zellen: Antikörpersekretion Reifung im Knochenmark (bone marrow) / bei Vögeln in der Bursa fabricii - extrazelluläre Erreger T-Zellen: Reifung im Thymus Helfer-T-Zellen: Aktivierung von T- und BZellen (Proliferation und Differenzierung) - Aktivierung von Makrophagen zur 3 Tötung intrazellulärer Erreger. Zytotoxische T-Zellen (CTL): Zell-Lyse NK-Zellen: Zell-Lyse -Tötung infizierter Zellen/ Tumorzellen Eliminierung des Infektionsresevoirs Regulatorische T-Zellen: aktive Immunsuppression 1.3. Phasen der spezifischen Immunantwort Erkennungsphase: Aktivierungsphase: Effektorphase: Antigene binden an klon-spezifische Rezeptoren der naiven Lymphozyten. Mind. zwei Signale sind notwendig. Es kommt zu einer klonalen Expansion der antigen-spezifischen Lymphozyten und zur Differenzierung in Effektorzellen oder Gedächtniszellen. Effektorzellen erfüllen ihre Aufgabe (Antikörper-, Zytokinproduktion, Lyse) 1.4. Vom Antigen zum Antikörper Das membranständige Immunglobulin ist der spezifische Antigen-Rezeptor der BZellen. Extrazelluläres Antigen bindet an den B-Zell-Rezeptor (BCR) und wird von der BZelle internalisiert und in Lysosomen degradiert zu Peptiden (Antigen-Prozessierung). Diese Peptide binden an MHC-Klasse II Moleküle* und werden mit diesen zur Zelloberfläche zurücktransportiert (Antigen-Präsentation). T-Zellen, deren Antigen-Rezeptor (TCR) spezifisch für diesen MHC-Klasse II/PeptidKomplex sind, können mit der B-Zelle interagieren. Dabei setzt die T-Helfer-Zelle Zytokine frei, die zur Aktivierung und zur Differenzierung der B-Zelle in Plasmazellen und Antikörperproduktion führen. 4 * MHC=major histocompatibility complex / Haupthistokompatibilitätskomplex; im Mensch HLA genannt: human leukocyte antigens; membranständige HLA-Klasse I (HLA-A, -B, -C) und HLA-Klasse II ( HLA-DR, -DP, -DQ) Moleküle, die für die Transplantatabstoßung eine wichtige Rolle spielen, da die Genprodukte des MHC polymorph sind (d.h. versch. Individuen besitzen unterschiedliche MHC-Spezifitäten). MHC Klasse I: auf allen kernhaltigen Zellen, jedes Klasse I Molekül ist mit einem 2-Mikroglobulin Molekül assoziiert. MHC Klasse II: bestehen aus - und -Kette; konstitutiv exprimiert auf dendritischen Zellen, B-Zellen, Thymusepithelzellen 1.5. Antikörper/ Immunglobulin (Ig)-Klassen Antikörper: Struktur/Funktion Antikörper bestehen aus 4 Polypeptidketten, 2 schweren und 2 leichten Ketten, die durch Disufidbrücken verbunden sind. Der Fab-Teil (variable Region/enthält hypervariable Regionen) dient der Antigenerkennung, der Fc-Teil (konstante Region) bestimmt die biologische Funktion (z.B: Rezeptor-/ Komplement-Bindung). Bsp: IgE Antigen- V, variable Region Bindungsstellen C, konstante Region Disulphidbrücken (rot) Glykosylierungsstellen (grau) Domänenstruktur Es gibt 2 Typen von leichten Ketten lambda () und kappa () Die Ig-Klasse und damit die Effektorfunktion wird bestimmt durch die schwere Kette. Es gibt 5 Ig-Klassen (Isotypen): IgM, IgD, IgG, IgA, IgE. IgG ist bei weitem die häufigste Ig-Klasse und umfaßt 4 verschiedene Subklassen (IgG1,2,3 und 4). 5 IgM und IgE besitzen eine zusätzliche konstante Region, aber keine „Hinge“ Region („Scharnier/Gelenk“/ mobiler Anteil) zwischen Fc- und Fab-Teil. IgM und IgA bilden Polymere (IgM: Pentamer; IgA: Dimer). Hauptfunktionen der Antikörper: Unschädlich machen eines fremden Mikroorganismus oder Antigens durch: Neutralisierung Opsonisierung Komplement-Aktivierung Funktionen der verschiedenen Ig-Subklassen: 6 1.6. Monoklonale Antikörper/CD Nomenklatur Monoklonale Antikörper gegen spezielle Proteine können durch Immunisierung (z.B. von Mäusen) und Fusion der B-Zellen aus dem immunisierten Tier mit murinen Myelomzellen und nachfolgender Selektion der Ak-produzierenden, unsterblichen Zellen gewonnen werden. Diese sog. Hybridomzellen, werden kloniert und der Zellklon, der den gewünschten Ak produziert wird expandiert und zur unlimitierten Antikörperproduktion herangezogen. Eine neue, schnellere Methode zur Herstellung monoklonaler Antikörper bzw. von Fab- oder einzelnen variablen Regionen (sFv) bedient sich rekombinanter cDNA-Banken, die über 10 Milliarden Spezifitäten enthalten. Diese werden auf der Oberfläche von Bakteriophagen exprimiert („Phage-display“) und gegen die gewünschten Antigene in vitro getestet. Solche rekombinanten Antikörper machen bereits ca. 30% aller derzeit in der klinischen Prüfung befindlichen Biopharmazeutika aus. Die Antikörper dienen der Identifizierung und Phänotypisierung von Zellen (z.B. CD Antigene, Durchflußzytometrie), der Diagnostik (z.B. dem Nachweis spezifischer Antigene oder Antikörper (z.B. ELISA) und der Therapie (z.B. anti-TNF in Rheumatoider Arthritis). CD Nomenklatur Oberflächenmoleküle können als Marker für spezielle Zellpopulationen, die diese exprimieren, verwendet werden. Die internationale Nomenklatur für solche Zellmarker ist das CD (cluster of differentiation)-System. Die Funktionen dieser Oberflächenmoleküle sind divers und manche sind für einen bestimmten Zelltyp (z.B. CD4 T Helfer Zellen) oder eine best. Abstammungslinie spezifisch („lineage-marker“: z.B.: CD3 für TZellen, CD20 für B-Zellen). Monoklonale Antikörper, die spezifisch diese Oberflächenantigene erkennen, können zur Zellcharakterisierung eingesetzt werden. Anwendung: Diagnostik: Bestimmung der absoluten und relativen Zahl verschiedener Zelltypen (Durchflußzytometrie/ bes. im hämatologischen Bereich) Therapie: „targeting“ (Stimulation, Entfernung oder Isolation gewünschter Zelltypen) Forschung: Charakterisierung von Zellen und Funktionen, vielfältig 1.7. T-Zell-Immunantwort Alle T-Zellen exprimieren auf ihrer Oberfläche den CD3/TCR-Komplex. 7 CD3 dient der Signal-Leitung und ist ein „Lineage“-Marker, d.h. ein Oberflächenmolekül, das ausschließlich auf T-Zellen exprimiert ist. Expression von CD4: Helfer-T-Zellen (Th) -> B-Zell-Hilfe (Steigerung der Ig-produktion), Aktivierung der angeborenen Immunität (Makrophagen, NK-Zellen), Produktion von Entzündungsmediatoren (IFN-, TNF) Expression von CD8: Zytotoxische T-Zellen (CTL) -> Virenabwehr, Tumorüberwachung, Transplantatabstoßung Antigenerkennung: Im Gegensatz zu den B-Zellen, deren spezifische Rezeptoren natives Antigen binden, erkennt der T-Zell-Rezeptor als Ligand lineare Peptide, die erst durch Prozessierung des Antigens in Antigen-präsentierenden Zellen entstehen und eingebettet in MHCKlasse I- (CD8+ T-Zellen) oder MHC-Klasse II (CD4+ T-Zellen) Moleküle auf der Oberfläche von Antigenpräsentierenden Zellen dargeboten werden. Antigen-präsentierende Zellen (APC): Dendritische Zellen, Makrophagen, B-Zellen Endogen produzierte Proteine, die ins Zytosol gelangen (z.B. virale Antigene) landen nach der Prozessierung in Proteasomen im ER schließlich in MHC-Klasse I-Molekülen. Letztere haben eine besondere Affinität zu CD8-Molekülen und interagieren deshalb nur mit CD8+ TZellen. Exogene Antigene dagegen (z.B. Allergene, Bakterien) werden von APC endozytiert und in Endosomen bei saurem pH enzymatisch zu Peptidfragmenten degradiert. Nach Fusion mit Vesikeln, die MHC-Klasse II Moleküle enthalten, werden letztere mit den Peptiden beladen und können dann CD4-Zellen stimulieren. T-Zell-Aktivierung: die „Immunologische Synapse“ Für die T-Zell-Aktivierung sind mindestens 2 Signale notwendig: CD4 oder CD8 1. TCR-MHC/Peptid-Interaktion 2. Ko-stimulierende Oberflächenmoleküle (z.B.: CD80, CD86, ICAM-1) auf APC Ein 3. Signal kann z.B. für die Differenzierung ausschlaggebend sein (z.B. Interleukin(IL)-12->Th1) 8 Naive T Zellen werden durch die Interaktion mit Dendritischen Zellen „geprimed“. Sie proliferieren und produzieren zunächst ein sehr eingeschränktes Spektrum an Zytokinen (Th0; IL-2). Bei weiterer Aktivierung differenzieren die T-Zellen in Effektor- oder Gedächtniszellen. CD4+ T-Helferzellen (Th) können in verschiedene funktionelle „Subsets“ eingeteilt werden: Th1 (Leit-Zytokin: IFN-) : -> Inflammation Aktivierung von Makrophagen , CD8-, NK-Zellen ->Zelluläre Immunabwehr Th2 (IL-4, IL-5, IL-13): -> humorale Abwehr Wurmabwehr, Allergie IL-4, IL-13 -> B-Zell-Switch zur IgE-produktion IL-4 ->Wachstums-/Differenzierungsfaktor für Th2 IL-5-> Eosinophilen-Rekrutierung und Aktivierung Th17 (IL-17): v.a. relevant in der Autoimmunität Außerdem gibt es verschiedene regulatorisch wirkende CD4+ Suppressor-Zellen die ihre Funktion über Zell-Zell-Kontakt oder suppressive Mediatoren ausüben, z.B. : CD4+CD25+ Treg (IL-10/TGF-), Tr1 (IL-10),Th3 (TGF-) -> orale Toleranz von Nahrungsmitteln, Verhinderung von Autoimmunität und überschießenden Immunreaktionen, d.h. Abdrehen der normalen Immunantwort Die Differenzierung von T-Zellen involviert sowohl mehrmalige Zellteilung als auch den Einfluß des jeweiligen ‚Microenvironments’. Eine Rolle spielen z.B. Dosis, Route des Antigens, Eigenschaften der APC oder des Antigens (z.B. partikulär vs. löslich). Eine Differenzierung in verschiedene Effektor-Subpopulationen wird durch bestimmte Zytokine bewirkt, die aus den APC oder von anderen Zellen in der Umgebung stammen: Th1: IFN-, IL-12 Th2: IL-4 Th17: IL-6, TGF- Treg: IL-10 z.B.: Th1/Th2Differenzierung 9 Bei der T-Zell-Differenzierung wird die Expression von Genen (z.B. für bestimmte Zytokine) induziert oder reprimiert. Verschiedene Transkriptionsfaktoren sind für die unterschiedliche Differenzierung von CD4-TZellen verantwortlich bzw. kennzeichnend, z.B.: für Th1: T-bet, STAT-4 Th2: GATA-3, STAT-6 Treg: Foxp3 Im Laufe der Differenzierung kommt es zu epigenetischen Umstrukturierungen am Chromatin wie Hyperacetylierung von Histonen und Demethylierung von DNA, so dass relativ stabile T-Zell-Phänotypen entstehen. 1.8. Antigen-präsentierende Zellen (APC) Professionelle APC: Diese Zellen exprimieren MHC-Klasse I/II Antigene (Antigenpräsentation) und sind in der Lage, gleichzeitig Ko-stimulierende Signale zu liefern, um naive T-Zellen zu aktivieren: Dendritische Zellen (DC) (in Milz, Lymphknoten); Langerhans-Zellen (in der Haut), B-Zellen (potent in der Präsentation von Antigen, das vom eigenen Antikörper erkannt wird) und Monozyten/Makrophagen (ähnlich: Mikroglia-Zellen im Gehirn, Kupffer-Zellen /Leber). Reife DC sind bei weitem die potentesten APC in der Aktivierung naiver T-Zellen (Priming). Unreife dendritische Zellen (MHC und Kostimuli schwach exprimiert; stark phagozytisch) nehmen das Antigen an der Infektionsstelle im Gewebe auf, werden dabei aktiviert, wandern zu den lokalen Lymphknoten, wo sie als reife DC (MHC, Ko-Stimuli wie CD80, CD86 etc. und Adhäsionsmoleküle stark exprimiert) mit naiven T Zellen interagieren. Nicht professionelle APC: z.B.: Endothelzellen, Epithelzellen, Fibroblasten: sie exprimieren normalerweise keine MHC Klasse II- Antigene können diese aber fakultativ exprimieren (z.B. nach Stimulation durch IFN-) und Antigene präsentieren. Antigen-Aufnahme in die APC Partikuläre oder lösliche Antigene können per Phagozytose oder Pinozytose aufgenommen werden. Wesentlich effizienter ist hingegen die Rezeptor-vermittelte Aufnahme von Antigenen über: – „Pattern Recognition“ Rezeptoren z.B.: CD14 für LPS (Monozyten) 10 – membrangebundenes Ig (B-Zellen) – Komplementrezeptoren: C3bR=CD35 (Monozyten, B-Zellen) – Fc Rezeptoren: Fc CD64 DC, Monozyten/Makrophagen Fc CD32 Monozyten/Makrophagen, B-Zellen Fc CD16 Makrophagen, B-Zellen - FcRI: - FcRII: 2. DC, Monozyten/Makrophagen CD23 B-Zellen, akt. Makrophagen, follikuläre DC Allergie 2.1. Hypersensibilität vom Typ I-IV Einteilung der allergischen Reaktionen nach Coombs und Gell (1963): Die Überempfindlichkeitsreaktionen vom Typ I-III sind Antikörpervermittelt. In der Pathogenese der Typ IV-Reaktionen spielen TLymphozyten die entscheidende Rolle (z.B.: Tuberkulin-Reaktion). Obige Abbildung zeigt eine Zusammenfassung der verschiedenen pathologischen Immunreaktionen. 11 2.2. Typ I Allergie Der Begriff Allergie wurde von Clemens von Pirquet (1906-Ordinarius der Kinderklinik in Wien) geprägt: grch. allos (anders, verändert); ergos (Arbeit),) Aktion Definition : Allergie= Veränderte Reaktivität des Immunsystems; sie ist nicht protektiv sondern überschießend und für den Körper schädlich. d.h. –>Allergie ist eine sog. Überempfindlichkeitsreaktion, bei der eine per se nicht schädliche Substanz in prädisponierten Individuen eine Immunantwort auslöst und damit zu Krankheitserscheinungen führen kann. Bereits vor 4000 Jahren starb Pharao Menses an einer BienengiftAllergie. Die Zahl der Allergiker steigt ständig an. Epidemiologische Studien zwischen 1926 und 1995 haben z.B. den enormen Anstieg der Prevalenz an Pollenallergien von 1.2% auf 16.3% gezeigt. 2.2.1. Der atopische Formenkreis: Atopische Dermatitis - Allergische Rhinitis/Konjunktivitis - Allergisches Asthma bronchiale Bei der Atopie handelt es sich um eine typische Überreaktion der Th2Immunantwort. Die Zahl der IL-4 produzierenden T-Zellen im Blut von Atopikern ist höher als die von normalen Kontrollpersonen. Daher findet man praktisch immer erhöhte Gesamt-IgE-Spiegel, 2-10x über dem Normalwert von 50ng/ml (= 0.001%Ig), allergen-spezifisches IgE und Eosinophilie. Es gibt im englischen Sprachgebrauch den Begriff „atopy“, der mit Typ I Allergie gleichgesetzt wird. Es gibt aber Typ I-Allergie ohne Atopie oder auch Atopische Dermatitis ohne Typ I Allergie. Prävalenz atopischer Erkrankungen: Positiver Hauttest: Tatsächliche atopische Erkrankung: 30% 15-20% Aeroallergene: max. Prävalenzrate zwischen 15-30 Jahren Atopische Dermatitis: 50% der Betroffenen im 1. Lebensjahr 90% im Alter von 1-3 Jahren 12 Asthma bronchiale: 5-10% Prevalenz, ist damit die häufigste chronische Kinderkrankheit! Altersabhängige Inzidenzrate (erstes Auftreten) von Symptomen: Inzidenz Nahrungsmittelallergie Atopische Dermatitis Asthma Allergische Rhinitis 0 0.5 1 3 7 15 Alter (Jahre) Im frühen Kindesalter überwiegen Nahrungsmittelallergie und Atopische Dermatitis, während allergische Rhinitis und Asthma bronchiale erst im Schulalter auftreten. Etwa 25% der Patienten mit Rhinitis entwickeln später mit Fortbestehen der Allergie eine Asthma-Symptomatik („Etagenwechsel“). Obwohl es Unterschiede zwischen Rhinitis und Astma gibt, legen pathophysiologische Studien nahe, dass obere und untere Atemwege von einem gemeinsamen, wahrscheinlich fortschreitendem Entzündungsprozess betroffen werden. 2.3. Allergene Definition: Ein Allergen ist ein Antigen, das potentiell zu einer Sensibilisierung mit dem nachfolgendem Zustand der Überempfindlichkeit führen kann. Eine Allergenquelle (z.B.: Pollen, Tierhaare, Schimmelpilze) kann eine Reihe von Allergenen enthalten. Diese werden definiert über ihre Fähigkeit, IgE aus sensibilisierten Individuen zu binden und aus Effektorzellen Histamin freizusetzen. Diese Proteine oder Glycoproteine werden nach ihrer Relevanz in Hauptallergene (Protein gegen das > 50% aller gegen diese Allergenquelle allergischen Patienten spezifische IgE-Antikörper besitzen; z.B.: 13 Bet v 1- 95% der Birkenpollenallergiker sind auf Bet v 1 sensibilisiert) und Nebenallergene (<50% Prävalenz; z.B. Bet v 2) unterteilt. Sog. Panallergene sind Allergene, deren Homologe ubiquitär in vielen, eigentlich nicht verwandten Spezies vorkommen und deshalb oft zu Kreuzreaktivität führen (z.B. Bet v 2= Profilin). Häufige Allergenquellen: inhalative Allergene: saisonal: Pollen (Gräser, Bäume, Unkräuter); Symptome nur während der entprechenden Blühperiode perennial: Hausstaubmilben-Ausscheidungen (nicht Staub!), Tierhaare/-epithelien, Schimmelpilzsporen sind oft Ursache für Asthma bronchiale Nahrungsmittelallergene: Die häufigsten Nahrungsmittel, die im Kleinkinderalter eine Typ-I-Allergie auslösen sind: Kuhmilch, Hühnerei, Weizen, Nüsse. Diese Form der Allergie verschwindet normalerweise wieder. In Erwachsenen sind Nahrungsmittelallergien seltener und sind häufig gegen Gemüse, Obst, Gewürze, Milch/-produkte, Fisch, Krebstiere, Muscheln, Nüsse oder Getreide gerichtet. In Folge einer Pollen-Allergie kann es auch zu Kreuzreaktionen von Pollen-spezifischem IgE mit Nahrungsmittelbestandteilen kommen. Diese Kreuzreaktion basiert auf Homologien von Proteinen in den Nahrungsmitteln mit Pollenallergenen, z.B. mit dem BirkenpollenHauptallergen Bet v 1 (Kreuzallergien: Apfel, Pfirsich, Haselnuß, Kirsche, Sellerie, etc.). Beifußpollen-Allergiker sind oft auch allergisch auf Sellerie und verschiedene Gewürze, oder Ragweed-Allergiker auf Melone. „Non-atopische“ Allergene: d.h. Substanzen, die auch in nicht atopisch prädisponierten Individuen Allergien auslösen sind z.B.: Insektengifte: besonders aus Biene und Wespe oder Medikamente: Penicillin, andere Antibiotika, Analgetika (Haptene, die an Serumproteine gebunden als Vollallergen wirken) Charakteristika von Allergenen: Mit wenigen Ausnahmen sind Allergene Proteine oder Glykoproteine mit 5-100 kDa molekularer Masse. Meist sind sie wasserlöslich (d.h. sie lösen sich z.B. im Sekret der Schleimhäute). Sie müssen von Lymphozyten des spez. Immunsystems als Fremdantigen erkannt werden. Für 14 die Sensibilisierung notwendige Allergendosen sind nicht genau bekannt, aber sehr niedrig (µg-Bereich). Die physikalischen und chemischen Eigenschaften von Allergenen treffen auch auf viele Moleküle zu, die keine allergene Potenz besitzen. Die bekannten Allergene lassen sich zwar grob in bestimmte StrukturKlassen einteilen, aber die Allergenizität eines Proteins lässt sich nicht a priori aus seiner Struktur vorhersagen. Allergen-Homologe, d.h. sehr verwandte, struktur-ähnliche Proteine aus anderen Spezies können allerdings Kreuzallergene darstellen (s.o. z.B. viele Nahrungsmittelallergene) und allergische Symptome auslösen. Nomenklatur: Allergene werden entsprechend ihrer biolog. Taxonomie benannt z.B.: Bet v 1 aus Betula vulgaris (Birke), Phl p 1 aus Phleum pratense (Lieschgras). Die ersten 3 Buchstaben der Gattung, erster Buchstabe der Art, und eine arabische Zahl, die in der Reihenfolge ihrer Identifikation erteilt wird und nicht immer die Relevanz des betreffenden Allergens widerspiegelt. 2.4. IgE-Rezeptoren FcRI: =hoch-affiner IgE-Rezeptor Tetrameraus (extrazellulär; Bindung von IgE)und2-Ketten (trans-membranös bzw.intrazellulär; Signalübertragung). Expression insbesondere auf Mastzellen und Basophilen, aber auch auf Eosinophilen und Langerhans-Zellen der Haut, Monozyten und Makrophagen. Die Interaktion von IgE mit dem FcRI führt zu einer Erhöhung seiner Expression. Deshalb ist die Rezeptorzahl auf den Effektorzellen bei Allergikern erhöht. Eine lange Verweildauer des Rezeptor-gebundenen IgE erhöht die Halbwertszeit des IgE (T1/2: 3 Wochen vs. Serum T1/2: 2-3 Tage) beträchtlich. FcRII: =niedrig-affiner IgE-Rezeptor (CD23) auf Lymphozyten, Eosinophilen, Makrophagen, Langerhanszellen, Thrombozyten -> Aktivierung der Immunantwort durch IgE-Immunkomplexe/ Verstärkte, spezifische, IgE-vermittelte Allergenaufnahme in APC. 15 2.5. Pathomechanismus Prausnitz und Küstner: 1921 Selbstversuch / gegenseitige Übertragung der Allergie durch Serum (PCA / passive cutaneous anaphylaxis) 3 Komponenten sind nötig: 1. Allergene 2. Spezifische Serumfaktoren von allergischen Individuen (Allergen-spezifische IgE Antikörper) 3. Gewebekomponenten in allen Individuen (Effektorzellen = Mastzellen) Die Grundlage einer jeden Allergie ist eine spezifische Immunreaktion, wobei eine Phase der Sensibilisierung von der Effektor-Phase zu unterscheiden ist. Die Effektormechanismen verursachen erst die eigentlichen Allergie-Symptome. 2.5.1. Sensibilisierungsphase Die Sensibilisierung kann über verschiedene Routen führen: häufig inhalativ, oral). Normale Allergene (z.B. aus Pollen) lösen präferentiell in Atopikern Typ I Allergien aus. Sog. „nicht-atopische“ Allergene wie z.B. Insektengift oder Penizillin, können bei mehrmaliger Injektion in 16 bestimmter Zeitfolge auch in nicht-disponierten Individuen zu einer allergischen Sensibilisierung führen. Das Allergen kommt bei seinem Eintritt in die Mukosa zunächst mit Antigen-präsentierenden Zellen (dendritische Zellen; Langerhanszellen) in Kontakt. Diese nehmen das Protein auf, prozessieren es und präsentieren Peptid-Epitope an Th Zellen. In Allergikern entsteht bei dieser Immunantwort ein Übergewicht an Zellen der Th2-Subpopulation, die neben anderen Zytokinen große Mengen an IL-4, IL-13 und IL-5 produzieren. IL-4 und IL-13 induzieren in B-Lymphozyten einen Ig-Switch und die Produktion von IgE. IL-5 rekrutiert und aktiviert eosinophile Granulozyten. IgE Antikörper binden über ihren Fc-Teil an hoch affine FcRI von Basophilen und Mastzellen (Effektorzellen). Die Zellen sind damit „sensibillisiert“ und können aufgrund der Stabilität dieses IgERezeptor-Komplexes über lange Zeit, bei erneutem Allergenkontakt, eine allergische Situation auslösen. 2.5.2. Effektorphase Die Effektorphase gliedert sich in 2 Phasen, eine Sofort- und eine Spätreaktion. Soforttypreaktion: Sie tritt typischerweise innerhalb von 5-15 Minuten nach Antigenkontakt ein und kann sowohl lokal als auch systemisch auftreten. Es werden aus den Mastzellen, bereits in Granula gespeicherte Substanzen (Entzündungsmediatoren und Spasmogene) freigesetzt: Histamin, Tryptase, Kininogenase. V.a. Histamin löst eine akute Entzündung aus. Histamin erweitert kleine Blutgefäße (große werden kontrahiert) und erhöht deren Permeabilität, Es verursacht Juckreiz, Schmerz und Kontraktion lokaler glatter Muskulatur (z.B.: in den Bronchien). Die typische Hauteffloreszenz der Typ I Allergie ist die Quaddel-Erythem Reaktion (engl. wheal and flare) wie sie z.B. im Pricktest zu beobachten ist. Auch die Symptome der Inhalationsallergien (Rhinitis, Konjunktivitis) sind v.a. Histaminwirkungen und können daher gut mit Histaminrezeptorantagonisten (Antihistaminika, H1-Rezeptorenblockern) bekämpft werden. Spätphasenreaktion Im Rahmen der Mastzelldegranulation werden auch verschiedene chemotaktische Faktoren (z.B. ECF-A eosinophilic chemotactic factor, 17 NCF neutophilic chemotactic factor) und Zytokine freigesetzt (TNF, IL-3, IL-4, IL-5, IL-8), die auf Entzündungszellen und Endothel wirken. Innerhalb von 6-8 Stunden entsteht ein Infiltrat von Granulozyten (viele Eosinophile) und Lymphozyten (v.a. Th2). Über Aktivierung von Phospholipase A wird aus der Membran Arachidonsäure freigesetzt, das in potente Entzündungsmediatoren metabolisiert wird (Leukotriene, Prostaglandine, Thromboxan). In der Haut präsentiert sich die Spätphasenreaktion als eine histologisch dicht infiltrierte Effloreszenz. Besonders bedeutend ist die Spätphasenreaktion für das allergische Asthma bronchiale. 2.6. Nicht-IgE-vermittelte Mastzelldegranulation Mastzellen spielen nicht nur bei der Typ I Allergie eine wichtige Rolle, sondern sind auch im Rahmen normaler Entzündungs- und Abwehrvorgänge von Bedeutung. Mastzellen werden degranuliert durch: - physikalische Reize (Traumen): es kommt zu einer akuten Entzündung, wobei Immunzellen rekrutiert werden, die -falls nötig- eine Immunantwort ermöglichen - Anaphylatoxine (Spaltprodukte des Komplementsystems: C5a, C3a) - Tachykinine: z.B. Substanz P, Neurokinin A,B - Medikamente: Opiate, Röntgenkontrastmittel, Insektengifte - Lektine (Proteine oder Glykoproteine die an Kohlehydrate binden) Nicht-IgE-vermittelte Mastzelldegranulation mit Anaphylaxie-ähnlichen Symptomen heißen „anaphylaktoide Reaktionen“. Diese können gelegentlich durch Medikamente (z.B. Röntgenkontrastmittel) oder bei massiver Komplementaktivierung durch Anaphylatoxine ausgelöst werden. 3. Allergie-Diagnostik 3.1. Pathogenetische Faktoren - Genetische Prädisposition: multiple „Atopie-Gene“ -> Struktur- und Promoter-Varianten verschiedener Gene sind mit Atopie assoziiert, z.B.: auf Chromosom 11: FcRI; auf Chromosom 5: IL-4-Promoter, IL-4R TIM/T-Zell-Oberflächenantigene, IL-12 p 40; 18 Polymorphismus in Gen ADAM33 =bronchiale Metalloproteinase ->Assoziation mit Asthma Das Kind erbt Veranlagung zur Atopie (Ausnahmen: Penizillin, Bienengift), Schweregrad und Art der Organbeteiligung, jedoch nicht die Allergiespezifität! Man geht davon aus, dass Allergien das Resultat überlappender Genkonstellationen sind und zusätzlich durch unterschiedliche Umweltfaktoren beeinflusst werden. Generell ist eine Zunahme der Allergien mit dem sog. „Westlichen Lebensstil“ verbunden. So geht etwa die „Hygienehypothese“ davon aus, dass die heutige geringere bakterielle und parasitäre Exposition der Bevölkerung (hoher Hygiene-Status; Durchimpfung der Population) die Entgleisung des Immunsystems bewirkt. Adjuvante Faktoren spielen ebenso eine Rolle (z.B.: Luftverschmutzung: Ruß/Diesel-Exposition, Raucherkinder -> Asthmarisiko stark erhöht). Risikofaktoren für Allergie-Entwicklung: - Allergiker in der Blutsverwandtschaft; - Frühe Entwicklung von allergischen Symptomen bei AllergenExposition in Nahrung u. Luft (z.B.: Kuhmilch, Milbenallergene) - Kleinfamilie, hohes soziales Niveau; wenig durchgemachte Infektionen; Tabakrauch der Eltern; Schutzfaktoren: - Großfamilie mit mehreren Geschwistern und Tieren im Haushalt, - Früher Kontakt mit Stall-Tieren (Bauernhof/ 1. Lebensjahr ist relevant) - Früher Besuch einer Kinderkrippe 3.2. Erscheinungsformen der Allergie Symptomatik: von lokal (d.h. am Ort des Kontaktes mit dem Allergen) bis systemisch; Maximalvariante: anaphylaktischer Schock Allergische Rhinokonjunktivitis: unangenehmer Schnupfen, Niesanfälle („Heuschnupfen“), Bindehautentzündung bei Inhalation des Allergens oder Auftreffen des Allergens über den Luftweg. Allergisches Asthma bronchiale: Asthma =grch. „Atemnot“ Oft Folge einer unbehandelten Rhinitis („Etagenwechsel“). Definition: Variable und reversible Bronchialobstruktion infolge entzündlicher Veränderungen der Bronchialschleimhaut (vermehrte 19 Schleimbildung; Ödeme) und Hyperreaktivität der Atemwege (Verkrampfung der Bronchialmuskulatur). Typischer zwei-phasiger Verlauf mit Soforttypreaktion innerhalb von Minuten mit anschließender Besserung der Bronchialobstruktion, dann lang andauerende Obstruktion aufgrund der Spätphasenreaktion. Nahrungsmittelallergie: Orales Allergie-Syndrom: lokale Reaktionen an der Mundschleimhaut (Jucken, Bläschenbildung, Schwellung im Rachenraum und der Zunge), Erbrechen, Durchfall. Systemische Symptome: Urtikaria, Angioödem (Quincke Ödem), Asthma bronchiale, anaphylaktischer Schock. Insektengiftallergie: Symptome: über das normale Maß hinaus verstärkte Lokalreaktionen (Schwellung > handtellergroß), über leichte-mittlere systemische Reaktion mit Asthma bronchiale, Urtikaria, Schwindel, Diarrhoe etc. bis zum anaphylaktischer Schock. Medikamentenallergie: Urtikaria, Arzneimittelexantheme bis hin zum anaphylaktischer Schock. 3.3. Diagnostik der Typ I Allergie genaue Anamnese; vor allem zu beachten: Familiengeschichte, Auftreten der Symptome: Seit wann? Ob perennial/saisonal? Mögliche Allergenexposition (zuhause/ beruflich)? Probleme beim Verzehr von bestimmten Nahrungsmitteln? 3.3.1. In vivo-Diagnostik: Der Prick-Test ist ein Test bei dem flüssige Allergenextrakte an der Innenseite der Unterarme eingeritzt (“geprickt”) werden. Falls eine Überempfindlichkeit besteht, entsteht nach einigen Minuten eine Quaddel/Erythem-Reaktion. Der Intrakutan-Hauttest ist sensitiver als der Prick-Test und wird z.B. bei Verdacht auf Insektengift angewendet: intrakutane Injektion von 50µl Allergenlösung ausgehend von 1% der im Prick-Test negativen Lösung. Provokationstests: Es kann notwendig sein, den Patienten mit dem Allergen direkt zu provozieren: inhalativ- nasal/ bronchial (Rhinomano20 metrie / Provokationskammer); bei Verdacht auf Asthma: Lungenfunktionstest und Bestätigung der Reversibilität, oder oral (z.B.: Nahrungsmittel: doppel-blind-Plazebo-kontrolliert, d.h. weder Patient noch Arzt wissen die Abfolge von Verum und Plazebo) Spezielle Tests: Prick-to-Prick-Test z.B.: bei Verdacht auf Nahrungsmittelallergie; zuerst wird mit der Lanzette das Allergen (z.B. Apfel) und dann sofort mit derselben Lanzette die Haut des Patienten geprickt. Epikutantest (Atopy-Patch-Test) bei Verdacht auf allergisches KontaktEkzem / Typ IV Allergie oder Atopische Dermatitis: Auf eine Ekzem-freie Hautstelle am Rücken werden Teststreifen aufgeklebt, die kleine Kammern mit Allergenen in Vaseline oder in Wasser gelöst enthalten. Die Teststreifen werden nach 48 Stunden abgenommen und die Haut nach 48 und 72 Stunden auf Ekzeme mit diskreten Papeln untersucht. 3.3.2. In vitro Diagnostik: Bestimmung des Gesamt-IgE-Spiegels z.B: mit PRIST (paper radio immuno sorbent test) -> Aussage über allergische Disposition Bestimmung der Allergen-spezifischen IgE-Antikörper z.B. mit CAP-FEIA (Fluoreszenz-Enzym-Immun-Assay). Der Spiegel des allergen-spezifischen IgE korreliert nicht mit dem schweregrad der Symptomatik. Wichtig ist die Relation von allergen-spezifischem IgE zum Gesamt-IgE! Die Besetzung der IgE-Rezeptoren auf den Effektorzellen ist ausschlaggebend für die allergische Reaktion. Gesamt IgE: altersspeziifsche Referenzwerte kU/L (1kU= 2.4mg) newborn <5 3 months < 11 1 Jahr < 29 5 Jahre < 52 10 Jahre < 63 Erwachs. < 81 “Atopiker“ >120 21 Allergen-Microarrays: Sog. „Allergen-Chips“ befinden sich im Entwicklungsstatus. Mit deren Hilfe sollte IgE gegen eine Vielzahl von Allergenen in einem Test und in einer minimalen Serummenge bestimmbar sein. Weitere indikative Marker: Bestimmung von ECP (eosinophiles kationisches Protein) im Serum Basophile Granulozyten-Aktivierung: Bestimmung von Histaminfreisetzung (Histamin-Nachweis) oder von Aktivierungsmarkern nach Zugabe von Allergen (CD63 /nach 20-40 min.; CD203c/ nach 5-15 min. mittels Durchflußzytometrie). 4. Allergie-Therapie Literatur: Leitfaden Management der allergischen Rhinitis und ihr Einfluß auf das Asthma: Allergologie 25: (1) 7-18 (2002) In Abhängigkeit vom Schweregrad der allergischen Rhinitis (leicht/ mäßig-schwer bzw. intermittierend/persistierend) wird ein schrittweises therapeutisches Vorgehen vorgeschlagen: Kombination von - Allergenkarenz (falls möglich) - Pharmakotherapie - Immuntherapie Bei persistierender allergischer Rhinitis sollte auf gleichzeitiges Vorliegen von Asthma bronchiale untersucht werden, um eine geeignete Kombinationstherapie zu finden. 4.1. Anti-allergische und anti-inflammatorische Pharmakotherapie Symptomatische Therapie: erfolgt unter Berücksichtigung der Art der zu behandelnden allergischen Reaktionen und des Manifestationsorgans Die Arzneimittel haben keine langanhaltende Wirkung nach Absetzen, d.h. bei persistierender Erkrankung ist eine Dauertherapie nötig. Die Wirkung der Medikamente nimmt üblicherweise nicht mit Dauer der Anwendung ab. 22 Allgemeine Therapiestrategie: Im Falle einer Verbesserung Step-down; im Falle einer Verschlechterung Step-up - Antihistaminika H1-Rezeptorblocker (oral, intranasal) Erste Generation (ZNS-gängig), Zweite Generation (nicht ZNS-gängig, nicht sedativ), Dritte Generation (ähnlich 2. Generation; aktive Enantiomere) Anwendung: Rhinokonjunktivitis/ bei Bedarf als Antihistamin-Tropfen oder –Sprays; sind die ideale Behandlung wenn nur leichte Beschwerden vorwiegend an einer Stelle auftreten, z.B. wenn nur eine Bindehautentzündung vorliegt. Die Therapie ist ausgezeichnet verträglich. Die Wirkung tritt schnell ein (oral:<1 Stunde, topisch: < 30 min). Wenig wirksam gegen Nasenverstopfung. Beachte: H2-Rezeptorblocker >> H2-Rez. an Magenschleimhaut, Herz, Blutgefäßen - Mastzellstabilisatoren: Cromone / Hemmer der Mediatorfreisetzung z.B.: Cromoglycinsäure / Nedocromil Schwächere Wirkung als Anti-Histaminika und Kortison; Anwendung bei Kleinkindern, bei Rhinokonjunktivitis (sehr wirksam intraokulär), schwachem Asthma, Bronchitis. Die Wirkung tritt erst verzögert ein, muss daher z.B. schon eine Woche vor Pollensaison eingenommen werden. Wirkungsmechanismus kaum verstanden. - Anti-inflammatorische Medikamente: Kortikosteroide: (intranasal, oral) Kortisonhältige Medikamente sind die stärksten Mittel gegen Allergie. In Tropfen- oder Sprayform wirken sie ausgezeichnet bei blockierter Nase und stärkeren Beschwerden durch Schnupfen. Die Substanzen die inhalativ an den Schleimhäuten angewendet werden wirken nur lokal und werden praktisch nicht in den Organismus aufgenommen; die problematischen Nebenwirkungen einer systemischen (Tabletten, Injektion) Kortisontherapie treten daher nicht auf. Aufgrund des Wirkungsmechanismus (Genregulation) keine Sofortwirkung möglich (Wirkung setzt nach 6-12h ein; max. erst nach wenigen Tagen)! - Dekongestiva: (intranasal, oral) Sympathomimetika 23 Als Nasenspray-/tropfen wirksam bei nasaler Obstruktion, zum Abschwellen der Nasenschleimhaut sehr effektiv; Bedarfsmediktation. Stimulieren das vegetative Nervensystem/ Nervus symphaticus -Sympathomimetika: primär Vasokonstriktion, verringerte Durchblutung ohne Bronchodilatation oder Tachykardie Bei Anaphylaktischem Schock: Sofortbehandlung mit Adrenalin: i.v. (stimuliert 1-Rezeptoren an Gefäßen -> vasokonstriktorisch, antiödematös und 2-Rezeptoren an Herz/glatter Muskulatur -> Bronchodilatation in Kombination mit Antihistaminika. Die Therapie des Asthma bronchiale oder atopischer Dermatitis ist sehr komplex. Deshalb hier nur Beispiele anderer medikamentöser Ansätze, die auch mit den oben genannten Medikamenten kombiniert werden können: - Theophyllin (Asthma bronchiale) Hemmt die Phosphodiesterase II und blockiert vermutlich Adenosin-A1Rezeptoren -> cAMP-Erhöhung, bewirkt Abnahme des Bronchospasmus. - Leukotrien-Rezeptor-Antagonisten (z.B. Montelukast, Pranlukast) werden bei leichtem bis mittel-schwerem Asthma bronchiale eingesetzt; binden an LTD4-Rezeptoren; sind anti-inflammatorisch, indem sie die PAF-induzierte chemotaktische Migration der eosinophilen Granulozyten von Endothelzellen reduziert. - anti-IgE-Antikörper (Omalizumab) humanisierter anti-IgE-Antikörper bindet C3-Domäne und fängt IgE ab bevor es an FcRI binden kann; wird eingesetzt bei schwerem, therapieresistentem allergischem Asthma bronchiale. -2-Sympathomimetika: wirken auf Adrenorezeptoren, imitieren die Catecholamine (Adrenalin/Noradrenalin) und wirken bronchienerweiternd und spasmolytisch; rasche Wirkung bei Asthma bronchiale. 24 - Kortikosteroide: Topische Anwendung bei Neurodermitis/atopischem Ekzem v.a. bei allen akuten Formen. Kortisonhältige Cremes müssen gezielt und nicht zu lange eingesetzt werden, sind aber in bestimmten Situationen unumgänglich. - Cyclosporin, Tacrolimus: bei Neurodermitis, chronischer Urtikaria Tacrolimus/Pimecrolimus: eine neue Generation von Medikamenten, die eine entzündungshemmende Wirkung wie Kortison haben, ohne jedoch ähnliche Nebeneffekte zu bewirken. 4.2. Kausaltherapie / Spezifische Immuntherapie Allergenkarenz: Vermeidung des Kontakts mit dem Allergen soweit wie möglich z.B.: Wohnungssanierung (Maßnahmen gegen Hausstaubmilben, Schimmelpilz), Arbeitsplatzwahl, Vermeidung bestimmter Nahrungsmittel Spezifische Immuntherapie (SIT) (Hyposensibilisierung): SIT ist indiziert bei Patienten, - deren Symptomatik durch konventionelle Pharmakotherapie nur unzureichend zu kontrollieren ist, - bei denen orale H1-Antihistaminika und intranasale Pharmakotherapie die Symptome nur unzureichend kontrollieren, - die (Langzeit-) Pharmakotherapie ablehnen, - bei denen Pharmakotherapie unerwünschte Nebeneffekte auslöst. Im Grunde gibt es die SIT bereits seit 1911 (Noon, Lancet) Versuch der Standardisierung im WHO-position paper 1998 (Allergy) Ziel der SIT ist eine Umorientierung des Immunsystems, wobei versucht wird, über die Applikation von möglichst hohen Allergenkonzentrationen über einen langen Zeitraum die allergen-spezifische Immunantwort auf verschiedenen Ebenen der Regulation zu beeinflussen. Um IgE-mediierte Nebenwirkungen zu vermeiden, wird die Allergenkonzentration in der Steigerungsphase schrittweise (wöchentliche Applikation) bis zur Erreichung der Erhaltungsphase (etwa 3 Monate) erhöht und dann Zeitdauer von bis zu 3 Jahren bei konstante Dosierung fortgesetzt (evtl. Reduktion während Pollensaison). SIT wird erst ab einem Alter von 5 Jahren empfohlen. 25 Konventionell werden Allergenextrakte subkutan verabreicht. Bei der SIT -Impfung wird in Europa i.d.R. Aluminiumhydroxid als Adjuvans verwendet (dagegen kein Adjuvans in den USA). Die mukosale Gabe des Allergens sublingual (SLIT; wässrige Lösung/ kein Adjuvans) in Tropfen oder Tablettenform mit täglicher Applikation scheint ebenfalls einen ähnlichen Therapieerfolg zuzulassen. Hier ist die Allergenkonzentration allerdingssehr viel höher als in der SIT (50-100x). Grundsätzlich ist der Therapieerfolg einer SIT höher, wenn das Sensibilisationsspektrum eng ist, d.h. wenn nur wenige Allergene für die klinische Symptomatik des Patienten verantwortlich sind, und je jünger diese sind. Insektengift-Allergie: Therapieerfolg bei SIT ist 85-98%; es gibt für diese Form der Allergie auch eine wirksame, sehr beschleunigte Rush- und Ultra-Rush SIT, die in der Klinik durchgeführt wird. Ebenfalls erfolgreich ist die SIT bei Patienten mit Pollen-, Hausstaubmilben- und Tierhaar-Allergie. 4.3. Immunologische Veränderungen während der SIT B-Zell-Immunantwort/Serum-Antikörper: allergen-spezifisches IgE: zunächst Anstieg, im späteren Verlauf Abfall allergen-spezifisches IgG: Anstieg, insbesondere IgG4 Anstieg des IgG4/IgE-Ratios Eigenschaften von IgG4: keine Komplement-Aktivierung vermittelt keine Entzündungsreaktion Theorie der „blockierenden Antikörper“, d.h. IgG4 erkennt dieselben Epitope wie IgE und kann durch Absättigung dieser Epitope eine Bindung von IgE an das Allergen verhindern. Damit verbunden ist somit auch eine Blockierung der IgE-mediierten Histaminfreisetzung aus Effektorzellen (Mastzellen und Basophilen). Zusätzlich verhindern die IgG4-Antikörper auch eine IgE-vermittelte Aufnahme von Allergen in APC und deren Antigenpräsentation an TZellen Cave: Der Anstieg von IgG4 per se kann nicht als Marker für einen Therapieerfolg genommen werden. IgG4 steigt auch bei ‚nonrespondern’ an und es ist kein bestimmter Schwellenwert definierbar. 26 T-Zell-Immunantwort: Die allergen-spezifische T-Zellantwort ist bereits in früher Phase der SIT signifikant reduziert. Immundeviation: IL-4-Produktion istreduziert, IFN--Produktion steigt an Th2-> Th0/1 IL-10 wird induziert/ aktive Suppression (Treg cells) Eine klonale Anergie oder Deletion von allergen-spezifischen T-Zellen ist möglich, aber bisher nicht nachweisbar. Anti-allergische Wirkung von IL-10 IL-10 induziert IgG4-> blockierende Antikörper verhindern IgE-Bindung an das Allergen IL-10 inhibiert IgE-mediierte Aktivierung von Mastzellen (durch Reduktion von FcR) IL-10 hemmt das Wachstum und Aktivierung von Eosinophilen (durch Reduktion von IL-5) IL-10 induziert regulatorische CD4+ T-Zellen Frühe und späte Wirkungsmechanismen induziert durch SIT Bousquet, J.; Allergy 60 (1), 1-3 (2005) 4.4. Neue Konzepte für die spezifische Immuntherapie Ziel: Effektivitätssteigerung und Reduktion von IgE-vermittelten Nebenwirkungen unter Erhaltung der T-Zellreaktivität - Allergoide = Glutaraldehyd-modifizierte Pollenextrakte mit reduzierter IgE-Bindung 27 - gentechnisch hergestellte rekombinante Allergene: im Gegensatz zu Allergenextrakten definierte Proteine; bessere Standardisierbarkeit der Vakzine. - rekombinante Hypoallergene: nicht-IgE-bindendene Allergenkonstrukte Gentechnologische Veränderungen von rekombinanten Allergenen -> Veränderung der Tertiärstruktur z.B.: Punktmutationen, Fragmentierung, Oligomerisierung - synthetische Allergen-Peptide, die T-Zell-Epitope enthalten Immunstimulatorische Strategien: - Adjuvantien: Sie sollen die Immunmodulation/ Förderung von Th1 und regulatorischer T-Zell-Immunantwort (Treg, IL-10, TGF-) unterstützen. Elemente des nativen Immunsystems werden dabei gezielt aktiviert z.B. mit folgenden Th1-induzierende Substanzen bakteriellen Ursprungs: MPL monophosporyl lipid A (LPS-Anteil; aktiviert Toll like-Rezeptor 4 (TLR4) ist bereits seit 1999 in klinischer Testung als Zusatz zu PollenAllergoiden mit L-tyrosin als Depotträger; ermöglicht eine Kurzzeitimmuntherapie: Injektionen nur 4x präsaisonal /Jahr Oligo-Desoxynucleotide mit CpG-Motiven: bakterielle DNA besitzt erhöhten Anteil an nicht methylierten “CpG-motiven”, d.h.Sequenzen mit direkter Abfolge von Cytosin/Guanidin; die von TLR9 erkannt werden. Eine Phase I Studie in Ragweed-Allergikern mit Amb a 1/CpGKonjugaten zeigte bei wesentlich kürzerer Anwendung als in der konventionellen SIT (6x/Jahr) Wirkung. - DNA-Vakzine: Werden noch nicht im Humansystem eingesetzt; im Tiermodell: Immunisierung mit bakterieller Plasmid-DNA (enthält CpG-Motive, geeignete Promotoren und Gene für Allergene), die zur Expression des Allergens im Wirt führt und dort eine Immunreaktion auslöst. Diese Methode bietet große Variationsmöglichkeiten z.B.: humane Kodon-Optimimierung von Allergen-Genen, CpG-Anreicherung von Plasmidvektoren, hypoallergene DNA-Vakzine durch Fragmentierung oder forcierte Ubiquitinierung. 28 Replikase-Vakzine: Alphavirus-Vakzine mit erhöhter Effizienz/Stabilität; Insbesondere die Selbst-Vernichtung durch Apoptose der transfizierten Zellen könnte eventuelle Sicherheitsrisiken sehr einschränken. - neue Antigenrouten Oral/intranasal: Eine Immunmodulation durch probiotische Laktobazillen wird angestrebt. Milchsäurebakterien (wichtige Vertreter der menschlichen Darmflora) werden im Tiermodell als Allergenträger getestet. Topisch: Eine topische Behandlung von Mäusen mit CpG/CholeratoxinB/Erdnuss-Extrakt verhindert eine nachfolgende Allergisierung gegen Erdnuß. 29